Журнал эволюционной биохимии и физиологии, 2023, T. 59, № 3, стр. 178-189
Влияние неонатальной гипоксии и антидепрессанта флуоксетина на когнитивную и стресс-гормональную функции у взрослых крыс
В. А. Михайленко 1, *, И. П. Буткевич 1, Е. А. Вершинина 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: viktormikhailenko@yandex.ru
Поступила в редакцию 29.01.2023
После доработки 07.04.2023
Принята к публикации 11.04.2023
- EDN: YHNJYS
- DOI: 10.31857/S0044452923030063
Аннотация
У взрослых самцов и самок крыс, подвергнутых на 2-й день жизни умеренной острой гипоксии и затем хроническому введению ингибитора обратного захвата серотонина флуоксетина, исследовали способность к пространственному обучению и функциональность пространственной памяти, а также стрессорную реактивность гипоталамо-гипофизарно-адренокортикальной cистемы (ГГАКС). При тестировании способности к пространственному обучению у взрослых крыс, подвергнутых неонатальной гипоксии, обнаружено увеличение латентного периода достижения платформы в водном лабиринте Морриса в первой пробе в первый из пяти дней тренировки по сравнению с животными, не подвергавшимися гипоксии. Полученные результаты по исследованию памяти в тесте распознавания нового объекта и в водном лабиринте Морриса свидетельствуют о том, что гипоксия не вызывала дефицит памяти у взрослых животных. Более того, гипоксия улучшала показатели памяти у самцов на первый день, а у самок – на 4-й день тестирования после удаления платформы из бассейна по сравнению с соответствующими контрольными значениями. Содержание кортикостерона в плазме крови самцов в ответ на тестирование памяти не различалось в контрольной и гипоксической группах и характеризовалось более высокими показателями, чем у самок соответствующих групп. Гипоксия увеличила реактивность ГГАКС у самок, что сочеталось у них с более длительным хранением памяти. Флуоксетин нормализовал показатель пространственного обучения, не вызвал изменений у контрольных животных и не изменил выявленное улучшение памяти у гипоксических крыс без введения этого препарата. Полученные новые данные расширяют представление о долговременном влиянии неонатальной нормобарической умеренной гипоксии на пространственную память и реактивность ГГАКС в зависимости от половой принадлежности и подчеркивают отсутствие вредного влияния флуоксетина на пространственную память как у контрольных крыс, так и у крыс с воздействием гипоксии.
ВВЕДЕНИЕ
Одной из актуальных задач возрастной физиологии является изучение отдаленных последствий стрессорных воздействий в перинатальный период развития. Перенесенный в раннем возрасте стресс программирует развитие мозга, определяющее в дальнейшем реактивность гипоталамо-гипофизарно-адренокортикальной системы (ГГАКС) и когнитивной сферы в ответ на различные стрессорные ситуации [1–3]. Ранний неонатальный период развития является критическим для приспособления новорожденных к внеутробному существованию, особенно к физиологическим изменениям в дыхательной системе и в функционировании малого круга кровообращения [4, 5]. В структурах головного мозга в это время активно протекают процессы пролиферации, миграции, дифференцировки, синаптогенеза, миелинизации, апоптоза, что определяет, с одной стороны, высокий уровень пластичности, а с другой – высокую уязвимость мозга к неблагоприятным воздействиям [6, 7]. Перинатальная гипоксия, связанная с недостатком кислорода, является распространенным стрессором у новорожденных, у которых адаптация к стрессу осуществляется с участием комплекса физиологических систем, среди которых ключевой является ГГАКС [8, 9].
Исследованию разных типов гипоксии в зависимости от дозы и продолжительности при экспериментальном моделировании гипоксических состояний млекопитающих животных и человека посвящено большое число работ (для обзора см. [10–12]). Основное внимание в исследованиях на животных, преимущественно грызунах, уделяется изучению влияний гипоксического стресса, вызванного гипоксией-ишемией, которая связана с недостатком кислорода, сочетающимся с нарушением кровоснабжения в головном мозге, что приводит к гибели нейронов мозга и тяжелым последствиям для организма. В экспериментальных условиях гипоксия-ишемия достигается снижением поступления кислорода в головной мозг и окклюзией сонных артерий. Установлено, что долговременными последствиями неонатальной гипоксии-ишемии являются нарушения функции ГГАКС и когнитивных способностей [8, 10], что связано с отклонениями в развитии гиппокампа, главного регулятора функции памяти [12, 13].
Настоящая работа посвящена исследованию долговременного влияния умеренной неонатальной нормобарической гипоксии, вызывающей дефицит кислорода, не осложненной ишемическим вмешательством, на когнитивные функции и гормональный статус животных. Исследование влияний именно более мягкой неонатальной гипоксии особенно важно, поскольку даже слабо выраженное нарушение снабжения мозга кислородом может быть причиной задержки темпов развития систем мозга, обеспечивающих сложные интегративные функции. Ранее при использовании разработанной в нашей лаборатории модели недоношенной беременности у крыс, позволяющей исследовать последствия перинатальной гипоксии-энцефалопатии новорожденных, были выявлены отклонения от нормы структурно-функциональных характеристик неокортекса и гиппокампа у особей разного возраста (5, 10, 20, 30 и 40 дней жизни) [14]. В настоящей работе мы использовали аналогичные условия неонатальной гипоксии для исследования последствий ее влияния у взрослых крыс.
Серотонинергическая система (5-HT система), как и ГГАКС, участвует в процессах адаптации к гипоксии. Обе системы вовлечены в регуляцию функции гиппокампа благодаря наличию в нем глюкокортикоидных и серотонинергических рецепторов [15, 16]. Гиппокамп является ключевой структурой в формировании памяти [17], поэтому серотонинергической иннервации гиппокампа уделяется большое внимание [15]. Есть данные, что гипоксия-ишемия вызывает изменения всех компонентов серотонинергической системы в ядре шва, префронтальной коре, гиппокампе, включая синтез и количество 5-HT, уровень экспрессии его рецепторов и транспортера, а также продуктов метаболизма [16]. Появляются работы о половых различиях во влиянии гипоксии на эти показатели [18]. Кроме повреждения серотонинергических нейронов гипоксия может вызывать нейровоспалительный процесс. Поскольку увеличение уровня серотонина способствует нормализации адаптивного поведения, направленную регуляцию серотонинергической системы можно использовать в терапевтических целях. Селективный ингибитор обратного захвата серотонина антидепрессант флуоксетин применяется в клинике для лечения депрессии у беременных, хотя имеются разногласия в вопросе о его влиянии на развивающийся мозг [19]. Полагают, что действие флуоксетина заключается в блокаде серотонинового транспортера (SERT), что приводит к накоплению серотонина в синаптической щели с последующей большей активацией и захватом серотониновых рецепторов (5HTRs). Усиление активности 5HTRs взаимосвязано с изменениями нейропластичности, что приводят к повышению регуляции синаптических белков и плотности дендритных шипиков, которая является важным показателем нейронной пластичности. Кроме того, данные литературы свидетельствуют о способности флуоксетина стимулировать эндогенный нейрогенез, вызывать противовоспалительный эффект в центральной нервной системе, способствовать выживанию нейронов [20]. Однако экспериментальные и клинические данные о последствиях гипоксии, как и неонатального введения флуоксетина, противоречивы, а точный механизм их влияния на когнитивные функции и ГГАКС остается не ясным, что требует дальнейших исследований. Поскольку диапазон современных терапевтических подходов к лечению последствий перинатальной гипоксии все еще ограничен, такие исследования имеют большое практическое значение.
Цель проведенного нами исследования состояла в изучении долговременного влияния острой умеренной неонатальной гипоксии на когнитивные функции, реактивность ГГАКС у взрослых крыс обоего пола и в изучении влияния неонатального хронического введения флуоксетина на исследованные функциональные показатели у взрослых гипоксических и контрольных крыс.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные и экспериментальные группы
Работа выполнена на взрослых самцах и самках из потомства крыс линии Wistar, полученных из биоколлекции Института физиологии им. И.П. Павлова Российской академии наук. Всего было получено 15 взрослых первородящих самок и 10 самцов. После двух дней адаптации к условиям лабораторного вивария (свободный доступ к стандартизированной пище и воде, световой день с 8 до 20 ч, температура 21.0–23.0°С) трех первородящих самок (220–230 г) подсаживали к двум самцам (330–350 г) и помещали в стандартную пластиковую клетку; на следующее утро у самок брали мазки из влагалища для определения наличия беременности. Беременных самок отсаживали от самцов и содержали по 5 особей в клетке до 17-го дня беременности, а с 18‑го дня – в индивидуальных клетках. День беременности и день появления потомства на свет принимали за нулевой (G0 и P0 соответственно). На второй день после рождения пометы сокращали до 8 крысят, оставляя по возможности равное число разнополых особей. Крысят произвольно разделяли на группы: экспериментальные, которых подвергали гипоксии (гипоксические животные) и контрольные, которые находились в тех же условиях без воздействия гипоксии.
Модель гипоксии и введение флуоксетина
Двухдневных крысят экспериментальной группы помещали на 60 мин в барокамеру с проточной газовой смесью, содержащей 7.6–7.8% кислорода и 91.8% азота при температуре 35–36°С и нормальном атмосферном давлении 760 мм рт. ст.). Состав газовой смеси был аналогичен смеси, использованной в предыдущих работах лаборатории [14]. Считается, что мозг одно-двухдневного крысенка примерно соответствует развитию мозга недоношенного ребенка (23–24-я неделя беременности) [21]. Сразу после удаления из камеры экспериментальных и контрольных животных начинали подвергать ежедневной инъекции ингибитора обратного захвата серотонина флуоксетина (10 мг/кг, по 5 мкл в холку) или физиологического раствора. Инъекции продолжались в течение двух недель. Число животных в исследованных группах было следующим: контроль + физиологический раствор (самцы n = 6, самки n = 10), гипоксия + физиологический раствор (самцы n = 8, самки n = 8), контроль + флуоксетин (самцы n = 13, самки n = 9) и гипоксия + флуоксетин (самцы n = 8, самки n = 8) (рис. 1). Крысята находились со своими матерями до 30-дневного возраста, затем разнополых животных рассаживали в разные клетки по 4–6 особей.
Тестирование памяти по распознаванию нового объекта
Начиная с 90–95-дневного возраста, у крыс исследовали функциональность памяти в тесте “Распознавание нового объекта”, основанном на естественном для грызунов предпочтении новизны [22]. В первый день крысу помещали на 10 мин в установку “открытое поле” (камера 50 × 50 см, ограниченная стенками из оргстекла) для адаптации к условиям опыта. На следующие сутки крысу помещали на 5 мин в знакомую установку, в центре которой были размещены два одинаковых объекта (светлые пластмассовые кубики). Регистрировали время исследования каждого объекта (с). Затем крысу перемещали в домашнюю клетку на 10 мин. За это время левый объект заменяли новым незнакомым предметом, выполненным из темного пластика, округлой формы, правый объект оставляли неизменным. Животных помещали обратно в установку для исследования нового и знакомого предметов и регистрировали время, в течение которого крыса уделяла внимание каждому из них. После каждого животного предметы и установку протирали спиртом (40%). Для оценки функциональности памяти использовали коэффициент дискриминации (Кр) – разницу между временем исследования нового и знакомого предметов по отношению к суммарному времени их исследования. Нулевое значение этого параметра предполагает одинаковое время обследования знакомого и нового объектов. Чем меньше Кр, тем хуже память распознавания. Кр = [Время (Объект Новый) – Время (Объект Знакомый)/Время (Объект Новый) + Время (Объект Знакомый)] × 100%.
Тестирование обучения и памяти в водном лабиринте Морриса
Через три дня после проведения данного теста начинали тестирование обучения в водном лабиринте Морриса [23], которое продолжалось в течение пяти дней. Крысу на 60 с помещали в бассейн (диаметр 120 см, высота 72 см, температура воды 22–24°С), на дне которого находилась металлическая платформа, ее поверхность была на 2 см ниже уровня воды, окрашенной мелом, чтобы сделать платформу невидимой для крысы. Бассейн произвольно был разделен на четыре равных квадранта. Круглая стальная платформа (высота 39 см, диаметр 12 см) была помещена в центр квадранта 2, на расстоянии 30 см от стенки бассейна, ее локализация была фиксирована в течение всех дней тестирования обучения для всех крыс. Видеокамера была установлена на перекладине над центром бассейна. Бассейн был расположен в комнате с отдаленными визуальными сигналами различной формы, разного размера и цвета, чтобы обеспечить пространственную ориентацию во время обучения. Экспериментатор был виден крысе и всегда стоял в одном месте во время всех экспериментов. Первую попытку начинали с целевого квадранта 1, следующую попытку с квадранта 2 и так далее против часовой стрелки. Регистрировали время, в течение которого крыса находила платформу (латентный период, с), на которой ей позволяли находиться в течение 20 с, давая крысе возможность сориентироваться в пространстве. Если попытка была неудачной, то латентный период принимали за 60 с, а крысу помещали на платформу на 20 с, затем следовал 15 с период покоя в сухой клетке, что вместе представляло первую попытку. Четыре такие попытки составляли первую пробу, после которой крысу вытирали бумажным полотенцем и помещали на 4 мин в сухую теплую клетку. Затем проводили вторую пробу, аналогичную первой. По такой схеме обучение продолжалось четыре дня. На пятый день после первой пробы обучения убирали платформу из бассейна и проводили пробное испытание, результат которого в дальнейшем рассматривали как память первого дня тестирования после удаления платформы (пробный тест на память), а через 96 ч отдыха – память четвертого дня тестирования после удаления платформы (долговременная память). С помощью веб-камеры и специальной компьютерной программы, разработанной в нашем институте, регистрировали траекторию движения крысы, латентный период достижения целевого квадранта (c), где в процессе обучения находилась платформа, а также время пребывания в целевом квадранте (c) за период времени, равный 60 с.
Через 30 мин после завершения тестирования долговременной памяти у крыс посредством декапитации собирали образцы крови для дальнейшего определения содержания кортикостерона в плазме крови, которую хранили при температуре минус 20°С. Кортикостерон определяли в двух пробах методом иммуноферментного анализа с использованием стандартных наборов (“Xema-Medica Co” Cat №: K210R; Россия) с помощью спектрофотометрической пластины (Spectrostar NANO, BMG Labtech, Германия).
Статистический анализ данных
После проверки гипотезы об отклонении распределений данных от нормального с использованием критерия Колмогорова–Смирнова проводили статистический анализ результатов с использованием дисперсионного анализа ANOVA в программном комплексе SPSS Inc 13 с последующими множественными сравнениями по Бонферрони. Данные, полученные в тесте “Распознавание нового объекта”, анализировались с использованием смешанного дисперсионного анализ Mixed ANOVA. Зависимые переменные: время исследования нового и время знакомого объектов, факторы: пол, условие (гипоксия/контроль), воздействие (физиологический раствор/флуоксетин) и новый – знакомый объект. Анализ данных по обучению и памяти проводили с использованием разных моделей смешанного дисперсионного анализа. Во всех моделях независимыми факторами выступали пол, условие (контроль/гипоксия) и воздействие (физиологический раствор/флуоксетин). Зависимыми факторами были день (1/2/3/4 или 5 дней) при изучении динамики обучения и памяти (на 1-й и 4‑й дни тестирования). При изучении содержания кортикостерона факторами были: пол, условие (контроль/гипоксия) и воздействие (физиологический раствор/флуоксетин). При апостериорных сравнениях мы использовали поправку Бонферрони, когда число уровней факторов составляло более двух. Данные представлены средними значениями ± стандартные ошибки среднего значения. Различия считались значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Визуально воздействие гипоксии проявлялось в цианозе (посинение кожного покрова) у крысят сразу после изъятия из камеры. Все экспериментальные и контрольные животные благополучно дожили до взрослого состояния, участвовали в экспериментах, что дало возможность получить следующие поведенческие и физиологические данные.
Тест “Распознавание нового объекта”
Смешанный дисперсионный анализ Mixed ANOVA был использован для обработки данных, полученных в тесте распознавание нового объекта. В качестве зависимых переменных мы рассматривали продолжительность времени исследования нового и старого объектов, факторы: пол, условие (гипоксия/контроль), воздействие (физиологический раствор/флуоксетин) и новый – знакомый объект.
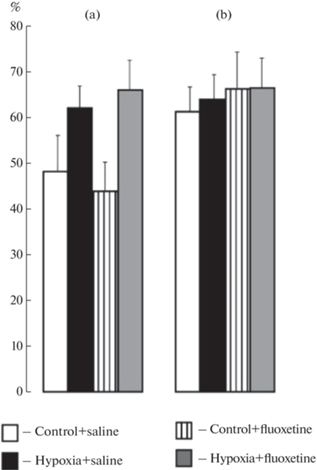
Коэффициент дискриминации статистически значимо не различался между группами (рис. 2), что указывает на отсутствие влияний воздействия гипоксии и флуоксетина на функциональность памяти.
Рис. 2.
Коэффициент дискриминации в исследовании функциональности памяти в тесте “распознавание нового объекта” у самцов (a) и самок (b) взрослых крыс контрольной группы или подвергнутых воздействию гипоксии, а также введению флуоксетина или физиологического раствора в неонатальный период развития. Ордината: коэффициент дискриминации (%).
Водный лабиринт Морриса – способность к пространственному обучению
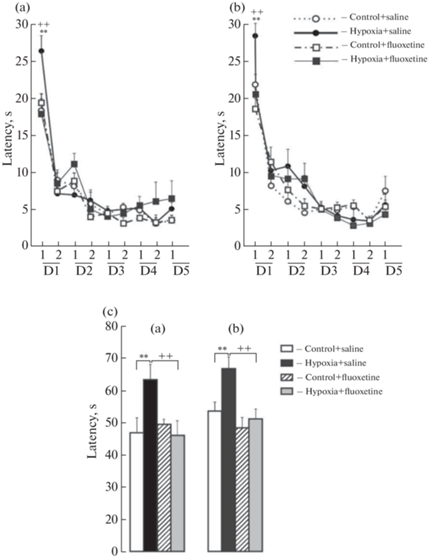
Смешанный дисперсионный анализ Mixed ANOVA был использован для исследования динамики латентного периода (ЛП) достижения платформы по дням для первой пробы, состоявшей из 4-х попыток. В качестве зависимых переменных мы рассматривали 1-й, 2-й, 3-й, 4-й и 5-й дни, факторы: пол, условие (контроль, гипоксия) и воздействие (физиологический раствор, флуоксетин). Такой же анализ был проведен для второй пробы для четырех дней. В качестве зависимых переменных рассматривали значения латентного периода, факторы: пол, условие (контроль, гипоксия) и воздействие (физиологический раствор, флуоксетин). Для усредненных по четырем попыткам данным в первой пробе и первом дне получено значимое влияние условия (гипоксия) F(1.62) = 7.6, p = 0.007, η2 = 0.110, воздействия (флуоксетин) F(1.62) = 11.8, p = 0.001, η2 = 0.160 и взаимодействия факторов условие и воздействие F(1.62) = 6.9, p = 0.011, η2 = = 0.100. Апостериорный анализ с поправкой по Бонферрони показал, что в первый день обучения гипоксия увеличила ЛП в первой пробе у взрослых самцов (р = 0.009) (рис. 3a, с) и самок (р = 0.017) (рис. 3b, с) по сравнению с ЛП контрольных животных. В последующие дни обучения различий в ЛП между контрольными и гипоксическими крысами не наблюдалось. По результатам стастистического анализа был проведен трехфакторный дисперсионный анализ для 1–4-й попыток первой пробы. Апостериорный анализ с поправкой по Бонферрони показал, что значимые различия между гипоксическими и контрольными крысами выявлены в первой попытке у самцов (p = 0.01) и самок (p = 0.007). Введение флуоксетина животным, подвергнутым в период новорожденности воздействию гипоксии, уменьшило данный показатель на первый день у взрослых самцов (р = 0.003) (рис. 3a, с) и самок (р = 0.005) (рис. 3b,с), т.e. флуоксетин восстановил ЛП до контрольного уровня (рис. 3с).
Рис. 3.
Латентный период достижения платформы в водном лабиринте Морриса у самцов (а) и самок (b) взрослых крыс контрольной группы или подвергнутых воздействию гипоксии, а также введению флуоксетина или физиологического раствора в неонатальный период развития. Абсцисса: пробы (1, 2) и пять тренировочных дней (D1–D5). Ордината: латентный период (с) достижения платформы. (c): график иллюстрирует результаты статистического анализа в первый тренировочный день в пробе 1 у самцов (a) и самок (b). **p < 0.01, контроль + физиологический раствор vs гипоксия + физиологический раствор; ++p < 0.01, гипоксия + физиологический раствор vs гипоксия + флуоксетин. Данные представлены средними значениями ± стандартные ошибки среднего.
Оценка пространственной памяти
На пятый день после первой пробы тестирования обучения удаляли платформу из бассейна и исследовали у крыс пространственную память (1-й день тестирования памяти) и через четыре дня отдыха в “родной клетке” (4-й день тестирования памяти). Смешанный дисперсионный анализ Mixed ANOVA был использован для исследования функциональности памяти. В экспериментах по тестированию памяти обнаружено значимое влияние дня тестирования памяти (первый/четвертый дни), F(1.62) = = 23.1, p < 0.001, η2 = 0.275, условия (контроль/гипоксия) F(1.61) = 16.8, p < 0.001, η2 = 0.216 и взаимодействия факторов память и условие F(1.62) = 11.5, p < 0.001, η2 = 0.159. Апостериорный анализ с поправкой по Бонферрони показал, что гипоксия увеличила время пребывания в целевом квадранте у самцов по сравнению с контролем (р = 0.001), т.е. улучшила память на первый день тестирования, но вызвала недостоверную тенденцию у самок (рис. 4а). Неонатальное хроническое введение флуоксетина не изменило этот показатель памяти как у контрольных, так и гипоксических крыс. На первый день тестирования у животных с гипоксией и флуоксетином время пребывания в целевом квадранте было выше, чем у контрольных крыс с введением флуоксетина (самцы, р = 0.024; самки, р = 0.021) (рис. 4a).
Рис. 4.
Пространственная память на первый (а) и четвертый (b) дни тестирования без платформы в водном лабиринте Морриса у самцов и самок взрослых крыс контрольной группы или подвергнутых воздействию гипоксии, а также введению флуоксетина или физиологического раствора в неонатальный период развития. Ордината: время нахождения в целевом квадранте (с). *p < 0.05, **p < 0.01, контроль + физиологический раствор vs гипоксия + физиологический раствор; +p < 0.05, контроль + флуоксетин vs гипоксия + флуоксетин; vp < 0.05, vvp < 0.01, память на первый vs четвертый дни тестирования. Данные представлены средними значениями ± стандартные ошибки среднего.
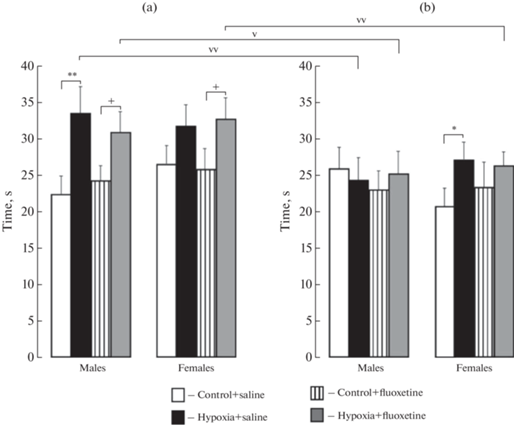
При тестировании памяти на 4-й день обнаружено, что гипоксия увеличила время пребывания в целевом квадранте у самок (р = 0.044), то есть улучшила сохранность пространственной памяти, но не изменила ее у самцов (рис. 4b). Введение флуоксетина не изменило этот показатель памяти, как у контрольных, так и гипоксических крыс обоего пола (рис. 4a ,b). Функциональность памяти на 4-й день тестирования по сравнению с 1-м днем была ниже у гипоксических самцов (p < 0.001), а также у гипоксических самцов (p = 0.011) и самок (p = 0.004), подвергнутых введению флуоксетина (рис. 4a, b).
Уровень кортикостерона в плазме крови у взрослых самцов и самок крыс после тестировании памяти на 4-й день в водном лабиринте Морриса
Одномерный трехфакторный дисперсионный анализ был использован для обработки данных по содержанию кортикостерона в плазме крови. В качестве зависимых переменных рассматривали содержание кортикостерона, факторы включали: пол, условие (контроль, гипоксия), воздействие (физиологический раствор, флуоксетин). Обнаружено значимое влияние факторов пол: F(1.62) = 36.4, p < 0.001, η2 = 0.370 и условие: F(1.62) = 11.5, p = 0.001, η2 = 0.158 на содержание кортикостерона. Апостериорный анализ с поправкой по Бонферрони показал, что гипоксия увеличила содержание кортикостерона у самок крыс, по сравнению с контрольным значением (р = 0.024) (рис. 5b), но не изменила у самцов (рис. 5a).
Рис. 5.
Содержание кортикостерона в плазме крови у самцов (a) и самок (b) взрослых крыс контрольной группы или подвергнутых воздействию гипоксии, а также введению флуоксетина или физиологического раствора в неонатальный период развития. Ордината: содержание кортикостерона в плазме крови (нмоль/л). *p < 0.05, контроль + физиологический раствор vs гипоксия + физиологический раствор; ++p < 0.01, контроль + флуоксетин vs гипоксия + флуоксетин, #p < 0.05, ##p < 0.01, при сравнении половых различий. Данные представлены средними значениями ± стандартные ошибки среднего.
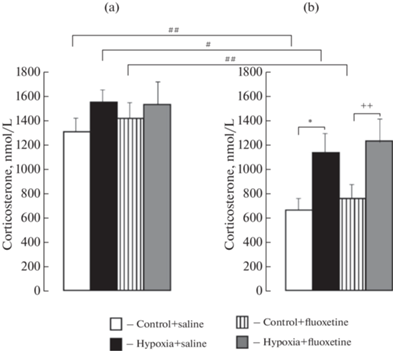
Флуоксетин не изменил уровень гормона как у контрольных крыс, так и его повышенное содержание у гипоксических крыс. При этом содержание кортикостерона в плазме крови у гипоксических самок с введением флуоксетина было выше, чем у контрольных самок с его введением (p = 0.012) (рис. 5b). Обращает на себя внимание более высокое содержание кортикостерона у контрольных (р = 0.001), гипоксических (р = = 0.024) самцов, и у контрольных самцов с введением флуоксетина (р = 0.001) по сравнению с содержанием кортикостерона у самок соответствующих групп.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Настоящее исследование демонстрирует новые данные о влиянии неонатального стресса, вызванного умеренной гипоксией, на способность к пространственному обучению, функциональность пространственной памяти на разных сроках тестирования, реактивность ГГАКС у взрослых самцов и самок крыс [17]. Гипоксия не изменила способность крыс обоего пола изучать местоположение платформы, о чем свидетельствует улучшение обучения с первого по пятый день тренировки. Только в первой пробе в первый из пяти дней тренировки обнаружено увеличение латентного периода достижения платформы в водном лабиринте Морриса у крыс обоего пола гипоксической группы по сравнению с контролем. Полученные результаты по исследованию памяти в тесте “Распознавание нового объекта” и водном лабиринте Морриса согласуются и свидетельствуют о том, что умеренная неонатальная гипоксия не вызвала дефицит памяти. Более того, гипоксия даже улучшила функциональность памяти у самцов при тестировании долговременной памяти на 1-й день, а у самок – при тестировании на 4-й день по сравнению с соответствующими контрольными значениями. Тем не менее у гипоксических, но не контрольных крыс, обнаружены различия в сохранности пространственной памяти, о чем свидетельствует снижение памяти на 4-й день тестирования по сравнению с 1-м днем. Содержание кортикостерона в плазме крови было одинаково во всех группах самцов и характеризовалось более высокими показателями, чем у самок. Гипоксия увеличила реактивность ГГАКС у самок, что сочеталось у них с более высокой функциональностью долговременной памяти. Флуоксетин ни в одной из групп крыс не оказал неблагоприятное влияние на исследованные когнитивные показатели, и даже нормализовал показатель пространственного обучения. Его введение также не нарушило улучшение памяти у самцов и самок, подвергнутых гипоксии.
Отсутствие нарушений в показателях обучения после первого дня тренировки, а также пространственной памяти, у гипоксических взрослых крыс по сравнению с контрольными значениями можно было бы объяснить использованием умеренной по степени и длительности нормобарической гипоксии, смоделированной путем снижения концентрации кислорода во вдыхаемом воздухе, и вызывающей дефицит кислорода у новорожденных крысят. Как уже упоминалось во вступлении, имеются многочисленные данные о повреждающем влиянии гипоксии-ишемии на когнитивные, физиологические и морфогенетические показатели у грызунов [12, 13]. В небольшом числе работ, в которых исследовали влияние перинатальной нормобарической гипоксии без ишемии на пространственное обучение и память у грызунов, получены не однозначные результаты. Например, гипоксия (8% кислорода, продолжительность 120 мин) у крысят линии Wistar в возрасте двух дней не вызвала изменений в пространственной памяти в лабиринте Барнса при достижении 41–47 дней жизни [24]. При этом пренатальная нормобарическая гипоксия (7% кислорода, продолжительность 180 мин) на 14‑й день беременности у крыс линии Wistar вызывала нарушение памяти в тесте “Распознавание нового объекта” у 20–30-дневного потомства [25]. Аноксия (100% азотная смесь, продолжительность 25 мин) однодневных крысят линии Wistar вызывала дефицит пространственной памяти в водном лабиринте Морриса при тестировании в возрасте 60 дней [26]. Умеренную гипоксию на взрослых млекопитающих животных часто применяют для повышения резистентности нервной системы к дальнейшему влиянию другого типа стресса, при этом акцентируется внимание на том, что в адаптивном механизме устойчивости мозга к дальнейшему влиянию нового стресс-фактора участвуют глюкокортикоиды [9]. Однако, как было показано ранее, умеренная нормобарическая неонатальная гипоксия не защитила у молодых крыс когнитивные способности в условиях добавления нового стресса (звуковой сигнал), который вызывал у животных дефицит памяти [24]. Перечисленные различия во влиянии гипоксии связаны с разными условиями гипоксического воздействия, возрастными характеристиками, а также используемым тестом для оценки последствий гипоксии, и самим дизайном экспериментов.
При изучении влияния пренатальной нормобарической гипоксии показано отклонение в развитии гиппокампа у крыс более раннего возраста по сравнению с возрастом крыс, исследованных в нашей работе. Так, у крыс в возрасте 23 дней жизни в морфометрических характеристиках пирамидного слоя поля СА1 гиппокампа выявлено снижение числа клеток после гипоксии [25]. При использовании трансмиссионной электронной микроскопии обнаружено, что неонатальная аноксия индуцировала у 60-дневных крыс изменения в гиппокампе, приводящие к потере клеток и нарушению его функций. После сопоставления данных морфогенеза с поведенческими показателями авторы выдвинули предположение о связи изменений в гиппокампе с дефицитом пространственной памяти [26].
Отсутствие повреждающего влияния гипоксии на когнитивные показатели у взрослых крыс в нашей работе может быть связано и с нейрогенезом в гиппокампе. Показано, что в гиппокампе взрослых млекопитающих нейрогенез усиливает нейрональную пластичность, которая лежит в основе памяти [27, 28]. Результаты изучения, не исследованного ранее процесса нейрогенеза в ходе постнатального развития, позволило предположить, что функция нейронов, которые генерируются в зубчатой извилине в раннем подростковом возрасте и которые определяют появление пространственной навигации, является временной. При достижении половозрелого состояния в данной структуре гиппокампа появляются новые нейроны, выполняющие адаптивную функцию, что свидетельствует о вовлечении нейрогенеза в эти процессы [29, 30]. Поскольку мы не оценивали нейрогенез, мы можем только предполагать, что интенсивность и продолжительность примененного нами гипоксического стресса могут способствовать образованию новых нейронов в структурах гиппокампа у взрослых крыс и усилению пространственной памяти по сравнению с контрольными показателями.
Нивелированию вредных последствий гипоксии и усилению функциональности памяти также, вероятно, сопутствовал хэндлинг животных. Действительно, в нашем эксперименте крысята после гипоксии каждый раз подвергались взятию в руки после уколов флуоксетина или физиологического раствора в течение двух недель. Возможное протективное влияние хэндлинга при изучении последствий гипоксии-ишемии обсуждалось в литературе [31]. Кроме того, сочетание хэндлинга и исследование крыс в двух разных тестах, в наших экспериментах (тест распознавание нового объекта, а затем водный лабиринте Морриса) также могли привести к улучшению исследованных показателей. О модифицирующем влиянии сочетания стрессорных воздействий на поведенческий и физиологический ответы сообщалось нами ранее [32].
Данные о более слабой эффективности сохранения памяти на 4-й день тестирования по сравнению с 1-м днем тестирования у гипоксических крыс обоего пола, но отсутствие таких различий у контрольных крыс может указывать на разный механизм влияния гипоксии на синаптические процессы, вовлеченные в организацию памяти. В основе пространственной памяти первого и четвертого дней тестирования после удаления платформы из бассейна лежат разные формы синаптической пластичности – кратковременная пластичность и долговременная потенциация, которые в разной степени зависят от активации рецепторов глутамата, играющего центральную роль в формировании памяти [33]. Глутаматергическая система участвует в регуляции памяти с помощью нескольких типов рецепторов, обнаруженных во всех областях кортиколимбических структур мозга. Увеличение времени пребывания в целевом квадранте у гипоксических самцов при тестировании памяти на первый день после удаления платформы, а у гипоксических самок при тестировании памяти на четвертый день может свидетельствовать об активации долговременной потенциации. В этом плане интересны данные о долговременном влиянии ингибитора обратного захвата серотонина флуоксетина, хроническое введение которого осуществлялось нами сразу после однократного воздействия гипоксией двухдневных крысят. Протестированное нами влияние флуоксетина показало, что у контрольных крыс обоего пола флуоксетин не вызвал изменений в функциональности памяти, а в условиях, созданных гипоксией, сохранил усиление памяти первого дня тестирования у гипоксических самцов и памяти четвертого дня тестирования у гипоксических самок. Наши данные позволяют предполагать, что неонатальное введение флуоксетина гипоксическим крысам не оказывает влияния на долговременную потенциацию у гипоксических самцов и самок.
Увеличение времени пребывания в целевом квадранте в водном лабиринте Морриса у гипоксических самок и отсутствие изменений в этом показателе у гипоксических самцов сочетались с увеличением у первых содержания кортикостерона в плазме крови и отсутствием изменений в этом показателе у вторых. По данным литературы [17], тестирование в лабиринте Морриса вызывает у грызунов стресс, сопровождающийся изменением реактивности ГГАКС (по содержанию кортикостерона в плазме крови). Уровень кортикостерона во всех группах был выше у самцов, чем у самок, что может быть связано с более ранней адаптацией процесса высвобождения кортикостерона в ответ на хронический стресс у самок [34, 35].
Флуоксетин не изменил содержание кортикостерона у контрольных крыс и не изменил также повышенный уровень этого стресс-гормона у гипоксических крыс обоего пола, т.е. введение флуоксетина не повлияло на содержание кортикостерона. Тесное взаимодействие ГГАКС с серотонинергической системой в ответ на стресс в зависимости от пола подтверждают данные о том, что привыкание к стрессу сопровождается увеличением чувствительности пресинаптических рецепторов 5-HT1A у самцов, но повышением чувствительности постсинаптических рецепторов 5‑HT1A у крыс обоего пола [36, 37]. Серотонин, как уже упоминалось, участвует в регуляции функции гиппокампа, играющего ведущую роль в формировании пространственной памяти [15].
Половые различия во влиянии гипоксии на исследуемые нами системы связаны с половыми гормонами, которые модулируют пре- и постнатальное развитие многих систем, включая ГГАКС и когнитивную систему, поэтому в ходе развития крысят могут определять влияние глюкокортикоидов и на когнитивные процессы. Под влиянием половых гормонов изменяется синаптическая пластичность – ключевой механизм памяти [25, 27, 38]. Ранее было обнаружено, что стресс, вызванный неонатальной нормобарической гипоксией, вызывает у новорожденных крыс усиление секреции кортикостерона и тестостероновой волны [8]. Вызванное гипоксией увеличение уровня тестостерона в первые два дня после рождения (во время нормального неонатального всплеска тестостерона) программирует последующую активность ГГАКС. Нормальная динамика тестостерона у новорожденных необходима для правильного развития ГГАКС и гипоталамо-гипофизарно-гонадной системы. На основании результатов исследований, проведенных на гипоксических взрослых крысах, авторами был сделан вывод, что острая гипоксия в неонатальный период развития может иметь долгосрочные последствия для ГГАКС и гипоталамо-гипофизарно-гонадной системы в зависимости от полового диморфизма [8].
Хотя мы не определяли стадию эстрального цикла у самок перед забором крови, полученные нами данные указывают на различное влияние гипоксии на показатели пространственной памяти в разные сроки тестирования и на уровень кортикостерона у разнополых взрослых особей. Имеющиеся данные о влиянии фаз эстрального цикла, касающиеся влияния стероидов яичников на когнитивные процессы, не всегда убедительны. В настоящее время полагают, что эстрадиол оказывает активационный эффект на пространственную память, опосредованную гиппокампом, как у особей женского, так и мужского пола [38]. Фактически, эстрогены являются важными модуляторами памяти и нейронной функции у обоего пола. Хотя эстрогены производятся в основном фолликулярным аппаратом яичников, но также присутствуют в семенниках у особей мужского пола, где они могут достичь концентрации, типичной для женского организма. Локальный синтез эстрогенов в гиппокампе также важен для процессов памяти у особей обоего пола. Поскольку стресс влияет на производство половых гормонов, исследование влияния эстрального цикла имеет важное значение как для нейробиологии, так и клиники, а также для развития терапии когнитивной сферы [39].
Таким образом, неонатальная умеренная нормобарическая гипоксия в нашем исследовании не изменила или даже усилила функциональность памяти в зависимости от времени тестирования памяти и пола животных. Обнаружено долговременное протективное влияние флуоксетина, хроническое неонатальное введение которого нормализовало способность к обучению, не изменило функциональность памяти и реактивность ГГАКС у контрольных и гипоксических крыс обоего пола. Содержание кортикостерона во всех группах самцов было выше по сравнению с содержанием данного гормона у самок. Гипоксия увеличила реактивность ГГАКС у самок, что сочеталось у них с более высокой сохранностью памяти. Снижение памяти на 4-й день по сравнению с первым днем тестирования у самцов и самок крыс, подвергнутых действию неонатальной гипоксии и флуоксетина, может указывать на уменьшение синаптической пластичности в областях гиппокампа, вовлеченных в процессы консолидации и сохранения памяти. Полученные новые данные с использованием умеренной по интенсивности и длительности неонатальной нормобарической гипоксии расширяют представление о долговременном влиянии гипоксии на пространственную память и реактивность ГГАКС в зависимости от половой принадлежности и подчеркивают отсутствие вредного влияния флуоксетина на функциональность памяти как у контрольных животных, так и после воздействия гипоксии в ранний постнатальный период развития.
Список литературы
Van Bodegom M, Homberg JR, Henckens MJAG (2017) Modulation of the hypothalamic-pituitary-adrenal axis by early life stress exposure. Front Cell Neurosci 19: 11–87. https://doi.org/10.3389/fncel.2017.00087
Giannopoulou I, Pagida MA, Briana DD, Panayotacopoulou MA (2018) Perinatal hypoxia as a risk factor for psychopathology later in life: the role of dopamine and neurotrophins. Hormones (Athens) 17: 25–32. https://doi.org/10.1007/s42000-018-0007-7
Matthews SG, McGowan PO (2019) Developmental programming of the HPA axis and related behaviours: epigenetic mechanisms. J Endocrinol 242: 69–79. https://doi.org/10.1530/joe-19-0057
Maccari S, Krugers HJ, Morley-Fletcher S, Szyf M, Brunton PJ (2014) The consequences of early-life adversity: neurobiological, behavioural and epigenetic adaptations. J Neuroendocrinol 26: 707–723. https://doi.org/10.1111/jne.12175
Renz H, Adkins BD, Bartfeld S, Blumberg RS, Farber DL, Garssen J, Ghazal P, Hackam DJ, Marsland BJ, McCoy KD, Penders J, Prinz I, Verhasselt V, von Mutius E, Weiser JN, Wesemann DR, Hornef MW (2018) The neonatal window of opportunity-early priming for life. J Allergy Clin Immunol 141 (4): 1212–1214. https://doi.org/10.1016/j.jaci.2017.11.019
Rice D, Barone JrS (2000) Critical periods of vulnerability for the developing nervous system: evidence from humans and animal models. Environmental Health Perspectives 108: 511–533. https://doi.org/10.1289/ehp.00108s3511
Lupien SJ, McEwen BS, Gunnar MR, Heim C (2009) Effects of stress throughout the lifespan on the brain, behaviour and cognition. Nat Rev Neurosci 10: 434–445. https://doi.org/10.1038/nrn2639
Gehrand AL, Phillips J, Malott K, Raff H (2020) Corticosterone, adrenal, and the pituitary-gonadal axis in neonatal rats: effect of maternal separation and hypoxia. Endocrinology 161: bqaa085. https://doi.org/10.1210/endocr/bqaa085
Rybnikova E, Nalivaeva N (2021) Glucocorticoid-dependent mechanisms of brain tolerance to hypoxia. Int J Mol Sci 22: 7982. https://doi.org/10.3390/ijms22157982
Millar LJ, Shi L, Hoerder-Suabedissen A, Molnár Z (2017) Neonatal hypoxia ischaemia: mechanisms, models, and therapeutic challenges. Front Cell Neurosci 11: 78. https://doi.org/10.3389/fncel.2017.00078
Semenov DG, Belyakov AV, Rybnikova EA (2022) Experimental modeling of damaging and protective hypoxia of the mammalian brain. J Evol Biochem Physiol 58: 2021–2034. https://doi.org/10.1134/s0022093022060291
Sanches EFF, Arteni NSS, Nicola F, Boisserand L, Willborn S, Netto CAA (2013) Early hypoxia-ischemia causes hemisphere and sex-dependent cognitive impairment and histological damage. Neuroscience 237: 208–215. https://doi.org/10.1016/j.neuroscience.2013.01.066
Duran-Carabali LE, Odorcyk FK, Sanches EF, de Mattos MM, Anschau FCA, Netto CAA (2022) Effect of environmental enrichment on behavioral and morphological outcomes following neonatal hypoxia-ischemia in rodent models: a systematic review and meta-analysis affiliations expand. Mol Neurobiol 59: 1970–1991. https://doi.org/10.1007/s12035-022-02730-9
Khozhai LI, Otellin VA (2022) Distribution of GABAergic neurons and expression levels of GABA transporter 1 in the rat neocortex during the neonatal period after perinatal hypoxic exposure. J Evol Biochem Physiol 58: 1432–1441. https://doi.org/10.1134/S0022093022060023
Bombardi C, Grandis A, Pivac N, Sagud M, Lucas G, Chagraoui A, Lemaire-Mayo V, De Deurwaerdère P, Di Giovanni G (2021) Serotonin modulation of hippocampal functions: From anatomy to neurotherapeutics. Progress Brain Res 261: 83–158. https://doi.org/10.1016/bs.pbr.2021.01.031
Carneiro IBC, Toscano AE, da Cunha MSB, Lacerda DC, Pontes PB, de Castro RM, de Jesus Deiró TCB, Mede-iros JMB (2022) Serotonergic mechanisms associated with experimental models of hypoxia: a systematic review. Int J Dev Neurosci 82(8):668–680. https://doi.org/10.1002/jdn.10226
Vorhees CV, Williams MT (2014) Assessing spatial learning and memory in rodents. ILAR J 55: 310–332. https://doi.org/10.1093/ilar/ilu013
Nagano R, Nagano M, Nakai A, Takeshita T, Suzuki H (2017) Differential effects of neonatal SSRI treatments on hypoxia-induced behavioral changes in male and female offspring. Neuroscience 360: 95–105. https://doi.org/10.1016/j.neuroscience.2017.07.051
Tate K, Kirk B, Tseng A, Ulffers A, Litwa K (2021) Effects of the selective serotonin reuptake inhibitor fluoxetine on developing neural circuits in a model of the human fetal cortex. Int J Mol Sci 22:10457. https://doi.org/10.3390/ijms221910457
Khodanovich M, Kisel A, Kudabaeva M, Chernysheva G, Smolyakova V, Krutenkova E (2018) effects of fluoxetine on hippocampal neurogenesis and neuroprotection in the model of global cerebral ischemia in rats. Int J Mol Sci 19: 162. https://doi.org/10.3390/ijms19010162
Dobbing J (1981) Nutritional growth restriction and the nervous system. Davidson AN, Thompson RHS (Eds.), The Molecular Basis of Neuropathology. Edward Arnold Co. London. 221–233.
Cohen SJ, Stackman RW (2015) Assessing rodent hippocampal involvement in the novel object behavior. Brain Res 285: 105–117. https://doi.org/10.1016/j.bbr.2014.08.002
Morris RGM (1981) Spatial localization does not require the presence of local cues. Learning and Motivation 12: 239–260. https://doi.org/10.1016/0023-9690(81)90020-5
Sukhanova IuA, Sebentsova EA, Khukhareva DD, Vy-sokikh MYu, Bezuglov VV, Bobrov MYu, Levitskaya NG (2019) Early-life N-arachidonoyl-dopamine exposure increases antioxidant capacity of the brain tissues and reduces functional deficits after neonatal hypoxia in rats. Int J Dev Neurosci 78: 7–18. https://doi.org/10.1016/j.ijdevneu.2019.06.007
Zhuravin IA, Dubrovskaya NM, Vasilev DS, Postnikova TY, Zaitsev AV (2019) Prenatal hypoxia produces memory deficits associated with impairment of long-term synaptic plasticity in young rats. Neurobiol Learn Mem 164: 107066. https://doi.org/10.1016/j.nlm.2019.107066
Takada SH, Dos Santos Haemmerle CA, Motta-Teixeira LC, Machado-Nils AV, Lee VY, Takase LF, Cruz-Rizzolo RJ, Kihara AH, Xavier GF, Watanabe I-S, Nogueira MI (2015) Neonatal anoxia in rats: hippocampal cellular and subcellular changes related to cell death and spatial memory. Neuroscience 284: 247–259. https://doi.org/10.1016/j.neuroscience.2014.08.054
Toda T, Gage FH (2018) Review: adult neurogenesis contributes to hippocampalplasticity. Cell Tissue Res 373: 693–709. https://doi.org/10.1007/s00441-017-2735-4
Kempermann G (2022) What is adult hippocampal neurogenesis good for? Front Neurosci 16: 852680. https://doi.org/10.3389/fnins.2022.852680
Bond AM, Ming G-l, Song H (2022) What is the relationship between hippocampal neurogenesis across different stages of the lifespan? Front Neurosci 16: 891713. https://doi.org/10.3389/fnins.2022.891713
Masachs N, Charrier V, Farrugia F, Lemaire V, Blin N, Mazier W, Tronel S, Montaron M-F, Ge S, Marsicano G, Cota D, Deroche-Gamonet V, Herry C, Abrous DN (2021) The temporal origin of dentate granule neurons dictates their role in spatial memory. Mol Psychiatry 26: 7130–7140. https://doi.org/10.1038/s41380-021-01276-x
Muntsant A, Shrivastava K, Recasens M, Giménez-Llort L (2019) Severe perinatal hypoxic-ischemic brain injury induces long-term sensorimotor deficits, anxiety-like behaviors and cognitive impairment in a sex-, age- and task-selective manner in C57BL/6 mice but can be modulated by neonatal handling. Front Behav Neurosci 13: 7. https://doi.org/10.3389/fnbeh.2019.00007
Butkevich IP, Mikhailenko VA (2018) Effect of fluoxetine in prenatal period on nociceptive system reactivity and psychoemotional behavior in young female rats. Bull Exp Biol Med 165: 209–212. https://doi.org/10.1007/s10517-018-4131-9
France G, Volianskis R, Ingram R, Bannister N, Rothärmel R, Irvine MW, Fang G, Burnell ES, Sapkota K, Costa BM, Vhpra DA, Michael-Titus AT, Monaghan DT, Georgiou J, Bortolotto ZA, Jane DE, Collingridge GL, Volianskis A (2022) Differential regulation of STP, LTP and LTD by structurally diverse NMDA receptor subunit-specific positive allosteric modulators. Neuropharmacology 202: 108840. https://doi.org/10.1016/j.neuropharm.2021.108840
Luine V (2002) Sex differences in chronic stress effects on memory in rats. Stress 5: 205–216. https://doi.org/10.1080/1025389021000010549
Luine V, Gomez J, Beck K, Bowman R (2017) Sex differences in chronic stress effects on cognition in rodents. Pharmacology, Biochem Behav 152: 13–19. https://doi.org/10.1016/j.pbb.2016.08.005
Goel N, Philippe TJ, Chang J, Koblanski ME, Viau V (2022) Cellular and serotonergic correlates of habituated neuroendocrine responses in male and female rats. Psychoneuroendocrinology 136: 105599. https://doi.org/10.1016/j.psyneuen.2021.105599
Philippe TJ, Bao L, Koblanski ME, Viau V (2022) Sex differences in serotonin 5-HT 1A receptor responses to repeated restraint stress in adult male and female rats. Int J Neuropsychopharmacol 25: 863–876. https://doi.org/10.1093/ijnp/pyac046
Taxier LR, Gross KS, Frick KM (2020). Oestradiol as a neuromodulator of learning and memory. Nat Rev Neurosci 21: 535–550. https://doi.org/10.1038/s41583-020-0362-7
Rocks D, Kundakovic M (2022) Hippocampus-based behavioral, structural, and molecular dynamics across the estrous cycle. J Neuroendocrinol e13216. https://doi.org/10.1111/jne.13216
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии