Журнал эволюционной биохимии и физиологии, 2023, T. 59, № 3, стр. 190-197
Влияние предсердной электрической стимуляции на трансмуральную последовательность деполяризации стенок желудочков сердца крыс при золетил-ксилазиновом наркозе
В. П. Нужный 1, Н. А. Киблер 1, *, А. С. Цветкова 1, С. Н. Харин 1, А. Б. Байрхаев 1, Д. Н. Шмаков 1
1 Институт физиологии Коми научного центра Уральского отделения Российской академии наук,
ФИЦ Коми НЦ УрО РАН
Сыктывкар, Россия
* E-mail: natanadya@mail.ru
Поступила в редакцию 09.01.2023
После доработки 23.03.2023
Принята к публикации 12.04.2023
- EDN: YHUEQA
- DOI: 10.31857/S0044452923030075
Аннотация
Исследована трансмуральная последовательность деполяризации свободных стенок желудочков сердца крыс линии Вистар при увеличении частоты сердечных сокращений на фоне золетил ксилазинового наркоза. Увеличение частоты сердечных сокращений вызывали посредством предсердной электрической стимуляции. Золетил-ксилазиновый наркоз при внутримышечном введении в дозе 0.15 мг/кг золетила и 3 мг/кг ксилазина вызвал значительный отрицательный хронотропный эффект с резко выраженной брадикардией, характеризующейся уменьшением частоты сердечных сокращений от исходной в два раза. При сниженном синусно-предсердном ритме с частотой 237 ± 34 уд/мин первоначально деполяризовались субэндокардиальные слои, затем интрамуральные и далее субэпикардиальные слои левой и правой свободных стенок желудочков сердца. Области оснований свободных стенок желудочков деполяризовались позже верхушечных областей приблизительно на 2–4 мс также движением волны активации от эндокарда к эпикарду. При увеличении частоты сердечных сокращений последовательность и трансмуральный градиент деполяризации не изменялись. Вместе с тем увеличение частоты стимуляции от 300 до 500 уд/мин приводило к уменьшению времени прибытия волны деполяризации к субэндокардиальным, интрамуральным и субэпикардиальным слоям стенок левого и правого желудочков. Несмотря на депрессивное действие золетил-ксилазинового наркоза на сердце и его хронотропную функцию, при высокой частоте предсердной электрической стимуляции градиент деполяризации от эндокарда к эпикарду и от верхушки к основанию желудочков сохранялся, происходили лишь незначительные изменения длительности процесса трансмуральной деполяризации стенок желудочков сердца. Это свидетельствует о резистентности активации желудочков сердца крыс линии Вистар к токсическому действию золетил-ксилазинового наркоза.
ВВЕДЕНИЕ
Последовательность деполяризации миокарда желудочков играет ведущую роль в формировании начального желудочкового комплекса QRS ЭКГ. Ранее нами были подробно изучены пространственно-временные параметры процессов активации желудочков сердца и исследована их корреляция с элементами комплекса QRS у разных классов позвоночных животных [1].
При моделировании и изучении болезней сердца человека широкое распространение получили электрокардиографические методы исследования [2–4]. К настоящему времени за рубежом при проведении острых опытов, чаще всего на крысах, хорошо изучено действие на сердечно-сосудистую систему кетамин-ксилазинового наркоза [5–7]. В ветеринарной практике и физиологических экспериментах для наркотизации крыс также широко используется золетил, а в качестве анальгетика и мышечного релаксанта – ксилазин. По данным исследователей при действии золетила у крыс происходит увеличение частоты сердечных сокращений (ЧСС) [8–11], которая выше по сравнению с ЧСС у животных, наркотизированных кетамином, изофлураном, пентобарбиталом и кетамин/ксилазином [6, 12]. В противоположность золетилу, ксилазин угнетает сердечную деятельность [8] и оказывает значительное отрицательное хронотропное воздействие на сердце [5]. Установлено, что для крыс сочетание ксилазина с золетилом является крайне токсичным и сильнодействующим сердечно-сосудистым депрессантом [8, 13].
Методами электрокардиографии изучено влияние различных анестетиков на ЧСС, длительность зубцов Р, комплексов QRS, зубцов T и интервалов P-Q, Q-T [2–4]. Вместе с тем полученные разными авторами показатели ЭКГ значительно отличаются. Так, длительность комплекса QRS у крыс линии Wistar, анестезированных уретаном, составила 14–16 мс, кетамином в сочетании с ксилазином – 17–25 мс, пентобарбиталом – 18–19.6 мс, эфиром – 18–28 мс [14]. Влияние того или иного вида наркоза на механизм формирования зубцов, комплексов ЭКГ, в частности комплекса QRS, остается малоизученным. Поскольку последовательность процесса деполяризации миокарда лежит в основе механизма формирования ЭКГ [1], а комбинация золетила с ксилазином вызывает отрицательную хронотропную и депрессивную реакцию сердца, особый интерес представляет вопрос о сочетанном влиянии золетил-ксилазинового наркоза и высокой ЧСС, индуцированной электрокардиостимуляцией, на трансмуральную последовательность и длительность процесса деполяризации стенок желудочков сердца и их соотношение с комплексм QRS. Ранее нами [15] был подробно изучен процесс активации миокарда желудочков у белых лабораторных крыс линии Вистар и исследована корреляция показателей пространственно-временных фронтов волны деполяризации с элементами комплекса QRS при синусно-предсердном ритме. Целью настоящей работы являются исследование влияния увеличения ЧСС посредством предсердной электрокардиостимуляции на трансмуральную последовательность деполяризации стенок желудочков сердца у крыс линии Вистар и длительность комплекса QRS ЭКГ на фоне золетил-ксилазинового наркоза.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты были проведены на 30 взрослых самцах крыс линии Вистар. Животных наркотизировали золетилом (15 мг/кг, внутримышечно) и после их засыпания для миорелаксации внутримышечно вводили ксилазин в дозе 3 мг/кг. Затем животных переводили на искусственную вентиляцию легких с помощью медицинского компрессора Newport Breeze E-150 Ventilator. Вскрытие грудной клетки осуществляли по среднегрудинной линии, после чего разрезали перикард. Температура тела крысы поддерживалась на уровне 37–38°C, сердце смачивалось теплым физиологическим раствором.
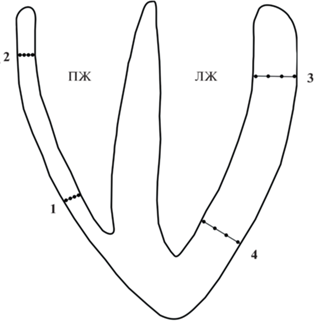
Регистрация миокардиальных электрограмм производилась с помощью игольчатых электродов. Каждый игольчатый электрод содержал четыре макроэлектрода. Игольчатые электроды вводились перпендикулярно миокардиальным стенкам в областях основания и верхушки ЛЖ и ПЖ (рис. 1). Длина интрамуральных игольчатых электродов соответствовала предполагаемой толщине свободных стенок желудочков в зонах их введения.
Рис. 1.
Схема расположения игольчатых интрамуральных электродов (1–4) в свободных стенках правого (ПЖ) и левого (ЛЖ) желудочков сердца крыс.
Момент прихода волны возбуждения в область отведения потенциала (время деполяризации) определялся по минимуму первой производной внеклеточных потенциалов (электрограмм) (dV/dtmin) в период комплекса QRS.
Частоту сердечных сокращений изменяли посредством электрокардиостимуляции при помощи диагностического электрокардиостимулятора ЧЭЭКС п-3 “Вектор-МС”, в диапазоне от исходного синусно-предсердного ритма, возникшего в результате воздействия ксилазина, до максимальной частоты сердечных сокращений, при которой возникали нарушения деятельности сердца. Стимулировали ушко правого предсердия импульсами прямоугольной формы длительностью 2 мс и амплитудой 3.5 V. Частоту сердечных сокращений изменяли от 300 уд/мин и выше с шагом 50 уд/мин.
В начале эксперимента до введения в наркоз у животных производили регистрацию электрокардиограммы в отведениях от конечностей. Для регистрации ЭКГ использовали устройство собственной конструкции (“крысиную нору”), выполненное из темного оргстекла в виде полуцилиндра с закрытой с одной стороны торцовой частью. К расположенному по продольной оси полуцилиндра основанию прикрепляли изолированные друг от друга четыре металлические пластины, которые служили отводящими электродами для регистрации ЭКГ. Перед записью ЭКГ их покрывали электропроводной пастой и далее животное запускали в “крысиную нору”. Исключение процедуры прикрепления электродов к животным уменьшало стрессовое влияние, и при записи ЭКГ они находились в более спокойном состоянии.
Результаты деполяризации субэндокардиальных, интрамуральных и субэпикардиальных слоев стенок желудочков анализировали с помощью программы для медико-биологической статистики BIOSTAT 4.03. с использованием непараметрических критериев Уилкоксона. Для оценки различий параметров до и после воздействия применяли критерий Стьюдента с применением поправки Бонферрони (с учетом множественных сравнений). Данные представлены в виде средней арифметической и стандартного отклонения средней. Различия считали статистически значимыми при р < 0.01.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Частота сердечных сокращений до проведения анестезии у бодрстующих крыс линии Wistar составила 446.2 ± 18.4 уд/мин, длительность комплекса QRS – 17.1 ± 1.0 мс. При анестезии золетил-ксилазиновым раствором после торакотомии по сравнению с интактными животными произошло уменьшение ЧСС с 446.2 ± 18.4 уд/мин до 237 ± 34 уд/мин (р < 0.001) и незначительное увеличение длительности комплекса QRS с 17.1 ± 1.0 мс до 20.5 ± 6.3 мс. При увеличении частоты стимуляции от 450 до 500 уд/мин наблюдалось уменьшение длительности комплекса QRS (р < 0.01) (табл. 1).
Таблица 1.
Время деполяризации субэндокардиальных, интрамуральных и субэпикардиальных слоев миокарда желудочков сердца крыс и длительность комплекса QRS при синусно-предсердном и артифициальных ритмах
| Область желудочков | Слои желудочков | Синусно- предсердный ритм | Предсердный артифициальный ритм | ||||
|---|---|---|---|---|---|---|---|
| Частота сердечных сокращений, уд/мин | 237 ± 34 | 300 | 350 | 400 | 450 | 500 | |
| Основание левого желудочка | 1 | 6.7 ± 3.3* | 6.3 ± 1.3* | 5.5 ± 2* | 5.4 ± 1.3* | 5.8 ± 2* | 5.5±2.9* |
| 2 | 8.5 ± 3.1 | 8.3 ± 2.2 | 7.5 ± 1.3 | 6.7 ± 1.4 | 7.9 ± 2.2 | 7.5±3.5 | |
| 3 | 9.6 ± 3.6 | 10.4 ± 2.4 | 9.6 ± 2.2 | 8.8 ± 2.1 | 9.8 ± 2.4 | 8.5±3.7 | |
| Верхушка левого желудочка | 1 | 3.6 ± 2.1* | 3.6 ± 1.4* | 3.5 ± 2* | 3.2 ± 1.6* | 3.9 ± 1.4* | 3.7±2.3* |
| 2 | 5.8 ± 2.7 | 5.7 ± 1.9 | 5.2 ± 2.2 | 5 ± 2 | 7.3 ± 3 | 5.5±2.1 | |
| 3 | 7.5 ± 3.1 | 7.6 ± 2.3 | 6.1 ± 2.3 | 6.3 ± 2 | 9.7 ± 2.9 | 7.3±1 | |
| Основание правого желудочка | 1 | 12 ± 5.3* | 10 ± 1.3* | 9.7 ± 0.6* | 8.9 ± 1.6* | 9.3 ± 1.5* | 9.2±0.4 * |
| 2 | 13.6 ± 4.7 | 10.7 ± 1.2 | 10.6 ± 0.8 | 10.3 ± 1.8 | 10.4 ± 1.6 | 10±0.6 | |
| 3 | 14.4 ± 4.4 | 11.6 ± 1.1 | 11 ± 1.1 | 11.3 ± 1.5 | 12.2 ± 1.8 | 10.7±0.4 | |
| Верхушка правого желудочка | 1 | 9.4 ± 4.4* | 7.9 ± 1.3* | 8.4 ± 1.2* | 7.5 ± 1.9* | 8 ± 1.5* | 7.7±1* |
| 2 | 10.9 ± 4.4 | 10.3 ± 1.3 | 9.8 ± 1.2 | 8.9 ± 2 | 10.3 ± 2.1 | 10±1.1 | |
| 3 | 12.2 ± 4.4 | 11.8 ± 1.6 | 10.3 ± 1.2 | 10.1 ± 2.1 | 11.8 ± 1.9 | 11.1±0.4 | |
| Длительность QRS, мс | 20.5 ± 6.3 | 22.1 ± 4.1 | 20.1 ± 3.8 | 19.5 ± 2.9 | 15.2 ± 2.1^ | 12.8 ± 0.8^ | |
При синусно-предсердном ритме с частотой 237 ± 34 уд/мин первоначально деполяризовались субэндокардиальные слои, затем интрамуральные и далее субэпикардиальные слои свободных стенок в области верхушек и оснований как левого, так и правого желудочков (табл. 1). Так, в областях введения электродов первоначально деполяризовались зоны миокарда, расположенные в субэндокарде верхушечной трети ЛЖ (рис. 2а, 1) и в субэндокарде верхушечной трети ПЖ (рис. 3а, 1), затем интрамуральные слои и несколько позже – зоны субэпикарда стенок желудочков.
Рис. 2.
Электрограммы (ЭГ) от интрамуральных игольчатых электродов, введенных в области основания и верхушки свободной стенки левого желудочка сердца крысы при синусно-предсердном (а), артифициальных ритмах 300 уд/мин (b) и 500 уд/мин (c). 1– субэндокард, 2.3 – интрамуральные слои, 4 – субэпикард. Момент прибытия волны возбуждения к электродам отмечен пересекающими ЭГ вертикальными линиями. Слева от ЭГ расположен стимулирующий импульс.
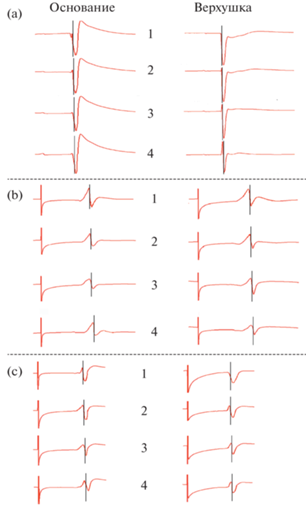
Рис. 3.
Электрограммы (ЭГ) от интрамуральных игольчатых электродов, введенных в области основания и верхушки свободной стенки правого желудочка сердца крысы. Обозначения те же, что и на рис 2.
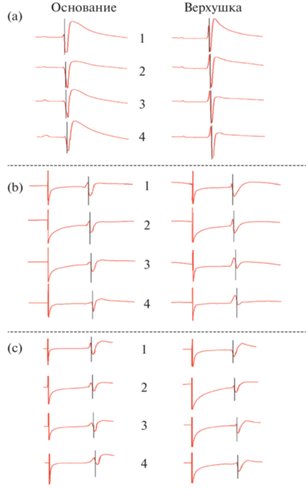
Как в правом, так и левом желудочках вся толща свободных стенок в области верхушки деполяризовалась на 2 мс раньше основания.
Таким образом, при сниженном в результате воздействия золетил-ксилазинового наркоза синусно-предсердном ритме первоначально деполяризовались области субэндокарда верхушки ЛЖ и ПЖ с последующим движением волны активации к эпикарду. Области оснований свободных стенок желудочков деполяризовались позже верхушечных областей приблизительно на 2–4 мс, при этом эндокард также возбуждался раньше эпикарда.
При увеличении частоты стимуляции от 300 до 500 уд/мин волна возбуждения в свободных стенках обоих желудочков, как и при синусно-предсердном ритме, двигалась в направлении от эндокарда к эпикарду. Градиент деполяризации от эндокарда к эпикарду и от верхушки к основанию желудочков сохранялся при всех частотах стимуляции (табл. 1; рис. 2b, c; рис 3b, c).
Вместе с тем по сравнению с синусно-предсердным ритмом на частотах стимуляции от 300 до 400 уд/мин наблюдался более быстрый приход волны возбуждения к субэпикардиальным слоям основания правого желудочка (табл. 1). При частоте стимуляции 450 уд/мин происходило увеличение времени прихода волны деполяризации ко всем слоям миокарда с последующим его уменьшением при увеличении частоты стимуляции до 500 уд/мин (табл. 1).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что у лабораторных крыс тилетамин-золазепамовый (золетиловый) наркоз увеличивает частоту сердечных сокращений [8–11]. В противоположность золетилу, ксилазин обладает значительным отрицательным хронотропным воздействием на сердце [5]. Комбинация золетила и ксилазина для крыс токсична, и ее сочетание является сердечно-сосудистым депрессантом [8, 13]. В нашем эксперименте у крыс линии Wistar при анестезии золетил-ксилазиновым наркозом даже в значительно меньшей дозировке ксилазина [5–7] произошло уменьшение ЧСС по сравнению с контролем с 446.2 ± 18.4 уд/мин до 237 ± 34 уд/мин (р < 0.001).
Таким образом, золетил-ксилазиновый наркоз при внутримышечном введении в дозе 0.15 мг/кг золетила и 3 мг/кг ксилазина вызвал значительный отрицательный хронотропный эффект с резко выраженной брадикардией, характеризующейся уменьшением частоты сердечных сокращений от исходной в два раза. Известно, что ксилазин является агонистом α2-адренорецепторов (α2-АР) [16, 17]. Вероятно, столь значительное снижение ЧСС было вызвано активацией ксилазином пресинаптических α2-адренорецепторов, которые в сердце млекопитающих располагаются на постсинаптических мембранах кардиомиоцитов [18, 19] и на пресинаптических мембранах адренергических волокон [20, 21]. Основная роль пресинаптических α2-адренорецепторов заключается в их участии в системе отрицательной обратной связи, регулирующей освобождение медиатора норадреналина [20, 22]. Возбуждение этих рецепторов тормозит освобождение норадреналина из варикозных утолщений симпатического волокна [22, 23] и усиливает вагусное влияние на сердце [24]. Вероятно, активация пресинаптических α2-адренорецепторов в результате воздействия ксилазина привела к снижению секреции норадреналина, что уменьшило его воздействие на β-адренергические рецепторы пейсмекерных клеток. В свою очередь это вызвало уменьшение уровня напрямую связанного с f-каналами циклического аденозинмонофосфата (цАМФ). В результате произошло уменьшение f-тока и, соответственно, снижение частоты сердечных сокращений [25].
Установлено, что длительность QRS у крыс Wistar в зависимости от вида наркоза составляет от 14 до 28 мс [14]. По нашим данным исходно у крыс после введения в наркоз при синусно-предсердном ритме длительность комплекса QRS составила 20.5 ± 6.3 мс. При предсердной электрической стимуляции с частотой до 500 уд/мин продолжительность комплекса QRS имела частотно зависимый характер, увеличиваясь в зависимости от частоты артифициального предсердного ритма и варьировала от 12.8 ± 0.8 до 22.1 ± 4.1 мс, что обусловлено, по-видимому, развитием внутри желудочковых аберраций проведения импульса. Известно, что комплекс QRS отображает последовательность и длительность процесса деполяризации миокарда желудочков [1], решающую роль в котором выполняет фаза быстрой деполяризации. Фаза быстрой деполяризации клеток миокарда обусловлена входящим током ионов Na+ через быстрые потенциал-зависимые натриевые каналы. Вероятно, при действии ксилазина происходит частичная блокада потенциал-зависимых натриевых каналов в клетках миокарда желудочков, что вызывает снижение скорости нарастания переднего фронта потенциалов действия (ПД) в фазу 0 (dV/dtmax). Увеличение длительности фазы быстрой деполяризации потенциала действия в свою очередь приводит к повышению продолжительности охвата возбуждением желудочков сердца и, соответственно, комплекса QRS ЭКГ. К тому же воздействие ксилазина, на фоне синусно-предсердного ритма, вероятно, вызывает межклеточное разобщение, которое в свою очередь определяет задержку проведения возбуждения между соседними клетками или группами клеток [26], что увеличивает их трансмуральную электрофизиологическую гетерогенность [27], повышая тем самым продолжительность охвата возбуждением миокарда желудочков.
При увеличении ЧСС посредством предсердной электрической стимуляции последовательность и трансмуральный градиент деполяризации не изменялись (табл. 1). Вместе с тем увеличение частоты стимуляции от 300 до 500 уд/мин приводило к уменьшению времени прибытия волны деполяризации к субэндокардиальным, интрамуральным и субэпикардиальным слоям стенок левого и правого желудочков, что, вероятно, было вызвано уменьшением трансмуральной электрофизиологической неоднородности в связи с повышением ЧСС [27] и улучшением проведения возбуждения в миокарде [26]. В результате этого процесса произошла более быстрая деполяризация стенок желудочков, соответствующая по длительности таковой у исследованных нами ранее крыс линии Вистар при синусно-предсердном ритме [15]. При частотах стимуляции 400–500 уд/мин, находящихся в диапазоне частоты сердечных сокращений у интактных крыс (446.2 ± 18.4 уд/мин), длительность комплекса QRS на ЭКГ уменьшалась, что может быть вызвано развитием “сверхнормального проведения” по проводящей системе миокарда, когда увеличение сердечных сокращений приводит к замедлению проведения импульса по атриовентрикулярному узлу и прекращению аберраций в желудочках, тем самым улучшается скорость проведения импульса по миокарду.
Данные, полученные в последнее время [28], позволяют переосмыслить сложившиеся представления о механизмах генерации ритма сердца и демонстрируют существование генератора ритма в центральной нервной системе наряду с генератором сердечного ритма в самом сердце. Важную роль в авторитмической деятельности сердца играют норадреналин, выделяющийся из симпатических нервных окончаний, триггером которого является активация нейронов голубого пятна в стволе головного мозга, и адреналин, секретируемый мозговым слоем надпочечников. При этом контролируемая ЦНС симпатоадреналовая активность у крыс является ключевым элементом в регуляции симпатической активности сердца [29]. Можно предположить, что предсердная электрокардиостимуляция с частотой, приближенной к ЧСС интактных животных, восстанавливает, вызванный ксилазином разрыв в системе центральной автономной регуляции деятельности сердца [30]. Поэтому, при частоте стимуляции 450 уд/мин, т.е. близкой к ЧСС крыс без анестезии – 446.2 ± ± 18.4 уд/мин, продолжительность комплекса QRS имеет тенденцию к возврату его длительности, зарегистрированной у бодрствующих животных.
Таким образом, несмотря на депрессивное действие золетил-ксилазинового наркоза на сердце и его хронотропную функцию, при высокой частоте предсердной электрической стимуляции градиент деполяризации от эндокарда к эпикарду и от верхушки к основанию желудочков сохраняется, происходят лишь незначительные изменения длительности процесса трансмуральной деполяризации стенок желудочков сердца. Это свидетельствует об устойчивости процесса активации миокарда желудочков к токсическому действию золетил-ксилазинового наркоза.
Список литературы
Roshchevsky MP, Shmakov DN (2003) Excitation of the heart. M. Nauka.
Farraj AK, Hazari MS, Cascio WE (2011) The utility of the small rodent electrocardiogram in toxicology. Toxicol Sci May 121 (1): 11–30. https://doi.org/10.1093/toxsci/kfr021
Лычева НА, Макарова МН, Макаров ВГ, Рыбакова АВ (2018) Влияние различных видов анестезии на параметры электрокардиограммы у крыс. Лаб жив научн исслед 2: 16–23. [Lycheva N, Makarova M, Makarov V, Rybakova A (2018) Effect of different species of anesthesia on electrocardiogram parameters in rats. Laboratory Animal Sci 2: 16–23. (In Russ)]. https://doi.org/10.29926/2618723X-2018-02-02
Привалова ИЛ, Шевелев ОА, Ходорович НА, Кузнецова ТШ, Глотова ИВ, Легостаева ТН, Озерова ИЮ (2019) Электрокардиография у крыс в экспериментальных исследованиях (обзор литературы). Ген развед жив 2: 108–120. [Privalova I, Shevelev O, Hodorovich N, Kuznetsova T, Glotova I, Legostaeva T, Ozerova I (2019) Electrocardiography in rats in experimental studies (review of the literature). Gen Breed Animal 2: 108–120. (In Russ)] https://doi.org/10.31043/2410-2733-2019-2-108-120
Picollo C, Serra AJ, Levy RF, Antonio EL, Santos L, Tucci PJF (2012) Hemodynamic and thermoregulatory effects of xylazine-ketamine mixture persist even after the anesthetic stage in rats. Arq Bras Med Vet Zootec 64 (4): 860–864.
Redfors B, Shao Y, Omerovic E (2014) Influence of anesthetic agent, depth of anesthesia and body temperature on cardiovascular functional parameters in the rat. Lab Anim 48 (1): 6–14. https://doi.org/10.1177/0023677213502015
Gonca E (2015) Comparison of thiopental and ketamine+xylazine anesthesia inischemia/ reperfusion-induced arrhythmias in rats. Turkish J Med Sci 45 (6): 34. https://doi.org/10.3906/sag-1403-25
Wilson RP, Zagon IS, Larach DR, Max Lang CM (1993) Cardiovascular and respiratory effects of tiletamine-zolazepam. Pharmacol, Biochem Behav 44 (1): 1–8.
Ивашов МН, Арльт АВ, Савенко ИА, Сергиенко АВ, Зацепина ЕЕ, Лысенко ТА, Куянцева АМ, Саркисян КХ (2012) Особенности кардиодинамики при применении золетила у лабораторных животных. Научные ведомости. Серия мед формация 4 (123) 17/1: 168–171. [Ivashev MN, Arlt AV, Savenko IA, Sergienko AV, Zatsepina EE, Lysenko TA, Kuyantseva AM, Sarkisyan KH (2012) Features of cardiodynamics when using zoletil in laboratory animals. Scientific bulletin. Med Pharmac Ser 4 (123) 17/1: 168–171. (In Russ)].
Савенко ИА, Усманский ЮВ, Ивашев МН, Сергиенко АВ, Лысенко ТА, Куянцева АМ, Арльт АВ, Зацепина ЕЕ, Саркисян КХ, Ефремова МП, Шемонаева МВ (2012) Возможность применения ветеринарного препарата в экспериментальной фармакологии. Фундамент исслед 5 (2): 422–425. [Savenko IA, Usmanskiy UV, Ivashev MN, Sergienko AV, Lysenko TA, Kuyantseva AM, Arlt AV, Zatsepina EE, Sarkisyan KH, Efremova MP, Shemonaeva MV (2012) Chance of veterinary medicine in experimental pharmacology. Fundamental Res 5 (2): 422–425. (In Russ)].
Svorc P (2020) Heart rate variability and heart rate under general anesthesia in rats of both sexes. Trends Med 21: 1–3. https://doi.org/10.15761/TiM.1000257
Saha DC, Saha AC, Malik G, Astiz ME, Eric C, Rackow EC (2007) Comparison of Cardiovascular Effects of Tiletamine–Zolazepam, Pentobarbital, and Ketamine–Xylazine in Male Rats. Vet Surg 46 (2): 74–80.
Смирнова АВ, Лагутина ЛД, Трубицына ИЕ, Васнев ОС (2012) Особенности проведения анестезии у крыс при полосных операциях. Эксп клин гастроэнтерол 5: 62–65. [Smirnova AV, Lagutina LD, Trubitsyna IE, Vasnev OS (2012) Features of anesthesia in rats during band operations. Exp Clin Gastroenterol 5: 62–65. (In Russ)].
Konopelski P, Ufnal M (2016) Electrocardiography in rats: a comparison to human. Physiol Res 65 (5): 717–725.
Roshchevskaya IM, Roshchevsky MP, Shmakov DN, Arteeva NV, Antonova NA (1999) Experimental and model investigation of cardioelectric field formation in Wistar rat at the period of ventricu lar depolarization. Electrocardiology’ 98/Ed:I Preda-London: World Sci: 173–176. (In Russ).
Veilleux-Lemieux D, Castel A, Carrier DF, Vachon P (2013) Pharmacokinetics of Ketamine and Xylazine in Young and Old Sprague–Dawley Rats. J Am Assoc Lab Anim Sci 52 (5): 567–570.
Cepiel A, Noszczyk-Nowak A, Janiszewski A, Pasławski R, Pasławska U (2018) Effect of xylazine, medetomidine and dexmedetomidine on cardiac conduction in pigs. Med Weter 74 (3): 187–192. https://doi.org/10.21521/mw.6057
Gyires K, Zádori ZS, Török T, Mátyus P (2009) Alpha(2)-adrenoceptor subtypes-mediated physiological, pharmacological actions. Neurochem Int 55 (7): 447–453. https://doi.org/10.1016/j.neuint.2009.05.014
Maltsev AV, Kokoz YuM, Evdokimovskii EV, Pimenov OY, Reyes S, Alekseev AE (2014) Alpha-2 adrenoceptors and imidazoline receptors in cardiomyocytes mediate counterbalancing effect of agmatine on NO synthesis and intracellular calcium handling. J Mol Cell Cardiol 68: 66–74.
Berg T, Jensen J (2013) Tyramine reveals failing alpha2-adrenoceptor control of catecholamine release and total peripheral vascular resistance in hypertensive rats. Front Neurol 4: 19.
Dudek M, Knutelska J, Bednarski M, Nowiński L, Zygmunt M, Mordyl B, Głuch-Lutwin M, Kazek G, Sapa J, Pytka K (2015) A comparisonof the anorectic effect and safety of the alpha2-adrenoceptor ligands guanfacine and yohimbine in rats with diet-induced obesity. Plos One 10: 1327–1371.
Knaus AE, Muthing V, Schickinger S, Moura E, Beetz N, Gilsbach R, Hein L (2007) Alpha (2)-adrenoceptor subtypes-unexpected functions for receptors and ligands derivated from gene-targeted mouse models. Neurochem Internat 51: 277–281.
Зефиров ТЛ, Хисамиева ЛИ, Зиятдинова НИ, Зефиров АЛ (2015) Особенности селективной блокады подтипов α2-адренорецепторов на хронотропию сердца новорожденных крысят. Бюл эксп биол мед 160 (7): 10–12. [Zefirov TL, Khisamieva LI, Ziyatdinova NI, Zefirov AL (2015) Peculiar effects of selective blockade of α2-adrenoceptor subtypes on cardiac chronotropy in newborn rats. Bull Exp Biol Med 160 (1): 6–8. (In Russ)].
Коротаева ЮВ, Циркин ВИ (2015) Альфа2-адренорецепторы миокарда (обзор литературы). Известия Коми НЦ УрО РАН 2 (22): 57–64. [Korotaeva YuV, Tsirkin VI (2015) Alpha 2-adrenoreceptors of the myocardium (literature review). Izvestiya Komi NC UrO RAS. 2 (22): 57–64. (In Russ)].
Асташкин ЕИ, Глезер МГ (2007) Пейсмекерные f-каналы миоцитов синусового узла, как новая терапевтическая мишень для снижения частоты сердечных сокращений. Кардиоваскуляр тер профилакт а 6 (8): 106–115. [Astashkin EI, Glezer MG (2007) Pace-maker f-channels of sinus node myocytеs as a new therapeutic target for heart rate reduction. Cardiovascular Therap Prevention 6 (8): 106–115. (In Russ)].
Глухов АВ, Егоров ЮВ, Розенштраух ЛВ Электрофизиологические механизмы устойчивости ритма сердца гибернирующих млекопитающих во время гипотермии. Успехи физиол наук 45 (1): 3–26. [Glu-khov AV, Egorov YuV, Rosenshtraukh LV (2014) Electrophysiological Mechanisms of Natural Resistance of the Hibernator Heart to Hypothermic Ventricular Fibrillation. Success physiol sci 45 (1): 3–26. (In Russ)].
Poelzing S, Akar FG, Baron E, Rosenbaum DS (2004) Heterogeneous connexin43 expression produces electrophysiological heterogeneities across ventricular wall. Am J Physiol Heart Circ Physiol 286: 2001–2009.
Покровский ВМ (2006) Интеграция уровней сердечного ритма: генератор ритма сердца в мозге Бюллетень сиб мед 5 (1): 26–31. [Pokrovsky VM (2006) Integration of cardiac rhythmogenesis levels: cardiac rhythm generator in the brain. Bull Siberian Med 5 (1): 26–31. (In Russ)]. https://doi.org/10.20538/1682-0363-2006-1-26-31
Бурсиан АВ (2014) Катехоламиновая регуляция авторитмической висцеро и соматомоторной активности в раннем онтогенезе крыс. Журн эвол биохим физиол 50 (1): 3–11. [Bursian AV (2014) Catecholaminergic regulation of autorhythmical viscero- and somatomotor activity in early rat ontogenesis. Zh Evol Biokhim Fiziol 50 (1): 3–11 (In Russ)].
Шальдах М (1992) Электрокардиотерапия (Технические аспекты электрокардиостимуляции). Санкт Петербург. [Schaldach M (1992) Electrocardiotherapy (Technical aspects of electrocardiostimulation). Saint Petersburg. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


