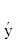Цитология, 2023, T. 65, № 2, стр. 146-156
Активность металлопротеиназ в двух линиях мезенхимных стволовых клеток плаценты от одного донора, различающихся адипогенным дифференцировочным потенциалом и характером репликативного старения
И. В. Воронкина 1, *, Л. В. Смагина 1, А. М. Кольцова 2, А. С. Мусорина 2, Г. Г. Полянская 2, **
1 Институт экспериментальной медицины
197022 Санкт-Петербург, Россия
2 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: voronirina@list.ru
** E-mail: gpolanskaya@gmail.com
Поступила в редакцию 15.09.2022
После доработки 14.10.2022
Принята к публикации 18.10.2022
- EDN: NFBOSD
- DOI: 10.31857/S0041377123020128
Аннотация
Проведено длительное культивирование 2-х линий МСК человека, выделенных из разных мест плаценты. Клеточная линия MSC-PL-1 характеризуется преждевременным старением по сравнению с линией MSC-PL-2. При индукции адипогенной дифференцировки в клетках обеих линиях оказалось, что она не происходит на ранних и поздних пассажах в клетках MSC-PL-1 в отличие от клеток линии MSC-PL-2. Сравнительный анализ активностей матриксных металлопротеиназ (ММП) 1, 2 и 9 в процессе репликативного старения (РС) этих линий свидетельствует о межлинейных различиях. Так, в линии MSC-PL-2 происходит снижение уровней активности ММП-2 и -1 в процессе РС и не изменяется уровень активности ММП-9, а в линии MSC-PL-1, имеющей преждевременное РС, наблюдается увеличение уровня активности ММП-9 и -1 и снижение уровня активности ММП-2. Анализ активностей ММП-1 и -2 в процессе адипогенной дифференцировки в клетках MSC-PL-2 на раннем 6-м пассаже показал ряд различий между ними в течение 21 сут, но изменения обеих ММП носят волнообразный характер. Активность ММП-9 в течение 21 сут дифференцировки изменяется иначе. На позднем 16-м пассаже характер изменений активности всех 3-х ММП в течение 21 сут дифференцировки одинаковый. В связи с отсутствием адипогенной дифференцировки в клетках MSC-PL-1, проведен анализ активностей ММП -1, -2 и -9 при культивировании в индукционной среде в течение 21 сут на раннем (6) и позднем (13) пассажах. В обоих вариантах имеет место изменения активности 3-х ММП в процессе культивирования в индукционной среде, но эти изменения носят несинхронный характер. Активности всех 3-х ММП на 13-м пассаже снижаются относительно пассажа 6. В целом, полученные результаты свидетельствуют об участии ММП в широком диапазоне процессов в МСК.
Мезенхимные стволовые клетки человека (МСК) широко используются для фундаментальных и прикладных биомедицинских исследований. Линии МСК человека, будучи неиммортализованными диплоидными клеточными популяциями, являются удобной моделью для изучения биологических процессов, как в здоровом организме, так и при его патологических состояниях. В настоящее время наблюдается значительное расширение биомедицинских исследований с использованием МСК человека разного происхождения в связи с их регенеративными способностями. (Adak et al., 2021; Albu et al., 2021; Eiro et al., 2021; Mannino et al., 2021; Moghadasi et al., 2021; Raposo et al., 2021; Reed, Escayg, 2021; Safary et al., 2021; Vilaca-Faria et al., 2021; Wangler et al., 2021; Xiao et al., 2021; Zhang et al., 2021).
Согласно требованиям Международного общества клеточной терапии, статус МСК разного происхождения определяется рядом характеристик (Dominici et al., 2006; Sensebé et al., 2010). Тем не менее, линии МСК, выделенные из разных источников, различаются по ряду характеристик, важнейших для жизнедеятельности клеток. В частности, обнаружены межлинейные различия по ростовым характеристикам, по дифференцировочному потенциалу, по кариотипической нестабильности и по характеру репликативного старения (РС) (Тепляшин и др., 2005; Stanko et al., 2014; Воронкина и др., 2016, 2020; Полянская, 2018; Li et al., 2018; Jin et. al., 2019; Кольцова и др., 2020; Akpinar et al., 2021; Chen et al., 2021; Semenova et al., 2021; Shin et al., 2021; Sun et al., 2021; Tai et al., 2021; Yigitbilek et al., 2021). Сравнительное изучение характеристик МСК человека, определяющих статус МСК, а также других характеристик, ответственных за важнейшие клеточные процессы, необходимо как для понимания механизмов биологических процессов в клетке, так и для расширения возможностей использования МСК в регенеративной медицине. Такие исследования важны в связи с особенностями взаимодействия клеток с их уникальным микроокружением, характерным для конкретной ткани, которое регулирует пролиферацию, выживаемость, миграцию, старение, дифференцировочный потенциал и другие клеточные процессы, посредством межклеточных взаимодействий и различных биоактивных молекул. Причинами наблюдаемых межлинейных различий могут быть как генетические, так и эпигенетические факторы (Cox et al., 1972; Hooper, Subak-Sharpe, 1981; Шаровская и др., 2009; Gattazo et al, 2014; Choi et al., 2015; Нимирицкий и др., 2018; Darnell et al., 2018; Niedernhofer et al., 2018).
Одним из направлений, исследующих функциональные особенности МСК, является выяснение роли матриксных металлопротеиназ (ММП) в процессах их дифференцировки и РС. Известно, что клетки в условиях in vivo и in vitro контактируют с сетью макромолекул, образующих внеклеточный матрикс (ВКМ), который состоит из разных белков, синтезируемых самими клетками. ВКМ является одним из важнейших регуляторов клеточных процессов и представляет собой микроокружение или нишу, в которой клетки существуют. Регуляция клеточных процессов осуществляется через взаимодействие ММП с белками ВКМ. ММП представляют семейство Ca- и Zn- зависимых эндопептидаз, которые регулируют активность многих биологических молекул, расщепляя или блокируя их. ММП и их специфические ингибиторы влияют на клеточные процессы, в частности пролиферацию, апоптоз, дифференцировку, РС. Они участвуют в процессах ремоделирования тканей и развития органов, специфически модулируя сигнальные пути, посредством взаимодействия c субстратами разной природы, включая перестройки ВКМ (Nagase, Woessner, 1999; Page-McCaw et al., 2007; Kessenbrock et al., 2010). ММП синтезируются разными клетками – нормальными фибробластами, кератиноцитами, фагоцитами, лимфоцитами, а также трансформированными.
В настоящее время идет накопление экспериментальных данных по анализу участия разных ММП в регуляции дифференцировок и РС МСК человека (Mannello et al., 2006; Schneider et al., 2010; Sillat et al., 2012; Lynch, Pei, 2014; Gutierrez-Fernandez et al., 2015; Almalki, Agrawal, 2016; Noh et al., 2017). В связи с этим несколько лет назад нами начаты подробные сравнительные исследования роли таких ММП, как ММП-1 (интерстициальная коллагеназа-1), ММП-2 (желатиназа А) и ММП-9 (желатиназа Б) в процессах РС и дифференцировки МСК человека разного происхождения. Показано наличие активностей этих ММП в процессе адипогенной и остеогенной дифференцировки в линиях МСК, выделенных из костного мозга (FetMSC), зачатка конечности (М-FetMSC) раннего эмбриона человека и полученных из них клеточных сфероидов. Сравнительный анализ динамики активностей этих металлопротеиназ в процессе адипогенной и остеогенной дифференцировок показал межлинейные различия, а также различия между монослойными культурами (2D) и клеточными сфероидами (3D) (Воронкина и др., 2016).
С целью изучения механизмов дифференцировки МСК проведено изучение динамики активностей ММП -1, -2, -8, -9, -13, а также анализ экспрессии маркеров хондрогенеза (коллагена 2 и аггрекана) и некоторых компонентов ВКМ (декорина, версикана, коллагена I) в процессе хондрогенной дифференцировки клеток линии MSCWJ-1, выделенных из Вартонова студня пупочного канатика в условиях 2D и 3D. В клеточных сфероидах (3D) процесс хондрогенеза более активен, чем в монослойной культуре (2D) (Воронкина и др., 2018).
Проведено сравнительное изучение динамики активности ММП и ВКМ в процессе РС 3-х линий МСК человека, выделенных из Вартонова студня пупочного канатика (MSCWJ-1), кожи век взрослого донора (DF-2), и из эпикардиальной жировой ткани (ADH-MSC), полученной от нездорового донора при аортокоронарном шунтировании (Воронкина и др., 2020). Полученные результаты свидетельствуют как о различиях между линиями по активности одной ММП, так и о различиях в одной линии разных ММП, а также о различиях по характеру изменений содержания коллагена 1 и фибронектина. Надо подчеркнуть, что все полученные нами результаты свидетельствуют в пользу роли микроокружения в наблюдаемых различиях. Косвенным подтверждением этого предположения могут быть результаты, полученные на клетках ADH-MSC. Важно отметить, что клетки ADH-MSC существенно отличались от двух других линий по цитогенетическим характеристикам, скорости старения, содержанию белков ВКМ и по активностям ММП (Мусорина и др., 2019). Возможно, что причиной такого расхождения является получение клеток от донора с заболеванием сердца, клетки которого имели не просто другое микроокружение в связи с иной их локализацией, но еще и нездоровое, связанное с больным органом, в котором они находились до перевода в состояние in vitro.
В связи с описанными результатами, необходимо было сравнить активности ММП параллельно в процессах РС и адипогенной дифференцировки в клетках линий МСК, выделенных из одной ткани, но имеющих разную локализацию. Такие линии можно получить из внезародышевого органа – плаценты. Известно, что плацента человека имеет сложный клеточный состав. В связи с этим при получении конкретной линии необходимо четко определить область происхождения и метод выделения клеток из этой ткани (Parolini et al., 2008). Возможно, что разные области плаценты имеют физиологические особенности.
Таким образом, учитывая влияние конкретной ниши на характеристики МСК, в настоящей работе были исследованы 2 клеточные линии, выделенные из 2-х областей плаценты: из области, расположенной рядом с пупочным канатиком (линия MSC-PL-1), и из области, удаленной от него (MSC-PL-2). Линии были выделены ранее, а их характеристика свидетельствует о наличии различий между ними (Кольцова и др., 2020).
В настоящей работе стояли следующие задачи: 1) длительное культивирование клеток линий MSC-PL-1 и MSC-PL-2; 2) сравнительный нализ активности фермента β-галактозидазы, характеризующей процесс РС при длительном культивировании клеток; 3) индукция и анализ адипогенной дифференцировки клеток обеих линий при длительном культивировании; 4) анализ активностей ММП-1, -2 и -9 при адипогенной дифференцировке клеток обеих линий на раннем и поздних пассажах.
МАТЕРИАЛ И МЕТОДИКА
Клетки. В работе использовали две линии МСК человека, полученных из 2-х областей плаценты: из области, расположенной в непосредственной близости к пупочному канатику (MSC-PL-1) и из области, удаленной от него (MSC-PL-2). Оба фрагмента содержали ткани из хориона и амниотической мембраны. Обе клеточные линии получены и охарактеризованы в ЦКП “Коллекция культур клеток позвоночных” ИНЦ РАН (Санкт-Петербург). Клетки исследуемых линий культивировали в ростовой среде, содержащей 90% среды DMEM/F12 (Биолот, Россия) и 10% эмбриональной бычьей сыворотки (FBS) (Hyclone, США). Обе линии культивировали в условиях 5% СО2 при 37°С и влажности 90%. Микробиологический анализ подтвердил отсутствие бактериальной, грибковой и микоплазменной контаминации в полученных линиях.
Морфологический анализ клеток проводили с помощью инвертированного микроскопа NICON (Япония).
Оценка РС клеток. РС оценивали по активности фермента β-галактозидазы. Клетки исследуемых линий (по 30 тыс.) высевали на чашки Петри 3.5 мм (Nunc, Дания) и культивировали в течение 1 сут. Затем среду удаляли и окрашивали клетки с помощью набора реактивов Senescence β-galactosidase staining kit, согласно инструкции (Cell Signaling, США). У клеток, вступающих в фазу РС, цитоплазма имеет ярко-синюю окраску. Анализ клеток MSC-PL-1 проводили с помощью инвертированного микроскопа (NICON, Япония) на пассажах 6 и 13, а клеток MSC-PL-2 – на пассажах 6 и 18. Долю окрашенных клеток в процентах определяли путем подсчета не менее 1000 клеток в разных полях зрения на одну временную точку.
Индукция адипогенной дифференцировки. Использовали модифицированный метод (Reyes et al., 2001). Клетки (10000 кл./см2) высевали в адипогенную дифференцировочную среду (HyClone Thermo Scientific HyClone Product, США). Для идентификации адипогенной дифференцировки клетки промывали PBS без ионов Ca2+ и Mg2+, фиксировали в метаноле в течение 2 мин при –20°С. Фиксированные клетки промывали 50%-ным этанолом и окрашивали масляным красным (Oil Red O) в течение 10 мин. Далее клетки промывали 50%-ным этанолом, затем дистиллированной водой и заливали 70%-ным глицерином. Индукцию проводили в течение 21 сут, меняя среду каждые 3–4 сут. Визуализацию проводили с помощью микроскопа Zeiss LSM 5 Pascal (Германия).
Зимография. Активность ММП в кондиционированной клетками среде определяли методом зимографии на желатине и казеине. Пробы среды брали на 1- (6 ч), 7-, 14- и 21-е сут культивирования и готовили для анализа, смешивая образцы среды с буфером для проб (Laemmli, 1970) без бета-меркаптоэтанола и нагревания, инкубируя при комнатной температуре в течение 30 мин. Количество белка в пробах определяли по Брэдфорд (Bradford, 1976). Гель для проведения электрофореза содержал 1 мг/мл желатина (для ММП-2 и ММП-9) или 0.5 мг/мл казеина (для ММП-1). Пробы наносили на 10%-ный полиакриламидный гель (ПААГ) в количестве, соответствующем 10 мкг белка на дорожку и разделяли с помощью электрофореза. После проведения электрофореза гель двукратно промывали в течение 15 мин в 2.5%-ном растворе Тритона Х-100 и инкубировали в течение 12 ч (для желатина) или 18 ч (для казеина) в буферном растворе (50 мМ Tris-HCl, 150 мМ NaCl, 5 мМ CaCl2, pH 7.4). Гель окрашивали Coomassie Brilliant Blue. Присутствие ММП, расщепляющих желатин, определяли по наличию неокрашенных полос на геле (Oliver et al., 1999). Для проведения количественного анализа содержания ММП-2 и ММП-9 гели сканировали, полученные изображения обрабатывали с помощью программы QuantiScan Version 2.1. Активность выражали в усл. ед., принятых в программе QuantiScan (произведение количества неокрашенных пикселов на интенсивность окраски). Все реактивы были от Sigma (Германия). Все эксперименты проводили на одном и том же пуле сыворотки. Значения активностей указанных ММП для образцов сред, кондиционированной клетками, получали путем вычитания значений активности ММП, полученных для чистой среды культивирования, содержащей сыворотку.
Статистический анализ. Использовали t-критерий Стьюдента. Различия считали достоверными при вероятности нулевой гипотезы P < 0.05. В каждом варианте проводили 3 независимых эксперимента.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Морфологический анализ. Морфологический анализ клеток линий MSC-PL-1 (13 пассажей) и MSC-PL-2 (16 пассажей) в процессе длительного культивирования показал однородность клеточных популяций, состоящих из вытянутых фибробластоподобных клеток, средних по размеру на 6-м пассаже (рис. 1а, в). На пассажах 13 и 16 размеры клеток и их распластанность увеличивались (рис. 1б, г).
Рис. 1.
Прижизненные фотографии клеток линий MSC-PL-1 и MSC-PL-2 на раннем (6) и позднем (13 или 16) пассажах. Инвертированный световой микроскоп Nicon Eclipse TS100, Япония. Масштабная линейка: 200 мкм.
Процесс РС клеточных линий. Результаты анализа активности фермента β-галактозидазы при длительном культивировании линий MSC-PL-1 и MSC-PL-2 представлены в табл. 1, из которой следует, что в обеих линиях наблюдается активное РС, и доля стареющих клеток увеличивается. Так, в клетках MSC-PL-1 к 13 пассажу доля стареющих клеток увеличена почти в 5.5 раза, тогда как в клетках MSC-PL-2 число таких клеток только к 18 пассажу увеличено в 4.2 раза. Наблюдаемые межлинейные различия характера РС могут быть связаны с разной изначальной локализацией выделенных клеток в ткани плаценты, т.е. с их разным микроокружением (Parolini et al., 2008). Эти результаты совпадают с ранее проведенными исследованиями, в которых еще дополнительно показаны существенные межлинейные различия по изменению пролиферативной активности в процессе РС (Кольцова и др. 2020).
Таблица 1.
Доля клеток линий MSC-PL1 и MSC-PL2 с выраженной активностью β-галактозидазы (β-гал) в процессе культивирования
| Пассаж | MSC-PL-1 | MSC-PL-2 | ||
|---|---|---|---|---|
| число клеток | доля окрашенных клеток, % | число клеток | доля окрашенных клеток, % | |
| 6 | 1609 | 7.60 ± 0.82 | 1607 | 12.20 ± 0.82 |
| 13 | 1635 | 40.00 ± 1.21 | – | |
| 18 | − | − | 1603 | 51.80 ± 1.30 |
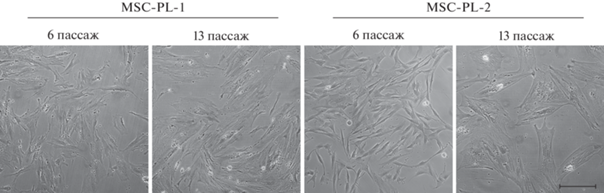
Анализ адипогенной дифференцировки. Результаты адипогенной дифференцировки в клетках MSC-PL-1 и MSC-PL-2 представлены на рис. 2. Культивирование клеток в адипогенной среде способствовало образованию кластеров адипоцитов, показанных с помощью окрашивания красителем масляным красным.
Рис. 2.
Дифференцировка клеток линий MSC-PL-1 и MSC-PL-2 в адипогенном направлении на раннем (6) и позднем (13 или 16) пассажах при длительном культивировании. Показано окрашивание жировых включений масляным красным (адипогенез). Можно видеть, что у клеток MSC-PL-1 дифференцировки не происходит, в отличие от клеток MSC-PL-2. Масштабная линейка: 100 мкм.
Различия между линиями при индукции адипогенной дифференцировки выражаются в том, что в клетках линии MSC-PL-1 эта дифференцировка так и не происходит как на 6-м, так и на 13 пассажах; тогда как в линии MSC-PL-2 она присутствует и на 6-м и на 16 пассажах. Надо заметить, что в предыдущем сравнительном исследовании в клетках MSC-PL-1 на раннем пассаже адипогенная дифференцировка происходила, но отсутствовала на позднем пассаже (Кольцова и др., 2020). Клетки для анализа в обоих случаях были взяты из одной криозакладки, т.е. изначально из одной популяции. По-видимому, в процессе декриоконсервации и культивирования до 6-го пассажа в клетках возник ряд неконтролируемых изменений, повлекших изменение в дифференцировочном процессе.
В связи с полученными результатами необходимо отметить, что в настоящее время накапливаются данные о значительных колебаниях уровня потенциала трех стандартных направлений дифференцировки МСК человека. Так, показаны существенные колебания, вплоть до отсутствия конкретной дифференцировки, при изменении условий культивирования, в случаях разного возраста доноров и разных источников выделения МСК, а также в процессе РС. Причем причиной колебаний дифференцировочного потенциала могут быть изменения, происходящие как на уровне транскрипции определенных генов, так и на уровне трансляции (Park et al., 2005; Bonab et al., 2006; Zhang et al., 2006; Lo Surdo et al., 2013; Крылова и др., 2015; Bianchi et al., 2017; Кольцова и др., 2018, 2019; Monterubbianesi et al., 2019).
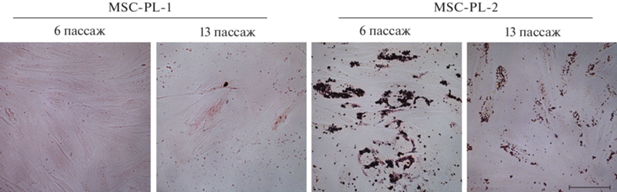
Динамика активности ММП в процессе РС клеточных линий. Результаты анализа активности ММП-1, -2 и -9 в клетках MSC-PL-1 представлены на рис. 3а. Показано, что в процессе РС происходит увеличение (P < 0.01) активности ММП-1 и -9 и снижение активности ММП-2 (P < 0.01). Анализ активности ММП в клетках MSC-PL-2 показал снижение активности ММП-1 и -2 (P < 0.05) и отсутствие изменений активности ММП-9 в процессе РС (рис. 3б).
Рис. 3.
Динамика активности ММП при репликативном старении клеток MSC-PL-1 (а) и MSC-PL-2 (б) на раннем пассаже (6-ом, светлые столбцы) и позднем пассаже (13- или 16-ом, темные столбцы) при длительном культивировании. Активность указана в усл. ед., принятых в программе QuantiScan. Представлены средние значения и стандартная ошибка среднего. Отличия 6 пассажа от 13 пассажа достоверны при *** p < 0.01; ** p < 0.05
Таким образом, наблюдаются межлинейные различия между активностями исследованных ММП. Так, в клетках линии MSC-PL-2 активность ММП-1 и -2 в процессе РС снижается, а активность ММП-9 не изменяется. В клетках линии MSC-PL-1, претерпевающих преждевременное РС, наоборот, активность ММП-1 и -9 увеличивается, а активность ММП-2 снижается.
В предыдущей работе (Воронкина и др., 2020) в линиях МСК – MSCWJ и DF-2, полученных от здоровых доноров, наблюдали низкую активность ММП-9 без изменений, а в клетках линии ADH-MSC, полученную от нездорового донора из нездорового органа, в процессе РС активность ММП-9 была значительной. Таким образом, наблюдается сходство в активности ММП-9 между двумя аномальными линиями, имеющими преждевременное РС и цитогенетические изменения на позднем пассаже (Мусорина и др., 2019; Воронкина и др., 2020; Кольцова и др., 2020). Возможно, что активность ММП-9 связана со стрессовой ситуацией в клеточных культурах, включая микроокружение клеток. В частности, известно, что ММП-9 участвует в патологических процессах в миокарде и является маркером сердечной недостаточности (Felkin et al., 2006; Yabluchanskiy et al., 2013).
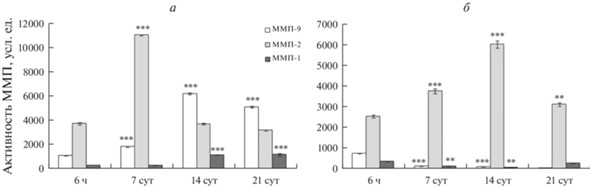
Динамика активности ММП при адипогенной дифференцировке. В данном случае окончательный результат адипогенной дифференцировки свидетельствует, что в клетках MSC-PL-1 адипогенная дифференцировка отсутствует как на 6-, так и на 13-м пассажах. Эти данные отличаются от результатов, полученных нами ранее (Кольцова и др. 2020). Комментарии по этому вопросу даны выше. В связи с этим, в настоящей работе авторы проводят сравнительный анализ активностей ММП-1, -2 и -9 в процессе адипогенной дифференцировки на 6-м и 16-м пассажах для линии MSC-PL-2. Результаты показаны на рис. 4. В процессе дифференцировки на 6-м пассаже активность ММП-9 увеличивается в течение 14 сут (P < 0.01) и далее к 21-м сут снижается (P < 0.01). Активность ММП-2 имеет волнообразный характер: в период от 6-ти ч до 7 сут увеличивается, снижается к 14 сут, а затем снова увеличивается (P < 0.01). Активность ММП-1 ведет себя так же: увеличивается к 7 сут, снижается к 14 сут и далее увеличивается к 21 сут (P < 0.01) (рис. 4а–в). Таким образом, изменения активности ММП-1 и -2 в процессе дифференцировки сходны, а изменение активности ММП-9 имеет иной характер.
Рис. 4.
Динамика активности ММП при нормальной дифференцировке клеток линии MSC-PL-2, взятых на раннем (6) и позднем (16) пассаже, в адипогенном направлении при длительном культивировании. ММП-9 (а), ММП-2 (б) и ММП-1 (в). Активность указана в усл. ед., принятых в программе QuantiScan. По горизонтали – время культивирования. Представлены средние значения и стандартная ошибка среднего. Отличия от 1 сут достоверны при ***P < 0.01 и **P < 0.05.
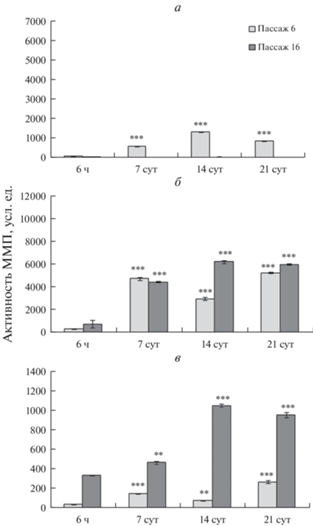
В клетках MSC-PL-2 на 16-м пассаже увеличивается уровень активности ММП-9 в течение 14 сут (P < 0.01), затем снижается к 21 сут (P < 0.01). Активность ММП-2 увеличивается в течение 14 сут (P < < 0.01), а затем незначительно снижается к 21 сут. Активность ММП-1 увеличивается в течение 14 сут (P < 0.01), а затем незначительно снижается к 21 сут (P < 0.05) (рис. 4а, б, в). Таким образом, изменения активности 3-х ММП в течение дифференцировки на 16-м пассаже имеют сходный характер.
В литературе есть данные, также свидетельствующие об участии ММП -1, -2 и -9 в адипогенной дифференцировке (например: Bouloumié et al., 2001; Chavey et al., 2003; Воронкина и др., 2016).
Динамика активности ММП при культивировании в адипогенной индукционной среде (в отсутствие адипогенеза). Несмотря на отсутствие адипогенной дифференцировки в линии MSC-PL-1, было проведено исследование активности ММП при культивировании клеток в течение 21 сут в индукционной среде. По мнению авторов, полученные результаты могут отражать влияние других процессов, в частности, условия жизнедеятельности клеток в связи с заменой стандартной ростовой среды на индукционную (дифференцировочную), в процессе культивирования на которой происходят морфологические изменения, обусловленные деградацией клеточного монослоя к 21-м сут культивирования.
Данные по активности ММП в клетках линии MSC-PL-1 представлены на рис. 5. Показано, что на пассаже 6 изменения активности ММП-9 имеют волнообразный характер: в течение 14 сут наблюдается достоверное увеличение активности (P < 0.01), а далее до 21 сут имеет место достоверное снижение (P < 0.01). ММП-2 также волнообразно изменяет активность, но отлично от ММП-9: в период 6 ч–7 сут она увеличивается, после 7 сут не изменяется, а на 21 сут снижается (P < 0.01). Активность ММП-1 не меняется на протяжении дифференцировки в течение 14 сут, а затем на 21 сут увеличивается (P < 0.01) (рис. 5а). Таким образом, изменения активности ММП-1, 2 и 9 носят несинхронный характер.
Рис. 5.
Динамика активности ММП клеток MSC-PL-1, взятых на раннем (6-ой, а) и позднем (13-ый, б) пассаже, и находящихся в адипогенной дифференцировочной среде, при длительном культивировании. Другие объяснение те же, что и в подписи к рис. 4.
Для этой же линии – MSC-PL-1 на 13-м пассаже активность ММП-9 достоверно снижается на протяжении 21 сут (P < 0.01); активность ММП-2 увеличивается в течение 14 сут (P < 0.01) и затем снижается на 21 сут (P < 0.01); активность ММП-1 снижается в течение 14 сут и затем увеличивается на 21 сут (P < 0.01) (рис. 5б). Таким образом, на 13-м пассаже, также как и на 6-м, наблюдаются изменения активностей всех ММП, которые носят несинхронный характер. При сравнении активностей 3-х ММП между 6-м и 13-м пассажами при культивировании в дифференцировочной среде, в клетках MSC-PL-1 в целом наблюдается значимое снижение активностей всех 3-х ММП на 13-м пассаже по сравнению с 6-м пассажем. Этот результат вполне логичен, если учесть данные морфологического анализа о частичной деградации клеточного монослоя, связанного, по-видимому, с нарушением взаимодействия клеток с ВКМ на начальном этапе клеточной гибели.
Ранее был проведен анализ характеристик полученных линий при длительном культивировании, свидетельствующий о различиях по характеру РС, и по ростовым характеристикам (Кольцова и др., 2020). Кариотипический анализ показал, что на раннем пассаже обе линии имеют нормальный диплоидный кариотип с незначительным количеством неклональных хромосомных перестроек. На позднем 15-м пассаже клетки линии MSC-PL-2 также сохраняют нормальный кариотип. При культивировании линии MSC-PL-1 до пассажа 14 обнаружены, помимо неклональных перестроек, клональные, одна из которых –Х, add(X)(p22.3) – является характерной чертой клеток линии MSC-PL-1 при РС (Кольцова и др., 2020). Полученные в настоящей работе результаты по разному изменению активностей 3-х ММП в этих линиях МСК в процессе РС расширяют полученные ранее данные о межлинейных различиях МСК.
В исследованиях клеток MSC-PL-1 и MSC-PL-2, наблюдаемые различия, по-видимому, связаны с физиологическими особенностями (например, кровообращение) той области органа (плаценты), из которой были выделены МСК. Надо подчеркнуть, что обе области не имели существенных различий по составу: обе содержали ткани из хориона и амниотической мембраны и имели зародышевое происхождение. Анализ ДНК профиля (STR) подтвердил однородность (сходство) обеих линий по STR профилю.
В целом, полученные результаты свидетельствуют об участии ММП в широком диапазоне клеточных процессов. Наблюдаемая динамика активности ММП-9 и -2 безусловно связана с взаимодействием клеток и индукционной среды, в которой изначально присутствует сыворотка, содержащая эти ММП. Поэтому из наших результатов нельзя сделать однозначный вывод о присутствии и функционировании именно клеточных ММП-2 и -9. Но можно констатировать, что эти ММП, независимо от их происхождения, необходимы для процессов дифференцировки МСК. Из результатов по ММП-1 можно уверенно утверждать, что именно клеточная ММП-1 сопровождает процесс дифференцировки МСК, т.к. в индукционной среде она практически отсутствует.
Список литературы
Воронкина И.В., Смагина Л.В., Бильдюг Н.Б., Мусорина А.С., Полянская Г.Г. 2020. Динамика активности матриксных металлопротеиназ и содержание белков внеклеточного матрикса в процессе репликативного старения линий мезенхимных стволовых клеток человека. Цитология. Т. 62. № 3. С. 210. (Voronkina I.V., Smagina L.V., Bildyug N.B., Musorina A.S., Poljanskaya G.G. 2020. Dynamics of matrix metalloproteinase activity and extracellular matrix proteins content in the process of replicative senescence of human mesenchymal stem cells. Cell Tis. Biol. V. 14. P. 349.)https://doi.org/10.31857/S0041377120030086
Воронкина И.В., Смагина Л.В., Гин И.И., Крылова Т.А., Мусорина А.С., Полянская Г.Г. 2018. Анализ динамики активности матриксных металлопротеиназ в процессе хондрогенной дифференцировки линии мезенхимных стволовых клеток, выделенных из Вартонова студня пупочного канатика человека. Цитология. Т. 60. № 9. С. 725. (Voronkina I.V., Smagina L.V., Gin I.I., Krylova T.A., Musorina A.S., Poljanskaya G.G. 2018. Analysis of matrix metalloproteinases activity dynamics during chondrogenic differentiation process of mesenchymal stem cell line derived from Wharton’s jelly of human umbilical cord. Tsitologiya. V. 60. № 9. P. 725.) https://doi.org/10.7868/S0041377118090084
Воронкина И.В., Смагина Л.В., Крылова Т.А., Мусорина А.С., Полянская Г.Г. 2016. Сравнительный анализ динамики активности матриксных металлопротеиназ в процессе дифференцировки мезенхимных стволовых клеток человека, выделенных из разных тканей одного донора. Цитология. Т. 58. № 11. С. 865. (Voronkina I.V., Smagina L.V., Krylova T.A., Musorina A.S., Poljanskaya G.G. 2017. Analysis of matrix metalloproteinase activity during differentiation of mesenchymal stem cells isolated from different tissues of one donor. Cell Tiss. Biol. V. 11. P. 95.)https://doi.org/10.1134/S1990519X17020092
Кольцова А.М., Зенин В.В., Петросян М.А., Турилова В.И., Яковлева Т.К., Полянская Г.Г. 2020. Получение и характеристика линий мезенхимных стволовых клеток, выделенных из разных областей плаценты одного донора. Цитология. Т. 62. № 9. С. 713. (Koltsova A.M., Zenin V.V., Petrosyan M.A., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2021. Isolation and characterization of Mesenchymal Stem Cell Line Derived from different regions of the placenta of the same donor. Cell Tiss. Biol. V. 15. P. 356.) https://doi.org/10.31857/S0041377120090035
Мусорина А.С., Зенин В. В., Турилова В. И., Яковлева Т. К., Полянская Г. Г. 2019. Характеристика неиммортализованной линии мезенхимных стволовых клеток, выделенных из эпикардиальной жировой ткани человека. Цитология. Т. 61. № 4. С. 272. (Musorina A.S., Zenin V.V., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2019. Х Characterization of a nonimmortalized mesenchymal stem cell line isolated from human epicardial adipose tissue. Cell Tiss. Biol. V. 13. P. 247.)https://doi.org/10.1134/S0041377119040047
Нимирицкий П.П., Сагарадзе Г.Д., Ефименко А.Ю., Макаревич П.И., Ткачук В.А. 2018. Ниша стволовой клетки. Цитология. 60. № 8. P. 575. https://doi.org/10.31116/tsitol.2018.08.01 (Nimiritsky P.P., Sagaradze G.D., Efimenko A.Yu., Makarevich P.I., Tkachuk V.A. 2018. The stem cell niche. Tsitologiya. V. 60. P. 955).
Полянская Г.Г. 2008. Типы клеточных культур. Образование, основные характеристики и изменчивость клеточных линий. В кн.: Методы культивирования клеток. Санкт-Петербург: Изд-во Политехнического университета. С. 22. (Poljanskaya G.G. 2008. Types of cell cultures. Formation, main characteristics and variability of cell lines. In: Methods of cell cultivation. St. Petersburg: Publishing house of the Polytechnic University. P. 22.)
Полянская Г.Г. 2018. Сравнительный анализ характеристик линий мезенхимных стволовых клеток человека, полученных в коллекции культур клеток позвоночных (обзор). Сб. “Клеточные культуры”, ISSN 2077-6055. Санкт-Петербург. Изд-во Политехнического ун-та, вып. 34. С. 3. (Poljanskaya G.G. 2018. Comparative analysis of the lines of human mesenchymal stem cells derived in the collection of cell cultures of vertebrates (review). Collection “Cell cultures”, ISSN 2077-6055. St. Petersburg: Polytechnic University Publishing house. № 34. P. 3.
Тепляшин А.С., Чупикова Н.И., Коржикова С.В., Шарифуллина С.З., Ростовская М.С., Топчиашвили З.А., Савченкова И.П. 2005. Сравнительный анализ двух клеточных популяций с фенотипом, подобным мезенхимным стволовым клеткам, выделенных их разных участков подкожно-жировой клетчатки. Цитология. Т. 47 № 7. Р. 637−643. (Teplyashin A.S., Chupikova N.I., Korzhikova S.V., Sharifullina S.Z., Rostovskaya M.S., Topchiashvili Z.A., Savchenkova I.P. 2005. Comparative analysis of two cell populations with a phenotype similar to mesenchymal stem cells isolated from different areas of subcutaneous fat. Tsitologiya. V. 47. № 7. P. 637−643).
Шаровская Ю.Ю., Лагарькова М.А., Киселев С.Л., Чайлахян Л.М. 2009. Исследование диффузионной связи через щелевые контакты в эмбриональных стволовых клетках человека в процессе спонтанной дифференцировки. Доклады Академии наук. Т. 427. № 3. С. 387. (Sharovskaya Y.Y, Lagarkova M.A, Kiselev S.L, Chailakhyan L.M. 2009. Gap junctional intercellular communication in human embryonic stem cells during spontaneous differentiation. Dokl. Biol. Sci. V. 427. P. 387.)
Adak S., Magdalene D., Deshmukh S., Das D., Jaganathan B. 2021. A review on mesenchymal stem cells for treatment of retinal diseases. Stem Cell Rev. Rep. V. 6. P. 1. https://doi.org/10.1007/s12015-020-10090-x
Akpinar G., Yoneten K.K., Kasap M., Erdal Karaoz E. 2021. Search for novel plasma membrane proteins as potential biomarkers in human mesenchymal stem cells derived from dental pulp, adipose tissue, bone marrow, and hair follicle. J. Membr. Biol. V. 254. P. 409. https://doi.org/10.1007/s00232-021-00190-1
Albu S., Kumru H., Coll R., Vives J., Vallés M., Denito- Penalva J., Rodriguez L., Codinach M., Hernández J., Navarro X., Vidal J. 2021. Clinical effects of intrathecal administration of expanded Wharton jelly mesenchymal stromal cells in patients with chronic complete spinal cord injury: a randomized controlled study. Cytotherapy. V. 23. P. 146. https://doi.org/10.1016/j.jcyt.2020.08.008
Almalki S.G., Agrawal D.K. 2016. Effects of matrix metalloproteinases on the fate of mesenchymal stem cells. Stem Cell Res. Ther. V. 7. P. 129. https://doi.org/10.1186/s13287-016-0393-1
Bouloumié A., Sengenès C., Portolan G., Galitzky J., Lafontan M., 2001. Adipocyte produces matrix metalloproteinases 2 and 9: involvement in adipose differentiation. Diabetes. V. 50. P. 2080. https://doi.org/10.2337/diabetes.50.9.2080
Bradford M.M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. V. 72. P. 248. https://doi.org/10.1016/0003-2697(76)90527-3
Chavey C., Mari B., Monthouel M.N., Bonnafous S., Anglard P., Van Obberghen E., Tartare-Deckert S. 2003. Matrix metalloproteinases are differentially expressed in adipose tissue during obesity and modulate adipocyte differentiation. J. Biol Chem. V. 278. P. 11888. https://doi.org/10.1074/jbc.M209196200
Chen C.-F., Chen Y.-C., Fu Y.-S., Tsai S.-W., Wu P.-K., Chen C.-M., Chang M.-C., Chen W.-M. 2021. Characterization of osteogenesis and chondrogenesis of human decellularized allogeneic bone with mesenchymal stem cells derived from bone marrow, adipose tissue, and Wharton’s jelly. Int. J. Mol. Sci. V. 22. P. 8987. https://doi.org/10.3390/ijms22168987
Choi J.S., Lee B.J., Park H.Y., Song J.S., Shin S.C., Lee J.C., Wang S.G., Jung J.S. 2015. Effects of donor age, long-term passage culture, and cryopreservation on tonsil-derived mesenchymal stem cells. Cell Physiol. Biochem. V. 36. P. 85. https://doi.org/10.1159/000374055
Costa L., Eiro N Fraile M., Gonzalez L., Saá J., Garcia-Portabella P., Vega B., Schneider J., Vizoso F. 2021. Functional heterogeneity of mesenchymal stem cells from natural niches to culture conditions: implications for further clinical uses. Cell Mol. Life Sci. V. 78. P. 447. https://doi.org/10.1007/s00018-020-03600-0
Cox R.P., Krauss M.R., Balis M.E., Dancis J. 1972. Communication between normal and enzyme-deficient cells in tissue culture. Exp. Cell Res. V. 74. P. 251. https://doi.org/10.1016/0014-4827(72)90503-4
Darnell M., O’Neil A., Mao A., Gu L., Rubin L.L., Mooney D.J. 2018. Material microenvironmental properties couple to induce distinct transcriptional programs in mammalian stem cells. Proc. Natl. Acad. Sci. USA. V. 115. P. E8368. https://doi.org/10.1073/pnas.1802568115
Dominici M., Le Blanc K., Mueller I., Slaper–Cortenbach I., Marini F., Krause D., Deans R., Keating A., Prockop Dj., Horwitz E. 2006. Minimal criteria for defining multipotent mesenchymal stromal cells. Int. Soc. Cell. Therapy Position Statement. Cytother. V. 8. P. 315. https://doi.org/10.1080/14653240600855905
Eiro N., Fraile M., Fernandes-Francos S., Sanchez R., Costa L.A., Vizovo F.J. 2021. Importance of the origin of mesenchymal (stem) stromal cells in cancer biology: “alliance” or “war” in intercellular signals. Cell Biosci. V. 11. P. 109. https://doi.org/10.1186/s13578-021-00620-6
Gattazzo F., Urciuolo A., Bonaldo P. 2014. Extracellular matrix: a dynamic microenvironment for stem cell niche. Biochim. Biophys. Acta. V. 1840. P. 2506. https://doi.org/10.1016/j.bbagen.2014.01.010
Gutiérrez-Fernández A., Soria-Valles C., Osorio F.G., Gutiérrez-Abril J., Garabaya C., Aguirre A., Fueyo A., Fernández–García M.S., Puente X.S., López-Otín C. 2015. Loss of MT1-MMP causes cell senescence and nuclear defects which can be reversed by retinoic acid. EMBO J. V. 34. P. 1875. https://doi.org/10.15252/embj.201490594
Hooper M.L., Subak-Sharpe J.H. 1981. Metabolic cooperation between cells. Int. Rev. Cytol. V. 69. P. 45. https://doi.org/10.1016/S0074-7696(08)62320-7
Jin Q., Yuan K., Lin W., Niu C., Ma R., Huang Z. 2019. Comparative characterization of mesenchymal stem cells from human dental pulp and adipose tissue for bone regeneration potential. Artif. Cells Nanomed. Biotechnol. V. 47. P. 1577. https://doi.org/10.1080/21691401.2019.1594861
Kessenbrock K., Plaks V., Werb Z. 2010. Matrix metalloproteinases: regulators of the tumor microenvironment. Cell. V. 141. P. 52. https://doi.org/10.1016/j.cell.2010.03.015
Kobayashi T., Torii D., Iwata T., Izumi Y., Nasu M., Tsutsui T.W. 2020. Characterization of proliferation, differentiation potential, and gene expression among clonal cultures of human dental pulp cells. Hum. Cell. V. 33. P. 490. https://doi.org/10.1007/s13577-020-00327-9
Laemmli U. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. V. 227. P. 680 685. https://doi.org/10.1038/227680a0
Li J., Xu S.-Q., Zhao Y.-M., Yu S., Ge L.-H., Xu B.-H. 2018. Comparison of the biological characteristics of human mesenchymal stem cells derived from exfoliated deciduous teeth, bone marrow, gingival tissue, and umbilical cord. Mol. Med. Rep. V. 18. P. 4969. https://doi.org/10.3892/mmr.2018.9501
Lynch K., Pei M. 2014. Age associated communication between cells and matrix: a potential impact on stem cell-based tissue regeneration strategies. Organogenesis. V. 10. P. 289. https://doi.org/10.4161/15476278.2014.970089
Mannello F., Tonti G.A., Bagnara G.P., Papa S. 2006. Role and function of matrix metalloproteinases in the differentiation and biological characterization of mesenchymal stem cells. Stem Cells. V. 24. P. 475. https://doi.org/10.1634/stemcells.2005-0333
Mannino G., Russo C., Longo A., Anfuso C.G., Lupo G., Furno D.L., Giuffrida R., Giurdanella G. 2021. Potential therapeutic applications of mesenchymal stem cells for the treatment of eye diseases. World J. Stem Cells. V. 13. P. 632. https://doi.org/10.4252/wjsc.v13.i6.632
Moghadasi S., Elveny M., Rahman H.S., Suksatan W., Jalil A.T., Abdelbasset W.K., Yumashev A.V., Shariatzadeh S., Motavalli R., Behzad F., Marofi F., Hassanzadeh A., Pathak Y., Jarahian M. 2021. A paradigm shift in cell-free approach: the emerging role of MSCs-derived exosomes in regenerative medicine. J. Transl. Med. V. 19. P. 302. https://doi.org/10.1186/s12967-021-02980-6
Muraglia A., Cancedda R., Quarto R. 2000. Clonal mesenchymal progenitors from human bone marrow differentiate in vitro according to a hierarchical model. J. Cell Sci. V. 7. P. 1161. https://doi.org/10.1242/jcs.113.7.1161
Nagase H., Woessner J.F. 1999. Matrix metalloproteinases. J. Biol. Chem. V. 274. P. 21491. https://doi.org/10.1201/9781482272765
Niedernhofer L.J., Gurkar A.U., Wang Y., Vijg J., Hoeijmakers J.H.J., Robbins P.D. 2018. Nuclear genomic instability and aging. Ann. Rev. Biochem. V. 87. P. 295. https://doi.org/10.1146/annurev-biochem-062917-012239
Noh E.M., Kim J.M., Hong O.Y., Song H.K., Kim J.S., Kwon K.B., Lee Y.R. 2017. PTEN inhibits replicative senescence-induced MMP-1 expression by regulating NOX4-mediated ROS in human dermal fibroblasts. J. Cell Mol. Med. V. 21. P. 3113. https://doi.org/10.1111/jcmm.13220
Oliver G.W., Stetler-Stevenson W.G., Kleiner D.E. 1999. Zymography, casein zymography, and reverse zymography: activity assays for proteases and their inhibitors. In: Proteolytic enzymes. Berlin, Heidelberg: Springer Lab. Manual. Springer. https://doi.org/10.1007/978-3-642-59816-6_5
Page-McCaw A., Ewald A.J., Werb Z. 2007. Matrix metalloproteinases and the regulation of tissue remodelling. Nat. Rev. Mol. Cell Biol. V. 8. P. 221. https://doi.org/10.1038/nrm2125
Parolini O., Alviano F., Bagnara G.P., Bilic G., Buhring H.J., Evangelista M., Hennerbichler S., Liu B., Magatti M., Mao N., Miki T., Marongiu F., Nakajima H., Nicaido T., Portmann-Lanz C.B. et al. 2008. Concise review: isolation and characterization of cells from human term placenta: outcome of the first international Workshop on Placenta derived stem cells. Stem Cells. V. 26. P. 300. https://doi.org/10.1634/stemcells.2007-0594
Raposo L., Lourenço A.P., Nascimento D.S., Rui Cerqueira R., Cardim N., Leite-Moreira A. 2021. Human umbilical cord tissue-derived mesenchymal stromal cells as adjuvant therapy for myocardial infarction: a review of current evidence focusing on pre-clinical large animal models and early human trials. Cytotherapy. V. 23. P. 974. https://doi.org/10.1016/j.jcyt.2021.05.002
Reed S.L., Escayg A. 2021. Extracellular vesicles in the treatment of neurological disorders. Neurobiol. Dis. V. 157. P. 105 445. https://doi.org/10.1016/j.nbd.2021.105445
Reyes M., Lund T., Lenvik T., Aguiar D., Koodie L., Verfaillie C.M. 2001. Purification and ex vivo expansion of postnatal human marrow mesodermal progenitor cells. Blood. V. 98. P. 2615.
Safari F., Shakery T., Sayadamin N. 2021. Evaluating the effect of secretome of human amniotic mesenchymal stromal cells on apoptosis induction and epithelial-mesenchymal transition inhibition in LNCaP prostate cancer cells based on 2D and 3D cell culture models. Cell Biochem. Funct. V. 39. P. 813. https://doi.org/10.1002/cbf.3654
Schneider R.K., Puellen A., Kramann R., Raupach K., Bornemann J., Knuechel R., Perez-Bouza A., Neuss S. 2010. The osteogenic differentiation of adult bone marrow and perinatal umbilical mesenchymal stem cells and matrix remodelling in three-dimensional collagen scaffolds. Biomaterials. V. 31. P. 467.
Semenova E., Grudniak M.P., Machaj E.K., Bocian K., Chroscinska-Krawczyk M., Trochonowicz M., Stepaniec I.M., Murzyn M., Zagorska K.E., Boruczkowski D. Kolanowski T.J., Oldak T., Rozwadowska N. 2021. Mesenchymal stromal cells from different parts of umbilical cord: approach to comparison and characteristics. Stem Cell Rev. Rep. https://doi.org/10.1007/s12015-021-10157-3
Sensebé L., Krampera M., Schrezenmeier H., Bourin P., Giordano R. 2010. Mesenchymal stem cells for clinical application. Vox Sang. V. 98. P. 93.
Shin S., Lee J., Kwon Y., Park K.-S., Jeong J.-H., Choi S.-J., Bang S., Chang J., Lee C. 2021. Comparative proteomic analysis of the mesenchymal stem cells secretome from adipose, bone marrow, placenta and Wharton’s jelly. Int. J. Mol. Sci. V. 22. P. 845. https://doi.org/10.3390/ijms22020845
Sillat T., Saat R., Pöllänen R., Hukkanen M., Takagi M., Konttinen Y.T. 2012. Basement membrane collagen type IV expression by human mesenchymal stem cells during adipogenic differentiation. J. Cell Mol. Med. V. 16. P. 1485.
Somoza R., Conget P., Rubio F.J. 2008. Neuropotency of human mesenchymal stem cell cultures: clonal studies reveal the contribution of cell plasticity and cell contamination. Biol. Blood Marrow Transplant. V. 14. P. 546. https://doi.org/10.1016/j.bbmt.2008.02.017
Stanko P., Kaiserova K., Altanerova V., Altaner C. 2014. Comparison of human mesenchymal stem cells derived from dental pulp, bone marrow, adipose tissue, and umbilical cord tissue by gene expression. Biomed. Pap. Med. Fac. Univ. Palacky Olomouc Czech Repub. V. 158. P. 373. https://doi.org/10.5507/bp.2013.078
Sun J., Xing F., Zou M., Gong M., Li L., Zhou Xiang Z. 2021. Comparison of chondrogenesis-related biological behaviors between human urine-derived stem cells and human bone marrow mesenchymal stem cells from the same individual. Stem Cell Res. Ther. V. 12. P. 366.
Sworder B.J., Yoshizawa S., Mishra P.J., Cherman N., Kuznetsov S.A., Merlino G., Balakumaran A, Robey P.G. 2015. Molecular profile of clonal strains of human skeletal stem/progenitor cells with different potencies. Stem Cell Res. V. 14. P. 297. https://doi.org/10.1016/j.scr.2015.02.005
Tai C., Wang L., Xie Y., Gao T., Huang F., Wang B. 2021. Analysis of key distinct biological characteristics of human placenta-derived mesenchymal stromal cells and individual heterogeneity attributing to donors. Cells Tiss. Organs V. 210. P. 45. https://doi.org/10.1159/000513038
Vilaça-Faria H., Marote A., Lages I., Ribeiro C., Mendes-Pinheiro B., Domingues A.V., Campos J., Lanceros-Mendez S., Salgado A.J., Teixeira F.G. 2021. Fractionating stem cells secretome for Parkinson’s disease modeling: is it the whole better than the sum of its parts? Biochimie. V. 189. P. 87. https://doi.org/10.1016/j.biochi.2021.06.008
Wangler S., Kamali A., Wapp C., Wuertz-Kozak K., Häckel S., Fortes C., Lorin M Benneker L.M., Haglund L., Richards R.G., Alini M., Peroglio M., Sibylle Grad S. 2021. Uncovering the secretome of mesenchymal stromal cells exposed to healthy, traumatic, and degenerative intervertebral discs: a proteomic analysis. Stem Cell Res. Ther. V. 12. P. 11. https://doi.org/10.1186/s13287-020-02062-2
Xiao Z., Lei T., Liu Y., Yang Y., Bi W., Du H. 2021. The potential therapy with dental tissue-derived mesenchymal stem cells in Parkinson’s disease. Stem Cell Research & Therapy. V. 12. P. 5. https://doi.org/10.1186/s13287-020-01957-4
Yigitbilek F., Conley S.M., Tang H., Saadiq I.M., Jordan K.L., Lerman L.O., Taner T. 2021. Comparable in vitro function of human liver-derived and adipose tissue-derived mesenchymal stromal cells: implications for cell-based therapy. Front. Cell Dev. Biol. V. 9. eCollection. https://doi.org/10.3389/fcell.2021.641792
Zhang X., Wang N., Huang Y., Li Y., Li G., Lin Y., Atala A., Hou J., Zhao W. 2022. Extracellular vesicles from three dimensional culture of human placental mesenchymal stem cells ameliorated renal ischemia/reperfusion injury. Int. J. Artif. Organs. 45. V. 2. P. 181–92. https://doi.org/10.1177/0391398820986809
Дополнительные материалы отсутствуют.