Цитология, 2023, T. 65, № 2, стр. 131-145
Ростовые и молекулярные характеристики клеток глиобластом человека линий A172 и R1, резистентных к действию темозоломида
А. А. Пиневич 1, 2, *, Н. Л. Вартанян 1, А. В. Карташев 1, Л. Н. Киселева 1, И. В. Смирнов 1, Ж. Ю. Сидорова 3, 4, С. П. Свитина 3, М. П. Самойлович 1, 2
1 Российский научный центр радиологии и хирургических технологий им. акад. А.М. Гранова
197758 Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
3 Российский научно-исследовательский институт гематологии и трансфузиологии
191024 Санкт-Петербург, Россия
4 Петербугский институт ядерной физики им. Б.П. Константинова НИЦ “Курчатовский институт”
188300 Санкт-Петербург, Россия
* E-mail: agniapinevich@gmail.com
Поступила в редакцию 13.10.2022
После доработки 07.11.2022
Принята к публикации 08.11.2022
- EDN: NDBVPD
- DOI: 10.31857/S0041377123020086
Аннотация
Рецидивирование глиобластом обусловлено исходной и приобретенной в результате терапии резистентностью опухолевых клеток. Широко ведутся исследования по поиску маркеров, которые позволили бы предсказывать уровень резистентности клеток глиобластом к терапии. Сложность проблемы связана с высокой гетерогенностью индивидуальных опухолей и клеточного состава каждой опухоли. В представленной работе проведено сравнительное изучение однократного действия темозоломида в форме Темодала® на известную линию глиобластомы А172 и новую линию R1. В высокочувствительной к темозоломиду линии А172 после воздействия 0.1 мМ химиопрепарата сохранялись отдельные клетки, которые возобновляли пролиферацию. Для глиобластомы R1 доза темозоломида, после которой выживали единичные клетки, возобновлявшие пролиферацию, составила 1.0 мМ. Популяции, полученные в результате пролиферации таких клеток, были обозначены как резистентные. В резистентных клетках A172 и R1 исследовали экспрессию генов, ответственных за устойчивость к химиопрепаратам и прогрессию опухолей (MGMT, А-ВСВ1, АВСС1, ABCG2), наличие фермента MGMT, экспрессию генов ростовых факторов (VEGF, HGF), а также продукцию цитокинов IL-6 и IL-8 и экспрессию кодирующих их генов. В клетках А172 был подтвержден метилированный статус промотора гена MGMT, а также отсутствие экспрессии соответствующего гена. Впервые показано, что глиобластома R1 гетерогенна по статусу метилирования промотора гена MGMT и присутствию самого фермента. В популяциях резистентных клеток А172 и R1 уровень метилирования промотора гена MGMT был ниже, чем в исходных клетках, а экспрессия гена усилена, что может быть причиной большей устойчивости таких клеток к химиопрепаратам. Экспрессия большинства генов, связанных с устойчивостью к химиотерапии и более агрессивным течением заболевания, генов ростовых факторов и интерлейкинов в резистентных клетках А172 была выше, чем в интактных клетках. В резистентных клетках R1 экспрессия большинства тех же генов (за исключением АВСС1 и VEGF, уровень экспрессии которых менялся незначительно) была, напротив, ниже, чем в исходной линии. Полученные результаты подтверждают значимость MGMT в формировании резистентности клеток глиобластом к темозоломиду. Прогностическая ценность остальных исследованных показателей пока представляется неоднозначной.
Глиобластомы представляют собой наиболее распространенные злокачественные опухоли нервной системы человека, отличающиеся высокой резистентностью к лечебным воздействиям. Стандартная терапия пациентов с глиобластомой включает максимальную хирургическую резекцию в сочетании с лучевой терапией и (или) химиотерапию темозоломидом (Braun, Ahluwalia, 2017; Lu et al., 2018; Тягунова и др., 2022). Несмотря на проводимую терапию, неизбежно возникают рецидивы глиобластомы, приводящие к низкому уровню выживаемости, медиана которого составляет около 14 мес.
Рецидивирование глиобластом обусловлено как свойственной исходной популяции резистентностью опухолевых клеток, так и резистентностью, приобретенной в результате терапии. До сих пор лечение пациентов с рецидивирующей глиобластомой не приводит к желаемым результатам, и почти 90% рецидивов глиобластомы не отвечают на повторный курс химиотерапии (Oliva et al., 2010). Основным препаратом первой линии химиотерапии пациентов с первичной глиобластомой в настоящее время является темозоломид. Это цитостатический препарат алкилирующего типа действия, механизм которого состоит в присоединении метильной группы к молекуле ДНК, что приводит к нарушению ее структуры и гибели клетки (Юкальчук и др., 2016; Thomas et al., 2017; Strobel et al., 2019). Изначальный уровень чувствительности к этому препарату и его вариации в ходе лечения индивидуальны для каждого пациента.
Известно, что глиобластомы отличаются высокой степенью гетерогенности, каждая опухоль несет в себе черты уникальности. Опухоли, возникшие у разных пациентов, различаются по морфологии, фенотипу и генетическим особенностям клеток (Кит и др., 2017; Mirzayans, Murray, 2020). При этом каждая из них сформирована неоднородными клеточными популяциями. Учитывая эти особенности глиобластом, актуальным является как изучение реакций на темозоломид различных клеточных линий, так и исследование свойств клеточных популяций, которые являются потомками единичных, наиболее резистентных к препарату клеток в исходной гетерогенной клеточной линии.
В исследование нами были взяты две линии глиобластом человека: А172 и R1. Линия А172 хорошо изучена, используется в лабораторной практике уже с 70-х годов прошлого века и относится к числу чувствительных к темозоломиду (Giard et al., 1973). Линия R1 получена и охарактеризована недавно (Киселева и др., 2017), и действие на нее темозоломида не известно. Однако ранее мы показали, что линия R1 чувствительна к фотемустину, химиопрепарату второй линии терапии глиобластом (Киселева и др., 2018). Клетки R1, так же, как и клетки линии А172, обладали существенно более высокой чувствительностью к этому препарату, чем линии Т98G и T2, о которых известно, что они высоко резистентны к действию темозоломида.
Цель настоящей работы заключалась в изучении действия темозоломида на линии глиобластом А172 и R1 и характеристике потомков наиболее резистентных к препарату клеток исходных линий, включающая исследование экспрессии ряда генов, ответственных за устойчивость к химиопрепаратам и прогрессию опухолей.
МАТЕРИАЛ И МЕТОДИКА
Клеточные линии. Клетки глиобластомы линии A172 были получены из коллекции клеточных культур Научно-исследовательского института гриппа им. А.А. Смородинцева Минздрава РФ (Санкт-Петербург). Клеточная линия R1 была выделена из операционного материала пациента в Петербургском институте ядерной физики им. Б.П. Константинова национального исследовательского центра “Курчатовский институт” (Санкт-Петербург). Обе линии были охарактеризованы ранее (Киселева и др., 2016, 2017, 2018).
Культивирование клеточных линий. Клетки культивировали в вентилируемых пластиковых флаконах площадью 12.5 см2, а также в 12-, 24- и 96-луночных планшетах (Jet Biofil, Китай; Sarstedt, Германия) в среде αMEM (БиолоТ, Россия), содержащей 5% эмбриональной телячьей сыворотки (HyClone, США) и 0.5% гентамицина (БиолоТ, Россия) при 37°С и 6% CO2. Пересев клеток проводили с помощью 0.25%-ного раствора трипсина с версеном (БиолоТ, Россия).
Морфологические исследования. Клетки фиксировали ледяным карбинолом, окрашивали по Май-Грюнвальду−Гимзе и фотографировали с помощью инвертированного микроскопа Nikon Diaphot, оборудованного камерами Nikon D60 и Nikon D5600 (Nikon, Япония).
Обработка клеточных линий темозоломидом. Для обработки клеток глиобластом использовали водорастворимый препарат Темодал® (Бакстер Онкология ГмбХ, Германия), действующим веществом которого является темозоломид. Непосредственно перед внесением в клеточные культуры Темодал® растворяли в деионизированной воде и стерилизовали фильтрованием. Клетки глиобластом в логарифмической фазе роста культивировали в ростовой среде, содержащей 0.1–3 мМ темозоломида, в 24-луночных планшетах в течение 24 ч, после чего дважды отмывали ростовой средой. После отмывания клетки из каждой лунки 24-луночного планшета пересевали в 12 лунок 96-луночных планшетов, считая число клеток и посевную дозу на кондуктометрическом счетчике Z1 Coulter Counter (Beckman Coulter, США). Каждые 3–4 сут после удаления препарата и пересева проводили замену 1/2 ростовой среды в каждой лунке. В течение первых 14 сут культивирования считали число клеток каждые 4–5 сут и впоследствии каждые 7 сут вплоть до 28 сут. Клетки, продолжившие или возобновившие пролиферацию после обработки препаратом, на 28 сут культивирования последовательно пересевали в лунки 24-, 12‑луночных планшетов и флаконы площадью 12.5 см2. Все эксперименты проводили в трех повторностях.
Время удвоения численности популяций резистентных клеток (td) рассчитывали по формуле: td = = ln2 × N0/(dN/dt), где N0 – исходное число клеток (посевная доза), dN – прирост числа клеток, а dt – время (ч) от посева до снятия культуры (Гриффитс, 1989).
Иммуноцитохимическое выявление MGMT. Клетки культивировали в камерах для клеток на стекле BD Falcon CultureSlides (BD Biosciences, США) и фиксировали 4%-ным забуференным формальдегидом в течение 10 мин. Демаскирование антигена проводили путем термической инкубации при 95–99°С в 0.01М цитратном буфере (рН 6.0) в течение 20 мин. Клетки последовательно инкубировали с первичными антителами против MGMT (О-6-метилгуанин-ДНК-метилтрансферазы) и мечеными антителами Dako EnVision+ System-HRP Labelled polymer (Dako, Дания) по 30 мин во влажной камере при комнатной температуре. Ферментную метку визуализировали с помощью хромогена EnVisionTM FLEX DAB+ (Dako, Дания) и субстратного буфера EnVisionTM FLEX. Контрастное окрашивание ядер проводили в гематоксилине Майера (БиоВитрум, Россия) в течение 2 мин. Изображения получали при помощи сканера Leica SCN 400 (Leica Microsystems, Германия) с использованием программы Aperio Im-age Scope (Leica Microsystems, Германия) и микроскопа Axio Imager A2, оборудованного камерой AxioCam HRc (Carl Zeiss, Германия).
Исследование активности генов методом полимеразной цепной реакции (ПЦР) в режиме реального времени. РНК выделяли с помощью TRIzol Reagent согласно рекомендациям производителя (Thermo Fisher Scientific, США). В реакции обратной транскрипции использовали 500 нг РНК. Этапы выполнения анализа описаны нами ранее (Киселева и др., 2016). Последовательности праймеров представлены в табл. 1. Праймеры синтезированы фирмой Люмипроб РУС (Россия).
Таблица 1.
Последовательности праймеров, использованных для амплификации генов
| Ген | Прямой праймер | Обратный праймер |
|---|---|---|
| GAPDH | GTGAACCATGAGAAGTATGACAAC | CATGAGTCCTTCCACGATACC |
| VEGF | AGGGCAGAATCATCACGAAGT | AGGGTCTCGATTGGATGGCA |
| HGF | GCTATCGGGGTAAAGACTTACA | CGTAGCGTACCTCTGGATTGC |
| IL-6 | ACTCACCTCTTCAGAACGAATTG | CCATCTTTGGAAGGTTCAGGTTG |
| IL-8 | ACTGAGAGTGATTGAGAGTGGAC | AACCCTCTGCACCCAGTTTTC |
| MGMT | ACCGTTTGCGACTTGGTACTT | GACCCTGCTCACAACCAGAC |
| ABCB1 (MDR1) | TTGCTGCTTACATTCAGGTTTCA | AGCCTATCTCCTGTCGCATTA |
| ABCC1 (MRP1) | CTCTATCTCTCCCGACATGACC | AGCAGACGATCCACAGCAAAA |
| ABCG2 (BCRP) | GTTTTGTGTTTATGATGGTCTGTTG | ATGCTGCAAAGCCGTAAATCC |
| ASAH1 | ATTGGCCCCAGCCTACTTTAT | CCCTGCTTAGCATCGAGTTCAT |
Уровень экспрессии генов представляли в виде разницы между пороговым циклом исследуемого гена и гена сравнения GAPDH (ΔCt, где Ct – пороговый цикл, соответствующий числу циклов амплификации, необходимых для достижения порогового значения флуоресценции). Для сравнения уровня экспрессии генов в клетках до и после воздействия темозоломида использовали метод относительного количественного определения генов (метод 2–ΔΔCt); 2–ΔΔCT представляет собой кратность разницы между экспрессией гена в интактных и резистентных к темозоломиду клетках (Livak, Schmittgen, 2001).
Определение статуса метилирования гена MGMT. В качестве метода анализа статуса метилирования CpG-островков промоторных участков гена MGMT была использована метил-специфическая полимеразная цепная реакция (MSP) (Herman et al., 1996; Kristensen, Hansen, 2009). Выделение ДНК проводили с помощью набора для выделения геномной ДНК из клеток, тканей и крови производства ООО Биолабмикс (Россия) в соответствии с рекомендациями производителя. Для проведения бисульфитной конверсии проб ДНК использовали набор EZ DNA Methylation-Gold® (Zymo Research, США). После получения конвертированной и очищенной ДНК проводили амплификацию с праймерами, специфичными для метилированных и неметилированных участков ДНК промоторных областей гена MGMT (Christians et al., 2012): 5'-TTTCGACGTTCGTAGGTTTTCGC-3' (прямой праймер) и 5'-GCACTCTTCCGAAAACGAAACG-3' (обратный праймер) для обнаружения метилированных матриц (длина продукта 81 п.н.); 5'-TTTGTGTTTTGATGTTTGTAGGTTTTTGT-3' (прямой праймер) и 5'-AACTCCACACTCTTCCAAAAACAAACA-3' (обратный праймер) для обнаружения неметилированных матриц (длина продукта 93 п.н.).
ПЦР проводили в общем объеме 12 мкл, содержащем ПЦР-буфер, 1.1 мМ MgCl2, 0.2 мМ смеси дезоксинуклеотидтрифосфатов, по 10 пмоль соответствующего прямого и обратного праймера, 1 ед. Taq-полимеразы и 2 мкл ДНК-матрицы, обработанной бисульфитом. Программа ПЦР составляла 95°C в течение 3 мин, затем 40 циклов 95°C по 50 с, 60°C – 50 с, 72°C – 50 с и заключительный этап: 72°C в течение 3 мин. После проведения 40 циклов ПЦР полученный амплификат анализировали с помощью электрофореза в 10%-ном полиакриламидном геле. Фрагменты ДНК визуализировали в проходящем ультрафиолетовом свете после окрашивания геля бромистым этидием в концентрации 1 мкг/мл. Наличие амплификата, полученного при проведении ПЦР с праймерами для метилированных участков ДНК, свидетельствовало о наличии аберрантного метилирования. Наличие ПЦР-продукта, полученного при проведении ПЦР с праймерами для неметилированных участков ДНК, и отсутствие амплификата с праймерами для метилированных участков ДНК свидетельствовало об отсутствии аберрантного метилирования.
Концентрацию интерлейкинов IL-6 и IL-8 в среде культивирования клеток определяли с помощью наборов Интерлейкин-6-ИФА-БЕСТ и Интерлейкин-8-ИФА-БЕСТ (ООО Вектор-Бест, Россия) в соответствии с рекомендациями производителя.
Статистический анализ выполняли при помощи программного обеспечения Microsoft Excel и IBM SPSS Statistics 22.
Использованные реактивы: среда αMEM, гентамицин, раствор 0.25%-ного трипсина с версеном, деионизированная вода, фосфатно-солевой буферный раствор (БиолоТ, Россия), эмбриональная телячья сыворотка (HyClone, США), Темодал® (Бакстер Онкология ГмбХ, Германия), формальдегид, гематоксилин Майера (БиоВитрум, Россия), поликлональные кроличьи антитела к MGMT (Abcam, Великобритания), антитела Dako EnVision+ System-HRP Labelled poly-mer, хромоген EnVisionTM FLEX DAB+, субстратный буфер EnVisionTM FLEX (Dako, Дания), TRIzol Reagent (Thermo Fisher Scientific, США), Taq- полимераза, 10× ПЦР-буфер, MgCl2 (Силекс, Россия), праймеры (НПК, Россия; Синтол, Россия), трифосфаты (SibEnzyme, Россия), акриламид, бисакриламид, ТЕМЕД (AppliChem, Германия), персульфат аммония (Panreac, Испания).
РЕЗУЛЬТАТЫ
Клеточные линии глиобластом А172 и R1 были представлены фибробластоподобными отростчатыми клетками (рис. 1). Подробная морфологическая характеристика интактных культур A172 и R1 была проведена ранее (Киселева и др., 2016; 2017).
Рис. 1.
Интактные клетки линий A172 (а) и R1 (б). Окраска по Май-Грюнвальду–Гимзе. Масштабные отрезки: 100 мкм.

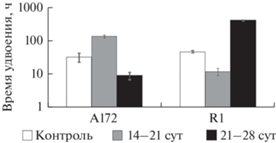
Воздействие темозоломида на клетки линии А172. Для обработки клеток глиобластомы линии A172 темозоломидом был выбран диапазон концентраций 0.1–1 мМ (рис. 2). В течение 4 сут после воздействия препарата клетки продолжали пролиферировать. После 4-суточного культивирования, за счет гибели клеток их количество стало уменьшаться. К 14 сут во всех культурах A172, подвергнутых действию темозоломида, число живых клеток не превышало 6% от исходной посевной дозы. Наконец, к 21 сут в культурах A172, обработанных 0.25–1 мМ темозоломида не было выявлено живых клеток. В течение следующих 7 сут жизнеспособные клетки в этих культурах обнаружены не были. Таким образом, концентрация темозоломида свыше 0.25 мМ оказалась летальной для клеток линии А172. В то же время, в культуре А172, испытавшей воздействие темозоломида в дозе 0.1 мМ, к 14 сут оставались одиночные клетки, численность которых составляла 3.8% от исходной посевной дозы. За следующую неделю (14–21 сут культивирования) количество клеток увеличилось вдвое, а к 28 сут за счет пролиферации клеток произошло восстановление численности популяции до исходных значений. Одиночные клетки, восстановившие способность к пролиферации, представляют собой резистентные к темозоломиду клетки линии А172. Время удвоения таких резистентных клеток между 14 и 21 сут культивирования увеличивалось в 4 раза, а между 21 и 28 сут уменьшалось в 3.5 раза по сравнению с интактной культурой (рис. 3).
Рис. 2.
Изменения численности клеток линии A172 на ранних (а) и поздних (б) сроках после обработки темозоломидом в разных концентрациях.

Рис. 3.
Время удвоения интактных и обработанных темозоломидом клеток глиобластом линий A172 и R1. Указано время (сут) после обработки темозоломидом.
Воздействие темозоломида на клетки линии R1. Чувствительность линии R1 к воздействию темозоломида ранее изучена не была, поэтому для обработки клеток был выбран более широкий диапазон (0.25–3 мМ) концентраций препарата (рис. 4). В отличие от клеток А172, в культурах R1 непосредственно после удаления темозоломида не происходило роста численности клеточной популяции. Вплоть до 9-х сут культивирования число клеток R1 продолжало уменьшаться; количество сохранившихся клеток находилось в обратной зависимости от использованной дозы препарата. Дальнейшая динамика гибели и восстановления клеток линии R1 также определялась концентрацией темозоломида. Начиная с 9 сут, клетки R1, обработанные 0.25 и 0.5 мМ препарата, возобновляли пролиферацию, и до конца культивирования их количество увеличивалось в 8–10 раз по сравнению с исходной посевной дозой. После использования темозоломида в концентрации 1 мМ пролиферация и рост численности клеток R1 начался с 14-х сут культивирования. Клетки R1, обработанные 2 мМ темозоломида, возобновили пролиферацию к 21-м сут, и за 1 нед. их численность достигла значений посевной дозы; в течение следующей недели была отмечена массовая гибель этих клеток, что привело к гибели культуры к 28-м сут. Наконец, в культурах R1, обработанных 3 мМ темозоломида, к 14-м сут не оставалось живых клеток и при дальнейшем наблюдении не было признаков пролиферации.
Рис. 4.
Изменения численности клеток линии R1 на ранних (а) и поздних (б) сроках после обработки темозоломидом в разных концентрациях.

Таким образом, резистентные к темозоломиду клетки, возобновившие устойчивую пролиферацию, были получены при обработке глиобластомы R1 препаратом в концентрации 1 мМ. Наименьшее время удвоения эти клетки демонстрировали между 14 и 21 сут культивирования (рис. 3), однако оно превышало таковое у интактных клеток в 4 раза. Между 21 и 28 сут культивирования происходило дальнейшее замедление пролиферации таких резистентных клеток почти в 9 раз по сравнению с интактной культурой.
Уровень экспрессии генов в клетках А172 и R1. В интактных и резистентных к темозоломиду клетках А172 и R1 исследовали экспрессию генов, опосредующих различные механизмы резистентности опухолей к лекарственной терапии. Определяли статус метилирования промотора гена MGMT, а также уровень экспрессии этого гена. В клетках А172 было показано наличие метилирования промотора гена MGMT. Статус метилирования промотора гена M-GMT в клетках линии R1 ранее не был определен.
По нашим данным в популяции клеток R1 присутствуют клетки как с метилированным, так и с неметилированным промотором гена MGMT (рис. 5а). Определение активности гена MGMT подтвердило полученные результаты, показав практически полное отсутствие экспрессии MGMT в клетках А172 и лишь незначительную экспрессию этого гена в клетках R1. При этом в резистентных клетках обеих линий экспрессия MGMT существенно возрастала. В клетках А172 она увеличилась примерно в 50 раз, а в клетках R1 увеличилась незначительно (рис. 5б). Усиление экспрессии сопровождалось снижением числа клеток, несущих метилированный промотор гена MGMT (рис. 5а). Иммуноцитохимическое исследование интактных клеток показало, что популяция клеток линии R1 была неоднородной по наличию MGMT, в то время как в клетках линии A172 фермент обнаружен не был (рис. 5в, г).
Рис. 5.
Анализ метилирования CpG-островков промоторных областей гена MGMT в интактных и резистентных к темозоломиду клетках A172 и R1. а: дорожки Н и М – амплификат, полученный с праймерами для неметилированных и метилированных участков ДНК соответственно. б – Относительный уровень экспрессии гена MGMT в интактных клетках линий A172 и R1; по горизонтали – ΔCT (разница между пороговым циклом исследуемого гена и гена сравнения GAPDH); горизонтальные отрезки – стандартное отклонение. в – Изменение экспрессии гена MGMT в резистентных к темозоломиду клетках A172 и R1; по вертикали – 2–ΔΔCT (кратность разницы между экспрессией гена в резистентных и интактных клетках); за 1 ед. принят уровень активности гена MGMT в интактных клетках; вертикальные отрезки – стандартное отклонение. г, д – Иммуноцитохимическое определение наличия белка MGMT в интактных клетках A172 и R1 соответственно; масштабные отрезки: 100 мкм.

В клетках линий А172 и R1 исследовали активность генов множественной лекарственной устойчивости: ABCB1 (MDR1), ABCC1 (MRP1) и ABCG2 (BCRP). Более всего в обеих линиях была выражена экспрессия гена ABCC1 (BCRP), в резистентных клетках она практически не изменялась. Активность генов ABCB1 (MDR1) и ABCG2 (BCRP) в клетках А172 и R1 была выражена слабо, однако в резистентных клетках А172 экспрессия этих генов возрастала более чем в 10 раз, а в резистентных клетках R1, напротив, еще более снижалась (рис. 6).
Рис. 6.
Относительный уровень экспрессии генов множественной лекарственной устойчивости в интактных клетках линий A172 и R1. а – Значения ΔCT; горизонтальные отрезки – стандартное отклонение. б – Изменение экспрессии генов множественной лекарственной устойчивости в резистентных к темозоломиду клетках A172 и R1; по вертикали – значение 2–ΔΔCT. Другие объяснения см. в подписи к рис. 5.

Рис. 7.
Относительный уровень экспрессии генов интерлейкинов (IL-6, IL-8) в интактных клетках линий A172 и R1. а – Значения ΔCT; горизонтальные отрезки – стандартное отклонение. б – Изменение экспрессии генов интерлейкинов в резистентных к темозоломиду клетках A172 и R1; по вертикали – значение 2–ΔΔCT. Другие объяснения см. в подписи к рис. 5.
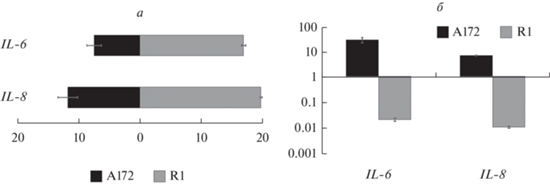
По экспрессии генов IL-6 и IL-8 клетки линий А172 и R1 существенно различались. Клетки А172 характеризовались умеренной активностью этих генов, тогда как клеткам R1 была свойственна чрезвычайно высокая экспрессия IL-6 и, особенно, IL-8. В резистентных к темозоломиду клетках этих линий мы наблюдали выраженное, но разнонаправленное, изменение активности обоих этих генов, которое проявлялось в усилении экспрессии генов IL-6 и IL‑8 в клетках А172 и ослаблении их активности в клетках линии R1 (рис. 7).
Количественное определение цитокинов IL-6 и IL-8 было проведено в среде культивирования интактных и резистентных клеток А172 и R1. Полученные результаты согласуются с данными по экспрессии соответствующих генов, подтверждая высокую продукцию IL-6 и IL-8 интактными клетками R1 и снижение ее в резистентных клетках. В клетках А172 отмечена обратная ситуация (рис. 8).
Рис. 8.
Концентрация цитокинов IL-6, IL-8 в среде культивирования интактных и резистентных к темозоломиду клеток линий глиобластом человека A172 и R1. Вертикальные отрезки – стандартное отклонение.

Клетки А172 и R1 характеризовались близкими значениями экспрессии гена VEGF. В резистентной популяции клеток линии А172 активность этого гена десятикратно возрастала, в резистентных клетках R1 оставалась неизменной (рис. 9). Ген HGF практически не экспрессировался в интактных клетках А172 и проявлял низкую активность в интактных клетках R1. В резистентных клетках А172 экспрессия гена HGF возрастала, а в клетках R1, напротив, существенно снижалась (рис. 9). В табл. 2 представлены обобщенные результаты изучения экспрессии генов в исследованных линиях глиобластом, а также в высоко резистентной к темозоломиду линии T98G, подробная характеристика которой была дана нами ранее (Пиневич и др., 2022).
Рис. 9.
Относительный уровень экспрессии генов ростовых факторов в интактных клетках линий A172 и R1. а – Значение ΔCT; горизонтальные отрезки – стандартное отклонение. б – Изменение экспрессии генов ростовых факторов в резистентных к темозоломиду клетках A172 и R1; по вертикали – значение 2–ΔΔCT. Другие объяснения см. в подписи к рис. 5.

Таблица 2.
Экспрессия генов в клетках глиобластом человека, интактных (инт.) и резистентных (рез.) к действию темозоломида
| Ген | Уровень экспрессии гена в клетках линии глиобластомы человека |
|||||
|---|---|---|---|---|---|---|
| A172 | R1 | T98G | ||||
| инт. | рез. | инт. | рез. | инт. | рез. | |
| ABCB1 (MDR1) | ± | + | ± | ± | ± | ± |
| ABCC1 (MRP1) | ++ | ++ | ++ | ++ | ++ | +++ |
| ABCG2 (BCRP) | ± | + | + | ± | ++ | ++ |
| MGMT | – | + | + | + | + | + |
| IL-6 | + | ++ | +++ | + | + | ++ |
| IL-8 | + | ++ | +++ | ++ | + | ++ |
| VEGF | ++ | +++ | ++ | ++ | ++ | ++ |
| HGF | – | + | + | – | – | – |
ОБСУЖДЕНИЕ
В настоящее время приведены убедительные доказательства того, что первичная и рецидивирующая глиобластомы существенно различаются между собой как морфологически, так и молекулярно-генетически (Kim et al., 2015; Marucci et al., 2015; Campos et al., 2016). Клетки глиобластом, избегающие гибели под воздействием лучевой и лекарственной терапии, эволюционируют и приобретают свойства, определяющие их устойчивость к дальнейшему лечению.
Феномен формирования резистентности глиобластом к терапии и механизмы, задействованные в этом процессе, изучаются очень активно (Daniel et al., 2019; Xia et al., 2021). В качестве клеточных моделей в подобных исследованиях принято использовать клеточные линии глиобластом, различающиеся между собой по ряду определенных параметров. Считается, что разнообразие клеточных линий в какой-то мере отражает чрезвычайно высокое разнообразие вариантов этого заболевания (Li et al., 2022; Zhu et al., 2022) и позволяет получить более достоверные результаты.
В лабораторной практике используется целый спектр линий глиобластом человека, как высоко резистентных к темозоломиду (LN-18 и Т98G), так и более чувствительных к этому препарату (А172, U87, U251 и U373) (Lee, 2016; Kinashi et al., 2020; Soni et al., 2022). Кроме того, пытаясь приблизить клеточные модели к реальной опухоли, исследователи используют первичные клеточные линии, выделенные из операционного материала пациентов, а также резистентные варианты постоянных линий, получаемые при воздействии на них химиопрепаратами или облучением. Подобные модели представляют особый интерес для изучения приобретенной резистентности и тестирования препаратов, предназначенных для лечения рецидивов заболевания. Так, известные линии, чувствительные к действию темозоломида (например, A172, SNB-19, U87, U251 и U373) используют для генерации клеток с резистентностью, приобретенной в результате повторных воздействий этого препарата. Однако результаты, полученные в разных лабораториях, существенно различаются между собой (Lee, 2016).
В настоящей работе мы обратились к изучению потомства наиболее резистентных к темозоломиду клеток, присутствующих в исходных линиях глиобластом A172 и R1. Линия глиобластомы A172 широко известна, тогда как линия, R1, напротив, получена недавно, мало известна и в отношении действия темозоломида ранее не была исследована. Клетки линий А172 и R1 были однократно обработаны темозоломидом в широком диапазоне доз. В качестве источника темозоломида был использован препарат Темодал® в лекарственной форме лиофилизата для приготовления инфузионного раствора. Преимущества такого подхода описаны нами ранее (Пиневич и др., 2022).
Как и ожидалось, клетки А172 оказались высоко чувствительны к действию темозоломида. Летальная доза препарата составила для них 0.25 мМ. Однако при воздействии 0.1 мМ препарата отдельные устойчивые клетки линии смогли избежать гибели и восстановили способность к пролиферации, сформировав популяцию потомков наиболее резистентных клеток. Клетки линии R1 показали более высокую устойчивость к этому препарату. Летальная доза для них составила 2 мМ. Резистентные клетки, устойчиво возобновившие пролиферацию после действия препарата, были получены при обработке глиобластомы R1 темозоломидом в дозе 1 мМ.
Популяции, сформировавшиеся из единичных клеток, выживших после воздействия темозоломида, были определены нами как резистентные. Морфологически резистентные клетки обеих линий мало отличались от исходных клеток. При этом пролиферативная активность резистентных клеток А172 была выше, чем интактных, а у резистентных клеток R1, напротив, была снижена. Резистентные и интактные клетки А172 и R1 были исследованы нами в отношении экспрессии в них ряда генов, активность которых сопряжена с лекарственной устойчивостью и прогрессированием опухолей.
Одной из основных характеристик, определяющих чувствительность опухолевых клеток к темозоломиду, является статус фермента MGMT. Активность этого фермента определяет потенциальную возможность репарации индуцированных темозоломидом повреждений ДНК (Pegg, Byers, 1992). Кроме того, общепринятой считается значимость белка р53, супрессора образования злокачественных опухолей (Lee, 2016; Tiek et al., 2018; Rabe et al., 2020). Так, для резистентных линий LN-18 и Т98G характерна высокая экспрессия MGMT, а ген, кодирующий белок р53, несет мутации. В клетках более чувствительной к темозоломиду линии А172 экспрессия гена MGMT практически отсутствует, а промотор этого гена метилирован, при этом клетки характеризуются наличием р53 дикого типа (Hermisson et al., 2006; Perazzoli et al., 2015; Lee, 2016; Kinashi et al., 2020; Soni et al., 2022).
Мы подтвердили статус промотора гена MGMT в клетках А172 как метилированного, а также почти полное отсутствие экспрессии соответствующего гена. В линии R1 таким статусом обладает лишь часть клеток, что позволяет гену MGMT экспрессироваться. В резистентных вариантах обеих изучаемых линий отмечены значимые изменения этих показателей. Уровень метилирования в них снижался, а экспрессия MGMT, напротив, возрастала, особенно в резистентных клетках А172. Подобные изменения функционирования гена MGMT были описаны в ряде работ (Feldheim et al., 2022). Однако некоторым исследователям не удалось наблюдать изменения со стороны этого гена под воздействием химиопрепаратов (Lee, 2016).
MGMT признан основным и пока единственным предиктивным маркером в лечении пациентов с глиобластомой (Louis et al., 2016; Мацко и др., 2019). С низкой экспрессией гена MGMT в клетках опухоли ассоциируется более длительная продолжительность жизни больных с первичной глиобластомой, при условии проведения стандартной химиотерапии (Hegi et al., 2005; Matsko, Imaynitov, 2015). Показано, что уровень мРНК этого фермента в целом ниже у пациентов с высокой продолжительностью жизни (Мацко и др., 2019).
Один из важнейших молекулярных механизмов, лежащих в основе формирования резистентности опухоли, связан с функционированием транспортных белков – АВС-транспортеров, осуществляющих выброс химиопрепаратов из клеток против градиента концентрации с затратой энергии АТФ, что приводит к быстрому уменьшению внутриклеточного уровня препаратов ниже терапевтической концентрации (Borst et al., 2000; Kathawala et al., 2015).
Семейство АВС-транспортеров включает в себя 49 различных белков, однако значимость в развитии резистентности глубоко изучена только для трех из них: белка множественной лекарственной резистентности 1 (MDR1, также известного как Р-гликопротеин или АВСВ1), MDR-ассоциированного белка 1 (MRP1, АВСС1) и белка резистентности рака молочной железы (BCRP, ABCG2) (Gottesman et al., 2002). Эти белки экспрессируются в опухолевых и стволовых опухолевых клетках и усиливают их резистентность к химиопрепаратам, в том числе темозоломиду (Peignan et al., 2011; Coyle et al., 2015; de Gooijer et al., 2018; Wang et al., 2019).
В наших исследованиях в отношении одного из генов – ABCC1 (MRP1) – изменения экспрессии в резистентных клетках не отмечено, тогда как в отношении экспрессии двух других генов были получены противоположные результаты. В резистентных клетках А172 было отмечено существенное повышение активности ABCB1 (MDR1) и ABCG2 (BCRP), а в резистентных клетках R1, напротив, – выраженное снижение по сравнению с интактными клетками.
Важная роль в процессе канцерогенеза, в том числе глиомагенеза, отводится IL, в том числе IL-6 и IL-8 (Christofides et al., 2015; Goutnik, Lucke-Wold, 2022). Иммуногистохимические исследования показали, что клетки глиобластом могут экспрессировать оба этих цитокина (Christofides et al., 2015; Shan et al., 2015; Sharma et al., 2018). Уже давно проводится параллель между уровнем экспрессии IL-6 и IL-8 и степенью злокачественности глиомы (Rolhion et al., 2001; Brat et al., 2005; Samaras et al., 2009), однако многие вопросы до сих пор остаются не выясненными. IL-6 играет важную роль в процессах регулирования клеточного цикла (Xu et al., 2014). Он способствует пролиферации опухолевых клеток по пути JAK/STAT (Mostofa et al., 2017), активируя белок STAT3, ответственный за рост, пролиферацию, дифференцировку и апоптоз. Выявлена корреляция между уровнем мРНК IL-6 и степенью злокачественности глиомы (Wang et al., 2009). Повышенный уровень сывороточного IL-6 наблюдается у значительного числа пациентов и коррелирует с плохим прогнозом и повышенной агрессивностью заболевания (Tchirkov et al., 2007; Christofides et al., 2015).
Высокая экспрессия IL-8 ассоциирована с плохим прогнозом при раке поджелудочной железы, молочной железы, яичников, легкого, простаты и мочевого пузыря (Ha et al., 2017). При глиобластоме наблюдается аналогичная тенденция (Sharma et al., 2017). Показано, что IL-8 усиливает пролиферацию и инвазию опухолевых клеток, кроме того он является мощным ангиогенным фактором (Sharma et al., 2018). Zhang с соавторами (2015) наблюдали высокую экспрессию IL-8 примерно в 80% образцов ткани опухоли. При этом было показано, что IL-8 усиливает рост глиомы, связываясь аутокринным способом с рецептором CXCR1 на поверхности клеток (Sharma et al., 2017). В настоящее время IL-6 и IL-8 рассматривают в качестве возможных прогностических маркеров течения заболевания (Shan et al., 2015; Bunevicius et al., 2018; Shrivastava et al., 2022).
Мы показали, что клетки А172 обладают невысоким уровнем секреции IL-6 и IL-8, что согласуется с данными других исследователей (Yuhas et al, 2015). Однако в клетках R1, ранее не изученных в этом отношении, был выявлен чрезвычайно высокий уровень экспрессии как генов, так и белков IL-6 и IL-8. Нам не известны работы, в которых клеточные линии глиобластом демонстрировали бы подобный высокий уровень IL-6 и IL-8. При этом в резистентных клетках R1 он был существенно ниже, чем в интактных. В клетках линии А172 с изначально более низким уровнем экспрессии как генов, так и белков IL-6 и IL-8, эти показатели, напротив, значимо возрастали. Таким образом, в клетках линий А172 и R1, восстановивших пролиферацию после обработки темозоломидом, нами были выявлены разнонаправленные изменения продукции IL-6 и IL-8 и экспрессии кодирующих их генов.
Аналогичная тенденция прослеживалась и в отношении экспрессии гена фактора роста эндотелия сосудов (VEGF), роль которого в стимулировании роста опухолей хорошо документирована (Vimalraj, 2022), а также гена гепатоцитарного ростового фактора (HGF), участвующего в процессах регуляции клеточного цикла, дифференцировки, морфогенеза и апоптоза (Phan et al., 2015; Barzaman et al., 2022).
Таким образом, в потомстве наиболее резистентных к темозоломиду клеток линий А172 и R1 мы наблюдали увеличенную экспрессию гена MGMT, что может служить причиной более высокой устойчивости этих клеток к препарату. Однако в отношении прочих исследованных генов в клетках линий А172 и R1 были отмечены разнонаправленные тенденции. В резистентных клетках А172 экспрессия большинства исследованных генов, связанных с устойчивостью к химиотерапии и более агрессивным течением заболевания, ожидаемо увеличивалась, а в резистентных клетках R1, напротив, снижалась.
Полученные нами результаты подтверждают значимость MGMT в формировании резистентности к темозоломиду. Однако прогностическая ценность прочих обсуждаемых показателей представляется неоднозначной. Ранее было показано, что разработанные специфические ингибиторы MDR1 (АВСВ1), зосуковидар и тариквидар, не дали преимущества в терапии рака молочной железы в комбинации с антрациклинами и таксанами (Pusztai et al., 2005; Ruff et al., 2009). Неудачу этого подхода, по мнению Волкова (2021), можно объяснить тем, что выброс химиопрепаратов АВС-переносчиками не играет определяющей роли, а также возможностью компенсировать блокировку одного белка-транспортера активностью других. Ценность предиктивной значимости экспрессии IL-6 и IL-8 также остается неоднозначной. Для уточнения этого вопроса несомненна ценность клеточной линии R1, клетки которой на высоком уровне экспрессируют IL-6 и IL-8.
Итак, нами проведено сравнительное изучение действия темозоломида на хорошо известную линию глиобластомы А172 и на новую линию R1. Исследование клеточных популяций, которые явились потомками наиболее резистентных к темозоломиду клеток, показало, что они обладают молекулярным профилем, существенно отличающимся от молекулярного профиля исходных линии глиобластом A172 и R1.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена в рамках Госзадания “Изучение резистентных опухолевых клеток на культурах глиобластом при моделировании стереотаксической радиохирургии рецидивирующей глиобластомы” ФГБУ “РНЦРХТ им. акад. А.М. Гранова” (Санкт-Петербург, Россия).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Процедуры проводили в соответствии с нормативными требованиями научно-исследовательского этического комитета Российского научного центра радиологии и хирургических технологий им. акад. А.М. Гранова.
ВКЛАД АВТОРОВ
А.А Пиневич, Н.Л. Вартанян, А.В. Карташев, М.П. Самойлович: идея работы, ее планирование. А.А. Пиневич, М.П. Самойлович: культивирование клеток. Н.Л. Вартанян: выделение РНК, проведение ПЦР. Л.Н. Киселева: иммуноцитохимия. Ж.Ю. Сидорова, С.П. Свитина: определение статуса метилирования гена MGMT. И.В. Смирнов: иммуноферментный анализ. А.А. Пиневич, Н.Л. Вартанян, М.П. Самойлович: обработка результатов, написание текста, подготовка иллюстраций. Все авторы принимали участие в обсуждении результатов.
Список литературы
Волков Н.М. 2021. Резистентность к химиотерапии – исчерпаны ли возможности? Практическая онкология. Т. 22. № 2. С. 99. (Volkov N.M. 2021. Cancer resistance to chemotherapy – are all possibilities exhausted? Pract. Oncol. V. 22. № 2. P. 105.)
Гриффитс Б. 1989. Культура животных клеток. Методы. С. 56. (Griffits B. 1989. Animal cell culture. Methods. P. 56.)
Киселева Л.Н., Карташев А.В., Вартанян Н.Л., Пиневич А.А., Самойлович М.П. 2016. Характеристика клеточных линий А172 и T98G. Цитология. Т. 58. № 5. С. 349. (Kiseleva L.N., Kartashev A.V., Vartanyan N.L., Pinevich A.A., Samoilovich M.P. 2016. A172 and T98G cell lines characteristics. Cell Tiss. Biol. V. 10. № 5. P. 341.)
Киселева Л.Н., Карташев А.В., Вартанян Н.Л., Пиневич А.А., Самойлович М.П. 2018. Действие фотемустина на клетки линий глиобластом человека. Цитология. Т. 60. № 1. С. 21. (Kiseleva L.N., Kartashev A.V., Vartanyan N.L., Pinevich A.A., Samoilovich M.P. 2018. The effect of f-otemustine on human glioblastoma cell lines. Cell Tiss. Biol. V. 12. № 2. P. 93.)
Киселева Л.Н., Карташев А.В., Вартанян Н.Л., Пиневич А.А., Филатов М.В., Самойлович М.П. 2017. Характеристика новых клеточных линий глиобластом человека. Цитология. Т. 59. № 10. С. 669. (Kiseleva L.N., Kartashev A.V., Vartanyan N.L., Pinevich A.A., Filatov M.V., Samoilovich M.P. 2018. Characterization of new human glioblastoma cell lines. Cell Tiss. Biol. V. 12. № 1. P. 1.)
Кит О.И., Водолажский Д.И., Расторгуев Э.Е., Франциянц Е.М., Поркшеян Д.Х., Панина С.Б. 2017. Мультиформная глиобластома: патогенез и молекулярные маркеры. Вопросы онкологии. Т. 63. № 5. С. 694. (Kit O.I., Vodolazhsky D.I., Rastorguev E.Е., Frantsiyants Е.М., Porksheyan D.Kh., Panina S.B. 2017. Glioblastoma multiforme: pathogenesis and molecular markers. Voprosy Oncologii. V. 63. № 5. P. 694.)
Мацко М.В., Мацко Д.Е., Волков Н.М., Улитин А.Ю., Моисеенко В.М., Имянитов Е.Н., Иевлева А.Г. 2019. Морфологические и молекулярно-генетические особенности первичных глиобластом у пациентов с необычно высокой продолжительностью жизни. Сибирский онкол. журнал. Т. 18. № 3. С. 34. (Matsko M.V., Matsko D.E., Volkov N.M., Ulitin A.Yu., Moiseenko V.M., Imyanitov E.N., Iyevleva A.G. 2019. Morphologic and molecular features of primary glioblastoma in patients surviving more than 3 years. Siberian J. Oncol. V. 18. № 3. P. 34.)
Пиневич А.А., Бодэ И.И., Вартанян Н.Л., Киселева Л.Н., Карташев А.В., Самойлович М.П. 2022. Клетки глиобластом человека линий T2 и T98G, резистентные к действию темозоломида. Цитология. Т. 64. № 2. С. 126. (Pinevich A.A., Bode I.I., Vartanyan N.L., Kiseleva L.N., Kartashev A.V., Samoilovich M.P. 2022. Temozolomide-re-sistant human T2 and T98G glioblastoma cells. Cell Tiss. Biol. V. 16. № 4. P. 126.)
Тягунова Е.Е., Захаров А.С., Костин Р.К., Шлапакова Т.И., Тягунова Т.Е., Захарова Ю.А., Малюгин Д.А. 2022. Особенности химио- и радитерапии пациентов с глио-бластомой. Медицинский альманах. № 1(70). С. 49. (Tyagunova E.E., Zakharov A.S., Kostin R.K., Shlapakova T.I., Tyagunova T.E., Zakharova Y.A., Malyugin D.A. 2022. Features of chemo- and radiotherapy for patients with glioblastoma. Medicinskij Al’manah. № 1(70). P. 49.)
Юкальчук Д.Ю., Пономаренко Д.М., Снетков Е.В., Юкальчук Т.Н., Шевчук А.В., Демченкова М.В., Шелехов А.В. 2016. Применение парентеральной формы препарата Темодал® (темозоломид) в терапии глиобластом. Эффективная фармакотерапия. Т. 8. С. 46. (Yukalchuk D.Yu., Ponomarenko D.M., Snetkov Ye.V., Yukalchuk T.N., Shevchuk A.V., Demchenkova M.V., Shelekhov A.V. 2016. Use of parenteral Temodal® (temozolomide) in therapy of glioblastoma. Effectivnaya pharmacotherapiya. V. 8. P. 46.)
Barzaman K., Vafaei R., Samadi M., Kazemi M.H., Hossei-nzadeh A., Merikhian P., Moradi-Kalbolandi S., Eisavand M.R., Dinvari H., Farahmand L. 2022. Anti-cancer therapeutic strategies based on HGF/MET, EpCAM, and tumor-stromal cross talk. Cancer Cell Int. V. 22. P. 259. https://doi.org/10.1186/s12935-022-02658-z
Borst P., Evers R., Kool M., Wijnholds J. 2000. A family of drug transporters: the multidrug resistance-associated proteins. J. Natl. Cancer Inst. V. 92. P. 1295–1302. https://doi.org/10.1093/jnci/92.16.1295
Brat D.J., Bellail A.C., Van Meir E.G. 2005. The role of interle-ukin-8 and its receptors in gliomagenesis and tumoral angiogenesis. Neuro Oncol. V. 7. P. 122–133. https://doi.org/10.1215/S1152851704001061
Braun K., Ahluwalia S. 2017. Treatment of glioblastoma in older adults. Curr. Oncol. Rep. V. 19. P. 81. https://doi.org/10.1007/s11912-017-0644-z
Bunevicius A., Radziunas A., Tamasauskas S., Tamasauskas A., Laws E.R., Iervasi G., Bunevicius R., Deltuva V. 2018. Prognostic role of high sensitivity C-reactive protein and interleukin-6 in glioma and meningioma patients. Neurooncol. V. 138. P. 351. https://doi.org/10.1007/s11060-018-2803-y
Campos B., Olsen L.R., Urup T., Poulsen H.S. 2016. A comprehensive profile of recurrent glioblastoma. Oncogene. V. 35. P. 5819. https://doi.org/10.1038/onc.2016.85
Christians A., Hartmann C., Benner A., Meyer J., von Deimling A., Weller M., Wick W., Weiler M. 2012. Prognostic value of three different methods of MGMT promoter methylation analysis in a prospective trial on newly diagnosed gliobla-stoma. PLoS One. V. 7. https://doi.org/10.1371/journal.pone.0033449
Christofides A., Kosmopoulos M., Piperi C. 2015. Pathophysiological mechanisms regulated by cytokines in gliomas. C-ytokine. V. 71. P. 377. https://doi.org/10.1016/j.cyto.2014.09.008
Coyle B., Kessler M., Sabnis D.H., Kerr I.D. 2015. ABCB1 in children’s brain tumors. Biochem. Soc. Trans. V. 43. P. 1018. https://doi.org/10.1042/BST20150137
Daniel P., Sabri S., Chaddad A., Meehan B., Jean-Claude B., Rak J., Abdulkarim B.S. 2019. Temozolomide induced hypermutation in glioma: evolutionary mechanisms and therapeutic opportunities. Front. Oncol. V. 9. P. 41. https://doi.org/10.3389/fonc.2019.00041
Feldheim J., Kessler A.F., Feldheim J.J., Schulz E., Wend D., Lazaridis L, Kleinschnitz C., Glas M., Ernestus R.-I., Brandner S., Monoranu C.M, Löhr M., Hagemann C. 2022. Effects of long-term temozolomide treatment on glio-blastoma and astrocytoma WHO grade 4 stem-like cells. Int. J. Mol. Sci. V. 23. P. 5238. https://doi.org/10.3390/ijms23095238
Giard D.J., Aaronson S.A., Todaro G.J., Arnstein P., Kersey J.H., Dosik H., Parks W.P. 1973. In vitro cultivation of human t-umors: establishment of cell lines derived from a series of solid tumors. J. Nat. Cancer Inst. V. 51. P. 1417. https://doi.org/10.1093/jnci/51.5.1417
de Gooijer M.C., de Vries N.A., Buckle T., Buil L.C.M., Beijnen J.H., Boogerd W., van Tellingen O. 2018. Improved brain pene-tration and antitumor efficacy of temozolomide by inhibition of ABCB1 and ABCG2. Neoplasia. V. 20. P. 710. https://doi.org/10.1016/j.neo.2018.05.001
Gottesman M.M., Fojo T., Bates S.E. 2002. Multidrug resistance in cancer: role of ATP-dependent transporters. Nat. Rev. Cancer. V. 2. P. 48. https://doi.org/10.1038/nrc706
Goutnik M., Lucke-Wold B. 2022. Commentary: evaluating potential glioma serum biomarkers, with future applications. World J. Clin. Oncol. V. 13. P. 412. https://doi.org/10.5306/wjco.v13.i5.412
Ha H., Debnath B., Neamati N. Role of the CXCL8-CXCR1/2 axis in cancer and inflammatory diseases. Theranostics. V. 7. P. 1543. https://doi.org/10.7150/thno.15625
Hegi M.E., Diserens A.-C., Gorlia T., Hamou M.-F., de Tribolet N., Weller M., Kros J.M., Hainfellner J.A., Mason W., Mariani L., Bromberg J.E.C., Hau P., Mirimanoff R.O., Cairncross J.G., Janzer R.C., Stupp R. 2005. MGMT gene silencing and benefit from temozolomide in glioblastoma. N. Engl. J. Med. V. 352. P. 997. https://doi.org/10.1056/NEJMoa043331
Herman J.G., Graff J.R., Myöhänen S., Nelkin B.D., Baylin S.B. 1996. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. Proc. Natl. Acad. Sci. USA. V. 93. P. 9821. https://doi.org/10.1073/pnas.93.18.9821
Hermisson M., Klumpp A., Wick W., Wischhusen J., Nagel G., Roos W., Kaina B., Weller M. 2006. O6-methylguanine DNA methyltransferase and p53 status predict temozolomide sensitivity in human malignant glioma cells. J. N-eurochem. V. 96. P. 7666. https://doi.org/10.1111/j.1471-4159.2005.03583.x
Kathawala R.J., Gupta P., Ashby C.R., Chen Z.-S. 2015. The modulation of ABC transporter-mediated multidrug resistance in cancer: a review of the past decade. Drug Resist. Updat. V. 18. P. 1. https://doi.org/10.1016/j.drup.2014.11.002
Kim H., Zheng S., Amini S.S., Virk S.M., Mikkelsen T., Brat D.J., Grimsby J., Sougnez C., Muller F., Hu J., Sloan A.E., C-ohen M.L., Van Meir E.G., Scarpace L., Laird P.W., et al. 2015. Whole-genome and multisector exome sequencing of primary and post-treatment glioblastoma reveals patterns of tumor evolution. Genome Res. V. 25. P. 16. https://doi.org/10.1101/gr.180612.114
Kinashi Y., Ikawa T., Takahashi S. 2020. The combined effect of neutron irradiation and temozolomide on glioblastoma cell lines with different MGMT and P53 status. Appl. R-adiat. Isot. V. 163. P. 109204. https://doi.org/10.1016/j.apradiso.2020.109204
Kristensen L.S., Hansen L.L. 2009. PCR-based methods for detecting single-locus DNA methylation biomarkers in cancer diagnostics, prognostics, and response to treatment. Clin. Chem. V. 55. P. 1471. https://doi.org/10.1373/clinchem.2008.121962
Lee S.Y. 2016. Temozolomide resistance in glioblastoma multiforme. Genes Dis. V. 3. P. 198. https://doi.org/10.1016/j.gendis.2016.04.007
Li Z., Li M., Xia P., Lu Z. 2022. HOTTIP mediated therapy re-sistance in glioma cells involves regulation of EMT-related miR-10b. Front. Oncol. V. 12. P. 873561. https://doi.org/10.3389/fonc.2022.873561
Livak K.J., Schmittgen T.D. 2001. Analysis of relative gene ex-pression data using real-time quantitative PCR and the 2–Delta Delta C(T)) method. Methods. V. 25. P. 402. https://doi.org/10.1006/meth.2001.1262
Louis D.N., Perry A., Reifenberger G., von Deimling A., Figarella-Branger D., Cavenee W.K., Ohgaki H., Wiestler O.D., Kleihues P., Ellison D.W. 2016. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathol. V. 131. P. 803. https://doi.org/10.1007/s00401-016-1545-1
Lu V.M, Jue T.R., McDonald K.L., Rovin R.A. 2018. The sur-vival effect of repeat surgery at glioblastoma recurrence and its trend: a systematic review and meta-analysis. World Neurosurg. V. 115. P. 453. https://doi.org/10.1016/j.wneu.2018.04.016
Marucci G., Fabbri P.V., Morandi L., Biase D.D., Oto E.D., Tallini G., Sturiale C., Franceschi E., Frezza G.P., Foschi-nin M.P. 2015. Pathological spectrum in recurrences of glioblastoma multiforme. Pathologica. V. 107. P. 1.
Matsko M.V., Imaynitov E.N. 2015. Predictive role of O6-meth-ylguanine DNA methyltransferase status for the treatment of brain tumors. Epigen. Terr. Cancer. P. 251. https://doi.org/10.1007/978-94-017-9639-2_9
Mirzayans R., Murray D. 2020. Intratumor heterogeneity and therapy resistance: contributions of dormancy, apoptosis reversal (anastasis) and cell fusion to disease recurrence. Int. J. Mol. Sci. V. 15. P. 1308. https://doi.org/10.3390/ijms21041308
Mostofa A.G.M., Punganuru S.R., Madala H.R., Al-Obaide M., Srivenugopal K.S. 2017. The process and regulatory com-ponents of inflammation in brain oncogenesis. Biomolecules. P. 7. P. 34. https://doi.org/10.3390/biom7020034
Oliva C.R., Nozell S.E., Diers A., McClugage 3rd S.G., Sarkaria J.N., Markert J.M., Darley-Usmar V.M., Bailey S.M., Gillespie G.Y., Landar A., Griguer C.E. 2010. Acquisition of temozolomi-de chemoresistance in gliomas leads to remodeling of mitochondrial electron transport chain. J. Biol. Chem. V. 285. P. 39759. https://doi.org/10.1074/jbc.M110.147504
Pegg A.E, Byers T.L. 1992. Repair of DNA containing O6-alkylguanine. FASEB J. V. 6. P. 2302. https://doi.org/10.1096/fasebj.6.6.1544541
Peignan L., Garrido W., Segura R., Melo R., Rojas D., Carcamo J.G., San Martin R., Quezada C. 2011. Combined use of anticancer drugs and an inhibitor of multiple drug resistance-as-sociated protein-1 increases sensitivity and decreases survival of glioblastoma multiforme cells in vitro. Neurochem. Res. V. 36. P. 1397. https://doi.org/10.1007/s11064-011-0464-8
Perazzoli G., Prados J., Ortiz R., Caba O., Cabeza L., Berdasco M., Gonzalez B., Melguizo C. 2015. Temozolomide resistance in glioblastoma cell lines: implication of MGMT, MMR, P-glycoprotein and CD133 expression. PLoS One. V. 10. P. e0140131. https://doi.org/10.1371/journal.pone.0140131
Phan L.M., Fuentes-Mattei E., Wu W., Velazquez-Torres G., Sircar K., Wood C.G., Hai T., Jimenez C., Cote G.J., Ozsari L., Hofmann M.-C., Zheng S., Verhaak R., Pagliaro L., Cortez M.A. et al. 2015. Hepatocyte growth factor/cMET pathway activation enhances cancer hallmarks in adrenocortical carcinoma. Cancer Res. V. 75. P. 4131. https://doi.org/10.1158/0008-5472.CAN-14-3707
Pusztai L., Wagner P., Ibrahim N., Rivera E., Theriault R., Booser D., Symmans F.W., Wong F., Blumenschein G., Fl-eming D.R., Rouzier R., Boniface G., Hortobagyi G.N. 2005. Phase II study of tariquidar, a selective P-glycoprotein inhibitor, in patients with chemotherapy-resistant, advanced breast carcinoma. Cancer. V. 104. P. 682. https://doi.org/10.1002/cncr.21227
Rabe M., Dumont S., Alvarez–Arenas A., Janati H., Belmonte-Beitia J., Calvo G.F., Thibault-Carpentier C., Sery Q., Chauvin C., Joalland N., Briand F., Blandin S., Scotet E., Pecqueur C., Clairambault J. et al. 2020. Identification of a transient state during the acquisition of temozolomide re-sistance in glioblastoma. Cell Death Dis. V. 11. P. 19. https://doi.org/10.1038/s41419-019-2200-2
Rolhion C., Penault–Llorca F., Kemeny J.L., Lemaire J.J., Jullien C., Labit-Bouvier C., Finat-Duclos F., Verrelle P. 2001. Interleukin-6 overexpression as a marker of malignancy in human gliomas. J. Neurosurg. V. 94. P. 97. https://doi.org/10.3171/jns.2001.94.1.0097
Ruff P., Vorobiof D.A, Jordaan J.P., Demetriou G.S., Moodley S.D., Nosworthy A.L., Werner I.D., Raats J., Burgess L.J. 2009. A randomized, placebo-controlled, double-blind phase 2 study of docetaxel compared to docetaxel plus zosuquidar (LY335979) in women with metastatic or locally recurrent breast cancer who have received one prior chemotherapy regimen. Cancer Chemother. Pharmacol. V. 64. P. 763. https://doi.org/10.1007/s00280-009-0925-9
Samaras V., Piperi C., Levidou G., Zisakis A., Kavantzas N., Themistocleous M.S, Boviatsis E.I., Barbatis C., Lea R.W., Kalofoutis A., Korkolopoulou P. 2009. Analysis of int-erleukin (IL)-8 expression in human astrocytomas: associations with IL-6, cyclooxygenase-2, vascular endothelial growth factor, and microvessel morphometry. Hum. Immunol. V. 70. P. 391. https://doi.org/10.1016/j.humimm.2009.03.011
Shan Y., He X., Song W., Han D., Niu J., Wang J. 2015. Role of IL-6 in the invasiveness and prognosis of glioma. Int. J. Clin. Exp. Med. V. 8. P. 9114.
Sharma I., Singh A., Sharma K.C., Saxena S. 2017. Gene ex-pression profiling of chemokines and their receptors in low and high grade astrocytoma. Asian Pac. J. Cancer Prev. V. 18. P. 1307. https://doi.org/10.22034/APJCP.2017.18.5.1307
Sharma I., Singh A., Siraj F., Saxena S. 2018. IL-8/CXCR1/2 signalling promotes tumor cell proliferation, invasion and vascular mimicry in glioblastoma. J. Biomed. Sci. V. 25. P. 62. https://doi.org/10.1186/s12929-018-0464-y
Shrivastava R., Gandhi P., Gothalwal R. 2022. The road-map for establishment of a prognostic molecular marker panel in glioma using liquid biopsy: current status and future directions. Clin. Transl. Oncol. V. 24. P. 1702. https://doi.org/10.1007/s12094-022-02833-8
Soni V., Adhikari M., Lin L., Sherman J.H., Keidar M. 2022. Theranostic potential of adaptive cold atmospheric plasma with temozolomide to checkmate glioblastoma: an in vitro study. Cancers. V. 14. P. 3116. https://doi.org/10.3390/cancers14133116
Strobel H., Baisch T., Fitzel R., Schilberg K., Siegelin M.D., Karpel-Massler G., Debatin K.-M., Westhoff M.-A. 2019. Te-mozolomide and other alkylating agents in glioblastoma therapy. Biomedicines. V. 7. P. 69. https://doi.org/10.3390/biomedicines7030069
Tchirkov A., Khalil T., Chautard E., Mokhtari K., Veronese L., Irthum B., Vago P., Kemeny J.-L., Verrelle P. 2007. In-terleukin-6 gene amplification and shortened survival in glioblastoma patients. Br. J. Cancer. V. 96. P. 474. https://doi.org/10.1038/sj.bjc.6603586
Thomas A., Tanaka M., Trepel J., Reinhold W. C., Rajapakse V. N., Pommier Y. 2017. Temozolomide in the era of precision medicine. Cancer Res. V. 77. P. 823. https://doi.org/10.1158/0008-5472.CAN-16-2983
Tiek D.M., Rone J.D., Graham G.T., Pannkuk E.L., Haddad B.R., Riggins R.B. 2018. Alterations in cell motility, proliferation, and metabolism in novel models of acquired temozolomide resistant glioblastoma. Sci. Rep. V. 8. P. 7222. https://doi.org/10.1038/s41598-018-25588-1
Vimalraj S. 2022. A concise review of VEGF, PDGF, FGF, Notch, angiopoietin, and HGF signalling in tumor angiogenesis with a focus on alternative approaches and future directions. Int. J. Biol. Macromol. V. 221. P. 1428. https://doi.org/10.1016/j.ijbiomac.2022.09.129
Wang D., Wang C., Wang L., Chen Y. 2019. A comprehensive review in improving delivery of small-molecule chemotherapeutic agents overcoming the blood−brain/brain t-umor barriers for glioblastoma treatment. Drug Deliv. V. 26. P. 551. https://doi.org/10.1080/10717544.2019.1616235
Wang H., Lathia J.D., Wu Q., Wang K., Li Z., Heddleston J.M., Eyler C.E., Elderbroom J., Gallagher J., Schuschu J., MacSwords J., Cao Y., McLendon R.E., Wang X.-F., Hjelmeland A.B., Rich J.N. 2009. Targeting interleukin 6 signaling suppresses glioma stem cell survival and tumor growth. Stem Cells. V. 27. P. 2393. https://doi.org/10.1002/stem.188
Xia Q., Liu L., Li Y., Zhang P., Han D., Dong L. 2021. Ther-peutic perspective of temozolomide resistance in gli-oblastoma treatment. Cancer Invest. V. 39. P. 627. https://doi.org/10.1080/07357907.2021.1952595
Xu B., Yu D.-M., Liu F.-S. 2014. Effect of siRNA induced in-hibition of IL-6 expression in rat cerebral gliocytes on cerebral edema following traumatic brain injury. Mol. Med. Rep. V. 10. P. 1863. https://doi.org/10.3892/ mmr.2014.2462
Yuhas Y., Ashkenazi S., Berent E., Weizman A. 2015. Immunomodulatory activity of ketamine in human astroglial A172 cells: possible relevance to its rapid antidepressant activity. Neuroimmunol. V. 282. P. 33. https://doi.org/10.1016/j.jneuroim.2015.03.012
Zhang B., Shi L., Lu S., Sun X., Liu Y., Li H., Wang X., Zhao C., Zhang H., Wang Y. 2015. Autocrine IL-8 promotes F-actin polymerization and mediate mesenchymal transition via ELMO1-NF-kB-Snail signaling in glioma. Cancer Biol. Ther. V. 16. P. 898. https://doi.org/10.1080/ 15384047.2015.1028702
Zhu Y., Chen Z., Kim S.N., Gan C., Ryl T., Lesjak M.S., Rodemerk J., Zhong R.D., Wrede K., Dammann P., Sure U. 2022. Characterization of temozolomide resistance using a novel acquired resistance model in glioblastoma cell lines. Cancers (Basel). V. 14. P. 2211. https://doi.org/10.3390/cancers14092211
Дополнительные материалы отсутствуют.


