Цитология, 2023, T. 65, № 2, стр. 157-169
Влияние гипоксии и макромолекулярных краудеров на продукцию внеклеточного матрикса мезенхимными стромальными клетками эндометрия человека
И. Е. Перевозников 1, *, Р. Е. Ушаков 1, Е. Б. Бурова 1
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: ilyaperevoznikov@gmail.com
Поступила в редакцию 01.10.2022
После доработки 12.10.2022
Принята к публикации 28.10.2022
- EDN: LYQSER
- DOI: 10.31857/S0041377123020074
Аннотация
Последние десятилетия отмечены интенсивным развитием биологии внеклеточного матрикса (ВКМ), контролирующего основные клеточные функции – от пролиферации и дифференцировки до миграции и апоптоза. Биоактивные свойства ВКМ открывают широкие перспективы его использования в биоинженерии и регенеративной медицине. В этом контексте ключевой технологией является получение ВКМ путем децеллюляризации органов, тканей или клеточных культур. Проблема быстрой наработки больших количеств биоактивных ВКМ культивируемых клеток для медицинских целей представляется весьма актуальной; вместе с тем, в отношении эндометриальных мезенхимных стромальных клеток человека (эМСК) вопрос остается открытым. С целью оптимизации условий продукции ВКМ культивируемыми эМСК мы изучили влияние макромолекулярных соединений (краудеров) – фиколла и полиэтиленгликоля – на эффективность депонирования белков ВКМ в зависимости от времени, концентрации и молекулярного веса краудеров в условиях нормоксии и гипоксии. Как показано методом иммунофлуоресценции, фиколл 400 наиболее эффективен для наработки ключевых компонентов матрикса – фибронектина, коллагена IV типа и в меньшей степени коллагена III типа. При сравнении нормоксических (20% О2) и гипоксических (3% О2) условий культивирования выявлено, что клетки продуцируют ВКМ с более развитой структурой при пониженной концентрации кислорода; существенно, что в этих условиях фиколл 400 способствует депонированию ВКМ только при низком содержании сыворотки в ростовой среде. Суммируя, можно заключить, что сочетание гипоксии, фиколла 400 и низкого содержания сыворотки в ростовой среде обеспечивает оптимальный способ продукции ВКМ. Мы впервые продемонстрировали феномен макромолекулярного краудинга в контексте улучшения депонирования и организации структуры ВКМ у эМСК.
Использование мезенхимных стромальных клеток (МСК) в тканевой инженерии и регенеративной медицине благодаря их способности к самообновлению, мультипотентности, стабильности кариотипа и секреторному фенотипу открывает широкие возможности для лечения кардиоваскулярных и ревматических болезней, костных заболеваний, повреждений нейронов, воспалительных процессов в легких, диабета и т.д. (Maumus et al., 2013; Konala et al., 2016; Cunningham et al., 2018; Xu et al., 2019; Rolandsson Enes et al., 2021).
В настоящее время в научной среде доминирует точка зрения, что терапевтический эффект трансплантированных МСК связан с их паракринным действием благодаря секретируемым факторам, которые поддерживают процессы регенерации в поврежденных тканях, индуцируют ангиогенез и модулируют иммунную систему. С другой стороны, как известно, основные клеточные функции контролирует внеклеточный матрикс (ВКМ), являющийся основным компонентом микроокружения клеток и принимающий непосредственное участие в формировании клеточной (тканевой) ниши (Lin et al., 2012; Rao Pattabhi et al., 2014; Xing et al., 2020).
ВКМ представляет собой трехмерную молекулярную сеть, занимающую пространство между клетками во всех тканях организма, причем его состав и свойства сильно варьируют. Основными компонентами ВКМ являются структурные белки – коллагены, гликопротеины и протеогликаны (Hynes, 2009; Naba et al., 2012; Матвеева, Андреева, 2020); кроме того, ВКМ выполняет функцию депо для ряда морфогенов и факторов роста (Discher et al., 2009). ВКМ вовлечен в регуляцию важнейших клеточных процессов, таких как дифференцировка, пролиферация, миграция клеток, проведение внеклеточных сигналов, апоптоз и морфогенез (Rozario, DeSimone, 2010; Clause, Barker, 2013; Assunção et al., 2020; Xing et al., 2020). Влияние на столь широкий спектр функций происходит благодаря взаимодействию с различными мембранно-связанными клеточными рецепторами, в первую очередь интегринами. Реагируя на сигналы от ВКМ, клетки, в свою очередь, способны ремоделировать матрикс (Ahmed, Ffrench-Constant, 2016). Осуществляется это за счет сериновых и цистеиновых протеаз, а также матриксных металлопротеиназ, которые могут как участвовать в деградации белков ВКМ, так и высвобождать депонированные в нем факторы роста, в частности TGF-β (Schaefer, 2010). Таким образом, взаимодействие клеток и ВКМ является двунаправленным.
Одним из способов получения ВКМ является децеллюляризация тканей, однако при использовании такого матрикса возникает опасность иммунного отторжения в случае неполного удаления клеток (Massaro et al., 2021); кроме того, следует учитывать сложность децеллюляризации некоторых тканей, особенно ниш стволовых клеток (Assunção et al., 2020). В качестве альтернативы используются синтетические двумерные и трехмерные скаффолды, покрытые отдельными белками ВКМ (Yang et al., 2020), либо подложки из смеси белков, входящих в состав ВКМ. В последние годы повышенный интерес научного сообщества вызывает исследование матриксов клеточного происхождения в связи с их существенными преимуществами перед синтетическими аналогами: уникальная биосовместимость, сохранение архитектуры и биохимических свойств ткани (Hoshiba et al., 2010; Nellinger et al., 2022), возможность скрининга популяции исходных клеток-продуцентов и контроля за условиями наработки ВКМ (Li et al., 2020; Antich et al., 2021). Децеллюляризованные ВКМ клеточного происхождения находят применение в качестве модели для изучения взаимодействий матрикс–клетка, а также выступают основой для разработки биосовместимых скаффолдов.
Однако широкое применение ВКМ клеточного происхождения ограничено низкой скоростью и эффективностью его наработки in vitro, а также невысокой физико-механической прочностью по сравнению с нативным ВКМ тканей. Решение первой проблемы связано с созданием масштабного производства ВКМ со специальной инфраструктурой, для чего потребуется разработка нового оборудования и вложение определенных денежных средств. Вторая проблема, в принципе, может быть решена путем введения специальных сшивок в структуру ВКМ (Nyambat et al., 2020). Принимая во внимание возникающие сложности в обоих случаях, на сегодняшний день не теряет актуальности поиск способов увеличения скорости депонирования ВКМ культивируемыми клетками (Assunção et al., 2020).
Среди факторов, которые могут влиять на продукцию ВКМ МСК, рассматривают рН, концентрацию О2, температуру, механические стимулы и регуляторные молекулы (Matveeva, Andreeva, 2020). С целью ускорения и усиления депонирования ВКМ в системах культивируемых клеток используют инертные высокополимерные вещества (краудеры); добавление таких макромолекул в ростовые среды имитирует существующее in vivo плотное внеклеточное пространство и позволяет ускорить, например, энзиматическую конверсию водорастворимого проколлагена в нерастворимый коллаген I типа – ключевую стадию образования коллагенового матрикса (Bateman et al., 1986; Lareu et al., 2007). Макромолекулярный краудинг – это биофизический феномен, связанный с объемом, исключаемым макромолекулами, поскольку они подвергаются стерическому отталкиванию и электростатическим взаимодействиям. Эффекты исключенного объема описываются величиной FVO (fraction volume occupancy), т.е. фракцией от общего объема, занимаемой краудером. Исключенный объем зависит от формы, размера, заряда и полидисперсности молекул. В отношении биологических систем это означает увеличение вероятности встречи ферментов с субстратом, что существенно ускоряет протекание биологических процессов (Cigognini et al., 2016), в том числе ферментативных реакций, ответственных за сборку и депонирование матрикса (Chen et al., 2011; Kuznetsova et al., 2014). К макромолекулярным краудерам (ММК) относятся такие различные по природе соединения, как фиколл (ficoll), гиалуроновая кислота (hyaluronic acid), каррагинан (carrageenan), сульфат декстрана (dextran sulphate), поливинилпирролидон (polyvinylpyrrolidone) (Gaspar et al., 2019; Tsiapalis, Zeugolis, 2021).
Другим подходом является культивирование клеток в условиях гипоксии. Для МСК концентрация О2 ниже атмосферного уровня является одним из наиболее важных физических факторов тканевого микроокружения (Buravkova et al., 2014). Адаптация МСК к гипоксическим условиям происходит благодаря активации HIF-1 (hypoxia inducible factor-1), который регулирует транскрипционную активность структурных компонентов ВКМ и ферментов его ремоделирования. Было показано, что в условиях гипоксии в матриксе МСК существенно повышается содержание фибронектина, коллагеновых белков и ангиогенных факторов (Cigognini et al., 2016; Du et al., 2017), причем добавление в ростовую среду краудеров (каррагинана и фиколла) при культивировании МСК из костного мозга при пониженном содержании кислорода также приводит к увеличению эффективности продукции белков ВКМ (Cigognini et al., 2016). Следовательно, совмещение условий гипоксии и макромолекулярного краудинга может представлять интерес для всестороннего исследования. Наряду с этим отмечали, что культивирование клеток в ростовой среде с низкой концентрацией сыворотки (около 1%) также может увеличивать скорость наработки компонентов ВКМ (Satyam et al., 2014; Kumar et al., 2015a, 2015b).
Представленная работа посвящена оптимизации условий депонирования компонентов внеклеточного матрикса мезенхимными стромальными клетками человека, выделенными из десквамированного эндометрия в менструальной крови (эМСК). Неинвазивный и легкодоступный источник эМСК обеспечивает широкомасштабные исследования in vitro. Благодаря высокой пролиферативной активности при длительном культивировании и генетической стабильности (Домнина и др., 2013), эти клетки могут быть перспективным источником ВКМ для изучения функциональной активности и потенциального применения децеллюляризованных ВКМ в регенеративной медицине. Как показывает анализ литературы, информация о применении краудеров различной природы с целью улучшения условий депонирования ВКМ культивируемыми МСК весьма ограничена. Так, в ряде работ было продемонстрировано, что макромолекулярный краудинг ускоряет депонирование и определяет архитектуру ВКМ, продуцированного МСК из костного мозга (Zeiger et al., 2012; Ang et al., 2014; Rashid et al., 2014; Prewitz et al., 2015); при этом использованные краудеры (фиколл, поливинилпирролидон и сульфат декстрана) повышали эффективность наработки коллагенов I–IV типов и фибронектина. В контексте эМСК, подобные работы до настоящего времени не были описаны в литературе.
Мы провели сравнительное исследование влияния макромолекулярных краудеров (фиколла и полиэтиленгликоля) на эффективность депонирования основных белков ВКМ – коллагена III и IV типов и фибронектина – в условиях нормоксии и гипоксии.
МАТЕРИАЛ И МЕТОДИКА
Характеристика клеток. Во всех экспериментах использовали эМСК человека, выделенные из десквамированного эндометрия в менструальной крови сотрудниками Лаборатории внутриклеточной сигнализации, ИНЦ РАН, на 10–11 пассаже (Земелько и др., 2011). Была подтверждена принадлежность выделенных эМСК к мезенхимным стромальным предшественникам с использованием минимальных критериев, предложенных ISTC (Dominici et al., 2006). Как было установлено (Земелько и др., 2011), используемые эМСК экспрессируют клеточные маркеры CD73, CD90, CD105, CD13, CD29 и CD44, но не обнаруживают поверхностных антигенов гемопоэтических клеток: CD19, CD34, CD45, CD117, CD130 и HLA-DR (класс II). Мультипотентность эМСК подтверждается их способностью дифференцироваться в различные мезодермальные типы клеток, такие как остеоциты и адипоциты. Кроме того, выделенные эМСК частично (более 50%) экспрессируют маркер плюрипотентности SSEA-4, но не экспрессируют Oct-4. Иммунофлуоресцентный анализ полученных клеток выявил экспрессию маркеров нейрональных предшественников нестина и бета-III-тубулина, что говорит об их нейрональной предрасположенности. эМСК характеризуются высокой скоростью пролиферации клеток (время удвоения 22–23 ч) и эффективностью колониобразования (около 60%).
Культивирование клеток. Клетки культивировали во флаконах Т25 и Т75 (Thermo Scientific, США) в полной ростовой среде (ПРС), содержащей среду DMEM/F12 (Gibco, США), 10% эмбриональной сыворотки (FBS) (HyClone, США), 1% PenStrep (Gibco, США) и 1% GlutaMAX (Gibco, США) при 37°C в атмосфере 5% CO2. Для проведения экспериментов в гипоксических условиях и в присутствии маркомолекулярных краудеров клетки трипсинизировали с помощью 0.05%-ного раствора трипсина и ЭДТА (Invitrogen, США) и рассевали по 200 тыс. клеток на покрытые 0.1%-ным раствором желатина чашки диаметром 35 мм (Thermo Scientific, США).
Нормоксические условия культивирования клеток. Через 3 сут после рассева клеток ПРС заменяли на среду, содержащую макромолекулярные краудеры в соответствующей концентрации. Краудеры растворяли в ростовой среде, содержащей 1% FBS и 0.2 мМ аскорбата натрия (Sigma, Германия), которую стерилизовали фильтрацией через мембрану 0.22 мкм непосредственно перед использованием. Аскорбат является необходимой добавкой для стабильной наработки ВКМ (Choi et al., 2008), выступая в роли антиоксиданта, а также кофактора ферментов лизилгидроксилазы и пролилгидроксилазы, участвующих в фибриллогенезе коллагена (Pinnell, 1985). Мы использовали тринатриевую соль 2-фосфо-L-аскорбиновой кислоты как стабильную форму аскорбата натрия с целью снижения частоты замены ростовой среды. В качестве контроля служили клетки, растущие в среде с содержанием FBS (1 или 10%) и 0.2 мМ аскорбата натрия. Клетки культивировали в течение 3 или 7 сут с момента добавления краудеров (или аскорбата натрия в случае контрольных клеток), заменяя среду на свежую каждые 3 сут. По окончании культивирования проводили децеллюляризацию с целью получения бесклеточного ВКМ.
Гипоксические условия культивирования клеток. После рассева клетки инкубировали в течение 1 сут в условиях нормоксии, затем чашки переносили в инкубатор с гипоксическими условиями (3% О2). Через 1 сут ПРС в чашках заменяли на среду, содержащую 50 мг/мл фиколла 400 и 1 или 10% FBS; все среды стерилизовали фильтрацией через мембрану 0.22 мкм непосредственно перед использованием. В качестве контроля служили клетки, растущие в условиях гипоксии в среде с содержанием FBS 1 или 10%. Все ростовые среды содержали 0.2 мМ аскорбата натрия. Клетки культивировали в течение 7 или 14 сут с момента добавления фиколла 400 (или аскорбата натрия в случае контрольных клеток), заменяя среду на свежую каждые 3 сут. По окончании инкубации проводили децеллюляризацию ВКМ.
Макромолекулярные краудеры. В качестве макромолекулярных краудеров для исследования мы выбрали фиколл 400 кДа (Pharmacia, Швеция), а также полиэтиленгликоль (ПЭГ) с молекулярной массой 2 (Merck, США), 4 и 6 кДа (Ferak Berlin, Германия). При расчете рабочих концентраций взяли за основу ПЭГ 4 кДа в концентрации 50 мг/мл, который способствовал повышению скорости процессинга проколлагена I в коллаген и накоплению последнего (Bateman et al., 1986). Согласно расчету по приведенной ниже формуле, фракционный объем (FVO), занимаемый ПЭГ в концентрации 50 мг/мл, составляет 12.9%. Для вычисления FVO использовали гидродинамический радиуc, который занимает 1 молекула ПЭГ 4 кДа в растворе. Значения гидродинамических радиусов были взяты из источников литературы (Kuznetsova et al., 2014; Dong et al., 2018): 1.6 нм (ПЭГ 4 кДа), 2.08 нм (ПЭГ 6 кДа) и 8 нм (фиколл 400 кДа). На основе этих данных была рассчитана концентрация для ПЭГ 6 кДа (35 мг/мл), соответствующая FVO = 12.9%. Расчет проводили по формуле, созданной на основе вычислений (см.: Chen et al., 2011):
В настоящей работе тестировали эффекты ПЭГ различной мол. массы в следующих концентрациях: ПЭГ 2 кДа – 40 мг/мл; ПЭГ 4 кДа – 25, 50 и 100 мг/мл; ПЭГ 6 кДа – 17.5, 35 и 70 мг/мл. На основе известного радиуса Стокса (1.15 нм) (Zhu et al., 2016) для ПЭГ 2 кДа было рассчитано значение FVO = 7.7%. Как было показано, наиболее эффективной концентрацией фиколла для депонирования ВКМ является смесь 37.5 мг/мл фиколла 70 кДа и 25 мг/мл фиколла 400 кДа (Chen et al., 2011; Tsiapalis, Zeugolis, 2021). Суммарный FVO смеси составляет около 17% по объему, что превосходит значение, вычисленное нами для ПЭГ; поэтому при выборе концентрации фиколла 400 кДа мы ориентировались на это значение и определили, что 50 мг/мл дают величину FVO близкую к этой (около 16%). Таким образом, для исследования эффекта фиколла 400 кДа были выбраны следующие концентрации: 25, 50 и 100 мг/мл.
Децеллюляризация ВКМ и иммунофлуоресценция. Децеллюляризацию ВКМ проводили, осторожно обрабатывая клетки 0.5%-ным раствором CHAPS, содержащим 20 мМ гидроксида аммония, в течение 3 мин при комнатной температуре с последующей промывкой PBS. Фиксировали ВКМ 3.7%-ным раствором формалина в течение 15 мин и инкубировали в 0.5%-ном Тритоне-X-100 в течение 15 мин. После каждой стадии препараты промывали PBS 5 раз по 3 мин. Далее ВКМ обрабатывали 1%-ным БСА в течение 30 мин и инкубировали в течение ночи при 4°C в 1%-ном БСА с первичными антителах к фибронектину (Sigma, США) (разведение 1 : 400), коллагену III или IV типов (ИМТЕК, Россия; разведение 1 : 20) с последующей промывкой PBS 5 раз по 2 мин; инкубировали с вторичными козьими антителами, выработанными против иммуноглобулинов кролика и конъюгированными с флуорофором Alexa 488 (GAR-Alexa 488) (Invitrogen, США; разведение 1 : 500), в течение 40 мин при комнатной температуре и промывали PBS 5 раз по 2 мин. Анализ окрашенного ВКМ проводили на флуоресцентном микроскопе Fluorescent Cell Imager (Bio-Rad, Сингапур).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В работе исследовали влияние различных по химической природе полимерных соединений – фиколла 400 и ПЭГ с мол. массой 2, 4 или 6 кДа – на эффективность депонирования ключевых белков ВКМ культивируемыми эМСК в условиях нормоксии и гипоксии. Следует подчеркнуть, что в контексте эМСК поиск подходов для увеличения скорости и эффективности продукции компонентов ВКМ является новаторским. Как известно, макромолекулярные соединения типа фиколла при добавлении в ростовую среду в процессе культивирования клеток рассматриваются как макромолекулярные краудеры, способствующие продукции белков ВКМ (Chen et al., 2011; Kuznetsova et al., 2014; Prewitz et al., 2015; Cigognini et al., 2016; Gaspar et al., 2019; Tsiapalis, Zeugolis, 2021). В частности, фиколл 400 в комбинации с фиколлом 70 стимулировал депонирование культивируемыми клетками ряда ключевых белковых компонентов ВКМ, таких как фибронектин, коллаген I, II и IV типа (Chen et al., 2011, 2013; Cigognini et al., 2016; Tsiapalis, Zeugolis, 2021), что позволяло надеяться на перспективность использования фиколла 400 для улучшения условий наработки матрикса эМСК. Кроме того, выбор фиколла 400 в качестве объекта исследования был обусловлен крайне скудной информацией о его самостоятельном действии на продукцию ВКМ клетками в культуре; в доступной нам литературе не удалось обнаружить и аналогичных сведений относительно ПЭГ.
Фиколл представляет собой нейтральный полимер, полученный в результате сополимеризации сахарозы и эпихлоргидрина; этот полисахарид не цитотоксичен и не оказывает существенного влияния на вязкость раствора при соответствующих концентрациях. ПЭГ, получаемый каталитической полимеризацией окиси этилена, является гидрофильным веществом с низкой токсичностью; находит широкое применение в различных областях – медицине, биологии, промышленности, в том числе химической и пищевой. Как правило, ПЭГ-полимеры в той или иной степени обладают полидисперсностью (молекулярно-массовым распределением), причем длина полимерных цепей зависит от соотношения реагентов при полимеризации.
С целью оптимизации условий депонирования компонентов ВКМ культивируемыми эМСК было проведено сравнительное изучение эффектов фиколла и ПЭГ разной мол. массы при варьировании концентрации ММК, времени продукции ВКМ, содержания кислорода в атмосфере в процессе культивирования клеток (нормоксия vs гипоксия) и содержания сыворотки в ростовой среде (10 vs 1%). Как сообщалось, культивирование клеток в ростовой среде с низкой концентрацией сыворотки (около 1%) или в бессывороточной среде приводит к увеличению скорости и эффективности депонирования ВКМ, поскольку сыворотка содержит металлопротеазы, разрушающие ВКМ, и снижает скорость его ремоделирования (Satyam et al., 2014; Kumar et al., 2015a, 2015b).
В предварительных экспериментах мы установили, что применение детергента CHAPS для децеллюляризации матрикса эМСК позволяет не только полностью удалить клетки, но и сохранить биоактивные свойства децеллюляризованного ВКМ; с помощью методов иммуноцитохимии и иммуноблотинга было продемонстрировано отсутствие клеточных структур (ядер, актинового и тубулинового цитоскелета), а также наличие основных белков ВКМ – фибронектина, коллагена I, III и IV типов (данные не показаны).
Влияние макромолекулярных краудеров на эффективность депонирования белков ВКМ клетками эМСК. Исследовали зависимость продукции фибронектина и коллагенов III и IV типа от концентрации краудеров ПЭГ и фиколла в стандартных условиях нормоксии в течение 3 и 7 сут. Использованные концентрации: ПЭГ 2 кДа – 40 мг/мл; ПЭГ 4 кДа – 25, 50 или 100 мг/мл; ПЭГ 6 кДа – 17.5, 35 или 70 мг/мл; фиколл 400 – 25, 50 или 100 мг/мл. После децеллюляризации анализ белкового состава полученных ВКМ проводили методом иммунофлуоресценции.
эМСК, инкубированные в средах с добавлением ПЭГ 4 кДа (100 мг/мл) или ПЭГ 6 кДа (35 и 70 мг/мл), в значительной степени погибали в течение первых 3-х сут, поэтому были исключены из эксперимента. Хотя ПЭГ считается по данным FDA (Food and Drug Administration) инертным и безопасным, вероятной причиной клеточной гибели вполне могло быть цитотоксическое действие высоких доз ПЭГ, а также потенциальное наличие в препаратах ПЭГ токсичных примесей – окиси этилена и 1,4-диоксана.
Эффективность депонирования белковых компонентов ВКМ оценивали по интенсивности их флуоресценции и плотности (целостности) образованной сети. Отрицательным контролем служило отсутствие флуоресценции при окраске ВКМ первичными антителами против α-тубулина и вторичными антителами GAR-Alexa 488 (рис. 1). Как показывает сравнение белков ВКМ, депонированных клетками в течение 3 сут в присутствии фиколла 400 (рис. 2), наиболее эффективно действует фиколл 400 в концентрации 50 мг/мл (FVO = 16%) (рис. 2б), при этом пролонгирование культивирования эМСК с фиколлом 400 до 7 сут усиливает депонирование фибронектина и коллагена IV типа (рис. 3б), которые по интенсивности окраски и плотности образуемой сети превосходят наблюдаемые для фиколла 400 в концентрациях 25 мг/мл (FVO = 8%) и тем более 100 мг/мл (FVO = 32%) (рис. 3а, в). Сравнение рис. 2г, д с рис. 3г, д показывает, что наработка всех исследуемых белков ВКМ при культивировании контрольных эМСК в среде с содержанием FBS 1 и 10% значительно усиливается в интервале от 3 до 7 сут.
Рис. 1.
Окрашивание децеллюляризованного внеклеточного матрикса (ВКМ) эндометриальных мезенхимных стромальных клеток человека (эМСК) первичными антителами против α-тубулина и вторичными антителами GAR-Alexa 488 (отрицательный контроль). а – Контраст в проходящем свете, б – флуоресценция вторичных антител (отсутствует). Съемку проводили на микроскопе Fluorescent Cell Imager (Bio-Rad, Сингапур), масштабный отрезок – 100 мкм.

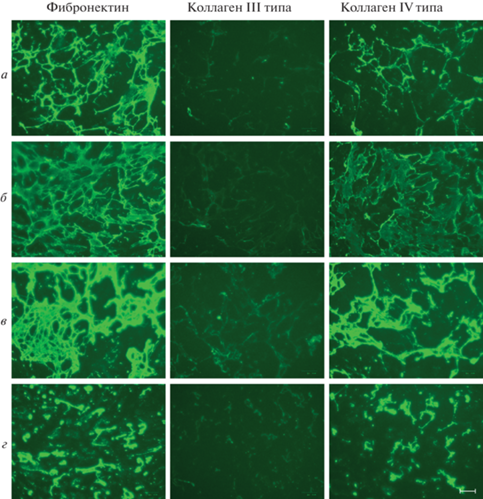
Рис. 2.
Влияние фиколла 400 в разных концентрациях на эффективность депонирования белков ВКМ эМСК в условиях нормоксии (20% О2) при культивировании в течение 3 сут. Иммунофлуоресценции на фибронектин, коллаген III и IV типа. Концентрация фиколла 400 в ростовой среде, содержащей 1% сыворотки FBS: а – 25, б – 50, в – 100 мг/мл. г, д – Среда, содержащая 1 и 10% FBS соответственно (окраска контрольных клеток, типичная и для варианта на рис. 4). Представлены наиболее репрезентативные результаты окрашивания белков ВКМ. Условия окраски и съемки идентичны для всех вариантов, представленных на рис. 2–7 (микроскоп Fluorescent Cell Imager; Bio-Rad, Сингапур), масштабный отрезок: 100 мкм.
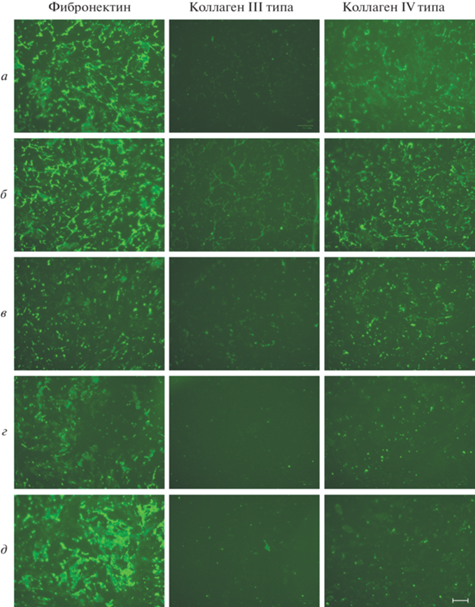
Рис. 3.
Влияние фиколла 400 на эффективность депонирования белков ВКМ эМСК в условиях нормоксии при культивировании в течение 7 сут. Концентрация фиколла 400 в ростовой среде, содержащей 1% сыворотки FBS: а – 25, б – 50, в – 100 мг/мл. г, д – Среда, содержащая 1 и 10% FBS соответственно (окраска контрольных клеток, типичная и для варианта на рис. 5).
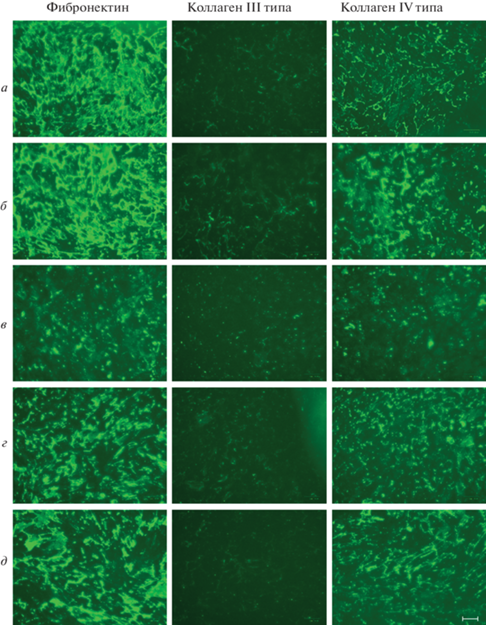
Тестирование ПЭГ в качестве потенциального краудера, позитивно влияющего на депонирование ВКМ, выявило большую эффективность ПЭГ 4000 в концентрации 25 мг/мл (рис. 4б) по сравнению с остальными препаратами ПЭГ различной мол. массы. При таких условиях через 7 сут усиливается наработка всех исследуемых белков ВКМ – фибронектина, коллагена III и IV типа (рис. 5б). Однако принимая во внимание результаты окраски контрольных эМСК, которые депонировали ВКМ в ростовой среде с 1% FBS в течение 7 сут (рис. 3г), не совсем корректно говорить о сильном стимулирующем эффекте 25 мг/мл ПЭГ 4000: в целом они сопоставимы. В противоположность ПЭГ 4000 (25 мг/мл), культивирование клеток в присутствии ПЭГ 6000 оказывает выраженное негативное влияние на депонирование белков ВКМ (рис. 4г и рис. 5г). Важно подчеркнуть, что сравнение результатов действия ПЭГ 4 и 6 кДа в разных концентрациях (за исключением 50 мг/мл ПЭГ 4000) вполне релевантно, поскольку значения их FVO одинаковы (6.5%). Как и в случае с фиколлом 400, пролонгирование времени культивирования в присутствии ПЭГ вне зависимости от его мол. массы и использованной концентрации приводит к ускорению депонирования белков ВКМ; однако, как и ожидалось, в разной степени (рис. 4, 5).
Рис. 4.
Наработка белков ВКМ при культивировании эМСК в течение 3 сут в присутствии полиэтиленгликоля (ПЭГ) разной мол. массы в ростовой среде, содержащей 1% FBS, в условиях нормоксии. а – ПЭГ 2 кДа, 40 мг/мл; б – ПЭГ 4 кДа, 25 мг/мл, в – ПЭГ 4 кДа, 50 мг/мл, г – ПЭГ 6 кДа, 17.5 мг/мл.
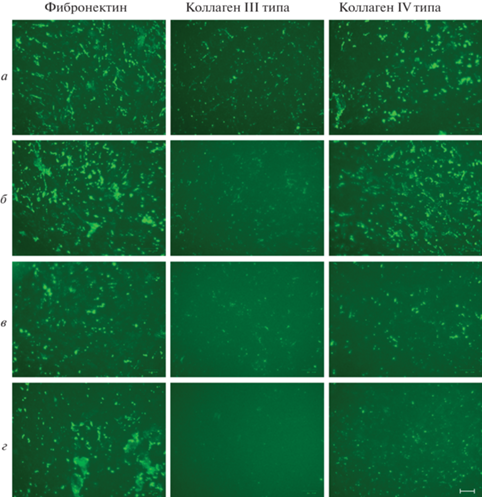
Рис. 5.
Наработка белков ВКМ при культивировании эМСК в течение 7 сут в присутствии ПЭГ в ростовой среде с 1% FBS в условиях нормоксии. а – ПЭГ 2 кДа, 40 мг/мл; б – ПЭГ 4 кДа, 25 мг/мл, в – ПЭГ 4 кДа, 50 мг/мл, г – ПЭГ 6 кДа, 17.5 мг/мл.
Понижение содержания сыворотки в ростовой среде до 1% не оказывает заметного стимулирующего эффекта на скорость депонирования ВКМ по сравнению с нормальной средой, содержащей 10% сыворотки: через 7 сут наблюдали практически идентичную окраску фибронектина, коллагена III и IV типа (рис. 3г, д).
Таким образом, полученные данные свидетельствуют о потенциале фиколла 400 как ММК для оптимизации депонирования компонентов ВКМ эМСК; в то же время применение ПЭГ для этой цели представляется бесперспективным.
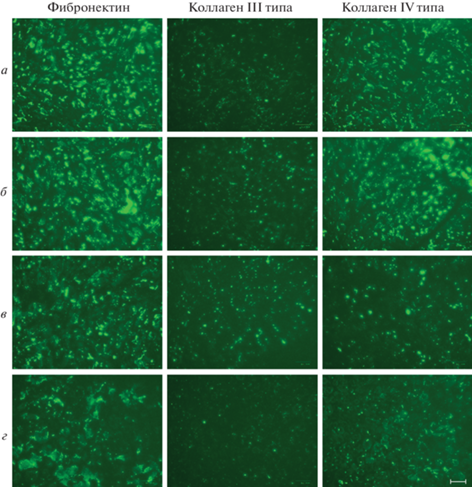
Влияние фиколла 400 на эффективность депонирования белков ВКМ эМСК в условиях гипоксии. Чтобы выяснить потенциальную роль гипоксии в депонировании белков ВКМ по сравнению с нормальными условиями культивирования (нормоксией) в присутствии ММК, использовали фиколл 400 в концентрации 50 мг/мл как наиболее перспективный краудинг-агент. При культивировании эМСК в условиях гипоксии обнаружили, что добавление фиколла 400 в стандартную ростовую среду (10% FBS) приводило к заметному нарушению целостности 7-суточного матрикса как в отношении фибронектина, так и коллагена IV типа (рис. 6б), причем эта тенденция становилась более выраженной через 14 сут (рис. 7г). Однако культивирование клеток в условиях гипоксии в среде, содержащей 1% FBS и фиколл 400, оказало прямо противоположный эффект: ВКМ обладал более развитой и целостной структурой (рис. 7б) по сравнению с ВКМ, который продуцировали клетки в ростовой среде с 1% FBS (рис. 7а). Таким образом, сочетание трех факторов – гипоксии, низкого содержания сыворотки и краудера – оказало сильное пролонгированное действие на депонирование фибронектина и коллагена IV типа и в меньшей степени – коллагена III типа. Ранее в ряде работ отмечали эффективность совмещения гипоксических условий и макромолекулярного краудинга для оптимального депонирования компонентов ВКМ в культуре МСК (Cigognini et al., 2016) и фибробластов (Satyam et al., 2016; Kumar et al., 2018). Аналогично, использование ростовой среды с пониженным содержанием сыворотки в присутствии краудинг-агентов приводило к ускорению продукции белков ВКМ фибробластами различной природы (Kumar et al., 2015a, 2015b).
Рис. 6.
Влияние фиколла 400 в концентрации 50 мг/мл на эффективность депонирования белков ВКМ при культивировании эМСК в течение 7 сут в условиях гипоксии (3% О2). а, б – содержание FBS в ростовой среде 1 и 10% соответственно.
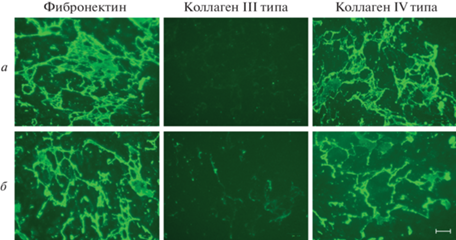
Рис. 7.
Влияние фиколла 400 в концентрации 50 мг/мл (б, г) на эффективность депонирования белков ВКМ при культивировании эМСК в течение 14 сут в условиях гипоксии (3% О2). а – 1% FBS в среде без фиколла, б – 1% FBS, присутствие фиколла; в – 10% FBS в среде без фиколла, г – 10% FBS, присутствие фиколла.
При сравнении 7-суточного ВКМ, продуцированного клетками в среде с 10% FBS в условиях нормоксии (рис. 3д) и гипоксии (рис. 6а), становится очевидной стимулирующая роль гипоксии в производстве ВКМ в контексте ускорения депонирования фибронектина и коллагена IV типа, а также образования более разветвленной и целостной сети этих белков. Кроме того, в гипоксических условиях через 14 сут наблюдали более выраженное образование фибриллярной сети коллагена III (рис. 7в). В совокупности, наши данные подтверждают, что применение гипоксических условий является перспективным подходом для оптимизации производства ВКМ культивируемыми МСК (Cigognini et al., 2016; Du et al., 2017).
Как было показано, комбинированное действие фиколла 400 и фиколла 70 вызывает ускорение депонирования ключевых белков ВКМ: коллагена I в случае культивируемых дермальных фибробластов (Gaspar et al., 2019), а также фибронектина, коллагена I и IV типа в случае МСК костного мозга (Zeiger et al., 2012; Rashid et al., 2014; Prewitz et al., 2015). Сведения о самостоятельных эффектах фиколла 400 в качестве ММК немногочисленны (Satyam et al., 2014; Gaspar et al., 2019); кроме того, прежде не исследовали способность этого краудера стимулировать наработку ВКМ культивируемыми эМСК. Мы установили, что в нормальных условиях культивирования эМСК пролонгированное действие фиколла 400 приводит к ускорению продукции фибронектина и коллагена III и IV типа, тогда как при гипоксии этот эффект значительно усиливается, но только при условии пониженного содержания сыворотки в ростовой среде клеток.
В представленной работе мы продемонстрировали влияние макромолекулярных краудеров фиколла 400 и ПЭГ различной мол. массы на депонирование ВКМ эМСК в условиях нормоксии и гипоксии. На основе полученных данных можно заключить, что фиколл 400 эффективен как краудер для ускорения продукции ключевых компонентов матрикса эМСК – фибронектина и коллагена IV типа, в меньшей степени коллагена III типа. При сравнении нормоксических (20% О2) и гипоксических (3% О2) условий культивирования показано, что клетки продуцируют ВКМ с более развитой структурой при пониженной концентрации кислорода. Отметим, что в условиях гипоксии фиколл 400 способствует депонированию ВКМ только при низком содержании сыворотки в ростовой среде. В контексте эМСК полученные результаты обладают новизной и расширяют представление о способах оптимизации депонирования ВКМ.
Список литературы
Домнина А.П., Фридлянская И.И., Земелько В.И., Пуговкина Н.А., Ковалева 3.В., Зенин В.В., Гринчук Т.М., Никольский Н.Н. 2013. Мезенхимные стволовые клетки эндометрия человека при длительном культивировании не подвергаются спонтанной трансформации. Цитология. Т. 55. № 1. С. 69. (Domnina A.P., Fridliandskaia I.I., Zemelko V.I., Pugovkina N.A., Kovaleva Z.V., Zenin V.V., Grinchuk T.M., Nikolsky N.N. 2013. Mesenchymal stem cells from human endometrium do not undergo spontaneous transformation during long-term cultivation. Cell Tiss. Biol. V. 7. P. 221.)
Земелько В.И., Гринчук Т.М., Домнина А.П., Арцыбашева И.В., Зенин В.В., Кирсанов А.А., Бичевая Н.К., Корсак В.С., Никольский Н.Н. 2011. Мультипотентные мезенхимные стволовые клетки десквамированного эндометрия. Выделение, характеристика и использование в качестве фидерного слоя для культивирования эмбриональных стволовых линий человека. Цитология. Т. 53. № 12. С. 919. (Zemelko V.I., Grinchuk T.M., Domnina A.P., Artzibasheva I.V., Zenin V.V., Kirsanov A.A., Bichevaia N.K., Korsak V.S., Nikolsky N.N. 2012. Multipotent mesenchymal stem cells of desquamated endometrium: isolation, characterization, and application as a feeder layer for maintenance of human embryonic stem cells. Cell Tiss. Biol. V. 6. № 1. P. 1.)
Матвеева Д.К., Андреева Е.Р. 2020. Регуляторная активность децеллюляризированного матрикса мультипотентных мезенхимных стромальных клеток. Цитология. Т. 62. № 10. С. 699. (Matveeva D.K., Andreeva E.R. 2020. Regulatory activity of decellularized matrix of multipotent mesenchymal stromal cells. Tsitologiya. V. 62. № 10. P. 699.)https://doi.org/10.31857/S004137712010003X
Ahmed M., Ffrench-Constant C. 2016. Extracellular matrix regulation of stem cell behavior. Curr. Stem Cell Rep. V. 2. P. 197. https://doi.org/10.1007/s40778-016-0056-2
Ang X.M., Lee M.H.C., Blocki A., Chen C., Ong L.L.S., Asada H.H., Sheppard A., Raghunath M. 2014. Macromolecular crowding amplifies adipogenesis of human bone marrow-derived mesenchymal stem cells by enhancing the pro-adipogenic microenvironment. Tiss. Eng. Part A. V. 20. P. 966. https://doi.org/10.1089/ten.TEA.2013.0337
Antich C., Jiménez G., de Vicente J., López-Ruiz E., Chocarro-Wrona C., Griñán-Lisón C., Carrillo E., Montañez E., Marchal J.A. 2021. Development of a biomimetic hydrogel based on predifferentiated mesenchymal stem-cell-derived ECM for cartilage tissue engineering. Adv. Healthc Mater. V. 10 (8): e2001847. https://doi.org/10.1002/adhm.202001847
Assunção M., Dehghan-Baniani D., Yiu C.H.K., Später T., Beyer S., Blocki A. 2020. Cell-derived extracellular matrix for tissue engineering and regenerative medicine. Front. Bioeng. Biotechnol. V. 8: 602009. https://doi.org/10.3389/fbioe.2020.602009
Bateman J.F., Cole W.G., Pillow J.J., Ramshaw J.A.M. 1986. Induction of procollagen processing in fibroblast cultures by neutral polymers. J. Biol. Chem. V. 261. P. 4198. https://doi.org/10.1016/s0021-9258(17)35645-4
Buravkova L.B., Andreeva E.R., Gogvadze V., Zhivotovsky B. 2014. Mesenchymal stem cells and hypoxia: where are we? Mitochondrion. V. 19. P. 105. https://doi.org/10.1016/j.mito.2014.07.005
Chen B., Wang B., Zhang W.J., Zhou G., Cao Y., Liu W. 2013. Macromolecular crowding effect on cartilaginous matrix production: a comparison of two-dimensional and three-dimensional models. Tiss. Engineering. V. 19. P. 586. https://doi.org/10.1089/ten.tec.2012.0408
Chen C., Loe F., Blocki A., Peng Y., Raghunath M. 2011. Applying macromolecular crowding to enhance extracellular matrix deposition and its remodeling in vitro for tissue engineering and cell-based therapies. Adv. Drug Delivery Rev. V. 63. P. 277. https://doi.org/10.1016/j.addr.2011.03.003
Choi K.M., Seo Y.K., Yoon H.H., Song K.Y., Kwon S.Y., Lee H.S., Park J.K. 2008. Effect of ascorbic acid on bone marrow-derived mesenchymal stem cell proliferation and differentiation. J. Biosci. Bioeng. V. 105. P. 586. https://doi.org/10.1263/jbb.105.586
Cigognini D., Gaspar D., Kumar P., Satyam A., Alagesan S., Sanz-Nogués C., Griffin M., O’brien T., Pandit A., Zeugolis D.I. 2016. Macromolecular crowding meets oxygen tension in human mesenchymal stem cell culture – a step closer to physiologically relevant in vitro organogenesis. Sci. Rep. V. 6. P. 30746. https://doi.org/10.1038/srep30746
Clause K.C., Barker T.H. 2013. Extracellular matrix signaling in morphogenesis and repair. Curr. Opin. Biotechnol. V. 24. P. 830. https://doi.org/10.1016/j.copbio.2013.04.011
Cunningham C.J., Redondo-Castro E., Allan S.M. 2018. The therapeutic potential of the mesenchymal stem cell secretome in ischaemic stroke. J. Cerebral Blood Flow Metab. V. 38. P. 1276. https://doi.org/10.1177/0271678X18776802
Discher D.E., Mooney D.J., Zandstra P.W. 2009. Growth factors, matrices, and forces combine and control stem cells. Science. V. 324. P. 1673. https://doi.org/10.1126/science.1171643
Dominici M., Le Blanc K., Mueller I., Slaper–Cortenbach I., Marini F., Krause D.S., Deans R.J., Keating A., Prockop D.J., Horwitz E.M. 2006. Minimal criteria for defining multipotent mesenchymal stromal cells. Cytotherapy. V. 8. P. 315. https://doi.org/10.1080/14653240600855905
Dong X., Al-Jumaily A., Escobar I.C. 2018. Investigation of the use of a bio-derived solvent for non-solvent-induced phase separation (NIPS) fabrication of polysulfone. Membranes. V. 8. P. 23. https://doi.org/10.3390/membranes8020023
Du H.-C., Jiang L., Geng W.-X., Li J., Zhang R., Dang J.-G., Shu M.-G., Li L.-W. 2017. Growth factor-reinforced ECM fabricated from chemically hypoxic MSC sheet with improved in vivo wound repair activity. BioMed Res. Int. V. 2017. https://doi.org/10.1155/2017/2578017
Gaspar D., Fuller K.P., Zeugolis D.I. 2019. Polydispersity and negative charge are key modulators of extracellular matrix deposition under macromolecular crowding conditions. Acta Biomaterialia. V. 88. P. 197. https://doi.org/10.1016/j.actbio.2019.02.050
Hoshiba T., Lu H., Kawazoe N., Chen G. 2010. Decellularized matrices for tissue engineering. Expert Opinion Biol. Ther. V. 10. P. 1717. https://doi.org/10.1517/14712598.2010.534079
Hynes R.O. 2009. Extracellular matrix: not just pretty fibrils. Science. V. 326. P. 1216. https://doi.org/10.1126/science.1176009
Konala V.B., Mamidi M.K., Bhonde R., Das A.K., Pochampally R., Pal R. 2016. The current landscape of the mesenchymal stromal cell secretome: A new paradigm for cell-free regeneration. Cytotherapy. V. 18. P. 13. https://doi.org/10.1016/j.jcyt.2015.10.008
Kumar P., Satyam A., Fan X., Collin E., Rochev Y., Rodriguez B.J., Gorelov A., Dillon S., Joshi L., Raghunath M., Pandit A., Zeugolis D.I. 2015a. Macromolecularly crowded in vitro microenvironments accelerate the production of extracellular matrix-rich supramolecular assemblies. Sci. Rep. V. 5. P. 8729. https://doi.org/10.1038/srep08729
Kumar P., Satyam A., Fan X., Rochev Y., Rodriguez B., Gorelov A., Joshi L., Raghunath M., Pandit A., Zeugolis D.I. 2015b. Accelerated development of supramolecular corneal stromal-like assemblies from corneal fibroblasts in the presence of macromolecular crowders. Tiss. Eng. C Methods. V. 21. P. 660. https://doi.org/10.1089/ten.TEC.2014.0387
Kumar P., Satyam A., Cigognini D., Pandit A., Zeugolis D.I. 2018. Low oxygen tension and macromolecular crowding accelerate extracellular matrix deposition in human corneal fibroblast culture. J. Tiss. Eng. Regen. Med. V. 12. P. 6. https://doi.org/10.1002/term.2283
Kuznetsova I.M., Turoverov K.K., Uversky V.N. 2014. What macromolecular crowding can do to a protein. Int. J. Mol. Sci. V. 15. P. 23090. https://doi.org/10.3390/ijms151223090
Lareu R.R., Subramhanya K.H., Peng Y., Benny P., Chen C., Wang Z., Rajagopalan R., Raghunath M. 2007. Collagen matrix deposition is dramatically enhanced in vitro when crowded with charged macromolecules: the biological relevance of the excluded volume effect. FEBS Letters. V. 581. P. 2709. https://doi.org/10.1016/j.febslet.2007.05.020
Li M., Zhang A., Li J., Zhou J., Zheng Y., Zhang C., Xia D., Mao H., Zhao J. 2020. Osteoblast/fibroblast coculture derived bioactive ECM with unique matrisome profile facilitates bone regeneration. Bioact. Mater. V. 5. P. 938. https://doi.org/10.1016/j.bioactmat.2020.06.017
Lin H., Yang G., Tan J., Tuan R.S. 2012. Influence of decellularized matrix derived from human mesenchymal stem cells on their proliferation, migration and multi-lineage differentiation potential. Biomaterials. V. 33. P. 4480. https://doi.org/10.1016/j.biomaterials.2012.03.012
Massaro M.S., Palek R., Rosendorf J., Cervenkova L., Liska V., Moulisova V. 2021. Decellularized xenogeneic scaffolds in transplantation and tissue engineering: Immunogenicity versus positive cell stimulation. Mater. Sci. Eng. C. V. 127. https://doi.org/10.1016/j.msec.2021.112203
Maumus M., Jorgensen C., Noël D. 2013. Mesenchymal stem cells in regenerative medicine applied to rheumatic diseases: role of secretome and exosomes. Biochimie. V. 95. P. 2229. https://doi.org/10.1016/j.biochi.2013.04.017
Naba A., Clauser K.R., Hoersch S., Liu H., Carr S.A., Hynes R.O. 2012. The matrisome: in silico definition and in vivo characterization by proteomics of normal and tumor extracellular matrices. Mol. and Cell. Proteomics. V. 11: M111.014647. https://doi.org/10.1074/MCP.M111.014647
Nellinger S., Mrsic I., Keller S., Heine S., Southan A., Bach M., Volz A.C., Chassé T., Kluger P.J. 2022. Cell-derived and enzyme-based decellularized extracellular matrix exhibit compositional and structural differences that are relevant for its use as a biomaterial. Biotechnol. Bioeng. V. 119. P. 1142. https://doi.org/10.1002/bit.28047
Nyambat B., Manga Y.B., Chen C.H., Gankhuyag U., Pratomo Wp A., Kumar S.M., Chuang E.Y. 2020. New insight into natural extracellular matrix: genipin cross-linked adipose-derived stem cell extracellular matrix gel for tissue engineering. Int. J. Mol. Sci. V. 21. P. 4864. https://doi.org/10.3390/ijms21144864
Pinnell S.R. 1985. Regulation of collagen biosynthesis by ascorbic acid: a review. Yale J. Boil. Med. V. 58. P. 553.
Prewitz M.C., Stissel A., Friedrichs J., Traber N., Vogler S., Bornhauser M., Werner C. 2015. Extracellular matrix deposition of bone marrow stroma hanced by macromolecular crowding. Biomaterials. V. 73. P. 60. https://doi.org/10.1016/j.biomaterials.2015.09.014
Rao Pattabhi S., Martinez J.S., Keller Iii T.C.S. 2014. Decellularized ECM effects on human mesenchymal stem cell stemness and differentiation. Differentiation. V. 88. P. 131. https://doi.org/10.1016/j.diff.2014.12.005
Rolandsson Enes S., Krasnodembskaya A.D., English K., dos Santos C.C., Weiss D.J. 2021. Research progress on strategies that can enhance the therapeutic benefits of mesenchymal stromal cells in respiratory diseases with a specific focus on acute respiratory distress syndrome and other inflammatory lung diseases. Front. Pharmacol. V. 12: 647652. https://doi.org/10.3389/fphar.2021.647652
Rashid R., Lim N., Chee S., Png S., Wohland T., Raghunath M. 2014. Novel use for polyvinylpyrrolidone as a macromolecular crowder for enhanced extracellular matrix deposition and cell proliferation. Tissue Eng. C Methods. V. 20. P. 994. https://doi.org/10.1089/ten.TEC.2013.0733
Rozario T., DeSimone D.W. 2010. The extracellular matrix in development and morphogenesis: a dynamic view. Devel. Biol. V. 341. P. 126. https://doi.org/10.1016/j.ydbio.2009.10.026
Satyam A., Kumar P., Cigognini D., Pandit A., Zeugolis D.I. 2016. Low, but not too low, oxygen tension and macromolecular crowding accelerate extracellular matrix deposition in human dermal fibroblast culture. Acta Biomaterialia. V. 44. P. 221. https://doi.org/10.1016/j.actbio.2016.08.008
Satyam A., Kumar P., Fan X., Gorelov A., Rochev Y., Joshi L., Peinado H., Lyden D., Thomas B., Rodriguez B., Raghunath M., Pandit A., Zeugolis D. 2014. Macromolecular crowding meets tissue engineering by self-assembly: a paradigm shift in regenerative medicine. Advanced Materials. V. 26. P. 3024. https://doi.org/10.1002/adma.201304428
Schaefer L. 2010. Extracellular matrix molecules: endogenous danger signals as new drug targets in kidney diseases. Curr. Opin. Pharmacol. V. 10. P. 185. https://doi.org/10.1016/j.coph.2009.11.007
Tsiapalis D., Zeugolis D.I. 2021. It is time to crowd your cell culture media – Physicochemical considerations with biological consequences. Biomaterials. V. 275: 120943. https://doi.org/10.1016/j.biomaterials.2021.120943
Xing H., Lee H., Luo L., Kyriakides T.R. 2020. Extracellular matrix-derived biomaterials in engineering cell function. Biotechnol. Adv. V. 42: 107421. https://doi.org/10.1016/j.biotechadv.2019.107421
Xu S., Liu C., Ji H.L. 2019. Concise review: therapeutic potential of the mesenchymal stem cell derived secretome and extracellular vesicles for radiation-induced lung injury: progress and hypotheses. Stem Cells Transl. Med. V. 8. P. 344. https://doi.org/10.1002/sctm.18-0038
Yang L., Ge L., van Rijn P. 2020. Synergistic effect of cell-derived extracellular matrices and topography on osteogenesis of mesenchymal stem cells. ACS Appl. Mater. Interfaces. V. 12. P. 25591. https://doi.org/10.1021/acsami.0c05012
Zeiger A.S., Loe F.C., Li R., Raghunath M., Van Vliet K.J. 2012. Macromolecular crowding directs extracellular matrix organization and mesenchymal stem cell behavior. PLoS One. V. 7 P. e37904. https://doi.org/10.1371/journal.pone.0037904
Zhu J., Zheng J., Liu C., Zhang S. 2016. Ionic complexing induced fabrication of highly permeable and selective polyacrylic acid complexed poly (arylene ether sulfone) nanofiltration membranes for water purification. J. Membr. Sci. V. 520. P. 130. https://doi.org/10.1016/j.memsci.2016.07.059
Дополнительные материалы отсутствуют.


