Цитология, 2023, T. 65, № 2, стр. 170-180
Разработка метода трехмерного культивирования мезенхимных стволовых (стромальных) клеток человека с использованием матрицы из целлюлозы
И. К. Кунеев 1, Ю. С. Иванова 1, Ю. А. Нащекина 1, Е. К. Патронова 1, А. В. Соколова 1, А. П. Домнина 1, *
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: aldomnina@mail.ru
Поступила в редакцию 29.10.22
После доработки 19.12.2022
Принята к публикации 20.12.2022
- EDN: LWOREJ
- DOI: 10.31857/S0041377123020037
Аннотация
Разработка методов культивирования клеток в трехмерных системах важна и необходима для развития актуальных направлений современной клеточной биологии. При культивировании в системе 3D воспроизводится тканеспецифическая архитектура, точнее воссоздается реальная микросреда и поведение клеток in vivo. Мезенхимные стволовые/стромальные клетки человека (МСК) обычно выделяют и культивируют как монослойную 2D-культуру. В данной работе мы разработали метод трехмерного культивирования и тканеспецифической децидуальной дифференцировки МСК, выделенных из ткани эндометрия человека, с использованием матрицы, полученной из децеллюляризированного яблока. Матрицы из децеллюляризированного яблока обладают достаточной механической прочностью, биосовместимы, доступны, просты в использовании и имеют широкие возможности для модификации поверхности. Данная система культивирования клеток подходит как для их изучения методом конфокальной микроскопии, так и для исследований с помощью проточной цитометрии. Разработанная нами модель может стать основой для создания новых клеточных продуктов и тканеинженерных конструкций для нужд регенеративной биомедицины.
Мезенхимные стволовые (стромальные) клетки человека (МСК) – один из наиболее часто используемых типов клеток при разработке новых технологий регенеративной медицины. Традиционно МСК выделяют и культивируют как монослойную двумерную (2D) культуру, однако в настоящее время активно исследуются возможности трехмерного (3D) культивирования МСК (Haycock, 2011; Domnina et al., 2018; Langhans, 2018; Jensen, Teng, 2020). Многими исследователями вариант культивирования МСК в 3D-системах предлагается как способ повышения их терапевтических свойств (Domnina et al., 2018, 2020; Bou-Ghannam et al., 2021; Kouroupis, Correa, 2021). Кроме того, культивирование в 3D-геометрии открывает возможности для воспроизведения в системе in vitro архитектуры ткани, моделирования тканеспецифического микроокружения и поведения клеток (Jauković et al., 2020; Jensen, Teng, 2020; Bou-Ghannam et al., 2021; Kouroupis, Correa, 2021). Поэтому разработка методов культивирования клеток в 3D-системах является актуальным направлением современной клеточной биологии, стимулирующим создание новых клеточных продуктов и тканеинженерных конструкций.
Основные приемы культивирования в 3D-системах подразделяются на способы с использованием каркаса для прикрепления клеток (скаффолда) и без него (клеточные пласты, сфероиды) (Haycock, 2011; Chen et al., 2015; Bartosh, Ylostalo, 2019). Матрицы для культивирования клеток могут быть созданы как на основе синтетических и природных полимеров (коллагена, хитозана, полилактида, полиглицеролсебаката и др.), так и путем децеллюляризации органов и тканей (Guruswamy Damodaran, Vermette, 2018; Baruffaldi et al., 2021; Hu et al., 2022).
Для успешного культивирования клеток человека на трехмерной матрице при ее создании необходимо учесть ряд требований к исходному материалу. Он должен обладать достаточной механической прочностью, физико-химической устойчивостью, быть биосовместимым и биологически инертным. Кроме того, целесообразно применять легкодоступные и недорогие материалы. Одним из таковых является биогенная целлюлоза. В частности, недавно в качестве матриц для 3D-культивирования было предложено использовать целлюлозные каркасы из децеллюляризированных растений (Modulevsky et al., 2014, 2016; Lee et al., 2019; Bilirgen et al., 2021).
Целлюлоза – компонент клеточной стенки растений и один из природных полимеров, удовлетворяющий всем перечисленным критериям. Этот материал дает возможность создавать матрицы разнообразной формы и архитектуры, при этом поверхность матриц можно химически модифицировать (Phan et al., 2020; Bilirgen et al., 2021). Еще одним важным свойством целлюлозных матриц является их устойчивость к диссоциации в водных растворах, что позволяет проводить длительное наблюдение за населяющими их клетками. Одним из широко используемых источников целлюлозного материала для создания трехмерных скаффолдов является целлюлоза, продуцируемая бактериями (Svensson et al., 2005; Gorgieva, Trček 2019; Cherng et al., 2021).
МСК могут быть выделены из различных тканевых источников, одними из наиболее доступных являются МСК, получаемые из менструальной крови. Эндометрий – это внутренняя оболочка матки, претерпевающая более 400 циклов регенерации и восстановления в течение репродуктивных лет жизни женщины. Каждый месяц 4–10 мм эндометрия отслаивается в течение пролиферативной фазы менструального цикла (Gargett, Masuda, 2010). Десквамированный (отшелушившийся) эндометрий, содержащийся в менструальной крови, оказался самым неинвазивным источником МСК человека (эМСК) (Meng et al., 2007; Мусина и др., 2008; Patel et al., 2008, Земелько и др., 2011). эМСК обладают всеми свойствами МСК из других тканевых источников – экспрессией характерных поверхностных маркеров, способностью к направленной остеогенной, адипогенной и хондрогенной дифференцировке, активной пролиферации, адгезивностью к пластику (Meng et al., 2007; Мусина и др., 2008; Patel et al., 2008, Земелько и др., 2011). Кроме этого, эМСК сохраняют тканеспецифическую функциональность. Основной функцией эндометрия является поддержание беременности на всех этапах. Для поддержания беременности на ранних этапах, в ответ на воздействие индукторов, клетки эндометрия претерпевают ряд морфологических и функциональных изменений, называемых децидуальной трансформацией. эМСК в культуре тоже сохраняют способность к дифференцировке в децидуальные клетки, которые характеризуются эпителиоподобной формой и увеличением секреции пролактина (Домнина и др., 2015).
В настоящей работе мы разработали технологию трехмерного культивирования эМСК с использованием матрицы из целлюлозы, полученной путем децеллюляризации яблока.
МАТЕРИАЛ И МЕТОДИКА
Подготовка матриц из целлюлозы. Целлюлозные матрицы для культивирования клеток изготавливали из мезокарпия (мякоти) яблок. Для этого был сконструирован прибор, состоящий из ломтерезки (слайсера) и ножа, позволяющий придавать заготовке из яблока удобную для дальнейшей работы форму (рис. 1а). С использованием этого оборудования изготавливали заготовки из яблочного мезокарпия с размером 10 × 10 × 2 мм, позволяющие обеспечить матрице достаточную прочность для удобной работы с ней (рис. 1б). Очистку целлюлозного каркаса от клеточного содержимого (децеллюляризацию) производили путем обработки заготовок 0.5%-ным раствором натрия додецилсульфата (SDS) на протяжении 48 ч в условиях покачивания пробирки с заготовками на шейкере (скорость вращения 180 об./мин). Затем производили очистку полученных матриц от детергента. С этой целью матрицы помещали в фосфатно-солевой буферный раствор (PBS) на 24 ч с покачиванием заготовок на шейкере (180 об./мин). После этого стерилизовали матрицы обработкой 70%-ным раствором этилового спирта в течение 1 ч с тем же покачиванием заготовок на шейкере. Отмывку целлюлозных матриц от этанола производили интенсивным пипетированием в 2 мл PBS с 12-кратной заменой буфера. После 9-ого цикла пипетирования матрицы переносили в новую стерильную пробирку, в которой по окончании отмывки их хранили в стерильном PBS до коллагенизации (не более 2 нед.). На рис. 1б представлены матрицы после каждого этапа обработки.
Рис. 1.
Подготовка и визуализация целлюлозной матрицы из яблока. а –Ломтерезка (слайсер) для нарезки заготовок для матриц из целлюлозы. б – Целлюлозные матрицы на разных стадиях децеллюляризации (ДЦ): 1 – матрица из яблока до ДЦ, 2, 3 – матрица после обработки 0.5%-ным раствором SDS в течение 24 и 48 ч соответственно; 4, 5 –матрица после обработки 0.1%-ным раствором SDS в течение 24 и 48 ч соответственно; 6 – ДЦ-целлюлозная матрица; в, г – матрица после ДЦ до и после окрашивания Конго красным соответственно.

Для улучшения адгезивных свойств поверхности для прикрепления клеток, матрицы обрабатывали коллагеном I типа, важнейшим компонентом внеклеточного матрикса эМСК, с использованием методики лиофильной сушки. Матрицы из целлюлозы, покрытые раствором коллагена I типа (в концентрации 2 мг/мл) в присутствии 0.1%-ной уксусной кислоты, инкубировали при температуре –20°С в течение 24 ч. Затем на протяжении 8 ч производили лиофильную сушку матриц при температуре –50°С и давлении 0.1 мм рт. ст. Далее матрицы стерилизовали озонированием и промывали стерильным раствором PBS в течение 48 ч на шейкере ( с частотой 180 об./мин), после чего помещали в новый стерильный PBS и хранили до применения (не более 1 мес.).
Для оценки геометрии строения полученных матриц с помощью флуоресцентной микроскопии использовали окрашивание красителем Конго красный (Congo Red; Sigma-Aldrich, США). Для этого исследуемые образцы инкубировали 10 мин при комнатной температуре в водном 0.2%-ном растворе Конго красного на шейкере (160 об./мин), после чего трехкратно промывали раствором PBS.
Подготовка эМСК для культивирования в трехмерной системе. Для заселения в трехмерную матрицу использовали эМСК из Коллекции культур клеток позвоночных (ЦКП Института цитологии РАН, Санкт-Петербург). эМСК были получены из фрагментов эндометрия, содержащихся в менструальной крови (Земелько и др., 2011). Клетки культивировали в среде DMEM/F12 (Gibco, США), содержащей 10% коровьей эмбриональной сыворотки, 1% глутамина и 1% смеси антибиотиков пенициллина и стрептомицина (Gibco, США), и пересевали с помощью 0.05%-ного раствора трипсина и ЭДТА (Invitrogen, США) в соотношении 1 : 3.
Для прижизненной визуализации эМСК в составе матрицы с помощью флуоресцентной микроскопии применяли полученную нами ранее с помощью лентивирусной трансдукции линию эМСК, способную к экспрессии в цитоплазму YFP-содержащего белка HyPer – биосенсора H2O2 (Lyublinskaya et al., 2017). Флуоресценция HyPer в цитоплазме позволяла оценить морфологию клеток, их жизнеспособность и метаболическую активность.
Для отдельных экспериментов ядра клеток дополнительно окрашивали красителем Hoechst 33342, интеркалирующим в ДНК живых клеток, согласно протоколу производителя (Sigma-Aldrich, США).
Заселение целлюлозных матриц эМСК. Для заселения в матрицы эМСК по достижении ими монослоя на пассажах 6–10 открепляли от подложки с помощью 0.05%-ного раствора трипсина и ЭДТА, после чего центрифугировали при 1500 g в течение 5 мин. эМСК (2 × 106) ресуспензировали в 60 мкл ростовой среды. Заселение модифицированных коллагеном матриц проводили путем инъекции суспензии клеток в матрицу с применением катетера “бабочка” с инфузионной иглой 25G с последующим дополнительным нанесением суспензии клеток на поверхность матрицы (капельно). Затем заселенные матрицы в чашках Петри 3.5 см2 помещали в инкубатор при 37°С и 5% CO2 на 45 мин, не добавляя ростовую среду, для обеспечения частичной адгезии клеток к матрице. После этого в чашки Петри добавляли по 2 мл свежей ростовой среды.
Оценка жизнеспособности и пролиферативной активности эМСК в составе целлюлозной матрицы методом проточной цитометрии. Единичную клеточную суспензию получали путем инкубации заселенной матрицы при температуре 37°С в растворе TrypLE™ Express (Fisher Scientific, США) в течение 15 мин с последующей промывкой матрицы ростовой средой под давлением с использованием шприца 2 мл без иглы. Клетки ресуспензировали (1 млн/мл) в растворе PBS, содержащем 5% эмбриональной коровьей сыворотки. Для мечения ядер мертвых клеток применяли йодистый пропидий (PI) (Sigma, США) в конечной концентрации 50 мкг/мл. Суспензию эМСК, извлеченных из целлюлозной матрицы, окрашивали PI в течение 5 мин и далее оценивали жизнеспособность клеток с помощью проточного цитофлуориметра CytoFLEX (Beckman Coulter, США).
Для исследования распределения эМСК по фазам клеточного цикла суспензию эМСК, извлеченных из целлюлозной матрицы, пермеабилизовали 0.1%-ным раствором Тритона X-100 (Sigma-Aldrich, США) и дополнительно окрашивали в течение 5 мин 4',6-диамидино-2-фенилиндолом (DAPI; Sigma-Aldrich, США) в конечной концентрации 2 мкг/мл при комнатной температуре. Число клеток в разных фазах клеточного цикла определяли с помощью проточного цитофлуориметра CytoFLEX (Beckman Coulter, США).
Оценка жизнеспособности и пролиферативной активности эМСК в составе трехмерной конструкции методом конфокальной микроскопии. Для анализа жизнеспособности эМСК после заселения в матрицу использовали 3 флуоресцентных метки: HyPer (сенсор перекиси водорода), интеркалирующий ядерный краситель Hoechst 33342, а также маркер ядер погибших клеток PI (Sigma, США) в конечной концентрации 50 мкг/мл. HyPer позволяет обнаруживать живые клетки, метаболические пути которых в текущий момент активны. Клетки, окрашенные PI (красные), считали погибшими. Для наблюдений использовали конфокальный лазерный сканирующий микроскоп Olympus FV3000 (Olympus, США).
Для визуальной оценки пролиферативной активности эМСК в составе целлюлозных матриц использовали коммерческий набор Click-iT™ EdU Cell Proliferation Kit for Imaging (Invitrogen, США) согласно протоколу производителя. Через 16 ч после посева клеток в ростовую среду добавлялся аналог тимидина 5-этинил-2'-дезоксиуридин (EdU), который встраивается в синтезируемую цепь ДНК в ходе репликации. Через 6 ч клетки фиксировали 4%-ным раствором параформальдегида и метили Alexa Fluor 488 в форме азида согласно протоколу производителя. Изображения матриц получали с использованием конфокального лазерного сканирующего микроскопа Olympus FV3000 (Olympus, США). Для дальнейшей обработки изображений использовали программное обеспечение ImageJ. Флуоресцирующие ядра считали, используя метод треугольников для определения порогового значения флуоресценции (Zack et al., 1977).
Оценка экспрессии поверхностных маркеров эМСК в составе целлюлозной матрицы методом проточной цитометрии. Иммунофенотипический анализ поверхностных CD-маркеров эМСК, извлеченных их матрицы, проводили с помощью проточного цитофлуориметра Cytoflex (Beckman Coulter, США). Клетки ресуспензировали (1 млн/мл) в растворе PBS, содержащем 5% эмбриональной коровьей сыворотки. Для анализа использовали антитела, конъюгированные с фикоэритрином: CD44, CD73, CD90, CD105. Все антитела, включая антитела изотипического контроля, были получены от Beckman Coulter (США) и использованы по протоколу производителя.
Имуноцитохимическое окрашивание на виментин. При проведении имуноцитохимического исследования матриц, заселенных эМСК, все манипуляции проводили при покачивании матриц, помещенных в чашки Петри, на шейкере (100 об./мин). Вначале матрицы с эМСК промывали раствором PBS 4 раза по 5 мин, фиксировали в 4%-ном растворе параформальдегида в течение 15 мин и снова промывали раствором PBS 4 раза по 5 мин. Затем клетки пермеабилизировали 1%-ным раствором Тритона Х-100 в течение 30 мин, после чего блокировали сайты неспецифического связывания в растворе, содержащем 1% бычьего сывороточного альбумина (BSA), 5% нормальной сыворотки козы и 0.3% Тритона X-100 в PBS в течение 1 ч. Инкубацию с первичными моноклональными мышиными антителами к виментину (MA5-11883; Invitrogen, США) в концентрации 2 мкг/мл (в присутствии 1% BSA и 0.3% Тритона X-100 в PBS) проводили в течение ночи при 4°С. Далее осуществляли промывку PBS, содержащим 0.3% Тритона X-100 4 раза по 5 мин и инкубировали со вторичными антителами козы к IgG мыши, коньюгированными с Alexa Fluor™ 594 (A-11005; Invitrogen, США) в разведении 1 : 500 (в присутствии 1% BSA и 0.3% Тритона X-100 в PBS) в течение 40 мин в темноте с последующей промывкой образца PBS 4 раза по 5 мин. Для визуализации ядер клеток последнюю промывку производили в присутствии 0.5 мкг/мл DAPI. После окрашивания матрицы помещали в 4-луночную кювету с дном из боросиликатного стекла и исследовали методом конфокальной микроскопии.
Проведение децидуальной дифференцировки. Целлюлозные матрицы после заселения эМСК, экспрессирующими HyPer, культивировали в течении 10 сут в стандартной ростовой среде. Затем среду заменяли на среду без сыворотки на 24 ч. После этого производили замену среды на среду, содержащую 2% коровьей эмбриональной сыворотки и 1 мМ индуктора децидуальной дифференцировки 8-Br-cAMP (Sigma, США). Замену среды на свежую производили каждые третьи сут культивирования. Контрольные матрицы с эМСК культивировали таким же образом и в той же культуральной среде, но без добавления 8-Br-cAMP. На 7 сут среду из контрольных и дифференцируемых культур отбирали для определения содержания пролактина. Содержание пролактина определяли методом иммуноферментного анализа (ELISA) с использованием коммерческого набора согласно инструкции производителя (Abcam, Великобритания). Концентрации пролактина, определенные методом иммуноферментного анализа, соотносили с числом клеток. Морфологию клеток определяли с помощью конфокального лазерного сканирующего микроскопа Olympus FV3000 (Olympus, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Основной целью данной работы стала разработка методики трехмерного культивирования МСК в составе целлюлозных матриц и поиск подходов для анализа клеток в составе 3D-систем культивирования. Матрицы были созданы с использованием адаптированной нами методики Модулевского с коллегами (Modulevsky et al., 2014) и разработанного авторами работы слайсера для получения образцов с заданными параметрами. Полученная матрица обладала ячеистой структурой, морфологические особенности которой были оценены методами световой и флуоресцентной микроскопии с применением Конго красного, окрашивающего β-глюканы (рис. 1в, г). Размер ячеек матрицы составляет 200–300 мкм, ячейки взаимосвязаны и высокопористы, поэтому матрица не создает препятствий для переноса питательных веществ и кислорода, клеточной пролиферации и миграции (Modulevsky et al., 2014). Согласно данным из литературы, матрица из яблока обладает наиболее подходящими для роста клеток механическими свойствами по сравнению с целлюлозными скаффолдами, полученным из других растительных объектов (Lee et al., 2019).
Следующим этапом работы была разработка методики заселения целлюлозных матриц МСК. В настоящей работе в качестве клеточного компонента 3D-системы культивирования использовали эМСК человека. Несмотря на высокую способность эМСК к адгезии, при попытках заселения матрицы без дополнительной модификации ее поверхности не удавалось достичь эффективного заселения; эМСК не прикреплялись к матрице и образовывали сфероиды внутри целлюлозных ячеек (рис. 2а). Для увеличения клеточной адгезии была разработана методика покрытия целлюлозной матрицы коллагеном I типа с использованием метода лиофильной сушки.
Рис. 2.
эМСК после заселения в целлюлозную матрицу. а – эМСК, сформировавшие сфероиды в не обработанной коллагеном I типа целлюлозной матрице; б – эМСК, экспрессирующие в цитоплазме биосенсор H2O2 (HyPer, зеленый цвет), культивируемые в монослое; в – эМСК, экспрессирующие в цитоплазме биосенсор H2O2 (HyPer, зеленый цвет), культивируемые в целлюлозной матрице, обработанной коллагеном I типа; г – эМСК, культивируемые в целлюлозной матрице, обработанной коллагеном I типа, окрашенные до заселения в матрицу ДНК-интеркалирующим красителем Hoechst 33342 (синий); д – 3D-модель матрицы с клетками, собранная из серии изображений, полученных последовательно на разном фокусном расстоянии; е – эМСК, экспрессирующие HyPer (зеленый), окрашенные Hoechst 33342 (синий) и йодистым пропидием (PI) (красный) для визуализации погибших клеток.

Согласно данным из литературы, для заселения матриц обычно наносят суспензию клеток в небольшом объеме культуральной среды (20–40 мкл) на поверхность матрицы и недолго выдерживают (около 6 ч) в стандартных условиях (37°С, 5% CO2) для лучшего прикрепления клеток с последующим добавлением культуральной среды до необходимого объема (Modulevsky et al., 2014; Lee et al., 2019). Для увеличения плотности и равномерности заселения эМСК в матрицы нами предложен комбинированный метод посева эМСК, состоящий из введения клеточной суспензии в толщу матрицы с помощью иглы-катетера и дополнительного нанесения суспензии на поверхность матрицы. Матрицы после заселения кратковременно (45 мин) культивировали без добавления культуральной среды для обеспечения частичной адгезии клеток в их составе. Данный инъекционно-капельный метод заселения позволил увеличить эффективность посева до уровня свыше 85% от исходного числа клеток, а также повысить равномерность распределения эМСК в целлюлозной матрице.
Несмотря на масштабность проводимых исследований в области 3D-культивирования клеток, основное внимание уделяется выбору материала скаффолда, служащего основой для роста клеток, улучшению его адгезивных свойств, подбору клеточного материала, совместимого с материалом скаффолда. Однако вопросы, связанные с фундаментальными характеристиками клеток, помещенных в 3D-окружение, остаются в тени. Разработанная нами модель культивирования эМСК в 3D-системе позволяет охарактеризовать клетки.
Для визуализации живых эМСК с помощью конфокальной микроскопии, в экспериментах использовали линии клеток, экспрессирующие генетически кодируемый биосенсор перекиси водорода HyPer, который преимущественно применяется для оценки редокс-статуса клеток. Известно, что перекись водорода является одним из регуляторов внутриклеточного сигналинга, поэтому в интактной (без добавления экзогенной перекиси водорода) клетке поддерживается определенный базальный уровень перекиси водорода, активирующий флуоресценцию биосенсора HyPer. В настоящей работе мы использовали этот флуоресцентный сигнал для визуализации метаболически активных клеток. Кроме того, перед заселением в матрицу клетки были помечены прижизненным ДНК-интеркалирующим красителем Hoechst 33342 (рис. 2б, в). Это позволило оценивать плотность заселения матриц, пролиферативную активность, морфологические особенности и жизнеспособность клеток in situ без дополнительных манипуляций с помощью флуоресцентной микроскопии. Жизнеспособность оценивали, определяя число PI-положительных клеток (рис. 2г). 3D-модель, собранная из серии изображений, последовательно полученных на разном фокусном расстоянии, отражает равномерное распределение клеток на внутренних поверхностях матрицы по всем трем направлениям (рис. 2д). При оценке морфологии клеток внутри матриц отмечали сохранение веретенообразной формы, характерной для эМСК, культивируемых в виде монослоя (рис. 2е).
Оценку пролиферативной активности эМСК при культивировании в матрицах проводили с использованием набора Click-iT™ EdU Cell Proliferation Kit, позволяющего визуализировать флуоресцентный сигнал меченого красителем аналога тимидина, встраиваемого в ДНК в процессе репликации (рис. 3а, б). Проведенный флуоресцентный анализ выявил популяцию EdU-положительных клеток, что свидетельствует об активной пролиферации эМСК, населяющих скаффолд. Для подтверждения этих наблюдений и изучения динамики заполнения матрицы клетками осуществляли последовательную съемку определенного фрагмента матрицы в различные дни культивирования, участок отмечали механически, и все изображения получали на одинаковой глубине относительно поверхностей матрицы.
Рис. 3.
Ядра эМСК, окрашенные красителем Hoechst 33342 и меченные EdU с последующим окрашиванием Alexa Fluor 488, при культивировании в матрицах, обработанных коллагеном I типа. а – Ядра пролиферирующих эМСК флуоресцируют зеленым цветом (EdU), ядра не пролиферирующих эМСК окрашены только синим (Hoechst 33342). б - Сшивка изображений, полученная в результате последовательной сьемки матрицы, заселенной эМСК, по которым производили подсчет окрашенных Hoechst 33342 и меченных EdU с последующим окрашиванием Alexa Fluor 488 ядер пролиферирующих эМСК.
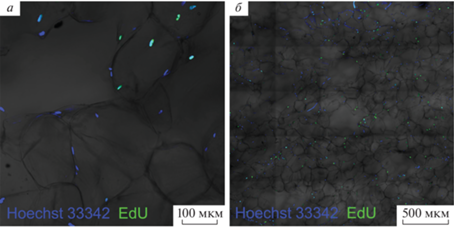
Рис. 4.
Изображения флюоресцирующих зеленым цветом эМСК для визуальной оценки их пролиферативной активности в целлюлозной матрице. Конфокальная микроскопия. а, б – Участок матрицы через 1 и 6 сут соответственно после заселения ее эМСК, экспрессирующими флюоресцирующий биосенсор H2O2 (HyPer); показаны участок матрицы на глубине ближе к поверхности (позиция 1) и ближе к середине (позиция 2).

Для количественной характеристики свойств эМСК, культивируемых в 3D-условиях, были разработаны протоколы, позволяющие извлекать заселенные в матрицу клетки. Проведенная методом проточной цитометрии оценка жизнеспособности эМСК показала, что на 7 сут культивирования в матрице доля жизнеспособной популяции составляла более 86% (рис. 5а). При более длительном культивировании (до 30 сут) в составе матрицы также определяли значительное количество живых клеток (данные не представлены). При анализе распределения эМСК по фазам клеточного цикла было обнаружено, что в популяции клеток, извлеченных из матрицы, соотношение фаз клеточного цикла было аналогично распределению в пролиферирующих монослойных культурах эМСК (рис. 3б).
Рис. 5.
Жизнеспособность и пролиферативная активность эМСК, культивируемых в матрицах, обработанных коллагеном I типа. Проточная цитометрия. а – Гистограмма, показывающая долю живых и мертвых эМСК, извлеченных из матрицы; б – распределение по фазам клеточного цикла эМСК, культивируемых в матрицах, обработанных коллагеном I типа (цифры над столбцами указывают долю клеток); в – гистограмма проточной цитометрии, показывающая наличие поверхностных CD-маркеров эМСК, культивируемых в целлюлозных матрицах (Iso – изотипический контроль).

Кроме того, с помощью проточной цитометрии была проведена фенотипическая характеристика эМСК, культивируемых в матрицах. Экспрессия ключевых поверхностных маркеров эМСК (рис. 5в) соответствовала стандартным значениям, характерным для МСК (Husein, Thiemermann, 2010).
Для подтверждения сохранения мезенхимных свойств эМСК при культивировании в составе целлюлозных матриц, проводили иммуноцитохимическое окрашивание на наличие в клетках виментина, одного из основных маркеров клеток мезенхимного ряда. В результате было обнаружено характерное окрашивание цитоскелета эМСК в составе матрицы (рис. 6).
Рис. 6.
Иммуноцитохимическое окрашивание эМСК, культивируемых в целлюлозных матрицах, на виментин (красный цвет). Ядра окрашены DAPI (синие).

Помимо фенотипических признаков, одним из ключевых маркеров МСК является их способность к тканеспецифической дифференцировке (Husein, Thiemermann, 2010). МСК эндометриального происхождения, в первую очередь, присуща способность к дифференцировке в децидуальные клетки (Домнина и др., 2015). Как известно, ткань эндометрия при завершении менструального цикла децидуализируется, что обеспечивает возможность последующей успешной имплантации бластоцисты в ходе эмбрионального развития зародыша (Gargett, Masuda, 2010). Культивирование эМСК внутри целлюлозной матрицы в присутствии индуктора децидуализации 8-Br-cAMP в ростовой среде повлекло за собой морфологические и секреторные изменения. Форма клеток изменилась с веретеновидной на более округлую, что характерно для децидуально дифференцированных эМСК (рис. 7а, б). Наблюдалось увеличение секреции пролактина по сравнению с не дифференцированными эМСК (рис. 7в).
Рис. 7.
Индукция тканеспецифической децидуальной дифференцировки эМСК, культивируемых в целлюлозных матрицах. Дифференцировку (Диф.) индуцировали добавлением 1 мМ 8-Br-cAMP (Sigma, США) в культуральную среду. а – Недифференцированные эМСК, б – изменение морфологии эМСК при дифференцировке. Стрелками указаны клетки, имеющие наиболее характерные морфологические изменения. в – Секреция пролактина эМСК недифференцированных (контроль) и при децидуальной дифференцировке (при добавлении 1 мМ 8-Br-cAMP); н.о. – не определяется.

По данным литературы, растительные целлюлозные матриксы, заселенные клетками, в основном предлагаются для регенерации костной ткани, поэтому авторы работ проводят дифференцировку в остеогенном направлении (Bilirgen et al., 2021). Нами впервые показана возможность использовать такие модели для формирования других типов тканей, а также показана возможность дифференцировать эМСК в составе целлюлозной матрицы в тканеспецифические децидуальные клетки.
Обсуждая полученные результаты и перспективы использования созданных 3D-клеточных структур, важно отметить, что разработанная нами технология позволяет варьировать способы модификации поверхности матриц, применяя не только коллаген I типа, но и другие компоненты внеклеточного матрикса клеток человека, такие как фибронектин и коллаген IV типа (Bilirgen et al., 2021). Она позволяет создавать 3D-системы на основе других типов клеток, используя их для моделирования заболеваний и тестирования фармакологических препаратов, а также развивать предложенный нами метод культивирования эМСК, реализуя амбициозную задачу восстановления архитектуры ткани эндометрия in vitro.
В итоге мы показали, что целлюлозная матрица, полученная из мезокарпия яблока, может служить подходящим каркасом для культивирования и дифференцировки эМСК в 3D-системе. Эта модель подходит как для изучения клеток методом конфокальной микроскопии, так и для исследований с помощью проточной цитометрии. Благодаря достаточной механической прочности, биосовместимости, доступности и легкости в использовании, применение матриц из децеллюляризированной ткани яблока, заселенных МСК, может стать новой стратегией в регенеративной медицине.
Список литературы
Домнина А.П., Новикова П.В., Фридлянская И.И., Шилина М.А., Зенин В.В. Никольский Н.Н. 2015. Индукция децидуальной дифференцировки в эндометриальных мезенхимных стволовых клетках. Цитология. Т. 57. № 12. С. 880. (Domnina A.P., Novikova P.V., Fridlyanskaya I.I., Shilina M.A., Zenin V.V., Nikolsky N.N. 2016. Induction of decidual differentiation of endometrial mesenchymal stem cells. Tsitologiya. V. 57. № 12. P. 880.)
Земелько В.И., Гринчук Т.М., Домнина А.П., Арцыбашева И.В., Зенин В.В., Кирсанов А.А., Бичевая Н.К., Корсак В.С., Никольский Н.Н. 2011. Мультипотентные мезенхимные стволовые клетки десквамированного эндометрия. Выделение, характеристика и использование в качестве фидерного слоя для культивирования эмбриональных стволовых линий человека. Цитология. Т. 53. № 12. С. 919. (Zemelko V.I., Grinchuk T.M., Domnina A.P., Artzibasheva I.V., Zenin V.V., Kirsanov A.A., Bichevaia N.K., Korsak V.S., Nikolsky N.N. 2012. Multipotent mesenchymal stem cells of desquamated endometrium: isolation, characterization and use as feeder layer for maintenance of human embryonic stem cell lines. Cell Tiss. B-iol. (Tsitologiya). V. 6. P. 1.)
Мусина Р.А., Белявский А.В., Тарусова О.В., Соловьева Е.В., Сухих Г.Т. 2008. Мезенхимные стволовые клетки эндометрия, полученные из менструальной крови. Кл. техн. биол. мед. Т. 2. С. 110. (Musina R.A., Tarusova O.V., Solovyova E.V., Sukhikh G.T., Belyavski A.V. 2008. Endometrial mesenchymal stem cells isolated from the menstrual blood. V. 145. P. 539)
Bartosh T.J., Ylostalo J.H. 2019. Efficacy of 3D culture priming is maintained in human mesenchymal stem cells after extensive expansion of the cells. Cells. V. 8. P. 1031. https://doi.org/10.3390/cells8091031
Baruffaldi D., Palmara G., Pirri C., Frascella F. 2021. 3D cell culture: recent development in materials with tunable stiffness. ACS Applied Bio Materials. V. 4. P. 2233. https://doi.org/10.1021/acsabm.0c01472
Bilirgen A.C., Toker M., Odabas S., Yetisen A. K., Garipcan B., Tasoglu S. 2021. Plant-based scaffolds in tissue engineering. ACS Biomat. Sci. Eng. V. 7. P. 926. https://doi.org/10.1021/acsbiomaterials.0c01527
Bou-Ghannam S., Kim K., Grainger D.W. 2021. 3D cell sheet structure augments mesenchymal stem cell cytokine production. Sci Rep. V. 11. P. 8170. https://doi.org/10.1038/s41598-021-87571-7
Chen G., Qi Y., Niu L., Di T., Zhong J., Fang T., Yan W. 2015. Application of the cell sheet technique in tissue engineering. Biomed. Rep. V. 3. P. 749. https://doi.org/10.3892/br.2015.522
Cherng J.-H., Chou S.-C., Chen C.-L., Wang Y.-W., Chang S.-J., Fan G.-Y., Leung F.-S., Meng E. 2021. Bacterial cellulose as a potential bio-scaffold for effective re-epithelialization. Therapy Pharmaceutics. V. 13. P. 1592. https://doi.org/10.3390/pharmaceutics13101592
Domnina A.P., Ivanova J.V., Alekseenko L.L., Kozhukharova I.V., Borodkina A.V., Pugovkina N.A., Smirnova I.S., Lyublinskaya O.G., Fridlyanskaya I.I., Nikolsky N.N. 2020. Three-dimensional compaction switches stress response programs and enhances therapeutic efficacy of endometrial mesenchymal stem/stromal cells. Front. Cell Devel. B-iol. V. 8. P. 473. https://doi.org/10.3389/fcell.2020.00473
Domnina A.P., Novikova P.V., Obidina J.I., Fridlyanskaya I.I, Alekseenko L.L., Kozhukharova I.V., Lyublinskaya O.G., Zenin V.V., Nikolsky N.N. 2018. Human mesenchymal stem cells in spheroids improve fertility in model animals with damaged endometrium. Stem Cell Res. Ther. V. 9. P. 1. https://doi.org/10.1186/s13287-018-0801-9
Gargett C.E., Masuda H. 2010. Adult stem cells in the endometrium. Mol. Hum. Reprod. V. 16. P. 818. https://doi.org/10.1093/molehr/gaq061
Gorgieva S., Trček J. 2019. Bacterial cellulose: production, modification and perspectives in biomedical applications. Nanomaterials. V. 9. P. 1352. https://doi.org/10.3390/nano9101352
Guruswamy Damodaran R., Vermette P. 2018. Tissue and organ decellularization in regenerative medicine. Biotech. Progress. V. 34. P. 1494. https://doi.org/10.1002/btpr.2699
Haycock J.W. 2011. 3D cell culture: a review of current approaches and techniques. Methods Mol. Biol. V. 695. P. 1. https://doi.org/10.1007/978-1-60761-984-0_1
Husein K.S., Thiemermann C. 2010. Mesenchymal stromal cells: current understanding and clinical status. Stem Cells. V. 28. P. 585. https://doi.org/10.1002/stem.269
Jauković A., Abadjieva D., Trivanović D. 2020. Specificity of 3D msc spheroids microenvironment: impact on msc behavior and properties. Stem Cell Rev. Rep. V. 16. P. 853. https://doi.org/10.1007/s12015-020-10006-9
Jensen C., Teng Y. 2020. Is it time to start transitioning from 2d to 3d cell culture? Front. Mol. Biosci. V. 7. P. 33. https://doi.org/10.3389/fmolb.2020.00033
Kouroupis D., Correa D. 2021. Increased mesenchymal stem cell functionalization in three-dimensional manufacturing settings for enhanced therapeutic applications. Front. Bioeng. Biotechnol. V. 9. P. 621748. https://doi.org/10.3389/fbioe.2021.621748
Langhans S.A. 2018. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Front. Pharmacol. V. 9. P. 6. https://doi.org/10.3389/fphar.2018.00006
Lee J., Jung H., Park N. 2019. Induced osteogenesis in plants decellularized scaffolds. Sci. Rep. V. 9. P. 20194. https://doi.org/10.1038/s41598-019-56651-0
Lyublinskaya O.G., Ivanova J.S., Pugovkina N.A., Kozhukharova I.V., Kovaleva Z.V., Shatrova A.N., Aksenov N.D., Zenin V.V., Kaulin Y.A., Gamaley I.A., Nikolsky N.N. 2017. Redox environment in stem and differentiated cells: a quantitative approach. Redox Biol. V. 12. P. 758. https://doi.org/10.1016/j.redox.2017.04.016
Meng X., Ichim T.E., Zhong J., Rogers A., Yin Z., Jackson J., Wang H., Ge W., Bogin V., Chan K.W., Thébaud B., Riordan N.H. 2007. Endometrial regenerative cells: a novel stem cell population. J. Transl. Med. V. 5. P. 57. https://doi.org/10.1186/1479-5876-5-57
Modulevsky D.J., Cuerrier C.M., Pelling A.E. 2016. Biocompatibility of subcutaneously implanted plant-derived cellulose biomaterials. PLoS One. V. 11. P. e0157894. https://doi.org/10.1371/journal.pone.0157894
Modulevsky D.J., Lefebvre C., Haase K., Al-Rekabi Z., Pelling A.E. 2014. Apple derived cellulose scaffolds for 3D mammalian cell culture. PLos One. V. 9. P. e97835. https://doi.org/10.1371/journal.pone.0097835
Patel A.N., Park E., Kuzman M., Benetti F., Silva F.J., Allickson J.G. 2008. Multipotent menstrual blood stromal stem cells: isolation, characterization, and differentiation. Cell Transplant. V. 17. P. 303. https://doi.org/10.3727/096368908784153922
Phan N.V., Wright T., Rahman M.M., Xu J., Coburn J.M. 2020. In vitro biocompatibility of decellularized cultured plant cell derived matrices. ACS Biomater. Sci. Eng. V. 6. P. 822. https://doi.org/10.1021/acsbiomaterials.9b00870
Svensson A., Nicklasson E., Harrah T., Panilaitis B., Kaplan D.L., Brittberg M., Gatenholm P. 2005. Bacterial cellulose as a potential scaffold for tissue engineering of cartilage. Biomaterials. V. 26. P. 419. https://doi.org/10.1016/j.biomaterials.2004.02.049
Hu Xinqiang, Xia Zengzilu, Cai Kaiyong. 2022. Recent advances in 3D hydrogel culture systems for mesenchymal stem cell-based therapy and cell behavior regulation. J. Mater. Chem. B. V. 10. P. 1486. https://doi.org/10.1039/D1TB02537F
Zack G.W., Rogers W.E., Latt S.A. 1977. Automatic measurement of sister chromatid exchange frequency. J. Histochem. Cytochem. V. 25. P. 741. https://doi.org/10.1177/25.7.70454
Дополнительные материалы отсутствуют.


