Цитология, 2023, T. 65, № 2, стр. 200-205
Перициты как необходимый клеточный элемент в Transwell-модели ГЭБ in vitro
А. И. Мосягина 1, *, Е. Д. Хилажева 1, А. В. Моргун 1
1 Научно-исследовательский институт молекулярной медицины и патобиохимии Красноярского государственного медицинского университета им. профессора В.Ф. Войно-Ясенецкого
660022 Красноярск, Россия
* E-mail: angelina.mosiagina@gmail.com
Поступила в редакцию 07.10.2022
После доработки 24.11.2022
Принята к публикации 24.11.2022
- EDN: LWQJAN
- DOI: 10.31857/S0041377123020050
Аннотация
Цель настоящей работы заключалась в демонстрации преимущества четырехклеточной модели гематоэнцефалического барьера (ГЭБ) in vitro в сравнении с традиционной трехклеточной моделью, а также влияния перицитов на фенотип эндотелиальных клеток. В работе описан способ сокультивирования первичных эндотелиальных клеток микрососудов головного мозга, перицитов, астроцитов и нейронов в Tr-answell-модели ГЭБ in vitro. Проведен количественный анализ между показателями трансэндотелиального электрического сопротивления (ТЭС), а также между содержанием маркеров плотных контактов эндотелиальных клеток в трех- и четырехклеточной Transwel-моделях ГЭБ. Согласно полученным данным, присутствие перицитов сопровождается более высокими показателями ТЭС и более высоким содержанием белков плотных контактов. Представленные результаты согласуются с мировой научной литературой и подтверждают гипотезу о том, что перициты выполняют не только опорную функцию для эндотелиальных клеток, но и являются важным метаболическим звеном, регулирующим барьерные функции ГЭБ. Таким образом, сокультивирование клеток нейроваскулярной единицы (НВЕ) головного мозга с перицитами необходимо для формирования у эндотелиальных клеток фенотипа, приближенного к условиям в микроокружении НВЕ in vivo.
Нейроваскулярная единица (НВЕ) представляет собой морфофункциональную единицу гематоэнцефалического барьера (ГЭБ) и является совокупностью клеток, обеспечивающих взаимодействие нейронов и церебральных микрокапилляров для обеспечения энергетических потребностей головного мозга. К ключевым компонентам НВЕ относят перициты, а их дисфункция является одним из звеньев патогенеза при таких заболеваниях, как болезнь Альцгеймера (Nortley et al., 2019) и ишемический инсульт (Yang et al., 2017), поэтому все больше исследований направлено на определение роли перицитов в функционировании НВЕ головного мозга. Так, в ряде работ было показано, что перициты выполняют не только опорную функцию, но и регулируют проницаемость, сократимость и пролиферативную активность эндотелиального слоя, ангиогенез, а также могут выполнять роль периваскулярных тканевых макрофагов (Sweeney et al., 2016).
В настоящее время наиболее распространенными моделями ГЭБ in vitro являются трехклеточные Transwell-модели, однако они не отражают в должной степени клеточный состав НВЕ и характеризуются относительно низкими значениями трансэндотелиального электрического сопротивления (ТЭС) и высокой проницаемостью (Hatherell et al., 2011; Srinivasan, Kolli, 2019). Сфероидные модели ГЭБ in vitro (Nzou et al., 2018) и микрофлюидные системы (Shin et al., 2019) также находят широкое применение, однако хотя и обладают приближенными к микроокружению in vivo характеристиками, но вместе с тем являются более сложными в воспроизведении. Таким образом, несмотря на всю простоту, Transwell-модели могут предложить ряд значительных преимуществ: они просты в реализации и управлении, экономически доступны, а также позволяют использовать широкий спектр методов исследования.
Цель настоящей работы заключалась в том, чтобы продемонстрировать преимущества использования четырехклеточной модели ГЭБ in vitro относительно традиционной трехклеточной модели, а также показать значение перицитов в функционировании НВЕ и формировании у эндотелиальных клеток фенотипа, наиболее близкого к условиям в микроокружении in vivo.
МАТЕРИАЛ И МЕТОДИКА
В работе использовали первичные культуры эндотелиальных клеток микрососудов головного мозга, астроцитов, нейронов и перицитов, полученные из крыс линии Wistar в возрасте Р4–Р10 (n = 10).
Выделение и культивирование церебральных эндотелиоцитов. Церебральные эндотелиоциты получали согласно известному протоколу (Liu et al., 2013) с модификациями. Животных декапитировали после охлаждения на льду с последующим забором головного мозга и удалением мозговых оболочек и крупных церебральных сосудов методом роллинга на фильтровальной бумаге. Далее выделяли кору головного мозга в холодном растворе Хенкса (ПанЭко, Россия), измельчали до размеров 1 мм3 и центрифугировали в течение 3 мин при 150 g и комнатной температуре. Далее к осадку добавляли 25%-ную сыворотку FBS (HyClone, США) в PBS (ПанЭко, Россия) в двукратном объеме относительно объема осадка, тритурировали и центрифугировали гомогенат в течение 10 мин при 600 g. Нижний слой переносили в новую пробирку 15 мл и трижды повторяли этапы тритурирования и центрифугирования. Далее производили ферментативную обработку осадка в двукратном объеме 0.1%-ной коллагеназы II (ПанЭко, Россия) в течение 35 мин в условиях инкубатора (37°С, 5% CO2), после чего осадок ресуспензировали и центрифугировали при 150 g в течение 5 мин. Фрагменты и отдельные эндотелиальные клетки культивировали в культуральных флаконах Т-75, предварительно покрытых желатином (Gelatin Solution 0.1%; Biological Industries, США), в условиях CO2-инкубатора с использованием культуральной среды следующего состава: DMEM (ПанЭко, Россия), 20% FBS (ПанЭко, Россия), 3 мг/мл глюкозы (Sigma-Aldrich, США), 0.58 мг/мл глутамина (Sigma-Aldrich, США), 100 ЕД/мл пенициллина, 100 мг/мл стрептомицина (HyClone, США). Смену питательной среды производили каждые 3 сут.
Выделение и культивирование нейросфер. Головной мозг забирали, выделяли гиппокамп в холодном растворе Хенкса (ПанЭко, Россия), измельчали до размеров 1 мм3 и переносили для осаждения в пробирку 15 мл со свежим раствором 2%-ной глюкозы (Sigma-Aldrich, США) в PBS (ПанЭко, Россия) на 1 мин. Далее удаляли супернатант, ресуспензировали осадок в 1 мл среды NeuroCult NS-A Proliferation (StemCell, США) и тритурировали до получения однородной суспензии клеток. К полученной суспензии добавляли 1 мл свежей среды. После осаждения неразделенных кусочков ткани переносили супернатант в новую пробирку и центрифугировали при 150 g в течение 5 мин, после чего удаляли супернатант и ресуспензировали осадок в 1 мл свежей среды. Клетки культивировали в культуральных флаконах Т-75 в условиях CO2-инкубатора с использованием культуральной среды NeuroCult NS-A Proliferation (StemCell, США). Через 24–48 ч наблюдали образование нейросфер.
Получение астроцитов и нейронов. Культуру астроцитов и нейронов получали из нейросфер путем направленной дифференцировки. Дифференцировку нейросфер в астроциты проводили в среде Astrocyte Medium (ScienCell, США): базальная среда (Basal Medium; ScienCell, США), 10% FBS (HyClone, США), 5 мл AGS (astrocyte growth supplement; ScienCell, США), раствор пенициллина и стрептомицина (ScienCell, США) в конечной концентрации 50 Ед./мл. Через 7–9 сут культивирования в среде Astrocyte Medium наблюдали образование монослоя астроцитов. Дифференцировку нейросфер в нейроны проводили в среде Neuronal Medium (ScienCell, США): базальная среда (Basal Medium; ScienCell, США), 10% FBS (HyClone, США), 5 мл NGS (neuronal growth supplement; ScienCell, США), раствор пенициллина-стрептомицина (ScienCell, США) в конечной концентрации 50 Ед./мл. Через 7–9 сут культивирования в среде Neuronal Medium наблюдали образование нейронов.
Выделение и культивирование перицитов. Перициты получали согласно известному протоколу (Crouch, Doetsch, 2018) с модификациями. После извлечения головной мозг помещали в чашку Петри с холодным раствором PBS (ПанЭко, Россия). Лезвием бритвы производили 4 корональных среза и далее в каждом срезе выделяли кору и вентрикулярно-субвентрикулярную зону (V-SVZ). Выделенную ткань измельчали до размера 1 мм3 и центрифугировали при 300 g и комнатной температуре в течение 5 мин, после чего супернатант удаляли, а осадок ресуспензировали в 0.25 мл раствора коллагеназы и диспазы (ПанЭко, Россия) и 7.25 мл 2%-ной сыворотки FBS (HyClone, США) в PBS (ПанЭко, Россия). Ферментативную обработку осадка производили в течение 30 мин в условиях СО2-инкубатора, далее осадок центрифугировали при 300 g в течение 5 мин, удаляли супернатант, ресуспензировали содержимое пробирки в растворе для тритурации, содержащем 50 мкл ДНКазы (Invitrogen, США) и 1 мл 2%-ной сыворотки FBS (HyClone, США) в PBS (ПанЭко, Россия), и тритурировали.
После этого содержимое пробирки аккуратно добавляли поверх перколла в пробирку 15 мл, содержащую 8 мл 22%-ного перколла (GE, США). Пробирку центрифугировали при 560 g в течение 10 мин, удаляли супернатант с облаком миелина, ресуспензировали клеточный осадок в 1 мл раствора Хенкса (HyClone, США) и центрифугировали при 300 g и комнатной температуре в течение 5 мин. Снова удаляли супернатант, осадок ресуспензировали в среде следующего состава: базальная среда (Basal Medium; ScienCell, США), 2% FBS (HyClone, США), 5 мл PGS (Pericyte Growth Supplement; ScienCell, США), раствор пенициллина и стрептомицина (ScienCell, США) в конечной концентрации 50 Ед./мл. Клетки культивировали в культуральных флаконах в условиях CO2-инкубатора. Через 7–9 сут наблюдали образование монослоя перицитов.
Получение трехклеточной модели ГЭБ in vitro. Трехклеточную модель ГЭБ in vitro получали согласно изложенному ранее протоколу Хилажевой и соавторов (2015). Для оценки показателей ТЭС cмесь астроцитов и нейронов в соотношении 1 : 1 помещали на дно лунок культурального 24-луночного планшета, затем устанавливали культуральные вставки (Corning-Costar, США), на которые помещали эндотелиальные клетки. Для оценки содержания молекул-маркеров во вставки помещали астроциты и нейроны, а эндотелиоциты засевали на дно лунок. Смесь клеток культивировали в среде, состоящей из DMEM с FBS, глутамином и смесью антибиотиков, в условиях СО2-инкубатора.
Получение четырехклеточной модели ГЭБ in vitro. Четырехклеточную модели ГЭБ in vitro получали согласно протоколу (Stone et al., 2019) с модификациями. Дно лунок культурального планшета и базолатеральную сторону культуральных вставок покрывали желатином (Gelatin Solution 0.1%; Biological Industries, США). Для этого в планшет с помещенными в него вставками добавляли 100 мкл желатина, после чего желатин убирали путем аспирации. Далее планшет инвертировали и на базолатеральную сторону культуральных вставок засевали первичную культуру перицитов в объеме среды 50 мкл. Дно планшета аккуратно помещали на крышку так, чтобы не повредить нанесенный на инвертированные вставки клеточный слой, после чего планшет помещали в СО2-инкубатор. Через 2–3 ч планшет переворачивали и культивировали перициты последующие 48 ч в среде из DMEM с FBS, PGS и смесью антибиотиков. Через 48 ч культивирования перицитов в планшеты засевали астроциты, нейроны и эндотелиоциты в двух модификациях: для оценки показателей ТЭС на дно лунок засевали смесь астроцитов и нейронов, а на дно вставок помещали эндотелиальные клетки; для оценки содержания молекул-маркеров во вставки помещали астроциты и нейроны, а эндотелиальные клетки засевали на дно лунок. Производили смену среды на среду DMEM с FBS, глутамином и смесью антибиотиков. Культивирование смеси клеток осуществлялось в условиях СО2-инкубатора.
Иммуноцитохимическое определение маркеров плотных контактов эндотелиальных клеток. Регистрацию маркеров белков плотных контактов эндотелиальных клеток в трех- и четырехклеточной моделях ГЭБ in vitro проводили с использование первичных антител к ZO1 (sc-8147; Santa Cruz, США) и JAM1 (ab52647; Abcam, Великобритания). Первичные антитела разводили 1 : 300, время инкубации составляло 18 ч при 4°С. Вторичные антитела Alexa Fluor 488 (ab150129; Abcam, Великобритания) и Alexa Fluor 555 (ab150078; Abcam, Великобритания) использовали в рабочем разведении 1 : 500, время инкубации составляло 2 ч при 37°С. Визуализацию клеток осуществляли на флуоресцентном микроскопе ZOE (Bio-Rad, США). Оценивали относительную интенсивность флуоресценции эндотелиоцитов, экспрессирующих целевые маркеры.
Регистрация трансэндотелиального сопротивления (ТЭС). Регистрацию ТЭС в трех- и четырехклеточной моделях ГЭБ in vitro проводили через 24, 48 и 72 ч после сокультивирования клеток. ТЭС непосредственно измеряли с помощью эпителиального вольтметра EVOM2 с использованием электрода STX2 (World Precision Instruments, США).
Статистический анализ. Статистический анализ полученных результатов проводили с помощью пакета программного обеспечения GraphPad Prizm version 9.3.0 (GraphPad Software, Inc., США). Для оценки нормальности распределения использовали критерий Шапиро–Уилка. Так как распределение соответствовало критериям нормальности, применяли t-критерий Стьюдента при сравнении в независимых выборках. Различия считали достоверными при уровне значимости р ≤ 0.05. Результаты представлены в виде среднего значения и его ошибки.
РЕЗУЛЬТАТЫ
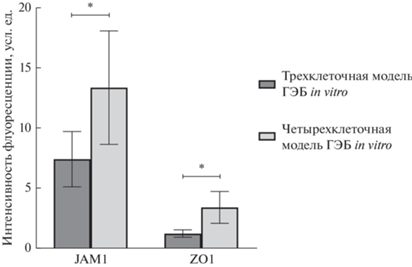
Сравнение содержания маркеров плотных контактов эндотелиальных клеток в трех- и четырехклеточной моделях ГЭБ in vitro. При сравнении уровней ZO1 и JAM1 эндотелиальных клеток в трех- и четырехклеточной моделях ГЭБ in vitro было выявлено, что содержание белков плотных контактов статистически значимо выше в четырехклеточной модели ГЭБ in vitro, т.е. в присутствии перицитов (рис. 1). Так, относительная интенсивность флуоресценции ZO1-иммунопозитивных эндотелиоцитов в трехклеточной модели составила 7.3 ± 2.3, а в четырехклеточной – 12.4 ± 4.7 усл. ед. Относительная интенсивность флуоресценции JAM1-иммунопозитивных эндотелиоцитов в трехклеточной модели составила 1.3 ± 0.3, а в четырехклеточной – 3.5 ± 1.3 усл. ед. (рис. 2).
Рис. 1.
Микрофотографии, демонстрирующие белки плотных контактов (JAM1 и ZO1) в эндотелиальных клетках в трех- (а, в) и четырехклеточной (б, д) Transwell-моделях гематоэнцефалического барьера (ГЭБ) in vitro. Иммунофлюоресценция с использованием специфических антител к JAM1 (красный) и ZO1 (зеленый), голубым цветом показаны ядра клеток (краситель DAPI). Масштабная линейка: 100 мкм.
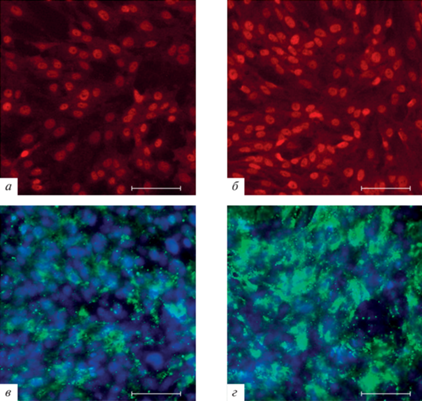
Рис. 2.
Уровни белков плотных контактов эндотелиальных клеток в трех- и четырехклеточной Transwell-модели ГЭБ in vitro. * Различия достоверны при р ≤ 0.05.
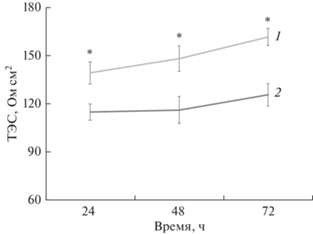
Сравнение ТЭС в трех- и четырехклеточной моделях ГЭБ in vitro. Во всех временных точках зарегистрированные показатели ТЭС в четырехклеточной модели ГЭБ in vitro были статистически значимо выше показателей ТЭС в модели ГЭБ без перицитов и через 72 ч сокультивирования клеток составили 161.7 ± 5.4 и 125.7 ± 7 Ом см2 соответственно (рис. 3). Кроме того, прирост значений ТЭС на сроке 72 ч сокультивирования относительно срока 24 ч составил 16% для четырехклеточной модели и 9% для трехклеточной.
ОБСУЖДЕНИЕ
Результаты оценки уровней белков плотных контактов демонстрируют, что эндотелиальные клетки в четырехклеточной модели ГЭБ in vitro в результате присутствия перицитов и их влияния приобретают экспрессионный профиль, более приближенный к условиями in vivo, а значит, формируют более компетентный и менее проницаемый монослой.
Кроме того, опираясь на данные иммуноцитохимического анализа, можно заключить, что зарегистрированные нами более высокие значения ТЭС в четырехклеточной модели ГЭБ in vitro обусловлены не только наличием дополнительного слоя клеток на культуральной вставке, что логично приводило бы к более высоким показателям, но также более высокими уровнями белков плотных контактов эндотелиальных клеток.
На основании этого стоит отметить, что присутствие всех клеточных типов НВЕ/ГЭБ необходимо для формирования у них фенотипа, приближенного к реальным условиям, поскольку только во взаимодействии друг с другом у клеток формируется необходимый экспрессионный профиль. Кроме того, полученные данные подчеркивают значимую роль перицитов как метаболического звена, участвующего в сопряжении клеток ГЭБ и формировании его барьерных свойств.
Таким образом, использование перицитов делает четырехклеточную Transwell-модель ГЭБ in vitro более релевантной по сравнению со стандартной трехклеточной моделью. Наряду с этим, данная модель сохраняет все преимущества стандартной Transwell-модели, поскольку остается простой в реализации и управлении, дешевой и позволяет использовать все тот же широкий спектр методов исследования.
Список литературы
Хилажева Е.Д., Бойцова Е.Б., Пожиленкова Е.А., Солончук Ю.Р., Салмина А.Б. 2015. Получение трехклеточной модели нейроваскулярной единицы in vitro. Цитология. Т. 57. № 10. С. 710. (Khilazheva E.D., Boytsova E.B., Pozhilenkova E.A., Solonchuk Yu.R., Salmina A.B. 2015. The model of neurovascular unit in vitro consisting of three cells types. Cell Tiss. Biol. (Tsitologiya). V. 57. № 10. Р. 710.)
Crouch E.E., Doetsch F. 2018. FACS isolation of endothelial cells and pericytes from mouse brain microregions. Nat. Protoc. V. 13. P. 738. https://doi.org/10.1038/nprot.2017.158
Hatherell K., Couraud P.-O., Romero I.A., Weksler B., Pilkington G.J. 2011. Development of a three-dimensional, all-human in vitro model of the blood−brain barrier using mono-, co-, and tri-cultivation Transwell models. J. Neurosci. Methods. V. 199. P. 223. https://doi.org/10.1016/j.jneumeth.2011.05.012
Liu Y., Xue Q., Tang Q., Hou M., Qi H., Chen G., Chen W., Zhang J., Chen Y., Xu X. 2013. A simple method for isolating and culturing the rat brain microvascular endothelial cells. Microvasc. Res. V. 90. P. 199. https://doi.org/10.1016/j.mvr.2013.08.00
Nortley R., Korte N., Izquierdo P., Hirunpattarasilp C., Mishra A., Jaunmuktane Z., Kyrargyri V., Pfeiffer T., Khennouf L., Madry C., Gong H., Richard-Loendt A., Huang W., Saito T., Saido T.C. et al. 2019. Amyloid β oligomers constrict human capillaries in Alzheimer’s disease via signaling to pericytes. Science. V. 365. Article no. eaav9518. https://doi.org/10.1126/science.aav9518
Nzou G., Wicks R.T., Wicks E.E., Seale S.A., Sane C.H., Chen A., Murphy S.V., Jackson J.D., Atala A.J. 2018. Human cortex spheroid with a functional blood brain barrier for high-throughput neurotoxicity screening and disease modeling. Sci. Rep. V. 8. P. 7413. https://doi.org/10.1038/s41598-018-25603-5
Shin Y., Choi S.H., Kim E., Bylykbashi E., Kim J.A., Chung S., Kim D.Y., Kamm R.D., Tanzi R.E. 2019. blood–brain barrier dysfunction in a 3D in vitro model of Alzheimer’s disease. Adv. Sci. V. 6. P. 1900962. https://doi.org/10.1002/advs.201900962
Srinivasan B., Kolli A.R. 2019. Transepithelial/transendothelial electrical resistance (TEER) to measure the integrity of blood−brain barrier. blood−brain barrier. Neuromethods. N.Y.: Humana Press. P. 142. https://doi.org/10.1007/978-1-4939-8946-1_6
Stone N.L., England T.J., O’Sullivan S.E. 2019. A novel transwell blood brain barrier model using primary human cells. Front. Cell Neurosci. V. 13. P. 230. https://doi.org/10.3389/fncel.2019.00230
Sweeney M.D., Ayyadurai S., Zlokovic B.V. 2016. Pericytes of the neurovascular unit: key functions and signaling pathways. Nat. Neurosci. V. 19. P. 771. https://doi.org/10.1038/nn.4288
Yang S., Jin H., Zhu Y., Wan Y., Opoku E.N., Zhu L., Hu B. 2017. Diverse functions and mechanisms of pericytes in ischemic stroke. Curr. Neuropharmacol. V. 15. P. 892. https://doi.org/10.2174/1570159X15666170112170226
Дополнительные материалы отсутствуют.