Цитология, 2023, T. 65, № 2, стр. 191-199
GFAP- и виментин-иммунопозитивные структуры эпифиза человека
Д. А. Суфиева 1, Е. А. Фёдорова 1, В. С. Яковлев 1, Д. Э. Коржевский 1, И. П. Григорьев 1, *
1 Институт экспериментальной медицины
197022 Санкт-Петербург, Россия
* E-mail: ipg-iem@yandex.ru
Поступила в редакцию 25.10.2022
После доработки 18.11.2022
Принята к публикации 23.11.2022
- EDN: NDJWCZ
- DOI: 10.31857/S0041377123020104
Аннотация
Эпифиз играет ключевую роль в координации различных функций организма. Основную часть клеток эпифиза составляют пинеалоциты, а вторые по количеству – глиальные клетки, данные по которым противоречивы. Настоящая работа предпринята для изучения астроглиальных клеток эпифиза человека с помощью иммуногистохимического метода с применением микроскопии проходящего света и, впервые, с использованием конфокальной лазерной микроскопии. Для маркирования астроцитов использовали антитела к глиальному фибриллярному кислому белку (GFAP) и виментину. В эпифизе человека выявлено большое число GFAP- и виментин-иммунопозитивных структур. GFAP был локализован в полигональных клетках, расположенных в дольках среди пинеалоцитов, а виментин – в кровеносных сосудах и округлых клетках, локализованных преимущественно в трабекулах и частично в пинеальных дольках. И GFAP-, и виментин-иммунореактивные клетки имели по несколько длинных ветвящихся отростков, которые пронизывали всю паренхиму эпифиза, образуя густую сеть, и заканчивались на поверхности эпифиза, кровеносных сосудах и вокруг конкрементов. GFAP-иммунореактивные волокна плотно оплетали все конкременты (одиночные и в группах), тогда как виментин-иммуноположительные отростки окружали лишь часть из них. Исследование последовательных срезов эпифиза показало, что совпадение локализации GFAP и виментина для клеток эпифиза не типично. Можно полагать, что в эпифизе человека существуют две отдельные популяции астроцитоподобных клеток, GFAP- или виментин-содержащие, и различающиеся не только цитохимически, но и по морфологическим особенностям и локализации клеточных тел, а также по расположению отростков.
Эпифиз (шишковидное тело, пинеальная железа, лат. glandula pinealis) – это нейроэндокринный орган, основная функция которого состоит в том, чтобы получать информацию о текущем состоянии светового режима в окружающей среде (свет или темнота) и передавать эту информацию на внутренние системы организма с помощью секреции гормона мелатонина. Синтез и секреция мелатонина подвержены циркадным колебаниям: с наступлением темноты синтез мелатонина и его концентрация в крови значительно возрастает, при свете синтез мелатонина подавлен и концентрация его в крови падает. В соответствии с концентрацией мелатонина в крови в течение суток циклично меняется активность внутренних органов. Эпифиз играет ключевую роль в координации различных функций организма, в первую очередь, регуляции цикла бодрствование–сон, но, кроме того, влияет на репродуктивную функцию, иммунитет и реакцию организма на стресс. К настоящему времени установлено, что функциональная активность эпифиза нарушена при ряде нервных и психических заболеваний (болезнь Альцгеймера, заболевания аутистического спектра и др.), а также в старости (Stehle et al., 2011). Причины и механизмы этих нарушений, как и механизмы регуляции деятельности пинеалоцитов в норме пока не установлены.
Что касается структуры шишковидной железы у человека, то она имеет грушевидную форму, продольный размер составляет до 10 мм, поперечный – 4–8 мм. Эпифиз является частью эпиталамуса и расположен в задней части III желудочка, между каудальной комиссурой и дорсальной комиссурой уздечки, на верхних бугорках крыши среднего мозга. Паренхима пинеальной железы представлена дольками, частично разделенными соединительнотканными трабекулами и состоит из многочисленных клеток, пинеалоцитов и кровеносных сосудов.
Большинство клеток эпифиза составляют синтезирующие мелатонин эндокринные клетки – пинеалоциты. Кроме них в эпифизе выявлены глиальные клетки, тучные и нейроноподобные клетки (Фёдорова и др., 2018; Pedersen et al., 1993; Sato et al., 1994; Ibanez Rodriguez et al., 2016; Григорьев и др., 2020; Csaki et al, 2021), причем астроцитоподобные клетки составляют вторую по численности клеточную популяцию после пинеалоцитов. К настоящему времени доказано, что астроглия в центральной нервной системе выполняет множество функций: она участвует в иммунной защите, обмене нейромедиаторов, синаптической передаче, синаптогенезе, нейрогенезе во взрослом мозге, в регуляции кровотока в мозговых сосудах, функционировании гематоэнцефалического барьера, водно-электролитном обмене (Sofroniew, Vinters, 2010; Butt, Verkhratsky, 2018; Lago-Baldaia et al., 2020). Учитывая полифункциональность астроглиальных клеток, не удивительно утверждение об их причастности к патогенезу многих, если не всех неврологических заболеваний (Sofroniew, Vinters, 2010; Verkhratsky et al., 2011; Dossi et al., 2018; Гомазков, 2020; Fernández-Blanco, Dierssen, 2020). Функции астроцитов, специфические для эпифиза, пока не определены, но вполне вероятно их участие в регуляции функциональной активности пинеалоцитов как в норме, так и при патологических состояниях. Однако, в отличие от структуры и функции пинеалоцитов, которые интенсивно исследовались в последние полвека, астроглиальные клетки эпифиза изучались недостаточно. Морфологическое описание астроцитов в эпифизе было дано с помощью классических гистологических методов еще в первой половине ХХ в. (Scharenberg, Liss, 1965), а попытки иммуногистохимического исследования пинеальных астроцитов предпринимались сразу после появления соответствующих специфических для астроглии антител, однако бóльшая часть работ была проведена на эпифизе животных, тогда как астроглия эпифиза человека с помощью иммуногистохимии исследовалась в единичных работах, причем все – в начале 1980-х годов, в период, когда иммуногистохимические методы были несовершенны (Lowenthal et al., 1982; Papasozomenos, 1983; Zang, 1985). В настоящем исследовании морфологические особенности астроглиальных клеток эпифиза человека были изучены с помощью иммуногистохимии и впервые – с помощью конфокальной лазерной микроскопии с использованием двух взаимодополняющих маркеров астроцитов – антител к глиальному фибриллярному кислому белку (GFAP) и виментину. Цель исследования состояла в изучении распределения и локализации GFAP- и виментин-иммунопозитвных структур в эпифизе человека.
МАТЕРИАЛ И МЕТОДИКА
Исследование проведено на образцах эпифиза человека (n = 9, 16–68 лет) из архива отдела общей и частной морфологии Института экспериментальной медицины. Архивация биологического материала была проведена с соблюдением этических норм, что подтверждено положительными заключениями локального этического комитета ФГБНУ ИЭМ № 58–9/1–684 от 11.12.2009 г. и № 2/22 от 06.04.2022 г. Образцы эпифиза были фиксированы в спирт−формалине или цинк−этанол−формалине (Korzhevskii et al., 2015), обезвожены и залиты в парафин по общепринятой методике. Из парафиновых блоков готовили серийные срезы толщиной 7 мкм на ротационном микротоме (Leica RM 2125RT) и наклеивали на предметные стекла с адгезивным покрытием Histobond+ (Marienfeld, Германия). После стандартной процедуры депарафинирования препараты подвергали тепловому демаскированию в цитратном модифицированном буфере S1700 (Dako, Дания).
Для иммуногистохимического исследования эпифиза мозга использовали антитела к глиальному фибриллярному кислому белку (GFAP) (в разведении 1 : 500, Agilent-Dako, Santa Clara, CA, США) и виментину (клон SP-20 в разведении 1 : 200, Spring Bioscience, Pleasanton, CA, США). В качестве вторичных антител для световой микроскопии использовали наборы Mach2 Universal HRP Polymer Kit for mouse and rabbit (Biocare Medical, США) и Reveal Polyvalent HRP DAB Detection System (Spring Bioscience, США). Для визуализации продукта иммуногистохимической реакции применяли 3,3-диаминобензидин (набор реагентов DAB+, Dako, Дания), часть срезов подкрашивали гематоксилином. Для конфокальной микроскопии в качестве вторичных реагентов применяли биотинилированные антитела против иммуноглобулинов кролика из набора R&D Cell and Tissue Staining Kit (R&D Systems, США) и биотинилированные вторичные антитела из набора VE-CTASTAIN Universal Quick HRP kit (Vector Labs, США). Затем срезы обрабатывали конъюгатом стрептавидина с флуорохромом Rhodamine Red™-X (RRX) (Jackson ImmunoResearch, США). Ядра были подкрашены флуоресцентным красителем SYTOX Green (Invitrogen, США). Срезы заключали в быстро сохнущую нефлуоресцирующую среду Cytoseal™ 60 (Richard-Allan Scientific, Kalamazoo, MI, США).
Для исследования полученных препаратов использовали микроскоп Leica DM750 с цифровой фотокамерой ICC50 (Leica Microsystems, Wetzlar, Германия). Флуоресцентно окрашенные препараты изучали с помощью конфокального лазерного микроскопа LSM800 (Carl Zeiss, Oberkochen, Германия) с использованием программного обеспечения для обработки изображений Zen-2012 (Carl Zeiss, Oberkochen, Германия).
РЕЗУЛЬТАТЫ
Предварительный гистологический анализ образцов эпифиза человека показал их хорошую сохранность, типичное лобулярное строение, наличие многочисленных конкрементов (кальцификаты или псаммомные тельца) и отдельных кист в его паренхиме.
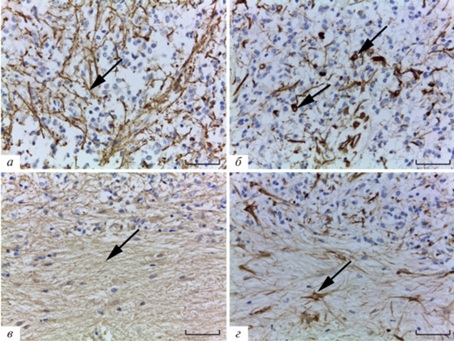
Иммуногистохимическое исследование препаратов с помощью реакции на виментин показало, что этот белок выявляется преимущественно в клетках трабекул, разделяющих паренхиму эпифиза на дольки (рис. 1). Как правило, иммунопозитивными оказываются клетки, ассоциированные с кровеносными сосудами, которые четко прослеживаются в составе трабекул и редко выявляются в составе паренхимы эпифиза. Эти клетки имеют округлую или овальную форму и обычно 1–2 отростка, которые могут оканчиваться на кровеносных сосудах, и морфологически отличаются от типичных звездчатых астроцитов. Виментин-иммуноположительные отростки локализуются чаще в трабекулах эпифиза. В некоторых случаях наблюдаются отдельные области в эпифизе с многочисленными виментин-иммуноположительными клеточными телами и отростками.
Рис. 1.
Распределение астроцитарных маркеров в эпифизе человека. Иммуногистохимическая реакция на виментин (а, б) и GFAP (в, г). Преимущественная локализация виментина в кровеносных сосудах соединительнотканных трабекул эпифиза (а, б), GFAP – в дольке эпифиза (в, г). а–в – Стрелка – долька эпифиза, головка стрелки – трабекула эпифиза. г – GFAP+-волокна в паренхиме эпифиза (отмечены стрелкой). Масштабный отрезок равен 200 мкм (а, в) и 50 мкм (б, г).

Иммуногистохимическое окрашивание препаратов с помощью антител к GFAP в светооптическом микроскопе обнаружило многочисленные равномерно распределенные GFAP-иммунореактивные отростки и отдельные клеточные тела в паренхиме эпифиза (рис. 1в, г). Отростки образовывали густую сеть, которая оплетала кровеносные сосуды и конкременты (рис. 1г, 4в, г). GFAP-иммунореактивные клеточные тела были меньше пинеалоцитов, встречались редко, обычно среди пинеалоцитов внутри долек. Исследование с помощью конфокального лазерного микроскопа показало, что тела GFAP+-астроцитов имеют полигональную форму, толстые первичные отростки и несколько тонких разветвляющихся вторичных отростков (рис 2а, б). Отростки располагались между пинеалоцитами в дольках эпифиза, причeм редко удавалось увидеть, чтобы отростки проходили через трабекулы (рис. 2а). Cети разнонаправленных и пучки однонаправленных GFAP-иммуноположительных волокон встречались примерно с такой же частотой, что и виментин-иммунореактивные. Часто волокна образовывали густое сплетение в центральной части эпифиза, на периферии располагались с меньшей плотностью, но формировали очень плотную кайму по краевой поверхности (рис. 2д).
Рис. 2.
Распределение GFAP в эпифизе человека. Конфокальная лазерная микроскопия. Иммуногистохимическая реакция на GFAP (красная флуоресценция) с подкраской ядер SYTOX Green (зеленый цвет). а, б – локализация и морфология GFAP+-астроцитов (указаны стрелкой) в пределах дольки эпифиза. в, г – Изолирующая глиальная прослойка, сформированная отростками астроцитов (указаны стрелкой), К – кальцификат. д – Краевая область эпифиза. Одиночная стрелка – отростки астроцитов, головка стрелки – краевая область эпифиза. а, б, д – одиночный оптический срез, г – трехмерная реконструкция, в – проекция 37 оптических срезов. Масштабный отрезок равен 50 (а), 20 (б), 10 (в, г), 200 мкм (д).

При исследовании последовательных срезов, окрашенных на виментин и GFAP, было обнаружено, что виментин-иммунопозитивные тела и отростки не совпадают по локализации с GFAP-иммунопозитивными, то есть представляют собой две разные популяции клеток (рис. 3а, б). Эта картина наблюдается и при исследовании случаев, в которых присутствовал обширный глиоз. Области с глиозом локализовались, как правило, в центральной части эпифиза, где отростки и тела глиальных клеток располагались концентрически. При этом при окраске на GFAP в этой области наблюдались лишь однонаправленные отростки и окрашенные гематоксилином ядра клеток, в то время как на параллельном срезе при окраске на виментин помимо разнонаправленных отростков (которые были более редкими по сравнению с GFAP+-отростками) наблюдались и виментин+-тела округлой и полигональной формы (рис. 3в, г).
Рис. 3.
Различная локализация GFAP+- и виментин+-структур на последовательных срезах эпифиза человека. Распределение GFAP+-волокон (а) и виментин+-тел (б) в паренхиме долек. в, г – обширный глиоз в эпифизе человека. Стрелками отмечены отростки GFAP+-волокон (а, в) и виментин-иммуноположительных клеточных тел (б, г). Ядра клеток окрашены гематоксилином. Масштабный отрезок равен 50 мкм.
В большинстве исследованных случаев в эпифизе были обнаружены многочисленные кальцификаты, которые были либо одиночными, либо формировали группы. Они могут локализоваться как в центральных областях эпифиза, так и по периферии. GFAP- и виментин-иммунореактивные волокна оплетают своими отростками и одиночные конкременты, и их группы, формируя изолирующую прослойку от окружающей нервной ткани (рис 4а, в). При этом при окраске на виментин не все конкременты (как правило, это касается одиночных кальцификатов) были изолированы виментин-иммунореактивными волокнами (рис 4б), в отличие от GFAP, который наблюдался вокруг всех кальцификатов (рис. 4в, г). При исследовании с помощью конфокального лазерного микроскопа и построения трехмерных реконструкций видно, что в областях локализации кальцификатов GFAP+-волокна формируют густую сеть, а сама глиальная изолирующая прослойка плотно примыкает по всей поверхности кальцификата.
Рис. 4.
Кальцификаты в эпифизе человека. Иммуногистохимическая реакция на виментин (а, б) и на GFAP (в, г). Виментин+- (а) и GFAP+- (в, г) волокна формируют изолирующую прослойку от окружающей ткани. б – Отсутствие глиальной прослойки вокруг группы кальцификатов, при окраске на виментин. Ядра клеток окрашены гематоксилином. К – кальцификат.

При попадании на препарат вместе с эпифизом соседних участков мозга обращало на себя внимание, что виментин-иммуноположительные волокна и тела клеток встречались в эпифизе в значительно большем количестве, чем в прилежащих отделах головного мозга.
ОБСУЖДЕНИЕ
В представленной иммуногистохимической работе были использованы антитела к глиальному фибриллярному кислому белку (GFAP) и виментину (виментин ранее в эпифизе человека не исследовался). GFAP – это белок промежуточных филаментов астроцитов и общепризнанный селективный маркер астроглиальных клеток (Сухорукова и др., 2015; Kovacs, 2017; O’Leary et al., 2020). Виментин – также белок промежуточных филаментов, который представлен преимущественно в клетках мезенхимного происхождения. В раннем онтогенезе виментин экспрессируется почти во всех клетках, но по мере их дифференцировки, этот белок в большинстве клеток перестает синтезироваться, и его можно обнаружить только в некоторых типах клеток, таких как фибробласты, эндотелиоциты, макрофаги, меланоциты, шванновские клетки и эпендимоциты (Kovacs, 2017; O’Leary et al., 2020; Sarnat, Yu, 2022). В полном соответствии с этими данными мы наблюдали иммунореактивность виментина в эндотелиальных клетках сосудов, а также в астроцитоподобных клетках эпифиза человека. Кроме того, виментин выявлен в ряде клеток, которые не являются астроцитоподобными клетками стромы эпифиза. Последние, по нашим наблюдениям, имели округлую форму, обычно 1–2 отростка и морфологически отличались от типичных звездчатых астроцитов. GFAP-иммуноположительные клетки имеют полигональную форму, как правило, несколько толстых первичных отростков, от которых отходят тонкие разветвляющиеся отростки, что более соответствует форме волокнистых астроцитов. Характерно, что если GFAP-иммунореактивные тела клеток располагались среди пинеалоцитов в пинеальных дольках, то виментин-иммунореактивные клеточные тела встречались в дольках эпифиза редко, чаще они локализовались в соединительнотканных трабекулах.
Длинные виментин-иммунореактивные волокна тянутся через всю толщу эпифиза и могут заканчиваться на краевой поверхности, кровеносных сосудах или окружать кальцификаты. Однако характерно, что если GFAP-иммунореактивные волокна оплетают практически все конкременты, одиночные и в группах, формируя плотную изолирующую прослойку от окружающей ткани, то виментин-иммунореактивные отростки окружают только часть из них. Возможно, виментин-иммуноположительные клетки оплетают кальцификаты, которые формировались в области трабекул эпифиза.
Известно, что в ходе нормального и патологического развития центральной нервной системы радиальная глия и незрелые астроциты экспрессируют в основном виментин, а по мере дифференцировки – преимущественно GFAP. Поэтому считается, что виментин характерен для дифференцирующихся астроцитов, а глиальный фибриллярный кислый белок – для зрелых астроглиальных клеток (Boya, Calvo, 1993). Исходя из этих данных, можно было бы предположить, что в эпифизе человека существует пул зрелых (содержащих GFAP) и пул незрелых (содержащих виментин) астроцитов. Однако, по нашим наблюдениям, виментин-иммунореактивные клетки обладают хорошо развитой сетью отростков, пронизывающих все части эпифиза, плотно опутывающие кровеносные сосуды, конкременты и выходящие на краевую поверхность, вследствие чего их трудно считать незрелыми. Кроме того, сопоставление распределения GFAP и виментина на соседних срезах не позволило в подавляющем большинстве случаев обнаружить совпадения их локализации, что свидетельствует против солокализации этих двух белков и указывает на отсутствие или малое число переходных форм астроцитов, содержащих оба белка одновременно. Эти данные приводят к выводу, что в эпифизе человека астроглия представлена двумя цитохимически различающимися подвидами: GFAP- и виментин-содержащими астроцитоподобными клетками. Нужно заметить, что ранее сходное разделение астроцитов на субпопуляции, различающиеся по цитохимическому составу, отмечали в эпифизе взрослых лабораторных животных (Huang et al., 1984; Schachner et al., 1984; Calvo et al., 1988; López–Muñoz, 1992), однако в эпифизе человека две цитохимически различные субпопуляции глиальных клеток описаны впервые в настоящем исследовании. Кроме того, виментин-иммунопозитивные клетки также могут быть представлены двумя подтипами: виментин+-клетками, расположенными в трабекулах, и виментин+-клетками, локализованными в дольках эпифиза. Эти подтипы могут различаться функционально в связи с разной локализацией в эпифизе.
Обильное представление астроглиальных волокон на поверхности эпифиза, омываемой цереброспинальной жидкостью III желудочка мозга, указывает на возможное их участие также в транспортных процессах между эпифизом и ликвором, в том числе, возможно, в транспортировке мелатонина из пинеалоцитов в ликвор.
Густое оплетение астроглиальными волокнами пинеальных конкреций пока не имеет объяснения, поскольку неизвестна причина возникновения и возможная функция конкреций. Они представляют собой минерализованные (кальцифицированные) остатки органических соединений, обладают рядом интересных биофизических свойств, встречаются в эпифизе людей разного возраста примерно в одинаковом количестве и число их заметно изменяется при ряде нервных и психических заболеваний (Baconnier et al., 2002; Фокин и др., 2006). Самое простое объяснение заключается в том, что астроглиальные волокна изолируют конкреции для защиты от механического повреждения пинеальных клеток и волокон. Так ли это на самом деле, ещё предстоит выяснить.
Суммируя, можно сказать, что проведенное исследование показало наличие в эпифизе человека небольшого числа астроцитоподобных клеток, которые располагаются в дольках среди плотно упакованных пинеалоцитов и дают начало многочисленным разветвленным волокнам большой длины, которые образуют густую сеть во всей паренхиме эпифиза. Продемонстрировано наличие двух подтипов клеток – содержащих либо GFAP, либо виментин, которые отличаются не только цитохимически, но и морфологически, а также локализуются в разных компартментах эпифиза (GFAP+-клетки локализуются преимущественно в дольках, виментин+-клетки – в трабекулах эпифиза). Установлено, что кальцификаты оплетены волокнами астроцитов. При этом GFAP+-астроциты заметно чаще чем виментин+-астроциты формировали изолирующую прослойку вокруг конкрементов. Все вышесказанное может указывать и на функциональные различия этих двух подтипов глиоцитов. Последующие исследования глиальных клеток эпифиза помогут установить их роль в нормальном функционировании пинеалоцитов, а также понять их причастность к развитию различных патологий эпифиза.
Список литературы
Гомазков О.А. 2020. Астроциты мозга и синаптический диссонанс: нейродегенеративная и психическая патология. Усп. совр. биол. Т. 140. №. 2. С. 130. (Gomazkov O.A. 2020. Brain astrocytes and synaptic dissonance: neurodegenerative and mental pathology. Usp. Sovr. Biol. V. 140. P. 130. [Article in Russian].) https://doi.org/10.31857/S0042132420010019
Григорьев И.П., Фёдорова Е.А., Суфиева Д.А., Коржевский Д.Э. 2020. Иммуногистохимическое исследование клеточной организации эпифиза человека. Морфология. Т. 158. № 4–5. С. 19. (Grigorev I.P., Fedorova E.A., Sufieva D.A., Korzhevskii D.E. 2021. Immunohistochemical studies of cell organization in the human epiphysis. Neurosci. Behav. Physiol. V. 51. P. 546.)https://doi.org/10.1007/s11055-021-01103-4
Сухорукова Е.Г., Коржевский Д.Э., Алексеева О.С. 2015. Глиальный фибриллярный кислый белок – компонент промежуточных филаментов астроцитов мозга позвоночных. Журн. эвол. биох. физиол. Т. 51. № 1. С. 3. (Sukhorukova E.G., Korzhevskii D.E., Alekseeva O.S. 2015. Glial fibrillary acidic protein: the component of intermediate filaments in the vertebrate brain astrocytes. J. Evol. Biochem. Physiol. V. 51. P. 1.)https://doi.org/10.1134/S0022093015010019
Фёдорова Е.А., Суфиева Д.А., Григорьев И.П., Коржевский Д.Э. 2018. Тучные клетки эпифиза человека. Усп. геронтол. Т. 31. № 4. С. 484. (Fedorova E.A., Sufieva D.A., Grigorev I.P., Korzhevskii D.E. 2018. Mast cells of the human pineal gland. Adv. Gerontol. V. 9. P. 62.)https://doi.org/10.1134/S2079057019010053
Фокин Е.А., Савельев С.В., Гулимова В.И., Асадчиков В.Е., Сенин Р.А., Бузмаков А.В. 2006. Морфогенез и пространственная организация конкрементов эпифиза человека при болезни Альцгеймера, шизофрении и алкоголизме. Арх. патол. Т. 68. № 5. С. 20. (Fokin E.I., Savel’ev S.V., Gulimova V.I., Asadchikov E.V., Senin R.A., Buzmakov A.V. 2006. The morphogenesis and spatial organization of human pineal gland concretions in Alzheimer’s disease, schizophrenia, and alcoholism. [Article in Russian]. Arkh. Patol. V. 68. P. 20.)
Baconnier S., Lang S.B., Polomska M., Hilczer B., Berkovic G., Meshulam G. 2002. Calcite microcrystals in the pineal gland of the human brain: first physical and chemical studies. Bioelectromagnetics. V. 23. P. 488. https://doi.org/10.1002/bem.10053
Boya J., Calvo J.L. 1993. Immunohistochemical study of the pineal astrocytes in the postnatal development of the cat and dog pineal gland. J. Pineal Res. V. 15. P. 13. https://doi.org/10.1111/j.1600-079x.1993.tb00504.x
Butt A., Verkhratsky A. 2018. Neuroglia: realising their true potential. Brain Neurosci. Adv. V. 2. 2398212818817495. https://doi.org/10.1177/2398212818817495
Calvo J., Boya J., Borregon A., Garcia-Mauriño J.E. 1988. Presence of glial cells in the rat pineal gland: a light and electron microscopic immunohistochemical study. Anat. Rec. V. 220. P. 424. https://doi.org/10.1002/ar.1092200412
Csaki A., Koves K., Kiss A.L., Rohlich P., Boldogkoi Z., Vereczki V., Puskar Z., Tombacz D., Csabai Z. 2021. Pinealocytes can not transport neurotropic viruses. Pinealo-to-retinal connection in prepubertal rats originates from pineal neurons: Light and electron microscopic immunohistochemical studies. Neurosci. Lett. V. 23. P. 135517. https://doi.org/0.1016/j.neulet.2020.135517
Dossi E., Vasile F., Rouach N. 2018. Human astrocytes in the diseased brain. Brain Res. Bull. V. 136. P. 139. https://doi.org/10.1016/j.brainresbull.2017.02.001
Fernández-Blanco Á., Dierssen M. 2020. Rethinking intellectual disability from neuro-to astro-pathology. Int. J. Mol. Sci. V. 21. P. 9039. https://doi.org/10.3390/ijms21239039
Huang S.-K., Nobiling R., Schachner M., Taugner R. 1984. Interstitial and parenchymal cells in the pineal gland of the golden hamster. Cell Tissue Res. V. 235. P. 327. https://doi.org/10.1007/bf00217857
Ibanez Rodriguez M.P., Noctor S.C., Munoz E.M. 2016. Cellular basis of pineal gland development: emerging role of microglia as phenotype regulator. PLoS One. V. 11. P. e0167063. https://doi.org/10.1371/journal.pone.0167063
Korzhevskii D.E., Sukhorukova E.G., Kirik O.V., Grigorev I.P. 2015. Immunohistochemical demonstration of specific antigens in the human brain fixed in zinc−ethanol−formaldehyde. Eur. J. Histochem. V. 59. P. 2530.https://doi.org/10.4081/ejh.2015.253026428887
Kovacs G.G. 2017. Cellular reactions of the central nervous system. Handb. Clin. Neurol. V. 145. P. 13. https://doi.org/10.1016/B978-0-12-802395-2.00003-1
Lago-Baldaia I., Fernandes V.M., Ackerman S.D. 2020. More than mortar: Glia as architects of nervous system development and disease. Front. Cell Dev. Biol. V. 8. P. 611269. https://doi.org/10.3389/fcell.2020.611269
López-Muñoz F., Calvo J.L., Boya J., Carboneil A.L. 1992. Coexpression of vimentin and glial fibrillary acidic protein in glial cells of the adult rat pineal gland. J. Pineal Res. V. 12. P. 145. https://doi.org/10.1111/j.1600-079x.1992.tb00041.x
Lowenthal A., Flament-Durand J., Karcher D., Noppe M., Brion J.P. 1982. Glial cells identified by anti-α-albumin (anti-GFA) in human pineal gland. J. Neurochem. V. 38. P. 863. https://doi.org/10.1111/j.1471-4159.1982.tb08714.x
O’Leary L.A., Davoli M.A., Belliveau C., Tanti A., Ma J.C., Farmer W.T., Turecki G., Murai K.K., Mechawar N. 2020. Characterization of vimentin-immunoreactive astrocytes in the human brain. Front. Neuroanat. V. 14. P. 31. https://doi.org/10.3389/fnana.2020.00031
Papasozomenos S.C. 1983. Glial fibrillary acidic (GFA) protein-containing cells in the human pineal gland. J. Neuropathol. Exp. Neurol. V. 42. P. 391. https://doi.org/10.1097/00005072-198307000-00003
Pedersen E.B., Fox L.M., Castro A.J., McNulty J.A. 1993. Immunocytochemical and electron-microscopic characterization of macrophage/microglia cells and expression of class II major histocompatibility complex in the pineal gland of the rat. Cell Tissue Res. V. 272. P. 257. https://doi.org/10.1007/bf00302731
Sarnat H.B., Yu W. 2022. Ganglion cell maturation in peripheral neuroblastic tumours of children. Clin. Neuropathol. V. 41. P. 101. https://doi.org/10.5414/NP301450
Sato T., Kaneko M., Fujieda H., Deguchi T., Wake K. 1994. Analysis of the heterogeneity within bovine pineal gland by immunohistochemistry and in situ hybridization. Cell Tissue Res. V. 277. P. 201. https://doi.org/10.1007/bf00327768
Schachner M., Huang S.-K., Ziegelmüller P., Bizzini B., Taugner R. 1984. Glial cells in the pineal gland of mice and rats. Cell Tissue Res. V. 237. P. 245. https://doi.org/10.1007/bf00217142
Scharenberg K., Liss L. 1965. The histologic structure of the human pineal body. Structure and Function of the Epiphysis Cerebri. Prog. Brain Res. V. 10. P. 193. https://doi.org/10.1016/s0079-6123(08)63452-4
Sofroniew M.V., Vinters H.V. 2010. Astrocytes: biology and pathology. Acta Neuropathol. V. 119. P. 7. https://doi.org/10.1007/s00401-009-0619-8
Stehle J.H., Saade A., Rawashdeh O., Ackermann K., Jilg A., Sebesteny T., Maronde E. 2011. A survey of molecular details in the human pineal gland in the light of phylogeny, structure, function and chronobiological diseases. J. Pineal Res. V. 51. P. 17. https://doi.org/10.1111/j.1600-079X.2011.00856.x
Verkhratsky A., Sofroniew M.V., Messing A., DeLanerolle N.C., Rempe D., Rodríguez J.J., Nedergaard M. 2011. Neurological diseases as primary gliopathies: a reassessment of neurocentrism. ASN NEURO V. 4. art: e00082. https://doi.org/10.1042/AN20120010
Zang X., Nilaver G., Stein B.M., Fetell M.R., Duffy P.E. 1985. Immunocytochemistry of pineal astrocytes. J. Neuropathol. Exp. Neurol. V. 44. P. 486. https://doi.org/10.1097/00005072-198509000-00004
Дополнительные материалы отсутствуют.


