Цитология, 2023, T. 65, № 2, стр. 206-214
Изменение популяции незрелых нейронов пириформной коры экспериментальных животных в отдаленном периоде после стресса раннего периода жизни
А. Б. Салмина 1, 2, Ю. А. Успенская 3, *, Ю. А. Панина 1, 4, Я. В. Горина 1, 4, О. Л. Лопатина 4
1 Научно-исследовательский институт молекулярной медицины и патобиохимии Красноярского государственного медицинского университета им. проф. В.Ф. Войно-Ясенецкого Минздрава РФ
660022 Красноярск, Россия
2 Институт мозга Научного центра неврологии
125367 Москва, Россия
3 Красноярский государственный аграрный университет
660049 Красноярск, Россия
4 Кафедра биохимии с курсами медицинской, фармацевтической и токсикологической химии Красноярского государственного медицинского университета им. проф. В.Ф. Войно-Ясенецкого Минздрава РФ
660022 Красноярск, Россия
* E-mail: yulia.uspenskaya@mail.ru
Поступила в редакцию 23.09.2022
После доработки 17.11.2022
Принята к публикации 18.11.2022
- EDN: NDICBL
- DOI: 10.31857/S0041377123020098
Аннотация
Стресс раннего периода жизни является важным фактором, предрасполагающим к развитию патологии нервной системы у животных и людей в отдаленном периоде онтогенеза. Мы использовали модель стресса раннего периода жизни для оценки активации пириформной коры при предъявлении обонятельных стимулов экспериментальным животным (мышам линии CD1 в возрасте P60 (60 сут постанатального развития) и 10 мес.) и для оценки экспрессии маркеров нейронов с пролонгированной незрелостью, участвующих в процессах пластичности взрослого головного мозга и его восстановления после повреждения. Установлено, что стресс раннего периода жизни редуцирует количество незрелых нейронов с фенотипом DCX+PSA-NCAM+ в пириформной коре головного мозга и ответ на индукцию обонятельной памяти в отдаленном периоде после перенесенного стресса. В возрасте Р60 обонятельная стимуляция снижает чувствительность к неприятным раздражителям и стимулирует процессы кратковременного запоминания, тогда как в возрасте 10 мес. такой эффект менее выражен. Полученные результаты свидетельствуют о возможном вкладе незрелых нейронов пириформной коры в механизмы аберрантной нейропластичности в отдаленном периоде онтогенеза после перенесенного стресса раннего периода жизни.
Стресс раннего периода жизни (СРПЖ) – феномен, лежащий в основе длительных изменений пластичности мозга, вызванных воздействием стрессовых факторов, действующих пренатально или в раннем постнатальном онтогенезе (Успенская и др., 2015; Malinovskaya et al., 2018; Fogelman, Canli, 2019; Kronman et al., 2021). Различные пренатальные или ранние постнатальные стимулы могут привести к запуску механизмов, специфичных для СРПЖ, например, гипоксия, действие ксенобиотиков, нарушение социальных взаимодействий, при этом затрагиваются многие физиологические механизмы, что приводит к нарушению развития головного мозга, неврологическому дефициту и повышенной предрасположенности к развитию нейродегенерации в более поздние периоды жизни. Это известно как “феномен раннего программирования”, или праймирование развивающегося мозга к патологическим состояниям из-за пренатального, интранатального или раннего постнатального стресса (Huang, 2014). Реакция на стресс всегда связана с гиперактивацией гипоталамо-гипофизарно-надпочечниковой оси и симпатической нервной системы, запуском провоспалительных механизмов, изменением эпигенетической регуляции экспрессии генов, которые влияют на нормальное развитие клеток головного мозга и их метаболизм (Salmina et al., 2021).
В последнее время повысился интерес исследователей к изучению вклада нейронов с пролонгированной незрелостью (nng-IN, non-newly generated immature neurons), локализованных в нетипичных для нейрогенеза регионах зрелого головного мозга (в частности, в коре), в процессы нейропластичности в норме и при патологии. Так, известно, что nng-IN обладают рядом интересных и мало изученных характеристик, в числе которых – сохранение экспрессии маркеров незрелых нейронов (в периоде эмбриогенеза), в частности, коэкспрессии белков даблкортина (DCX) и полисиалилированной молекулы адгезии нервных клеток (PSA-NCAM), что соответствует феномену “приостановленного развития” (arrested development); пребывание в микроокружении, не соответствующем таковому для незрелых клеток (например, формируемому в нейрогенных нишах головного мозга), которое, вероятно, обеспечивается окружающими их клетками астроглии; отсутствие пролиферативной активности и способность дифференцироваться до зрелых постмитотических нейронов при получении внешних сигналов; тесная ассоциация с васкулярным компонентом пронейрогенного микроокружения (Gómez-Climent et al., 2008, 2011; Piumatti et al., 2017). Было показано, что при старении организма часть nng-IN трансформируется в глутаматергические возбуждающие нейроны (Rotheneichner et al., 2018) или в ГАМКергические интернейроны (Benedetti et al., 2020). Однако оставалось неясным, контролируется ли этот процесс и как внешними стимулами (например, обучением), или он спонтанно реализуется и регулируется такими нейромедиаторами, как глутамат и дофамин (Coviello et al., 2020).
Весьма вероятно, что вклад nng-IN в процессы пластичности мозга может быть изменен при патологических состояниях, связанных с нарушением его развития, например, после перенесенного СР-ПЖ, и, вероятно, эта популяция клеток может рассматриваться в качестве мишеней для управления механизмами нейрогенеза, протекающего в “неклассических” нейрогенных нишах. Например, управление дифференцировочным потенциалом nng-IN может осуществляться за счет подавления экспрессии PSA-NCAM или путем модуляции адренергических механизмов в пириформной коре (Vadodaria et al., 2017; La Rosa et al., 2020; Bonfanti, Seki, 2021). С учетом вклада постнатального нейрогенеза в “классических” нейрогенных нишах (субвентрикулярной и субгранулярной зонах) мозг взрослого организма должен обладать весьма значительным ресурсом для усиления нейрогенеза и обновления популяции зрелых нейронов, когда это необходимо как в физиологических условиях (обучение, консолидация памяти), так и при патологических состояниях и, в частности, для предупреждения развития дисбаланса возбуждения–торможения, вызванного значительными изменениями в популяциях нейронов (Berdugo-Vega et al., 2020; Besnard, Sahay, 2021).
Мы предположили, что, будучи локализованными в пириформной коре (обонятельной зоне), nng-IN могут участвовать в механизмах нейропластичности, связанной с восприятием запахов, в формировании клеток ассоциативной памяти, в то время как СРПЖ способен нарушать активность таких нейронов и подавлять их участие в механизмах пластичности мозга в отдаленные периоды развития организма, истощая резерв клеток, чувствительных к действию внешних стимулов. Поэтому цель настоящей работы заключалась в изучении изменений популяции nng-IN при реализации механизмов пластичности головного мозга у животных, перенесших СРПЖ.
МАТЕРИАЛ И МЕТОДИКА
Животные. В работе использовали лабораторных животных – мышей-самцов линии CD1 (n = 150). Животных содержали в клетках со свободным доступом к воде и корму при постоянной температуре 21 ± 1°С и регулярном световом цикле 12 ч день/12 ч ночь. Исследования на животных проводили в соответствии с соблюдением принципов гуманности, изложенных в Директиве Европейского сообщества (2010/63/ЕС).
Нами была использована модель хронического стресса мыши раннего постнатального периода (СРПЖ, сепарация “мать – детеныш”, стадия постнатального развития на P2–P14; стрессу подвергали ежедневно по 3 ч (Mirescu et al., 2004); ожидаемые результаты к возрасту P60: нарушения нейрогенеза, нарушения социального поведения, тревожность, депрессивноподобную симптоматику). К 10-му мес. у животных регистрируется развитие признаков нейродегенерации (Mirescu et al., 2004).
Животных делили на группы: 2 группы контрольные – интактные животные в возрасте, соответственнo, Р60 и 10 мес. (n = 25 в каждой группе); 2 группы экспериментальные – мыши с СРПЖ тех же возрастов (Р60 и 10 мес. соответственно, n = 25 в каждой). Мыши из каждой группы подвергали обонятельной стимуляции (ОС). Общий дизайн эксперимента представлен на рис. 1.
Рис. 1.
Общий дизайн эксперимента. СРПЖ – стресс раннего периода жизни. Две контрольные группы (интактные животные) и две группы мышей с СРПЖ; возраст мышей (n = 25 в каждой группе) 60 сут постнатального развития (Р60) и 10 мес. Через 2, 24 ч и 7 сут после обонятельной стимуляции производили забор тканей головного мозга для иммуногистохимического анализа (ИГХ). На каждую временную точку для ИГХ брали по 5 мышей из каждой группы. Через 24 ч проводили поведенческий тест “Fear conditioning” (контекстуальное кондиционирование страха) для оценки активации пириформной коры на поведенческом уровне (n = 10 в каждой группе).
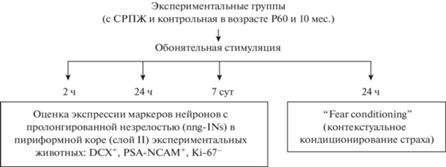
С помощью ОС было проведено моделирование активации пириформной коры по протоколу (Schellinck et al., 2001). ОС представляла собой однократное последовательное предъявление животному различных запахов (воды, арахисового масло, подстила из-под крыс) в отдельной чистой клетке. Подачу ОС проводили по следующей схеме: чистая вода–перерыв–арахисовое масло–перерыв–арахисовое масло–перерыв–подстил из-под крыс–перерыв–подстил из-под крыс; длительность стимула – 2 мин, перерыв – 1 мин. Через 2, 24 ч и 7 сут после ОС производили забор тканей головного мозга для иммуногистохимического анализа (ИГХ). На каждую временную точку для ИГХ было взято по 5 мышей из каждой группы.
Через 24 ч проводили поведенческий тест “Fear conditioning” (контекстуальное кондиционирование страха) (рис. 2) для оценки активации пириформной коры на поведенческом уровне (n = 10 для каждой группы).
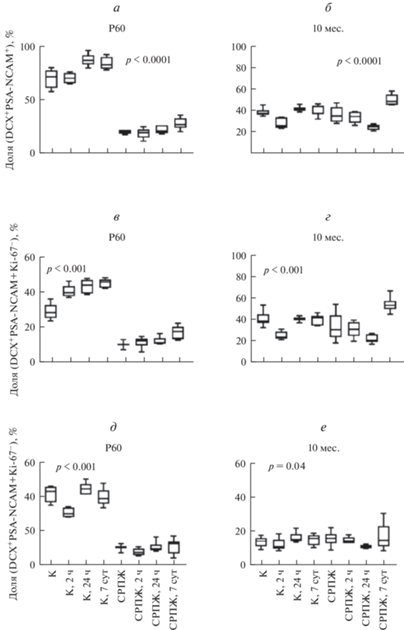
Рис. 2.
Содержание маркеров DCX+, PSA-NCAM+ и Ki-67+в пириформной коре мышей в возрасте Р60 (слева) и 10 мес. (справа) а, б – Колоколизация DCX+ и PSA-NCAM+. в, г – Колоколизация DCX+, PSA-NCAM+ и Ki-67+. д, е – Колоколизация DCX+, PSA-NCAM+ и Ki-67−. К – интактные мыши (контроль) через 2, 24 ч и 7 сут после обонятельной стимуляции (ОС). СРПЖ – животные с СРПЖ (стрессом раннего периода жизни) до стимуляции и с СРПЖ через 2, 24 ч и 7 сут после ОС. Представлены средние значения и их стандартные отклонения (анализировали по 5 животных из группы, 5 срезов от каждого животного и 5 полей зрения на срезе), использован дисперсионный двухфакторный анализ; различия между всеми группами достоверны при p < 0.05.
ИГХ-анализ. Оценку количества молекул-маркеров (DCX, PSA-NCAM, Ki-67) проводили на свободно плавающих сагитальных срезах головного мозга (толщина срезов 50 мкм) согласно стандартным протоколам. От каждого животного получали 5 срезов на уровне lateral 2.9 мм – lateral 3.9 мм согласно стереотаксическому атласу головного мозга мыши. Полученные срезы промывали в фосфатно-солевом буферном растворе (PBS), блокировали 3%-ным бычьим сывороточным альбумином (BSA; Sigma-Aldrich, США) и 1%-ном Тритоне X-100 (Sigma-Aldrich, США) в PBS. После промывки смесью PBS и 0.2% Тритона X-100 срезы инкубировали с первичными антителами в течение 20 ч. Были использованы первичные антитела: козьи поликлональные к DCX (ab113435; Abcam, Великобритания); мышиные моноклональные к PSA-NCAM (14-9118-82; Invitrogen, США); кроличьи поликлональные к Ki-67 (ab15580; Abcam, Великобритания); все антитела использовали в разведении 1 : 1000.
После инкубации с первичными антителами срезы пятикратно отмывали в PBS и погружали на 1 ч в раствор, содержащий вторичные антитела: козьи антимышиные, Alexa Fluor 488 (ab150117; Abcam, Великобритания), ослиные антикроличьи, Alexa Fluor 647 (ab150073, Великобритания), ослиные антикозьи, Alexa Fluor 555 (ab150073, Abcam, Великобритания); все в разведении 1 : 1000.
В качестве финального этапа иммуногистохимической окраски во всех случаях наносили 30 мкл жидкости для фиксации срезов (70% глицерина в PBS + DAPI для окрашивания ядер клеток), на препарат помещали покровное стекло. Микроскопию срезов, окрашенных на DCX, PSA-NCAM, Ki-67, осуществляли на полностью автоматизированном конфокальном лазерном сканирующем микроскопе с водной иммерсией Olympus FV10i-W (Olympus, Япония). Иммунопозитивными считали клетки, экспрессирующиe DCX/PSA-NCAM и Ki67 (в том числе одновременно) в пириформной коре в пирамидальном слое (второй слой). Анализ изображений проводили с применением пакета программного обеспечения ImageJ (1.47 v, США).
Тест “Fear conditioning” – оценка контекстной памяти мышей. Экспериментальное животное помещали в аппарат (звуконепроницаемую камеру с размерами 31 × 24 × 21 см и решетчатым полом, к которому подведено электричество для создания электрического шока). Выполняли 3 сессии – в первый, второй и третий день соответственно. День 1: обучение, подача в камеру электрического тока (0.5 мА продолжительностью 2 с) в комбинации со звуковым сигналом (2.8 кГц) осуществляли на 120, 180, 240, 300 и 360 с от начала теста. Мышь удаляли из камеры через 60 с после последней подачи электрического тока. Экспериментальные группы СРПЖ с ОС получали обонятельную стимуляцию за 24 ч до начала первой сессии. День 2: оценка запоминания; в камеру подавали только белый шум (1 кГц). День 3: оценка кратковременной памяти в условиях контекста. Мышь помещали в камеру на 5 мин без каких-либо стимуляций для оценки воспроизведения поведенческих реакций, которые она запомнила в первый день при подаче стимулов. Параметры замирания животного (защитную реакцию, которая проявляется как отсутствие движения (кроме дыхания) в течение 0.75 с и дольше) регистрировали с использованием цифровой видеосистемы и программного обеспечения для отслеживания видеосигнала ANY-maze (ANY-maze, США).
Статистическая обработка. Результаты иммуногистохимии обрабатывали с использованием методов описательной статистики, непараметрической статистики (по критерию Манна–Уитни) при сравнении 2 групп. При сравнении трех и более групп использовали дисперссионный двухфакторный анализ Н-Краскала−Уоллеса. Результаты представлены в виде среднего значения и его стандартного отклонения. Статистически значимыми считали различия при p < 0.05 и менее.
Результаты поведенческого теста обрабатывали с использованием методов дисперсионного анализа (двухфакторный Н-Краскала−Уоллеса) с последующим post-hoc-тестом Бонферрони. Результаты представлены в виде среднего значения и его стандартной ошибки. Статистически значимыми считали различия при p < 0.05 и менее.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Животные, перенесшие СРПЖ, демонстрируют в отдаленном периоде онтогенеза изменения в популяционном составе клеток пириформной коры. В частности, при оценке количества клеток с белковыми маркерами DCX и PSA-NCAM, мы обнаружили, что в отличие от животных контрольной группы, животные с СРПЖ на стадии развития Р60 имели значимо сниженное количество этих двух маркеров (рис. 2а). Примечательно, что такое изменение было характерным как для клеток DCX+PSA-NCAM+Ki67+ (пролиферирующих нейробластов, вероятно, мигрирующих в этот регион головного мозга из субвентрикулярной нейрогенной ниши (рис. 2в), так и для клеток DCX+PSA-NCAM+Ki67− (непролиферирующих незрелых клеток, которые фенотипически соответсвуют nng-IN, сохранившимся в коре с периода эмбрионального развития) (рис. 2д). Полученные результаты соответствуют данным о влиянии СРПЖ на аберрантное созревание мозга, которые могут лежать в основе прогрессирующей уязвимости к развитию нейродегенерации, поскольку белок DCX характеризует процессы нейрогенеза и маркирует незрелые клетки: PSA-NCAM (маркер развивающихся и мигрирующих нейробластов), Ki-67 (маркер митотической активности клетки). В частности, предполагают, что СРПЖ, особенно в перинатальном периоде, влияет на созревание областей мозга, отвечающих за когнитивные способности и эмоции, усиливает депрессивно-подобное поведение и вызывает метаболический дисбаланс (Ruiz et al., 2018; Herzberg, Gunnar, 2020).
При предъявлении ОС мы обнаружили, что животные с СРПЖ не демонстрировали характерного для животных контрольной группы изменения количества клеток DCX+PSA-NCAM+Ki67−, а именно, снижения их числа ко 2-му ч после действия стимула, которое мы интерпретировали как результат индукции заключительных этапов дифференцировки и трансформацию в глутаматергические или ГАМКергические нейроны коры (рис. 2д, е). У животных, перенесших СРПЖ, количество DCX+PSA-NCAM+Ki67 клеток оставалось стабильно низким на протяжении всего периода наблюдения после ОС (через 2 и 24 ч). Аналогичная тенденция касалась и клеток DCX+PSA-NCAM+Ki67+ (рис. 2в, г). Примечательно, что к 7-м сут после ОС число клеток DCX+PSA-NCAM+Ki67+ увеличивалось у животных в возрасте 10 мес., перенесших СРПЖ, что может быть объяснено миграцией нейробластов из субвентрикулярной зоны (рис. 2г).
Животные на 10-м мес. постнатального развития, перенесшие СРПЖ, характеризовались тем, что общее количество нейронов DCX+PSA-NCAM+ в пириформной коре соответствовало уровню контроля (рис. 2б), что могло бы быть интерпретировано как некое закономерное для животных этого возраста изменение количества незрелых нейронов в этом регионе головного мозга. Действительно, считается, что по мере старения организма популяция nng-IN нейронов коры и миндалевидного тела может сокращаться, но не за счет гибели, а за счет постоянной – в течение жизни организма – конверсии в глутаматергические нейроны (Rotheneichner et al., 2018; Sorrells et al., 2019).
У животных возраста 10 мес. количество клеток DCX+PSA-NCAM+, которые не обладают митотической активностью (клетки Ki67−), не отличалось в группах контроля и после перенесенного СРПЖ, как, впрочем, и не изменялось в обеих группах после предъявления ОС (2, 24 ч и 7 сут после стимуляции). Однако иным было изменение числа клеток DCX+PSA-NCAM+Ki67+ в пириформной коре: исходное (без стимуляции) их количество было одинаковым в контроле и в группе животных с СРПЖ, но снижение было зарегистрировано ко 2-му ч после ОС в контрольной группе животных, но не в группе животных, перенесших СРПЖ (рис. 2, 3).
Рис. 3.
Пример наличия маркеров PSA-NCAM, DCX и Ki-67 на клетках пириформной коры мышей в группе с СРПЖ в возрасте 10 мес. без ОС (контроль, а) и через 2 ч (б), 24 ч (в) и 7 сут (г) после стимуляции. Головки стрелок (черные) указывают на клетки с колокaлизацией маркеров.

Таким образом, в пириформной коре животных, перенесших СРПЖ, в отдаленном периоде развития регистрируется сниженное количество незрелых клеток нейрональной природы, в том числе нейронов с пролонгированной незрелостью, обладающих низкой респонсивностью при предъявлении ОС. Такая количественная разница маркеров незрелых нейронов животных контрольной группы особенно очевидна на сроке Р60 постнатального развития животных, который соответствует окончанию юношеского периода развития человека. С учетом данных о том, что именно в юношеском периоде значительная часть незрелых нейронов, в том числе, вероятно, nng-IN конвертируется в зрелые глутаматергические нейроны (Sorrells et al., 2019), не удивительно, что к 10-му мес. развития мышей (что соответствует зрелому возрасту человека) (Liu et al., 2020) такие отличия в популяции незрелых клеток пириформной коры фактически утрачиваются.
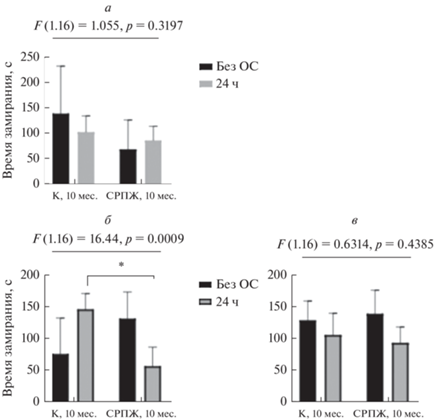
При оценке когнитивного статуса было обнаружено, что обонятельная стимуляция снижала чувствительность к неприятным раздражителям в молодом возрасте (Р60) у животных с СРПЖ (рис. 4), тогда как в возрасте 10 мес. подобного влияния не наблюдали (рис. 5). Также ответ в сессиях на запоминание и контекстуальную кратковременную память был более выражен в молодом возрасте (Р60) у обеих экспериментальных групп.
Рис. 4.
Результаты теста для оценки контекстной памяти (“Fear conditioning” – контекстуальное кондиционирование страха) у животных в возрасте Р60. а – Первый день, стимуляция электрическим током и звуком; б – 2-й день, стимуляция белым шумом; в – 3-й день, условия контекста без стимуляции. К – контрольная группа (без ОС). 24 ч – предварительная ОС за 24 ч до проведения теста. Представлены средние значения и их стандартные ошибки (дисперсионный двухфакторный анализ Н-Краскала−Уоллеса с последующим post-hoc-тестом Бонферрони); * различия достоверны при p < 0.05.
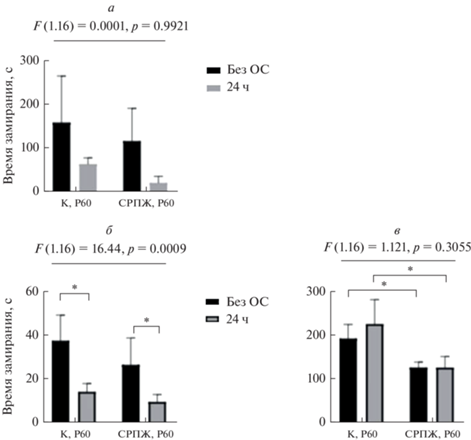
Рис. 5.
Результаты теста “Fear conditioning” (контекстуальное кондиционирование страха) у животных в возрасте 10 мес. а – Первый день, стимуляция электрическим током и звуком; б – 2-й день, стимуляция белым шумом; в – 3-й день, условия контекста без стимуляции. К – контрольная группа (без ОС). 24 ч – предварительная ОС за 24 ч до проведения теста. Другие объяснения см. в подписи к рис. 1.
Необходимы дальнейшие исследования, чтобы выяснить, как (пато)физиологические условия на разных этапах онтогенеза влияют на популяцию незрелых нейронов в коре головного мозга, связано ли это с метаболическими изменениями, которые характерны для процессов дифференцировки незрелых нейронов (Agostini et al., 2016; Iwata, Vanderhaeghen, 2021), как это характерно, например, для клеток нейрогенной ниши гиппокампа (Wang et al., 2020). Логично предполагать, что разработка технологий, уменьшающих влияние стресса на популяцию незрелых нейронов в коре головного мозга, способных конвертироваться в зрелые, функционально компетентные клетки, поможет предотвратить или замедлить развитие нейродегенерации.
Таким образом, в результате проведенного исследования получены новые данные об отсроченном изменении популяции незрелых нейронов пириформной коры после перенесенного СРПЖ. Установлено, что СРПЖ редуцирует число незрелых нейронов с фенотипом DCX+PSA-NCAM+ в пириформной коре головного мозга и их ответ на индукцию обонятельной памяти в отдаленном периоде после перенесенного стресса (P60, 10 мес.). Такие изменения касаются обеих субпопуляций незрелых клеток – Ki67+ и Ki67− (соответственно незрелые клетки, мигрирующие в этот регион мозга из нейрогенных ниш, и собственно нейроны с пролонгированной незрелостью, сохранившие свое присутствие в коре с периода эмбриогенеза). Обонятельная стимуляция снижает чувствительность к неприятным раздражителям в молодом возрасте (Р60) и стимулирует процессы кратковременного запоминания, тогда как в возрасте 10 мес. такой эффект менее выражен.
В целом, стимуляция ольфакторной памяти у животных, перенесших СРПЖ, демонстрирует дефицит присутствия в пириформной коре незрелых нейронов. Коль скоро незрелые нейроны коры в норме способны дифференцироваться в зрелые клетки при действии стимулов, индуцирующих механизмы пластичности мозга, снижение количества таких клеток в пириформной коре в отдаленном периоде после перенесенного СРПЖ свидетельствует в пользу вовлеченности клеток DCX+PSA-NCAM+ в механизмы формирования феномена раннего программирования.
Список литературы
Успенская Ю.А., Малиновская Н.А., Волкова В.В., Панина Ю.А., Рябоконь Р.В., Фролова О.В., Салмина А.Б. 2015. Особенности развития неврологической дисфункции после перинатальной гипоксии головного мозга и стресса раннего периода жизни у экспериментальных животных. Сибирское медицинское обозрение. № 5. С. 49. (Uspenskaya Yu.A., Malinovskaya N.A., Volkova V.V., Panina Yu.A., Ryabokon R.V., Frolova O.V., Salmina A.B. 2015. Development of neurological deficit after perinatal hypoxia and early life stress in laboratory animals. Siberian Medical Review. V. 5. P. 49.)
Agostini M., Romeo F., Inoue S., Niklison-Chirou M.V., Elia A.J., Dinsdale D., Morone N., Knight R.A., Mak T.W., Melino G. 2016. Metabolic reprogramming during neuronal differentiation. Cell Death Differ. V. 23. P. 1502.
Benedetti B., Dannehl D., König R., Coviello S., Kreutzer C., Zaunmair P., Jakubecova D., Weiger T.M., Aigner L., Nacher J., Engelhardt M., Couillard-Després S. 2020. Functional integration of neuronal precursors in the adult murine piriform cortex. Cereb. Cortex. V. 30. P. 1499.
Berdugo-Vega G., Arias-Gil G., López-Fernández A., Artegiani B., Wasielewska J.M., Lee C.-C., Lippert M.T., Kempermann G., Takagaki K., Calegari F. 2020. Increasing neurogenesis refines hippocampal activity rejuvenating navigational learning strategies and contextual memory throughout life. Nat. Commun. V. 11. P. 135.
Besnard A., Sahay A. 2021. Enhancing adult neurogenesis promotes contextual fear memory discrimination and activation of hippocampal-dorsolateral septal circuits. Behav. Brain Res. V. 399. P. 112917.
Bonfanti L., Seki T. 2021. The PSA-NCAM-positive “immature” neurons: an old discovery providing new vistas on brain structural plasticity. Cells. V. 10. P. 2542.
Coviello S., Gramuntell Y., Castillo-Gomez E., Nacher J. 2020. Effects of dopamine on the immature neurons of the adult rat piriform cortex. Front. Neurosci. V. 14. P. 574234.
Fogelman N., Canli T. 2019. Early life stress, physiology, and genetics: a review. Front. Psychol. V. 10. P. 1668.
Gómez-Climent M.A., Castillo-Gómez E., Varea E., Guirado R., Blasco-Ibáñez J.M., Crespo C., Martínez-Guijarro F.J., Nácher J. 2008. A population of prenatally generated cells in the rat paleocortex maintains an immature neuronal phenotype into adulthood. Cereb. Cortex. V. 18. P. 2229.
Gómez-Climent M.A., Guirado R., Castillo-Gómez E., Varea E., Gutierrez-Mecinas M., Gilabert-Juan J., García-Mompó C., Vidueira S., Sanchez-Mataredona D., Hernández S., Blasco-Ibáñez J.M., Crespo C., Rutishauser U., Schachner M., Nacher J. 2011. The polysialylated form of the neural cell adhesion molecule (PSA-NCAM) is expressed in a subpopulation of mature cortical interneurons characterized by reduced structural features and connectivity. Cereb. Cortex. V. 21. P. 1028.
Herzberg M.P., Gunnar M.R. 2020. Early life stress and brain function: activity and connectivity associated with processing emotion and reward. Neuroimage. V. 209. P. 116493.
Huang L.-T. 2014. Early-life stress impacts the developing hippocampus and primes seizure occurrence: cellular, molecular, and epigenetic mechanisms. Front. Mol. Neurosci. V. 7. P. 8.
Iwata R., Vanderhaeghen P. 2021. Regulatory roles of mitochondria and metabolism in neurogenesis. Curr. Opin. Neurobiol. V. 69. P. 231.
Kronman H., Torres-Berrío A., Sidoli S., Issler O., Godino A., Ramakrishnan A., Mews P., Lardner C.K., Parise E.M., Walker D.M., van der Zee Y.Y., Browne C.J., Boyce B.F., Neve R., Garcia B.A. et al. 2021. Long-term behavioral and cell-type-specific molecular effects of early life stress are mediated by H3K79me2 dynamics in medium spiny neurons. Nat. Neurosci. V. 24. P. 667.
La Rosa C., Parolisi R., Bonfanti L. 2020. Brain structural plasticity: from adult neurogenesis to immature neurons. Front. Neurosci. V. 14. P. 75.
Liu J.-H., Wang Q., You Q.-L., Li Z.-L., Hu N.-Y., Wang Y., Jin Z.-L., Li S.-J., Li X.-W., Yang J.-M., Zhu X.-H., Dai Y.-F., Xu J.-P., Bai X.-C., Gao T.-M. 2020. Acute EPA-induced learning and memory impairment in mice is prevented by DHA. Nat. Commun. V. 11. P. 5465.
Malinovskaya N.A., Morgun A.V., Lopatina O.L., Panina Y.A., Volkova V.V., Gasymly E.L., Taranushenko T.E., Salmina A.B. 2018. Early life stress: consequences for the development of the brain. Neurosci. Behav. Physiol. 2018. V. 48. P. 233.
Mirescu C., Peters J.D., Gould E. 2004. Early life experience alters response of adult neurogenesis to stress. Nat. Neurosci. V. 7. P. 841.
Piumatti M., Palazzo O., La Rosa C., Crociara P., Parolisi R., Luzzati F., Lévy F., Bonfanti L. 2017. Non-newly generated, “immature” neurons in the sheep brain are not restricted to cerebral cortex J. Neurosci. V. 38. P. 826.
Rotheneichner P., Belles M., Benedetti B., König R., Dannehl D., Kreutzer C., Zaunmair P., Engelhardt M., Aigner L., Nacher J., Couillard-Despres S. 2018. Cellular plasticity in the adult murine piriform cortex: continuous maturation of dormant precursors into excitatory neurons. Cereb. Cortex. V. 28. P. 2610.
Ruiz R., Roque A., Pineda E., Licona-Limón P., Valdéz–Alarcón J.J., Lajud N. 2018. Early life stress accelerates age-induced effects on neurogenesis, depression, and metabolic risk. Psychoneuroendocrinol. V. 96. P. 203.
Salmina A.B., Gorina Y.V., Komleva Y.K., Panina Y.A., Malinovskaya N.A., Lopatina O.L. 2021. Early life stress and metabolic plasticity of brain cells: impact on neurogenesis and angiogenesis. Biomed. V. 9. P. 1092.
Schellinck H.M., Forestell C.A., LoLordo V.M. 2001. A simple and reliable test of olfactory learning and memory in mice. Chem. Senses. V. 26. P. 663.
Sorrells S.F., Paredes M.F., Velmeshev D., Herranz-Pérez V., Sandoval K., Mayer S., Chang E.F., Insausti R., Kriegstein A.R., Rubenstein J.L., Garcia-Verdugo J.M., Huang E.J., Alvarez-Buylla A. 2019. Immature excitatory neurons develop during adolescence in the human amygdala. Nat. Commun. V. 10. P. 2748.
Vadodaria K.C., Yanpallewar S.U., Vadhvani M., Toshniwal D., Cameron Liles L., Rommelfanger K.S., Weinshenker D., Vaidya V.A. 2017. Noradrenergic regulation of plasticity marker expression in the adult rodent piriform cortex. Neurosci. Lett. V. 644. P. 76.
Wang X., Liu H., Morstein J., Novak A.J.E., Trauner D., Xiong Q., Yu Y., Ge S. 2020. Metabolic tuning of inhibition regulates hippocampal neurogenesis in the adult brain. Proc. Natl. Acad. Sci. USA. V. 117. P. 25818.
Дополнительные материалы отсутствуют.


