Журнал аналитической химии, 2020, T. 75, № 4, стр. 327-332
Влияние условий отбора образцов слюны человека на результаты определения макро- и микроэлементов
С. С. Савинов a, *, А. А. Анисимов a
a Санкт-Петербургский государственный университет, Институт химии
199034 Санкт-Петербург, Университетская наб., 7/9, Россия
* E-mail: s.s.savinov@spbu.ru
Поступила в редакцию 28.12.2018
После доработки 24.04.2019
Принята к публикации 30.10.2019
Аннотация
Рассмотрены и обсуждены экспериментальные результаты по выявлению влияния циркадного ритма, стимуляции слюноотделения при пробоотборе, условий хранения и пробоподготовки (на примере совместного использования центрифугирования и замораживания) на концентрации определяемых макро- и микроэлементов в слюне человека методом дуговой атомно-эмиссионной спектрометрии по способу сухого остатка. Показано, что указанные факторы приводят к уменьшению концентрации элементов в анализируемых пробах, что необходимо принимать во внимание при интерпретации результатов, полученных по различным схемам анализа.
Элементы, присутствующие в организме человека, принято разделять в зависимости от их воздействия на эссенциальные и токсичные [1]. Однако эссенциальные элементы при повышенном поступлении также могут проявлять токсическое действие. Определение как микроэлементного баланса, так и содержания отдельных элементов в различных биологических объектах может быть использовано при мониторинге состояния организма, оценке влияния окружающей среды, диагностировании заболеваний [2, 3]. Для биомониторинга традиционными биожидкостями являются кровь (и ее компоненты) и моча. Однако в последнее время возрастает интерес к слюне как биообразцу, благодаря ряду преимуществ ее использования [2, 4]. Естественно, что правильность получаемых результатов и корректность их интерпретации, зависящие в том числе от манипуляций с пробами, являются одними из актуальных вопросов при использовании этого биосубстрата [5].
В настоящее время представлено множество данных о влиянии циркадного ритма, различных форм стимуляции, продолжительности пробоотбора, приема пищи и курения на результаты анализа слюны [5–14]. Однако хорошо изучен лишь случай определения органических веществ в слюне. При изучении влияния циркадного ритма на содержание гистамина и мочевой кислоты в человеческой слюне установлены акрофазы в 6 и 18 ч, согласующиеся с максимальным слюноотделением у людей в данные промежутки времени [6]. При определении концентраций ряда неорганических электролитов, белков и углеводов выявлены ритмы, описываемые синусоидальной кривой с 24-часовым периодом [7]. Концентрация гормона прогестерона выше в утренние часы, чем в вечерние [8].
Искусственная стимуляция слюноотделения также может сказываться на концентрации компонентов слюны. В частности, при стимуляции лимонной кислотой выделения слюны околоушными железами установлено, что содержание кальция(II) во флюиде существенно изменяется по отношению к содержанию элемента в нестимулированной слюне [7]. В то же время стимуляция лимонной кислотой и глицерином не влияет на изменение уровня кортизола [9]. Прием пищи и курение могут влиять на состав слюны из-за краткосрочных физиологических изменений в работе слюнных желез. Известно, что содержание гормона грелина после выкуривания одной сигареты значимо снижается во флюиде [10].
При анализе биологических жидкостей достаточно часто этапы отбора образцов и их анализа разделены во времени. В этих случаях пробы слюны обычно центрифугируют (с целью удаления клеточного дебриса, муцини и других крупных молекул и частиц [11]) и/или замораживают. Установлено, что каждый из этих этапов оказывает влияние по получаемые результаты, например, хранение слюны при отрицательных температурах значительно увеличивает погрешность определения концентраций ряда гормонов [12, 13], аналогичное явление имеет место и при центрифугировании [14]. При определении макро- и микроэлементов в слюне также обнаружено уменьшение их концентраций при предварительном центрифугировании и замораживании образцов [5]. Однако вопрос совместного влияния этих процессов остается малоизученным.
Исследования, указывающие на существенное влияние процедур пробоотбора и пробоподготовки слюны человека и внешних факторов на результаты анализа, подтверждают важность этого этапа. При этом в большинстве исследований установлено влияние перечисленных выше факторов на содержание органических веществ в образце, для случая же определения микроэлементов представлено малое количество данных.
Цель работы состояла в установлении влияния особенностей отбора и хранения образцов слюны на результаты последующего определения макро- и микроэлементов с использованием высокочувствительного метода атомно-эмиссионной спектрометрии с возбуждением спектра сухого остатка пробы с торца угольного электрода в дуговом разряде переменного тока [15, 16].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Отбор проб. Все доноры образцов были заранее предупреждены о дате отбора и кратко проинструктированы по предстоящей методике отбора проб. Образцы отбирали в течение единого 2-часового интервала времени, чтобы свести к минимуму возможные циркадные изменения микроэлементного состава слюны (за исключением эксперимента по выявлению влияния циркадного ритма). Волонтеры перед отбором проб не принимали пищи в течение не менее 1.5 ч и воздерживались от курения (если это было необходимо) в течение 0.5 ч для предотвращения влияния данных факторов на результаты анализа (за исключением эксперимента по выявлению влияния курения). Непосредственно перед отбором слюны волонтеры ополаскивали ротовую полость деионизованной водой. Слюну, образовавшуюся в течение первой минуты, сплевывали и не использовали для анализа. Далее волонтерам были предоставлены стеклянные стаканчики, в которые посредством сплевывания набиралось около 2 мл образца слюны. В среднем этот процесс занимал от 5 до 15 мин (в редких случаях доходил до 0.5 ч). Образцы слюны собирали без какой-либо стимуляции ее выделения (за исключением эксперимента по выявлению влияния стимуляции). После отбора все образцы были зашифрованы и анонимизированы.
Схема анализа. Для определения концентраций элементов использовали схему атомно-эмиссионного цифрового спектрографического анализа малых объемов жидких проб с возбуждением спектра сухого остатка пробы с торца угольного электрода в дуге переменного тока [15, 16]. Достоинством этой методики является существенно меньшая стоимость используемого оборудования и расходных материалов по сравнению с методами масс-спектрометрии и атомно-эмиссионной спектрометрии (АЭС) с индуктивно связанной плазмой, а также нивелирование влияния биоосновы на правильность анализа. Исследования выполняли на установке МФС-8 (ЛОМО, Санкт-Петербург, Россия) с шириной входной щели спектрографа 50 мкм для увеличения интенсивности регистрируемых аналитических линий [17, 18]. В качестве детектора использовали многоканальный анализатор эмиссионных спектров МАЭС (ВМК-Оптоэлектроника, Новосибирск, Россия), который регистрирует спектр в интервале 197‑343 нм [19, 20]. Спектральные данные обрабатывали с помощью программы “Атом” [21]. Электропитание дугового разряда осуществляли от генератора ИВС-28 (АОМЗ, Азов, Россия) при силе тока 20 А в течение 20 с. В качестве аналитического сигнала использовали интегральную по всему контуру спектральной линии и суммарную по времени полной экспозиции интенсивность с учетом фонового излучения и контрольного опыта [22]. Концентрации определяли по градуировочным зависимостям, установленным по стандартным водным растворам элементов (MerckKGaA, Дармштадт, Германия). Стабильность градуировочной характеристики контролировали с помощью двух стандартных растворов с концентрациями на различных участках рабочего диапазона, которые анализировали вместе с пробами слюны. Отличие экспериментально определенной концентрации от известного значения не превышало погрешность методики. Пробы слюны объемом 150 мкл (15 капель по 10 мкл) последовательно наносили на торец угольных электродов марки “Искра”, класс F (Карботэк, Москва, Россия), предварительно подготовленных в соответствии с методикой, и выпаривали под инфракрасной лампой. С образцами слюны перед нанесением их проб на электроды не проводили никаких манипуляций, т.е. анализировали цельную только что отобранную слюну (за исключением эксперимента по выявлению совместного влияния центрифугирования и замораживания). Далее для нивелирования матричного влияния на торец электродов наносили 150 мкг NaCl ос. ч. (Merck KGaA, Дармштадт, Германия) в виде 10 мкл водного раствора с концентрацией 15 г/л, который также выпаривали под инфракрасной лампой. Анализировали по 9 параллельных проб каждого образца. Проверка правильности путем сравнительного анализа одного образца напрямую по описанной схеме и методом АЭС с индуктивно связанной плазмой после кислотной минерализации, а также путем анализа одного образца с различным наносимым на торец электрода объемом пробы (аналогично [23, 24]), подтвердила отсутствие влияния макросостава биопроб на результаты анализа (табл. 1). При формулировании выводов относительно значимости влияния какого-либо фактора на результаты определения микроэлементного состава слюны попарно сравнивали получаемые средние значения концентраций (с помощью t-критерия значимости, p < 0.05) и их дисперсии (с помощью критерия Фишера, p < 0.05) для каждого определяемого элемента и каждого фактора влияния. В случае, если для рассматриваемого фактора сравниваемые концентрации были равнорассеянными, а их средние значения различались незначимо, делали вывод о незначимости данного фактора, в противном случае считали, что влияние фактора на определяемые концентрации значимо [25].
Таблица 1.
Концентрации некоторых элементов в одном образце слюны при различном объеме V пробы, нанесенном на электрод (n = 9, P = 0.95)
| Элемент | V, мл | c, мг/л | Элемент | V, мл | c, мг/л |
|---|---|---|---|---|---|
| Al | 0.10 | 0.10 ± 0.02 | Mn | 0.10 | 0.047 ± 0.005 |
| 0.15 | 0.09 ± 0.02 | 0.15 | 0.048 ± 0.005 | ||
| 0.20 | 0.11 ± 0.02 | 0.20 | 0.050 ± 0.006 | ||
| Ca | 0.10 | 210 ± 10 | P | 0.10 | 270 ± 20 |
| 0.15 | 220 ± 10 | 0.15 | 250 ± 20 | ||
| 0.20 | 220 ± 10 | 0.20 | 260 ± 20 | ||
| Cr | 0.10 | 0.063 ± 0.006 | Pb | 0.10 | <0.018 |
| 0.15 | 0.057 ± 0.006 | 0.15 | 0.012 ± 0.002 | ||
| 0.20 | 0.056 ± 0.005 | 0.20 | 0.012 ± 0.002 | ||
| Cu | 0.10 | 0.037 ± 0.004 | Si | 0.10 | 1.8 ± 0.2 |
| 0.15 | 0.035 ± 0.004 | 0.15 | 1.7 ± 0.2 | ||
| 0.20 | 0.039 ± 0.005 | 0.20 | 1.9 ± 0.2 | ||
| Fe | 0.10 | 0.42 ± 0.05 | Ti | 0.10 | 0.093 ± 0.012 |
| 0.15 | 0.39 ± 0.04 | 0.15 | 0.092 ± 0.011 | ||
| 0.20 | 0.40 ± 0.05 | 0.20 | 0.094 ± 0.010 | ||
| Mg | 0.10 | 21 ± 1 | Zn | 0.10 | 0.19 ± 0.02 |
| 0.15 | 19 ± 1 | 0.15 | 0.18 ± 0.02 | ||
| 0.20 | 20 ± 1 | 0.20 | 0.17 ± 0.02 |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Влияние циркадного ритма. Для выявления влияния циркадного ритма на содержание элементов в слюне отбирали образцы у 5 доноров в течение дня с 10 до 18 ч с интервалом в 2 ч. При обработке данных получили две группы определяемых элементов. Для первой группы (Al, Cr, Cu, Fe, Mg, Mn, Pb, Si, Ti, Zn) характерно снижение содержания элементов во флюиде с последующим выходом на постоянное значение в течение указанного временного интервала, что проиллюстрирует рис. 1. Во вторую группу элементов, содержание которых не изменяется в течение дня, входят Ca и P.
Рис. 1.
Изменение содержания хрома (1) и меди (2) при отборе проб слюны в различные промежутки времени t в течение дня.
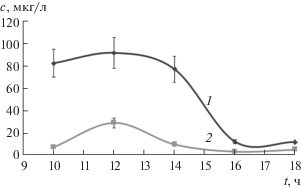
Исходя из полученных данных, можно заключить, что при использовании слюны в качестве объекта для клинической диагностики при определении микроэлементов необходимо учитывать изменение состава в течение дня. Принимая во внимание, что ко второй половине дня (после 15 ч) содержание микроэлементов в слюне выходит на постоянное значение, оптимальным временем для отбора образцов можно считать именно этот период (аналогично определению органических компонентов [7]). В случае необходимости осуществления пробоотбора в другое время следует использовать минимальный по длительности и жестко фиксированный временной интервал.
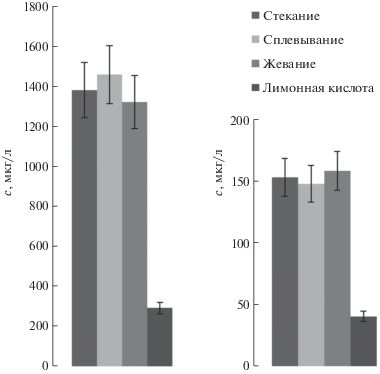
Влияние стимуляции слюноотделения. Стимуляция слюноотделения позволяет значительно сократить продолжительность пробоотбора, однако, как отмечено выше, она может влиять на содержание различных веществ в образце. Для выявления степени влияния различных видов стимуляции от 5 различных доноров отобрали по 4 пробы посредством 1) свободного стекания (отсутствие механической стимуляции, естественное слюноотделение), 2) сплевывания по мере накапливания (незначительная механическая стимуляция при работе челюстных мышц), 3) жевания стерильной ваты (интенсивная механическая стимуляция при полной работе челюстных мышц), 4) воздействия лимонной кислотой на слизистые оболочки полости рта (химическая стимуляция). Все 4 пробы у одного донора согласно рекомендациям [5] отбирали с интервалом не менее 15 мин. Установлено, что содержания исследуемых элементов в слюне при стекании и сплевывании одинаковы, при стимуляции жеванием получаются результаты, близкие к стеканию только для ряда элементов, воздействие лимонной кислотой давало наименьшие результаты для большинства элементов (рис. 2). Подобные данные свидетельствуют о том, что сплевывание следует использовать как основной метод пробоотбора, так как он занимает меньше времени, чем стекание, и позволяет получить представительный образец (идентичный по содержанию микроэлементов образцу, получаемому при естественном стекании).
Рис. 2.
Содержание кремния (слева) и железа (справа) в пробе слюны при отборе методами стекания, сплевывания, воздействия лимонной кислотой и жевания.
Влияние курения. При изучении влияния курения на содержание элементов в слюне отобрали по 3 пробы (до, сразу после и через час после курения сигарет) от 4 различных доноров. При сравнении получаемых концентраций элементов в данных пробах не выявили значимого различия (в пределах погрешности метода), что свидетельствует о незначимости этого фактора на результаты анализа.
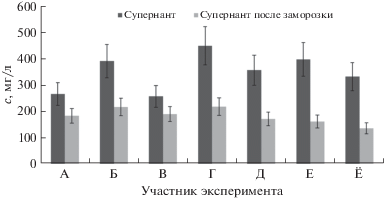
Влияние центрифугирования и замораживания проб. Ранее при определении макро- и микроэлементов в слюне выявлено уменьшение их концентраций при предварительном центрифугировании и замораживании образцов [5]. В связи с этим представляло интерес изучение совместного действия данных факторов. Для этого отобрали пробы от 7 различных доноров. Каждый образец разделили на две части, первую анализировали сразу же после центрифугирования, вторую − после центрифугирования сохраняли при –10°С в течение нескольких дней, после чего размораживали и анализировали. При сравнении результатов анализа данных проб выделили две группы элементов по степени изменения их содержания. Первая группа – Al, Cr, Cu, Mn, Si, Ti, содержание которых в супернатанте не изменяется (в пределах погрешности метода) при хранении в замороженном виде. Вторая группа – Ca, Fe, P и Pb, для которых наблюдается значительное снижение их содержания в супернатанте после хранения в замороженном виде по сравнению со свежеполученным супернатантом (на рис. 3 для примера представлены результаты определения кальция). Третья группа – Mg и Zn, для которых не удалось выявить четкую зависимость, т.е. зафиксировали как уменьшение, так и неизменность содержания микроэлементов в образцах супернатантов. Поскольку снижение содержания макро- и микроэлементов (Ca, Fe, P, Pb, Mg, Zn), отмеченное при замораживании супернатанта слюны, имело место и при замораживании образцов цельной слюны, основной причиной такого результата скорее всего является именно способ консервации пробы.
* * *
Таким образом, показано, что циркадный ритм значимо влияет на концентрации макро- и микроэлементов в образцах слюны. Различные виды стимуляции слюноотделения, включая механическую и химическую, также приводят к изменению элементного состава получаемых проб. Центрифугирование образцов слюны, а также их замораживание приводят к уменьшению концентрации элементов в анализируемых пробах по сравнению с исходной свежеотобранной пробой цельной слюны. Данные факты необходимо принимать во внимание при сопоставлении результатов, полученных различными исследователями при реализации разных схем пробоотбора и пробоподготовки, поскольку в противном случае отсутствует возможность корректной интерпретации результатов.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-33-00022 мол_а. Авторы выражают благодарность ресурсному центру Научного парка СПбГУ “Ресурсный Образовательный Центр по направлению химия” и ООО “ВМК-Оптоэлектроника”, чье оборудование было использовано при выполнении исследования.
Список литературы
Авцын А.П., Жаворонков А.А., Риш М.А., Строч-кова Л.С. Микроэлементозы человека. Этиология, классификация, органопатология. М.: Медицина, 1991. 496 с.
Chiappin S., Antonelli G., Gatti R., De Palo E.F. Saliva specimen: A new laboratory tool for diagnostic and basic investigation // Clin. Chim. Acta. 2007. V. 383. № 1–2. P. 30.
Lee J.M., Garon E., Wong D.T. Analyzing saliva to diagnose and monitor health status // Dent. Abstracts. 2011. V. 56. № 1. P. 53.
Crouch D.J. Oral fluid collection: the neglected variable in oral fluid testing // Forensic Sci. Int. 2005. V. 150. № 2–3. P. 165.
Савинов С.С., Анисимов А.А., Дробышев А.И. Проблемы и оптимизация отбора образцов, их хранения и пробоподготовки при определении микроэлементного состава слюны человека // Журн. аналит. химии. 2016. Т. 71. № 10. С. 1063. (Savinov S.S., Anisimov A.A., Drobyshev A.I. Problems and optimization of sampling, storage, and sample preparation in the determination of the trace element composition of human saliva // J. Analyt. Chem. 2016. V. 71. № 10. P. 1016.)
Castagnola M., Cabras T., Denotti G., Fadda M.B., Gambarini G., Lupi A., Manca I., Onnis G., Piras V., Soro V., Tambaro S., Messana I. Circadian rhythms of histatin 1, histatin 3, histatin 5, statherin and uric acid in whole human saliva secretion // Biol. Rhythm Res. 2002. V. 33. № 2. P. 213.
Ferguson D.B., Botchway C.A. Circadian variations in flow-rate and composition of human stimulated sub-mandibular saliva // Arch. Oral Biol. 1979. V. 24. № 6. P. 433.
Konishi S., Brindle E., Guyton A., O’Connor K.A. Salivary concentration of progesterone and cortisol significantly differs across individuals after correcting for blood hormone values // Am. J. Phys. Anthropol. 2012. V. 149. № 2. P. 231.
Brorsson C., Dahlqvist P., Nilsson L., Naredi S. Saliva stimulation with glycerine and citric acid does not affect salivary cortisol levels // Clin. Endocrinol. 2014. V. 81. № 2. P. 244.
Kaabi Y.A., Khalifa M.A. Acute one-cigarette smoking decreases ghrelin hormone in saliva: A pilot study // Int. J. Endocrinol. 2014. V. 2014. P. 575671.
Wang D., Du X., Zheng W. Alteration of saliva and serum concentrations of manganese, copper, zinc, cadmium and lead among career welders // Toxicol. Lett. 2008. V. 176. № 1. P. 40.
de Jong E.P., van Riper S.K., Koopmeiners J.S., Carlis J.V., Griffin T.J. Sample collection and handling considerations for peptidomic studies in whole saliva; implications for biomarker discovery // Clin. Chim. Acta. 2011. V. 412. № 23–24. P. 2284.
Toone R.J., Peacock O.J., Smith A.A., Thompson D., Drawer S., Cook C., Stokes K.A. Measurement of steroid hormones in saliva: effects of sample storage condition // Scand. J. Clin. Lab. Inv. 2013. V. 73. № 8. P. 615.
Durdiakova J., Fabryova H., Koborova I., Ostatnikova D., Celec P. The effects of saliva collection, handling and storage on salivary testosterone measurement // Steroids. 2013. V. 78. № 14. P. 1325.
Дробышев А.И., Савинов С.С. Дуговой атомно-эмиссионный цифровой спектрографический анализ жидких биопроб с использованием МАЭС // Заводск. лаборатория. Диагностика материалов. 2015. № 1(II). С. 142.
Савинов С.С., Дробышев А.И. Возможности атомно-эмиссионной цифровой спектрографии с дуговым возбуждением спектра в анализе жидких объектов // Вестн. СПбГУ. Серия 4: физика, химия. 2013. № 3. С. 98.
Дробышев А.И., Савинов С.С. Экспериментальное исследование светосилы цифрового спектрографа на базе МФС-МАЭС // Оптика и спектроскопия. 2016. Т. 120. № 2. С. 349. (Drobyshev A.I., Savinov S.S. An experimental study of the luminosity of an MFC–MAES-based digital spectrograph // Optics Spectrosс. 2016. V. 120. № 2. P. 335.)
Дробышев А.И., Савинов С.С. Экспериментальное исследование аппаратной функции и разрешающей способности оптического цифрового спектрографа на базе полихроматора МФС // Оптический журн. 2014. Т. 81. № 1. С. 44. (Drobyshev A.I., Savinov S.S. Experimental study of the spread function and resolving power of an optical digital spectrograph based on an MFS polychromator // J. Opt. Technol. 2014. V. 81. № 1. P. 33.)
Лабусов В.А., Попов В.И., Путьмаков А.Н., Бехтерев А.В., Селюнин Д.О. Анализаторы МАЭС и их использование в качестве систем регистрации и обработки атомно-эмиссионных спектров // Аналитика и контроль. 2005. Т. 9. № 2. С. 110.
Лабусов В.А., Гаранин В.Г., Шелпакова И.Р. Многоканальные анализаторы атомно-эмиссионных спектров. Современное состояние и аналитические возможности // Журн. аналит. химии. 2012. Т. 67. № 7. С. 697. (Labusov V.A., Garanin V.G., Shelpakova I.R. Multichannel analyzers of atomic emission spectra: current state and analytical potentials // J. Analyt. Chem. 2012. V. 67. № 7. P. 632.)
Гаранин В.Г., Неклюдов О.А., Петроченко Д.В., Семёнов З.В., Шаталов И.Г., Панкратов С.В. Программное обеспечение атомно-эмиссионного спектрального анализа (программа “Атом”) // Заводск. лаборатория. Диагностика материалов. 2012. Т. 78. № 1(II). С. 69.
Дробышев А.И., Савинов С.С. О некоторых особенностях регистрации спектра и фотометрирования спектральных линий с помощью цифрового спектрографа на базе МФС–МАЭС // Приборы и техника эксперимента. 2013. № 6. С. 56. (Drobyshev A.I., Savinov S.S. On certain features of spectrum recording and photometric measurements of spectral lines using a MFS–MAES-based digital spectrograph // Instrum. Exp. Tech. 2013. V. 56. № 6. P. 693.)
Дробышев А.И., Рядчикова Н.А., Савинов С.С. Атомно-эмиссионный анализ волос человека на содержание микроэлементов // Журн. аналит. химии. 2016. Т. 71. № 7. С. 745. (Drobyshev A.I., Ryadchikova N.A., Savinov S.S. Atomic emission analysis of human hair for the presence of trace elements // J. Analyt. Chem. 2016. V. 71. № 7. P. 717.)
Савинов С.С., Будаляева Р.М., Дробышев А.И. Атомно-эмиссионный анализ ногтей человека на содержание микроэлементов // Журн. аналит. химии. 2018. Т. 73. № 2. С. 106. (Savinov S.S., Budalyaeva R.M., Drobyshev A.I. Atomic emission analysis of human nails for the content of trace elements // J. Analyt. Chem. 2018. V. 73. №. 2. P. 133.)
Родинков О.В., Бокач Н.А., Булатов А.В. Основы физико-химических измерений и химического анализа. СПб: ВВМ, 2010. 132 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии