Журнал аналитической химии, 2020, T. 75, № 4, стр. 360-367
Гибридные нанокомпозиты как модификаторы электродов амперометрических иммуносенсоров при определении амитриптилина
Э. П. Медянцева a, *, Д. В. Брусницын a, Э. Р. Газизуллина a, Р. М. Варламова a, О. А. Коновалова b, Г. К. Будников a
a Казанский (Приволжский) федеральный университет, Химический институт им. А.М. Бутлерова
420008 Казань, ул. Кремлевская, 18, Россия
b Казанский (Приволжский) федеральный университет, Институт физики
420008 Казань,
ул. Кремлевская, 18, Россия
* E-mail: emedyant@gmail.com
Поступила в редакцию 20.12.2018
После доработки 29.01.2019
Принята к публикации 07.10.2019
Аннотация
Различные наноструктурированные материалы (графена, фуллерен С60, углеродные нанотрубки и наночастицы кобальта как метку) использованы в качестве нанокомпозитов для модификации поверхности первичных преобразователей сигнала (печатный графитовый электрод) при разработке амперометрических иммуносенсоров для определения трициклического антидепрессанта амитриптилина. Применение наноматериалов позволило улучшить аналитические характеристики соответствующих иммуносенсоров. Диапазон рабочих концентраций иммуносенсора составил 1 × 10–9–1 × 10–4 М, нижняя граница определяемых содержаний на уровне 5 × 10–10 М. Определены константы связывания иммунных комплексов антиген–антитело. Иммуносенсоры апробированы при контроле содержания лекарственных препаратов в моче.
Лекарственные препараты чаще всего определяют с применением хроматографических методов [1–3]. В то же время развитие биосенсорных технологий способствует повышению чувствительности и селективности анализов, в частности, за счет разработки иммуносенсоров [4–6]. Еще одна тенденция – использование в конструкциях иммуносенсоров современных наноструктурированных материалов [7–9].
Большое число публикаций последнего времени посвящено определению антибиотиков [10, 11]. Сведений об определении антидепрессантов значительно меньше [12, 13], хотя они играют важную роль в жизни человека из-за увеличения числа стрессовых ситуаций. Как следствие, с одной стороны, необходимо контролировать качество антидепрессантов и выявлять фальсифицированную продукцию, а с другой, – их количество в биологических жидкостях.
Наномодификаторы различной природы можно получить в присутствии полимеров [14–16]. Имеются сведения о применении для этих целей дендримеров [17–19]. Данные об использовании полиэфирополиолов отсутствуют, хотя, исходя из строения, их применение для получения наномодификаторов представляется весьма перспективным.
Особое внимание при разработке иммуносенсоров уделяют веществам, которые могут играть роль меток и обеспечивать аналитический сигнал при регистрации иммунологических реакций. Наиболее часто для этих целей используют некоторые ферменты. Описано применение в качестве метки пероксидазы хрена и холинэстеразы [20, 21]. С развитием нанотехнологий в качестве меток стали использовать наночастицы золота и серебра [22, 23]. Сведения относительно использования наночастиц кобальта в качестве меток при иммунохимических определениях в литературе отсутствуют.
Помимо иммуносенсоров используют и другие варианты иммунохимического определения лекарственных препаратов. Описано определение антибиотиков методом поляризационного флуоресцентного иммуноанализа [24, 25], который является одним из высокочувствительных и специфичных методов. Однако чувствительность этого метода сильно зависит от свойств выбранного трейсера.
Цель настоящего исследования – разработка новых амперометрических иммуносенсоров на основе печатных графитовых электродов, модифицированных фуллереном (C60), восстановленным оксидом графена (ВГО), углеродными нанотрубками (УНТ), наночастицами кобальта (НЧCo) и оценка их аналитичеcких возможностей при определении содержания антидепрессантов в лекарственных формах и в биологических жидкостях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве основы амперометрических иммуносенсоров применяли печатные графитовые электроды системы 3 × 1 (изготовлены на кафедре аналитической химии КФУ и фирмой “Русал”, Москва, Россия), описанные в работе [26]. В качестве модификаторов поверхности использовали коммерчески доступные углеродные наноматериалы (УНТ, ВГО, С60) и НЧCo, которые получали электрохимически [27].
Для получения дисперсий углеродных наноматериалов применяли аминопроизводные на платформе полиэфирополиола второй генерации (Н20-NH2) полученные на кафедре неорганической химии КФУ (Казань, Россия). Исходная концентрация получаемых дисперсий составляла 2 мг/мл. Модифицированные электроды сушили при комнатной температуре (20 ± 2°C) не менее суток.
Поликлональные антитела против трициклических антидепрессантов (предоставлены проф. Ереминым С.А., МГУ) иммобилизовали на поверхность модифицированных электродов (ВГО-УНТ-Н20-NH2/НЧСо, С60-ВГО-Н20-NH2/НЧСо), используя в качестве матричного компонента Н20-NH2. В качестве сшивающего реагента применяли водный раствор глутарового альдегида (ГА) (ICN Biomedicals Ins., США).
Фосфатные буферные растворы с рН (6.2–8.0), боратный буферный раствор с pH 8.5 готовили из препаратов х. ч. и ч. д. а. (ЗАО “Лаверна”, Россия). Использовали лекарственное вещество амитриптилин (Sigma-Aldrich, США).
Для электрохимических измерений использовали потенциостат/гальваностат 204N (Autolab, Netherlands) со встроенным модулем FRA32M (модуль для измерения спектроскопии электрохимического импеданса). Условия получения диаграмм Найквиста: ν (частота) = 0.04–105 Гц, А (амплитуда) 5 мВ. Микроскопические изображения получали на атомно-силовом микроскопе (АСМ) SolverP47H (ЗАО “НТ-MДТ”, Россия). При приготовлении растворов амитриптилина использовали центрифугу MiniSpin (Eppendorf, Германия).
Для получений дисперсий наноструктурированных материалов применяли ультразвуковую (УЗ) ванну модели S30H (Elmasonic, Германия) с частотой УЗ 37 КГц.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Характеристика гибридных нанокомпозитов, используемых при создании иммуносенсоров. Поскольку модифицированные печатные графитовые электроды служили основой разрабатываемого иммуносенсора, исследовали гибридные наноматериалы, используемые для этих целей.
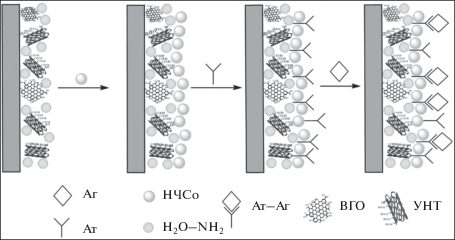
Углеродные наноструктурированные материалы в составе дисперсии взаимодействуют определенным образом с H20-NH2, что подробно описано в работе [28]. Взаимодействие УНТ с поверхностью электрода описано в работе [29].
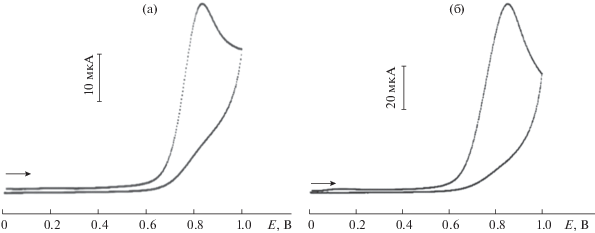
Циклическая вольтамперометрия. В первую очередь для модификации рабочей поверхности электрода на нее наносили нанокомпозиты (С60, ВГО, УНТ). Затем электрохимически наносили НЧCo. Электрохимические способы получения наночастиц металлов обеспечивают более прочное закрепление наночастиц на поверхности электродов и возможность контроля за их размерами [30]. В ходе электрохимического получения НЧСо в режиме хроноамперометрии варьировали потенциал накопления НЧСо (E = –1.1 В) и время накопления от 5 (НЧСо1) до 60 с (НЧСо2). В ходе исследования установлено, что НЧCo обладают электрохимической активностью и дают анодный пик в диапазоне потенциалов 750–800 мВ (рис. 1).
Рис 1.
Вольтамперограммы, полученные на печатных графитовых электродах, модифицированных наночастицами кобальта. (а) – НЧCo1, (б) – НЧCo2; v = 5 мВ/с; фосфатный буферный раствор с pH 7.5.
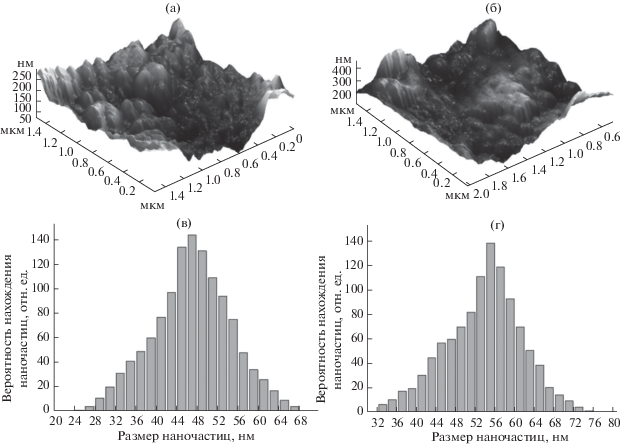
Атомно-силовая микроскопия. Исследование морфологии поверхности печатного графитового электрода показало, что нанесение НЧCo приводит к получению развитой поверхности (рис. 2а, 2б), что может привести к более прочному закреплению антител (Ат) на поверхности электрода. При этом размер НЧ (рис 2в, 2г) составляет для НЧCo1 47 нм, а для НЧCo2 – 55 нм.
Рис. 2.
Изображения в режиме топографии в 3D проекциях поверхности электрода, модифицированного НЧCo1 (a), НЧCo2 (б), размер 1.5 × 1.5 мкм. Гистограмма распределения по размерам НЧCo1 (в), НЧCo2 (г).
Спектроскопия электрохимического импеданса (СЭИ). Для выявления наилучшего наноструктурированного композита использовали СЭИ. Варьировали состав композиций на основе используемых углеродных наноматериалов и НЧСо. Сопротивление переноса электрона оценивали, используя диаграмму Найквиста.
Согласно представленным значениям (рис. 3, табл. 1), наименьшим сопротивлением на границе электрод/модификатор обладает гибридный нанокомпозит на основе фуллерена С60 и ВГО в H20-NH2 в сочетании с НЧCo2 – С60-ВГО-H20-NH2/НЧСо2 (табл. 1, позиция 6; рис. 3б, кривая 3).
Рис. 3.
Диаграммы Найквиста. (а): 1 – ВГО-УНТ-H20-NH2, 2 – УНТ-H20-NH2, 3 – ВГО-УНТ-H20-NH2/НЧСо2; (б): 1 – С60-Н20-NH2, 2 – С60-ВГО-H20-NH2, 3 – С60-ВГО-H20-NH2/НЧСо2. Здесь Ret1 и Ret2 – сопротивление переноса электрона на границе электрод/модификатор и сопротивление переноса электрона на границе электрод/раствор, C1 – емкость на границе электрод/модификатор, C2 – емкость на границе электрод/раствор, Rs – сопротивление раствора, Zw – импеданс Варбурга.
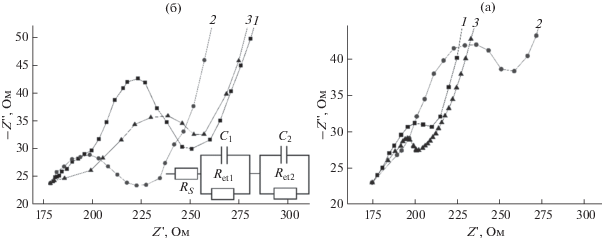
Таблица 1.
Параметры электрохимического импеданса наноструктурированных покрытий (n = 5, P = 0.95)
| Состав слоя* |
(Ret)1, кОм | (Ret)2, кОм |
|---|---|---|
| 1 | 0.14 ± 0.02 | 1.7 ± 0.1 |
| 2** | 0.13 ± 0.02 | 1.8 ± 0.1 |
| 3 | 0.61 ± 0.05 | 3.8 ± 0.2 |
| 4** | 0.45 ± 0.04 | 14 ± 2 |
| 5 | 0.38 ± 0.02 | 2.6 ± 0.1 |
| 6*** | 0.11 ± 0.02 | 5.9 ± 0.5 |
| 7 | 0.21 ± 0.02 | 2.5 ± 0.1 |
| 8 | 0.14 ± 0.02 | 3.2 ± 0.2 |
Иммуносенсор для определения амитриптилина на основе электродов, модифицированных гибридными нанокомпозитами. Для получения биочувствительной части иммуносенсора на поверхность рабочего электрода, предварительно модифицированного наноматериалами и НЧСо, наносили смесь, содержащую раствор антител, водный раствор матричного компонента Н20-NH2, фосфатный буферный раствор с pH 7.5 и 1%-ный водный раствор ГА.
Полученные результаты позволили разработать 2 типа иммуносенсоров:
– иммуносенсор 1 на основе печатного графитового электрода, модифицированного ВГО-УНТ-Н20-NH2 в сочетании с НЧСо2;
– иммуносенсор 2 на основе печатного графитового электрода, модифицированного С60-ВГО-Н20-NH2 в сочетании с НЧСо2.
После нанесения наилучшего, согласно данным АСМ и СЭИ, нанокомпозита на поверхность электрода, подбирали концентрацию Ат. Для этого варьировали разбавление Ат (разведение от 1 : 50 до 1 : 1000). При разработке иммуносенсоров всегда особое внимание уделяют меткам. Поскольку НЧСо обладают электрохимической активностью, в качестве метки выбрали пик окисления НЧCo (аналитический сигнал). Установлено, что разведение Ат 1 : 100 приводит к получению лучшего аналитического сигнала по сравнению с другими разведениями, например 1 : 1000. Очевидно, что низкая концентрация Ат (например, при разведении 1 : 1000) позволяет лишь небольшому количеству антигенов вступать в иммунологическую реакцию, и это приводит лишь к незначительному изменению аналитического сигнала.
Схема получения и функционирования иммуносенсора при его контакте с исследуемым раствором, содержащим антиген (Аг) (амитриптилин), представлена на рис. 4. Амитриптилин как антиген взаимодействует с антителами, иммобилизованными на поверхности модифицированного углеродными наноматериалами и НЧСо электрода, при этом происходит образование иммунного комплекса Аг–Ат, а НЧСо выполняют роль метки.
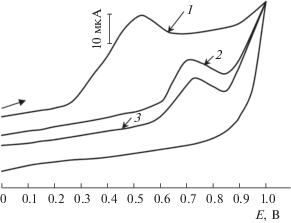
Действие иммуносенсора основано на уменьшении аналитического сигнала (ток окисления НЧCo) на фоне фосфатного буферного раствора в интервале потенциалов от 0.3 до 1.0 В при добавлении различных концентраций антигена (амитриптилина), что связано с образованием на поверхности электрода иммунного комплекса Аг–Ат, который частично экранирует электроосажденные НЧCo (рис. 5).
Рис. 5.
Вольтамперограммы, полученные с применением разработанного иммуносенсора (модификатор С60-ВГО-H20-NH2 и НЧCo, иммобилизованные антитела против трициклических антидепрессантов), фосфатного буферного раствора с рН 7.5 (1), 1 × 10–8 М (2) и 1 × 10–7 М растворов антигена – амитриптилина (3).
Изучение аналитических возможностей разработанных иммуносенсоров показало, что линейная зависимость величины тока от концентрации антидепрессанта линейна в диапазоне 1 × 10–9–1 × 10–4 М (табл. 2), а нижняя граница определяемых концентраций находится на уровне (5–7) × 10–10 М. В случае иммуносенсоров наблюдается более селективный отклик по сравнению с разработанными ранее моноаминоксидазными биосенсорами для определения трициклических антидепрессантов, к числу которых относится и амитриптилин [28].
Таблица 2.
Аналитические возможности разработанных биосенсоров при определении амитриптилина (n = 5, Р = 0.95)
| Рабочий диапазон, М | Уравнение градуировочной зависимости* I = (A ± δ) + (B ± δ)(–lgc) |
сн, М | ||
|---|---|---|---|---|
| A ± δ | B ± δ | r | ||
| Иммуносенсор 1 | ||||
| 1 × 10–9–1 × 10–4 | 155 ± 12 | 9 ± 1 | 0.9905 | 5 × 10–10 |
| Иммуносенсор 2 | ||||
| 1 × 10–9–1 × 10–4 | 116 ± 8 | 12 ± 1 | 0.9840 | 7 × 10–10 |
| МАО-биосенсор [28] | ||||
| 1 × 10–8–1 × 10–5 | 7.3 ± 0.6 | 23.1 ± 0.8 | 0.9987 | 7 × 10–9 |
* Для иммуносенсоров 1 и 2: I = (I1/I0) × 100%, где I1 – ток реакции окисления наночастиц кобальта при образовании комплекса антиген–антитело, I0 – ток окисления наночастиц кобальта с антителами в отсутствие антигена; для моноаминоксидазного (МАО) биосенсора: I = (I1/I0) × 100%, где I1 – ток реакции окисления пероксида водорода с ингибитором, I0 – ток окисления пероксида водорода в отсутствие ингибитора.
Следует отметить, что для иммуносенсоров диапазон рабочих концентраций шире и нижняя граница определяемых концентраций ниже по сравнению с разработанными ранее моноаминоксидазными биосенсорами (модификатор УНТ-в хитозане) [28].
Определение характеристических параметров иммунохимических взаимодействий. Определение константы связывания. Константа связывания (Kа) является одной из наиболее важных физико-химических характеристик иммунологической реакции, на основании которой можно сделать вывод о возможности использования данной реакции в аналитических целях и оценить качество иммунореагентов. Для разработки методов иммуноанализа достаточно знать эффективные значения констант связывания, характеризующие свойства используемых Ат.
Величину Ка определяли, используя график Скэтчарда [31], т.е. зависимость отношения концентраций связанного и свободного Аг от равновесной концентрации иммунного комплекса. Для этого проводили серию опытов по определению концентрации свободного и связанного амитриптилина при различных начальных концентрациях антидепрессанта и постоянной концентрации Ат в системе. Наличие двух участков на кривой зависимости Скэтчарда говорит о преимущественном присутствии двух популяций антител. Константы связывания составляют Ka1 = (3.1 ± 0.5) × 10–8 моль–1 и Ka2 = (1.0 ± ± 0.3) × 10–6 моль–1. Значение Ka1 соответствует условиям, благоприятным для осуществления иммунохимических определений [31].
Таким образом, селективность отклика иммуносенсоров к амитриптилину как к трициклическому антидепрессанту выше, чем при его определении моноаминоксидазным биосенсором (модификатор УНТ-в хитозане) [28]. В частности, установлено, что процент перекрестного реагирования относительно флуоксетина (антидепрессант второго поколения, не относится к трициклическим антидепрессантам) не более 16%.
Определение амитриптилина в лекарственном препарате “Амитриптилин” и в урине. Полученные результаты позволили предложить методику определения действующего вещества в лекарственном препарате и в урине.
Методика определения амитриптилина в лекарственном препарате “Амитриптилин”. Пробоподготовку лекарственного препарата проводили с учетом последующих измерений иммуносенсорами в режиме вольтамперометрии. Схема приготовления образца (препарат “Амитриптилин”) включала следующие операции:
– получение однородного мелкодисперсного порошка путем растирания в ступке;
– растворение в небольшом количестве этилового спирта (5 мл) вследствие хорошей растворимости препарата в воде и этаноле [32];
– добавление ~10 мл дистиллированной воды;
– перемешивание полученного раствора и обработка на центрифуге в течение 15 мин при 7000 об./мин;
– перенос прозрачного раствора в мерную колбу емк. 25 мл;
– повторная обработка оставшегося осадка после добавления 10 мл дистиллированной воды в центрифуге в тех же условиях;
– перенос прозрачного раствора в ту же мерную колбу емк. 25 мл и доведение водой до метки;
– перенос 200 мкл этого раствора в электрохимическую ячейку емк. 2 мл, содержащую фосфатный буферный раствор с рН 7.5, ввод туда же иммуносенсора и через 5 мин регистрация вольтамперограммы в области потенциалов от 0.3 до 1.0 В при скорости наложения потенциала 50 мВ/с. Измерение величины тока пика при потенциале 0.70–0.72 В и определение концентрации антидепрессанта по градуировочному графику.
Согласно полученным результатам, определение действующего вещества в лекарственном препарате “Амитриптилин” по предлагаемой методике позволяет получить результаты с погрешностью (sr) не более 0.041 (табл. 3). Правильность определения предлагаемым иммуносенсором оценивали путем сопоставления результатов анализа одного и того же образца моноаминоксидазным биосенсором и иммуносенсором. Полученные значения t- и F-критериев (табл. 3) позволяют сделать вывод о том, что результаты определения амитриптилина разными биосенсорами, основанными на различных принципах функционирования, равноточны и вклад систематической погрешности незначим.
Таблица 3.
Результаты определения 25 мг амитриптилина биосенсорами (n = 5, Р = 0.95, tтабл = 2.78, Fтабл = 6.39)
| Тип сенсора | Найдено, мг | sr | tрасч | Fрасч |
|---|---|---|---|---|
| Иммуносенсор 1 | 25.1 ± 0.9 | 0.041 | 1.23 | 4.18 |
| МАО-биосенсор | 24.8 ± 0.9 | 0.065 |
Большинство лекарственных препаратов выводится из организма с мочой, поэтому представляла интерес разработка способов их определения в данной биологической жидкости с помощью разработанных иммуносенсоров.
Определение амитриптилина в урине. Предлагаемый иммуносенсор апробировали при определении амитриптилина в модельном растворе урины, содержащем ее основные компоненты [33], и в урине. Для уменьшения влияния матричных компонентов разбавляли урину и ее модельный раствор в 50 раз. Необходимость такой операции связана с тем, что в состав урины входят компоненты, которые могут окисляться в рабочей области потенциалов (в частности, мочевая кислота [34]).
Ранее на примере моноаминоксидазных биосенсоров установлено, что линейная зависимость между величиной аналитического сигнала и концентрацией лекарственного препарата на фоне модельного раствора урины наблюдается в той же области концентраций, что и на фоне буферного раствора, при этом коэффициент чувствительности также изменяется незначительно [35]. Эта же тенденция сохраняется и при определении амитриптилина иммуносенсором (табл. 4). Таким образом, для определения остаточных количеств лекарственного препарата в урине можно использовать градуировочный график, построенный как на фоне модельного раствора урины, так и на фоне фосфатного буферного раствора.
Таблица 4.
Определение амитриптилина иммуносенсором 1 (рабочий диапазон 1 × 10–9 –1 × 10–4 М, n = 5, Р = 0.95)
| Исследуемый раствор | Уравнение градуировочной зависимости I = (A ± δ) + (B ± δ)(–lgc) |
сн, М | ||
|---|---|---|---|---|
| A ± δ | B ± δ | r | ||
| Урина | 125 ± 7 | 5 ± 1 | 0.9815 | 9 × 10–10 |
| Модельный раствор урины | 150 ± 9 | 7 ± 1 | 0.9832 | 8 × 10–10 |
Правильность определения антидепрессанта разработанным иммуносенсором оценивали способом введено–найдено. Погрешность определения (sr) не превышает 0.072. Данные представлены в табл. 5.
Таблица 5.
Результаты определения амитриптилина иммуносенсором 1 (n = 5, P = 0.95)
| Исследуемый раствор | Введено, М | Найдено, М | sr |
|---|---|---|---|
| Урина | 1 × 10–7 | (1.15 ± 0.08) × 10–7 | 0.072 |
| 1 × 10–6 | (0.92 ± 0.06) × 10–6 | 0.067 | |
| Модельный раствор урины | 1 × 10–7 | (1.19 ± 0.07) × 10–7 | 0.061 |
| 1 × 10–6 | (0.89 ± 0.04) × 10–6 | 0.048 | |
| Фосфатный буферный раствор | 1 × 10–7 | (1.18 ± 0.08) × 10–7 | 0.069 |
| 1 × 10–6 | (1.12 ± 0.06) × 10–6 | 0.055 |
Методика определения. В электрохимическую ячейку емк. 2 мл вносят 1800 мкл разбавленной фосфатным буферным раствором урины, добавляют 2–200 мкл раствора лекарственного препарата соответствующей концентрации. Помещают в ячейку иммуносенсор и через 5 мин регистрируют вольтамперограмму в описанных выше условиях. Концентрацию антидепрессанта находят по градуировочному графику (см. табл. 5).
Использование разбавленной урины позволяет, с одной стороны, нивелировать электрохимическую активность компонентов урины, а с другой стороны, за счет высокой чувствительности иммуносенсоров обеспечивает их способность реагировать на малые содержания антидепрессанта в урине и ее модельном растворе [36].
Список литературы
Bisceglia K.J., Yu J.T., Coelhan M., Bouwer E.J., Roberts A.L. Trace determination of pharmaceuticals and other wastewater-derived micropollutants by solid phase extraction and gas chromatography/mass spectrometry // J. Chromatogr. A. 2010. V. 1217. P. 558.
Bakera D.R., Kasprzyk-Hordern B. Multi-residue determination of the sorption of illicit drugs and pharmaceuticals to wastewater suspended particulate matter using pressurised liquid extraction, solid phase extraction and liquid chromatography coupled with tandem mass spectrometry // J. Chromatogr. A. 2011. V. 1218. P. 7901.
Albero B., Sánchez-Brunete C., Miguel E., Aznar R., Tadeo J.L. Determination of selected pharmaceutical compounds in biosolids bysupported liquid extraction and gas chromatography–tandem massspectrometry // J. Chromatogr. A. 2014. V. 1336. P. 52.
Truta L.A.A.N.A., Moreira F.T.C., Sales M.G.F. A dye-sensitized solar cell acting as the electrical reading box of an immunosensor: Application to CEA determination // Biosens. Bioelectron. 2018. V. 107. P. 94.
Suresh L., Brahman P.K., Reddy K.R., Bondili J.S. Development of an electrochemical immunosensor based on gold nanoparticles incorporated chitosan biopolymer nanocomposite film for the detection of prostate cancer using PSA as biomarker // Enzyme Microb. Technol. 2018. V. 112. P. 43.
Li W., Shu D., Zhang D., Ma Z. Multi-amplification of the signal of voltammetric immunosensors: Highly sensitive detection of tumor marker // Sens. Actuators B. 2018. V. 262. P. 50.
Zhu C., Du D., Lin Y. Graphene-like 2D nanomaterial-based biointerfaces for biosensing applications // Biosens. Bioelectron. 2017. V. 89. P. 43.
Maduraiveeran G., Jin W. Nanomaterials based electrochemical sensor and biosensor platforms for environmental applications // Trends Environ. Anal. Chem. 2017. V. 13. P. 10.
Merum S., Veluru J.B., Seeram R. Functionalized carbon nanotubes in bio-world: Applications, limitations and future directions // Mater. Sci. Eng. B. 2017. V. 223. P. 43.
Lan L., Yao Y., Ping J., Ying Y. Recent advances in nanomaterial-based biosensors for antibiotics detection // Biosens. Bioelectron. 2017. V. 91. P. 504.
Gaudin V. Advances in biosensor development for the screening of antibiotic residues in food products of animal origin – A comprehensive review // Biosens. Bioelectron. 2017. V. 90. P. 363.
Wozniakiewicz M., Wietecha-Posłuszny R., Garbacik A., Koscielniak P. Microwave-assisted extraction of tricyclic antidepressants from human serum followed by high performance liquid chromatography determination // J. Chromatogr. A. 2008. V. 1190. P. 52.
Castro de A., Mar Ramırez Fernandez del M., Laloup M., Samyn N., Boeck De G., Wood M., Maes V., Lopez-Rivadulla M. High-throughput on-line solid-phase extraction–liquid chromatography–tandem mass spectrometry method for the simultaneous analysis of 14 antidepressants and their metabolites in plasma // J. Chromatogr. A. 2007. V. 1160. P. 3.
Zhang Y., Ma H., Wu D., Li Y., Du B., Wei Q. Label-free immunosensor based on Au@Ag2S nanoparticles/magnetic chitosan matrix for sensitive determination of ractopamine // J. Electroanal. Chem. 2015. V. 741. P. 14.
Jain R., Jadon N., Pawaiya A. Polypyrrole based next generation electrochemical sensors and biosensors: A review // Trends Anal. Chem. 2017. V. 97. P. 363.
Yang N., Chena X., Ren T., Zhang P., Yang D. Carbon nanotube based biosensors // Sens. Actuators B. 2015. V. 207. P. 690.
Hasanzadeh M., Shadjou N., Eskandani M., Soleymani J., Jafari F., Guardia la de M. Dendrimer-encapsulated and cored metal nanoparticles for electrochemical nanobiosensing // Trends Anal. Chem. 2014. V. 53. P. 137.
Cong F., Jian-Ping L. Application of dendrimers in analytical chemistry // Chin. J. Anal. Chem. 2013. V. 41. №. 11. P. 1762.
Prashant K., Avinash G., Arun K.I., Keerti J., Manish K.C., Umesh G. Recent advances in nanomaterial-based biosensors for antibiotics detection // Drug Discovery Today. 2018. V. 23. № 2. P. 300.
Evtugyn G.A., Eremin S.A., Shaljamova R.P., Ismagilova A.R., Budnikov H.C. Amperometric immunosensor for nonylphenol determination based on peroxidase indicating reaction // Biosens. Bioelectron. 2006. V. 22. P. 56.
Медянцева Э.П., Будников Г.К. Амперометрические иммуноферментные сенсоры для биомедицинских исследований и определений // Бутлеровские сообщения. 2011. Т. 25. № 8. С. 9.
He Z., Zang S., Liu Y., He Y., Lei H. A multi-walled carbon nanotubes-poly(L-lysine)modified en- antioselective immunosensor for ofloxacin by using multi-enzyme-labeled gold nanoflower as signal enhancer // Biosens. Bioelectron. 2015. V. 73. P. 85.
Dawan S., Kanatharana P., Wongkittisuksa B., Limbut W., Numnuam A., Limsakul C., Thavarungkul P. Label-free capacitive immunosensors for ultra-trace detection based on the increase of immobilized antibodies on silver nanoparticles // Anal. Chim. Acta. 2011. V. 699. P. 232.
Beloglazova N.V., Shmelin P.S., Eremin S.A. Sensitive immunochemical approaches for quantitative (FPIA) and qualitative (lateral flow tests) determination of gentamicin in milk // Talanta. 2016. V. 149. P. 217.
Song E., Yu M., Wang Y., Hu W., Cheng D., Swihart M.T., Song Y. Multi-color quantumdot-based fluorescence immunoassay array for simultaneous visual detection of multiple antibiotic residues in milk // Biosens. Bioelectron. 2015. V. 72. P. 320.
Медянцева Э.П., Брусницын Д.В., Варламова Р.М., Максимов А.А., Коновалова О.А., Будников Г.К. Модификация поверхности электродов углеродными нанотрубками и наночастицами золота и серебра в моноаминоксидазных биосенсорах для определения некоторых антидепрессантов // Журн. аналит. химии. 2017. Т. 72. № 4. С. 305. (Medyantseva E.P., Brusnitsyn D.V., Varlamova R.M., Maksimov A.A., Ko-novalova O.A., Budnikov H.C. Surface modification of electrodes by carbon nanotubes and gold and silver nanoparticles in monoaminoxidase biosensors for the determination of some antidepressants // J. Analyt. Chem. 2017. V. 72. № 4. Р. 362.)
Benchettara A., Benchettara A. Electrochemical sensor based on nanoparticles of cobalt oxides for determination of glucose // Mater. Today: Proceedings. 2015. V. 2. P. 4212.
Медянцева Э.П., Брусницын Д.В., Варламова Р.М., Кутырева М.П., Улахович Н.А., Фаттахова А.Н., Коновалова О.А., Будников Г.К. Гиперразветвленные полиэфирополиолы в составе амперометрических моноаминоксидазных биосенсоров на основе электродов модифицированных наноматериалами для определения антидепрессантов // Журн. прикл. химии. 2017. Т. 90. № 1. С. 104. (Medyantseva E.P., Brusnitsyn D.V., Varlamova, R.M., Kutyreva M.P., Ulakhovich N.A., Fattakhova A.N., Konovalova, O.A., Budnikov H.C. Hyperbranched polyesterpolyols as components of amperometric monoamine oxidase biosensors based on electrodes modifi ed with nanomaterials for determination of antidepressants /// Russ. J. Appl. Chem. 2017. V. 90. № 1. P. 97.)
Брусницын Д.В., Медянцева Э.П., Варламова Р.М., Ситдикова Р.Р., Фаттахова А.Н., Коновалова О.А., Будников Г.К. Углеродные наноматериалы как модификаторы поверхности электродов при разработке амперометрических моноаминоксидазных биосенсоров // Заводск. лаборатория. Диагностика материалов. 2015. Т. 81. № 6. С. 21. (Brusnitsyn D.V., Medyantseva E.P., Varlamova R.M., Sitdikova R.R., Fattakhova A.N., Konovalova O.A., Budnikov H.C. Carbon nanomaterials as electrode surface modifiers in development of amperometric monoamino oxidase biosensors// Inorg. mater. 2016. V. 52. P. 1413.)
Helia H., Pishahang J. Cobalt oxide nanoparticles anchored to multiwalled carbonnanotubes: Synthesis and application for enhanced electrocatalyticreaction and highly sensitive nonenzymatic detection of hydrogen peroxide // Electrochim. Acta. 2014. V. 123. P. 518.
Егоров А.М., Осипов А.П., Дзантиев Б.Б., Гаврилова Е.М. Теория и практика иммуноферментного анализа. М.: Высшая школа, 1991. 288 с.
XII Государственная фармакопея российской федерации. М., 2010. Ч. 2. 480 с.
Березов Т.Т., Коровкин Б.Ф. Биологическая химия. М.: Медицина, 1998. 704 с.
Шайдарова Л.Г., Челнокова И.А., Романова Е.И., Гедмина А.В., Будников Г.К. Совместное вольтамперометрическое определение дофамина и мочевой кислоты на электроде, модифицированном самоорганизующимся монослоем цистамина с наночастицами золота // Журн. прикл. химии. 2011. Т. 84. № 2. С. 222. (Shaidarova L.G., Chelnokova I.A., Romanova E.I., Gedmina A.V., Budnikov G.K. Joint voltammetric determination of dopamine and uric acid // Russ. J. Appl. Chem. 2011. V. 84. № 2. P. 218.)
Медянцева Э.П., Брусницын Д.В., Варламова Р.М., Бешевец М.А., Будников Г.К., Фаттахова А.Н. Возможности амперометрических моноаминоксидазных биосенсоров на основе модифицированных многостенными углеродными нанотрубками графитовых печатных электродов для определения некоторых антидепрессантов // Журн. аналит. химии. 2015. Т. 70. №. 5. С. 470. (Medyantseva E.P., Brusnitsyn D.V., Varlamova R.M., Beshevets M.A., Budnikov H.C., Fattakhova A.N. Capabilities of amperometric monoamine oxidase biosensors based on screen-printed graphite electrodes modified with multiwall carbon nanotubes in the determination of some antidepressants // J. Analyt. Chem. 2015. V. 70. № 5. P. 535.)
Медянцева Э.П., Брусницын Д.В., Варламова Р.М., Коновалова О.А., Будников Г.К. Наноструктурированные композиты на основе графена и наночастиц кобальта в составе моноаминоксидазных биосенсоров для определения антидепрессантов // Заводск. лаборатория. Диагностика материалов. 2018. Т. 54. № 8. С. 5.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии