Журнал аналитической химии, 2020, T. 75, № 4, стр. 368-378
Разработка способа оценки активности helicobacter pylori по составу выдыхаемого воздуха с применением массива химических пьезосенсоров
Т. А. Кучменко a, *, А. А. Шуба a, Д. А. Кучменко b, Р. У. Умарханов c, **
a Воронежский государственный университет инженерных технологий, кафедра физической и аналитической химии
394000 Воронеж, просп. Революции, 19, Россия
b Воронежская детская клиническая больница ВГМУ им. Н.Н. Бурденко
394036 Воронеж, переулок Здоровья, 16, Россия
c ООО “Сенсорика – Новые Технологии”
394000 Воронеж, просп. Революции, 19, корп. 1, Россия
* E-mail: tak1907@mail.ru
** E-mail: rus_270487@mail.ru
Поступила в редакцию 12.12.2018
После доработки 01.11.2019
Принята к публикации 01.11.2019
Аннотация
Современное состояние проблемы заболеваний желудка и двенадцатиперстной кишки предполагает обязательное обследование пациентов на наличие инфекции Helicobacter pylori. Имеющиеся в арсенале клиницистов методы диагностики позволяют выявить Helicobacter pylori практически в 100% случаев. Грамотный подход к выбору диагностического теста обеспечивает качественную, своевременную и экономичную верификацию возбудителя. В работе приведены сведения о существующих на данный момент диагностических методиках выявления хеликобактерной инфекции, а также результаты диагностики хеликобактериоза по оценке уреазной активности слюны. Основное направление исследования – разработка аналитического решения на основе количественного определения аммиака, обнаружения аминов, алифатических кислот в выдыхаемом воздухе по сигналам массива разнохарактерных химических пьезосенсоров. Для обработки данных применены простые алгоритмы, обоснованы качественные и количественные критерии принятия решения. Метод анализа с применением химических сенсоров характеризуется высокими специфичностью (96% по аммиаку) и чувствительностью (90%), не требует специальной пробоподготовки, незаменим при масштабных исследованиях и персональном мониторинге, а также при выборе тактики лечения.
Решение многих аналитических задач требует сложных методик и дорогостоящих приборов. Упрощение и снижение стоимости средств химического анализа – одна из задач современной аналитической химии. Успехи ряда областей химии, физики, электроники, математики обеспечивают возможность создания миниатюрных, недорогих и простых с точки зрения использования средств анализа, сопоставимых по своим аналитическим характеристикам с современными инструментальными методами. Тест-системы, несомненно, могут быть отнесены к таким средствам. Потребность в тест-наборах растет и этим объясняется разработка тест-систем разного типа и назначения, в основе которых лежат чувствительные и селективные химические реакции. Поскольку ложноположительные результаты выявления различных патологий влекут за собой неоправданное назначение дорогостоящего лечения, в ряде случаев оказывающего сопутствующее неблагоприятное влияние на различные функции организма, актуальность повышения надежности диагностических результатов несомненна. Прогнозирование терапии и контроль ее эффективности в ходе лечения с целью адекватной его корректировки логически вытекает из неинвазивности, атравматичности и проведения диагностики in vivo, так как при этом процедура может быть без ущерба для пациента проведена многократно в период, предшествующий лечению, в ходе самой терапии и по ее завершении. Перспективность неинвазивного направления в диагностике заболеваний и контроля за их течением и лечением очевидна. Она обеспечивает отсутствие боли, других неприятных ощущений от забора проб, полную безопасность от заражения инфекциями (СПИД, вирусный гепатит и др.).
Одним из распространенных объектов неинвазивной диагностики является выдыхаемый воздух. Это связано с простотой пробоотбора, отсутствием химических реактивов, пробирок, одноразовых игл и лаборантов. Схема анализа сводится к выдоху пациентом воздуха в специальное устройство и детектированию аналитов различными методами. Helicobacter pylori (HbP) во всем мире считается одним из самых важных и распространенных патогенных микроорганизмов. В России к 10 г. жизни инфицированными оказываются 45–55% детей, у людей старше 20 лет инфицированность достигает 98%.
В 1994 г. Всемирная организация здравоохранения занесла Helicobacter pylori в разряд канцерогенов первого класса. В последние годы появляются сообщения о возможной связи инфекции с ишемической болезнью сердца, гипертонической болезнью, болезнью Рейно, мигренью, бронхиальной астмой и др. Helicobacter pylori – спиралевидные анаэробные микроорганизмы, которые, попав в новый организм, спускаются непосредственно в желудок. Основное специфическое свойство Helicobacter pylori – синтез высокоактивной уреазы. Помимо этого, Helicobacter pylori способны изменять местную кислотность желудка [1, 2]. Бактерия продуцирует уреазу в огромных количествах для того, чтобы гидролизовать карбамид, присутствующий в биологических жидкостях человека:
Из представленной схемы очевидно, что изменение содержания аммиака и углекислого газа в выдыхаемом воздухе до и после нагрузки карбамидом является аналитическим маркером при неинвазивной диагностике Helicobacter pylori для оценки уровня ее активности. Современные методы диагностики инфекции представлены на рис. 1.
Способы оценки уреазной активности стандартизованы. Ее обычно измеряют способами in vivo или in vitro по скорости разложения мочевины и, в частности, по количеству аммиака или углекислого газа, выделяющихся в результате реакции ферментативного гидролиза. Традиционно методы диагностики хеликобактерной инфекции делят на инвазивные, требующие проведения эндоскопии и биопсии, и неинвазивные, при которых эндоскопию и биопсию не проводят (рис. 1) [3–7]. Выделяют также прямые методы непосредственного определения бактерий и косвенные, регистрирующие последствия заражения Helicobacter pylori в организме человека. В табл. 1 сопоставлены основные диагностические показатели ряда наиболее часто используемых в лабораторном анализе методов.
Таблица 1.
Сравнительная характеристика различных методов диагностики хеликобактериоза
| Тест | Чувствительность, % | Специфичность, % |
|---|---|---|
| Серология | 67–94 | 75–95 |
| ПЦР: | ||
| слюны | 65–89 | 72–90 |
| мочи | 82–83 | 82–83 |
| кала | 94 | 92 |
| Дыхательный тест: | ||
| с применением 13С | 90–96 | 88–98 |
| уреазный тест | 85–95 | 95–100 |
| Другие методы: | ||
| гистология | 93–96 | 98–99 |
| бактериология | 80–98 | 100 |
Самым специфичным (100%-ным) методом, “золотым стандартом” лабораторной диагностики Helicobacter pylori, является бактериологический. Длительность и трудоемкость ограничивают применение этого метода для быстрого контроля [4].
Гистологический метод позволяет не только идентифицировать Helicobacter pylori, но и оценить степень морфологических изменений слизистой оболочки желудка и двенадцатиперстной кишки. Однако эффективность гистологической диагностики во многом зависит от квалификации морфолога и его опыта работы, к тому же этот способ травматичен, особенно для детей и пожилых людей.
Уреазные тесты основаны на том, что никакие другие бактерии, кроме Helicobacter рylori, не способны продуцировать уреазу в условиях желудка в таких больших количествах. При помещении биоптата в среду с мочевиной под влиянием уреазы происходит химическая реакция с выделением иона аммония, значительно повышающего рН среды, что фиксируется индикатором. Предложены различные варианты тестов: тест со средой Христенсена, 4-часовой быстрый уреазный тест, 1-минутный тест, CLO-тест, Campy-test, экспресс-тест, Биохит и др. Они различаются по времени проведения – от 1 мин до 24 ч, по носителям сред – жидкие или твердые, по стабильности сред, определяющих сроки их хранения. Почти все уреазные тесты характеризуются высокой чувствительностью (85–98%) и специфичностью (по некоторым данным до 100%). Преимуществами уреазных тестов являются простота выполнения, низкая стоимость и экспресссность, позволяющая врачу работать по схеме “tstandtreat”. Именно благодаря этому свойству уреазные тесты получили широкое распространение в рутинной врачебной практике [5]. Наиболее часто в России применяют Хелпил-Тест, разработанный В.Е. Милейко (ООО “Синтана-СМ”, Россия).
Инвазию Helicobacter pylori оценивают также хромогастроскопией; при этом существенно увеличивается время обследования пациентов при сохранении показателей чувствительности и специфичности, характерных для всех методов уреазной диагностики биоптатов [6, 7].
Неинвазивную диагностику хеликобактериоза, согласно рекомендациям Канадской и Европейской групп по изучению Helicobacter pylori, особенно предпочтительно использовать у детей [8, 9].
Из всех серологических методов наибольшее распространение в мире получил метод твердофазного иммуноферментного анализа [10–18]. Для оценки наличия или отсутствия Helicobacter pylori используют метод полимеразной цепной реакции (ПЦР) с определением специфических фрагментов гена уреазы (ureC). По интенсивности флуоресцентного свечения можно также полуколичественно оценить содержание Helicobacter pylori в образце [4].
В клинической диагностике применяют различные газоаналитические технологии, основанные на определении аммиака в выдыхаемом альвеолярном воздухе, в воздухе, поступающем из желудка, или при оценке суммарной концентрации NH3. На данный момент разработаны нагрузочные тесты, предполагающие прием пациентом карбамида мочевины, меченной изотопом 13С. Если Helicobacter pylori в организме нет, то мочевина проходит пищеварительный тракт без разложения и практически не влияет на соотношение изотопов углерода в выдыхаемом воздухе (отрицательный результат теста) [19].
За рубежом широко применяют радиоактивный изотоп 14С, для регистрации которого необходим сцинтилляционный счетчик, и нерадиоактивный изотоп 13C, для определения которого используют масс-спектрометры [20–25]. Оба варианта являются высокоспецифичными и высокочувствительными, однако широкому внедрению метода мешают значительная стоимость, трудоемкость, необходимость наличия специального оборудования и высококвалифицированного персонала. Другой недостаток (особенно для детей) – необходимость приема внутрь мочевины, меченной изотопом.
В настоящее время в большинстве исследований и при гастроэнтерологической диагностике на основе анализа изотопного соотношения углерода в выдыхаемом диоксиде углерода применяют масс-спектрометрические методы [26, 27].
Концентрацию NH3 после нагрузки можно определять также с помощью индикаторных трубок. Технологии UBT-NH заключаются в определении изменения концентрации аммиака с помощью линейных газоанализаторов – индикаторных трубок в традиционном и в капиллярном варианте – и пассивных фронтальных колориметрических дозиметров. Продолжительность аналитической процедуры составляет от 30 с до 5 мин в зависимости от применяемого теста. Концентрацию аммиака оценивают по длине отличающегося от первоначального по цвету слоя адсорбента индикаторной трубки [18, 28]. Существующие на сегодняшний день методы диагностики хеликобактериоза сопоставлены в табл. 2.
Таблица 2.
Методические основы и ограничения применимости методов диагностики хеликобактерной инфекции
| Метод | Принцип | Недостатки |
|---|---|---|
| Бактериологический | Посев материала на питательных средах с последующей специфической реакцией, вызывающей изменение цвета исследуемого материала | Инвазивный. Ограничение по временидоставки образца. Длительная пробоподготовка: 5–7 дней |
| Гистологический | Специфическая реакция, вызывающая изменение цвета исследуемого материала | Инвазивный. Ограничение по времени доставки образца. Высокая степень зависимости от квалификации морфолога |
| Полимеразная цепная реакция | Идентификация видоспецифичного фрагмента ДНК Helicobacter рylori | Инвазивный/неинвазивный. Высокие сложность и стоимость оборудования |
| Серологический (определение специфических Ig к Helicobacter рylori) | Наличие специфических антител: IgG, IgA, IgM | Инвазивный/неинвазивный. Неинформативен у детей. Серопозитивность: возникает через 60 дней после инфицирования. Сохраняется до года после успешной эрадикации Helicobacter рylori |
| Уреазные дыхательные тесты на основе изотопов 12С,13С, 14С | Расщепление Helicobacter рylori мочевины, меченной ххС, до аммиака и углекислого газа, попадающих в кровь | Высокая стоимость оборудования. Необходимость приема внутрь мочевины, меченной изотопом |
Сравнительный анализ методов диагностики Helicobacter рylori диктует необходимость использования в практической деятельности комбинации диагностических тестов. Актуальной проблемой хеликобактериологии является разработка путей оптимизации диагностики Helicobacter рylori у инфицированных больных.
Настоящая работа направлена на установление общих закономерностей взаимодействия ключевых метаболитов Helicobacter pylori и их смесей с тонкими пленками чувствительных покрытий химических сенсоров и разработку алгоритмов оценки уровня активности инфекции с применением “электронного носа” на пьезосенсорах с разной селективностью по результатам анализа выдыхаемого воздуха.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для определения продуктов метаболизма бактерии (аммиак и углекислый газ) в выдыхаемом воздухе применяли статический “электронный нос” МАГМед (МИП ООО “СНТ”, Россия) с уменьшенным объемом ячейки детектирования и шестью измерительными элементами – пьезосенсорами [29]. В качестве покрытий пьезосенсоров на основе предварительного эксперимента выбрали пленки, чувствительность и селективность которых к веществам-маркерам и другим летучим соединениям патогенных процессов обоснована ранее [30]. При этом массив сформирован по принципу тройного сканирования состава воздуха: всех соединений (универсальные сорбенты на сенсорах), паров аммиака и алкиламинов (основные пленки на сенсорах), паров углекислоты и органических кислот (кислотные пленки сенсоров). Группа сенсоров с универсальными сорбционными свойствами: многостенные углеродные нанотрубки (МУНТ – сенсор 1), полиэтиленгликоль сукцинат (ПЭГСк – сенсор 3), пчелиный клей (ПчК – сенсор 6); покрытия, проявляющие селективность к аминам: бромкрезоловый зеленый (БКЗ – сенсор 2); проявляющие селективность к кислотам: Tween-40 (Tw – сенсор 4), метиловый оранжевый на подложке из полистирола (МО/ПС – сенсор 5).
Пьезосенсоры изготавливали по описанным ранее методикам [30]. Предварительно массив пьезосенсоров тренировали по индивидуальным веществам (газы-маркеры): растворам аммиака, первичным, вторичным и третичным аминам с алкильными радикалами, растворам летучих карбоновых кислот С2–С5 нормального и развевленного строения (все препараты ч. д. а., х. ч.) до стабилизации откликов и минимальных уровней шумов.
На предварительном этапе необходимо было правильно выбрать количественные параметры, регистрируемые и рассчитываемые с помощью программного обеспечения прибора, максимально коррелирующие с содержанием аммиака как наиболее специфичного из регистрируемых газов.
В качестве объектов испытания выбрали несколько групп людей, соблюдая нормы этики и обеспечивая добровольность участия в эксперименте. Первая группа состояла из 10 пациентов отделения гастроэнтерологии ГУЗ ВОКБ № 1 с разными диагнозами с отрицательными и положительными хелико-тестами, из которых 4 мужчины и 6 женщин в возрасте от 34 до 74 лет. Вторая группа состояла из 38 пациентов пульмонологического отделения ВДКБ ВГМУ в возрасте от 3 до 17 лет, страдающих бронхиальной астмой в сочетании с хроническим гастродуоденитом и не получавших антихеликобактерную терапию, 14 пациентам была проведена фиброгастродуоденоскопия с последующим гистоморфологическим исследованием биоптата слизистой оболочки желудка и двенадцатиперстной кишки как “золотой” стандарт диагностики инфекции НbР. Третья группа состояла из 27 пациентов – 6 мужчин и 21 женщины в возрасте от 20 до 55 лет, посещавших кабинет рефлексотерапии консультационной поликлиники ГУЗ ВОКБ № 1, с методом диагностики по R. Voll (резонансная рефлексотерапия). Для тестирования использовали диагностический медицинский аппарат DETA-D и медикаментозный селектор DETA-PHARMA (НПП “ЭЛИС”, Москва). Измерения и медикаментозное тестирование осуществляли в контрольно-измерительных точках меридиана желудка справа и слева до и после приема карбамида.
Условия подготовки испытуемых пациентов к анализу выдыхаемого воздуха соответствовали стандартным условиям для неинвазивной диагностики инфекции по индикаторным трубкам (Хелико-тест). Особенно контролировали отсутствие курения, прием лекарств и пищи. В связи с этим тестирование проводили в период с 8 до 10 ч в условиях стационара. Методика сенсорного анализа с применением “электронного носа” заключалась в отборе 5 см3 воздуха изо рта испытуемого до принятия раствора карбамида (базальный, нулевой уровень), забор воздуха спустя 5, 10, 15 (иногда 20) мин после принятия 50 см3 раствора карбамида.
Альтернативные методы исследования – фиброгастроскопия с отбором биоматериала для теста, дыхательный Хелико-тест.
Параллельно применяли известную методику тест-диагностики инфекции по содержанию аммиака в слюне пациентов [27]. По ее результатам оценивали чувствительность и специфичность теста с применением массива химических сенсоров. Для диагностики Helicobacter pylori по оценке уреазной активности слюны выбрали 24 человека в возрасте 9 лет–24 г. Материалом исследований служила слюна, которую получали путем сплевывания в пробирку типа Эппендорф. При этом соблюдались общие требования подготовки пациента, в том числе обследование натощак.
Индикаторные бумажки (тест-билет) изготавливали путем пропитывания и высушивания носителя реагентов – фильтровальной бумаги “синяя лента” – растворами карбамида (2 мас. %) и бромтимолового синего (0.04 мас. %) в 96%-ном этаноле способом послойного нанесения реагентов после высушивания в сушильном шкафу при 98–100°С [31]. Полученную реактивную бумагу разрезали на полоски и использовали для биохимических тестов. Для оценки уреазной активности тест-билет смачивали слюной и регистрировали появление индикационного эффекта – синего пятна на желтом фоне. Для создания градуировочной цветовой шкалы готовили серию водных растворов аммиака. Аналитический эффект регистрировали путем фотографирования тест-билетов с помощью фотокамеры коммуникатора Samsung Galaxy S II (GT-i9100). Условия съемки: формат сохранения графической информации – JPЕG, фотокамера – 8 млн пикс., фокусное расстояние – 29 мм, размер изображения – 3.2 Мб, расстояние от объекта – 30 см, вспышка – отключена, светочувствительность – 80ISO или “Авто”, параметры баланса белого – “Авто”, экспозамер – точечный замер, стабилизация изображения – включена. Определение цветометрических характеристик полученных изображений и преобразования цветовых координат выполняли в программе “Цветометрия 16-2” в среде MathCAD 15. Для этого на изображении окрашенного образца выделяли прямоугольную область, по которой программа проводит усреднение значений цветовых параметров модели (яркости красного R, зеленого G и синего B каналов). По результатам анализа стандартных растворов аммиака с концентрациями в диапазоне от 0.000 до 0.010% с шагом 0.001% составляли цветовую шкалу для визуально-аналоговой регистрации результатов уреазной активности Helicobacter pylori в слюне.
Для окрашенных в синий цвет образцов цветовых шкал при определении бактерии Helicobacter pylori наиболее резко изменяющимся цветовым каналом является красный (R), наиболее ярким и наименее резко изменяющимся – синий (B) канал, соответствующий цвету образца. По уравнению градуировочного графика вычисляли концентрацию аммиака у пациентов по показателю цветности R.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
После изготовления и тренировки пленок тестировали пьезосенсоры в парах веществ для оценки их активности и специфичности для определения микроконцетраций не только аммиака и углекислоты, но и других возможных маркеров патогенных процессов (аминов, алифатических кислот). Оценивали базовые характеристики некоторых активных тонких пленок модификаторов электродов пьезокварцевых резонаторов в парах тест-веществ: шум, дрейф, износостойкость. Данные характеристики важны для оценки воспроизводимости сорбционных свойств тонких пленок модификаторов в зависимости от числа взаимодействий с аналитами (табл. 3).
Таблица 3.
Функциональные параметры пленок сорбентов в парах циклогексиламина
| Модификатор сенсоров | $m_{{{\text{пл}}}}^{{{\text{исх}}}}$, мкг | Устойчивость, % | Шум, Гц | Дрейф, Гц |
|---|---|---|---|---|
| ПчК | 15.43 | 99.4 | 4 | 9 |
| БКЗ | 10.32 | 99.3 | 4 | 14 |
| МО/ПС | 10.06 | 98.5 | 3 | 8 |
| МУНТ | 4.26 | 97.0 | 3 | 17 |
Шум оценивали как сдвиг базовой частоты пьезосенсора за 10 мин (∆F10 мин, Гц) – время, в 3–5 раз превышающее время измерения. Дрейф оценивали как изменение исходной частоты пьезосенсора после десорбции дополнительного агрессивного сорбата (внешний стандарт) за 3–5 циклов сорбции с учетом шума в системе (∆F3–5 циклов, Гц). Устойчивость пленок оценивали по уменьшению массы вновь сформированной пленки сорбента ($m_{{{\text{пл}}}}^{{{\text{исх}}}},$ мкг) за 10 сорбционно-десорбционных циклов ((1 – ∆m10/$m_{{{\text{пл}}}}^{{{\text{исх}}}}$) × 100%). В качестве дополнительного агрессивного сорбата выбрали пары циклогексиламина, наиболее интенсивно взаимодействующего с пленками. Следовательно, легколетучие амины и аммиак, а также кислоты будут в значительно меньшей степени изнашивать при сорбции пленки выбранных модификаторов сенсоров.
Установлено, что наиболее устойчивыми к взаимодействиям с агрессивным стандартом являются пленки сорбентов ПчК, БКЗ. Изменение их массы в парах тест-веществ не превышает 1% за 10 сорбционно-десорбционных циклов, воспроизводимость откликов пьезосенсоров с этими пленками наилучшая из изученных. Для массива в целом потеря массы пленок не превышает 5%. Особую роль при расчете дрейфа играют наиболее интенсивно сорбирующиеся вещества для каждой пленки. В связи с этим, например, пьезосенсор с пленкой МО/ПС, имеющий небольшое значение дрейфа, изменяет свою исходную частоту колебаний, что может негативно сказаться на его чувствительности и воспроизводимости результатов. В то же время, если такие соединения будут отсутствовать в смеси, то пьезосенсоры с чувствительными пленками можно эффективно использовать для определения аммиака и кислот (углекислый газ с парами воды).
Эффективность сорбции в методе пьезокварцевого микровзвешивания оценивают по массовой чувствительности к выбранным тест-веществам. Чем больше чувствительность, тем меньшее количество данного соединения можно надежно определять в смеси. В табл. 4 приведены экспериментально полученные массовые чувствительности для выбранных пленок в парах исследуемых тест-веществ, выделены максимальные значения для каждого аналита.
Таблица 4.
Массовая чувствительность (Sm, Гц м3/г) пленок сорбентов в парах некоторых тест-веществ
| Пленка | Вода | Муравьиная кислота | Уксусная кислота | Аммиак |
|---|---|---|---|---|
| ПчК | 0.99 | 11.3 | 10.5 | 2.24 |
| БКЗ | 2.97 | 37.1 | 96.9 | 15.2 |
| МУНТ | 2.48 | 17.5 | 20.9 | 14.3 |
Для оценки влияния других газов и паров, находящихся в выдыхаемом воздухе, на сигналы массива “электронного носа” необходимо использовать пьезосенсоры на основе пленок, характеризующихся низкими значениями массовых чувствительностей к парам тест-веществ, особенно к парам воды. Из изученных сорбентов такими свойствами характеризуются МУНТ и ПчК.
Для получения информации о присутствии (качественном анализе) и содержании (количественном анализе) тест-веществ в многокомпонентной смеси, которую представляет собой выдыхаемый воздух, необходимо использовать сложные алгоритмы обработки многомерной матрицы сигналов массива пьезосенсоров [32]. Именно перекрестная чувствительность пленок сорбентов к компонентам смеси позволяет, с одной стороны, улавливать их на уровне следов, а с другой стороны, не дает возможности оценить присутствие по сигналам отдельных сенсоров. Для этого используют различные методы хемометрики (нейронные сети, регрессионные и дискриминантные методы) [32]. Наиболее широко для решения таких задач применяют метод главных компонент (МГК), позволяющий заменить исходное описание образцов с помощью новых переменных в пространстве главных компонент для распознавания и изучения общей структуры данных (программное обеспечение Unscrumbler 10.0.0). Одним из достоинств МГК является возможность исследования зависимостей между всеми переменными одновременно и установления степени взаимного влияния их друг на друга.
Для дифференциации тест-веществ в выдыхаемом воздухе при обработке результатов пьезокварцевого микровзвешивания в качестве переменных применяли традиционные параметры: аналитические сигналы всех пьезосенсоров (∆Fmax,i, Гц), площадь “визуального отпечатка” (Sв. о., Гц с) и параметры эффективности сорбции паров индивидуальных соединений – отношение максимальных сигналов наиболее чувствительных пьезосенсоров к выбранным соединениям $\left( {А_{{ij}}^{{\max }}} \right),$ которые рассчитывали по формуле [33]:
Параметр $А_{{ij}}^{{\max }}$ является мерой относительной чувствительности двух пьезосенсоров к сорбату и остается постоянным в определенной зоне его содержаний, что позволяет идентифицировать соединения в смеси [33]. Подбор таких параметров для каждого вещества индивидуален и зависит от многих факторов. Установлено, что для алифатических аминов и аммиака информативными являются критерии $А_{{23}}^{{\max }},$ $А_{{56}}^{{\max }},$ ∆Fmax, 5, так как пьезосенсоры с пленками МУНТ, БКЗ и ПЭГСк наиболее эффективно сорбируют сильноосновные тест-вещества с малыми геометрическими параметрами молекул.
Для поиска наиболее корректного количественного аналитического сигнала строили график зависимости площади “визуального отпечатка” максимальных откликов пьезосенсоров от концентрации раствора аммиака (рис. 2а, 2б). При этом применяли площадь фигуры “визуального отпечатка” сигналов всех сенсоров в массиве (рис. 2а, ∑Sв.о., Гц с) и площадь фигуры “визуального отпечатка” сигналов наиболее чувствительных к аммиаку сенсоров 1, 2 и 3 (рис. 2б, Sв.о.(1, 2, 3), Гц с).
Рис. 2.
Зависимость площади “визуального отпечатка” максимальных откликов разного числа пьезосенсоров от концентрации раствора аммиака для полного массива сенсоров (а), для наиболее чувствительных к аммиаку сенсоров (б).
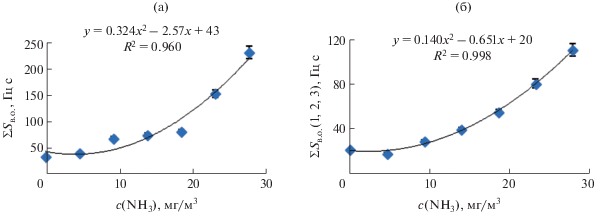
Установлено, что для количественного определения аммиака как основного вещества-маркера при определении уровня хеликобакретной активности по уреазному дыхательному тесту, наиболее пригоден параметр Sв.о.(1, 2, 3), Гц с. Для повышения правильности качественного и количественного определения в выдыхаемом воздухе аммиака и аминов при обработке результатов применяли отклики только чувствительных к ним пьезосенсоров с покрытиями МУНТ, БКЗ и ПЭГСк, для кислот приоритетна информация сенсоров с пленками МО/ПС, Tw.
Градуировочный график на рис. 2б не является традиционно линейным, его можно разделить на 3 участка по значениям концентрации аммиака и принятию решения об активности HbP: с(NH3) < < 4.60 мг/м3 – отрицательный результат теста (–); с(NH3) > 23.20 мг/м3 – положительный однозначный результат теста (+++); 4.60 мг/м3 < с(NH3) ≤ ≤ 23.20 мг/м3 – положительный неоднозначный результат теста (+/++).
При проведении диагностики пациентов на наличие инфекции Helicobacter pylori рассчитывали значение площади “визуального отпечатка” максимальных откликов первых трех пьезонсенсоров с покрытиями МУНТ, БКЗ и ПЭГСк, по градуировочному графику оценивали содержание аммиака в выдыхаемом воздухе обследуемых пациентов и делали вывод об изменении концентрации основного целевого газа-маркера на трех этапах измерения (табл. 5). При этом имеет значение не только абсолютное значение концентрации аммиака в выдыхаемом воздухе в каждой точке измерения, но и тенденция ее нарастания от нулевой к конечной точке контроля.
Таблица 5.
Результаты диагностики уровня активности инфекции Helicobacter pylori у пациентов по значениям площади “визуального отпечатка” максимальных откликов пьезонсенсоров с покрытиями многостенные углеродные нанотрубки, бромкрезоловый зеленый и полиэтиленгликоль сукцинат
| № пациента | Площадь “визуального отпечатка” максимальных откликов пьезосенсоров с пленками МУНТ, БКЗ и ПЭГСк, Гц с | Содержание аммиака в выдыхаемом воздухе, мг/м3 | Результат диагностики |
||||
|---|---|---|---|---|---|---|---|
| 5 мин | 10 мин | 15 мин | 5 мин | 10 мин | 15 мин | ||
| 8 | 58.11 | 48.33 | 81.51 | 18.90 | 16.63 | 23.35 | +++ |
| 9 | 40.64 | 37.66 | 37.61 | 14.56 | 13.65 | 13.64 | ++ |
| 10 | 41.32 | 46.67 | 40.67 | 14.75 | 16.21 | 14.57 | ++ |
| 12 | 50.45 | 50.29 | 43.71 | 17.15 | 17.11 | 15.42 | ++ |
| 20 | 43.80 | 36.83 | 41.40 | 15.45 | 13.39 | 14.78 | ++ |
| 22 | 36.70 | 57.51 | 35.48 | 13.35 | 18.77 | 12.94 | ++ |
Для получения дополнительной диагностической информации о пробах воздуха и оценки их качественного состава рассчитали параметры эффективности сорбции $А_{{ij}}^{{\max }}$ как для стандартных растворов аммиака, так и для исследуемых проб выдыхаемого воздуха. Для исследуемых концентраций стандартных растворов аммиака рассчитали наиболее информативные параметры эффективности сорбции, которые представлены в табл. 6.
Таблица 6.
Значения параметров эффективности сорбции аммиака из газовой фазы над пробами стандартных растворов для наиболее информативных пьезосенсоров (n = 3, P = 0.95)
| c(NH3, пары), мг/м3 | Сочетание сигналов пьезосенсоров с покрытиями | ||
|---|---|---|---|
| МУНТ/МО/ПС | ПЭГСк/МО | Tw/МО/ПС | |
| 0 (вода) | 1.4 ± 0.9 | 1.6 ± 0.3 | 1.5 ± 1.0 |
| 0.01 | 1.2 ± 0.2 | 1.3 ± 0.7 | 1.3 ± 0.1 |
| 0.02 | 0.9 ± 0.4 | 1.1 ± 0.3 | 1.0 ± 0.3 |
| 0.03 | 0.89 ± 0.04 | 1.1 ± 0.8 | 1.1 ± 0.3 |
| 0.04 | 0.5 ± 0.1 | 1.0 ± 0.1 | 0.7 ± 0.3 |
| 0.05 | 0.6 ± 0.2 | 1.1 ± 0.2 | 1.0 ± 0.2 |
Выделены диапазоны параметров эффективности сорбции $\left( {A_{{ij}}^{{{\text{max}}}}} \right)$ аммиака над пробами стандартных растворов для идентификации веществ-маркеров Helicobacter pylori. Так, надежная идентификация углекислого газа (углекислоты) осуществима по показателю Ai/j для сенсоров с покрытиями Tw/МО/ПС при попадании его в интервал значений 0.4 ± 1.0 < А < 1.3 ± 0.4; аммиака по показателю Ai/j для сенсоров с покрытиями МУНТ/МО/ПС в интервале 0.2 ± 0.9 < А < 1.2 ± 0.2; алкиламинов, аммиака по показателю Ai/j для сенсоров с покрытиями ПЭГСк/МО/ПС в интервале 0.4 ± 1.1 < А < 1.3 ± 0.4.
Выводы об уровне активности инфекции могут быть сделаны также по идентичности геометрии областей “визуальных отпечатков” максимальных откликов пьезосенсоров, которые строятся автоматически с помощью программного обеспеченя прибора. Несмотря на их некоторые различия, для пациентов внутри одной группы “визуальные отпечатки” характеризуются определенной формой. Так, установлено, что для проб выдыхаемого воздуха у пациентов, имеющих результат диагностики “+++” и “++”, максимальный аналитический сигнал характерен для пьезосенсора с пленкой ПЭГСк, меньшие значения аналитических сигналов – у пьезосенсоров с пленками МУНТ, Tw, МО/ПС, что свидетельствует о наличии аммиака в пробе выдыхаемого воздуха, а также о присутствии органических кислот. У пациентов, имеющий отрицательный результат диагностики инфекции Helicobacter pylori (“+” или “–”), отличительной особенностью являются наибольшие значения сигналов пьезосенсоров с пленками Tw, МО/ПС, ПчК и значительное уменьшение сигнала пьезосенсора с пленками МУНТ, ПЭГСк.
Об общем изменении содержании легколетучих веществ в выдыхаемом воздухе можно судить по изменению площади “визуальных отпечатков” максимальных сигналов пьезосенсоров в разных точках контроля по сравнению с начальным уровнем. Установлено увеличение разности площадей “визуальных отпечатков” максимальных откликов пьезонсенсоров для проб выдыхаемого воздуха пациентов с результатами диагностики “+++” и “++” после приема карбамида по сравнению с базальным уровнем измерения, что связано с увеличением содержания легколетучих соединений. Резкое увеличение значения аналитического сигнала сразу после приема раствора карбамида (контрольное измерение № 1) указывает на явное наличие инфекции Helicobacter pylori в организме. Если увеличение аналитического сигнала происходит спустя 5 мин после приема раствора карбамида (контрольное измерение № 2), то это может указывать на наличие язвы луковицы двенадцатиперстной кишки. Также стоит отметить, что резкое увеличение различия площадей при контрольном измерении № 3 (спустя 15 мин после приема карбамида) подтверждает наличие и высокую активность Helicobacter pylori в организме. Если при контрольном измерении № 3 значение аналитического сигнала уменьшается или достигает значения базального уровня измерения, то это может быть связано с наличием у пациента таких заболеваний, как эритематозный гастродуоденит, нодулярный гастрит, эрозия желудка и др., не связанных напрямую с Helicobacter pylori. Напротив, у пациентов с отрицательными результатами диагностики наблюдается резкое уменьшение значения разности площадей “визуальных отпечатков” максимальных откликов пьезонсенсоров после приема раствора карбамида (табл. 5), что объясняется смывом веществ с пищевода раствором при отсутствии активного разложения мочевины.
Результаты диагностики сенсорным методом анализа плохо совпадают с результатами анализа с применением тест-билета для общей выборки пациентов. По концентрации аммиака цветовую шкалу также разделяли на 3 участка: с(NH3) < 0.001% – отрицательный результат теста (6 человек: пробы №№ 2, 3, 4, 6, 9, 21); с(NH3) > 0.005% – положительный результат теста (2 человека: пробы №№ 8, 22); 0.001% < с(NH3) ≤ 0.005% – неоднозначный результат (16 человек: пробы №№ 1, 5, 7, 10–20).
Пример откликов при измерении уреазной активности Helicobacter pylori в слюне с помощью тест-полосок представлен на рис. 3. В соответствии с градуировочным графиком и данными интенсивности цветового канала R все пациенты также были разделены на 3 группы: R < 90 – положительный результат теста (2 человека: пробы №№ 8, 22); R > 220 – отрицательный результат теста (6 человек: пробы №№ 2, 3, 4, 6, 9, 21); 90 < R < 220 – неоднозначный результат теста (16 человек: пробы №№ 1, 5, 7, 10–20).
Рис. 3.
Пример измерений уреазной активности Helicobacter pylori в слюне с помощью тест-полосок (n = 4).

С учетом опроса испытуемых и наличия у них параллельных подтверждающих результатов других методов установлено, что уреазный бумажный тест на слюну является низкочувствительным и не позволяет получить дополнительную информацию о состоянии желудочно-кишечного тракта и в ряде случаев достоверные данные об уровне активности HbP. Вместе с тем его можно применять при диспансеризации населения. Однако составить конкуренцию по аналитическим характеристикам и информативности сенсорному методу этот подход не может.
Обобщенные результаты сенсорного анализа выдыхаемого воздуха для 1 группы пациентов выглядят следующим образом: у 6 испытуемых определено наличие HbP в желудке и двенадцатиперстной кишке; у 4 пациентов дыхательный тест дал отрицательный результат, что на 75% соответствует результатам микробиологического анализа, у 10% получены ложноположительные результаты по результатам микробиологического теста и 10% (одна проба) показали несоответствие двух дыхательных тестов. Селективность массива пьезосенсоров к аммиаку – 100%.
Результаты для 2 группы пациентов: у 71 пациента результаты фиброгастроскопии и дыхательного теста на “электронном носе” с шестью сенсорами совпали (10 из 14 пациентов). Врачами отмечена экспрессность и простота теста, не требующего реактивов и особых навыков при использовании прибора и освоении методики измерения. В 3 группе у шести пациентов установлено наличие инфекции, сходимость результатов – более 90%.
Предложенный подход по применению “электронного носа” более информативен по сравнению с широко применяемым коммерческим Хелико-тестом. Так, при сканировании выдыхаемого воздуха через 5 и 15 мин после нагрузки карбамидом возможна дифференциальная оценка уровня активности инфекции в разных отделах – желудке и луковице двенадцатиперстной кишки. Такое дифференцирование весьма важно для испытания у взрослых и детей, для которых колонии микроорганизма заселяются по-разному. С учетом имеющихся результатов подтверждения диагнозов в разных выборках пациентов другими более специфичными и чувствительными методами, чувствительность и специфичность сенсорного анализа составили соответственно более 90 и 96%. С учетом неспечифичности, химической устойчивости покрытий сенсоров, неинвазивности определения, общей продолжительности анализа не более 20 мин, многократности применения сенсоров (не менее 800–1000 измерений без замены) предлагаемый подход характеризуется высокими оценочными критериями, перспективен для применения как дополнение к стандартным методам испытаний. Следует отметить экономичность метода при мониторинге заболевания, оценке эффективности проведения лечебных мероприятий. Предложенный подход особенно привлекателен для детей из-за нетравматичности и простоты отбора пробы и замеров, легко применим при прикроватной диагностике и для быстрой корректировки терапевтических мероприятий.
Работа выполнена при финансовой поддержке гранта РНФ № 18-76-10015.
Список литературы
Sanders M.K., Peura D.A. Helicobacter pylori-associated diseases // Curr. Gastro Reports. 2002. V. 4. P. 448.
Uemura N., Okamoto S., Iamamoto S. Helicobacter pylori infection and the development of gastric cancer // N. Engl. J. Med. 2001. V. 345. P. 784.
Робакидзе Н.С. Состояние полости рта у Helicobacter pylori-инфицированных больных при различных вариантах течения язвенной болезни. Автореф. дис. … канд. мед. наук. СПб: 2000. 20 с.
Nguyen A.M.N., El-Zaatari F.A.K., Graham D.Y. Helicobacter pylori in the oral cavity: A critical review of the literature // Oral Surg., Oral Med., Oral Pathol., Oral Radiol. Endod. 1995. V. 76. P. 705.
Riggio M. P., Lennon A. Identification by PCR of Helicobacter pylori in subgingival plaque of adult periodontitis patients // J. Med. Microbiol. 1999. V. 48. Suppl. 3. P. 317.
Исаков В. А., Домарадский И. В. Хеликобактериоз. М.: ИД “Медпрактика”, 2003. 412 с.
Акопян И.Г., Барышникова Н.В., Григорян Т.М. Методы диагностики хеликобактериоза. СПб: Диалект, 2008. С. 5.
Корниенко Е.А. Дмитриенко М.А., Ломанина Е.А. Повышение точности хелик-теста в диагностике инфекции Helicobacter pylori // Рос. журн. гастроэнтерол., гепатол., колопроктол. 2003. № 3. С. 14.
Gressman H., Linz B., Ghai L. Gain and loss of multiple genes during the evolution of Helicobacter pylori // PLoS Genetics. 2005. V. 1 № 4. P. 0419.
Viara D., Malfertheiner P., Megraud F. Non invasive antigen based assay for assessing Helicobacter pylori eradication // Am. J. Gastroenterol. 2002. V. 95. P. 925.
Malfertheiner P., Megraud F. Current concepts in the management of Helicobacter pylori infection / The Maastricht 2-2000 Consensus Report Aliment Pharmacol. 2002. V. 16. P. 67.
Леонтьева Н.И., Щербаков И.Т., Новикова Л.И. Оценка инвазивных и неинвазивных методов диагностики хеликобактерной инфекции // Современные технологии в медицине. 2011. № 2 С. 57.
Бельмер С.В., Гасилина Т.В., Еремеев В.С. Значение серологического выявления пилорического хеликобактериоза у детей с язвенной болезнью // Materia Medica. 2000. № 2 (26). С. 88.
Говорун В.М., Момыналиев К.Т., Смирнова О.В. Современные подходы к молекулярной диагностике и типированию клинических изолятов Helicobacter pylori в России // Рос. журн. гастроэнтерол., гепатол., колопроктол. 2002. № 3. С. 57.
Говорун В.М., Гущин А.Е., Кудрявцева Л.В. / Тез. докл. 3-й Всерос. научно-практической конф. “Генодиагностика в современной медицине”. Москва, 2000. С. 295.
Ивашкин В.Т., Шептулин А.А. Болезни пищевода и желудка. М.: Медпресс-информ. 2002. 144 с.
Исаков В.А. Молекулярно-генетические основы патогенности Helicobacter pylori // Рос. журн. гастроэнтерол., гепатол. и колопроктол. 2002. № 6. С. 82.
Исаков В.А., Тудиков Г.В. Серологические методы диагностики инфекции Helicobacter pylori: рекомендации и перспективы применения // Клин. лаб. диагност. 2000. № 1. С. 38.
Кишкун А.А. Современные методы диагностики и оценки эффективности лечения инфекции Helicobacter pylori // Лаб. медицина. 2000. № 3. С. 37.
Кудрявцева Л.В., Щербаков П.Л., Иваников И.О., Говорун В.М. Helicobacter pylori-инфекция: современные аспекты диагностики и терапии. Пособие для врачей. М., 2004. С. 24.
Ohkura R., Miwa H., Muraiet T. Usefulness of a novel enzyme immunoassay for the detection of Helicobacter pylori in feces // Scand. J. Gastroenterol. 2000. P. 49.
Цодинов Г.В., Морозова Н.А., Зякун А.М. Диагностическое значение различных способов проведения методики уреазного дыхательного теста // Гастроэнтерология Санкт-Петербурга. 2003. № 2–3. С. 185.
Ивашкин В.Т., Маев И.В., Лапина Т.Л. Рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению инфекции Helicobacter pylori у взрослых // Рос.журн. гастроэнтерол. гепатол., колопроктол. 2012. С. 87.
Ge R., Chen Z., Zhou Q. The actions of bismuth in the treatment of Helicobacter pylori infections: An update // Metallomics. 2012. P. 239.
Маев И.В., Самсонов А.А., Андреев Д.Н. Клиническое значение инфекции Helicobacter pylori // Клиническая медицина. 2013. С. 4.
Tonkic A., Tonkic M., Lehours P., Mégraud F. Epidemiology and diagnosis of Helicobacter pylori infection // Helicobacter. 2012. P. 1.
Успенский Ю.П., Барышникова Н.В. Helicobacter pylori-ассоциированные заболевания: патогенез, особенности диагностики и дифференцированное лечение. Учебно-методическое пособие. Санкт-Петербург, 2010. 64 с.
Маев И.В., Самсонов А.А., Андреев Н.Г. Эволюция представлений о диагностике и лечении инфекции Helicobacter pylori (по материалам консенсуса Маастрихт IV, Флоренция 2010) // Вестник практического врача. 2012. Спецвыпуск 1. С. 6.
Кучменко Т.А., Атискова И.Ю., Силина Ю.Е. Способ неинвазивной диагностики инфекции Нelicobacter pylori. Патент № 2325845 РФ. Заявка от 15.01.2007, опубл. 10.06.2008.
Кучменко Т.А., Шуба А.А., Тюркин И.А., Битюкова В.В. Способ диагностики хламидиоза, гарднереллеза, трихоманиаза, уреаплазмоза, микоплазмоза по составу равновесной газовой фазы над цервикальной слизью. Патент № 2458139 РФ. Заявка № 2010154802 от 30.12.2010, опубл. 10.08.2012.
Дмитриенко М.А., Корниенко Е.А., Милейко В.Е. Способ диагностики хеликобактериоза по оценке уреазной активности биологического материала и устройство для его осуществления. Патент № 2184781 РФ. Заявка № 97117123 от 30.09.97, опубл. 10.07.2002.
Кучменко Т.А. Химические сенсоры на основе пьезокварцевых микровесов. В монографии Проблемы аналитической химии. Т. 14 / Под ред. Власова Ю.Г., М.: Наука, 2011. С. 127.
Кучменко Т.А., Шуба А.А., Бельских Н.В. Пример решения идентификационных задач в методе пьезокварцевого микровзвешивания смесей некоторых органических соединений // Аналитика и контроль. 2012. Т. 16. № 2. С. 1.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии



