Журнал аналитической химии, 2019, T. 74, № 3, стр. 186-200
Эффект удерживания кислоты в сорбционных колоннах с двумя жидкими фазами. Возможности использования в пробоподготовке при элементном анализе
Р. Х. Хамизов 1, *, А. Н. Крачак 1, Е. Б. Подгорная 2, А. Н. Груздева 1
1 Институт геохимии и аналитической химии им. В.И. Вернадского Российской академии наук
119991 Москва, ул. Косыгина, 19, Россия
2 ООО “НЕОХИМ”
195030 Санкт-Петербург, ул. Потапова, 2, лит. А, Россия
* E-mail: khamiz@mail.ru
Поступила в редакцию 20.03.2017
После доработки 15.09.2018
Принята к публикации 15.09.2018
Аннотация
Описаны основные закономерности метода “удерживания кислоты” (Acid Retardation) для хроматографического разделения смесей в концентрированных кислых растворах и разработанных авторами новых его вариантов, удобных для использования в технологии и химическом анализе. Представлены результаты исследований по апробации нового подхода к разделению смесей электролитов c использованием колонок, в которых слой анионита заполнен органической жидкостью, несмешивающейся с водой и водными растворами. На примерах разделения компонентов модельных смесей, содержащих азотную кислоту и ее соли, натурных растворов кислотного разложения костной ткани, а также почвы на анионите АВ-17 в нитратной форме показана перспективность предложенного подхода для пробоподготовки в химическом анализе, в частности, для эффективного уменьшения кислотности растворов после разложения трудно разлагаемых проб. Воспроизводимость результатов, полученных с использованием предложенного подхода, оценена путем анализа выходных кривых сорбции−десорбции макрокомпонентов раствора костного минерализата в повторяющихся экспериментах.
Высокотехнологичные спектральные методы инструментального контроля, в частности, масс-спектрометрия с индуктивно связанной плазмой (МС-ИСП) широко используют в современной аналитической практике. Для твердых проб, таких как геологические образцы минералов или биологические ткани, требуется предварительная подготовка, которая заключается в разрушении природной матрицы (минерализации) и растворении химических элементов объекта исследования, например, в автоклавах или с помощью микроволнового разложения. В качестве активного агента минерализации чаще всего используют концентрированные кислоты. Высокая концентрация кислоты в растворе после разложения не позволяет анализировать непосредственно минерализат. При этом его разбавление может приводить к тому, что концентрации микрокомпонентов проб оказываются ниже пределов обнаружения. На практике для отделения избытка кислоты применяют различные традиционные способы, например контролируемое испарение или нейтрализацию. Для первого метода характерна высокая трудоемкость, для второго – увеличение общей минерализации образца, что также нежелательно.
Нами предложен новый метод пробоподготовки для элементного анализа, позволяющий выделять раствор солевых компонентов из смешанного исходного раствора с помощью эффекта удерживания кислоты в сорбционной колонне с анионитом в форме аниона отделяемой кислоты [1–3]. Метод основан на принципиально новом подходе к организации процессов массопереноса в трехфазных сорбционных системах с нулевым свободным объемом для водных растворов разделяемых компонентов [4–6]. Особенность, отличающая предлагаемый нами подход от известного метода удерживания кислоты (Acid Retardation, AR) [7–9], состоит в использовании сорбционной системы с двумя жидкими фазами: органической и водной, что позволяет исключить наличие свободного пространства, занимаемого перерабатываемым раствором в разделительной колонке. Для химико-аналитической практики это обеспечивает нетрудоемкую методику пробоподготовки с получением в процессе разделения концентрационных зон с пониженным содержанием кислоты при содержании определяемых солевых компонентов, практически равном их концентрациям в исходном анализируемом растворе. Подход уже получил развитие в исследованиях других авторов [10], что, возможно, говорит о его перспективности.
В настоящей работе описаны существо подхода, механизм процесса разделения и продемонстрированы некоторые его аналитические возможности на примерах разделения кислот и солей в высокоминерализованных модельных и реальных растворах кислотного разложения геологических объектов, образцов почв, а также нативной костной ткани.
ФУНДАМЕНТАЛЬНЫЕ ОСНОВЫ МЕТОДА
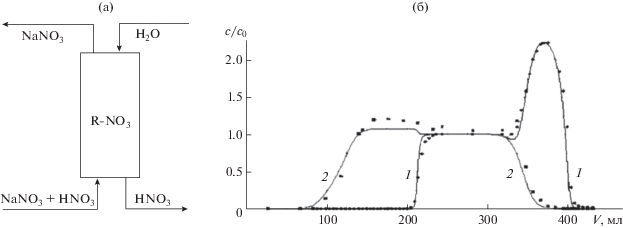
Механизм разделения кислот и солей в нанопористой среде. В течение многих лет после начала широкомасштабного использования ионитов существовало мнение, что эти материалы предназначены только для разделения и концентрирования в растворах с относительно низким содержанием целевых компонентов. Наиболее типичными примерами такого применения ионообменников в технологии являются очистка воды для электростанций, выделение микрокомпонентов в гидрометаллургии, различные методы очистки растворов, а в анализе – ионообменная хроматография и ионная хроматография как ее частный случай. В начале 1960-х годов появилась одна из первых публикаций [7], в которой речь шла о возможности необычного хроматографического метода отделения кислот от их солей в высококонцентрированных растворах на ионообменниках, названного его авторами Acid Retardation, AR. Метод не был связан с ионообменным процессом, поскольку для отделения кислоты от солей с общим анионом использовали анионообменник в той же анионной, т.е. равновесной с раствором, форме. Авторами было показано, что разделение кислотных и солевых компонентов может быть реализовано как в режиме элюативной хроматографии с использованием в качестве элюента просто воды, так и в повторяющихся циклах фронтальной хроматографии с удерживанием кислоты и “проскоком” солей через слой сильноосновного гелевого анионита с последующим вытеснением водой раствора кислоты в каждом цикле. На рис. 1 показана схема такого циклического процесса на примере разделения нитрата натрия и азотной кислоты [11]. Исходный смешанный концентрированный раствор разделяемых компонентов подается на колонку с сильноосновным анионитом в нитратной форме (в среде чистой воды) в направлении снизу вверх (рис. 1а). После начала проскока кислоты в колонку подается вода в направлении сверху вниз. В таком режиме более плотный раствор в колонке всегда находится ниже менее плотного, что уменьшает эффект продольного размытия концентрационных фронтов. Как видно из выходных кривых (рис. 1б), при пропускании через слой анионита концентрированного смешанного раствора вначале из колонки выходит только вода, затем раствор нитрата натрия, затем начинает выходить раствор кислоты и первая фаза процесса (250 мл эффлюента) заканчивается выходом исходного равновесного раствора. После начала пропускания воды из колонки выходит равновесный раствор, находящийся в свободном объеме, затем кислота с примесью солей, концентрация которых убывает по ходу процесса, затем выходит чистая кислота, концентрация которой в пике может существенно превышать ее концентрацию в исходном растворе. Цикл завершается выходом чистой воды, используемой в качестве вытесняющего агента.
Рис. 1.
(а): Схема AR-процесса разделения нитрата натрия и азотной кислоты; (б) – выходные кривые компонентов в AR-процессе разделения HNO3 (1) и NaNO3 (2) из смешанного раствора 1.4 М HNO3 и 2.96 М NaNO3. Колонка с загрузкой 160 мл анионита АВ-17 в NO3-форме. Точки – экспериментальные, линии – расчетные данные.
В течение долгого времени механизм разделения в методе удерживания кислоты был неясен. Например, в работе [8] и других работах Ферапонтова и соавт. предложена концепция твердофазной экстракции, которая не согласуется с закономерностями, полученными нами в систематических исследованиях процессов удерживания кислоты и эффектов разделения в однокомпонентных и двухкомпонентных модельных системах [12, 13]. Обнаружено, что степень удерживания нелинейным образом повышается с увеличением концентрации кислоты и суммарной концентрации раствора, а степень разделения компонентов зависит от природы солеобразующего катиона, увеличиваясь с повышением энергии его гидратации. Это говорит о возможности наличия размерного (ситового) эффекта в разделении на анионитах с гелевой нанопористой структурой. Ситовой механизм был предложен Даванковым и соавт. [9], которые показали, что разделение типа “удерживания кислоты” реализуется на созданных ими нейтральных (не имеющих функциональных групп) сверхсшитых сополимерах стирола и дивинилбензола с наноразмерными порами. По мнению авторов, разделение происходит по принципу ион-эксклюзионной хроматографии. В соответствии с этим механизмом следует полагать, что в ходе хроматографического разделения имеет место исключение из наноразмерных пор гелевого ионита или сверхсшитого сополимера крупных гидратированных ионов, что, в свою очередь, провоцирует дополнительное проникновение кислот (ионов гидроксония) в сорбент из-за необходимости сохранения электронейтральности и механического (осмотического) равновесия.
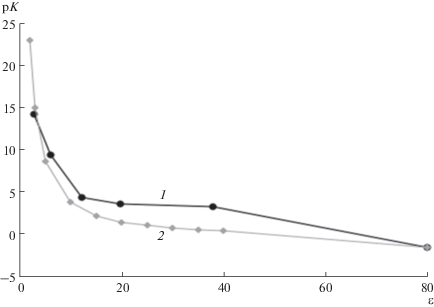
В связи с невозможностью дальнейшей детализации механизма разделения в AR-методе с помощью лабораторных экспериментов, были проведены теоретические исследования и численные эксперименты [11, 13, 14] c использованием предложенного Тихоновым [15, 16] нового подхода для расчета физико-химических свойств растворов электролитов. На рис. 2 сравниваются расчетные концентрационные зависимости диэлектрической проницаемости растворов нитратов натрия (кривая 1) и лития (кривая 2) с экспериментальными данными [17]. На этом же рисунке показаны соответствующие зависимости для внутренних растворов в гелевом ионите (кривые 3, 4) и сверхсшитом сополимере стирола и дивинилбензола (кривые 5, 6). Как видно, значения параметра ε во всем диапазоне его изменения в последних двух случаях существенно меньше. С этими данными можно сравнить расчетные и экспериментальные зависимости констант диссоциации азотной кислоты от диэлектрической проницаемости растворов (рис. 3). Экспериментальные зависимости построены на основе табличных данных (в порядке возрастания ε) для масляной и уксусной кислот, пиридина, а также этилового и метилового спиртов [18]. Расчетная кривая получена также на основе подхода [15, 16]. Из представленных результатов следует, что концентрированные кислоты в фазах исследуемых сорбционных материалов могут находиться в основном в молекулярной форме или в форме сильно связанных ионных пар.
Рис. 2.
Зависимость усредненной диэлектрической проницаемости раствора от концентрации NaNO3 (1) и LiNO3 (2). 1, 2 – внешний раствор; 3–6 – внутренний раствор в зерне сорбента в отсутствие (3, 4) и при наличии (5, 6) заряженных функциональных групп. Сплошные линии – расчетные, точки – экспериментальные данные [17].
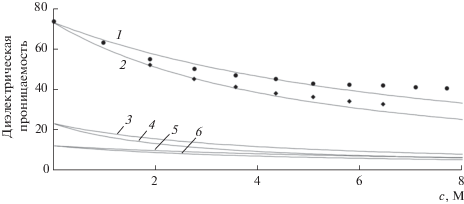
Рис. 3.
Зависимости константы диссоциации азотной кислоты от диэлектрической проницаемости. 1 – табличные данные, 2 – расчетная кривая.
Можно сформулировать уточненный механизм разделения в методе кислотного удерживания. Разделение кислот и солей из концентрированных смешанных растворов электролитов в AR-процессе определяется тем, что в фазе сорбционного материала в условиях с низкой диэлектрической проницаемостью кислоты частицы меньшего размера, чем нанопоры, а именно молекулы или сильно связанные и слабо гидратированные ионные пары, проникают в них и удерживаются там за счет молекулярной сорбции или сил конкурентной сольватации. Соль в виде сильно гидратированных ионов или слабо связанных ионных пар в существенно меньшей степени проникает в нанопоры.
Увеличение общей концентрации электролита или кислоты в растворе ведет к повышению ее удерживания за счет сдвига равновесия диссоциации. В этом отношении можно говорить об эксклюзии нейтральных компонентов – молекул и ионных пар. Роль ионной эксклюзии незначительна. Влияние природы катиона металла в смешанном растворе кислоты и ее соли можно объяснить двумя факторами: конкурентной сольватацией полярными молекулами кислоты слабо связанных ионных пар соли, проникающей в фазу нанопористого сорбента, эксклюзией нейтральных сильногидратированных ионных пар, которая обусловливает дополнительное проникновение кислоты в сорбент из-за стремления системы к осмотическому равновесию.
Косвенным подтверждением правильности предложенного механизма разделения является то, что основанная на нем модель динамики AR-процессов позволяет с хорошим приближением рассчитать выходные кривые для всех полученных экспериментальных данных при одном и том же наборе модельных параметров для каждой из сорбционных систем [11]. Пример расчетных кривых приведен на рис. 1.
Стабилизация коллоидов при их перколяции через нанопористую среду. Метод удерживания кислоты привлекателен из-за возможности осуществления разделения без использования вспомогательных реагентов, кроме воды. Однако метод в его классическом варианте имеет серьезные ограничения, главное из которых – его применимость только в том случае, когда отделенные от кислоты соли хорошо растворимы в воде. При разделении в реальных концентрированных многокомпонентных растворах, например в сульфатных или фосфатных средах, содержащих, как правило, железо, щелочноземельные металлы и другие компоненты, стандартные AR-процессы оказываются бесполезными. Как только в ходе движения раствора через гранулированный слой концентрационный фронт солей опережает кислотный фронт, сильно гидролизующиеся компоненты или малорастворимые соли, оказавшись в нейтральной среде, образуют осадки в слое. Теоретические исследования позволили обосновать модифицированный AR-метод, обеспечивающий стабильность коллоидных систем в сорбционных слоях. Суть его состоит в использовании в циклических процессах вместо воды сильно разбавленного раствора кислоты для вытеснения концентрированного раствора этой же кислоты. Вытесняющий агент для каждого сорбционного цикла “производится” в предыдущем цикле. На стадии разделения нанопористый сорбционный материал находится в среде такой разбавленной кислоты. Образующиеся в ходе разделения компонентов малорастворимые соединения солей в виде устойчивых коллоидных частиц иммобилизуются на поверхности гранул пористого материала, образуя тонкие динамические пленки. Эти коллоиды, имея избыточный заряд на своей поверхности, сольватируются полярными молекулами, в том числе кислотой, незначительное исходное количество которой в порозном пространстве слоя способно обеспечить большую концентрацию в динамической пленке и предотвратить образование твердых фаз. Эффект полностью соответствует изученному ранее механизму стабилизации перенасыщенных растворов в ионообменных системах [19, 20]. Модифицированный AR-метод открывает путь к созданию новых технологий разделения и получения неорганических веществ [13], однако для использования в анализе более пригодным является описанный ниже принципиально новый вариант метода удерживания кислоты.
Массообменный процесс в трехфазной среде. Имеется еще одно ограничение классического варианта AR-метода, в связи с чем он долго не находил применения, например, в промышленных технологиях. Оно связано с весьма короткими сорбционными циклами, в которых объемы фильтратов соизмеримы с объемами сорбционных слоев. В этих условиях необходимо полностью исключить перемешивание растворов разной природы, вызванное продольной дисперсией в слое. Из-за эффектов сжатия–набухания зерен ионита при изменении концентрации растворов, проходящих через любое сечение колонны, продольная дисперсия возникает независимо от направления потоков, поэтому трудно организовать динамический процесс, исключающий “паразитные” явления: смешивание различных веществ, а также получение дополнительных объемов разбавленных водных растворов, требующих утилизации. Решение проблемы, предложенное Брауном [21], состояло в практически полном исключении свободного объема в колонне, в том числе порозного пространства между зернами. Для этого колонну загружают слоем ионита или другого полимерного сорбента с размерами зерен порядка десятков микрон, причем слой сжимают до такой степени, чтобы зерна были деформированы, и между ними практически не оставалось свободного пространства. Из-за необходимости использования повышенного давления для прокачивания жидкостей через такие “хроматографические” колонны промышленные варианты последних имеют вид больших плоских дисков с высотой ~1 м и диаметром ~3 м. В коротких циклах концентрированные растворы подаются снизу вверх, а вода или разбавленные потоки в противоположном направлении. Для технологического применения изобретение Брауна [21] оказалась удачным, и оно в настоящее время широко используется во многих областях под общим названием Recoflo Technolo или Micro Media Technology [22].
Нами предложен новый подход к организации процессов массопереноса в ионообменных и сорбционных слоях [4–6], не требующий специальных установок и высокого давления, поэтому ионообменные материалы могут использоваться в течение длительного времени. Этот подход состоит в уменьшении объема, занимаемого водой и рабочими растворами в колоннах путем использования дополнительной жидкой фазы. Колонна, загруженная ионообменным гранулированным материалом, заполняется органической жидкостью, не смешивающейся с водой и с водными растворами. Все процессы в колоннах можно проводить, не меняя направление пропускания раствора как на сорбционной, так и на регенерационной стадиях рабочего цикла. На первый взгляд, кажется, что колонка, в которой гранулированный слой ионообменника полностью заполнен органической жидкостью и в нем не осталось свободного объема в межзеренном пространстве, не будет пропускать раствор. Однако эксперименты показывают, что при использовании органической жидкости с низкой плотностью, не смешивающейся с водой, например деканола или додекана, и гидрофильного сорбционного материала, например сильноосновного анионообменника, это возможно. В такой системе можно организовать пропускание через колонку воды или водного раствора. В этом случае в начале процесса из колонки выходит небольшое количество органической жидкости (несколько процентов от объема слоя), а затем протекает только водный раствор, а органическая жидкость остается в колонне.
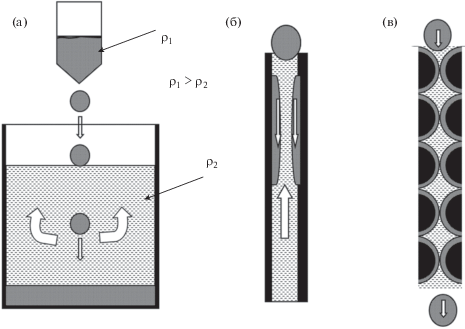
Для понимания описанного выше процесса рассмотрим рис. 4. На рис. 4а показано, что в широком сосуде с маслом более плотная капля воды или водного раствора падает, вытесняя органику наверх. Уменьшим диаметр сосуда, пока он не станет закрытым снизу капилляром (рис. 4б). Если вода имеет более высокую энергию смачивания стенок сосуда, чем масло, то капля деформируется и стекает по поверхности стенки, вытесняя масло. Теперь возьмем открытый капилляр сложной формы, показанный на рис. 4в, вдоль оси которого имеются периодические сужения, образующие очень тонкие щели. При некоторой очень малой толщине такой щели вода или водный раствор способны проникать в нее, и можно организовать процесс спонтанного течения через капилляр с удержанием масла в нем. Множество капилляров, подобных показанному на рис. 4в, расположенных параллельно, имитируют стационарный слой сорбента. Можно полагать, что прохождение водных жидкостей через слой сорбента имеет аналогичный механизм.
Рис. 4.
Схема прохождения водного раствора через слой менее плотной гидрофобной жидкости: (а) – в свободном объеме; (б) – в ограниченном объеме, в капилляре из материала с гидрофильной поверхностью; (в) – в плотном слое гидрофильного ионита.
Таким образом, можно предложить следующую интерпретацию механизма массопереноса в предлагаемой системе. При пропускании растворов, содержащих ионы, через слой зернистого ионообменного материала в отсутствие свободного пространства между зернами, а также в условиях, когда органическая жидкость отталкивает воду или водный раствор, последний выводится на границу раздела между органической жидкостью и гидрофильной поверхностью гранул, образуя очень тонкие пленки, охватывающие каждое зерно ионообменника, и стекает по точкам соприкосновения между ними (рис. 4в). Такая устойчивая динамическая система ультратонких подвижных пленок обеспечивает чрезвычайно большую площадь контакта между фазами, участвующими в массообмене. Из-за того, что рабочие растворы занимают незначительный объем в колонке, отсутствует возможность перемешивания потоков разных веществ, а также не возникает проблем с выбором направления этих потоков. Можно использовать самый простой вариант с пропусканием сверху вниз. При малых скоростях пропускания раствора органическая жидкость остается внутри колонны, однако из-за динамических причин могут иметь место небольшие потери при слишком высоких скоростях. Однако более легкая органическая жидкость, покидая колонну, сразу же всплывает вверх и может быть возвращена через трубку, соединяющую верх и низ колонны. Для относительно больших колонн может быть применена более сложная система [4, 5]. Предложенный метод назван NewChem по имени компании, которая сыграла важную роль в его развитии.
Важным является вопрос о возможности осуществления в трехфазных системах разделения компонентов сложных растворов и лиофильных коллоидных систем, содержащих осадкообразующие компоненты. Если слой сорбционного материала целиком заполнен органической жидкостью, то использование модифицированного AR-метода (см. выше) неэффективно. Опыт показывает, что в органической среде скорость образования осадков в процессе отделения солей от кислот уменьшается. Механизм этого эффекта пока неясен. Возможно, он связан с недостижимостью в некоторых случаях критических размеров зародышей кристаллизации в весьма тонких пленках [6].
В аналитической практике метод может быть реализован в самом простом варианте и, в принципе, должен обеспечить нетрудоемкую методику пробоподготовки с получением в процессе разделения концентрационных зон с пониженным содержанием кислоты при содержании определяемых солевых компонентов, равном их содержанию в исходном анализируемом растворе. Ниже изложены результаты применения метода в анализе для предварительной пробоподготовки.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Методики и материалы. Использовали промышленный сильноосновный анионит АВ-17-8-чС ГОСТ 20301-74 с размерами зерен 0.5–1.0 мм, который предварительно обрабатывали в динамическом режиме растворами соляной кислоты и щелочи (последовательно), а затем переводили в NO3-форму 1 М HNO3 и тщательно отмывали деионированной водой. Ионит в виде водной суспензии переносили в стеклянные колонки, снабженные фильтрующим устройством, позволяя стечь воде при одновременном осаждении зерен до образования плотного слоя, не содержащего воды выше его верхней границы. Слой анионита в каждой колонке дополнительно поджимали сверху, вводя в колонку небольшой кусок поролона или неплотный моток стекловолокна, плотно примыкающий к ее стенкам. Воду из свободного порозного пространства слоя анионита в колонках вытесняли чистым деканолом. Для этого через каждую из колонок в направлении сверху вниз пропускали деканол до тех пор, пока вся вода не вытеснялась из слоя ионита и свободного объема под слоем, после чего закрывали колонки на выходе. Высота слоя ионита в каждой из колонок практически не менялась, а объем деканола в ней с хорошей точностью соответствовал свободному объему при порозности 0.38 (значение предварительно определяли независимым методом [23]). В каждую из колонок добавляли дополнительное количество деканола, чтобы над слоем ионита выше поролона находился некоторый дополнительный объем органической жидкости. После проведения этих операций колонки были готовы к работе. Эксперименты по разделению проводили при пропускании модельного раствора или натурного минерализата со скоростью 0.5 колоночных объемов в час, отбирая фракции по 2–5 мл. В ходе экспериментов, особенно в начале, наблюдали вынос небольших объемов деканола из колонок. В этих случаях фильтрат собирали, деканол отделяли на делительной воронке от водного фильтрата и возвращали в соответствующую колонку.
Эксперименты по сорбционному разделению электролитов проводили с использованием подготовленных ионообменных колонок в две последовательные стадии. На первой стадии в режиме прямого фронтального анализа соответствующие растворы смесей кислоты и ее солей пропускали через колонки до достижения равновесия (уравнивания составов на входе и выходе из колонки). На следующей стадии в режиме обратного фронтального анализа через колонку пропускали деионированную воду до полного вытеснения (десорбции) кислоты. После такого цикла сорбции-десорбции система приходила в исходное состояние, что позволяло при необходимости повторить эксперимент по разделению компонентов. Фильтраты, выходящие из колонки на разных стадиях, собирали, определяли содержания в них кислоты и солей и по полученным данным строили выходные кривые сорбции или десорбции компонентов. При отсутствии свободного объема в слое ионита, заполненного деканолом, деионированную воду и растворы независимо от их плотности пропускали через колонки в направлении сверху вниз. Условия экспериментов указаны ниже в подписях под рисунками.
Характеристики использованных ионообменных колонок, а также загрузок анионита и органической жидкости приведены в табл. 1. Использовали исходные рабочие растворы, названия и составы которых по основным компонентам приведены в табл. 2.
Таблица 1.
Характеристики колонок, заполненных анионитом АВ-17 в NO3-форме в среде воды или деканола
| № колонки | Высота слоя, см | Сечение колонки, см2 | Объем слоя ионита, см3 | Объем деканола, см3 | Свободный объем, см3 |
|---|---|---|---|---|---|
| 1 | 28 | 6.25 | 175.0 | – | 75.0 |
| 2 | 20 | 5.96 | 119.2 | – | 40.8 |
| 3 | 20 | 5.96 | 119.2 | 45.0 | 4.5 |
| 4 | 20 | 0.98 | 19.6 | 7.5 | 1.0 |
Таблица 2.
Составы разделяемых растворов по некоторым макро- и мезокомпонентам
| № | Наименование | HNO3 | Ca(NO3)2 | Ca(H2PO4)2 | CaSO4 | NaNO3 | KNO3 | Al(NO3)3 |
|---|---|---|---|---|---|---|---|---|
| 1 | Модельный 2-компонентный раствор | 1.40 | – | – | – | 2.96 | – | – |
| 2 | Модельный раствор выщелачивания нефелина | 1.39 | – | – | – | 0.92 | 0.25 | 1.03 |
| 3 | Модельный раствор кислотного озоления костной ткани | 5.90 | 1.75 | – | – | – | 2.0 × 10–3 | 1.0 × 10–3 |
| 4 | Натурный раствор кислотного озоления костной ткани | 6.20 | 1.58 | 0.78 | 0.013 | 0.12 | 2.6 × 10–3 | 1.2 × 10–3 |
Для приготовления модельного раствора кислотного выщелачивания нефелина (№ 2) применяли данные по составам реальных растворов, представленных компанией “Акрон” (Великий Новгород). Модельный раствор кислотного озоления (минерализата) костной ткани (№ 3) готовили на основании данных, представленных лабораторией геохимии и аналитической химии благородных металлов ГЕОХИ РАН. Натурный раствор минерализата (№ 4) получали методом мокрого озоления кости в соответствии с процедурой, близкой к методике [24]. Образцы костной ткани (фрагменты бедренной кости человека) были предоставлены кафедрой судебной медицины Военно-медицинской Академии (Санкт-Петербург). В химический стакан из термостойкого стекла помещали 100 г костного материала в виде небольших осколков размерами меньше 1 см и заливали 250 мл конц. (14 М) HNO3. Стакан помещали в теплую воду и медленно обрабатывали кислотой на водяной бане, в которой поддерживали температуру не более 50°С (на воздухе, под тягой). В течение 8 ч добивались эффекта полного разрушения и растворения костей. В ходе растворения наблюдали неинтенсивное выделение диоксида азота. Разложенная проба после отгонки представляла собой желтоватый прозрачный раствор (200 мл) без нерастворившихся частиц на дне и стенках стакана.
В качестве объекта исследования также использовали пробы (по 0.5 г) почвы дерново-подзолистой тяжелосуглинистой (ГСО 8702-2005). Микроволновую минерализацию образцов проводили согласно МУК 4.1.1483-03. Для минерализации использовали смесь 70%-ной HNO3 (перегнанной) и деионированной бидистиллированной воды в соотношении 1 : 1.
Для анализа растворов применяли методы кислотно-основного и комплексонометрического титрования, атомной эмиссии и абсорбции, спектрометры AAS-1N (Германия) и ETAAS S-OLAAR MQZ (ThermoElectronCorp., USA); атомной эмиссии с индуктивно связанной плазмой, спектрометр IRISIntrepidIIXDL (ThermoElectronCorp., USA); рентгеноспектрального флуоресцентного анализа, спектрометр СПЕКТРОСКАН-V (НПО “Спектрон”, Санкт-Петербург). Погрешности аналитических методик составили: для титриметрии– не более 1–1.5%, для атомно-эмиссионного, атомно-абсорбционного и рентгенофлуоресцентного анализов – не более 10%.
Для многоэлементного анализа растворов деминерализации почв применяли метод МС-ИСП, масс-спектрометр ICP-MS 7700 х Agilent. Определяли содержание 25 элементов: Na, Mg, Al, K, Mn, Mo, Ca, Cr, Fe, Co, Ni, Cu, Zn, As, Pb, Li, Be, Sr, Ba, Se, Sb, Ag, Tl, Sc, V. Концентрацию элементов рассчитывали как среднее значение результатов пяти параллельных определений с использованием программного обеспечения ICP-MS“MassHunter”; относительное стандартное отклонение не превышало 5%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Размытие динамических выходных кривых. Выше указано, что для снижения продольной дисперсии компонентов в колонке в классическом AR-методе более плотный раствор всегда подается снизу, а вода – сверху. Экспериментальные точки выходных кривых, представленные на рис. 1б, получены именно таким образом с использованием колонки № 1 (табл. 1) и модельного раствора № 1 (табл. 2). Попытка изменения направления потока немедленно приводит к существенному размытию выходных кривых солевых компонентов. Это видно из рис. 5, где приведен пример разделения нитрата алюминия и азотной кислоты из модельного раствора кислотного выщелачивания нефелина. Пунктирные линии разделяют области, соответствующие выходу воды из свободного объема, а также стадии пропускания через колонку исходного смешанного раствора (“сорбция”) и воды (“десорбция”). Для сравнения на рис. 6 показаны данные, полученные для этого же раствора при тех же условиях проведения эксперимента за исключением того, что разделение проводили в трехфазной системе при использовании колонки, заполненной деканолом. Как видно, в этих условиях практически не наблюдается неконтролируемое размытие выходных кривых солевых компонентов, что важно для пробоподготовки. Пунктирная линия 3 разделяет участки кривых, соответствующие стадиям сорбции и десорбции. Между линиями 1 и 2 выбран участок, которому соответствуют фракции фильтрата стадии сорбции, характеризующиеся необходимыми для аналитической пробы свойствами: концентрации макрокомпонентов близки к их содержанию в исходном растворе (сMe/сMe,0 ≈ 1), при этом кислотность растворов снижена более чем на порядок ${{c}_{{{{{\text{H}}}^{ + }}}}} \ll {{c}_{{{{{\text{H}}}^{ + }},0}}}$.
Рис. 5.
Выходные кривые сорбции и десорбции компонентов в опыте с модельным раствором (№ 2) выщелачивания нефелинового концентрата с использованием колонки 2. Средняя скорость пропускания раствора и воды через колонку 4.4 мл/мин.
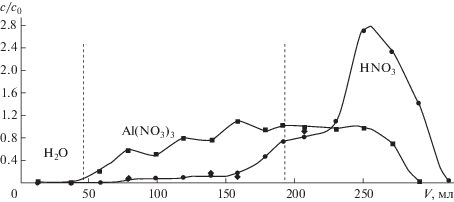
Рис. 6.
Выходные кривые сорбции и десорбции Al(NO3)3 (4), NaNO3 (5) и HNO3 (6) в опыте с модельным раствором выщелачивания нефелинового концентрата с использованием колонки 2. Средняя скорость пропускания раствора и воды через колонку 4.4 мл/мин. Участки между линиями: 0–1 – практически нейтральный раствор солей с увеличивающейся концентрацией; 1–2 – слабокислый раствор солей c сMe/сMe, 0 ≈ 1; 2–3 – растворы с постоянной (исходной) концентрацией солей и увеличивающейся до исходной концентрацией кислоты; 3 и далее – десорбция колонки деионированной водой.
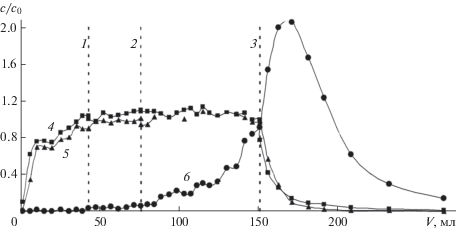
Описанная закономерность подтверждается и для других разделяемых систем. Рис. 7 иллюстрирует сорбцию компонентов из модельного раствора минерализата костной ткани. Вертикальными линиями 1 и 2, как и на рис. 6, ограничен наиболее удобный участок для работы с пробой, в которой солевые компоненты содержатся в средних концентрациях, практически равных соответствующим концентрациям в исходном анализируемом растворе. Объединенный раствор из указанных фракций можно без дополнительного разбавления анализировать на содержание микрокомпонентов с использованием ряда аналитических методов, включая атомную абсорбцию и эмиссию (в том числе с индуктивно связанной плазмой), а также МС-ИСП. Для повышения чувствительности комбинированного метода и расширения ассортимента определяемых микрокомпонентов такой раствор можно подвергнуть сорбционному концентрированию на селективных комплексообразующих сорбентах [25].
Рис. 7.
Выходные кривые сорбции Al(NO3)3 (3), KNO3 (4), Ca(NO3)2 (5) и HNO3 (6) из модельного раствора разложения костной ткани на колонке 3. Скорость пропускания раствора – 0.2 мл/мин. 0–линия 1 – практически нейтральный раствор солей с относительной концентрацией 0–1; 1–2 – слабокислый раствор солей с сMe/сMe, 0 ≈ 1; после линии 2 – область десорбции.
Таким образом, предложенный подход может найти применение для снижения кислотности сильнокислого раствора, содержащего катионы металлов, полученного разложением твердого образца в ходе пробоподготовки, перед прямым инструментальным анализом или дальнейшим сорбционном концентрированием и определением микроэлементов, например металлов. Для оценки возможности практического применения предложенного метода к сложным реальным растворам, прежде всего, следует оценить воспроизводимость результатов, для чего важно показать возможность осуществления стабильных повторяющихся хроматографических процессов.
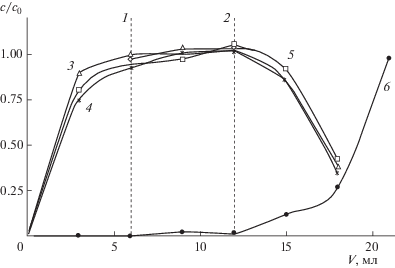
Стабильность процесса и воспроизводимость результатов. Провели три последовательных цикла сорбции-десорбции на одной и той же колонке с использованием натурного раствора костного минерализата. Соответствующие выходные кривые для стадии сорбции и кривые, полученные в ходе одного рабочего цикла для стадии десорбции, представлены на рис. 8, 9. Изменение концентрации катионов в исследуемом растворе наблюдали по содержанию макрокомпонентов минерализата (кальция и кислоты) в пробах фильтрата. Полученные данные свидетельствуют о высокой воспроизводимости результатов определения основных макрокомпонентов.
Рис. 8.
Изменение концентрации нитрата кальция в ходе повторяющихся циклических процессов сорбции–десорбции на колонке 1 с использованием натурного раствора минерализата костной ткани. Скорость пропускания раствора и воды 0.5 мл/мин.
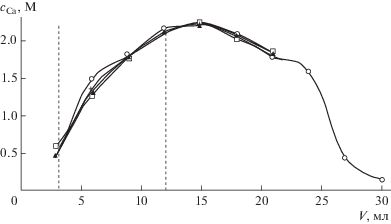
Рис. 9.
Изменение концентрации азотной кислоты в ходе повторяющихся циклических процессов сорбции–десорбции на колонке 1 с использованием натурного раствора минерализата костной ткани. Скорость пропускания раствора и воды 0.5 мл/мин.
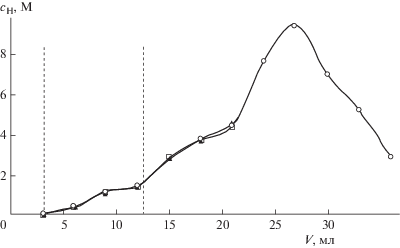
Отличительной особенностью процесса в каждом повторяющемся цикле является то, что на стадии сорбции первые несколько фракций прозрачного солевого раствора, выходящего из колонки, при хранении в течение суток и больше мутнеют, и в них наблюдается образование осадков. Данные, представленные на рис. 8, 9, а именно найденные после фильтрации осадков концентрации компонентов, отличаются от приведенных на рис. 7 для модельного раствора. При разделении солей и кислоты в реальных растворах костного минерализата концентрация нитрата кальция не достигает равновесных значений (как это ожидалось) в первых фракциях выходящего из колонки раствора. Кроме того, в этих фракциях, соответствующих области, ограниченной вертикальными линиями на рис. 8, 9, концентрация кислоты существенно больше, чем в аналогичном эксперименте для модельного раствора. Это связано с большим содержанием фосфатов в растворе костного минерализата. Химический анализ осадков показывает содержание в них гидрофосфатов кальция с примесью гипса. По данным потенциометрического исследования в этих фракциях практически нет свободной азотной кислоты, а щелочь при кислотно-основном титровании расходуется на взаимодействие с более слабой фосфорной кислотой и ее кислыми солями. В табл. 3 сравниваются усредненные данные по содержанию компонентов в исходном растворе костного минерализата и в аликвоте, взятой из объединенных фракций раствора, соответствующих области, ограниченной вертикальными линиями на рис. 8, 9. В табл. 4 сравниваются усредненные данные по содержанию мезо- и микрокомпонентов в исходном растворе костного минерализата и в растворе после отделения азотной кислоты при пропускании через колонку, заполненную деканолом. Для всех компонентов, кроме кремния и титана, наблюдается совпадение с разницей менее 20%. Полученные результаты свидетельствуют о стабильности процесса разделения компонентов и воспроизводимости результатов даже в случае пробоподготовки сложных многокомпонентных растворов, каким является раствор кислотного разложения нативной костной ткани.
Таблица 3.
Сравнение данных по содержанию макрокомпонентов (мг/л) во фракции натурного раствора костного минерализата до (с0,H = 6.2 М) и после обработки – пробоподготовки с отделением азотной кислоты (сH = 0.07 М)
| Раствор | Ca | P | S | Na | Mg | K |
|---|---|---|---|---|---|---|
| До обработки | 94 800 | 48 200 | 408 | 2730 | 1400 | 103 |
| После обработки | 36 800 | 20 750 | 249 | 3210 | 1180 | 115 |
| Разница, % | –61.2 | –57.0 | –39.0 | +17.6 | –15.7 | +11.7 |
Таблица 4.
Сравнение данных по содержанию (мг/л) мезо- и микрокомпонентов в исходном растворе костного минерализата и в растворе после отделения азотной кислоты
| Раствор | Sr | Zn | Al | Si | B | Zr | Ti | Cu | Mo |
|---|---|---|---|---|---|---|---|---|---|
| Исходный | 42 | 51 | 42 | 18 | 3.3 | 0.5 | 0.7 | 0.42 | 0.2 |
| После обработки | 36 | 42 | 33 | 24 | 3.5 | 0.6 | 0.5 | 0.50 | 0.2 |
| Разница, % | –14.3 | –17.6 | –21.4 | 33.3 | 6.1 | –20 | –28.5 | 19.0 | 0.0 |
Демонстрация возможности использования нового метода пробободготовки и некоторые метрологические характеристики. На рис. 10 представлены выходные кривые, характеризующие удерживание компонентов минерализата почвы на колонке со слоем анионита, заполненным деканолом. Содержание металлов в растворе после колонки приведено в относительных единицах на фоне азотной кислоты, содержание которой дано в абсолютных единицах. Фракция, соответствующая выходящему объему 4–6 мл, характеризуется необходимыми для аналитической пробы свойствами: концентрация большинства растворов снижена более чем на порядок (3%). Выходные кривые некоторых элементов на рисунке не приведены, чтобы избежать их наложения друг на друга. Статистическая обработка результатов (табл. 5) показывает, что удовлетворительные результаты получаются для большинства элементов, кроме анионобразующих (As, Sb, Se, Mo) и некоторых тяжелых металлов (Ag, Tl, Pb).
Рис. 10.
Выходные кривые сорбции компонентов минерализата почвы: кислоты (1), Na (2), Zn (3), Co (4), Ni (5), Cu (6), Sr (7), Ca (8), K (9), As (10), Mo (11), Pb (12). Выходные кривые Cr, Fe, Al, Mn, Mg находятся между кривыми 3, 4; Be, V – между кривыми 5, 6; Ba, Li, Sc – между кривыми 7, 8.
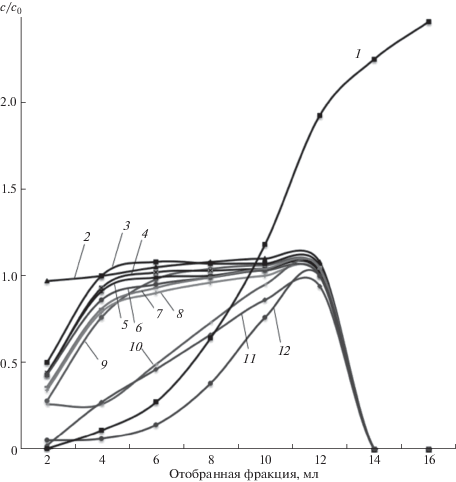
Таблица 5.
Результаты статистического анализа третьей фракции (V = 2 мл) отбора, удовлетворяющей условиям проведения спектрального анализа (ск-ты = 3%, число серий n = 5)
| Элемент | Среднее значение с/с0 | Стандартное отклонение | Стандартная погрешность среднего | ±Δ(0.95) |
|---|---|---|---|---|
| Li | 0.990 | 0.060 | 0.035 | 0.111 |
| Be | 0.999 | 0.060 | 0.035 | 0.110 |
| Na | 1.047 | 0.075 | 0.043 | 0.138 |
| Mg | 1.021 | 0.079 | 0.045 | 0.145 |
| Al | 1.044 | 0.081 | 0.047 | 0.148 |
| K | 0.979 | 0.081 | 0.047 | 0.149 |
| Ca | 0.904 | 0.077 | 0.044 | 0.141 |
| Sc | 0.847 | 0.032 | 0.019 | 0.060 |
| V | 0.977 | 0.063 | 0.036 | 0.115 |
| Cr | 1.068 | 0.045 | 0.026 | 0.083 |
| Mn | 1.034 | 0.046 | 0.027 | 0.085 |
| Fe | 1.041 | 0.072 | 0.042 | 0.132 |
| Co | 1.018 | 0.053 | 0.031 | 0.097 |
| Ni | 0.995 | 0.092 | 0.053 | 0.169 |
| Cu | 0.953 | 0.009 | 0.005 | 0.017 |
| Zn | 1.080 | 0.062 | 0.036 | 0.113 |
| As | 0.488 | 0.073 | 0.042 | 0.135 |
| Se | 0.781 | 0.058 | 0.034 | 0.107 |
| Sr | 0.934 | 0.060 | 0.035 | 0.111 |
| Mo | 0.465 | 0.045 | 0.026 | 0.082 |
| Ag | 0.316 | 0.137 | 0.079 | 0.251 |
| Sb | 1.755 | 0.427 | 0.246 | 0.783 |
| Tl | 0.645 | 0.092 | 0.053 | 0.168 |
| Pb | 0.140 | 0.036 | 0.021 | 0.065 |
Полученные результаты свидетельствуют о том, что с использованием небольших анионообменных колонок методом фронтальной хроматографии компонентов жидкого концентрата (после СВЧ- или автоклавного разложения) удается отделить раствор смеси солей (нитратов) от конц. HNO3 практически без изменения концентрации большинства солей. Это позволяет уменьшить степень разбавления проб перед инструментальным (например, МС-ИСП) анализом металлов более чем на порядок. Предложенный безреагентный метод дает возможность работать с небольшими объемами образцов при значительно меньшей продолжительности анализа за счет использования миниатюрных колонок или шприцов со слоями анионита, заполненными органической фазой.
* * *
Описаны основные закономерности метода “удерживания кислоты” для хроматографического разделения смесей в концентрированных кислых растворах и разработанных авторами новых его вариантов, удобных для использования в технологии и химическом анализе. Разделение компонентов растворов кислот и их солей по методу удерживания кислоты можно проводить в сорбционных системах с двумя жидкими фазами: постоянно находящейся в колонке органической жидкостью, заполняющей порозное пространство слоя ионита, и пропускаемыми через колонку водой или водными растворами, образующими вторую жидкую фазу, не смешивающуюся с органической жидкостью. Апробация такого подхода к разделению компонентов ряда растворов, содержащих азотную кислоту и нитраты некоторых металлов, на анионите АВ-17 × 8 в NO3-форме показывает, что никаких качественных изменений в закономерностях разделения по сравнению с изученными ранее аналогичными процессами с использованием колонок с ионитом без органической жидкости не наблюдается. В то же время использование сорбционных систем, в которых практически отсутствуют свободные объемы, дает некоторые методические преимущества, важные для аналитической практики. Возможно использование простых методик с пропусканием жидкостей через колонку сверху вниз при исключении размывающих эффектов за счет продольной дисперсии, можно работать с малыми объемами проб (существенно меньшими, чем свободные объемы колонок), существенно сокращается продолжительность экспериментов (общее число колоночных объемов пропускаемых жидкостей). Изученные примеры разделения компонентов смешанных растворов показывают, что предложенный подход обеспечивает нетрудоемкую методику снижения кислотности растворов, полученных при обработке трудно разлагаемых проб неорганической и биологической природы, для последующего анализа. Статистическая обработка результатов экспериментов по сорбции и десорбции компонентов натурных растворов кислотного разложения костной ткани с использованием слоя анионита, заполненного деканолом, показывает их хорошую воспроизводимость, что свидетельствует о перспективности предложенного подхода.
Авторы выражают благодарность старшему научному сотруднику лаборатории геохимии и аналитической химии благородных металлов ГЕОХИ РАН к. х. н. О.А. Тютюнник за помощь в проведении анализов методами атомной абсорбции с электротермическим возбуждением и атомной эмиссии с индуктивно связанной плазмой.
Список литературы
Подгорная Е.Б., Крачак А.Н., Хамизов Р.Х. Использование сорбционного способа разделения растворов кислот и их солей в системах с двумя жидкими фазами для решения проблем пробоподготовки в анализе // Сорбционные и хроматографические процессы. 2011. Т. 11. № 1. С. 99.
Подгорная Е.Б., Бурова О.И., Радилов А.С., Хамизов Р.Х. Использование сорбционного способа удерживания кислоты в системах с двумя жидкими фазами для решения проблем пробоподготовки в элементном анализе методом ИСП-МС // Сорбционные и хроматографические процессы. 2013. Т. 13. № 5. С. 618.
Khamizov R.Kh., Krachak A.N., Khamizov S.Kh. Separation of ionic mixtures in sorption columns with two liquid phases // Сорбционные и хроматографические процессы. 2014. Т. 14. № 1. С. 14.
Хамизов Р.Х., Крачак А.Н., Подгорная Е.Б., Хамизов С.Х. Cпособ проведения массообменных сорбционных процессов, аппарат для его осуществления, промышленная установка для разделения компонентов водных растворов неорганических веществ и аппарат для отделения органических жидких веществ от водных растворов. Патент № 2434679 РФ // Б.и. 2011. № 33.
Khamizov R.Kh., Krachak A.N., Podgornaya E.B., Khamizov S.Kh. Method of mass-transfer processes. US Patent 8940175. Publ. 27.01.2015.
Khamizov R.Kh., Krachak A.N., Gruzdeva A.N., Kha-mizov S.Kh., Vlasovskikh N.S. / Ion Exchange and Solvent Extraction: A series of Advances. V. 22 / Ed. SenGupta A. NewYork–London: CRS Press, 2016. P. 148.
Hatch M.J., Dillon J.A. Acid retardation. simple physical method for separation of strong acids from their salts // Ind. Eng. Chem. Process Des. Dev. 1963. V. 2. № 4. P. 253.
Ferapontov N.B., Parbuzina L.R., Gorshkov V.I., Strusovskaya N.L., Gagarin A.N. Interaction of cross-linked polyelectrolytes with solutions of low-molecular-weight electrolytes // React. Funct. Polym. 2000. V. 45. P. 145.
Tsyurupa M., Blinnikova Z., Davankov V. / Green Chromatographic Techniques: Separation and Purification of Organic and Inorganic Analytes / Eds. Mohammad A., Inamuddin D. Springer, 2014. P. 19.
Seregina I.F., Perevoznik O.A., Bolshov M.A. Acid retardation method in analysis of strongly acidic solutions by inductively coupled plasma mass-spectrometry // Talanta. 2016. V. 159. P. 387.
Сидельников Г.Б., Тихонов Н.А., Хамизов Р.Х., Крачак А.Н. Моделирование и исследование сорбционного процесса разделения кислот и солей в растворе // Математическое моделирование. 2013. Т. 25. № 4. С. 3. (Sidelnikov G.B., Tikhonov N.A., Khamizov R.K., Krachak A.N. Modeling and study of sorption and separation of acids in solution // Math. Models Comput. Simulations. 2013. V. 5. № 6. P. 501.)
Крачак А.Н., Хамизов Р.Х., Познухова В.А., Подгорная Е.Б., Дурнайкин В.А. Основные закономерности разделения электролитов в методе “удерживания кислоты” (acid retardation). 1. Влияние природы катиона на сорбцию кислот и их солей из бинарных растворов // Сорбционные и хроматографические процессы. 2011. Т. 11. № 1. С. 77.
Khamizov R.Kh., Krachak A.N., Gruzdeva A.N., Vlasovskikh N.S., Tikhonov N.A. Separation of concentrated acid and salt solutions in nanoporous media as the basis for a new technology of processing of phosphorus-containing raw materials // Geochem. Int. 2016. V. 54. № 13. P. 1221.
Глотова Е.А., Тихонов Н.А., Хамизов Р.Х., Крачак А.Н. Математическое моделирование сорбционного процесса “удерживания кислоты” из раствора // Вестн. Моск. ун-та. Серия 3: Физика. Астрономия. 2013. № 1.С. 64. (Glotova E.A., Tikhonov N.A., Kha-mizov R.K., Krachak A.N. Mathematical modeling of a sorption process for the retention of acid from a solution // Moscow Univ. Phys. Bull. 2013. V. 68. № 1. P. 65.)
Тихонов Н.А. Новый подход к расчету коэффициентов активности в широком диапазоне концентраций электролитов // Доклады РАН. 2010. Т. 434. № 2. С. 175.
Tikhonov N.A., Sidelnikov G.B. Quantitative analysis of physical factors that determine the behavior of activity coefficients of electrolytes // J. Math. Chem. 2013. V. 51. № 10. P. 2746.
Лященко А.К., Каратаева И.М. Активность воды и диэлектрическая константа водных растворов электролитов // Журн. физ. химии. 2010. Т. 84. № 2. С. 376.
Справочник химика в 6-ти томах / Под ред. Никольского Б.П. М.-Л.: Химия, 1963. Т. 1. С. 948. 1964. Т. 3. С. 78.
Tikhonov N.A., Khamizov R.Kh., Kirshin V.V. Description of exchange dynamics in the presence of colloid particles on the surface of sorbent granules // Журн. физ. химии. 2000. Т. 74. № 2. С. 309. (Tikhonov N.A., Khamizov R.Kh, Kirshin V.V. Description of exchange dynamics in the presence of colloid particles on the surface of sorbent granules // Russ. J. Phys. Chem. 2000. V. 74. № 2. P. 246.)
Muraviev D., Khamizov R., Tikhonov N.A. Peculiarities of the dynamics of ion exchange in supersaturated solutions and colloid systems // Langmuir. 2003. V. 19. P. 10852.
Brown C.J. Fluid treatment method and apparatus. US Patent 4673507. Publ. 17.06.1987.
Dejak M. Keeping water soft // Oilfield Technol. 2013. V. 6. № 7. P. 35.
Веницианов В.В., Рубинштейн Р.Н. Динамика сорбции из жидких сред. М.: Наука, 1983. 240 с.
Назаров Г.Н., Макаренко Т.Ф. Методы спектрального анализа в судебной медицине. М.: МНПП ЭСИ, 1994. 360 с.
Золотов Ю.А., Цизин Г.И., Дмитриенко С.Г., Моросанова Е.И. Сорбционное концентрирование микрокомпонентов из растворов. Применение в неорганическом анализе. М.: Наука, 2007. 320 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


