Журнал аналитической химии, 2019, T. 74, № 3, стр. 211-217
Дериватизация ионов в условиях лазерной десорбции/ионизации, активируемой поверхностью
А. А. Гречников 1, *, А. С. Бородков 1, С. М. Никифоров 2
1 Институт геохимии и аналитической химии им. В.И. Вернадского Российской академии наук
119991 Москва, ул. Косыгина, 19, Россия
2 Институт общей физики им. А.М. Прохорова Российской академии наук
119991 Москва, ул. Вавилова, 38, Россия
* E-mail: grechnikov@geokhi.ru
Поступила в редакцию 19.03.2017
После доработки 20.09.2018
Принята к публикации 20.09.2018
Аннотация
Предложен способ химической модификации (дериватизации) ионов, полученных методом лазерной десорбции/ионизации, активируемой поверхностью (SALDI). Дериватизация основана на взаимодействии десорбированных ионов с молекулами спиртов. Способ отличается простотой, не влияет на продолжительность анализа и позволяет улучшить аналитические характеристики метода SALDI при проведении анализа в условиях интерференции пиков и при сильной фрагментации ионов аналита. Эффективность способа продемонстрирована при определении кофеина, пирролидина и дифенгидрамина в условиях нанесения пробы при атмосферном давлении.
Метод лазерной десорбции/ионизации, активируемой поверхностью, (метод SALDI) основан на использовании наночастиц или специально приготовленных подложек, хорошо поглощающих лазерное излучение, в качестве средства для ионизации органических соединений [1]. В рамках метода анализируемую пробу наносят на поверхность подложки. Затем на подложку фокусируют излучение импульсного лазера, воздействие которого инициирует процессы ионизации и десорбции ионов в газовую фазу. Образующиеся ионы детектируются в масс-анализаторе. В качестве подложек широкое применение находят нанокристаллические кремниевые материалы, которые могут быть получены различными методами, в частности, химическим и электрохимическим травлением [2–4], плазмохимическим осаждением из газовой фазы [5], электронно-лучевым испарением [6], радиочастотным распылением [2], лазерной обработкой [7, 8]. Ионизация в SALDI основана на протонировании молекул аналита на поверхности подложки, поэтому этот метод успешно применяют для определения основных соединений. В частности, на кремниевых подложках эффективно ионизуются только соединения с величинами основности в газовой фазе, превышающими 820 кДж/моль [9].
Важная особенность SALDI, которая отличает этот метод от таких традиционных методов, как электронная или химическая ионизация, заключается в том, что в условиях лазерной десорбции/ионизации молекулы аналита сорбируются на активной поверхности подложки и в случае соединений, имеющих значительную энергию связи с поверхностью, могут находиться на ней длительное время. Это позволяет разделить процессы сорбции и лазерной десорбции/ионизации в пространстве и наносить аналиты на подложку из раствора или из газовой фазы при атмосферном давлении. Вместе с тем, активированная лазерным излучением поверхность нанокристаллического кремния является эффективным сорбентом, поэтому масс-спектры, зарегистрированные в условиях нанесения пробы на воздухе, характеризуются высокими значениями фоновых сигналов, которые создаются ионами присутствующих в атмосфере воздуха органических соединений. При использовании масс-анализатора с относительно низкой разрешающей способностью такая ситуация часто приводит к проблеме однозначной идентификации определяемых соединений вследствие интерференции пиков целевого и мешающих компонентов пробы. В ряде случаев идентификацию затрудняет также сильная фрагментация ионов аналитов и соответственно низкая интенсивность ионов протонированных молекул, характеризующих массу соединения. Для увеличения термостабильности в масс-спектрометрии достаточно давно и широко используют химическую модификацию (дериватизацию) определяемого соединения на стадии пробоподготовки [10], однако это заметно усложняет анализ и увеличивает его продолжительность.
В данной работе предложен простой способ, позволяющий увеличить надежность и достоверность идентификации химических соединений при их определении методом SALDI. Способ основан на взаимодействии десорбированных лазерным излучением ионов с молекулами спиртов, введенных в ионный источник масс-анализатора.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование. Схема масс-спектрометрической установки детально описана в работе [11]. Установка включает в себя времяпролeтный масс-спектрометр, систему транспортировки подложек из области атмосферного давления в вакуумную камеру масс-спектрометра, оптическую систему и систему регистрации и обработки масс-спектрометрических данных. Времяпролетный масс-спектрометр собран по линейной бессеточной схеме с длиной свободного пролета 0.6 м. Для ускорения и фокусировки ионов использовали систему линз и лайнер, что обеспечивало близкий к 100% коэффициент пропускания масс-спектрометра. В качестве детектора ионов применяли вторично-электронный умножитель (ETP Pty Ltd., Австралия, модель 14 882) с временным разрешением 2 нс. Установка оборудована системой регулируемой подачи паров жидкостей, включающей прогреваемый капилляр, регулятор потока газа и источник паров, расположенный вне прибора.
Система транспортировки SALDI подложек из области атмосферного давления в масс-анализатор выполнена в виде вакуумно плотного металлического шара с симметрично установленными в его углублениях подложками. Одна из подложек находится вне масс-спектрометра, и на нее наносят пробу. В это же время противоположная ей подложка находится в ионном источнике, облучается лазерным излучением, а десорбированные ионы детектируются. После завершения анализа шар поворачивается на 180°, и процесс повторяется.
Для лазерной десорбции/ионизации использовали излучение третьей гармоники (длина волны 355 нм) Nd:YAG лазера с диодной накачкой (РЛ-02.355 производства ЭЛС-94, Москва), работающего с частотой повторения 300 Гц при длительности импульса 0.35 нс и максимальной энергией в импульсе 35 мкДж. Энергию лазерного излучения на поверхности регулировали в широком диапазоне с помощью аттенюатора. Для увеличения площади облучаемой поверхности использовали двузеркальное электромеханическое устройство сканирования лазерного луча (УСЛ-03, ИМКЭС СО РАН, Томск), разворачивающее луч в кадр размером 2 × 1 мм2.
Подложки. Для воспроизводимого получения подложек для лазерной десорбции/ионизации использовали способ, основанный на обработке лазерным излучением пластин монокристаллического кремния в вакуумной камере масс-спектрометра [7]. Способ включает две последовательных стадии. На первой стадии подложка обрабатывается излучением с интенсивностью, превышающей порог плавления кремния, в течение 20 с (примерно 20 лазерных импульсов в одну и ту же область поверхности). Затем обработанный материал подвергают повторному воздействию излучением с интенсивностью, меньшей порога плавления кремния, в присутствии паров воды (при давлении 10–6 мм. рт. ст.) в течение 300 с. В результате формируется сильно разупорядоченный нанокристаллический слой с высокой поверхностной плотностью протонодонорных групп.
Реактивы. Дифенгидрамин выделяли из лекарственного препарата (таблетки “Димедрол” производства Дальхимфарм) по следующей методике. Таблетки измельчали и растворяли в дистиллированной воде. Раствор подщелачивали NaOH до сильнощелочной реакции среды, после чего проводили трехкратную экстракцию эфиром (диэтилкетоном). После расслоения из растворов отбирали верхний эфирный слой с экстрагированным аналитом. Растворитель удаляли с помощью роторного испарителя. Оставшийся после упаривания осадок растворяли в смеси метанол–вода (1 : 1).
Остальные соединения получали коммерчески и использовали без дальнейшей очистки. Метанол и этанол х. ч. вводили в ионный источник масс-спектрометра с использованием систем регулируемой подачи паров жидкостей. Определяемые соединения наносили на кремниевую подложку при атмосферном давлении путем электрораспыления растворов аналита [11] или создавая поток воздуха, содержащего пары аналита известной концентрации.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Результаты предварительных исследований показали, что ввод в ионный источник паров растворителей или других органических соединений в процессе лазерной десорбции/ионизации приводит к изменению масс-спектров аналитов, обусловленному взаимодействием десорбированных ионов с молекулами введенного в прибор соединения. В результате реакции в масс-анализатор попадают ионы, характеризующие аналит, но имеющие другую массу. В качестве примера на рис. 1 приведен масс-спектр кофеина, зарегистрированный при вводе в прибор паров метанола. На кремниевых материалах в условиях SALDI кофеин ионизуется с образованием протонированных молекул с отношением массы к заряду m/z 195 [12]. Из рис. 1 видно, что при подаче в ионный источник CH3OH в масс-спектре появляется новый пик относительно высокой интенсивности с m/z 209, который может быть идентифицирован как соответствующий ионам соединения [М + СН3]. Подтверждением этому может служить тот факт, что замена CH3OH на дейтерированный метанол CD3OD приводит к смещению пика с m/z 209 до m/z 212 с образованием ионов состава [М + СD3]+. Взаимодействие протонированных молекул аналита (MH)+ с молекулами метанола можно описать реакцией метилирования:
Рис. 1.
Масс-спектр кофеина, зарегистрированный после подачи метанола в ионный источник лазерной десорбции/ионизации. Давление паров метанола 10–5 мм. рт. ст.
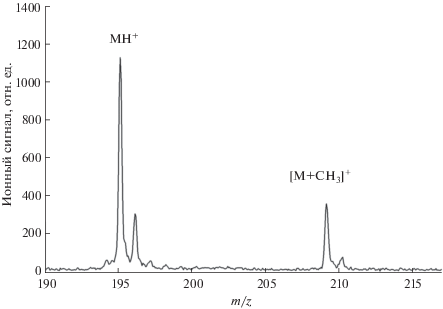
Для химической модификации ионов могут быть использованы и другие реакции и реагенты. Например, метилирование ряда соединений происходит также при вводе в прибор паров ацетонитрила. В данной статье рассмотрено применение для дериватизации ионов аналита спиртов.
С целью выбора оптимальных условий анализа на предварительном этапе изучали влияние давления паров спиртов. Реакция метилирования протекает, по-видимому, в начальный момент десорбции в облаке десорбированных частиц, которое имеет высокую плотность [12]. Очевидно, что увеличение потока реагента в ионный источник увеличивает вероятность его взаимодействия с десобированными ионами вследствие увеличения числа столкновений в единицу времени и, следовательно, увеличивает выход реакции. С другой стороны, рост давления ухудшает качество масс-спектров. Для использованной в работе экспериментальной установки лучшие результаты получены при давлении спиртов в ионном источнике порядка 10–5 мм. рт. ст. В ходе анализа поток реагента поддерживали постоянным.
В результате взаимодействия десорбированных лазерным излучением с подложки ионов с введенными в прибор молекулами реагента образуются ионы, имеющие другое значение отношения m/z по сравнению с протонированными молекулами аналита и обладающие иными химическими свойствами. Этот эффект может быть использован для улучшения аналитических характеристик метода SALDI при проведении анализа в условиях интерференции характеристических пиков и при сильной фрагментации ионов аналита.
Рис. 2 иллюстрирует детектирование паров пиролидина в лабораторном воздухе с использованием реакции метилирования. Кремниевую подложку, полученную лазерной обработкой, выводили из вакуумной камеры при помощи шарового устройства и помещали в лабораторный воздух на 5 с. После этого подложку снова перемещали в вакуумную камеру масс-спектрометра и проводили анализ методом SALDI. Зарегистрированный в контрольном опыте масс-спектр приведен на рис. 2а. Видно, что в масс-спектре присутствует ряд пиков, которые могут мешать определению и идентификации аналитов. В частности, в масс-спектре регистрируется пик со значением m/z 72, таким же, как и для протонированных молекул пирролидина, который интерферирует с пиком аналита при использовании масс-анализатора с недостаточно высоким разрешением. Интенсивность пика в контрольном опыте зависит от состояния атмосферы и может меняться во времени, искажая результаты анализа. Из данных рис. 2а также следует, что в области масс-спектра, соответствующей пикам метилированного пирролидина [M + CH3]+ с m/z 86, отсутствуют пики мешающих компонентов. Как показали дополнительные исследования, большинство пиков на рис. 2а принадлежит фрагментным ионам более тяжелых соединений, в частности, компонентов вакуумного масла. Подача в ионный источник метанола и этанола не приводит к изменению масс-спектра на рис. 2а в области m/z ионов метилированного и этилированного пирролидина, что позволяет использовать пары спиртов для дериватизации ионов этого соединения.
Рис. 2.
(а) – Масс-спектр атмосферного воздуха, зарегистрированный в контрольном опыте. (б) – Масс-спектр атмосферного воздуха, содержащего пары пироллидина, зарегистрированный при подаче в ионный источник паров метанола и этанола.
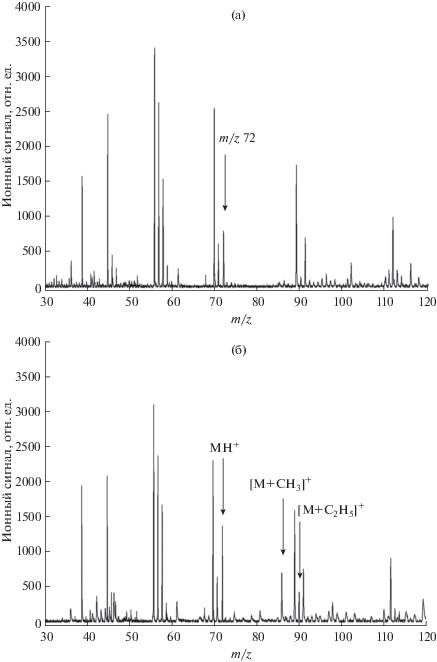
После проведения контрольного опыта подложку вновь выводили из вакуумной камеры и воздействовали в течение 5 с потоком лабораторного воздуха, содержащего пары пирролидина. Затем подложку перемещали в вакуумную камеру и проводили анализ методом SALDI. Для лазерной десорбции/ионизации использовали те же параметры, что и в контрольном опыте, но дополнительно вводили в ионный источник метанол и этанол. Давление, создаваемое парами спиртов, составляло 10–5 мм. рт. ст., метанол и этанол брали в равных концентрациях. Полученный масс-спектр приведен на рис. 2б. Видно, что интенсивность пика с m/z 72 возрастает вследствие вклада в ионный сигнал протонированных молекул пирролидина. Кроме того, в масс-спектре регистрируются дополнительно два новых пика, соответствующих метилированным [М + СН3]+ и этилированным [М + С2Н5]+ ионам пирролидина. Как отмечено выше, пик [М + СН3]+ с m/z 86 находятся в области масс-спектра, свободной от интерференции. Исследования показали, что при постоянном давлении реагента в вакуумной камере масс-спектрометра выход модифицированных ионов аналита линейно зависит от концентрации введенного в прибор соединения, что позволяет проводить количественный анализ, используя пики этих ионов. Следует также отметить, что величина основности спиртов в газовой фазе существенно ниже 820 кДж/моль [13], поэтому, даже взятые в избытке, они не дают вклада в фоновый ионный сигнал.
Из данных рис. 2б следует, что для дериватизации ионов может быть использован не только метанол, но и этанол. Варьируя спирт, а также используя изотопно обогащенные реагенты, можно выбирать для детектирования аналита участок в масс-спектре, свободный от интерференционных наложений. Однако, как показали эксперименты, вероятность образования ионов [M + СnH2n+ 1]+ при взаимодействии протонированных молекул аналита с молекулами спиртов СnH2n+ 1OH быстро уменьшается с ростом n, что ограничивает ряд спиртов, подходящих для дериватизации. На практике целесообразно использовать спирты с n ≤ 4.
Другим фактором, затрудняющим идентификацию определяемых соединений, является сильная фрагментация молекулярных ионов. Присутствие в масс-спектре пика, характеризующего молекулярную массу химического соединения, важно для правильной идентификации соединения, поскольку позволяет установить его брутто-формулу. В целом сильная фрагментация нетипична для SALDI, однако ряд соединений дают масс-спектры, в которых практически отсутствует пик протонированных молекул. Примером такого соединения служит дифенгидрамин – действующее вещество лекарственного препарата “Димедрол”. Масс-спектр дифенгидрамина приведен на вставке к рис. 3а. Видно, что протонированный дифенгидрамин является нестабильным ионом со степенью фрагментации, превышающей 95%. Использование реакции метилирования позволяет увеличить стабильность ионов, характеризующих молекулярную массу соединения. На рис. 3а, б представлены масс-спектры дифенгидрамина в области протонированных молекул, зарегистрированные до и после подачи в ионный источник метанола. Давление паров метанола составляло 10–5 мм. рт. ст. Спектры сняты при одинаковой плотности энергии лазерного излучения и при равных количествах нанесенного на подложку аналита. Масс-спектр на рис. 3а содержит единственный пик с m/z 256, соответствующий протонированным молекулам дифенгидрамина. Интенсивность пика мала и близка к фоновому сигналу, а при меньших концентрациях аналита в пробе пик не регистрируется. Ввод в ионный источник паров метанола приводит к появлению в масс-спектре нового пика с m/z 270, который соответствует ионам метилированного дифенгидрамина и однозначно характеризует молекулярную массу аналита. Интенсивность этого пика превышает фоновый сигнал в 20 раз. Таким образом, применение предложенного способа дериватизации ионов позволяет снизить на порядок величины концентрацию дифенгидрамина, при которой еще возможна его надежная идентификация.
Рис. 3.
Масс-спектр дифенгидрамина в области протонированных молекул, зарегистрированный до подачи в ионный источник паров метанола (а); после подачи паров метанола (б). На вставке приведен полный масс-спектр дифенгидрамина.
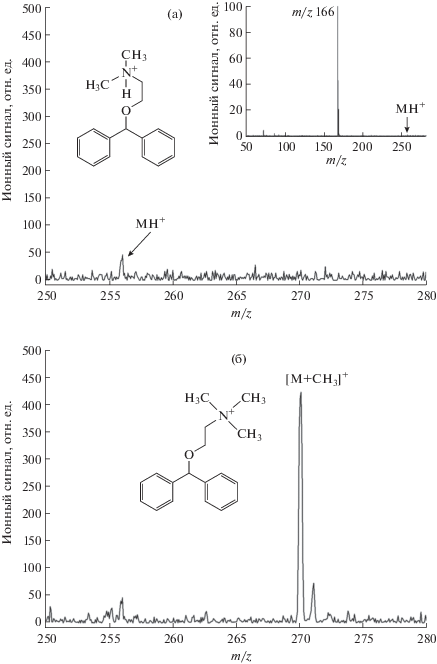
Для того чтобы лучше понять причины сильной фрагментации протонированного дифенгидрамина, выполнили квантово-химическое моделирование процесса образования фрагментного иона. В расчетах использовали программный пакет Firefly [14]. Квантово-химические расчеты проводили методом Хартри−Фока с использованием базисного набора 6-311+G**. Согласно полученным результатам, структура дифенгидрамина после присоединения протона стабилизируется путем частичного переноса протона к электроотрицательному атому кислорода (структура иона приведена на рис. 3а). Расстояние между атомами кислорода и водорода в ионе составляет 0.22 нм. Перенос заряда приводит к ослаблению связи С–О и значительному понижению энергии ее диссоциации что, в свою очередь, приводит к интенсивной фрагментации с образованием иона с m/z 166. Причиной фрагментации в условиях SALDI является быстрый нагрев поверхности подложки лазерным излучением, который обеспечивает передачу тепловой энергии десорбированным ионам [12, 15].
Ион метилированного дифенгидрамина, образующийся в результате взаимодействия с метанолом, является устойчивым соединением. Очевидно, что при замещении атома водорода в протонированной аминогруппе на метильную группу образуется ион, в котором внутримолекулярный перенос водорода уже невозможен (структура иона приведена на рис. 3б). В связи с этим метилирование ионов дифенгидрамина и аналогичных ему соединений обеспечивает их устойчивость.
* * *
Добавление в ионный источник SALDI паров спиртов при давлении 10–5 мм. рт. ст. приводит к химической модификации ионов определяемых соединений. В результате в масс-анализатор попадают ионы, характеризующие аналит, но с иной молекулярной массой по сравнению с протонированными молекулами аналита и другими химическими свойствами. Этот эффект использован для улучшения аналитических характеристик метода SALDI в условиях интерференции характеристических пиков и при сильной фрагментации ионов аналита. На примере определения пирролидина и дифенгидрамина показано, что анализ в присутствии паров метанола позволяет избежать наложения пиков аналита и мешающих компонентов, а также уменьшить степень фрагментации неустойчивых ионов.
Список литературы
Murray K.K., Boyd R.K., Eberlin M.N., Langley G.J., Li L., Naito Y. Definitions of terms relating to mass spectrometry (IUPAC Recommendations 2013) // Pure Appl. Chem. 2013. V. 85. № 7. P. 1515.
Alimpiev S.S., Grechnikov A.A., Sunner J., Karavanskii V.A., Zhabin S.N., Simanovsky Ya.O., Nikiforov S.M. On the role of defects and surface chemistry for surface-assisted laser desorption ionization from silicon // J. Chem. Phys. 2008. V. 128. № 1. P. 014711.
Piret G., Drobecq H., Coffinier Y., Melnyk O., Boukherroub R. Matrix-free laser desorption/ionization mass spectrometry on silicon nanowire arrays prepared by chemical etching of crystalline silicon // Langmuir. 2009. V. 26. № 2. P. 1354.
Tuomikoski S., Huikko K., Grigoras K., Ostman P., Kostiainen R., Baumann M., Abian J., Kotiaho T., Franssila S. Preparation of porous n-type silicon sample plates for desorption/ionization on silicon mass spectrometry (DIOS-MS) // Lab. Chip. 2002. V. 2. P. 247.
Cuiffi J.D., Hayes D.J., Fonash S.J., Brown K.N., Jones A.D. Desorption−ionization mass spectrometry using deposited nanostructured silicon films // Anal. Chem. 2001. V. 73. № 6. P. 1292.
Singh R., Bezuidenhout L.W., Jemere A., Wang Z., Brett M., Harrison D.J. Engineering matrix-free laser desorption ionization mass spectrometry using glancing angle deposition films // Rapid Commun. Mass Spectrom. 2017. V. 31. № 7. P. 631.
Алимпиев С.С., Гречников А.А., Никифоров С.М. Новые подходы в лазерной масс-спектрометрии органических объектов // Успехи физ. наук. 2015. Т. 185. С. 207. (Alimpiev S.S., Grechnikov A.A., Nikifo-rov S.M. New approaches to the laser mass spectrometry of organic samples // Physics–Uspekhi. 2015. V. 58. № 2. P. 191.)
Chen Y., Vertes A. Adjustable fragmentation in laser desorption/ionization from laser-induced silicon microcolumn arrays // Anal. Chem. 2006. V. 78. № 16. P. 5835.
Гречников А.А., Бородков А.С., Алимпиев С.С., Никифоров С.М., Симановский Я.О. Основность в газовой фазе – параметр, определяющий эффективность лазерной десорбции−ионизации с кремниевых поверхностей // Журн. аналит. химии. 2013. Т. 68. № 1. С. 22. (Grechnikov A.A., Borodkov A.S. Alimpiev S.S., Nikiforov S.M., Simanovsky Ya.O. Gas-phase basicity: Parameter determining the efficiency of laser desorption/ionization from silicon surfaces // J. Analyt. Chem. 2013. V. 68. № 1. P. 19.)
Anderegg R.J. Derivatization in mass spectrometry: Strategies for controlling fragmentation // Mass Spectrom. Rev. 1988. V. 7. № 4. P. 395.
Alimpiev S., Grechnikov A., Sunner J., Karavanskii V., Simanovsky Ya., Nikiforov S. Surface-assisted laser desorption/ionization mass spectrometry with a rotating ball interface // Rapid Commun. Mass Spectrom. 2011. V. 25. P. 140.
Жабин С.Н., Пенто А.В., Гречников А.А., Бородков А.С., Сартаков С.Б., Никифоров С.М., Алимпиев С.С. О роли лазерного излучения в процессах лазерной десорбции-ионизации с кремниевых поверхностей // Квантовая электроника. 2011. Т. 41. № 9. С. 835. (Zhabin S.N., Pento A.V., Grechnikov A.A., Borodkov A.S., Sartakov B.G., Simanovskii Ya.O., Nikiforov S.M., Alimpiev S.S. On the role of laser irradiation in the processes of laser desorption/ionisation from si-licon surfaces // Quantum Electron. 2011. V. 41. № 9. P. 835.)
Hunter E.P., Lias S.G. Proton Affinity Evaluation, NIST Chemistry WebBook, NIST Standard Reference Database / Eds. Linstrom P.J., Mallard W.G. (National Institute of Standards and Technology, Gaithersburg, MD, 2005). http://webbook.nist.gov. (Дата обращения 18.02.018 г.)
Granovsky A.A. Firefly version 7.1.G, http://classic.chem.msu.su/gran/firefly/index.html. (Дата обращения 15.01.012 г.)
Гречников А.А., Бородков А.С., Жабин С.Н., Алимпиев С.С. О механизме десорбции ионов в условиях лазерной десорбции/ионизации с кремниевых поверхностей // Масс-спектрометрия. 2014. Т. 11. № 2. С. 71. (Grechnikov A.A., Borodkov A.S., Zhabin S.N., Alimpiev S.S. On the mechanism of ion desorption in the process of laser desorption/ionization from silicon surfaces // J. Analyt. Chem. 2014. V. 69. № 14. P. 1361.)
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


