Журнал аналитической химии, 2019, T. 74, № 12, стр. 934-940
Определение метионина в лекарственных препаратах методом инверсионной вольтамперометрии
В. В. Шелковников a, *, А. М. Алтыев a, М. Е. Виноградов a
a Национальный исследовательский Томский государственный университет, химический факультет
634050 Томск, просп. Ленина, 36, Россия
* E-mail: shvv@chem.tsu.ru
Поступила в редакцию 05.06.2018
После доработки 13.05.2019
Принята к публикации 31.05.2019
Аннотация
Предложен способ определения метионина методом инверсионной вольтамперометрии на модифицированном витамином B12 углеродсодержащем электроде. В основе методики лежит реакция восстановления метионина до гомоцистеина. Подготовка электрода заключается в формировании на поверхности углеродсодержащего электрода, модифицированного углеродными нанотрубками, пленки витамина B12 методом циклической вольтамперометрии при развертке потенциала от –1.4 до +1 В. Оптимизированы условия анализа: потенциал накопления, время накопления, скорость развертки. Предел обнаружения метионина составляет 1 × 10–7 М.
Аминокислоты – органические соединения, разнообразные реакции которых объясняются одновременным присутствием в молекуле основной аминогруппы –NH2 и кислой карбоксильной группы –СООН. В природе чаще всего встречаются α-аминокислоты. Аминокислоты как основные составные части белков участвуют во всех жизненных процессах наряду с нуклеиновыми кислотами, углеводами и липидами. Кроме аминокислот, входящих в состав белков, живые организмы обладают постоянным резервом “свободных” аминокислот, содержащихся в тканях и в клеточном соке. Они находятся в динамическом равновесии при многочисленных обменных реакциях. Аминокислоты участвуют в биосинтезе полипептидов и белков, а также в синтезе фосфатидов, порфиринов и нуклеотидов. Свободные аминокислоты нужны в живом организме и для выполнения специфических задач [1].
Незаменимые аминокислоты, такие как метионин, триптофан, фенилаланин, являются необходимыми веществами для построения белков, улучшения выделения специфических гормонов и участия в биохимических реакциях, например в синтезе серотонина [2]. Данные аминокислоты не вырабатываются в организме человека, и источником их поступления являются продукты питания, биологически активные добавки и лекарственные препараты, поэтому необходимы надежные и экспрессные методы их определения. Данная работа посвящена определению метионина в лекарственных препаратах и биологически активных добавках (БАД).
Метионин (схема 1 ) – алифатическая серосодержащая α-аминокислота, в чистом виде представляющая собой бесцветные кристаллы со специфическим неприятным запахом. Метионин служит донором метильных групп при образовании адреналина, холина, а также источником серы при биосинтезе цистеина [3].
В настоящее время метионин определяют методами хромато-масс-спектрометрии, хемилюминесценции, спектрофотометрии, ВЭЖХ [3–6]. Для определения метионина данными методами необходима длительная пробоподготовка и использование дорогостоящих реагентов. Перспективным, на наш взгляд, является метод инверсионной вольтамперометрии, не требующий сложного аппаратурного оформления и обладающий высокой чувствительностью. Описаны [7–14] методики определения метионина методом инверсионной вольтамперометрии на угольно-пастовых электродах, углеродных электродах, модифицированных бензоилферроценом, многослойными рутениевыми металлодендримерами, наночастицами благородных металлов. Данные модификаторы сложны в приготовлении и нанесении на поверхность, поэтому разработка новых методов контроля метионина в сложных по составу объектах является актуальной задачей.
Схема 1 . Структурные формулы витамина B12 (а) и метионина (б).
Метионин, поступая в организм человека, при взаимодействии с ферментами восстанавливается до гомоцистеина [5]. Такая реакция может служить прообразом соответствующего электродного процесса. В качестве вспомогательного вещества мы предлагаем использовать цианокобаламин (витамин B12) – вещество, являющееся электроактивным за счет наличия в корриновом кольце кобальта(III) (схема 1 ). Известен процесс хемосорбции витамина B12 на мезопористом углероде [15]. Закрепив за счет адсорбции витамин B12 на поверхности электрода, можно создать условия, позволяющие связывать метионин из раствора для образования электроактивного соединения на электроде.
Цель данной работы − разработка способа определения метионина в лекарственных препаратах и БАДах методом вольтамперометрии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Аппаратура. Все электрохимические измерения проводили на вольтамперометрическом анализаторе TA-LAB (НПО “Томьаналит”) в постояннотоковом или в дифференциально-импульсном режиме в трехэлектродной ячейке. Индикаторным электродом служил модифицированный углеродсодержащий электрод, изготовленный методом “литья под давлением” (d = 5 мм), в качестве вспомогательного электрода и электрода сравнения использовали хлоридсеребряные электроды в 1 М растворе KCl. Многостенные углеродные нанотрубки (МУНТ) на поверхность углеродсодержащего электрода наносили электролизом из водной суспензии МУНТ с помощью универсального источника питания УИП-2. Морфологию поверхности исследовали на растровом электронном микроскопе Hitachi TM-3000 при ускоряющем напряжении 15 кВ в условиях режима снятия зарядки с образца (электронная пушка 5 × × 10–2 Па, камера для образца 30–50 Па). Спектры комбинационного рассеяния регистрировали на спектрометре Nicolet NXR 9650. Суспензию нанотрубок готовили в ультразвуковой ванне Сапфир – 2.8 ТТЦ, для анализа аминокислот методом хроматографии использовали Shimadzu LC-20 Prominence.
Реактивы. Использовали витамин B12 (Беларусь), метионин (Sigma, США), многостенные углеродные нанотрубки из Graphen (США) размерами 7−15 нм × 0.5−10 мкм. Буферный раствор с рН 4.01 (K2С8H4O4−KHС8H4O4) готовили из стандарт-титра. Все реактивы готовили на деионированной воде, полученной на Sartorius марки arium® pro. Все эксперименты проводили при комнатной температуре.
Подготовка модифицированного углеродсодержащего электрода. Суспензию МУНТ (0.5 мг/см3) готовили следующим образом: МУНТ измельчали в фарфоровой ступке, смачивали небольшим количеством этилового спирта, добавляли воду и помещали в ультразвуковую ванну на 3 ч. Готовую суспензию использовали для нанесения нанотрубок на поверхность углеродсодержащего электрода методом анодной поляризации. В качестве катода (противоэлектрода) использовали пластину из нержавеющей стали. Выбор оптимальных условий формирования электрода описан ниже. Витамин B12 осаждали на модифицированном МУНТ электроде методом циклической вольтамперометрии в диапазоне потенциалов от −1.4 до + 1.0 В при скорости сканирования потенциала 50 мВ/с в течение 40 циклов из 1.0 мМ раствора витамина B12 при рН 4.01. После нанесения модификатора электрод промывали водой и высушивали на воздухе. Перед регистрацией вольтамперограмм растворенный кислород удаляли барботированием инертного газа (азота).
Подготовка лекарственных препаратов к анализу. Содержимое капсул растворяли в воде. Твердый остаток отделяли центрифугированием с последующим фильтрованием через бумажный фильтр (“синяя лента”). Метионин определяли методом ВЭЖХ по ГОСТ 32195-2013 [6].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Чувствительность вольтамперометрического анализа можно повысить за счет увеличения рабочей поверхности электрода. Одним из способов увеличения активной поверхности является нанесение углеродных нанотрубок. В работе [16] нанотрубки наносили на полистирол методом электрофореза с последующим прокаливаем при 450°С для удаления матрицы. Процесс занимает не менее 24 ч. Мы предлагаем наносить МУНТ способом электрохимического осаждения в потенциостатическом режиме при анодной поляризации. В процессе электролиза при высоком потенциале углерод способен окисляться до карбоксильных групп, которые могут выступать в качестве адсорбционных центров при концентрировании определяемых веществ на поверхности электрода.
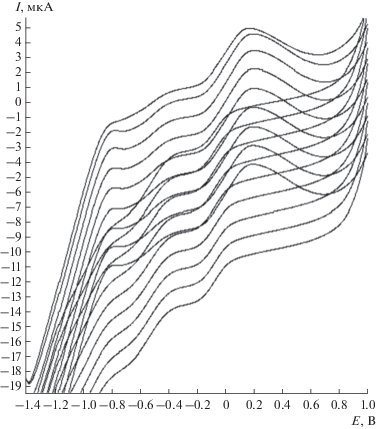
Для закрепления модификатора (витамина B12) на поверхности электрода использовали метод циклической вольтамперометрии. В присутствии в анализируемом растворе витамина B12 наблюдается анодный пик при потенциале −0.75 В, характерный для окисления кобальта (рис. 1). Ток пика в процессе непрерывного циклического изменения потенциала увеличивается, что свидетельствует о росте пленки витамина B12 на поверхности углеродсодержащего электрода.
Рис. 1.
Циклические вольт-амперные кривые процесса адсорбции витамина B12 в буферном растворе с pH 4.01; w = 50 мВ/с.
Оптимальные условия формирования электрода выбирали методом трехфакторного планирования эксперимента. В качестве факторов для оптимизации использовали напряжение источника питания, время нанесения нанотрубок и концентрацию витамина B12. В качестве функции отклика оптимизировали плотность тока анодного пика тестовой системы K3[Fe(CN)6]/K4[Fe(CN)6)]. Для этого ток пика относили к активной площади поверхности электрода, которую оценивали по уравнению Рендлса–Шевчика по циклическим вольт-амперным кривым.
В оптимальных условиях (осаждение нанотрубок при 6.5 В в течение 8 с и последующая адсорбция витамина B12 из раствора с концентрацией 0.025 мг/мл) плотность тока примерно в 6 раз больше, чем в случае аналогичного по параметрам немодифицированного электрода (2.02 против 0.33 мкА/см2).
На рис. 2 представлены фотографии поверхности углеродсодержащего электрода до и после модификации. При нанесении нанотрубок (рис. 2б) поверхность электрода становится более развитой. После поляризации электрода в растворе витамина B12 (рис. 2в) на поверхности формируется пленка из адсорбированного цианокобаламина, активные центры которого способны участвовать в формировании аналитического сигнала метионина.
Рис. 2.
Фотографии поверхности электрода при увеличении 1 : 2000: (а) – углеродсодержащий электрод; (б) – электрод после осаждения МУНТ; (в) – электрод, модифицированный витамином B12.

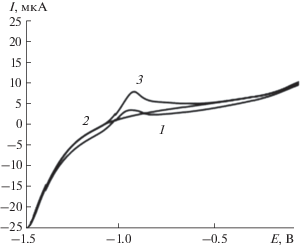
На рис. 3 представлены вольт-амперные кривые, полученные на модифицированном электроде при линейной развертке потенциала в постояннотоковом режиме. В присутствии метионина анодный пик, характерный для витамина B12, исчезает и появляется новый пик при потенциале −0.95 В. Величина тока пика пропорциональна концентрации метионина в растворе.
Рис. 3.
Постояннотоковая вольтамперограмма метионина: 1 – фоновый электролит с рН 4.01, 2 –2.29 × 10–6 М раствор метионина, 3 –4.58 × 10–6 М раствор метионина.
Для установления возможного механизма процесса концентрирования метионина и формирования аналитического сигнала регистрировали спектры комбинационного рамановского рассеяния. Для этого проводили электрохимическое концентрирование метионина при потенциале −1.6 В на модифицированном электроде в течение 300 с, затем электрод промывали деионированной водой, помещали в чистый фоновый электролит и при линейной развертке потенциала от −1.6 до 1.5 В растворяли концентрат с электрода. Данную операцию выполняли не менее 10 раз для повышения интенсивности спектра. На рис. 4 представлены спектры рамановского рассеяния водных растворов кобаламина (1), метионина (2) и продуктов электрохимического растворения метионина (3).
Рис. 4.
Спектры комбинационного рассеяния: 1 – витамин B12, 2 – 0.17 М раствор метионина, 3 – продукты растворения концентрата с электрода.
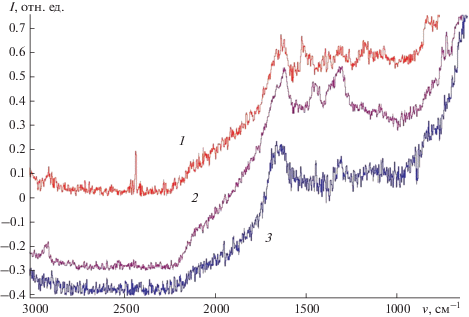
После растворения концентрата в чистом фоновом электролите из спектра исчезают полосы при 2930 и 1410 см–1, характерные для CH3(vs), полоса при 723 см–1, характерная CSC(s), смещается в более длинноволновую область до 782 см–1, что отвечает HSC(vs) [17]. Таким образом, после растворения концентрата в растворе присутствует гомоцистеин, который образуется из метионина в результате электродной реакции. Можно предложить следующий механизм процесса: атом серы метионина с частичным отрицательным зарядом за счет электростатических сил присоединяется к кобальту(III) витамина B12. При катодной поляризации электронная плотность смещается к атому серы, метильная группа отрывается от метионина, переходя на кобаламин. При анодной развертке потенциала в раствор переходит гомоцистеин. Отсутствие в спектре 3 рис. 4 полос, характерных для функциональных групп витамина B12 [18], свидетельствует о том, что пленка цианокобаламина на электроде достаточно устойчива и не растворяется при анодной поляризации.
Для увеличения чувствительности определения метионина вольт-амперные кривые регистрировали в дифференциально-импульсном режиме (рис. 5). Оптимальные условия определения: фоновый электролит – буферный раствор с pH 4.01, Eэ = −1.6 В, tэ = 120–300 с, w = 50 мВ/с, амплитуда волны 15 мВ, задержка измерения 7 мс, шаг развертки 10 мВ.
Рис. 5.
Дифференциально-импульсная вольтамперограмма: Еэ = −1.6 В, tэ = 300 с; 1 – фоновый раствор с рН 4.01, 2 – добавка 1 × 10–7 моль/л метионина.
В оптимальных условиях регистрации сигнала зависимость изменения тока окисления метионина от его концентрации в растворе в диапазоне концентраций от 1 × 10–7 до 50 × 10–7 М описывается уравнением регрессии:
где I – ток электроокисления метионина, мкА; с – концентрация метионина в анализируемом растворе, М. Предел обнаружения, рассчитанный по 3σ-критерию, составил 1.2 × 10–7 М.Таблица 1.
Результаты определения метионина в лекарственных средствах методами ВЭЖХ и инверсионной вольтамперометрии (ИВА) (n = 5, P = 0.95)
| Препарат | Номинальное содержание метионина в 1 таблетке, мг | Содержание метионина, мг/табл. | |
|---|---|---|---|
| ВЭЖХ | ИВА | ||
| Ревалид | 100 | 101 ± 10 | 98 ± 14 |
| Витрум-Бьюти | 3.3 | 3 ± 1 | 3 ± 1 |
| Метионин | 250 | 248 ± 31 | 253 ± 33 |
Таблица 2.
Проверка правильности определения метионина методом введено−найдено
| Содержание в образце, М | Введено, М | Найдено, М | Δ | R, % |
|---|---|---|---|---|
| 3.05 × 10–6 | 3.00 × 10–6 | (6.0 ± 0.4) × 10–6 | 2.90 × 10–6 | 97 |
| 1.30 × 10–7 | 5.00 × 10–7 | (6.0 ±0.5) × 10–7 | 4.72 × 10–7 | 94 |
В табл. 1 представлены результаты определения метионина в лекарственных препаратах и БАДах методами инверсионной вольтамперометрии и ВЭЖХ. Данные, полученные разными методами, хорошо согласуются между собой.
Для проверки правильности результатов использовали метод введено–найдено и расчет степени открытия R, равной отношению разности между найденной концентрацией и начальным содержанием вещества в пробе к введенной добавке. Значения R близки к 100%, что свидетельствуют об отсутствии значимой систематической погрешности.
Модифицированный электрод позволяет получать стабильные аналитические сигналы в течение не менее 25 циклов (холостой опыт, анализируемая проба, проба с добавкой). В дальнейшем чувствительность электрода уменьшается и требуется обновление поверхности электрода. Поверхность электрода очищают электролизом в течение 300 с при потенциале –0.5 В. Затем на поверхность наносят новую пленку витамина B12 методом циклического сканирования потенциала. Определению метионина не мешают присутствующие основные компоненты лекарственных средств.
* * *
Таким образом, разработана методика определения метионина методом инверсионной вольтамперометрии на модифицированном витамином B12 электроде в диапазоне концентраций 1 × × 10–5−1 × 10–7 М. Преимуществами методики являются простота формирования модифицированного электрода, широкий диапазон определяемых концентраций, высокие чувствительность и экспрессность, экономичность. Разработанную методику можно рекомендовать для контроля качества препаратов, содержащих метионин.
Список литературы
Якубке Х.Д., Ешкайт Х. Аминокислоты, пептиды, белки. Пер. с нем. М.: Мир, 1985. 456 с.
Turner E.H., Loftis J.M. Serotonin a la carte: Supplementation with the serotonin precursor 5-hydroxytryptophan // Pharmacol. Ther. 2006. V. 109. № 3. P. 325.
Jiang Yi., Sun Ch.-L., Lee H.-H. Simultaneous determination of plasma total homocysteine and methionine by liquid chromatography-tandem mass spectrometry // Clin. Chim. Acta. 2017. V. 464. P. 93.
Min Z., Ziao K. Flow-based determination of methionine in pharmaceutical formulations exploiting TGA-capped CdTe quantum dots for enhancing the luminol-KIO4 chemiluminescence // Luminescence. 2017. V. 183. P. 206.
Manta B., Relover S. Regulated methionine oxidation by monooxygenases // Free Radical Biol. Med. 2017. V. 109. P. 141.
ГОСТ 32195-2013. Корма, комбикорма. Метод определения содержания аминокислот. М.: Стандартинформ, 2016. 24 с.
Molaakbari E., Mostafavi A., Beitollahi H. Simultaneous electrochemical determination of dopamine, melatonin, methionine and caffeine // Sens. Actuators, B. 2015. V. 208. P. 195.
Beitolahhi H., Alireza M., Ghorbanni F. Electrocatalytic measurement of methionine concentration with a carbon nanotube paste electrode modified with benzoylferrocene // Chin. J. Catal. 2013. V. 34. P. 1333.
Шайдарова Л.Г., Зиганшина С.А., Тихонова Л.Н., Будников Г.К. Электрокаталитическое окисление и проточно-инжекционное определение серосодержащих аминокислот на графитовых электродах, модифицированных пленкой из гексацианоферрата рутения // Журн. аналит. химии. 2003. Т. 58. № 12. С. 1277. (Shaidarova L.G., Ziganshina S.A., Ti-khonova L.N., Budnikov G.K. Electrocatalytic oxidation and flow injection determination of sulfur-containing amino acids at graphite electrodes modified with a ruthenium hexacyanoferrate // J. Analyt. Chem. 2003. V. 58. № 12. P. 1144.)
Файзуллина Ю.Г., Яркаева Ю.А., Зильберг Р.А., Майстренко В.Н., Гилева Н.Г. Вольтамперометрческое определение метионина на модифицированном полиариленфталидом стеклоуглеродном электроде // Доклады Башкирского университета. 2017. Т. 2. № 5. С. 705.
Шайдарова Л.Г., Будников Г.К. Химически модифицированные электроды на основе благородных металлов, полимерных пленок или их композитов в органической вольтамперометрии // Журн. аналит. химии. 2008. Т. 63. № 10. С. 1014. (Shaidarova L.G., Budnikov G.K. Chemically modified electrodes based on noble metals, polymer films, or their composites in organic voltammetry // J. Analyt. Chem. 2008. V. 63. № 10. P. 922.)
Дубровский Д.И., Кабирова Л.Р., Хаблетдинова А.И., Зильберг Р.А., Майстренко В.Н. Вольтамперометрические сенсоры на основе композитов полиэлектролитного комплекса хитозана и α-, β-, γ-циклодекстринов для определения и распознавания энантиомеров метионина // Вестник Башкирского университета. 2018. Т. 23. № 3. С. 723.
Дорожко Е.В. Определение некоторых тиоловых соединений в биологических объектах методом вольтамперометрии. Автореф. дис. … канд. хим. наук. Томск: Томский политех. ун-т, 2010. 22 с.
Cheng L., Pacey G.E., Cox J.A. Carbon electrodes modified with ruthenium metallodendrimer multilayers for the mediated oxidation of methionine and insulin at physiological pH // Anal. Chem. 2001. V. 73. P. 5607.
Zhuo G., Guangshan Z., Bo G., Daliang Z., Ge T., Yue C., Weiwei Z. Adsorption of vitamin B12 on ordered mesoporous carbons coated with PMMA // Carbon. 2005. V. 43. № 11. P. 2344.
Mazurenko E., Mathieu E., Tananaiko O., Urbanova V. Electrophoretic deposition of macroporous carbon nanotube assemblies for electrochemical applications // Carbon. 2013. V. 53. P. 302.
Jose A., Lima Jr. Using Raman spectroscopy to understand the origin of the phase transition observed in the crystalline sulfur based amino acid l-methionine // Vib. Spectrosc. 2013. V. 65. P. 132.
Zhang Z., Wang B., Yin Y., Mo Y. Surface-enhanced Raman spectroscopy of vitamin B12 on silver particles in colloid and in atmosphere // J. Mol. Struct. 2009. V. 927. P. 88.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии