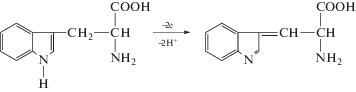Журнал аналитической химии, 2019, T. 74, № 12, стр. 941-952
Энантиоселективная вольтамперометрическая сенсорная система для распознавания D- и L-триптофана на основе стеклоуглеродных электродов, модифицированных композитами полиариленфталида с α-, β- и γ-циклодекстринами
Р. А. Зильберг a, *, В. Н. Майстренко a, Ю. А. Яркаева a, Д. И. Дубровский a
a Башкирский государственный университет, химический факультет
450076 Уфа, ул. Заки Валиди, 32, Россия
* E-mail: ZilbergRA@yandex.ru
Поступила в редакцию 05.05.2018
После доработки 22.06.2018
Принята к публикации 29.05.2019
Аннотация
Разработана энантиоселективная вольтамперометрическая сенсорная система на основе стеклоуглеродных электродов, модифицированных композитами полиариленфталида с α-, β- и γ-циклодекстринами, для селективного распознавания и определения энантиомеров триптофана (Трп). Электрохимические характеристики электродов и морфология поверхности изучены методами циклической вольтамперометрии, электрохимической импедансной спектроскопии и атомно-силовой микроскопии. Предложенная сенсорная система с регистрацией вольтамперограмм на трех электродах и хемометрической обработкой данных методами главных компонент и проекции на латентные структуры с дискриминантным анализом применена для распознавания энантиомеров Трп в пищевых добавках и установления производителя.
Многие органические соединения, участвующие в биохимических процессах в живых организмах (аминокислоты, сахара и др.), существуют в виде оптически активных изомеров (энантиомеров) [1]. Так, аминокислоты, входящие в состав белков, как правило, имеют L-конфигурацию, тогда как D-аминокислоты не участвуют в синтезе белков или оказывают неблагоприятное воздействие на живые организмы [2]. Среди аминокислот особый интерес представляет триптофан – 2-амино-3-(1Н-индол-3-ил)пропионовая кислота, L-энантиомер которой является предшественником нейротрансмиттера серотонина. Для человека триптофан является незаменимой аминокислотой, которая поступает в организм с белками пищи и пищевыми добавками. Это стимулировало развитие исследований по распознаванию и определению энантиомеров триптофана в лекарственных средствах и пищевых продуктах [3–9]. Обычно для этого используют флуоресцентную спектроскопию [3, 4], методы хроматографии [5–7], капиллярный электрофорез [8], ЯМР [9], масс-спектрометрию [7] и др. Однако применение перечисленных методов требует использования дорогостоящих приборов и оборудования, длительной пробоподготовки и тщательной очистки анализируемых образцов, наличия высококвалифицированных сотрудников. В связи с этим все большее внимание аналитиков привлекают электрохимические методы, в частности, вольтамперометрия, которые позволяют довольно просто и быстро при низкой стоимости анализа распознать с высокой чувствительностью энантиомеры триптофана [10–19].
В качестве хиральных селекторов в электрохимических сенсорах для распознавания энантиомеров триптофана наибольшее распространение получили циклодекстрины (ЦД) – циклические олигосахариды в форме усеченного конуса, содержащие (обычно) шесть (α-ЦД), семь (β-ЦД) или восемь (γ-ЦД) глюкопиранозидных единиц, соединенных 1,4-гликозидными связями [20–22]. Шестичленные глюкопиранозидные кольца в ЦД соединены между собой так, что их поверхности образуют гидрофобные полости различных размеров. Наличие этих полостей обусловливает уникальную способность ЦД к образованию комплексов включения типа “гость−хозяин” с другими молекулами или их гидрофобными фрагментами, например, с ароматическими аминокислотами [21–24]. При этом молекулы “гостей” или их гидрофобные фрагменты проникают в полости ЦД с образованием комплексов, устойчивость которых зависит от природы энантиомера.
В качестве селектора для распознавания энантиомеров триптофана в вольтамперометрических сенсорах в основном используют β-ЦД. Для иммобилизации β-ЦД на поверхности электрода (стеклоуглерод, золото и др.) применяют электропроводящие полимеры, супрамолекулярные структуры, самоорганизующиеся системы, нанокомпозиты, углеродные нанотрубки, графен и др. [11, 14, 16–19]. Однако даже при применении β-ЦД при регистрации вольтамперометрических кривых потенциалы пиков и токи окисления энантиомеров триптофана, как правило, незначительно различаются между собой. Для повышения энантиоселективности сенсоров используют различные способы: введение ионов металлов (Cu2+, Fe3+ и др.) или лигандов, конкурирующих с энантиомерами триптофана при образовании комплексов с β-ЦД [11]; импульсные методы регистрации вольтамперограмм; модифицирование электродов наноматериалами на основе графена и хитозана, содержащими нанотрубки, наночастицы углерода и платиновых металлов [15–19].
Для решения проблем распознавания и оценки содержания энантиомеров Трп в пищевых продуктах и лекарственных средствах применяют также мультисенсорные системы (“электронные языки”) [25–30]. В таких системах каждый сенсор чувствителен ко всем распознаваемым компонентам сразу, причем чувствительность и селективность отклика на один и тот же компонент (энантиомер) у разных сенсоров различна (перекрестная или кросс-селективность). С помощью мультисенсорных систем одновременно можно распознать многие (или все) компоненты, используя заранее установленные нелинейные многопараметрические зависимости, полученные при хемометрической обработке вольтамперограмм для растворов различного, но точно известного состава. Для увеличения вероятности распознавания обрабатывают большие массивы экспериментальных данных, содержащих значения мгновенных токов при разных потенциалах, полученные при регистрации последовательных вольтамперограмм на нескольких индикаторных электродах.
В настоящей работе изучена вольтамперометрическая сенсорная система для распознавания энантиомеров триптофана на основе стеклоуглеродных электродов (СУЭ), модифицированных композитами полиариленфталида (ПАФ) с α-, β- и γ-ЦД. Исходя из данных [10, 21–24, 26], можно предположить, что такие электроды будут иметь перекрестную чувствительность к энантиомерам триптофана. Это позволит использовать их в качестве хиральных сенсоров в составе сенсорной системы. С использованием методов вольтамперометрии, электрохимической импедансной спектроскопии (ЭИС) и атомно-силовой микроскопии (АСМ) оптимизированы условия модифицирования СУЭ композитами полиариленфталида с α-, β- и γ-ЦД. Установлены аналитические характеристики сенсоров, условия регистрации вольтамперограмм и возможности сенсорной системы для распознавания и определения энантиомеров триптофана в пищевых добавках.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
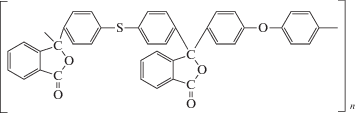
Полиариленфталид представляет собой полимер с ариленовыми фрагментами и гетероатомами в основной цепи и кардовыми фталидными группами [26, 31]. Пленки ПАФ электропроводны, обладают высокой термостойкостью, устойчивы к действию кислот и щелочей, растворимы во многих органических растворителях. Макромолекулы ПАФ склонны к самоорганизации и позволяют создавать композиционные материалы. Для модифицирования СУЭ использовали полимер с соотношением дифенилентио- и дифениленоксидных фрагментов 1 : 1 (схема 1 ).
Схема 1 . Структура полиариленфталида.
Образцы полимера с содержанием основного вещества ≥99% получены в Уфимском институте химии РАН (Уфа, Россия). D- и L-триптофан, α-, β-, γ-ЦД приобретены у Sigma Chemical Co. (США). Другие реагенты приобретены у Sigma Aldrich (Германия) и использованы без дальнейшей очистки. Пасту на основе 0.1−0.3 мкм Cr2O3 использовали для полировки поверхности СУЭ. Фоновым электролитом служил 0.1 M фосфатный буферный раствор, содержащий Na2HPO4 и NaH2PO4 (pH 6.86). Раствор [Fe(CN)6]4−/3− готовили с использованием 0.1 M раствора KCl в качестве фонового электролита. Все водные растворы приготовлены с использованием деионированной воды.
Циклические (ЦВА) и дифференциально-импульсные (ДИВ) вольтамперометрические измерения проводили с использованием потенциостата/гальваностата AUTOLAB PGSTAT 204 (Metrohm Autolab Ins., Нидерланды). Электрохимические эксперименты выполняли с использованием трехэлектродной системы, включающей “голый” или модифицированный СУЭ диаметром 2 мм (SIGRADUR G, HTW GmbH, Германия) в качестве рабочих электродов, платиновую проволоку в качестве вспомогательного электрода и хлоридсеребряный электрод в качестве электрода сравнения. Морфологические характеристики поверхности модифицированных ПАФ-композитами СУЭ изучали методом АСМ с использованием микроскопа CMM-2000T производства Протон-МИЭТ (Москва, Россия). Импедансметрические измерения проводили с использованием импедансметра Elins Z500 Pro (Москва, Россия). Спектры импеданса регистрировали в диапазоне частот от 50 кГц до 0.1 Гц с амплитудой сигнала 5 мВ. Измерения рН проводили с помощью рН-метра Seven Compact pH/Ion S220 (Mettler-Toledo AG, Швейцария). Все измерения выполняли при комнатной температуре 22.0 ± 0.5°C.
Стеклоуглеродные электроды, модифицированные ПАФ-композитами, готовили следующим образом: 3 мкл раствора 10 мг ПАФ и 10 мг модификатора (α-, β- или γ-ЦД) в 10 мл диметилформамида (ДМФА) с помощью дозатора наносили на тщательно очищенную поверхность СУЭ и сушили в лучах ИК-лампы. После серии параллельных измерений пленку модификатора смывали с поверхности электрода ДМФА, промывали электрод деионированной водой, сушили на воздухе под ИК-лампой и полировали пастой Cr2O3. Затем электрод промывали 0.1 М раствором ЭДТА для удаления микрочастиц Cr2O3, этанолом, деионированной водой, сушили на воздухе и модифицировали вновь.
Растворы энантиомеров Трп (0.035 мМ) готовили растворением навески вещества в 100 мл фосфатного буферного раствора (рН 6.86). Растворы более низких концентраций получали путем последовательного разбавления исходных растворов. Исследуемый раствор объемом 20 мл помещали в электрохимическую ячейку. Стандартные растворы пищевых добавок, содержащие L-триптофан, готовили растворением точной навески образца в мерных колбах емк. 100 мл в фосфатном буферном растворе (pH 6.86). Растворы с меньшими концентрациями готовили последовательным разбавлением исходных стандартных растворов. Циклические вольтамперограммы регистрировали в диапазоне потенциалов от 0.5 до 1.5 В со скоростью развертки потенциала 100 мВ/с после того, как индикаторный электрод выдерживали в растворе аналита в течение 30 с при энергичном перемешивании и Е = 0 В. Более продолжительное выдерживание электрода в растворе аналита не приводит к существенному изменению формы вольтамперограмм и токов пиков. Дифференциально-импульсные вольтамперограммы регистрировали в диапазоне потенциалов от 0.3 до 1.0 В с амплитудой 50 мВ, интервалом времени 0.25 с, временем модуляции 0.025 с и скоростью развертки 20 мВ/с. Массив данных для каждого образца состоял из четырех параллельных измерений, включающих 20 последовательных вольтамперограмм. Каждая вольтамперограмма содержала от 140 (ДИВ) до 200 (ЦВА) мгновенных токов (с шагом 5 мВ) при разных потенциалах.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Известно [16, 18], что Трп необратимо окисляется в фосфатном буферном растворе на модифицированных СУЭ с переносом двух электронов (схема 2 ):
Схема 2 . Электроокисление триптофана.
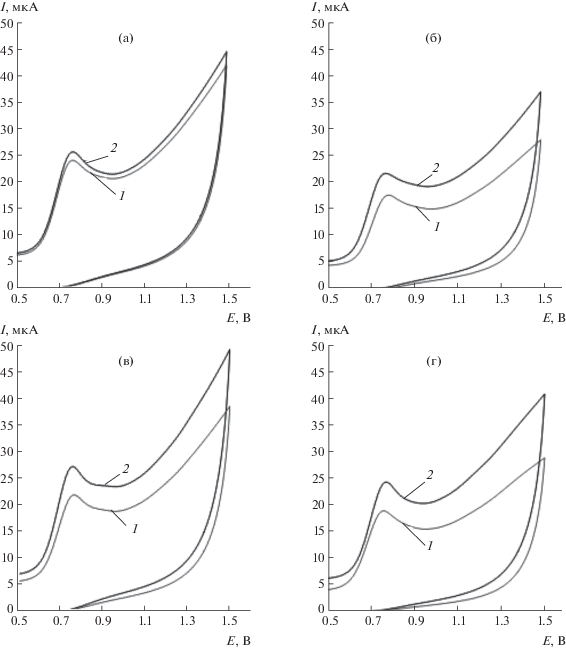
В исследуемом диапазоне потенциалов энантиомеры Трп окисляются в фосфатном буферном растворе на модифицированных композитами ПАФ с ЦД СУЭ с образованием соответствующих пиков (рис. 1). Видно, что в отсутствие ЦД вольтамперограммы энантиомеров Трп практически не отличаются друг от друга (рис. 1а).
Рис. 1.
Циклические вольтамперограммы 0.035 мМ растворов D-триптофана (1) и L-триптофана (2) в фосфатном буферном растворе (pH 6.86) на СУЭ/ПАФ (а), СУЭ/ПАФ/α-ЦД (б), СУЭ/ПАФ/β-ЦД (в), СУЭ/ПАФ/γ-ЦД (г). Скорость развертки потенциала 100 мВ/с.
Для характеристики электрохимических свойств СУЭ, модифицированных ПАФ-композитами, регистрировали циклические вольтамперограммы 5.0 мМ раствора (1 : 1) [Fe(CN)6]3–/4– в 0.1 М растворе KCl при 100 мВ/с. Из рис. 2а видно, что после модифицирования поверхности СУЭ пленкой ПАФ пики редокс-пары [Fe(CN)6]3−/4− уменьшаются по сравнению с “голым” СУЭ, что обусловлено увеличением сопротивления переноса заряда при модифицировании поверхности электрода ПАФ. При введении в полимерную пленку ЦД токи на циклических вольтамперограммах возрастают по сравнению с СУЭ, модифицированным только ПАФ. Наибольшие значения токов наблюдаются для СУЭ, модифицированного композитом ПАФ с γ-ЦД, а наименьшие – для композита ПАФ с α-ЦД, что согласуется с уменьшением размеров полости ЦД при переходе от γ-ЦД к α-ЦД.
Рис. 2.
(а): Циклические вольтамперограммы 5.0 мМ раствора редокс-пары [Fe(CN)6]3−/4− (1 : 1) на различных электродах (1 – СУЭ, 2 – СУЭ/ПАФ/γ-ЦД, 3 – СУЭ/ПАФ/β-ЦД, 4 – СУЭ/ПАФ/α-ЦД, 5 – СУЭ/ПАФ) на фоне 0.1 М KCl при скорости развертки потенциала 100 мВ/с. (б): Диаграммы Найквиста для различных электродов (1 – СУЭ, 2 – СУЭ/ПАФ/γ-ЦД, 3 – СУЭ/ПАФ/β-ЦД, 4 – СУЭ/ПАФ/α-ЦД, 5 – СУЭ/ПАФ) в 0.1 М растворе KCl, содержащем 5.0 мМ [Fe (CN)6]4−/3−. Вставка: эквивалентная электрическая схема Рэндлса, используемая для моделирования данных импеданса.
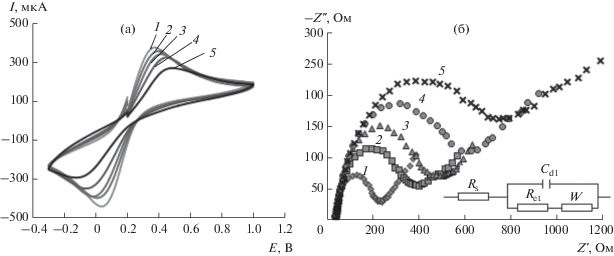
Другим эффективным методом, позволяющим получить информацию о межфазных свойствах поверхности модифицированных композитами ПАФ электродов, является ЭИС. На рис. 2б представлены кривые Найквиста для СУЭ, СУЭ/ПАФ, СУЭ/ПАФ/α-ЦД, СУЭ/ПАФ/β-ЦД, СУЭ/ПАФ/ γ-ЦД в 5.0 мМ растворе [Fe(CN)6]3–/4–, содержащем 0.1 М KCl. Данные импедансной спектроскопии согласуются с эквивалентной схемой, которая изображена на вставке рис. 2б, где Rs и Ret – сопротивление раствора и сопротивление переноса заряда соответственно. Кривые Найквиста показывают, что СУЭ, модифицированные ПАФ-композитами ЦД, имеют более низкое сопротивление переноса заряда по сравнению с СУЭ, модифицированным только ПАФ, и ускоряют перенос электрона на границе раздела фаз электрод/раствор. Сопротивление переноса заряда зависит также от соотношения ПАФ/ЦД в композите. Максимальные токи наблюдаются для композитов с соотношением ПАФ/ЦД 1 : 1.
Для характеристики поверхности модифицированных ПАФ-композитами СУЭ использовали также АСМ. Для примера на рис. 3 приведены AСM-изображения пленок композитов ПАФ с γ-ЦД. Видно, что на поверхности пленок имеются включения наносферических зерен γ-ЦД диаметром 60−100 нм, плотность расположения которых зависит от соотношения ПАФ/γ-ЦД. В отсутствие γ-ЦД поверхность электрода гладкая с редкими включениями в полимерной пленке.
Рис. 3.
АСМ-изображения полиариленфталидных пленок, модифицированных γ-циклодекстрином при соотношениях ПАФ−ЦД 1 : 0.25 (а), 1 : 0.5 (б), 1 : 1 (в).

Для установления оптимальных условий эксперимента изучено влияние рН раствора аналита, скорости развертки потенциала, времени выдерживания электрода в анализируемом растворе, концентрации энантиомеров Трп на значения токов пиков и форму вольтамперограмм. Критериями оптимизации служили чувствительность, стандартное отклонение и коэффициенты корреляции градуировочных графиков. Наиболее воспроизводимые ЦВА и ДИВ получены при рН 5−8, поэтому измерения проводили при рН 6.86. Изучено также влияние скорости развертки потенциала в диапазоне от 20 до 200 мВ/с на электрохимические характеристики энантиомеров Трп. Линейная зависимость между током пика (Ip) и квадратным корнем из скорости развертки потенциала (${{{v}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}$), свидетельствует о том, что электродный процесс контролируется в основном диффузией.
Циклические (рис. 1) и дифференциально-импульсные (рис. 4) вольтамперограммы энантомеров Трп на модифицированных композитами ПАФ с ЦД электродах отличаются друг от друга. Это обусловлено тем, что молекулы ЦД могут образовывать комплексы включения с энантиомерами Трп [21, 22], действуя как хиральные селекторы. Аналогичный эффект наблюдали на вольтамперограммах энантиомеров атенолола на СУЭ, модифицированных композитами полиэлектролитных комплексов хитозана с ЦД [32]. Электрохимические и аналитические характеристики дифференциальных импульсных вольтамперограмм энантиомеров Трп на СУЭ, модифицированных ПАФ-композитами с α-, β- или γ-ЦД, в диапазоне концентраций 4−70 мкM приведены в табл. 1.
Рис. 4.
Дифференциально-импульсные вольтамперограммы 0.035 мМ растворов D-триптофана (1) и L-триптофана (2) в фосфатном буферном растворе (pH 6.86) на СУЭ/ПАФ (а), СУЭ/ПАФ/α-ЦД (б), СУЭ/ПАФ/β-ЦД (в), СУЭ/ПАФ/γ-ЦД (г). Вставки: соответствующие градуировочные графики. Скорость развертки потенциала 20 мВ/с.
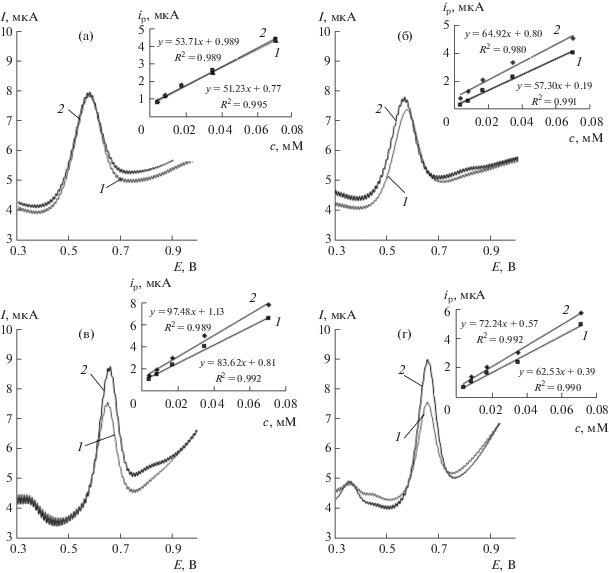
Таблица 1.
Характеристики дифференциально-импульсных вольтамперограмм 0.035 мМ растворов D- и L-энантиомеров триптофана на стеклоуглеродных электродах, модифицированных композитами полиариленфталида с α-, β-, γ-циклодектринами, в фосфатном буферном растворе (pH 6.86) при скорости развертки потенциала 20 мВ/с
| Сенсор | Ер, В | Ip, мкА | ∆ip/∆c, мА/М | Предел обнаружения, М | |||
|---|---|---|---|---|---|---|---|
| D | L | D | L | D | L | ||
| СУЭ/ПАФ | 0.58 | 0.58 | 7.77 | 7.76 | 53.71 | 51.23 | 3.2 × 10–6 |
| СУЭ/ПАФ/α-ЦД | 0.58 | 0.57 | 7.46 | 7.72 | 57.30 | 64.92 | 4.0 × 10–6 |
| СУЭ/ПАФ/β-ЦД | 0.65 | 0.66 | 7.39 | 8.75 | 83.62 | 98.48 | 4.0 × 10–6 |
| СУЭ/ПАФ/γ-ЦД | 0.65 | 0.66 | 7.42 | 8.83 | 62.53 | 72.24 | 7.0 × 10–6 |
Стандартные градуировочные графики (вставки на рис. 4) показывают, что СУЭ, модифицированные ПАФ-композитами с α-, β- и γ-ЦД, проявляют энантиоселективность по отношению к энантиомерам Трп в исследованном диапазоне концентраций. Наиболее заметные различия между откликами энантиомеров Трп наблюдаются на электродах, модифицированных ПАФ-композитами с β- и γ-ЦД. В табл. 2 приведены результаты ДИВ-определений энантиомеров Трп на СУЭ, модифицированных ПАФ-композитами с α-, β- и γ-ЦД в фосфатном буферном растворе с рН 6.86 при скорости развертки потенциала 20 мВ/с (n = 4, P = 0.95). Предел обнаружения оценивали по 3s-критерию.
Таблица 2.
Результаты (мМ) определения энантиомеров триптофана методом дифференциально-импульсной вольтамперометрии на стеклоуглеродных электродах, модифицированных композитами полиариленфталида с α-, β-, γ-ЦД в фосфатном буферном растворе (pH 6.86) при скорости развертки потенциала 20 мВ/с (n = 4, P = 0.95)
| Сенсор | Введено | Найдено | sr, % | |||
|---|---|---|---|---|---|---|
| D-Трп | L-Трп | D-Трп | L-Трп | D-Трп | L-Трп | |
| СУЭ/ПАФ/α-ЦД | 30 | 30 | 29 ± 3 | 28 ± 2 | 7.3 | 5.5 |
| 50 | 50 | 52 ± 2 | 53 ± 2 | 2.3 | 3.3 | |
| СУЭ/ПАФ/β-ЦД | 30 | 30 | 29 ± 2 | 30 ± 3 | 3.4 | 3.9 |
| 50 | 50 | 49 ± 2 | 52 ± 3 | 2.4 | 3.2 | |
| СУЭ/ПАФ/γ-ЦД | 30 | 30 | 29 ± 2 | 30 ± 2 | 1.9 | 3.9 |
| 50 | 50 | 50 ± 1 | 50 ± 3 | 6.1 | 4.0 | |
Таким образом, модифицированные ПАФ-композитами с α-, β- и γ-ЦД СУЭ можно использовать в качестве энантиоселективных сенсорных платформ для селективного распознавания и высокочувствительного определения энантиомеров Трп. Однако, как видно из рис. 1, вольтамперограммы энантиомеров Tрп на СУЭ, модифицированных ПАФ-композитами с α-, β- и γ-ЦД, отличаются друг от друга незначительно. Такая проблема характерна и для других энантиоселективных электродов, модифицированных полимерами, наночастицами, углеродными нанотрубками, графеном и т.д. [15, 16, 18, 19]. Для надежного распознавания энантиомеров Трп вольтамперограммы обрабатывали с использованием хемометрических методов, в частности, метода главных компонент (МГК) [33, 34]. В отличие от классического подхода, когда из имеющегося массива экспериментальных данных учитываются только токи пиков или потенциалы, при хемометрической обработке вольтамперограмм с помощью МГК рассматривается вся вольтамперограмма, то есть вся матрица экспериментальных данных.
Следует отметить, что для вольтамперограмм энантиомеров Трп, полученных при регистрации кривых при последовательных измерениях, почти во всех случаях наблюдается дрейф аналитического сигнала. Этот эффект наиболее выражен, когда регистрируется большое количество измерений без обновления поверхности электрода как на этапе градуировки (тренировки) сенсорной системы, так и на стадии распознавания энантиомеров, поскольку поверхность электрода изменяется после большого числа измерений [11, 35]. В результате энантиомеры могут быть распознаны ошибочно или вовсе отклонены. В отличие от многих сенсоров, предложенных для распознавания и определения энантиомеров Трп, СУЭ, модифицированные ПАФ-композитами с α-, β- и γ-ЦД, стабильны в водных растворах и их свойства практически не изменяются в течение длительного времени.
Результаты хемометрической обработки вольтамперограмм, зарегистрированных на отдельных композитных ПАФ-электродах (α-, β- или γ-ЦД), показаны на рис. 5. Кластеры (данные последовательных измерений) на графиках счетов в координатах ГК1−ГК2 пересекаются друг с другом (рис. 5a–5в), что не позволяет надежно распознать энантиомеры Трп. Для повышения вероятности распознавания энантиомеров Трп использовали сенсорную систему с тремя индикаторными электродами, модифицированными ПАФ-композитами с α-, β- и γ-ЦД, обладающими перекрестной чувствительностью к D- и L-энантиомерам Трп. В этом случае хемометрически обрабатывали массив экспериментальных данных, содержащих значения мгновенных токов, полученных при регистрации последовательных вольтамперограмм на всех индикаторных электродах. Для хемометрической обработки вольтамперограмм использовали программное обеспечение Chemometrics для Microsoft Excel [34].
Рис. 5.
Графики счетов МГК-моделирования дифференциально-импульсных вольтамперограмм 0.035 мМ растворов D- и L-триптофана на СУЭ/ПАФ/α-ЦД (а), СУЭ/ПАФ/β-ЦД (б), СУЭ/ПАФ/γ-ЦД (в) и с использованием трехэлектродной сенсорной системы (г).
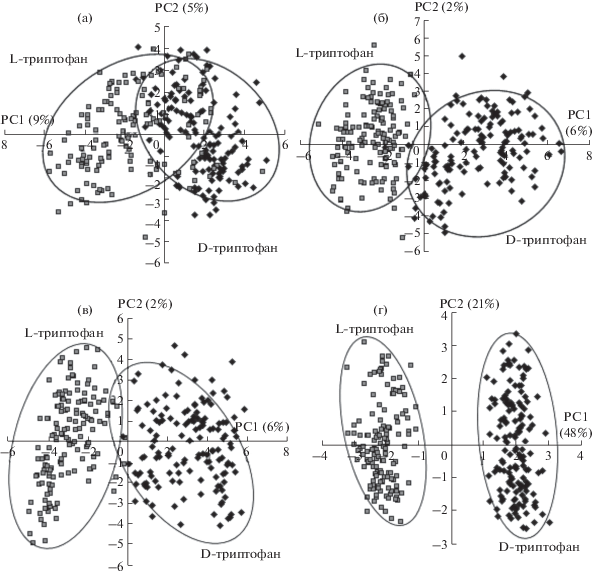
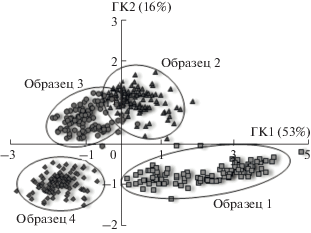
Рис. 6.
График счетов МГК-моделирования дифференциально-импульсных вольтамперограмм 0.035 мМ растворов L-триптофана различных производителей с использованием трехэлектродной сенсорной системы.
На рис. 5г показано, что при использовании трех индикаторных электродов кластеры на плоскости главных компонент не пересекаются друг с другом. Для распознавания энантиомеров Трп использовали метод проекции на латентные структуры с дискриминантным анализом (ПЛС-ДА). Наборы тестовых образцов и образцов сравнения готовили независимо друг от друга. Использование единичных СУЭ, модифицированных ПАФ-композитами с α-, β- и γ-ЦД, для распознавания энантиомеров Трп в 50% случаев приводит к ошибкам второго рода (т.е. к принятию неверного энантиомера за заданный) для α-ЦД и в 40% случаев – для γ-ЦД (табл. 3). Доля ошибочных результатов меньше для СУЭ, модифицированного ПАФ-композитами с β-ЦД, что обусловлено существенными различиями между константами связывания энантиомеров Трп с β-ЦД [21, 22]. При использовании сенсорной системы с тремя СУЭ, модифицированными ПАФ-композитами с α-, β- и γ-ЦД, ошибки первого рода (неправильное отнесение распознаваемого энантиомера) практически отсутствуют, а ошибки второго рода сводены к минимуму. В этом случае были правильно распознаны 99% тестируемых образцов.
Таблица 3.
Дискриминационные отклики ПЛС-ДА-модели для D- и L-триптофана на стеклоуглеродных электродах, модифицированных композитами полиариленфталида с α-, β-, γ-циклодекстринами, и с использованием сенсорной системы (n = 4, P = 0.95)
| Сенсор | СУЭ/ПАФ/α-ЦД | СУЭ/ПАФ/β-ЦД | СУЭ/ПАФ/γ-ЦД | Трехэлектродная сенсорная система | ||||
|---|---|---|---|---|---|---|---|---|
| D-Трп* | L-Трп* | D-Трп* | L-Трп* | D-Трп* | L-Трп* | D-Трп* | L-Трп* | |
| D-Трп** | 0.99 | 0.03 | 0.96 | 0.04 | 0.60 | 0.40 | 0.99 | 0.01 |
| L-Трп** | 0.58 | 0.42 | 0.01 | 0.89 | 0.17 | 0.99 | 0.11 | 0.99 |
Предложенный метод распознавания энантиомеров Трп апробировали также на реальных образцах пищевых добавок, содержащих вспомогательные вещества (пантотенат кальция, пиридоксин, целлюлозу, диоксиды кремния и титана, желатин и др.). В качестве реальных образцов выбрали содержащие L-Трп препараты разных производителей (Now Foods, Jarrow Formulaulas, Эвалар и Scitec Nutrition). Для распознавания реальных образцов методом ПЛС-ДА в качестве образцов сравнения использовали 0.035 мМ растворы энантиомеров Трп. Реальные образцы, растворы которых имели такие же концентрации, использовали в качестве тестовых образцов. Результаты распознавания представлены в табл. 4. Все тестовые образцы были распознаны как L-Трп. Наилучшие результаты получены для СУЭ/ПАФ/β-ЦД. В данном случае доля распознанных образцов превысила 80%, а ошибки второго рода составили менее 15%. Использование сенсорной системы позволяет увеличить долю распознанных образцов до 100%, а ошибки второго рода свести к минимуму.
Таблица 4.
Дискриминационные отклики ПЛС-ДА-модели препаратов, содержащих L-триптофан, на модифицированных композитами полиариленфталида с α-, β-, γ-циклодекстринами стеклоуглеродных электродах, и с использованием сенсорной системы (n = 4, P = 0.95)
| Сенсор | СУЭ/ПАФ/α-ЦД | СУЭ/ПАФ/β-ЦД | СУЭ/ПАФ/γ-ЦД | Трехсенсорная система | ||||
|---|---|---|---|---|---|---|---|---|
| L* | D* | L* | D* | L* | D* | L* | D* | |
| Образец 1** | 0.69 | 0.30 | 0.83 | 0.08 | 0.80 | 0.10 | 1.00 | 0.00 |
| Образец 2** | 0.78 | 0.20 | 0.85 | 0.15 | 0.97 | 0.00 | 0.97 | 0.07 |
| Образец 3** | 0.84 | 0.13 | 0.95 | 0.05 | 0.78 | 0.06 | 1.00 | 0.03 |
| Образец 4** | 0.89 | 0.11 | 0.91 | 0.06 | 0.83 | 0.19 | 0.96 | 0.10 |
В работе [36] показано, что вольтамперометрическая система на основе СУЭ, модифицированных ПАФ с различным числом дифенилентио- и дифениленоксидных фрагментов, позволяет распознать производителей лекарственных средств, содержащих инсулин и его аналоги. Предложенная нами сенсорная система также чувствительна к составу вспомогательных веществ в биологически активных пищевых добавках и лекарственных средствах, содержащих L-Трп, и позволяет распознать производителей. В этом случае вольтамперограммы реальных образцов образуют разные кластеры на графиках счетов при МГК-моделировании (рис. 6). Результаты распознавания представлены в табл. 5. Процент правильно распознанных образцов превысил 80%, а ошибки второго рода составили 11%.
Таблица 5.
Дискриминационные отклики ПЛС-ДА-модели при установлении производителей биологически активных добавок, содержащих L-триптофан, с использованием трехэлектродной сенсорной системы (n = 4, P = 0.95)
| Тестовый образец | Образец сравнения | |||
|---|---|---|---|---|
| 1 | 2 | 3 | 4 | |
| 1 | 0.89 | 0.03 | 0.01 | 0.07 |
| 2 | 0.02 | 0.89 | 0.11 | 0.03 |
| 3 | 0.01 | 0.10 | 0.82 | 0.07 |
| 4 | 0.07 | 0.02 | 0.06 | 0.88 |
При распознавании производителей пищевых добавок, содержащих L-Трп, отбирали пять навесок содержимого капсул (с маркировкой 500 мг Трп) для каждого образца. Часть тестируемого образца, эквивалентную концентрации исходного раствора 1 мМ, переносили в мерную колбу емк. 50 мл и доводили до метки деионированной водой. Полученный раствор тщательно перемешивали в течение 30 мин и центрифугировали. Соответствующее количество раствора разбавляли фосфатным буферным раствором с рН 6.86 и регистрировали ДИВ.
* * *
Таким образом, вольтамперометрическая сенсорная система типа “электронный язык” на основе СУЭ, модифицированных ПАФ-композитами c α-, β- и γ-ЦД, с хемометрической обработкой вольтамперограмм, зарегистрированных на трех электродах, не только позволяет распознать D- и L-энантиомеры Трп в пищевых добавках и лекарственных средствах, но и существенно повышает вероятность распознавания по сравнению с одиночными сенсорами. Кроме того, она позволяет распознать производителей пищевых добавок, содержащих Трп. Вольтамперограммы энантиомеров Трп, преобразованные МГК, могут служить также в качестве “отпечатков пальцев” для контроля качества и происхождения фармацевтических препаратов и пищевых добавок, содержащих Трп. Предложенную сенсорную систему после дополнительных исследований можно использовать для оценки энантиомерной чистоты препаратов, содержащих Трп; потери активности энантиомеров из-за неправильного хранения и транспортировки; истечения срока действия лекарственных средств и пищевых добавок.
Работа выполнена при поддержке РНФ: грант № 16-13-10257.
Список литературы
Илиел Э., Вайлен С., Дойл М. Основы органической стереохимии. Пер. с англ. М.: БИНОМ. Лаборатория знаний, 2007. 703 с.
Gopal R., Seo C.H., Song P.I., Park Y. Effect of repetitive lysine tryptophan motifs on the bactericidal activity of antimicrobial peptides // Amino Acids. 2013. V. 44. P. 645.
Iizuka H., Ishii K., Hirasa Y., Kubo K., Fukushima T. Fluorescence determination of D- and L-tryptophan concentrations in rat plasma following administration of tryptophan enantiomers using HPLC with pre-column derivatization // J. Chromatogr. B. 2011. V. 879. P. 3208.
Wei Y.L., Wang S.F., Shuang S.M., Dong C.A. Chiral discrimination between D- and L-tryptophan based on the alteration of the fluorescence lifetimes by the chiral additives // Talanta. 2010. V. 81. P. 1800.
Zhen Q.N., Xu B.A., Ma L., Tian G., Tang X.F., Ding M. Simultaneous determination of tryptophan, kynurenine and 5- hydroxytryptamine by HPLC: application in uremic patients undergoing hemodialysis // Clin. Biochem. 2011. V. 44. P. 226.
Zhang T., Holder E., Franco P., Lindner W. Method development and optimization on cinchona and chiral sulfonic acid-based zwitterionic stationary phases for enantiomer separations of free amino acids by high-performance liquid chromatography // J. Chromatogr. A. 2014. V. 1363. P. 191.
Taujenis L., Olsauskaite V., Padarauskas A. Enantioselective determination of protein amino acids in fertilizers by liquid chromatography-tandem mass spectrometry on chiral teicoplanin stationary phase // J. Agric. Food Chem. 2014. V. 62. P. 11099.
Li M., Liu X., Jiang F.Y., Guo L.P., Yang L. Enantioselective open-tubular capillary electrochromatography using cyclodextrin-modified gold nanoparticles as stationary phase // J. Chromatogr. A. 2011. V. 1218. P. 3725.
Labuta J., Ishihara S., Sikorsky T., Futera Z., Shundo A., Hanykova L., Burda J.V., Ariga K., Hill J.P. NMR spectroscopic detection of chirality and enantiopurity in referenced systems without formation of diastereomers // Nat. Commun. 2013. № 4. P. 2188.
Майстренко В.Н., Сидельников А.В., Зильберг Р.А. Энантиоселективные вольтамперометрические сенсоры: новые решения // Журн. аналит. химии. 2018. Т. 73. № 1. С. 3. (Maistrenko V.N., Sidel’nikov A.V., Zil’berg R.A. Enantioselective voltammetric sensors: new solutions // J. Analyt. Chem. 2018. V. 73. P. 1.)
Chen Q., Zhou J., Han Q., Wang Y.H., Fu Y.Z. Electrochemical enantioselective recognition of tryptophane enantiomers based on chiral ligand exchange // Coll. Surf. B. 2012. V. 92. P. 130.
Bao L., Tao Y., Gu X., Yang B., Deng L., Kong Y. Potato starch as a highly enantioselective system for temperature-dependent electrochemical recognition of tryptophan isomers // Electrochem. Commun. 2016. V. 64. P. 21.
Gou H., He J., Mo Z., Wei X., Hu R., Wang Y., Guo R. A highly effective electrochemical chiral sensor of tryptophan enantiomers based on covalently functionalize reduced graphene oxide with L-lysine // J. Electrochem. Soc. 2016. V. 163. P. B272.
Li Z., Mo Z., Guo R., Meng S., Wang R., Gao H., Niu X. Electrochemical enantiorecognition of tryptophan enantiomers based on a multi-walled carbon nanotube-hydroxyethyl chitosan composite film // Anal. Methods. 2017. V. 9. P. 5149.
Feng W.L., Liu C., Lu S.Y., Zhang C.Y., Zhu X.H., Liang Y., Nan J.M. Electrochemical chiral recognition of tryptophan using a glassy carbon electrode modified with β-cyclodextrin and graphene // Microchim. Acta. 2014. V. 181. P. 501.
Xu J., Wang Q., Xuan C., Xia Q., Lin X., Fu Y. Chiral recognition of tryptophan enantiomers based on β-cyclodextrin-platinum nanoparticles/graphene nanohybrids modified electrode // Electroanalysis. 2016. V. 28. P. 868.
Zor E., Morales-Narváez E., Alpaydin S., Bingol H., Ersoz M., Merkoçi A. Graphene-based hybrid for enantioselective sensing applications // Biosens. Bioelectron. 2017. V. 87. P. 410.
Xiao Q., Lu S., Huang C., Su W., Zhou S., Sheng J., Huang S. An electrochemical chiral sensor based on amino-functionalized graphene quantum dots/β-cyclodextrin modifed glassy carbon electrode for enantioselective detection of tryptophan isomers // J. Iran. Chem. Soc. 2017. V. 14. P. 1957.
Xiao Q., Lu S., Huang C., Su W., Huang S. Novel N-doped carbon dots/β-cyclodextrin nanocomposites for enantioselective recognition of tryptophan enantiomers // Sensors. 2016. V. 16. P. 1874.
Стид Дж.В., Этвуд Дж.Л. Супрамолекулярная химия. Пер. с англ. Т. 2. М.: Академкнига, 2007. 416 с.
Aachmann F.L., Larsen K.L., Wimmer R. Interactions of cyclodextrins with aromatic amino acids: a basis for protein interactions // J. Incl. Phenom. Macrocycl. Chem. 2012. V. 73. P. 349.
Roy M.N., Ekka D., Saha S., Roy M.C. Host-guest inclusion complexes of α- and β-cyclodextrins with α-amino acids // RSC Advances. 2014. V. 4. P. 42383.
Caso J.V., Russo L., Palmieri M., Malgieri G., Galdiero S., Falanga A., Isernia C., Iacovino R. Investigating the inclusion properties of aromatic amino acids complexing β-cyclodextrins in model peptides // Amino Acids. 2015. V.47. P. 2215.
Lipkowitz K.N., Raghothama S., Yang J. Enantioselective binding of tryptophan by α-cyclodextrin // J. Am. Chem. Soc. 1992. V. 114. P. 1554.
Baldwin E.A., Bai J., Plotto A., Dea S. Electronic noses and tongues: applications for the food and pharmaceutical industries // Sensors. 2011. V. 11. P. 4744.
Zilberg R.A., Sidelnikov A.V., Maistrenko V.N., Yarkaeva Y.A., Khamitov E.M., Kornilov V.M., Maksutova E.I. A voltammetric sensory system for recognition of propranolol enantiomers based on glassy carbon electrodes modified by polyarylenephthalide composites of melamine and cyanuric acid // Electroanalysis. 2018. V. 30. P. 619.
Woertz K., Tissen C., Kleinebudde P., Breitkreutz J. Taste sensing systems (electronic tongues) for pharmaceutical applications // Int. J. Pharm. 2011. V. 417. P. 256.
Rudnitskaya A., Kirsanov D., Blinova Y., Legin E., Seleznev B., Clapham D., Ives R.S., Saunders K.A., Legin A. Assessment of bitter taste of pharmaceuticals with multisensor system employing 3 way PLS regression // Anal. Chim. Acta. 2013. V. 770. P. 45.
Choi D.H., Kim N.A., Nam T.S., Lee S., Jeong S.H. Evaluation of taste-masking effects of pharmaceutical sweeteners with an electronic tongue system // Drug Dev. Ind. Pharm. 2014. V. 40. P. 308.
Сидельников А.В., Майстренко В.Н., Зильберг Р.А., Яркаева Ю.А., Хамитов Э.М. Энантиоселективный вольтамперометрический сенсор для распознавания стереоизомеров пропранолола // Журн. аналит. химии. 2017. Т. 72. № 5. С. 486. (Sidel’nikov A.V., Maistrenko V.N., Zil’berg R.A., Yarkaeva Y.A., Khamitov E.M. An enantioselective voltammetric sensor for the recognition of propranolol stereoisomers // J. Analyt. Chem. 2017. V. 72. P. 575.)
Salazkin S.N., Shaposhnikova V.V., Machulenko L.N., Gileva N.G., Kraikin V.A., Lachinov A.N. Synthesis of polyarylenephthalides prospective as smart polymers // Polym. Sci. A. 2008. V. 50. P. 243.
Zilberg R., Maistrenko V., Kabirova L., Dubrovsky D. Selective voltammetric sensors based on composites of chitosan polyelectrolyte complexes with cyclodextrins for recognition and determination of atenolol enantiomers // Anal. Methods. 2018. V. 10. P. 1886.
Esbensen K.H. Multivariate Analysis − in Practice. Oslo: CAMO Process AS, 2001.
Pomerantsev A.L. Chemometrics in Excel. New York: Wiley, 2014.
Nigmatullin R.R., Budnikov H.C., Sidelnikov A.V. New approach for voltammetry near limit of detection: integrated voltammograms and reduction of measurements to an “ideal” experiment // Electroanalysis. 2015. V. 27. P. 1416.
Зильберг Р.А., Яркаева Ю.А., Максютова Э.И., Сидельников А.В., Майстренко В.Н. Вольтамперометрическая идентификация инсулина и его аналогов с использованием модифицированных полиариленфталидами стеклоуглеродных электродов // Журн. аналит. химии. 2017. Т. 72. № 4. С. 348. (Zilberg R.A., Yarkaeva Y.A., Maksyutova E.I., Sidelnikov A.V., Maistrenko V.N. Voltammetric identification of insulin and its analogues using glassy carbon electrodes modified with polyarylenephthalides // J. Analyt. Chem. 2017. V. 72. P. 402.)
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии