Химия твердого топлива, 2021, № 4, стр. 34-41
ТЕОРЕТИЧЕСКИЕ АСПЕКТЫ АНТИОКСИДАНТНЫХ СВОЙСТВ ГУМИНОВЫХ КИСЛОТ
Т. А. Яркова 1, *, А. М. Гюльмалиев 2, **
1 ФГБОУ ВО Российский экономический университет имени Г.В. Плеханова
117997 Москва, Россия
2 ФГБУН Институт нефтехимического синтеза имени А.В. Топчиева РАН
119071 Москва, Россия
* E-mail: tat772003@list.ru
** E-mail: gyulmaliev@ips.ac.ru
Поступила в редакцию 24.01.2021
После доработки 16.02.2021
Принята к публикации 06.04.2021
Аннотация
Квантовохимическим методом DFTb3lyp с использованием базисного набора dgdzvp проведен расчет энергетических характеристик многостадийных последовательных процессов окисления кислородсодержащими окислителями структурных фрагментов гуминовых кислот. Установлена активность образовавшихся первичных и вторичных радикалов, предложены эффективные пути их нейтрализации. Показано, что гидрохиноновые фрагменты гуминовых кислот эффективны в качестве ингибиторов реакций окисления. Предложены органические фрагменты, введение которых в структуру гуминовых кислот способно усилить их антиоксидантные свойства.
Установление количественной взаимосвязи химического строения и донорно-акцепторных свойств соединений лежит в основе нового научного направления в химии лекарств QSAR (“QuantitativeStructure – ActivityRelationship”), и находит широкое применение в самых различных областях человеческой деятельности [1–3]. Центральное место в процедуре построения моделей типа “структура–свойства” занимает направление исследования научных основ мониторинга концентрации свободных радикалов – чрезвычайно реакционноспособных частиц, которые играют важную роль, прежде всего, в жизнедеятельности живых организмов. Среди первичных радикалов особое место занимает супероксид–анион–радикал молекулы кислорода ${\mathbf{О}}_{2}^{{\bar { \bullet }}}$, образующийся в аэробных клетках в результате присоединения электрона к молекуле кислорода. Супероксид–анион–радикал молекулы кислорода играет ключевую роль в формировании неспецифического иммунитета организма, его выработка активизируется в периоды борьбы с воспалительными процессами. Следовательно, увеличение концентрации этого радикала в организме человека может оказывать благотворное воздействие при лечении заболеваний воспалительной этиологии.
В настоящее время особое внимание уделяется лечению заболеваний биологически активными веществами, выделенными из природных источников. Гуминовые кислоты (ГК), полученные из торфа и бурого угля, обладают доказанной биологической активностью. Известно, что ГК, благодаря своему строению, являются природными антиоксидантами, их использование является одним из перспективных направлений “зеленой” химии для получения биологически активных веществ [4, 5]. ГК относительно легко подвергаются направленной химической модификации для получения новых структур с заданными окислительно-восстановительными свойствами, могут быть использованы в качестве основы для получения новых лекарственных и косметических препаратов, средств защиты и стимуляторов роста растений, эффективных сорбентов [6].
В работе [7] газоволюмометрическим методом доказано, что ГК из бурого угля проявляют выраженные антиоксидантные свойства, являясь эффективными ингибиторами модельных реакций инициированного радикального цепного окисления углеводородов (кумола и этилбензола), что позволило рекомендовать ГК для применения в качестве эффективных антиоксидантов для технических целей и медицины как перспективные биологически активные природные антиоксиданты для разработки новых классов лекарственных препаратов. Количество карбоксильных и фенольных групп в образцах ГК определяли методом потенциометрического титрования.
В работе [8] представлены результаты изучения антиоксидантных свойств ГК пелоидов (торфяных и сапропелевых лечебных грязей) амперометрическим и манометрическим методом. Установлено, что гуминовые пелоидопрепараты обладают антиоксидантными свойствами и могут быть использованы как биологически активные субстанции для лекарственных препаратов, лечения патологий, обусловленных нарушением окислительно-восстановительного гомеостаза организма. Известно, что применение ГК в качестве пищевых добавок вызывает у животных положительные изменения в обменных процессах, которые связаны с регулированием биокаталитических реакций в живых тканях, способствуя более интенсивному синтезу белков и нуклеиновых кислот [6].
Таким образом, поиск новых сырьевых ресурсов биологически активных веществ природного происхождения и разработка на их основе новых биодоступных лекарственных препаратов – актуальная задача [4]. Перспективным направлением является изучение антиокислительной способности ГК. Кроме того, научный поиск в этой области может быть полезен для технических целей в плане разработки антиоксидантов для жидких топлив, технических масел и смазок, а также для продления срока годности некоторых пищевых продуктов [9].
В работе [3] методами квантовой химии функционала энергии от электронной плотности DFTB3LYP/6-31G (d,p) показано, что свойства соединений с признанными антиоксидантными качествами хорошо коррелируют с их индексами реакционной способности. В работе [10] квантово-химическим методом РМ6 исследован самопроизвольный процесс адсорбции молекулярного кислорода на модельной структуре ГК, показано, что кислород хемосорбируется на функциональных группах (карбоксильных, фенольных и спиртовых гидроксилах).
Заметим, что несмотря на наличие исследовательских работ об антиоксидантных свойствах ГК, вопрос о роли отдельных структурных фрагментов в формировании окислительно-восстановительных свойств ГК нуждается в теоретическом обосновании.
Цель данной работы – количественная оценка влияния отдельных фрагментов в структуре ГК на их окислительно-восстановительные свойства. Взаимосвязь антиоксидантных свойств соединений с их химическим строением изучалась на модельных соединениях с применением современных квантово-химических методов расчета. Полученные результаты подводят обоснованную теоретическую базу к имеющимся экспериментальным данным, а также дают возможность планировать синтез по целенаправленной модификации структуры ГК в заданном направлении. В данной работе взаимодействие структурных фрагментов с окислителями исследовали квантово-химическим методом функционала электронной плотности DFTb3lyp с использованием базисного набора dgdzvp (density gauss double-zeta with polarization functions) [7] путем оптимизации всех геометрических параметров молекулы.
Полная электронная энергия Ee молекулы соответствует минимуму энергии системы при фиксированном положении ядер, соответствующих этому минимуму. Энергия низшего колебательного состояния молекулы E0 представляет собой сумму электронной энергии молекулы Ee и энергии гармонических частот, соответствующих локальному минимуму – ΔE(ZPE):
Далее вычисляются значения полных энергий с учетом поправок на энтальпию EH и полных энергий с учетом поправок на свободную энергию Гиббса EG в атомных единицах энергии по следующим формулам:
где Evib – энергия колебательного движения, Erot – энергия вращательного движения, Etrans – энергия поступательного движения, S – энтропия, T – температура, К.Энергии EH и EG определяются при температуре Т = 298.15 К.
В общем случае ГК представляют собой макромолекулы нерегулярного строения [11]. В литературе предлагаются их приближенные структурные модели [11, 12]. Следует отметить, что современные экспериментальные методы физико-химического анализа строения вещества позволяют с высокой достоверностью провести качественное и количественное определение содержания основных функциональных групп ГК, но из-за изменяющегося состава природных соединенийв зависимости от источника извлечения и географических особенностей генезиса, обобщенные модели не теряют свой значимости для выполнения теоретических расчетов и предсказания химической активности в выборе способов направленной химической модификации. В работе [12] предложена методика для построения среднестатистической модели ГК по элементному анализу и ЯМР 1Н-спектрам. Однако для выявления количественных закономерностей связи антиоксидантные свойства ГК с их функциональным составом была выбрана “обобщенная модель ГК” (рис. 1). Такая модель принята по аналогии с обобщенной моделью углей [13], она содержит основные структурные фрагменты, определенные экспериментальным путем [11] и хорошо согласуется с литературными данными.
Макромолекулы ГК состоят из центральной части, содержащей ароматический углеродный скелет, и периферической, обогащенной кислородсодержащими функциональными группами [14]. Гуматы представляют собой комплексы металлов. Существует мнение, что катион-гумусовые комплексы могут играть роль инициаторов или ингибиторов различных процессов в природе [15].
Согласно общепринятым определениям, оксиданты, или окислители, – это свободные радикалы (вещества с нечетным числом электронов), антиоксиданты – вещества, ингибирующие процесс окисления. Природа и происхождение радикалов могут быть весьма различными, но основными окислителями, безусловно, являются кислород и радикалы, произошедшие от его взаимодействия с органическими веществами. Молекулярный кислород вступает в реакцию после перехода в возбужденное состояние, поглощая излучательную энергию hγ (квант света):
Взаимодействие с углеводородами активного кислорода может приводить к образованию двух радикалов – алкильного и гидропероксидного:
Здесь ${\text{O}}_{2}^{*}$ означает возбужденное состояние молекулы O2.
В щелочной среде гидропероксидный радикал ${\text{HO}}_{2}^{{ \bullet - }}$образует супероксид $~{\mathbf{О}}_{2}^{{\bar { \bullet }}}$, обладающий высокой реакционной способностью:
В обратной реакции супероксид взаимодействует с водой в качестве восстановителя, что приводит к образованию двух активных радикалов.
Отметим, что супероксид ${\mathbf{О}}_{2}^{{\bar { \bullet }}}$ – сильный восстановитель, однако ${\text{HO}}_{2}^{ \bullet }$ во многих биологических реакциях может вести себя как окислитель, присоединяя атомы водорода. По этой причине гидропероксидный радикал является одним из основных инициаторов перекисного окисления липидов. Многочисленные экспериментальные исследования процессов окисления органических соединений (условно обозначенных RH) молекулярным кислородом свидетельствуют о том, что окисление всегда протекает по самой слабой С–Н-связи как цепная неразветвленная реакция или как радикально-цепной процесс с вырожденным разветвлением [16].
Антиоксидантные свойства ГК можно оценить по аналогичным свойствами отдельных функциональных групп, входящих в состав этих природных полимеров, исходя из структуры, приведенной на рис. 1. Исследования свойств функциональных групп можно проводить по значениям энергий E0, EH и EG атомов и молекул с учетом мультиплетности М их электронного состояния, вычисляемой по формуле
где ${{S}_{i}}$ – спиновое квантовое число i-го электрона, n – число электронов в химической частице – атоме или молекуле.Молекула кислорода – очень реакционноспособный оксидант, может участвовать в порождении новых радикалов, например:
$ \bullet {\text{О}} - {\text{О}}{\kern 1pt} \bullet $ (бирадикал молекулы кислорода – триплетный кислород),
${{{\text{O}}}_{2}} + {{e}^{ - }} = {\text{О}}_{2}^{{\bar { \bullet }}}$ (супероксид анион-радикал),
${\text{О}}_{2}^{{\bar { \bullet }}} + {{{\text{Н}}}^{ + }}{\text{\;}} = \bullet {\text{О}} - {\text{ОН}}$ (гидроксид-радикал),
$ \bullet {\text{О}} - {\text{ОН}} + {\text{\;}}{{е}^{ - }} = {{{\text{О}}}^{ - }} - {\text{ОН}}$ (гидроксид-анион),
${{{\text{О}}}^{ - }} - {\text{ОН}} + {{{\text{Н}}}^{ + }} = {{{\text{Н}}}_{2}}{{{\text{О}}}_{2}}$ (пероксид водорода).
В табл. 1 приведены расчетные значения энергии различных частиц. Энергия реакции образования ион-радикала супероксида ${\text{О}}_{2}^{{\bar { \bullet }}}$ при захвате электрона в основном триплетном состоянии $^{3}\Sigma _{g}^{ - }$ молекулы составляет
Таблица 1.
Значения энергии Ео, ЕН и EG простых химических частиц с различными зарядами (Q) и мультиплетностью М
| Химическая частица | Заряд и мультиплетность | Значение энергии*, а.е. |
|---|---|---|
| O2$^{3}\Sigma _{g}^{ - }$ | Q = 0; M = 3 | E0 = –150.3467; EH = –150.3434; EG = –150.3667 |
| O2 | Q = 0; M = 1 | E0 = –150.2853; EH = –150.2820; EG = –150.3043 |
| ${\text{O}}_{2}^{{}}{}^{2}{{\Pi }_{g}}$ | Q = 1; M = 2 | E0 = –149.8788; EH = –149.8755; EG = –149.8982 |
| ${\text{О}}_{2}^{{\bar { \bullet }}}$ | Q = –1; M = 2 | E0 = –150.3559; EH = –150.3526; EG = –150.3757 |
| ${{{\text{H}}}^{\centerdot }}$ | Q = 0; M = 2 | E0 = –0.5005; EH = –0.4982; EG = –0.5112 |
| H+ | Q = +1 | E0 = 0.0000; EH = 0.0024; EG = –0.0100 |
| H2 | Q = 0; M = 1 | E0 = –1.166007; EH = –1.162702; EG = –1.1775 |
| H2O | Q = 0; M = 1 | E0 = –76.4146; EH = –76.4108; EG = –76.43226 |
| ${\text{HO}}_{2}^{\centerdot }$ | Q = +1 | E0 = 0.0000; EH = 0.0024; EG = –0.0100 |
| H2O2 | Q = 0; M = 1 | E0 = –1.166007; EH = –1.162702; EG = –1.1775 |
| Fe | Q = 0; M = 5 | E0 = –1263.4471; EH = –1263.4448; EG = –1263.4643 |
| Fe2+ | Q = 2; M = 1 | E0 = –1262.4093; EH = –1262.4070; EG = –1262.4250 |
| Fe3+ | Q = 3; M = 6 | E0 = –1261.2387; EH = –1261.2364; EG = –1261.2561 |
Реакция присоединения электрона (другими словами этот процесс можно определить как “сродство к электрону”) идет с выделением энергии, следовательно, молекула O2 является хорошим акцептором электрона. В то же время процесс отщепления электрона от основного состояния O2, определяемый потенциалом ионизации, является эндотермическим и требует большого количества энергии
Реакция взаимодействия анион-радикала с протоном протекает с выделением большого количества энергии:
Супероксид-радикал может протонироваться до гидропероксидного радикала в результате реакции:
Взаимодействие молекулы O2 в основном электронном состоянии с атомом водорода приводит к тем же продуктам, но с меньшим выделением энергии:
Реакция супероксид-радикала с ионом железа протекает с выделением значительного количества энергии [17]:
Следующая стадия взаимодействия может быть описана уравнением реакции:
После сложения двух реакций получим
Анализ показывает, что в зависимости от условий проведения процесса в роли окислителей с различной реакционной способностью могут выступать как нейтральные молекулы с высоким сродством к электрону и протону, так и радикалы, в том числе анион- и катион-радикалы. Следовательно, эффективность антиоксидантов будет зависеть от наличия в их составе функциональных групп, способных ингибировать эти типы радикалов.
Согласно [8], среди различных функциональных групп ГК хиноидные структуры проявляют наибольшие антиоксидантные свойства, участвуют в процессах биологического окисления. Легкость восстановления хиноидных групп до фенольных объясняется высоким окислительно-восстановительным потенциалом, который может быть увеличен введением электроноакцепторных заместителей, оказывающих влияние на хиноидные группы. Такими заместителями могут быть, в частности, карбоксильные группы, присутствующие в структуре ГК. Восстановление хиноидных групп сопровождается переносом электрона с образованием семихинона, представляющего собой анион-радикал. Присоединение следующего электрона приводит к образованию бирадикала, который, в свою очередь, способен присоединить протоны с превращением в гидрохинон (фенольную группу). Согласно данным табл. 1 и рис. 2, приведена последовательность превращений гидрохинона в хинон, в которой цифрами указано значение ∆Е0 соответствующих реакций (в ккал/моль):
Как видно из приведенных данных, среди указанных реакций превращение семихинона в хинон, идущее с отрывом электрона, энергетически наиболее выгодно. В щелочной среде гидрохинон диссоциирует в дианион гидрохинона [18]. Ниже показано,что, согласно значениям энергий ∆Е0, ∆ЕН и ∆ЕG, реакция превращения гидрохинона в хинон с отрывом атомов водорода от гидроксильных групп должна идти благополучно. Однако эта же реакция с отрывом двух протонов затруднена:
 |
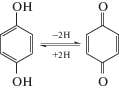 |
| ∆Е0 = –129.5 ккал/моль, | ∆Е0 = 859.1 ккал/моль, |
| ∆ЕН = –131.9 ккал/моль, | ∆ЕН = 858.5 ккал/моль, |
| ∆ЕG = –116.0 ккал/моль. | ∆ЕG = 859.4 ккал/моль. |
На рис. 2 приведены значения энергий ∆Е0, ∆ЕН и ∆ЕG реакции взаимодействия супероксид-иона с гидрохиноном и п-гидроксибензойной кислотой (Е0 = –495.9919 а.е., ЕН = –495.9826 а.е., ЕG = –496.0253 а.е.).
Бианион гидрохинона (при Q = –2 и M = 1, энергия Е0 = –381.2544 а.е., ЕН = –381.2474 а.е., ЕG = –381.2845 а.е.):
На рис. 3 приведены результаты определения энергии взаимодействия супероксид аниона ${\text{О}}_{2}^{{\bar { \bullet }}}$ и гидропероксидного радикала ${\text{HO}}_{2}^{\centerdot }$ с молекулой н-гексана. Видно, что в случае супероксид аниона происходит его адсорбция, при этом в структуре гексана особых изменений не происходит.
Рис. 3.
Энергии (а.е.) взаимодействия н-гексана с радикалами супероксида ${\mathbf{О}}_{2}^{{\bar { \bullet }}}$, гидропероксида ${\text{HO}}_{2}^{\centerdot }$ и протоном.

Однако в случае гидропереоксидного радикала происходит отрыв водорода от гексана с образованием пероксида водорода. При взаимодействии протона Н+ с гексаном продуктами реакции являются молекула водорода и катион гексана (рис. 3). Выбор органических соединений на рис. 2 и 3, используемых для расчета в качестве модельных, обусловлен наличием подобных структур в буроугольных ГК [11].
Поскольку радикалы с нулевым эффективным зарядом могут нейтрализоваться атомом водорода, то в этом случае в качестве антиоксиданта можно предложить молекулы, способные выступать донорами водорода. Примерами могут служить следующие процессы:
– превращение тетралина в нафталин
– образование двойной связи при отрыве водородов от вицинальных третичных атомов углерода:
Отметим, что в этих реакциях передача атомов водорода в реакционную среду происходит поэтапно, что обуславливает превращение донора водорода в стабильную структуру.
На рис. 4 приведена потенциальная поверхность энергии взаимодействия молекул кислорода и бензола. Видно, что устойчивым является состояние, при котором молекула кислорода адсорбируется на соседних углеродных атомах, изменив их гибридное состояние с sp2 на sp3.
Проведенный анализ показывает, что окислительные процессы последовательные и многостадийные. Часто оказывается, что нейтрализация одного типа радикала порождает другой его тип. Теоретические исследования позволяют оценить степень активности первичных и вторичных радикалов, предложить эффективные пути подавления их активности. Поскольку радикалы могут эффективно нейтрализоваться атомом водорода, то в качестве антиоксидантов можно предложить вещества, способные выступать донорами водорода, снова превращаясь в стабильные молекулярные структуры. Примером такого взаимодействия может служить превращение тетралина в нафталин или реакция отрыва водородов от двух соседних третичных углеродных атомов, с образованием двойной связи. Результаты проведенных исследований позволили выявить органические фрагменты, которые при вводе в структуру ГК способны усилить их антиоксидантные свойства.
Список литературы
Zefirov N.S., Palyulin V.A. // J. Chem. Inf. Comput. Sci. 2002. V. 42. № 5. P. 1112.https://doi.org/10.1021/ci020010e
Лазарева Н.В. О количественной связи между структурой органических соединений и их биологической активностью // История химии: область науки и учебная дисциплина. Под ред. Лунина В.В. и Орла В.М. М.: Изд-во МГУ, 2001. С. 60.
Яркова Т.А., Гюльмалиев А.М. // Вестник МГТУ им. Баумана. Сер. Естеств. науки. 2019. № 3. С. 96. [Herald of the Bauman Moscow State Technical University. Ser Natural Sciences, 2019. № 3. P. 96]. https://doi.org/ 10.18698/1812-3368-2019-3-96-104
Перминова И.В., Жилин Д.М. // Сб. науч. статей “Зеленая” химия в России” / Под ред. Лунина В.В., Тундо П., Локтевой Е.С. М.: Изд-во МГУ, 2004. С. 146.
Воронина Л.П., Якименко О.С., Терехова В.А. // Агрохимия. 2012. № 6. С. 45.
Зыкова М.В., Логвинова Л.А., Кривощеков С.В., Воронова О.А., Ласукова Т.В., Братишко К.А., Жолобова Г.А., Голубина О.А., Передерина И.А., Дрыгунова Л.А., Тверякова Е.Н., Белоусов М.В. // Химия раст. сырья. 2018. № 3. С. 239. https://doi.org/10.14258/jcprm.2018033925
Хилько С.Л., Ефимова И.В., Смирнова О.В. // ХТТ. 2011. № 6. С. 3. [Solid Fuel Chemistry. 2011. V. 45. № 6. P. 367].
Аввакумова Н.П., Глубокова М.Н., Катунина Е.Е. // Изв. Самарского науч. Центра РАН. Т. 15. № 3 (3). 2013. С. 1160.
Валуев Л.И., Валуева Т.А., Валуев И Л., Платэ Н.А. // Успехи биологич. химии. 2003. Т. 43. С. 307.
Яркова Т.А., Гюльмалиев А.М. // XTТ. 2020. № 1. С. 11. https://doi.org/10.31857/S0023117721010102
Кухаренко Т.А. Химия и генезис ископаемых углей. М.: Госгортехиздат, 1960. 328 с.
Яркова Т.А., Гюльмалиев А.М. // ХТТ. 2018. № 2. С. 17. [Solid Fuel Chemistry. 2018. V. 52. № 2. P. 73]. https://doi.org/10.3103/S036152191802012Xhttps://doi.org/10.7868/S0023117718020044
Гюльмалиев А.М., Головин Г.С., Гладун Т.Г. Теоретические основы химии угля. М.: МГГУ, 2003. 556 с.
Орлов Д.С. Гумусовые кислоты почв. М.: Изд-во МГУ, 1974. 177 с.
Маслов С.Г., Кусмауль С.А., Воронова О.А., Короткова Е.И. // Химия раст. сырья. 2013. № 4. С. 193. https://doi.org/10.14258/jcprm.1304193
Эммануэль Н.М., Денисов Е.Т., Майзус З.К. Цепные реакции окисления углеводородов в жидкой фазе. М.: Наука, 1965. 376 с.
Koppenol W.H. The Haber-Weiss cycle – 70 years later. Redox Report, 2001. V. 6. P. 229. https://doi.org/10.1179/135100001101536373
Редько А.В. Новый справочник химика и технолога. СПб.: Профессионал, 2006. 1446 с.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива









