Вестник Военного инновационного технополиса «ЭРА», 2023, T. 4, № 3, стр. 245-248
Исследование культивирования Chlorella vulgaris на поверхностных стоках для получения биодизеля
М. Г. Петрова 1, 2, К. В. Горин 1, *
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Московский политехнический университет
Москва, Россия
* E-mail: Gorin_KV@nrcki.ru
Поступила в редакцию 01.11.2023
После доработки 01.11.2023
Принята к публикации 03.11.2023
Аннотация
В течение последних десятилетий ископаемые виды топлива являются доминирующим первичным источником энергии и постоянно используются во всем мире. Исчерпывающая эксплуатация и потребление ископаемых видов топлива постепенно приводят к критическому истощению природных ресурсов. Кроме того, активное использование нефтяного топлива вызывает увеличение уровня парниковых газов в атмосфере посредством выбросов углекислого газа, двуокиси серы, оксидов азота, угарного газа, твердых частиц. Рост индустриализации и уровня жизни общества, повышение экономической и экологической устойчивости являются основными причинами поиска альтернативных источников энергии. Исследованы возможность культивирования микроводоросли Chlorella vulgaris на поверхностных стоках при искусственном освещении и жирнокислотный профиль полученной биомассы.
ВВЕДЕНИЕ
Биодизель из микроводорослей относится к биотопливу третьего поколения и имеет значительный экономический и экологический потенциал для крупномасштабного производства в будущем. В отличие от растений микроводоросли способны аккумулировать больше солнечной энергии в виде химических соединений (до 6%), удаляя из атмосферы CO2 [1, 2]. Способность к росту в соленых и сточных водах расширяет базу для культивирования микроводорослей по сравнению с растительным сырьем, более требовательным к условиям [3].
В связи с этим большое внимание уделяется микроводорослям как ресурсу для производства биотоплива третьего поколения.
Липиды микроводорослей состоят из глицерина, сахаров или оснований, этерифицированных насыщенными или ненасыщенными жирными кислотами (ЖК) (от 12 до 22 атомов углерода) [4].
Культура микроводоросли, пригодная для производства биотоплива, должна иметь высокий уровень накопления биомассы. Необходимая продуктивность по липидам – до 40% от сухого веса, кроме того, необходимо, чтобы липидная составляющая обладала высоким содержанием эфиров насыщенных ЖК [5].
К преимуществам использования культуры Chlorella vulgaris для производства биотоплива относятся высокая скорость ее воспроизводства, высокая фотосинтетическая эффективность, короткий цикл роста, приспособляемость к окружающей среде и высокая продуктивность по липидам [6, 7].
Эффективность использования штамма микроводорослей с целью получения сырья для биодизеля можно оценить, опираясь на результат накопления биомассы и прирост ЖК. Данные показатели можно варьировать, изменяя условия культивирования микроводоросли, такие как состав питательной среды, освещенность, температура, pH, дополнительная аэрация посредством барботирования. Изменение условий культивирования оказывает существенное влияние на качественный и количественный состав липидной составляющей [8].
По физико-химическим свойствам биотопливо не уступает дизельному, а по экологическим и эксплуатационным превосходит его.
При этом есть возможность применения биодизеля как самостоятельно, так и в бинарных смесях с дизельным топливом. Подобные смеси имеют маркировку: В2, В5, В20, В50, В100, где цифра показывает процентное содержание биодизеля.
Благодаря высокому цетановому числу (51–58) в отличие от минерального дизельного топлива (42–45) биодизель с температурой воспламенения выше 100°С позволяет отказаться от применения дополнительных веществ, стимулирующих воспламенение. Кроме того, данный показатель обеспечивает более безопасное использование по сравнению с дизельным топливом.
В биотопливе отсутствуют ароматические соединения, а процентное содержание серы составляет менее 0.001%, что исключает наличие оксидов серы и полициклических ароматических углеводородов в выхлопных газах [8, 9].
В случае протечек и попадания в водные объекты биодизель разлагается с образованием безвредных продуктов. Выявлено, что данное биотопливо способно разложиться на 90% всего за три недели [10].
В настоящей работе исследованы возможность культивирования микроводоросли Chlorella vulgaris на поверхностных стоках при искусственном освещении и жирнокислотный профиль полученной биомассы.
ЭКСПЕРИМЕНТАЛЬНО-МЕТОДИЧЕСКАЯ ЧАСТЬ
В работе использовали культуру микроводоросли Chlorella vulgaris GKV1 из коллекции НИЦ “Курчатовский институт”.
Посевной материал культуры Chlorella vulgaris выращивали на среде BBM [11]. Состав питательной среды ВВМ представлен в табл. 1.
Таблица 1.
Состав питательной среды ВВМ
| Компонент | Концентрация, г/л |
|---|---|
| NaNO3 | 1.25 |
| MgSO4 : MgSO4∙7H2O | 0.5 |
| KH2PO4 | 1.25 |
| M/Э* | 0.5 |
Питательную среду готовили на дистиллированной воде, pH питательной среды доводили до 7.0 с помощью pH-метра путем добавления в среду раствора 10%-го раствора гидроксида натрия. Выращивание проводили в колбах Эрленмейера объемом 250 мл с 150 мл питательной среды с постоянным барботированием атмосферным воздухом. Температуру при культивировании поддерживали на уровне 22 ± 1°C. Культура росла в условиях постоянной искусственной освещенности в течение дня и ночи люминесцентной лампой (20 Вт, 6400 К) при интенсивности 3000 Лк. Также в питательную среду добавляли 0.5 мл/л исходного раствора микроэлементов. Состав исходного раствора микроэлементов представлен в табл. 2.
Таблица 2.
Раствор микроэлементов по Пфеннигу
| Компонент | Концентрация, г/л |
|---|---|
| ЭДТА (трилон Б) | 5 |
| FeSO4∙7 H2O | 2 |
| ZnSO4∙7 H2O | 0.1 |
| MnCl2 | 0.03 |
| H3BO3 | 0.3 |
| CoCl2∙6H2O | 0.2 |
| CuCl2 | 0.01 |
| NiCl2∙2H2O | 0.02 |
| Na2MoO4∙2H2O или NH4MoO4 | 0.02 |
Поверхностные сточные воды собирали в осенний период на территории северо-западного административного округа г. Москвы. Сток воды собирали в пластиковую емкость, отстаивали при комнатной температуре в течение 24 ч. Затем из емкости отбирали необходимое количество и использовали в качестве питательной среды для культивирования C. vulgaris. Контроль культивировали на среде BBM. Все эксперименты проводили в колбах Эрленмейера объемом 500 мл с 250 мл питательной среды в течение 18 сут. Условия проведения были такими же, как в случае получения посевного материала.
Контроль роста культуры осуществляли путем измерения оптической плотности с помощью мультимодального ридера Thermo Scientific Varioskan LUX при длине волны 750 нм, измерения проводили 1 раз в сутки в трех повторах.
Для анализа содержания метиловых эфиров жирных кислот (МЭЖК) необходима лиофильно высушенная биомасса. Сбор биомассы проводили центрифугированием при 7500 об./мин (центрифуга Awel MF 20, ротор AMF 20-8 RFID, Франция) в течение 10 мин при 20°C и дважды промывали дистиллированной водой для удаления адсорбированных солей. Собранную влажную биомассу лиофильно высушивали на лиофильной сушилке FreeZone 2.5 (Labconco, США) в течение 12 ч.
Получение МЭЖК проводили прямым метанолизом согласно методу [12].
Анализ МЭЖК проводили методом газовой хроматографии на газовом хроматографе Bruker 430 GC (Varian Inc. США), снабженном пламенно-ионизационным детектором и кварцевой капиллярной колонкой Select TM Biodiesel (30 м × 0.32 мм × 0.25 мкм). Количество вводимой пробы составляло 1 мкл [13].
МЭЖК идентифицировали по относительному времени удерживания на колонке компонентов смеси в сравнении со стандартом, количественное содержание индивидуальных ЖК определяли методом нормализации площадей.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
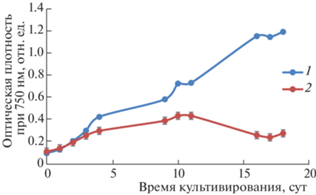
Посев культуры на контрольную питательную среду и поверхностный сток проводили так, чтобы начальная оптическая плотность культуры во всех колбах была равна 0.1 отн. ед. при длине волны 750 нм. Динамика роста культуры в контрольном и опытном образцах была схожей. На 18-е сутки концентрация биомассы, выращенной на среде ВВМ, в 4.3 раза превысила концентрацию микроводорослей, культивируемых на поверхностных сточных водах (рис. 1), что объяснимо более низкими концентрациями питательных веществ в поверхностных стоках.
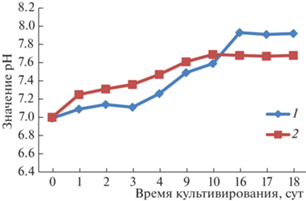
Исходные значения рН для контрольного и опытного образцов были одинаковыми и имели значение 7.0. В обоих случаях наблюдается защелачивание культуральной среды в процессе роста, причем более сильное наблюдалось в контроле. Окончательное значение рН составляло 7.92 и 7.68 для контроля и опыта соответственно (рис. 2).
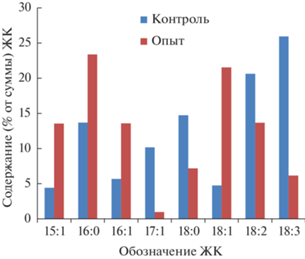
Всего в биомассе было идентифицировано восемь индивидуальных ЖК. Были выявлены значительные различия в концентрациях ЖК в опытном и контрольных образцах: в опытном наблюдалось значительное увеличение мононенасыщенных – пентадеценовой (15:1), пальмитолеиновой (16:1) и олеиновой (18:1) ЖК, и уменьшение полиненасыщенных – линолевой (18:2) и леноленовой (18:3) ЖК, также отмечено увеличение пальмитиновой (16:0) и уменьшение стеариновой (18:0) ЖК в опытном образце (рис. 3).
Рис. 3.
Распределение процентного содержания жирных кислот (15:1 – пентадеценовая, 16:0 – пальмитиновая, 16:1 – пальмитолеиновая, 17:1 – гептадеценовая, 18:0 – стеариновая; 18:1 – олеиновая, 18:2 – линолевая, 18:3 – линоленовая).
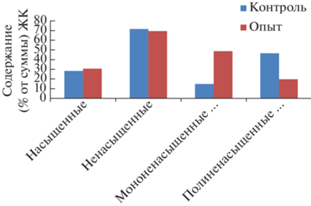
Общее содержание насыщенных и ненасыщенных ЖК в контрольном и опытном образце различалось незначительно, однако отметим, что содержание мононенасыщенных ЖК было выше на 69.5%, а полиненасыщенных ЖК ниже на 57.4% в опытном образце, чем в контроле. Коэффициент ненасыщенности при культивировании на среде BBM составляет 2.51, при культивировании на поверхностных сточных водах – 2.27 (рис. 4).
ЗАКЛЮЧЕНИЕ
Показана возможность культивирования Chlorella vulgaris на поверхностных сточных водах в лабораторных условиях.
Рост культуры на поверхностных сточных водах происходит не так активно, как на среде BBM, и на 18-е сутки уступает контролю в 4.3 раза. Также замена питательной среды на поверхностные стоки сказывается на жирно-кислотном составе биомассы: содержание мононенасыщенных ЖК было выше на 69.5%, а полиненасыщенных ЖК ниже на 57.4% в опытном образце, чем в контроле.
Работа выполнена в рамках тематического плана 5п.3.4 “Разработка платформенных технологий на основе фототрофных микроорганизмов для интенсивной утилизации СО2 и производства биотоплив и других полезных продуктов”.
Список литературы
Sharma A.K., Sahoo P.K., Singhal S., Joshi G. // Biores. Technol. 2016. V. 216. P. 793. https://doi.org/10.1016/j.biortech.2016.06.013
Горин К.В. // Вестник ВИТ “ЭРА”. 2021. Т. 2. № 2. С. 5.
Karpagam R., Raj K.J., Ashokkumar B., Varalakshmi P. // Biores. Technol. 2015. V. 188. P. 177. https://doi.org/10.1016/j.biortech.2015.01.053
Spolaore P., Joannis-Cassan C., Duran E., Isambert A. // J. Biosci. Bioeng. 2006. V. 101. № 2. P. 87. https://doi.org/10.1263/jbb.101.87
Yang J., Xu M., Zhang X. et al. // Biores. Technol. 2011. V. 102. № 1. P. 159. https://doi.org/10.1016/j.biortech.2010.07.017
Carvalho A.P., Meireles L.A., Malcata F.X. // Biotechnol. Prog. 2006. V. 22. № 6. P. 1490. https://doi.org/10.1021/bp060065r
Марков С.А. // Альтернативная энергетика и экология. 2009. Т. 70. № 2. С. 83.
Hu Q., Sommerfeld M., Jarvis E. et al. // Plant J. 2008. V. 54. № 4. P. 621. https://doi.org/10.1111/j.1365-313X.2008.03492.x
Гафурова Н.М., Хисматулин Р.Х. // Инновационная наука. 2016. № 5. С. 72.
Таманджа И., Шуйтасов Н.Н. // Вестник АГТУ. Сер.: “Морская техника и технология”. 2011. № 1. С. 147.
Yeh K., Chang J. // Biores. Technol. 2012. V. 105. P. 120. https://doi.org/10.1016/j.biortech.2011.11.103
Liu J., Liu Y., Wang H., Xue S. // Technol. 2015. V. 176. P. 284. https://doi.org/10.1016/j.biortech.2014.10.094
Сергеева Я.Э., Мостова Е.Б., Горин К.В. и др. // Биотехнология. 2017. Т. 33. № 1. С. 53.
Дополнительные материалы отсутствуют.
Инструменты
Вестник Военного инновационного технополиса «ЭРА»