Вестник Военного инновационного технополиса «ЭРА», 2023, T. 4, № 2, стр. 128-132
Исследование влияния различной концентрации азота в питательной среде на рост и состав жирных кислот микроводоросли Chlorella vulgaris при использовании естественного освещения
К. В. Горин 1, *, В. М. Пожидаев 1
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: Gorin_KV@nrcki.ru
Поступила в редакцию 06.07.2023
После доработки 06.07.2023
Принята к публикации 05.10.2023
Аннотация
Фотосинтезирующие микроорганизмы относят к перспективным возобновляемым источникам получения различных ценных продуктов, таких как протеины, липиды, углеводы, пигменты, антиоксиданты и др. Проведены исследования по культивированию микроводоросли Chlorella vulgaris GKV 1 на питательной среде с различной концентрацией азота при естественном освещении. Рассмотрено влияние концентрации азота на рост и изменение рН культуральной среды в процессе выращивания, а также состав индивидуальных жирных кислот в полученной биомассе.
ВВЕДЕНИЕ
В настоящее время микроводоросли считаются одним из основных возобновляемых источников получения биодизеля благодаря преимущестам перед остальным сырьем: они обладают высокой утилизирующей способностью диоксида углерода и его накоплением в своей бимомассе, высокой скоростью роста и продуктивностью, неприхотливостью и др. [1].
При оптимальных условиях культивирования достигается относительно небольшое количество образующихся липидов в биомассе микроводорослей. Недавние исследования, направленные на решение таких серьезных проблем, как осмотический стресс, регулирование pH, питательный стресс, применение химических реагентов, влияние температуры и тяжелых металлов, были проведены, чтобы разработать и определить эффективные стратегии для увеличения содержания липидов в биомассе микроводорослей. Кроме того, активно разрабатываются генетические манипуляции для индукции выработки липидов микроводорослями. Однако широко используемым методом для индукции выработки липидов микроводорослями является ограничение основных питательных веществ, таких как азота, в среде культивирования [2]. Дефицит азота и фосфора ингибирует рост Chlamydomonas приблизительно на 30% и в то же время значительно увеличивает содержание липидов [3]. В [4] показано, что ограничение по источнику азота в течение культивирования Scenedesmus quadricauda приводит к увеличению более чем в 2 раза выхода липидов (226 мг/л) по сравнению с условиями с достаточным количеством азота (99.3 мг/л). В условиях недостатка азота Chlorella vulgaris, Chlorella zofingiensis, Neochloris oleoabundans и Scenedesmus obliquus накапливали более 35% триацилглицеридов от общего количества высушенной биомассы [5].
В [6] были применены два подхода по ограничению источника азота: двустадийный, при котором выращивание C. vulgaris осуществлялось на богатой азотом среде для стимуляции роста, а затем выросшую культуру помещали в бедную по азоту среду, и одностадийный, при котором засев культуры осуществлялся в питательную среду с необходимым содержанием источника азота, который расходовался по мере роста культуры и истощался к концу культивирования. Для обоих подходов характерно то, что накопление биомассы и липидов зависело от культивируемого вида микроводоросли.
В данной работе рассматривается влияние различной концентрации азота в питательной среде на рост и накопление жирных кислот (ЖК) микроводорослью Chlorella vulgaris, выращенной при естественном освещении.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали культуру микроводоросли Chlorella vulgaris GKV 1 из коллекции НИЦ “Курчатовский институт”, широко используемую для различных исследовательских задач.
Микроводоросль C. vulgaris выращивали в конических колбах Эрленмейера объемом 250 мл со 150 мл питательной среды BG-11 [7]. В питательную среду добавляли в количестве 1 мл на 1 мл среды стоковый раствор микроэлементов [8]. Состав питательной среды и стокового раствора микроэлементов представлен в табл. 1 и 2 соответственно. рН питательной среды доводили до 7.0. Температура при культивировании составляла 16–18 ± 1°С, а освещенность – 500–600 Лк в течение светового дня. Колбы располагали перед оконным проемом на расстоянии 5 см.
Таблица 1.
Состав питательной среды BG-11
| Компонент | Концентрация, г/л |
|---|---|
| NaNO3 | 1.5 |
| KH2PO4 | 0.04 |
| MgSO4. 7H2O | 0.075 |
| CaCl2. 2H2O | 0.036 |
| Na2СO3 | 0.02 |
Таблица 2.
Состав стокового раствора микроэлементов
| Компонент | Концентрация, г/л |
|---|---|
| ЭДТА | 5 |
| FeSO4 · 7H2O | 2 |
| ZnSO4 · 7H2O | 0.1 |
| MnCl2 | 0.03 |
| H3BO3 | 0.3 |
| CoCl2 · 6H2O | 0.2 |
| CuCl2 | 0.01 |
| NiCl2 · 2H2O | 0.02 |
| Na2MoO4 · 2H2O | 0.02 |
В эксперименте по культивированию микроводоросли использовали ту же среду, что и для получения посевного материала, но с изменением концентрации нитрата натрия (NaNO3): 1, 2, 6 и 10 мМ. pH питательной среды также доводили до 7.0.
Образцы культивировали в течение 21 сут при естественном освещении (интенсивность освещения 390–520 Лк) и комнатной температуре (18 ± 1°C), перемешивание осуществляли путем барботирования атмосферным воздухом со скоростью 200 мл/мин. Контроль роста культуры осуществляли путем измерения оптической плотности на спектрофотометре Thermo Scientific Genesys 10s UV-Vis при длине волны 750 нм.
Для анализа содержания метиловых эфиров жирных кислот (МЭЖК) необходима лиофильно высушенная биомасса. Сбор биомассы проводили центрифугированием при 7500 об./мин (центрифуга Awel MF 20, ротор AMF 20-8 RFID, Франция) в течение 10 мин при 20°C и дважды промывали дистиллированной водой для удаления адсорбированных солей. Собранную влажную биомассу лиофильно высушивали на лиофильной сушилке FreeZone 2.5 (Labconco, США) в течение 12 ч.
Получение МЭЖК проводили прямым метанолизом согласно [9].
Анализ МЭЖК проводили методом газовой хроматографии на газовом хроматографе Bruker 430 GC (Varian Inc. США), снабженном пламенно-ионизационным детектором и кварцевой капиллярной колонкой Select TM Biodiesel (30 м × 0.32 мм × 0.25 мкм). Количество вводимой пробы – 1 мкл [10].
МЭЖК идентифицировали по относительному времени удерживания на колонке компонентов смеси в сравнении со стандартом, количественное содержание индивидуальных ЖК определяли методом нормализации площадей.
Определение абсолютно сухого вещества биомассы проводили высушиванием образца до постоянного веса.
В предварительно взвешенный стеклянный бюкс помещали точную навеску влажной биомассы и выдерживали в сушильном шкафу при температуре 95°С в течение 2 ч. Далее образец биомассы охлаждали до комнатной температуры в эксикаторе над слоем хлорида кальция, взвешивали и повторно выдерживали в сушильном шкафу в течение 45 мин, после чего образец охлаждали и взвешивали.
Количество выросшей биомассы (X) определяли по формуле
где X0 и X – количество биомассы в начале и конце культивирования соответственно.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
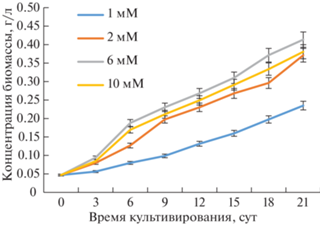
Культивирование проходило в весенний период (март), средняя продолжительность светового дня составляла 11.5 ч (рис. 1, 2). Изначально все образцы с различной концентрацией нитрата натрия засевали культурой C. vulgaris до достижения одинаковой оптической плотности 0.1 при 750 нм. Для различных концентраций нитрата натрия в среде характерна одинаковая закономерность постепенного роста. Максимальный рост по биомассе отмечался при концентрации 6 мМ нитрата натрия в питательной среде, минимальный – при 1 мМ (рис. 3).
Рис. 1.
Засеянные образцы с различной концентрацией нитрата натрия: 1, 2 – 1; 3, 4 – 2; 5, 6 – 6; 7, 8 – 10 мМ.

Рис. 2.
Рост культуры C. vulgaris на 21-е сутки культивирования: 1, 2 – 1; 3, 4 – 2; 5, 6 – 6; 7, 8 – 10 мМ.

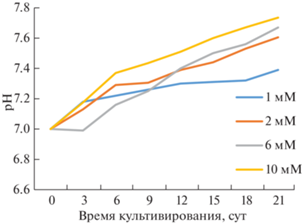
Исходные значения рН для всех вариантов сред были одинаковыми и составляли 7.0. Для всех исследуемых образцов отмечено защелачивание культуральной среды в процессе роста. Наибольшее изменение рН наблюдалось при концентрации азота в среде 10 мМ, наименьшее – при 1 мМ (рис. 4).
Всего в биомассе было идентифицировано семь индивидуальных ЖК. Сильных различий в концентрациях ЖК при различном содержании азота в среде не наблюдалось. Отметим, что наибольшее содержание пальмитиновой кислоты, олеиновой и линоленовой и наименьшее гептадеценовой и линолевой наблюдалось при концентрации азота 1 мМ (рис. 5). Среди всех ЖК больше всего во всех образцах содержалось линоленовой кислоты (18:3), затем стеариновой (18:0) и пальмитиновой кислот (16:0).
Рис. 5.
Содержание индивидуальных жирных кислот в биомассе C. vulgaris (16:0 – пальмитиновая, 16:1 – пальмитолеиновая, 17:1 – гептадеценовая, 18:0 – стеариновая, 18:1 – олеиновая, 18:2 – линолевая, 18:3 – линоленовая кислота).

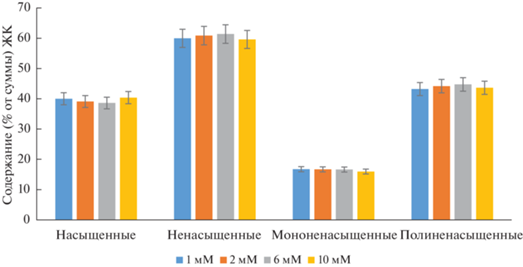
При рассмотрении отдельных групп ЖК отмечено, что наибольшее количество насыщенных и наименьшее ненасыщенных ЖК содержалось в образце с концентрацией азота 10 мМ (рис. 6).
В стандартах и требованиях к биодизелю существует ряд ограничений по профилю образующих его ЖК. Основой подобных ограничений, содержащихся, например, в стандарте EN 14214, является увеличение степени ненасыщенности липидов, приводящее к снижению цетанового числа [10]. С этой позиции наиболее предпочтительно получение биомассы при содержании азота в питательной среде 10 мМ.
В [11] при культивировании C. vulgaris при различной концентрации азота в питательной среде, но при искусственном освещении также было выявлено семь ЖК, аналогичных идентифицированным. Конечные плотности культуры были выше и достигались за меньшее время культивирования за счет использования постоянного искусственного освещения, более высокой температуры и подачи газо-воздушной смеси с 2% CO2. В исследовании олеиновая (18:1), пальмитиновая (16:0) и линоленовая кислоты (18:3) также преобладали в биомассе. Отметим, что полученные данные (содержание насыщенных ЖК меньше ненасыщенных во всех образцах) согласуются с данными, представленными в [11].
В исследовании [12] представлено подтверждение, что уровень ненасыщенных ЖК увеличивается при низких температурах, а насыщенных ЖК – при высоких температурах. Это объясняется тем, что при более низких температурах содержание растворенного кислорода больше, и кислородзависимые ферменты, десатуразы, могут эффективно работать [6, 13].
ЗАКЛЮЧЕНИЕ
Показана возможность эффективного культивирования C. vulgaris при естественном освещении. Максимальное содержание бимассы в количестве 0.4 г/л соответствует содержанию азота 6 мМ в питательной среде. В полученной биомассе было идентифицировано семь индивидуальных ЖК, преобладали линоленовая (18:3), стеариновая (18:0) и пальмитиновая (16:0) кислоты. Показано, что для получения биодизеля более подходящей является биомасса, выращенная при естественном освещении на питательной среде с содержанием азота 10 мМ.
Работа выполнена в рамках тематического плана “Разработка платформенных технологий на основе фототрофных микроорганизмов для интенсивной утилизации СО2 и производства биотоплив и других полезных продуктов”.
Список литературы
Горин К.В. // Вестник инновационного технополиса “ЭРА”. 2021. Т. 2. № 2. С. 5.
Arguelles E.D., Martinez-Goss M.R. // J. Appl. Phycol. 2021. V. 33. P. 1. https://doi.org/10.1007/s10811-020-02126-z
Yang L., Chen J., Qin S. et al. // Biotechnol. Biofuels. 2018. V. 11. P. 1. https://doi.org/10.1186/s13068-018-1041-z
Anand J., Arumugam M. // Bioresour Technol. 2015. V. 188. P. 190. https://doi.org/10.1016/j.biortech.2014.12.097
Breuer G., Lamers P.P., Martens D.E. et al. // Bioresour. Technol. 2012. V. 124. P. 217. https://doi.org/10.1016/j.biortech.2012.08.003
Minhas A.K., Hodgson P., Barrow C.J., Adholeya A. // Front. Microbiol. 2016. V. 7. P. 1. https://doi.org/10.3389/fmicb.2016.00546
Alves D., Guimarães L., Sueira J. et al. // Environ. Technol. Innov. 2022. V. 25. P. 102204. https://doi.org/10.1016/j.eti.2021.102204
Gorin K., Badranova G., Gotovtsev P. et al. // IOP Conf. Ser. Mater. Sci. Eng. 2018. V. 292. P. 012051. https://doi.org/10.1088/1757-899X/292/1/012051
Liu J., Liu Y., Wang H. et al. // Technol. 2015. V. 176. P. 284. https://doi.org/10.1016/j.biortech.2014.10.094
Сергеева Я.Э., Мостова Е.Б., Горин К.В. и др. // Биотехнология. 2017. Т. 33. № 1. С. 53.
Farooq W., Naqvi S.R., Sajid M. et al. // J. Biotechnol. 2022. V. 345. P. 30. https://doi.org/10.1016/j.jbiotec.2021.12.014
Liu X.J., Jiang Y., Chen F. // Proc. Biochem. 2005. V. 40. P. 371. https://doi.org/10.1016/j.procbio.2004.01.018
Ward O.P., Singh A. // Proc. Biochem. 2005. V. 40. P 3627. https://doi.org/10.1016/j.procbio.2005.02.020
Дополнительные материалы отсутствуют.
Инструменты
Вестник Военного инновационного технополиса «ЭРА»