Вестник Военного инновационного технополиса «ЭРА», 2022, T. 3, № 2, стр. 136-144
ВЗАИМНОЕ ВЛИЯНИЕ НЕРВОВ И СОСУДОВ В ПРОЦЕССЕ РАЗВИТИЯ И РЕГЕНЕРАЦИИ ТКАНЕЙ И МОДЕЛИРОВАНИЕ ЭТИХ ВЗАИМОДЕЙСТВИЙ В ЭКСПЕРИМЕНТЕ IN VITRO И EX VIVO
М. М. Михайлова 1, *, А. А. Пантелеев 1, **
1 Научный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: mashulenka79@yahoo.com
** E-mail: a.a.pantel@gmail.com
Поступила в редакцию 09.03.2022
После доработки 09.03.2022
Принята к публикации 20.03.2022
Аннотация
Кровеносная система, доставляющая к органам кислород и питательные вещества, является одной из важнейших систем организма. В эмбриогенезе развитие кровеносной и нервной систем тесно связано. Во взрослом организме при регенерации нервной системы эта взаимосвязь также играет важную роль: выживаемость нервных клеток и спраутинг аксонов сильно зависят от состояния сосудов в месте повреждения. В настоящей работе рассмотрено взаимное влияние нервов и сосудов в процессе эмбриогенеза и во взрослом организме при ранозаживлении. Особое внимание уделено процессам, происходящим при повреждениях спинного мозга. Дан обзор in vitro- и ex vivo-моделей, позволяющих изучать взаимное влияние нервных клеток и клеток сосудов в экспериментальных условиях.
ОГЛАВЛЕНИЕ
Введение
1. Ангиогенез и иннервация в эмбриогенезе
2. Взаимодействие нервов и сосудов во взрослом организме при повреждениях нервной системы
2.1. Про-ангиогенные факторы, гены которых активируются в СМ после травмы
2.2. Сосуды как направляющие для роста аксонов в нервной системе
2.3. Роль эндотелиальных клеток в уничтожении остатков миелина при повреждении нервной ткани
2.4. Эндотелиальные клетки как источник ростовых факторов для периферических нервов
3. Взаимодействие нервов и сосудов – экспериментальное моделирование in vitro и ex vivo
3.1. In vitro-модели взаимодействия нервной и сосудистой ткани (клеточные культуры)
3.2. Ex vivo-модели (органотипические культуры)
Выводы
ВВЕДЕНИЕ
Кровеносная система, доставляющая к органам кислород и питательные вещества, а также различные гуморальные факторы, является одной из важнейших систем организма. В свою очередь, нервная система контролирует функции всех тканей и органов и их ответ на действие факторов внешней и внутренней среды. Таким образом, именно эти две системы обеспечивают координацию деятельности отдельных частей организма, что делает его единым целым. Не удивительно, что развитие кровеносной и нервной систем в эмбриогенезе тесно связано и протекает параллельно. Прослеживается эта тесная связь и во взрослом состоянии, особенно в процессе ранозаживления или регенерации тканей, имеющем много сходных черт с процессом формирования тканей и органов в эмбриогенезе. Например, при травмах нервной системы выживаемость нервных клеток и спраутинг аксонов сильно зависят от состояния сосудов в месте повреждения. Хотя физиологическая значимость взаимодействий между элементами кровеносной и нервной систем очевидна, конкретные механизмы этих взаимодействий остаются во многом неясными. Одна из причин этого – недостаток адекватных экспериментальных моделей, позволяющих исследовать сложные межтканевые взаимодействия в стандартизированных условиях лабораторного эксперимента.
В настоящей работе рассмотрены особенности взаимного влияния нервов и сосудов в процессе эмбрионального развития млекопитающих, а также во взрослом организме после травмы и при последующем восстановлении функциональности нервной системы. Особое внимание уделено процессам, происходящим при повреждениях спинного мозга. Взаимодействие нервов и сосудов в головном мозге при обучении или в результате травм представляет собой отдельную сложную тему, которая останется за рамками данного обзора. Помимо межтканевых взаимодействий нервной и сосудистой систем рассмотрим существующие экспериментальные in vitro- и ex vivo- модели, позволяющие изучать взаимное влияние нервных клеток и клеток сосудов.
1. АНГИОГЕНЕЗ И ИННЕРВАЦИЯ В ЭМБРИОГЕНЕЗЕ
Известно, что в раннем эмбриогенезе млекопитающих в нейроэктодерме (дающей начало развитию нервной системы) отсутствуют эндотелиальные клетки или их предшественники (ангиобласты). В эмбрионах мышей миграция ангиобластов и эндотелиальных клеток из окружающих нейроэктодерму мезодермальных тканей начинается после формирования нервной трубки примерно на сроках E8.5–Е10 и приводит к образованию перинейрональной сети сосудов на поверхности нервной трубки [1–3]. Основной сигнальной молекулой, индуцирующей миграцию ангиобластов к нервной трубке, является хорошо известный проангиогенный фактор роста эндотелия сосудов А (VEGF-A), синтезируемый клетками нервной трубки и связывающийся с рецептором VEGFR2 на ангиобластах [4, 5]. Примерно через сутки после начала формирования перинейрональной сети сосудов кровеносные сосуды начинают проникать внутрь нервной трубки, формируя интранейрональную сеть сосудов. Этот процесс, как и при развитии перинейрональной сети сосудов, в значительной степени зависит от экспрессии VEGF-A, источником которого в это время являются преимущественно предшественники нейронов [2]. Помимо VEGF-A сигнальные белки Wnt7a и Wnt7b, а также канонический Wnt-зависимый регуляторный каскад играют важную роль в формировании интранейрональной сети [3]. Однако при васкуляризации ткани важен не только сам факт прорастания в нее сосудов, но и локализация и временной интервал, в течение которого происходит спраутинг сосудов в ткань, т.е. пространственный и временной “паттернинг” сосудов. В 2017 г. был выявлен один из возможных механизмов регуляции ангиогенеза в эмбрионах мыши [6]. В эмбриональный период для правильной васкуляризации спинного мозга важна не только экспрессия проангиогенного V-EGF‑A, но и экспрессия растворимой формы рецептора VEGF-sFlt1(soluble fms-like tyrosine kinase-1). Оказалось, что зона моторных нейронов спинного мозга, несмотря на активную экспрессию VEGF-A, остается не васкуляризированной до стадии эмбрионального развития E12,5. Кроме того, в экспериментах in vitro эмбриональные (Е11,5) экспланты нервной трубки, содержащие моторные нейроны, препятствовали миграции эндотелиальных клеток. Было показано, что экспрессируемый на этом сроке моторными нейронами sFlt1 выполняет роль “ловушки” для активно экспрессирующегося VEGF: связывая VEGF, sFlt1 препятствует взаимодействию VEGF с рецепторами и, следовательно, предотвращает ангиогенез. Таким образом, в присутствии активно экспрессирующегося VEGF область моторных нейронов остается не васкуляризированной до Е12.5, когда экспрессия sFlt1 начинает падать [6].
Важным этапом васкуляризации центральной нервной системы (ЦНС) является формирование гематоэнцефалического барьера (ГЭБ), которое начинается сразу после формирования интранейрональной сосудистой сети [7]. В этом процессе задействованы сигнальные пути с участием Wnt7a (индуцирует экспрессию одного из глюкозных транспортеров – Glut1 – на эндотелиальных клетках) и Wnt7b. Эндотелиальные клетки сосудов, образующие интранейрональную сосудистую сеть, привлекают перициты, а впоследствии сосуды “покрываются” астроцитами. Так формируются нейроваскулярные единицы, входящие в состав ГЭБ [8]. Одним из важнейших механизмов, регулирующих формирование ГЭБ, является сигнальный путь с участием трансформирующего фактора роста β (TGF-β) и αV-β8 интегрина, которые экспрессируются клетками радиальной глии [9].
Иннервация периферических тканей, например кожи, начинается в эмбриогенезе позже, чем их васкуляризация. Продемонстрировано [10], что в кожу конечности эмбриона сенсорные и моторные нейроны проникают примерно на сроке Е13,5, после того, как сформирована первичная капиллярная сеть. Однако на этом сроке еще не прослеживается связь между нервами и сосудами. К Е15,5 нервы уже тесно связаны с сосудами, экспрессирующими артериальные маркеры. Было сделано заключение, что периферические нервы влияют на артериальную дифференцировку эндотелиальных клеток. Более того, в этой же работе было показано, что у мутантных мышей с недостатком периферических нервов наблюдается нарушение васкуляризации. У мышей с таргетными мутациями в гене, кодирующем белок семафорин 3А (ключевой регулятор нейронального паттернинга – SEMA3А), изменялось не только направление роста нервов, но и направление роста сосудов, которые по-прежнему следовали за нервами. Был сделан вывод, что в эмбриогенезе мыши периферические нервы в коже конечности являются направляющими для сосудов, а также определяют тип вновь формирующихся сосудов, индуцируя экспрессию артериальных маркеров [10]. В [11] те же авторы показали, что одним из белков, отвечающих за тесную связь между периферическими нервами и сосудами, является выделяемый нервами хемокин SDF-1 (stromal cell-derived factor), связывающийся с рецептором Cxcr-4 (chemokinereceptortype 4) на эндотелиальных клетках. При этом артериальную дифференцировку эндотелиальных клеток в сосудах, растущих вдоль нервов, индуцирует синтезируемый нервами VEGF-A [11].
Таким образом, в эмбриогенезе прослеживается тесная взаимосвязь между развитием нервной системы и сосудов: в ЦНС сигналы нервной трубки стимулируют миграцию эндотелиальных клеток и последующий васкулогенез, а в периферической нервной системе нервы прорастают в кожу, привлеченные сигналами от уже сформировавшейся капиллярной сети. Однако впоследствии именно периферические нервы определяют направление роста сосудов, а также артериальную дифференцировку клеток сосудов.
2. ВЗАИМОДЕЙСТВИЕ НЕРВОВ И СОСУДОВ ВО ВЗРОСЛОМ ОРГАНИЗМЕ ПРИ ПОВРЕЖДЕНИЯХ НЕРВНОЙ СИСТЕМЫ
Сосуды и нервы оказывают влияние друг на друга не только в эмбриогенезе, но и во взрослом организме. Особенно значимой эта взаимосвязь становится при травмах нервной системы и при ее последующем восстановлении, например после повреждения спинного мозга (СМ). В норме кровоснабжение СМ осуществляется за счет передней спинномозговой артерии (anterior spinal artery) и двух задних спинномозговых артерий (posterior spinal artery), так называемых внешних артерий, дающих начало внутренним артериям [12]. Разные отделы СМ содержат разное количество внутренних артерий. Грудной отдел снабжается кровью хуже, чем шейный и поясничный. Известно также, что плотность капилляров значительно выше в сером веществе, чем в белом. По всей видимости, это связано с бóльшими метаболическими потребностями клеток в сером веществе по сравнению с аксонами в белом веществе. После травмы СМ на смену первичному повреждению, т.е. некрозу тканей, вызванному непосредственно механическим воздействием, приходит вторичное повреждение, которое в значительной степени вызвано повреждением сосудов в месте травмы и сопровождается ишемией, воспалением, накоплением свободных радикалов, образованием глиального рубца и другими процессами [13, 14]. Известно, что в очаге поражения большинство эндотелиальных клеток гибнет в течение первых 24 ч непосредственно из-за механического повреждения, а также из-за набухания в результате активации Ca2+-зависимых катионных Trpm4-каналов [15, 16]. В последующие 48 ч гибель эндотелиальных клеток продолжается, что проявляется в уменьшении количества сосудов и плотности сосудистой сети [17]. Однако в дальнейшем количество сосудов увеличивается [18]. Так, у мыши после травмы СМ спонтанный ангиогенез наблюдается на третий день после повреждения, и к седьмому дню васкуляризация составляет 540% по сравнению с интактной тканью [19]. В работе [16], выполненной на крысах, авторы оценили функциональность образовавшихся после травмы СМ сосудов, а также степень поражения и восстановления сосудов в белом и сером веществе. Оказалось, что через 14 дней после травматического сжатия СМ количество сосудов вокруг очага поражения лишь незначительно отличалось от интактного СМ, в то время как в самом очаге поражения сосудов было меньше. Однако оценка функциональности сосудов показала, что их перфузия снижена либо из-за тромбообразования, либо из-за того, что это еще незрелые сосуды, не имеющие прямой связи с васкулярной сетью. Также было продемонстрировано, что сосуды серого и белого веществ обладают разной чувствительностью к повреждениям. Уже к пятому дню в белом веществе количество сосудов восстановилось до 90%, причем перфузия наблюдалась более чем в 70% сосудов, в то время как в сером веществе к десятому дню перфузировались менее чем 50% сосудов. Таким образом, после повреждения СМ наблюдается образование новых сосудов, однако степень их восстановления и функциональность в сером и белом веществе различается.
2.1. Про-ангиогенные факторы, гены которых активируются в СМ после травмы
Какие молекулярные факторы способствуют ангиогенезу, который, как было сказано выше [16, 19], начинается уже через три дня после повреждения СМ? Работ, посвященных выявлению динамики секреции про-ангиогенных факторов после повреждения СМ, достаточно много. Показано, например, что ростовой фактор VEGF в СМ синтезируется как нейронами, так и астроцитами [20]. Однако после повреждения СМ уровни мРНК и белка VEGF значительно снижаются [20, 21]. Выявлено снижение уровня белка VEGF после травмы СМ также в крови человека [22]. Помимо VEGF ангиогенез стимулируется такими белками, как плацентарный ростовой фактор (PlGF), участвующий в артериогенезе; ангиопоэтин-1 (Ang-1), не влияющий на пролиферацию эндотелиальных клеток, но необходимый для стабилизации сосудов после повреждения [15]; тромбоцитарный фактор роста ВВ (PDGF-BB), который является хемоаттрактантом для перицитов и экспрессируется эндотелиальными клетками, а также некоторыми типами нейронов СМ. Однако в СМ экспрессия генов всех этих белков падает в течение первых трех дней после повреждения, что ставит под сомнение их активную роль в индукции ангиогенеза в первые дни после травмы СМ [21, 23, 24].
Вместе с тем помимо упомянутых выше белков, экспрессия генов которых уменьшается в первые дни после травмы, клетки СМ синтезируют белки, экспрессия генов которых увеличивается в результате повреждения. Так, олигодендроциты, нейроны, астроциты и микроглия в интактном СМ экспрессируют гены проангиогенных факторов роста фибробластов FGFa и FGFb [25], экспрессия которых значительно увеличивается после повреждения СМ [26]. Экспрессия гена фактора роста гепатоцитов (HGF), стимулирующего пролиферацию эндотелиальных клеток и перицитов, также возрастает после травмы СМ [21]. Увеличение уровня HGF после травмы СМ наблюдается и в периферической крови людей [22]. Таким образом, FGF и HGF являются возможными кандидатами на роль индукторов ангиогенеза в первые дни после травмы СМ.
Известно, что помимо классических про-ангиогенных факторов на миграцию и пролиферацию эндотелиальных клеток влияют нейротрофические факторы, такие как нейротрофический фактор мозга (BDNF) и фактор роста нервов (NGF) [27, 28]. Повреждение СМ вызывает повышение уровня этих белков [23, 29–31]. Таким образом, нервные клетки способны влиять на рост сосудов. Недавно был обнаружен еще один нейрональный индуктор ангиогенеза. Им оказался фермент, участвующий в цикле Креббса – лактатдегидрогеназа А (LDHA). Показано, что этот фермент высвобождается из нейронов после их повреждения и связывается с виментином на поверхности эндотелиальных клеток, что, в свою очередь, приводит к фосфорилированию рецептора VEGFR2 и пролиферации эндотелиальных клеток [32]. Таким образом, описан возможный механизм индукции ангиогенеза при повреждении нейронов.
Итак, после травмы СМ наблюдается активное увеличение интенсивности роста сосудов в месте повреждения, однако до сих пор остаются вопросы о физиологической значимости этого процесса – полезен ли он с точки зрения восстановления функциональности СМ или нет. Дело в том, что увеличение количества сосудов далеко не всегда означает их правильное функционирование. Сосуды, формирующиеся в контексте патологии, часто обладают повышенной проницаемостью, а значит, не исполняют роли ГЭБ. В этом случае их наличие и, тем более, активный рост после травмы будут приносить не только пользу, но и вред, являясь “входными воротами” для проникновения в нервную систему провоспалительных молекул, иммунных клеток и других факторов, препятствующих восстановлению ткани. Следовательно, при лечебных воздействиях, направленных на стимуляцию ангиогенеза, важно учитывать не только увеличение количества сосудов, но и их правильное функционирование.
2.2. Сосуды как направляющие для роста аксонов в нервной системе
Подчеркнем, что помимо снабжения тканей питательными веществами и кислородом, а также (как в случае ГЭБ) помимо защиты нервной системы от проникновения иммунных клеток сосуды могут оказывать влияние на нервные клетки другими способами, например играть роль направляющих для роста аксонов [10]. В случае травмы нервной системы сосуды могут оказывать влияние на рост нервов и во взрослом организме. Так, в [19] продемонстрировано, что после повреждения СМ у мышей спраутинг выживших аксонов наблюдается преимущественно вблизи сосудов. Кроме того, скорость роста отдельных аксонов вблизи сосудов значительно выше, чем скорость роста нейритов, не связанных с сосудами [19]. Поскольку продемонстрировано усиление синтеза ламинина и коллагена IV типа в СМ после травмы, можно предположить, что при регенерации СМ синтезируемый клетками сосудов ламинин используется как субстрат для нейронального спраутинга.
Направляющее действие сосудов на рост аксонов обнаружено не только при повреждении ЦНС, но и при регенерации периферических нервов. Так, продемонстрировано взаимное влияние сосудов и нервных клеток при повреждении седалищного нерва [33]. Показано, что гипоксия, возникающая в месте повреждения седалищного нерва, приводит к миграции макрофагов в зону повреждения. Макрофаги в условиях гипоксии начинают активно синтезировать про-ангиогенный фактор VEGF-A, что стимулирует рост новых сосудов в месте повреждения. Шванновские клетки мигрируют вдоль вновь образованных сосудов, создавая направляющие для роста аксонов. Таким образом, если в эмбриогенезе периферических тканей нервы играют роль направляющих для сосудов [10], то во взрослом организме после повреждения периферического нерва уже сосуды направляют рост аксонов.
2.3. Роль эндотелиальных клеток в уничтожении остатков миелина при повреждении нервной ткани
Помимо участия в реваскуляризации и влияния на направление роста нервов недавно было выявлено еще одно свойство эндотелиальных клеток, способствующее восстановлению функциональности нервной ткани после травмы. Эндотелиальные клетки после повреждения СМ могут выполнять фагоцитарную функцию, помогая избавляться от остатков миелина, ингибирующих рост аксонов [34]. Это свойство эндотелия может способствовать регенерации нервной ткани после травмы и восстановлению проводящей функции поврежденных нервов.
2.4. Эндотелиальные клетки как источник ростовых факторов для периферических нервов
Наконец, помимо формирования ГЭБ в ЦНС, контроля роста аксонов и фагоцитарной активности клетки сосудов могут влиять на рост аксонов, синтезируя стимулирующие ростовые факторы. Так, было обнаружено, что эндотелиальные клетки HUVEC стимулируют рост нейритов из дорсальных ганглиев [35]. Авторы выявили ряд ростовых факторов, секретируемых эндотелиальными клетками и поглощаемых сенсорными нейронами при совместном культивировании. Наиболее значимым из выделяемых эндотелиальными клетками факторов оказался BDNF, один из ключевых факторов стимуляции и поддержания процесса развития нейронов.
Таким образом, тесная взаимосвязь между нервами и сосудами прослеживается не только в эмбриогенезе, но и во взрослом организме в процессе регенерации нервной системы.
3. ВЗАИМОДЕЙСТВИЕ НЕРВОВ И СОСУДОВ – ЭКСПЕРИМЕНТАЛЬНОЕ МОДЕЛИРОВАНИЕ IN VITRO И EX VIVO
Возможность экспериментальной оценки посттравматического взаимного влияния нервов и сосудов на лабораторных животных in vivo могла бы послужить основой дальнейшего прогресса в исследовании этих взаимодействий при травме СМ. Однако подобный подход сопряжен со множеством ограничений и трудностей. Во-первых, для проведения экспериментов на СМ животных необходимы специальные хирургические навыки у исследователей, а также длительный и квалифицированный постоперационный уход за экспериментальными животными. Во-вторых, из-за индивидуальных различий и сложности стандартизации процесса нанесения раны для получения достоверных результатов требуется большое количество животных, что значительно увеличивает трудоемкость и стоимость экспериментов. Эти трудности отсутствуют в экспериментах in vitro и ex vivo, но искусственные модельные системы также имеют свои ограничения. В частности, даже в органотипической культуре очень сложно смоделировать весь комплекс клеточных взаимодействий, имеющих место в организме, поскольку в естественной ране всегда есть клетки, мигрирующие к месту повреждения из окружающих тканей (системный фактор). Однако исследования на культурах клеток (in vitro) либо на органотипических культурах (ex vivo), как правило, не имеют задачи исследования какого-либо физиологического процесса в целом, а концентрируются на каком-то его отдельном аспекте или механизме. Например, в [35] авторы ставили своей задачей выявление ростовых факторов, выделяемых эндотелиальными клетками и стимулирующих рост аксонов. Для ее решения достаточно культурального планшета и аналитических наборов для идентификации цитокинов, при этом моделировать движение крови по сосудам не обязательно.
Таким образом, экспериментальные модели in vitro и ex vivo являются эффективным инструментом исследования межтканевых взаимодействий между нервной и сосудистой системами. Выбор конкретного метода и уровня сложности модели должен определяться конкретной экспериментальной задачей.
3.1. In vitro-модели взаимодействия нервной и сосудистой ткани (клеточные культуры)
Подавляющее большинство работ, в которых изучалось взаимодействие нервов и сосудов in vitro и ex vivo, посвящено моделированию работы ГЭБ. Как правило, подобные исследования проводят на ко-культуре нескольких типов клеток, присутствующих в нервной системе и сосудах. Для работы используют специальные культуральные вставки, на одной стороне которых высаживают эндотелиальные клетки, а на другой – астроциты. Вставка помещается в лунку культурального планшета, на дне которой растут нейроны (например, [36, 37]). Другим вариантом подобной ко-культуры является культивирование всех клеток на вставке: на одной ее стороне помещаются эндотелиальные клетки, а на другой – смешанная культура нейронов и астроцитов. Такая модель позволяет исследовать влияние различных веществ на проницаемость искусственного барьера, а также оценивать эффективность новых методов доставки лекарств через ГЭБ [38, 39]. Помимо вставок для исследований свойств ГЭБ используются 3D-in vitro-модели, например ко-культивирование эндотелиальных клеток и астроцитов в матригеле с последующим образованием ГЭБ-подобных структур [38]. Отметим, что подавляющее большинство работ, моделирующих работу ГЭБ in vitro, проведены на клетках, выделенных из головного мозга, а не из СМ. В то же время показано, что, несмотря на сходство строения и функций, ГЭБ головного и спинного мозга различаются по количеству специфических для ГЭБ белков, например ZO-1 и окклюдина (маркеры плотных контактов), а также по проницаемости (ГЭБ в СМ более проницаем, чем в головном мозге) [40].
Совместное культивирование клеток сосудов и нервов не ограничивается моделированием ГЭБ. 2D-культуры (монослой на пластике или специальной подложке) используются также для изучения влияния, оказываемого нервными и эндотелиальными клетками друг на друга. Так, в [41] авторы изучали влияние эндотелиальных клеток на кортикальные нейроны при их совместном культивировании и обнаружили увеличение длины нейритов в присутствии эндотелиальных клеток. В [42] также продемонстрировано, что при культивировании кортикальных нейронов с эндотелиальными клетками ускоряется рост нейритов, и, кроме того, увеличивается частота постсинаптических токов в нейронах.
Помимо ко-культивирования на стекле или в геле ряд работ выполнен с использованием микрофлюидных устройств, содержащих микроканалы [43, 44]. Эти устройства позволяют культивировать различные типы клеток в отдельных компартментах, при этом аксоны могут прорастать по микроканалам в соседний компартмент, устанавливая таким образом взаимодействие с другим типом клеток. На подобном устройстве было продемонстрировано, что нейропептиды, синтезируемые сенсорными нейронами (субстанция Р и пептид, связанный с геном кальцитонина, CGRP), вызывают увеличение экспрессии в эндотелиальных клетках таких генов, как VEGF, ангиопоэтин-1, коллаген IV типа и матриксная металлопротеаза 2 [45]. В работе [46], также выполненной с использованием микрофлюидного устройства, продемонстрировано влияние эндотелиальных клеток на рост нейритов моторных нейронов и на осцилляции внутриклеточной концентрации Ca2+. Микрофлюидные устройства дают также возможность моделировать движение жидкости по сосудам путем подачи раствора под определенным давлением через специальные каналы к компартменту с эндотелиальными клетками [46].
3.2. Ex vivo-модели (органотипические культуры)
В предыдущем разделе было рассказано о моделях, основанных на монослое клеток либо на суспензии клеток в геле. Следующий ряд моделей, приближающий по сравнению с культурой клеток искусственную систему к живому организму – это органотипические культуры. Органотипическая культура представляет собой срезы нативной ткани до 500 мкм толщиной, культивируемые на границе жидкость–воздух, как правило, на культуральных вставках. При этом возможно как культивирование нескольких срезов одной ткани (для оценки внутритканевых взаимодействий при заживлении ран), так и совместное культивирование срезов различных тканей (для оценки межтканевых взаимодействий), а также совместное культивирование среза ткани и культуры клеток.
Множество работ с использованием органотипической было выполнено на ко-культуре среза нервной ткани (либо, как в случае дорсальных ганглиев, целого ганглия) и эндотелиальных клеток. Так, еще в 1999 г. продемонстрировано, что в присутствии эндотелиальных клеток, культивируемых с эксплантами субвентрикулярной зоны головного мозга, увеличиваются миграция нейрональных предшественников из эксплантов и рост нейритов [47]. Упомянутые работы [6] и [35] выполнены именно на такой модели, представляющей собой ко-культуру среза СМ (или ганглия) и эндотелиальных клеток.
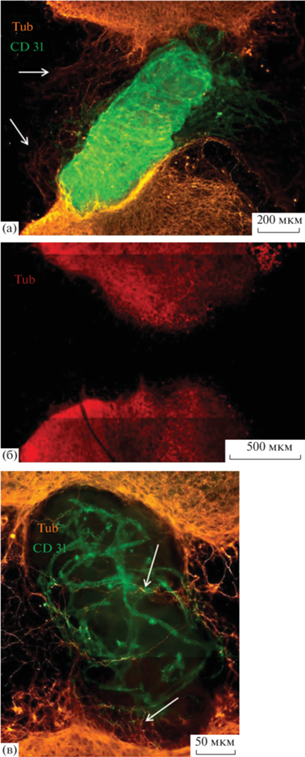
В лаборатории Биосовместимых матриксов и тканевой инженерии НИЦ “Курчатовский институт” разработали органотипическую модель, позволяющую изучать взаимодействие клеток крупных сосудов и СМ [48]. Модель представляет собой продольные срезы СМ с поперечным рассечением, помещенные на культуральную вставку. В зону повреждения среза помещали фрагменты аорты. Продемонстрировано, что срезы СМ индуцируют активную миграцию эндотелиальных (рис. 1а) и гладкомышечных (не показано) клеток из аорты. Проанализировав цитокины, синтезируемые в такой ко-культуре, предположили, что спраутинг аорты стимулировался факторами роста FGFa, FGFb, остеопонтином, фактором свертывания крови III (TF), белком 2, связывающим инсулиноподобный фактор роста (IGFBP-2) и SDF-1 (stromal cell- derived factor 1) [49]. Однако кроме влияния СМ на аорту данная модель позволяет исследовать влияние клеток аорты на рост аксонов. Как уже говорилось выше, после травмы СМ наиболее интенсивный нейрональный спраутинг наблюдается вблизи сосудов [19]. В данной модели присутствие аорты в зоне повреждения СМ стимулировало рост аксонов (сравнить рис. 1а и 1б), однако в качестве проводника (т.е. для роста по ее поверхности) ее использовали только единичные аксоны. Помимо аорты в зоне повреждения срезов СМ культивировали фрагменты полой вены (Vena cava) и обнаружили, что ее присутствие также стимулирует прорастание аксонов в зону повреждения СМ, при этом нейриты в качестве проводника более активно используют вену, чем аорту (рис. 1а, 1в). Таким образом, предложенная модель позволяет изучать взаимное влияние нервов и сосудов, во-первых, на молекулярном уровне, т.е. выявлять факторы, с одной стороны, синтезируемые СМ и индуцирующие миграцию клеток из сосудов, а с другой – синтезируемые клетками сосудов и стимулирующие рост аксонов. Во-вторых, модель позволяет исследовать непосредственное взаимодействие нервов и аксонов и определять, какие белки внеклеточного матрикса сосудов, с одной стороны, и интегрины нейронов, с другой, делают возможным рост нейритов по сосудам. Это позволит в будущем оценить возможность использования имплантации фрагментов сосудов в качестве направляющих для роста аксонов после травмы СМ.
Рис. 1.
Взаимное влияние сосудов и спинного мозга в органотипической культуре: а – миграция эндотелиальных клеток аорты, культивируемой в зоне повреждения среза спинного мозга. Стрелками показаны аксоны, проросшие в зону повреждения в присутствии аорты; б – отсутствие роста аксонов в зоне повреждения среза спинного мозга; в – рост аксонов по полой вене, культивируемой в зоне повреждения среза спинного мозга. Стрелками показаны аксоны. На рис. а и в оранжевым показан β3-тубулин, зеленым – CD31; на рис. б красным показан β3-тубулин.
ВЫВОДЫ
Тесное взаимодействие нервов и сосудов начинается в эмбриогенезе, когда эндотелиальные клетки и их предшественники, привлеченные сигналами нервной трубки, инициируют ее васкуляризацию. Иннервация периферических тканей, например кожи, происходит на более поздних сроках и начинается после образования капиллярной сети. При этом клетки периферических нервов играют решающую роль в последующем направлении роста более крупных сосудов, а также определяют характер дифференцировки эндотелиальных клеток. Во взрослом организме взаимное влияние нервов и сосудов становится отчетливо видно при травмах ЦНС. Так, нарушение целостности сосудов после травмы СМ вызывает вторичные повреждения, которые, в свою очередь, ведут к гибели нервных клеток, уцелевших после механических повреждений. Восстановление сосудов сильно влияет на выживаемость нервных клеток не только путем восстановления снабжения ткани кислородом и питательными веществами. Клетки сосудов являются источником ростовых, в том числе, нейротрофических факторов для нейронов, также эндотелиальные клетки могут играть роль направляющих и играть фагоцитарную роль, помогая избавиться от остатков миелина. В свою очередь, нервные клетки способствуют восстановлению сосудов, например, синтезируя нейротрофины BDNF и NGF, которые индуцируют пролиферацию и миграцию эндотелиальных клеток. Таким образом, тесная взаимосвязь сосудов и нервов прослеживается не только в эмбриогенезе, но и при регенерации после травм во взрослом организме. Дальнейшая разработка экспериментальных моделей, позволяющих исследовать непосредственное взаимодействие нервов и сосудов, поможет, с одной стороны, расширить и углубить знания о том, какие нейрональные факторы стимулируют или ингибируют ангиогенез, с другой стороны, выявить факторы, синтезируемые клетками сосудов и способствующие (или препятствующие) регенерации аксонов и выживанию нейронов после повреждений нервной системы.
Работа выполнена при поддержке НИЦ “Курчатовский институт” (приказ № 2180 от 18.08.2022).
Список литературы
Paredes I., Himmels P., Ruizde-Almodóvar C. // Rev. Dev. Cell. 2018. V. 45 № 1. P. 10. https://doi.org/10.1016/j.devcel.2018.01.023
Mancuso M.R., Frank Kuhnert B.S., Kuo C.J. // Lymphat. Res. Biol. 2008. V. 6. № 3–4. P. 173. https://doi.org/10.1089/lrb.2008.1014
Wälchli T., Wacker A., Frei K. et al. // Neuron. 2015. V. 87. № 2. P. 271.
James J.M., Gewolb C., Bautch V.L. // Development. 2009. V. 136. № 5. P. 833. https://doi.org/10.1242/dev.028845
Kurz H. // Cell. Adh. Migr. 2009. V. 3. № 2. P. 205. https://doi.org/10.4161/cam.3.2.7855
Himmels P., Paredes I., Adler H. et al. // Nat. Commun. 2017. V. 6 № 8. P. 14583. https://doi.org/10.1038/ncomms14583
Blanchette M., Daneman R. // Mech. Dev. 2015. V. 138. № 1. P. 8. https://doi.org/10.1016/j.mod.2015.07.007
James J.M., Mukouyama Y. // Semin. Cell. Dev. Biol. 2011. V. 22. № 9. P. 1019. https://doi.org/10.1016/j.semcdb.2011.09.010
Peguera B., Segarra M., Acker-Palmer A. // Curr. Opin. Neurobiol. 2021. V. 69. P. 202. https://doi.org/10.1016/j.conb.2021.04.005
Mukoyama Y., Shin D., Britsch S. et al. // Cell. 2002. V. 109. № 6. P. 693. https://doi.org/10.1016/s0092-8674(02)00757-2
Li W., Kohara H., Uchida Y. // Develop. Cell. 2013. V. 24. № 4. P. 359. https://doi.org/10.1016/j.devcel.2013.01.009
Melissano G., Bertoglio L., Rinaldi E. et al. // J. Cardiovasc. Surg. 2015. V. 56. № 5. P. 699.
Mautes A.E., Weinzierl M.R., Donovan F., Noble L.J. // Phys. Ther. 2000. V. 80. № 7. P. 673.
Alizadeh A., Dyck S.M., Karimi-Abdolrezaee S. // Front. Neurol. 2019. V. 10. P. 282. https://doi.org/10.3389/fneur.2019.00282
Ng M.T., Stammers A.T., Kwon B.K. // Transl. Stroke Res. 2011. V. 2. № 4. P. 474. https://doi.org/10.1007/s12975-011-0109-x
Figley S.A., Khosravi R., Legasto J.M. et al. // J. Neurotrauma. 2014. V. 31. № 6. P. 541. https://doi.org/10.1089/neu.2013.3034
Casella G.T., Marcillo A., Bunge M.B. et al. // Exp. Neurol. 2002. V. 173. № 1. P. 63. https://doi.org/10.1006/exnr.2001.7827
Imperato-Kalmar E.L., McKinney R.A., Schnell L. et al. // Exp. Neurol. 1997. V. 145. № 2. Pt. 1. P. 322. https://doi.org/10.1006/exnr.1997.6449
Dray C., Rougon G., Debarbieux F. // Proc. Natl. Acad. Sci. USA. 2009. V. 106. № 23. P. 9459. https://doi.org/10.1073/pnas.0900222106
Herrera J.J., Nesic O., Narayana P.A. // J. Neurotrauma. 2009. V. 26. № 7. P. 995. https://doi.org/10.1089/neu.2008.0779
Ritz M.F., Graumann U., Gutierrez B. et al. // Curr. Neurovasc. Res. 2010. V. 7. № 4. P. 301. https://doi.org/10.2174/156720210793180756
Paczkowska E., Rogińska, D., Pius-Sadowska E. et al. // J. Spinal Cord Med. 2015. V. 38. № 6. P. 729. https://doi.org/10.1179/2045772314Y.0000000227
Graumann U., Ritz M.F., Hausmann O. // Curr. Neurovasc. Res. 2011. V. 8. № 4. P. 334. https://doi.org/10.2174/156720211798121007
Xiyang Y.B., Liu S., Liu J. et al. // J. Neurotrauma. 2009. V. 26. № 2. P. 275. https://doi.org/10.1089/neu.2007.0374
Haenzi B., Moon L.D. // Neural Plast. 2017. V. 2017. P. 2740768. https://doi.org/10.1155/2017/2740768
Zhou Y., Wang Z., Li J. et al. // J. Cell. Mol. Med. 2018. V. 22. № 1. P. 25. https://doi.org/10.1111/jcmm.13353
Dollé J.P., Rezvan A., Allen F.D. et al. // J. Pharm. Exp. Ther. 2005. V. 315. № 3. P. 1220. https://doi.org/10.1124/jpet.105.093252
Kermani P., Hempstead B. // Trends Cardiovasc. Med. 2007. V. 17. № 4. P. 140. https://doi.org/10.1016/j.tcm.2007.03.002
Dougherty K.D., Dreyfus C.F., Black I.B. // Neurobiol. Dis. 2000. V. 7. № 6. Pt. B. P. 574. https://doi.org/10.1006/nbdi.2000.0318
Krenz N.R., Weaver L.C. // J. Neurochem. 2000. V. 74. № 2. P. 730. https://doi.org/10.1046/j.1471-4159.2000.740730.x
Sköld M., Cullheim S., Hammarberg H. et al. // Eur. J. Neurosci. 2000. V. 12. № 10. P. 3675.
Lin H., Muramatsu R., Maedera N. et al. // EBioMedicine. 2018. V. 27. P. 71. https://doi.org/10.1016/j.ebiom.2017.10.033
Cattin A.L., Burden J.J., Van Emmenis L. et al. // Cell. 2015. V. 162. № 5. P. 1127. https://doi.org/10.1016/j.cell.2015.07.021
Zhou T., Zheng Y., Sun L. et al. // Nat. Neurosci. 2019. V. 22. № 3. P. 421. https://doi.org/10.1038/s41593-018-0324-9
Grasman J.M., Kaplan D.L. // Sci. Rep. 2017. V. 7. № 1. P. 4092. https://doi.org/10.1038/s41598-017-04460-8
Xue Q., Liu Y., Qi H. et al. // Int. J. Biol. Sci. V. 2013. 9. № 2. P. 174. https://doi.org/10.7150/ijbs.5115
Stone N.L., England T.J., O’Sullivan S.E. // Front. Cell. Neurosci. 2019. V. 13. P. 230. https://doi.org/10.3389/fncel.2019.00230
Naik P., Cucullo L. // J. Pharm. Sci. 2012. V. 101. № 4. P. 1337. https://doi.org/10.1002/jps.23022
McCarthy R.C., Kosman D.J. // Cell Mol. Life Sci. 2015. V. 72 № 4. P. 709. https://doi.org/10.1007/s00018-014-1771-4
Bartanusz V., Jezova D., Alajajian B. et al. // Ann. Neurol. 2011. V. 70. № 2. P. 194. https://doi.org/10.1002/ana.22421
Muramatsu R., Takahashi C., Miyake S. // Nat. Med. 2012. V. 18. № 11. P. 1658. https://doi.org/10.1038/nm.2943
Wu K.W., Mo J.L., Kou Z.W. et al. // Front. Cell Neurosci. 2017. V. 11. P. 290. https://doi.org/10.3389/fncel.2017.00290
Middelkamp H.T., Verboven H.A., De SáVivas A.G. et al. // Sci. Rep. 2021. V. 11. № 1. P. 2281. https://doi.org/10.1038/s41598-021-81933-x
Adriani G., Ma D., Pavesi A. et al. // Lab. Chip. 2017. V. 17. № 3. P. 448. https://doi.org/10.1039/c6lc00638h
Leroux A., Paiva Dos Santos B., Leng J. et al. // Cell. Commun. Signal. 2020. V. 18. № 1. P. 162. https://doi.org/10.1186/s12964-020-00656-0
Osaki T., Sivathanu V., Kamm R.D. // Sci. Rep. 2018. V. 8. № 1. P. 5168. https://doi.org/10.1038/s41598-018-23512-1
Leventhal C., Rafii S., Rafii D. et al. // Mol. Cell. Neurosci. 1999. V. 13. № 6. P. 450. https://doi.org/10.1006/mcne.1999.0762
Mikhailova M.M., Panteleyev A.A. Jr, Paltsev M.A., Panteleyev A.A. // Cell. Biol. Int. 2019. V. 43. № 10. P. 1193. https://doi.org/10.1002/cbin.11112
Mikhailova M.M., Volobueva M.N., Panteleyev A.A. // Cell. Biochem. Funct. 2021. V. 39. № 5. P. 679.
Дополнительные материалы отсутствуют.
Инструменты
Вестник Военного инновационного технополиса «ЭРА»


