Радиационная биология. Радиоэкология, 2021, T. 61, № 6, стр. 615-624
Адаптaционная пластичность креатинкиназы мозга и печени крыс при воздействии общего рентгеновского излучения
Л. С. Нерсесова 1, *, М. С. Петросян 1, С. С. Гаспарян 1, М. Г. Газарянц 1, Ж. И. Акопян 1
1 Институт молекулярной биологии НАН РА
Ереван, Армения
* E-mail: l.nersesova@yahoo.com
Поступила в редакцию 13.08.2020
После доработки 06.07.2021
Принята к публикации 01.09.2021
Аннотация
Адаптация организма к воздействию любого фактора связана с энергетическими затратами. Креатин-креатинкиназная (Кр-КК) система играет ключевую роль в поддержании энергетического и Са-гомеостаза клетки, а также в сохранении структурной и функциональной стабильности митохондрий и, таким образом, способствует адаптации энергетического метаболизма клетки к воздействию стрессорного фактора. Сравнительная оценка адаптационных возможностей КК мозга и печени крыс, подвергнутых воздействию однократного общего рентгеновского излучения, и влияния Кр, как пищевой добавки, на эти изменения на основании анализа динамики пострадиационных изменений уровней активности КК, а также аланин- и аспартат-аминитрансфераз (АСТ и АЛТ), исследованных в сравнительном плане, выявила следующее. Кр-КК система мозга и печени крыс обладает значительной нативной адаптационной пластичностью, которая стимулируется Кр. Динамика пострадиационных изменений уровней активности КК и АСТ печени имеет аналогичный характер, что указывает на совместное участие этих ферментов в пострадиационном адаптивном репрограммировании энергетического обмена митохондрий. Адаптационная пластичность КК имеет тканеспецифический характер, связанный с интенсивностью энергетического обмена и количественным содержанием фермента в ткани. Колебательный характер пострадиационных изменений уровней активности мозговой и печеночной КК-аз во времени может свидетельствовать, с одной стороны, об отдаленных эффектах рентгеновского облучения, с другой стороны – о включении различных пострадиационных механизмов адаптации фермента.
Адаптация – фундаментальное свойство живого организма, обеспечивающее его непрерывное приспособление к изменяющимся условиям окружающей среды. Наиболее ярко значение адаптации проявляется при повреждении организма. В развитии адаптационных реакций, обычно, прослеживается два этапа: этап срочной, но несовершенной адаптации и последующий этап устойчивой и более совершенной долговременной адаптации. Срочный этап адаптационной реакции возникает непосредственно после начала действия раздражителя и реализуется на основе уже имеющихся ресурсов клетки. Важнейшая черта этого этапа адаптации состоит в том, что организм в это время действует, как правило, на пределе своих функциональных возможностей и далеко не всегда обеспечивает необходимый адаптационный эффект. Вследствие этого наступает этап долговременной адаптации, связанный с более глубокими метаболическими перестройками [1, 2].
Адаптация организма к любому фактору связана с энергетическими затратами: при этом изменяется энергетический метаболизм, увеличивается использование энергетических, информационных и пластических ресурсов [1, 2]. Возникающий дефицит энергоресурсов является сигналом для генетического аппарата клеток, запускающим увеличение образования в них митохондрий, ферментов, что ведет к активизации синтеза белков, нуклеиновых кислот и АТФ. Последнее обеспечивает восстановление и рост энергетического потенциала клеток, а это является основой способности организма к последующим функциональным перестройкам в ходе новых адаптивных реакций в ответ на воздействие факторов внутренней или внешней среды [1, 2].
Как известно, в основе повреждающего действия рентгеновского излучения лежит окислительный стресс (ОС), индуцирующий в клетке адаптивные ответы [3, 4]. Радиация значительно снижает содержание АТФ в клетке вследствие, с одной стороны, угнетения процессов окислительного фосфорилирования в митохондриях и, с другой стороны, повышения активности АТФ-аз в цитоплазме. На фоне уменьшения усвоения митохондриями глюкозы развиваются следующие адаптивные ответы: репрограммирование митохондриального метаболизма, которое ведет к активации окисления жирных кислот и глутамина через цикл трикарбоновых кислот (ЦТК), что повышает эффективность энергетического обмена; увеличение в митохондриальном дыхании доли несопряженных реакций; увеличение содержания митохондрий за счет их повышенного биогенеза; повышение активности АМФ-активируемой протеинкиназы, участвующей в качестве сигнальной молекулы в компенсаторных изменениях митохондриального энергетического обмена [4]. Креатин-креатинкиназная (Кр-КК) система играет ключевую роль в поддержании энергетического и Са-гомеостаза клетки, а также в сохранении структурной и функциональной целостности митохондрий [5–7] и, таким образом, способствует адаптации клетки к воздействию стрессорного фактора. Регуляция Кр-КК системы осуществляется через АМФ-активируемую протеинкиназу, которая может активироваться как понижением в клетке уровня отношения АТФ/АМФ, так и понижением уровня отношения креатинфосфат/Кр [6]. Таким образом, реакция клетки на опасные для нее внешние воздействия включает мобилизацию Кр-КК системы. Показано, что активация Кр-КК системы и изменения уровня экспрессии КК могут быть ранним индикатором окислительного и биоэнергетического стрессов в клетке [5–7]. Ранее нами показана высокая радиочувствительность КК как к рентгеновскому [8], так и к радиочастотному излучениям [9], а также радиозащитное действие Кр, используемого в качестве пищевой добавки [8]. Целью настоящей работы была сравнительная оценка адаптационных возможностей КК мозга, отличающегося интенсивным энергетическим обменом и высоким содержанием КК, и печени, характеризующейся низким содержанием фермента, но высокой способностью к адаптивному синтезу КК, а также влияния Кр на эти возможности у крыс, подвергнутых различным дозам общего однократного рентгеновского излучения. Кроме того, в сравнении с КК были оценены адаптационные возможности АЛТ и АСТ, которые осуществляют сопряжение аминокислотного и энергетического обменов в метаболоне Кребса, а также являются клиническими маркерами функционального состояния печени, основного органа детоксикации.
МАТЕРИАЛЫ И МЕТОДИКА
В опытах использовано 260 белых беспородных крыс-самцов, массой 180–210 г, которые содержались в стандартных условиях. Общее однократное облучение крыс проводили в изолированном помещении на рентгеновской установке “РУМ-17” (напряжение 200 кВт, сила тока 20 мА, Cu-Al фильтр; кожно-фокусное расстояние 50 см, мощность дозы облучения 1.78 Гр/мин).
Исходя из рекомендаций БЭК ИМБ НАН РА по использованию в опытах минимального количества животных, представленные результаты являются средними двух и, в одном случае, трех независимых экспериментов. В двух независимых экспериментах первой серии опытов животные в каждом эксперименте были разделены на опытную и контрольную (интактные) группы по восемь особей в каждой. Энзимологические пострадиационные эффекты исследовались на 6-е и 13-е сутки путем отбора на каждый срок из опытных и контрольных групп по 4 крысы (табл. 1).
Таблица 1.
Распределение крыс по экспериментальным группам для исследования пострадиационных энзимологических эффектов Table 1. Distribution of rats to experimental groups for the study of post-radiation enzymological effects
| I серия (2 независимых эксперимента) | II серия (два независимых эксперимента) | III серия (3 независимых эксперимента) | |||
|---|---|---|---|---|---|
| группы | группы | группы | |||
| 3.5 Гр/6-e сутки | 1 – облученные (n = 4 × 2) | 4.5 Гр/1-е сутки | 1) Кр/глюкоза (n = 5 × 2) | 6.5 Гр/30-е сутки | |
| 2) вода (n = 5 × 2) | |||||
| 2 – интактные (n = 4 × 2) | 3) глюкоза (n = 5 × 2) | ||||
| 4) интактные (n = 5 × 2) | |||||
| 3.5 Гр/13-e сутки | 1 – облученные (n = 4 × 2) | 4.5 Гр/7-е сутки | 1) Кр/глюкоза (n = 5 × 2) | 1) Кр/глюкоза (n = 5 × 3) | |
| 2) вода (n = 5 × 2) | 2) облученный контроль (n = 3 + 3 + 4) | ||||
| 2 – интактные (n = 4 × 2) | 3) глюкоза (n = 5 × 2) | ||||
| 4) интактные (n = 5 × 2) | 3) интактные (n = 5 × 3) | ||||
| 4.5 Гр/15-е сутки | 1) Кр/глюкоза (n = 5 × 2) | ||||
| 2) вода (n = 5 × 2) | |||||
| 3) глюкоза (n = 5 × 2) | |||||
| 4) интактные (n = 5 × 2) | |||||
В двух независимых экспериментах второй серии опытов, посвященной исследованию адаптационных свойств КК после облучения крыс в дозе 4.5 Гр в присутствии и в отсутствие Кр в качестве пищевой добавки, животные получали per os Кр в дозе 1 г/кг веса животного в растворе 0.9%-ной глюкозы (способствует усвоению Кр клетками и повышению ее биодоступности [10]), за 2 нед до и 2 нед после облучения. В индивидуальной клетке наряду с поилкой для воды устанавливалась специальная поилка для раствора Кр в 0.9%-ной глюкозе (0.2 г/10 мл), который ежедневно потреблялся в полном объеме. В каждом опыте животные были разделены на четыре группы по 15 крыс в каждой. Первая, опытная группа крыс, получала pаствор Кр/глюкоза; группа 2, служащая контролем на растворитель, по аналогичной схеме получала 0.9%-ную глюкозу; группы 3 и 4 служили в качестве облученного и интактного контролей соответственно. Пострадиационные эффекты исследовались на 1-е, 7-е и 15-е сутки путем отбора на каждый срок из опытных и контрольных групп по пять крыс.
В трех независимых экспериментах третьей серии опытов на выживаемость крыс облучали в дозе ЛД70/30, равной 6.5 Гр. Животные были разделены на три группы по 12 особей в каждой, соответственно общепринятому протоколу опытов на выживаемость. Крысам первой опытной группы по указанной выше схеме вводили креатин в 0.9%-ном растворе глюкозы; группы 2 и 3 служили в качестве облученного и интактного контролей. На 30-е сутки после облучения в каждом опыте из каждой группы для исследования были отобраны по пять крыс, за исключением группы облученного контроля, в которой выживало по 3–4 крысы. В экстрактах мозга, печени и в сыворотке крови крыс определялись уровни активности КК и содержание Кр. Декапитацию животных проводили на фоне эфирного наркоза. Сыворотку крови получали после ее свертывания путем центрифугирования в рефрижераторной центрифуге при 800 g в течение 20 мин. Мозг и печень отмывали от крови охлажденным физиологическим раствором и гомогенизировали в экстрагирующем буферном растворе с pH 7.2 (0.1 моль/л трис – HCl, 5 ммоль/л дитиотреитола и 1 ммоль/л этилендиаминтетраацетата). Экстракты, полученные после центрифугирования гомогенатов при 23 000 g в течение 30 мин, использовали для определения уровней ферментной активности и содержания Кр.
КК активность определяли спектрофотометрически по накоплению продукта реакции креатина [11], а АЛТ и АСТ активность – на основе измерения убыли восстановленного никотинамидадениндинуклеотида в сопряженных реакциях с лактатдегидрогеназой и малатдегидрогеназой соответственно [12]. Ферментную активность выражали в мкмоль/г влажной ткани в минуту для мозга и печени и мкмоль/л в минуту для сыворотки крови. Содержание креатина в мкг/г влажного веса органа и в мкг/мл сыворотки определяли спектрофотометрически согласно модифицированному методу Эннора Розенберга [11]. Использованные реагенты: креатин моногидрат, креатин-фосфат динатриевая соль (тетрагидрат), АДФ натриевая соль, 1-нафтол, диацетил, дитиотрейтол, ЭДТА фирмы “Sigma Aldrich” (Германия), а также 40%-ная глюкоза (ОАО Ереванская ХФФ) и диагностические наборы ООО “Дельта” (Армения). Для наглядного изображения рассчитанные средние и их стандартные отклонения для уровней активности ферментов и содержания Кр на графиках выражены в % по отношению к контрольному уровню, которым служили соответствующие данные, полученные для интактных животных. Для статистической обработки данных использован пакет SPSS (Statistical Package for Social Science). Характер распределения полученных данных определен методом Колмогорова–Смирнова. Сравнительный анализ проведен с использованием непараметрического теста Манна–Уитни. Различия считались достоверными при р ≤ 0.05. Корреляционный анализ проведен с использованием непараметрического теста Спирмена.
РЕЗУЛЬТАТЫ
Как известно, окончательное проявление радиационного поражения ферментных молекул in vivo зависит от дозы облучения и может растягиваться на дни [13]. Исходя из этого, нами были выбраны различные дозы облучения животных и различные сроки исследования пострадиационных изменений уровней активности ферментов, которые, как известно, связаны не только со структурными повреждениями их молекул, но и с пострадиационным изменением состава биосред ферментов, за счет накопления или утраты в этих средах ингибиторов и активаторов ферментов, а также с включением во времени разных адаптационных механизмов [14, 15].
На рис. 1 представлена диаграмма динамики пострадиационных изменений уровней активности КК в мозге, печени и сыворотке крови крыс, подвергнутых рентгеновскому облучению в дозе 3.5 Гр и исследованых через 6 и 13 дней после лучевого воздействия. Из полученных данных следует, что облучение крыс вызывает разнонаправленные изменения активности ферментов во времени (рис. 1, а, б). В случае КК в мозге на 6-е сутки имеет место достоверное падение уровня активности фермента на 25%, которое к 13-м суткам сменяется повышением его на 25%, а в печени уже на 6-е сутки обнаруживается компенсаторное повышение уровня активности КК на 25%, которое удваивается по отношению к контролю к 13-м суткам. Динамика пострадиационных изменений уровней активности печеночных КК и АСТ имела одинаковый характер и была направлена на компенсаторное повышение активности обоих ферментов, особенно выраженное на 13-е сутки после облучения, что скорее всего связано с участием этих ферментов в адаптивном ответе митохондрий на радиостресс и с включением долгосрочных механизмов адаптации. В отличие от мембраносвязанных АСТ и КК, которые представлены также и в цитоплазме гепатоцитов, АЛТ, в основном, цитоплазматический фермент, с чем, по-видимому, связаны ее большая радиочувствительность и меньшая адаптабельность: как видно из рис. 1, а, б, на 6-е сутки после облучения наблюдается падение уровня активности печеночной АЛТ на 25%, которое к 13-м пострадиационным суткам сменяется лишь тенденцией к восстанавлению до контрольного уровня.
Рис. 1.
Динамика пострадиационных изменений уровней активности КК, АЛТ и АСТ в мозге, печени и сыворотке крови крыс после облучения в дозе 3.5 Гр: а – 6-е сутки, б – 13-е сутки (n = 8 для каждой группы). Пунктирная линия – контрольный уровень, выражающий среднее значение активности КК интактных крыс, принятый за 100%. * Отличие от контроля достоверно при p ≤ 0.05.
Fig. 1. Dynamics of post-radiation alterations in the activity levels of CK, ALT and AST in the brain, liver, and serum of rats, following their irradiation in the dosage of the 3.5 Gy: a – day 6; b – day 13 (n = 8 for each for each group). Dashed line – the control level, representing the mean value of the CK activity of the intact rats, taken then as 100%. * p ≤ 0.05, compared to the control group.
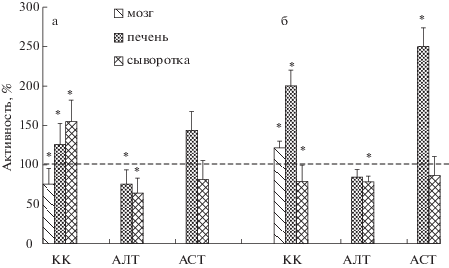
Изменения уровней активности сывороточных ферментов также носили разнонаправленный характер (рис. 1, а, б), однако не корреллировали с изменениями уровней активностей соответствующих ферментов в мозге и печени. Этот факт косвенно может свидетельствовать или о неизменности проницаемости клеточных мембран в этих органах при использованных дозе и способе облучения, а также пострадиационного срока исследования, или о разбалансировании регуляторных процессов в результате облучения [16]. На рис. 2 представлены данные по влиянию Кр, в качестве биологической добавки, на динамику изменений уровней активности КК (А) и содержания креатина (Б) в мозге, печени и сыворотке крови крыс на 1-е, 7-е и 15-е сутки после их облучения в дозе 4,5 Гр. Как следует из полученных данных, в первые пострадиационные сутки в мозге крыс контрольных групп 2 и 3, получавших воду и раствор глюкозы, активность КК достоверно падает (на 40–50%), однако в опытной группе крыс, получавших Кр, этот показатель вдвое меньше – 20% (p = 0.05). Достоверных изменений уровней активности печеночной и сывороточной КК в этот срок не отмечается.
Рис. 2.
Динамика изменений уровней активности КК (а) и содержания креатина (Кр) (б) в мозге, печени и сыворотке крови крыс после их облучения в дозе 4.5 Гр в присутствии и в отсутствие креатина: 1 – Кр/глюкоза, 2 – вода, 3 – глюкоза; а – 1-е сутки, б – 7-е сутки, в – 15-е сутки (n = 10 для каждой группы). Пунктирная линия – контрольный уровень, выражающий среднее значение активности КК интактных крыс, принятый за 100%. * Отличие от контроля достоверно при p ≤ 0.05; ** отличие от контроля достоверно при p ≤ 0.01.
Fig. 2. Dynamics of post-radiation alterations in the CK (a), activity level and the Cr (b) content in the brain, liver, and serum of rats, following their irradiation in the dosage of the 4.5 Gy in the presence, as well as absence of Cr: 1 – Cr/glucose, 2 – water, 3 – glucosePost-radiation periods; a – 1st, b – 7th, c – 15th day (n = 10 for each group). Dashed line – control level, representing mean value of CK activity of intact rats, taken then as 100%. * p ≤ 0.05 compared to control; ** p ≤ 0.01 compared to control

Развитие пострадиационных эффектов во времени приводит к компенсаторному повышению КК активности как в мозге, так и в печени опытных крыс, но с определенными различиями, связанными, по-видимому, с тканеспецифическими механизмами адаптации. Если на 15-е сутки активность мозговой КК возвращается к нативному контрольному уровню, то в случае печеночной КК повышение уровня активности во времени продолжается. Можно предположить, что резкое повышение активности КК в печени опытных крыс к этому сроку – в 2.5 раза (p = 0.05) – обусловлено действием механизма долгосрочной адаптации, связанной с экспрессией КК, стимулированной не только облучением, но и присутствием Кр-добавки (рис. 2, А, в).
В контрольных группах 2 и 3 наблюдающееся для печеночной КК на 7-е сутки компенсаторное повышение активности фермента, а для мозговой КК – стабилизация на уровне контроля, на 15-е сутки сменяется достоверным снижением активности фермента, причем для КК мозга ниже контрольного. Последнее, по-видимому, связано с истощением нативных адаптационных возможностей Кр-КК системы мозга и печени животных этих контрольных групп. Наблюдаемые небольшие колебания в уровнях активности КК и в содержании Кр в сыворотке крови животных всех групп во все пострадиационные сроки статистически недостоверны (рис. 2, (а) и (б)).
Рис. 3.
Активность КК (а) и содержание креатина (Кр) (б) в мозге, печени и сыворотке крыс на 30-е сутки после облучения их в дозе 6.5 Гр в присутствии и в отсутствиe Кр: 1 – креатин/глюкоза, 2 – облученный контроль (n = 15 для каждой группы, за исключением группы 2 – n = 10). Пунктирная линия – контрольный уровень, выражающий среднее значение активности КК интактных крыс, принятый за 100%. * Отличие от контроля достоверно при p ≤ 0.05; ** отличие от контроля достоверно при p ≤ 0.01.
Fig. 3. CK (а) activity and Cr (b) content in the brain, liver, and serum of rats on day 30 after their irradiation in the dosage of 6.5 Gy dosage in the presence, as well as absence of Cr: 1 – Cr/glucose, 2 – irradiated control (n = 15 for each group, except group 2 – n = 10). Dashed line – control level, representing mean value of CK activity of intact rats, taken then as 100%. * p ≤ 0.05 compared to the control; ** p ≤ 0.01 compared to the control.

Что касается содержания креатина в мозге и печени, то во все сроки отмечаются всплески его уровня, но они достоверно не отличаются от контрольного уровня, за единичным исключением, касающимся достоверного повышения содержания Кр на 27% в мозге крыс опытной группы 1 в первые пострадиационные сутки (рис. 2, (б), а, 1). Поскольку корреляционный анализ не выявил взаимосвязь между этим повышением и указанным выше падением уровня активности мозговой КК в этой группе крыс (r = 0.017; p = 0.983), можно предположить, что указанное повышенное содержание Кр связано со стимуляцией радиострессом эндогенного синтеза Кр, характерного для отдельных видов клеток мозга [17].
В следующей серии экспериментов были изучены адаптационные возможности КК мозга и печени через 30 дней после облучения в ответ на возможные отдаленные эффекты рентгеновского излучения при облучении крыс в дозе ЛД70/30, равной 6.5 Гр, в присутствии и в отсутствие Кр. При указанной дозе облучения у крыс имеет место развитие лучевой болезни средней тяжести [18], при которой в нашем случае в облученных группах, не получавших Кр, погибло 70% животных. Как следует из рис. 3, (а), (б), в опытной группе 1, животные которой получали Кр в растворе глюкозы, в мозге крыс как активность, так и содержание креатина почти не отличаются от контрольного уровня, что свидетельствует о стабилизации к этому сроку энергетического обмена мозговых клеток. Однако в печени и сыворотке крови как активность КК, так и содержание креатина на 30-й день после облучения остаются все еще повышенными.
Особый интерес представляют данные относительно выживших контрольных облученных крыс (группа 2), не получавших Кр. У этих животных определяются с высокой степенью достоверности повышенный уровень активности мозговой КК (более чем в 2 раза по сравнению с интактными крысами) при нормальном уровне содержания Кр в нем и повышенный уровень активности печеночной КК (на 20% по сравнению с интактными крысами) при повышенном уровне содержания Кр как в печени (почти на 40% по сравнению с интактными крысами), так и в сыворотке крови, что однозначно свидетельствует о том, что Кр-КК система принимает участие в повышенной природной резистентности этих животных к воздействию ионизирующего излучения за счет компенсаторных изменений активности фермента и эндогенного синтеза Кр в печени, который через кровь переносится ко всем остальным органам. Кроме того, при 2-кратном повышении содержания Кр в сыворотке крови животных этой группы наблюдается примерно равноценное падение уровня активности их сывороточной КК (рис. 3, (а), (б), 2), при высокой степени взаимосвязи изменений этих параметров (r = –0.865; p = 0.05). В качестве спекулятивного объяснения эго факта можно предположить, что в данном случае, в отличие от опытных групп, имеет место известное для КК субстратное торможение избытком Кр [19]. Таким образом, компенсаторные повышения уровней активности КК и содержания Кр в мозге, печени и сыворотке крови в отдельных группах облученных крыс имеют место и на 30-е пострадиационные сутки, которые соответствуют сроку окончания разгара острого лучевого заболевания средней тяжести и начала стабилизации течения болезни.
ОБСУЖДЕНИЕ
Гомеостаз и адаптация – это два конечных результата, которые организуют функциональные системы организма. Влияние внешних факторов на состояние гомеостаза приводит к запуску процесса адаптивной перестройки организма человека, в результате которой функциональные системы компенсируют произведенные и возможные нарушения гомеостаза и восстанавливают равновесие. Ведущие ученые в области биохимической адаптации П. Хочачка [1] и К. Стори [2] выделяют следующие основные категории биохимической адаптации: 1) количественная адаптация, т.е. приспособительные изменения в концентрациях макромолекул; 2) качественная адаптация, когда в ответ на изменения среды в действующую систему включаются новые виды макромолекул; 3) адаптация модуляционного типа – приспособительные изменения активности существующих макромолекул. Биохимическая адаптация этих трех типов, реализующаяся совместно или по отдельности, может быть или компенсаторной, или эксплуативной. Компенсаторные пути биохимической адаптации обеспечивают организму сохранение статус кво и, как правило, имеют место в ответ на воздействие неблагоприятных факторов окружающей среды, тогда как эксплуативные пути адаптации связаны с эволюционным прогрессом. Немедленная адаптация, так называемая адаптация первой линии защиты, от влияния стресс-факторов окружающей среды, к которым, в частности, относится и ионизирующее излучение (ИИ), происходит быстро путем модуляции активности уже имеющихся ферментов. Со временем на смену этой реакции приходят изменения в экспрессии генов, которые могут иметь как количественный, так и качественный характер, как, например, экспрессия множественных форм одного и того же фермента. Поддержание энергетического гомеостаза клетки и повышение резистентности митохондрий – однo из основных условий защиты клетки от воздействия ИИ, особенно, если принять во внимание новый взгляд на критическую роль митохондрий, наряду с ядром, в развитии радиотоксикоза [3]. В этом смысле оценка адаптационных возможностей Кр-КК системы, которая, как было отмечено выше, играет ключевую роль в поддержании энергетического и Са-гомеостаза клетки, а также в обеспечении структурной и функциональной целостности митохондрий [5, 6] представляет значительный интерес. Анализ полученных данных по динамике пострадиационных изменений активности КК мозга и печени и влиянию Кр, как пищевой добавки, на эти изменения позволяет обсудить нам следующие аспекты адаптационных возможностей Кр-КК системы.
Во-первых, динамика пострадиационных изменений уровней активности КК как мозга, так и печени крыс, индуцированных облучением в дозах 3.5, 4.5 и 6.5 Гр, свидетельствует об их компенсаторно-адаптационной природе, направленной на восстановление энергетического гомеостаза клетки (рис. 1, 2, 3); при этом значительная нативная адаптационная пластичность КК стимулируется в присутствии Кр (рис. 2, 3). Так, падение уровня активности мозговой КК в начальные пострадиационные сутки как в опытной, так и в контрольных группах (рис. 1, 2), связанное скорее всего с окислением функционально активных SН-групп фермента [20], сменяется компенсаторным повышением уровня активности фермента в последующие сутки. В присутствии Кр начальное падение активности КК в опытной группе вдвое меньше, а последующее повышение активности вдвое больше, чем в отсутствие Кр (сравните рис. 1 и рис. 2, а). Кроме того, возвращение уровня активности мозговой КК к контрольному уровню к 15-му пострадиационному дню свидетельствует о стабилизации активности фермента к этому сроку, что примерно совпадает с окончанием разгара острой лучевой болезни у крыс при облучении их в сублетальных дозах. Стабилизация уровня активности КК мозга на уровне контроля наблюдается и через 30 дней после облучения в дозе 6.5 Гр, что совпадает со стабилизацией течения лучевой болезни [13]. Особо следует отметить проявление нативной адаптационной пластичности КК в группе контрольных крыс, выживших после облучения в дозе 6.5 Гр (рис. 3, (а), 2): повышенные уровни активности как мозговой, так и печеночной КК, а также содержания Кр в печени, где имеет место синтез эндогенного Кр [6, 21], и в сыворотке крови, через которую Кр переносится к органам [6, 21], несомненно, указывают на участие Кр-КК системы в повышенной адаптации этих животных к воздействию ИИ.
Во-вторых, колебательный характер пострадиационных изменений активности исследованных ферментов во времени свидетельствуют о смене механизмов адаптации в ответ на развитие ОС. Установлено, что колебательные изменения характерны как для уровней активности и экспрессии ферментов, так и изоферментных спектров и кинетических параметров ряда ферментов и, в целом, характерны для пострадиационных биологических эффектов, что, по-видимому, связано с развитием процессов ОС во времени, в том числе с отдаленными эффектами облучения, и с включением на разных пострадиационных этапах различных адаптационных механизмов клетки [7, 22–24].
В-третьих, адаптационная пластичность КК имеет тканеспецифичный характер и зависит, по-видимому, от уровня содержания КК в ткани: если в мозге, отличающемся высоким содержанием КК, действуют механизмы как немедленной, так и долгосрочной адаптации, то в печени, отличающейся крайне низким содержанием КК, но высокой способностью к экспрессии фермента в стрессовых ситуациях [25–27], действуют механизмы долгосрочной адаптации, связанные с дополнительным синтезом ферментного белка. В отличие от мозговой КК, активность печеночной КК реагирует на радиостресс с некоторым отставанием, однако компенсаторное повышение уровня активности ее остается во все последующие пострадиационные сроки при всех исследованных дозах облучения.
Значительный интерес представляет и другой выявленный нами факт: динамика пострадиационных изменений уровней активности КК и АСТ, индуцированных рентгеновским излучением, имела одинаковый характер и была направлена на компенсаторное повышение активности обоих ферментов, особенно выраженное на 13-е сутки после облучения, что, скорее всего, связано с участием этих ферментов в адаптивном ответе митохондрий на радиостресс. Показано, что ионизирующая радиация вызывает репрограммирование энергетического обмена митохондрий, направленное на использование в качестве субстратов вместо глюкозы жирных кислот и глютамина [4]. Вовлечение последнего в цикл Кребса, как известно, предполагает его превращение в глутарат, которое катализируеся мит-АСТ; при этом мит-КК обеспечивает транспорт произведенной энергии из митоходрий в цитоплазму и участвует в стабилизации высокопроницаемых пор митохондрий. К сожалению, корреляционный анализ не выявил связи между изменениями уровней активности этих ферментов. На участие КК в адаптивном репрограммировании энергетического обмена митохондрий в ответ на ОС, индуцированный рентгеновским излучением, указывает и возрастание под этим воздействим активности АМФ-активируемой протеинкиназы [4], участвующей в качестве сигнальной молекулы в регуляции активности КК в стрессовых ситуациях [6]. Что касается изменений уровней активности КК в сыворотке крови, то при облучении в сублетальных дозах они достоверно не отличались от контрольного уровня, а повышение активности фермента после облучения в дозе 6.5 Гр может быть связано, с одной стороны, с повышенным поступлением фермента в кровь из различных органов и клеток крови в результате их повышенной физиологической активности или патологических изменений, которые продолжают иметь место к 30-му пострадиационному дню, с другой стороны – с уменьшением скорости деградации циркулирующей КК, которая происходит в печени и ретикулоэндотелиальной системе [19]. Здесь необходимо отметить, что в сыворотке крови отсутствует собственная КК: при минимальной активности в норме основной вклад в пул сывороточной КК вносит мышечная ткань: до 90–94% – это ММ изофермент [19]. В заключение следует отметить, что КК принадлежит к числу ферментов, существующих в разных множественных формах: изоферменты, конформеры, посттрансляционные белковые модификации, макромолекулярные комплексы, олигомерные агрегаты и экзотические формы, сопровождающие патологические процессы. Полиморфизм белков может быть результатом полипликации или дупликации гена, экспрессии семейства гомологичных генов, множественного аллелизма, дифференциального процессинга мРНК, мутационных процессов, посттрансляционных модификаций белка. Именно наличие множественных форм дает возможность тонко регулировать уровень активности КК, что обеспечивает его адаптивную пластичность.
ВЫВОДЫ
1. Кр-КК система мозга и печени крыс, подвергнутых общему однократному рентгеновскому излучению, обладает значительной адаптационной пластичностью, которая стимулируется Кр, получаемым животными в качестве пищевой добавки.
2. В отличие от АЛТ динамика пострадиационных изменений уровней активности КК и АСТ печени облученных крыс имеет аналогичный характер, что указывает на совместное участие этих ферментов в пострадиационном адаптивном репрограммировании энергетического обмена митохондрий, направленном на замещение пирувата глутаратом.
3. Адаптивная пластичность КК имеет тканеспецифический характер, обусловленный количественным содержанием фермента в ткани.
4. Колебательный характер пострадиационных изменений уровней активности мозговой и печеночной КК во времени свидетельствует, с одной стороны, об отдаленных эффектах облучения на фермент, с другой стороны, о включении различных механизмов адаптации.
Список литературы
Хочачка П., Сомеро Дж. Биохимическая адаптация. М.: Мир, 1988. 568 с. [Khochachka P., Somero Dzh. Biokhimicheskaya adaptatsiya. M.: Mir, 1988. 568 p. (In Russian)]
Storey K.B., Storey J.M. Biochemical Adaptation to Extreme Environments. Integrative Physiology in the Proteomics and Post-Genomics Age / Ed. W. Walz. Totowa. NJ. Humana Press Inc., 2005. P. 169–197.
Azzam E.I., Jay-Gerin J.P., Pain D. Ionizing radiation-induced metabolic oxidative stress and prolonged cell injury // Cancer Lett. 2012. V. 327. № 1–2. P. 48–60.
Kim E.J., Lee M., Kim D.Y. et al. Mechanisms of energy metabolism in skeletal muscle mitochondria following radiation exposure // Cells. 2019. V. 8. № 9. P. 950.
Schlattner U., Kay L., Tokarska-Schlattner M. Mitochondrial proteolipid complexes of creatine kinase // Subcell. Biochem. 2018. V. 87. P. 365–408.
Wallimann T., Tokarska-Schlattner M., Schlattner U. The creatine kinase system and pleiotropic effects of creatine // Amino Acids. 2011. V. 40. № 5. P. 1271–1296.
Sersa I., Kranjc S., Sersa G. et al. Study of radiation induced changes of phosphorus metabolism in mice by 31P NMR spectroscopy // Radiol. Oncol. 2010. V. 44. № 3. P. 174–179.
Нерсесова Л.С., Петросян М.С., Каралова Е.М. и др. Оценка радиомодифицирующего действия креатина на выживаемость, креатин-креатинкиназную систему печени, ядерно-ядрышковый аппарат гепатоцитов и клетки периферической крови крыс // Радиац. биология. Радиоэкология. 2019. Т. 56. № 6. С. 599–609. [Nersesova L.S.. Petrosyan M.S. Karalova E.M. et al. Otsenka radiomodifitsiruyushchego deystviya kreatina na vyzhivayemost. kreatin-kreatinkinaznuyu sistemu pecheni. yaderno-yadryshkovyy apparat gepatotsitov i kletki perifericheskoy krovi krys // Radiat. biol. Radioecol. 2019. V. 56. № 6. P. 599–609 (In Russian)]
Петросян М.С., Нерсесова Л.С., Газарянц М.Г. и др. Действие низкоинтенсивного электромагнитного излучения с частотой 900 MГц на активности ферментов, участвующих в энергетическом обмене мозга крыс // Радиац. биология. Радиоэкология. 2015. Т. 55. № 6. С. 1–7. [Petrosyan M.S., Nersesova L.S., Gazaryants M.G. et al. Deystviye nizkointensivnogo elektromagnitnogo izlucheniya s chastotoy 900 МГts na aktivnosti fermentov. uchastvuyushchikh v energeticheskom obmene mozga krys // Radiation biol. Radioecol. 2015. V. 55. № 6. P. 1–7 (In Russian)]
Cooke M., Cribb P.J. Ch. 9. Effective nutritional supplement combination // Cooke M., Cribb P.J., Ziegenfuss T., Kalman D.S., Antonio J. Nutritional supplements in sports and exercise. Switzerland: Humana press, 2015. C. 259–319.
Петрова Т.А., Лызлова С.Н. Оптимизация условий определения активности креатинкиназы колориметрическим методом // Вестн. ЛГУ. 1985. Т. 24. С. 88–90. [Petrova T.A.. Lyzlova S.N. Optimizatsiya usloviy opredeleniya aktivnosti kreatinkinazy kolorimetricheskim metodom // Vestn. LGU. 1985. V. 24. P. 88–90 (In Russian)]
Tietz N.W. Clinical guide to laboratory tests. 3d ed. Saunders Co.: Philadelphia, 1995. 374 p.
Куценко С.А., Бутомо Н.В., Гребенюк А.Н. и др. Военная токсикология, радиобиология и медицинская защита / Под ред. С.А. Куценко. СПб.: Фолиант, 2004. 528 с. [Kutsenko S.A., Butomo N.V., Grebenyuk A.N. et al. Voyennaya toksikologiya. radiobiologiya i meditsinskaya zashchita / Ed. S.A. Kutsenko. Sankt-Peterburg: Foliant, 2004. 528 р. (In Russian)]
Ильичева В.Н., Ушаков Б.Н. Влияние ионизирующего излучения на энергетический обмен в различных отделах коры головного мозга // Рос. мед.-биол. вестн. им. акад. И.П. Павлова. 2013. Т. 1. С. 31–36. [Ilicheva V.N., Ushakov B.N. Vliyaniye ioniziruyushchego izlucheniya na energeticheskiy obmen v razlichnykh otdelakh kory golovnogo mozga // I.P. Pavlov Russian Medical Biological Herald. 2013. V. 1. P. 31–36 (In Russian)]
Collins-Underwood J.R., Zhao W.L, Sharpe J.G., Robbins M.E. NADPH oxidase mediates radiation-induced oxidative stress in rat brain microvascular endothelial cells // Free Radic. Biol. Med. 2008. V. 45. № 6. P. 929–938.
Бурлакова Е.Б., Конрадов А.А., Мальцева Е.Л. Действие сверхмалых доз биологически активных веществ и низкоинтенсивных физических факторов // Хим. физ. 2003. Т. 22. № 2. С. 21–40. [Burlakova E.B., Konradov A.A., Maltseva E.L. Deystviye sverkhmalykh doz biologicheski aktivnykh veshchestv i nizkointensivnykh fizicheskikh faktorov // Rus. J. Phys. Chem. 2003. V. 22. № 2. P. 21–40 (In Russian)]
Andres R.H., Ducray A.D., Schlattner U. et al. Functions and effects of creatine in the central nervous system // Brain Res. Bull. 2008. V. 76. № 4. P. 329–343.
Шевцов В.И., Ирьянов Ю.М., Петровская Н.В. и др. Методика моделирования острой лучевой болезни у крыс линии Август // Современные наукоемкие технологии. 2004. № 1. С. 95. [Shevtsov V.I., Irianov Yu.M., Petrovskaya N.V. et al. Metodika mode-lirovaniya ostroy luchevoy bolezni u krys linii Avgust // Modern High Technol. 2004. № 1. P. 95 (In Russian)]
Lyzlova S.N., Stefanov W.E. Phosphagen kinases. Boston: CRC Press, 1991. 240 p.
Koufen P., Stark G. Free radical induced inactivation of creatine kinase: sites of interaction, protection, and recovery // Biochim. Biophys. Acta. 2000. V. 1501. № 1. P. 44–50.
Wyss M., Braissant O., Pischel I. et al. Creatine and creatine kinase in health and disease – a bright future ahead? // Subcell. Biochem. 2007. V. 46. P. 309–334.
Reisz J.A., Bansal N., Qian J. et al. Effects of ionizing radiation on biological molecules-mechanisms of da-mage and emerging methods of detection // Antioxid. Redox. Signal. 2014. V. 21. № 2. P. 260–292.
Баранцева М.Ю. Сочетанное воздействие химического и радиационного факторов низкой интенсивности на цитогенетические и биохимические реакции организма экспериментальных животных: Автореф. дис. … канд. мед. наук. М.: Институт медико-биологических проблем РАН, 2007. 26 с. [Barantseva M.Yu. Sochetannoye vozdeystviye khimicheskogo i radiatsionnogo faktorov nizkoy intensivnosti na tsitogeneticheskiye i biokhimicheskiye reaktsii organizma eksperimentalnykh zhivotnykh: Abstract of PhD thesis for the med. sci. M.: Institute of Biomedical Problems of RAS, 2007. 26 p. (In Russian)]
Аль Меселмани М.А., Евсеев А.В., Солодова Е.К. и др. Энергетический обмен и морфологические изменения в семенниках после однократного низкодозового радиационного облучения крыс // Обзоры по клин. фармакол. и лек. терапии. 2010. Т. 8. № 4. С. 40–46. [Al Meselmani M.A., Evseyev A.V., Solodova E.K. et al. Energeticheskiy obmen i morfolo-gicheskiye izmeneniya v semennikakh posle odnokratnogo nizkodozovogo radiatsionnogo oblucheniya krys // Rev. Clin. Pharm. and Drug Therapy. 2010. V. 8. № 4. P. 40–46 (In Russian)]
Auricchio A., Zhou R., Wilson J.M., Glickson J. In vivo detection of gene expression in liver by 31P nuclear magnetic resonance spectroscopy employing creatine kinase as a marker gene // Proc. Natl. Acad. Sci. USA. 2001. V. 98 № 9. P. 5205–5210.
Satoh S., Tanaka A., Hatano E. et al. Energy metabolism and regeneration in transgenic mouse liver expressing creatine kinase after major hepatectomy // Gastroenterology. 1996; V. 110. № 4. P. 1166–1174.
Hatano E., Tanaka A., Iwata S. et al. Induction of endotoxin tolerance in transgenic mouse liver expressing creatine kinase // Hepatology. 1996. V. 24. № 3. P. 663–669.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


