Радиационная биология. Радиоэкология, 2021, T. 61, № 2, стр. 180-188
Действие γ-излучения в малых дозах на цитогенетические параметры проростков семян лука Allium cepa в экспериментах разной длительности
А. В. Зуева 1, *, Е. А. Трофимова 1, Д. В. Дементьев 1, А. Я. Болсуновский 1
1 Институт биофизики СО РАН, Федеральный исследовательский центр “Красноярский научный центр СО РАН”
Красноярск, Россия
* E-mail: an.v.zueva@ya.ru
Поступила в редакцию 29.01.2020
После доработки 02.09.2020
Принята к публикации 16.12.2020
Аннотация
Изучена реакция проростков семян лука (Allium cepa L.) на воздействие γ-излучения в диапазоне малых доз (от 10 до 140 мГр) по ростовым и цитогенетическим параметрам при разной длительности воздействия (24 и 48 ч облучения). Наиболее чувствительными параметрами к γ-излучению являются частота встречаемости аномальных клеток и микроядер, которые достоверно отличаются от контроля при минимальных дозах 20 и 70 мГр соответственно. Количество клеток с микроядрами и хромосомными аберрациями возрастало линейно с увеличением поглощенной дозы, но для частоты микроядер выявлены отличия при разных временах облучения. Для образования хромосомных аберраций основным фактором является доза облучения, в то время как для выхода микроядер длительность воздействия также становится главным фактором наряду с дозовым эффектом. Проведено ранжирование параметров биотеста в отношении малых доз γ-излучения.
Испытания ядерного оружия и развитие атомной энергетики (включая аварии на АЭС) привели к поступлению техногенных радионуклидов в окружающую среду. В районах радиоактивного загрязнения живые организмы и население обычно подвергаются хроническому облучению малыми дозами ионизирующего излучения. Негативный эффект малых доз радиации (менее 200 мГр по данным UNSCEAR 2006 [1]) базируется на линейной беспороговой концепции (ЛБК). Составляя основу стандартов радиационной защиты, ЛБК предполагает экстраполяцию биологических эффектов ионизирующего излучения высоких доз на низкие [2, 3]. Открытие таких явлений, как эффект гиперрадиочувствительности, эффект свидетеля, адаптивный ответ и гормезис поставили под сомнение правомерность использования ЛБК для оценки радиационных рисков. Накопление данных о действии радиации на объекты живой природы показало, что зависимость доза–эффект на самом деле имеет сложный и неоднозначный характер. Объекты радиобиологических исследований (клетки растений и животных), а также их параметры, используемые в качестве индикаторов радиационного воздействия (ростовые показатели, пролиферативная активность, цитогенетические нарушения), имеют разную чувствительность к ионизирующему излучению, которая, в свою очередь, по-разному проявляется на различных отрезках дозовых величин [2–7].
Луковый тест (Allium test) традиционно используется для оценки токсичности факторов различной природы, включая действие ионизирующего излучения [8, 9]. В экспериментах используются как луковицы, так и семена этого растения [10, 11]. К одним из основных преимуществ лукового биотеста относится разнообразие показателей, используемых для оценки степени воздействия негативного фактора, представляющих собой разные уровни организации живой материи: от клеточного до организменного.
Результаты исследований по оценке влияния ионизирующего излучения в области малых доз на систему лукового и других растительных биотестов неоднозначны [6, 7, 10–14] и обусловливаются стохастическим характером действия изучаемого фактора на молекулярном уровне, определяя отсутствие четкой дозовой зависимости [6, 15]. В работе S.A. Geras’kin и соавт. [6] облучение проросших семян ячменя проводили γ-источником 137Cs при мощности дозы 500 мГр/ч. Кратковременное (от 6 мин до 2 ч) облучение семян таким источником в диапазоне малых доз от 50 до 1000 мГр привело к повышению уровня клеток с хромосомными нарушениями. В работе A.Y. Bolsunovsky и соавт. [14] облучение проростков семян лука проводили 24 ч при мощности дозы облучения, более чем на два порядка ниже (до 4.2 мГр/ч). Облучение проростков семян лука в малых дозах (50 и 100 мГр) при таких условиях также привело к достоверному возрастанию уровня хромосомных нарушений в клетках по сравнению с контролем [14]. Других работ по оценке эффектов облучения семян малыми дозами, но разной длительностью, нам неизвестно. Однако в работе S.A. Geras’kin и соавт. [16] кратковременное облучение семян ячменя разными мощностями доз и, следовательно, разной длительностью, приводило к разным эффектам роста корней, несмотря на одинаковую поглощенную дозу (10–20 Гр).
Известно, что облучение клеток на начальных стадиях клеточного цикла (первые 16 ч у лука) приводит к возникновению хромосомных нарушений в процессе деления клетки [17, 18]. Поэтому при увеличении длительности воздействия следовало бы ожидать увеличения количества аномальных клеток. Но, с другой стороны, запускаемые в ответ на воздействие процессы репарации призваны нивелировать негативные эффекты.
Цель настоящей работы – оценить действие γ-излучения разной длительности в малых дозах на ростовые и цитогенетические показатели корневой меристемы проростков семян лука Allium cepa.
МАТЕРИАЛЫ И МЕТОДИКА
В эксперименте использовали семена репчатого лука (Allium cepa L.) (2n = 16) сорта “Штутгартер ризен”. Перед началом эксперимента семена выдерживали в течение 14 сут при температуре 4°C для активации и синхронизации процесса прорастания и одновременного вступления в митоз большего числа клеток. Семена лука проращивали в полипропиленовых контейнерах на фильтровальной бумаге, смоченной в дистиллированной воде, в темноте при комнатной температуре. Всхожесть семян оценивали на 7-й день проращивания по ГОСТ 12038-84 [19], и она составляла 88%. Для облучения использовали проростки с длиной первичного корня – 3 мм.
На рис. 1 приведена схема эксперимента по облучению проростков семян лука источником 137Cs с активностью 12 МБк. Ранее эту схему использовали в экспериментах по облучению побегов растения Elodea сanadensis [20]. Проростки семян лука размещали на расстоянии 2 см (уровень R1), 3.5 см (уровень R2) и 5 см (уровень R3) от центра радиоактивного источника. Значения мощности дозы определялись расстоянием проростков от источника и были проверены прямыми измерениями дозиметром ДКГ-02У (НПП “Доза”, Россия). Значения мощности дозы для уровней облучения R3, R2 и R1 были равны 0.4, 0.8 и 2.9 мГр/ч соответственно. При этом поглощенные дозы составляли 10 мГр (уровень R3), 20 мГр (уровень R2), 70 мГр (уровень R1) для 24 ч облучения и 20 мГр (R3), 40 мГр (R2), 140 мГр (R1) для 48 ч. Поглощенная доза в контроле (К) – около 0.01 мГр.
Рис. 1.
Схема эксперимента по облучению проростков семян лука источником 137Cs. Проростки размещали на расстоянии 2 см (R1), 3.5 см (R2) и 5 см (R3) от центра радиоактивного источника.
Fig. 1. The experimental scheme on irradiation of onion seed seedlings with a 137Cs source. The seedlings were placed at a distance of 2 cm (R1), 3.5 cm (R2) and 5 cm (R3) from the center of the radioactive source.

Для каждого уровня облучения (R1, R2, R3) и контроля (K) было отобрано по 40 проростков. Пророщенные семена размещали в кристаллизаторе на двух слоях фильтровальной бумаги, смоченной дистиллированной водой. Облучение проводили в инкубаторе Sanyo MIR-254 (Panasonic, Япония) в темноте при температуре 21°C в течение 24 и 48 ч. Контролем служили необлученные проростки, которые культивировались в идентичных с облученными проростками условиях. Через 24 ч из каждого уровня облучения и контроля, случайным образом, отбирали по 20 штук проростков и фиксировали в уксусном алкоголе. Спустя следующие 24 ч (общее время экспозиции 48 ч) процедуру повторяли с оставшимися проростками.
В качестве индикаторов радиационного повреждения использовали следующие параметры: длину корней, митотический и фазовые индексы (доля клеток, находящихся на разных стадиях митоза), микроядерный индекс, долю аномальных клеток с различными типами нарушений на стадии ана-телофазы митоза.
Сразу после облучения корни фиксировали в уксусном алкоголе (3 : 1) в течение 24 ч, затем помещали в 1%-ный ацетоорсеин на 24 ч. Окрашенные корни дважды промывали в 45%-ном растворе уксусной кислоты от избытка красителя, мацерировали в том же растворе при температуре 60°C в течение 10 мин. После измерения длины корня меристему отделяли скальпелем и готовили давленый микропрепарат.
Учет цитогенетических параметров проводили при помощи светового микроскопа (Olympus CX31). Подсчет митотического индекса (МИ) и числа микроядер (МЯ) проводили на фотографиях полей зрения при помощи программы ImageJ 1.46r: Cell counter plugin [21]; просматривали 5 слайдов на каждый уровень облучения (2000–3000 клеток на уровень облучения, от 500 клеток на препарат, в среднем 600 клеток).
Для учета аномалий митоза было просмотрено от 12 до 20 препаратов (от 1100 до 1800 клеток на каждый уровень облучения). Отмечались следующие типы аномалий: фрагменты и мосты (одинарные, двойные и множественные), блуждающие хромосомы, множественные нарушения (наличие в клетке нескольких нарушений разных типов). К “прочим” аномалиям относили микроядра и их потенциальные предшественники (фрагменты хроматина нестандартной конфигурации).
Накопление, корректировку, систематизацию исходной информации и визуализацию полученных результатов осуществляли в электронных таблицах Microsoft Office Excel 2013. Статистический анализ проводили с использованием программы PAST 3.23 [22].
Количественные показатели оценивались на предмет соответствия нормальному распределению, для этого использовали критерий Шапиро–Уилка. Статистическую значимость различий между группами для параметров с нормальным распределением значений в выборках “длина корня” и “митотический индекс” оценивали при помощи однофакторного дисперсионного анализа (F-критерий), для параметров “микроядерный индекс” и “частота аберрантных клеток”, распределение выборочных значений которых не соответствовало нормальному, – при помощи непараметрического критерия Краскела–Уоллиса (H-критерий). В случае обнаружения статистически значимых различий между группами дополнительно проводили сравнение совокупностей попарно при помощи апостериорного критерия Тьюки или критерия Данна соответственно. Сравнение временных и дозовых эффектов проводили с помощью двухфакторного дисперсионного анализа (F-критерий). Для сравнения углов наклона дозовых зависимостей применяли ковариационный анализ (F-критерий). На рисунках и в таблицах представлены средние значения и их стандартные ошибки.
РЕЗУЛЬТАТЫ
В проведенных экспериментах длительностью облучения 24 ч длины корней семян лука, находившихся на разных уровнях облучения и в контроле, достоверно между собой не отличались (F = 1.76, p = 0.16). Угнетение роста корней наблюдалось только при облучении проростков, расположенных ближе всего к источнику ионизирующего излучения (уровень R1, 48 ч), что соответствовало поглощенной дозе 140 мГр (F = = 3.61, p = 0.02) (табл. 1).
Таблица 1.
Влияние γ-излучения на рост корней семян лука и митотическую активность клеток при разной длительности облучения Table 1. The influence of γ-radiation on the onion seed roots growth and mitotic activity of cells for different duration of irradiation (T, h)
| Т, ч | Уровень облучения | Доза, мГр | Длина корней, мм | Профаза % | Метафаза % | Анафаза % | Телофаза % | МИ % |
|---|---|---|---|---|---|---|---|---|
| 24 | K | 0.01 | 9.9 ± 1.7 | 5.0 ± 0.7 | 0.8 ± 0.1 | 0.7 ± 0.1 | 1.5 ± 0.3 | 7.9 ± 0.7 |
| R3 | 10 | 11.0 ± 2.3 | 3.6 ± 0.6 | 0.9 ± 0.2 | 0.9 ± 0.3 | 1.8 ± 0.2 | 7.3 ± 1.0 | |
| R2 | 20 | 9.8 ± 1.9 | 4.3 ± 0.7 | 1.1 ± 0.2 | 0.8 ± 0.2 | 1.8 ± 0.3 | 8.1 ± 0.8 | |
| R1 | 70 | 9.9 ± 1.3 | 5.8 ± 0.5 | 1.0 ± 0.2 | 0.9 ± 0.2 | 1.6 ± 0.2 | 9.3 ± 0.6 | |
| 48 | K | 0.01 | 21.2 ± 3.2 | 2.8 ± 0.4 | 1.2 ± 0.2 | 0.7 ± 0.2 | 2.4 ± 0.4 | 7.1 ± 0.9 |
| R3 | 20 | 20.0 ± 4.0 | 3.2 ± 0.4 | 1.0 ± 0.3 | 0.9 ± 0.2 | 1.5 ± 0.4 | 6.5 ± 0.7 | |
| R2 | 40 | 20.3 ± 3.5 | 3.8 ± 0.5 | 1.0 ± 0.2 | 1.0 ± 0.3 | 1.8 ± 0.1 | 7.6 ± 0.8 | |
| R1 | 140 | 17.6 ± 3.4* | 4.8 ± 0.7* | 0.9 ± 0.2 | 0.6 ± 0.1 | 2.1 ± 0.3 | 8.4 ± 0.9 |
Значения митотического индекса (МИ) при всех уровнях облучения разной длительностью изменялись в диапазоне от 6.5 до 9.3, в контроле значения МИ были 7.9 и 7.1% для 24 и 48 ч роста соответственно (табл. 1). В результате двухфакторного дисперсионного анализа было показано, что факторы времени и мощности дозы облучения (удаленности от источника) на величину митотического индекса не влияют. Однако в целом нельзя не заметить тенденцию, хотя и статистически не достоверную, к снижению пролиферативной активности с течением времени (табл. 1).
Рассмотрение фазовых индексов показало, что при облучении проростков семян лука, находившихся на первом уровне облучения (R1) в течение 48 ч, доля клеток, вступивших в стадию профазы больше, чем в соответствующем контроле (F = = 3.18, p = 0.05). Значения остальных индексов (доля клеток на стадиях мета-, ана- и телофазы) друг от друга существенно не отличались (табл. 1).
Количество микроядерных клеток (МЯ) корневой меристемы облученных семян лука, находившихся на первом уровне облучения (R1) в течение 24 ч (H = 11.58, p = 0.008) и 48 ч (H = 13.92, p = 0.002), значительно выше, чем в контроле (табл. 2). Была выявлена тенденция к увеличению доли клеток с числом микроядер больше одного (МЯ > 1) в корешках семян, находящихся на первых экспозиционных уровнях (H = 9.63, p = 0.009 и H = 6.14, p = 0.014 для 24 и 48 ч облучения соответственно). Также наблюдалось снижение количества микроядер с увеличением времени облучения (F = 6.49, p = 0.015). Так, микроядерный индекс в 48-часовом контроле ниже в 2 раза, чем в 24-часовом. Разница на первом (R1) и втором (R2) экспозиционных уровнях несколько меньше, однако клетки с числом микроядер больше одного (МЯ > 1) после 48 ч облучения исчезают или их доля существенно снижается (табл. 2).
Таблица 2.
Влияние γ-излучения на индукцию формирования микроядер (МЯ) в клетках на стадии интерфазы при разной длительности облучения Table 2. The influence of γ-radiation on the micronuclei induction in the interphase cells for different duration of irradiation (T, h)
| Т, ч | Уровень облучения | Доза, мГр | Число интерфазных клеток | МЯ, % | МЯ > 1, % |
|---|---|---|---|---|---|
| 24 | K | 0.01 | 2751 | 0.6 ± 0.4 | 0.04 ± 0.1 |
| R3 | 10 | 2764 | 1.2 ± 0.2 | 0.2 ± 0.2 | |
| R2 | 20 | 2761 | 1.2 ± 0.4 | 0.1 ± 0.1 | |
| R1 | 70 | 2671 | 5.3 ± 0.5* | 0.7 ± 0.1* | |
| 48 | K | 0.01 | 2705 | 0.3 ± 0.1 | 0.04 ± 0.1 |
| R3 | 20 | 2652 | 0.5 ± 0.1 | 0 | |
| R2 | 40 | 2737 | 0.8 ± 0.2 | 0 | |
| R1 | 140 | 2838 | 4.3 ± 0.7* | 0.4 ± 0.2* |
Доля аберрантных клеток на первом (R1) и втором (R2) уровнях облучения достоверно превышала контрольный (К) показатель (H = 44.17 и H = 49.93, p < 0.05) как для 24, так и 48 ч облучения (табл. 3). Однако, в отличие от микроядер (табл. 2), с увеличением длительности облучения число аберрантных клеток на первом и втором уровнях облучения увеличивается (F = 9.45, p = 0.002). Так, в корневой меристеме семян лука, находившихся на первом экспозиционном уровне (R1) в течение 48 ч, доля аберрантных клеток в 2 раза больше (26.8%), чем при облучении в течение 24 ч – 13.1% (табл. 3). В данном случае это может быть объяснено эффектом увеличения поглощенной дозы облучения.
Таблица 3.
Влияние γ-излучения на возникновение аномальных делений в клетках на стадии ана-телофазы при разной длительности облучения Table 3. The influence of γ-radiation on the induction of abnormal cell divisions at the ana-telophase stage for different duration of irradiation (T, h)
| Т, ч | Уровень облучения | Доза, мГр | Аберрантные клетки, % | Аберрантные клетки с нарушениями разных типов, % | ||||
|---|---|---|---|---|---|---|---|---|
| фрагменты | мосты | блуждающие хромосомы | прочие | множес-твенные | ||||
| 24 | K | 0.01 | 1.2 ± 0.3 | 0.3 ± 0.1 | 0.2 ± 0.1 | 0.2 ± 0.1 | 0.2 ± 0.1 | 0.3 ± 0.1 |
| R3 | 10 | 3.0 ± 0.5 | 0.9 ± 0.3 | 0.9 ± 0.3 | 0.9 ± 0.2* | 0.1 ± 0.1 | 0.2 ± 0.1 | |
| R2 | 20 | 3.3 ± 0.6* | 1.4 ± 0.3* | 0.5 ± 0.2 | 0.7 ± 0.2 | 0.3 ± 0.1 | 0.4 ± 0.1 | |
| R1 | 70 | 13.1 ± 1.5* | 7.2 ± 0.9* | 1.0 ± 0.3 | 1.8 ± 0.5* | 1.1 ± 0.3* | 2.0 ± 0.4* | |
| 48 | K | 0.01 | 1.0 ± 0.3 | 0.3 ± 0.1 | 0.3 ± 0.1 | 0.1 ± 0.1 | 0.2 ± 0.2 | 0.1 ± 0.1 |
| R3 | 20 | 3.0 ± 0.4* | 1.4 ± 0.3* | 0.6 ± 0.2 | 0.5 ± 0.2 | 0.4 ± 0.2 | 0.1 ± 0.1 | |
| R2 | 40 | 4.8 ± 0.8* | 1.5 ± 0.4* | 1.4 ± 0.6 | 0.6 ± 0.2 | 0.7 ± 0.3 | 0.6 ± 0.2 | |
| R1 | 140 | 26.8 ± 4.4* | 12.1 ± 1.9* | 2.0 ± 0.4* | 3.8 ± 0.8* | 2.0 ± 0.5* | 6.9 ± 2.3* | |
Вклад в формирование общей доли аномальных делений при облучении в основном вносил такой тип нарушений, как фрагменты, который достоверно отличался от контроля почти на всех уровнях облучения (табл. 3). Другие типы нарушений (мосты, множественные нарушения, блуждающие хромосомы и прочие) достоверно отличались от контроля только на первом уровне (R1), как при 24, так и 48 ч облучения. Таким образом, в диапазоне малых доз γ-излучения от 20 до 140 мГр общая доля аномальных делений в клетках (или отдельных типов нарушений) достоверно превышала контрольный уровень (табл. 3).
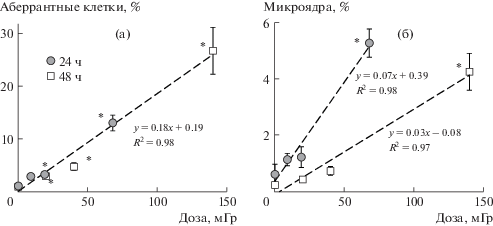
На рис. 2 представлены дозовые зависимости клеток с частотой аномальных митозов (а) и микроядер (б). Для обоих параметров зависимость имеет линейный характер, однако углы наклона 24 и 48-часовых дозовых зависимостей частоты микроядер различаются (F = 49.2, p < 0.05), в то время как для частоты клеток с нарушениями таких различий не наблюдается (F = 0.03, p = 0.95). Из всего вышеизложенного следует, что для параметра “частота микроядер” фактор времени (длительность облучения) имеет первостепенное значение, в сравнении с мощностью дозы облучения (удаленности от источника излучения).
Рис. 2.
Зависимость частоты нарушений на стадии ана-телофазы (а) и частоты микроядер (б) в клетках от величины поглощенной дозы при разной длительности γ-облучения. * Статистически значимое отличие от контрольного уровня (р < 0.05).
Fig. 2. Absorbed dose dependence of the frequencies aberrations in ana-telophase stage (a) and micronuclei (b) in the cells for different duration of γ-irradiation. * Statistically significant difference from the control level (p < 0.05).
ОБСУЖДЕНИЕ
Корни растений являются удобными объектами для изучения влияния факторов различной природы, в том числе и радиации. Это связано с рядом отличительных особенностей этого органа, например, таких, как интенсивная пролиферация и раннее начало роста. Рост корня обусловливается тремя основными процессами: 1 – пролиферация клеток корневой меристемы, 2 – переход клеток корневой меристемы к растяжению и 3 – собственно рост клеток в зоне растяжения [23]. Все три процесса взаимосвязаны и являются ключевыми для понимания воздействия радиационного фактора на динамику ростовых процессов в корнях.
В проведенном нами эксперименте было зарегистрировано угнетение роста корней семян лука только при максимальной поглощенной дозе 140 мГр (48 ч облучения). В наших предыдущих работах с облучением проростков семян лука в диапазоне доз от 20 до 13 000 мГр в течение 24 ч статистически значимого эффекта на длину корней обнаружено не было [14]. Но было показано угнетение ростовых параметров проростков при дозе 100 мГр на 6-е сутки после облучения [13]. В работе S.G. Vaijapurkar и соавт. [24] угнетения роста корней луковиц не регистрировали при дозах менее 5000 Гр и времени наблюдения до 280 ч.
Способность корня продолжать рост после облучения объясняется спецификой клеточных популяций меристемы. При облучении в определенных пределах, не превышающих летального уровня, происходит подавление деления основной части меристемы, с последующим выходом поврежденных клеток за ее пределы, а именно в зону растяжения. В то же время клетки покоящегося центра начинают активно делиться, восстанавливая тем самым основную часть меристемы. Устойчивость клеток покоящегося центра к действию радиации вызвана их пониженной метаболической активностью, а также протяженностью клеточного цикла (более длительный период G1) [23, 25].
Облучение приводит к снижению роста корня только спустя некоторое время после начала воздействия, что нами и наблюдалось ранее [13]. Замедление роста в таком случае объясняется снижением скорости перехода клеток к растяжению, которое в свою очередь обусловлено подавлением делений. Интенсивность деления клеток очень чувствительна к различным факторам. Поэтому при снижении скорости делений под действием ионизирующего излучения стоит ожидать снижения скорости выхода клеток из меристемы, хотя само воздействие на переход клеток к растяжению не влияет [23].
Одним из важных эффектов действия радиации на живые клетки является препятствие нормальной митотической активности. Замедление деления клеток отражается на величине митотического индекса, и, как правило, снижение значения этого показателя связано с остановкой клеток на какой-либо стадии митоза. Наш эксперимент показал, что в целом величина митотического индекса остается постоянной во времени и не зависит от дозы ионизирующего излучения. Однако выявленный нами факт накопления клеток на стадии профазы в меристеме проростков, получивших дозу 140 мГр, косвенно свидетельствует о начале задержки клеточного цикла. При этом используемой в эксперименте мощности дозы недостаточно для того, чтобы эффект отразился на величине митотического индекса в целом. Так, например, в работе S.G. Vaijapurkar и соавт. [24] было отмечено снижение митотической активности корневой меристемы головок лука при 20 000 мГр. В работе R. Zaka и соавт. [3] при облучении 6-дневных проростков гороха показано уменьшение митотического индекса при дозе 400 мГр.
Ранее считалось, что задержка делений обусловливается главным образом задержкой профазы: действие облучения приводит к нарушению синтеза ДНК и процессов редупликации и, как следствие, затруднению конденсации хромосом в профазе; завершение профазы, в свою очередь, свидетельствует о завершении процесса восстановления [18, 26]. В какой-то степени данное утверждение остается верным, однако в настоящее время изменения в динамике деления клеток связывают с действием регуляторов прохождения клеточного цикла, осуществляющимся во время перехода между фазами. Решающими моментами в регуляции клеточного цикла являются переходы между пресинтетической и синтетической фазами (G1/S) и постсинтетической фазой и началом митоза (G2/M). Связано это с наличием особых контрольных точек. В G1/S-переходе это точка рестрикции, в которой клетка “принимает решение” о подготовке к следующему циклу (запуск репликации) или о выходе из него. В фазе G2/M – контрольная точка, которая останавливает клетки на этой фазе, при обнаружении повреждений в ДНК [27]. С данной точки зрения, задержку клеток в профазе в наших экспериментах (табл. 1) можно рассматривать как следствие продления времени для репарации радиационно-индуцированных разрывов ДНК [28]. В связи с этим имеет значение то, на какой стадии клетка подверглась радиационному воздействию. Клетки, находящиеся в начале стадии G1, наименее чувствительны к действию радиации. При этом если клетка облучилась, находясь на стадии поздней профазы или после нее, – процесс деления не прерывается. При облучении клеток, пребывающих на стадиях G2 и S (до стадии ранней профазы), возможна остановка митоза или его временная задержка с последующим восстановлением, в зависимости от полученной дозы [24].
Среди всех оцениваемых параметров воздействия радиации на организм наиболее простым и эффективным показателем цитологических повреждений является уровень микроядер. Кроме того, считается, что количество радиационно-индуцированных микроядер сильно коррелирует с дозой [29].
В данной работе (табл. 2, рис. 2, б) нами показано достоверное увеличение доли клеток с микроядрами в проростках семян, расположенных ближе всего к источнику излучения (максимальные дозы облучения) при величинах поглощенных доз 70 и 140 мГр (24 и 48 ч воздействия). В нашей ранней работе с проростками семян лука повышение уровня микроядер отмечалось, начиная с дозы 1000 мГр при 24 ч облучения [14]. Однако в работе S.G. Vaijapurkar и соавт. [24] увеличение доли микроядерных клеток облученных корней головок лука происходит при более высокой дозе 4000 мГр. Также нами было выявлено снижение уровня микроядер с течением времени наблюдения. В работе [24] тоже показано снижение количества микроядер по мере наблюдения длительностью до 120 ч, но в качестве стартовой точки было выбрано время экспозиции 48 ч. Обнаруженное явление может быть объяснено исходя из нижеследующего. В зависимости от причины возникновения и механизма образования микроядра возможны различные варианты дальнейшего развития событий в клетке. Хромосомные микроядра (образованные из “отставшей” хромосомы) достаточно часто имеют интактную ядерную оболочку, оставаясь за счет этого функционально активными, т.е. способными осуществлять процессы транскрипции и трансляции. В том случае, если в течение интерфазы произойдет репарация повреждений кинетохорного района, во время следующего митоза хромосома может встроиться в веретено деления и войти в состав ядра одной из дочерних клеток. Также не исключается вариант, в котором хромосома, не имеющая нормального кинетохора, может примкнуть к одной из хромосомных групп в анафазе и войти в состав ядра. Микроядра, образовавшиеся из интерфазного хроматина (ядерный блеббинг), ацентрических фрагментов или в результате разрушения хромосомного моста, в большинстве случаев деградируют. Если же элиминация микроядра невозможна, а урон, нанесенный клетке его присутствием, не совместим с жизнью, происходит ее гибель [30, 31].
Очень небольшое количество меристематических клеток делится поперечно, т.е. в радиальном направлении для увеличения обхвата корня, в то время как большинство клеток делится в продольном направлении. Часть клеток, пройдя полный клеточный цикл, переходит в следующую за меристемой зону корня, формируя клеточную популяцию F1 [32]. В связи с этим ранее была предложена модификация микроядерного анализа, предполагающая подсчет клеток с микроядрами, располагающимися именно в этой части корня (F1) [32]. В свою очередь D.M. Leme и M.A. M-Morales [8] считают анализ хромосомных аберраций вкупе с учетом микроядер в меристематических клетках равноценным анализу микроядер в клетках первого поколения.
Таким образом, выявленное нами снижение уровня микроядер при 48-часовом облучении по сравнению с 24-часовым можно объяснить, во-первых, выходом микроядерных клеток за пределы зоны обнаружения (при используемом нами методе учета микроядер), во-вторых, клеточными процессами, направленными на уничтожение микроядер, и, в-третьих, работой систем репарации.
Клеточный цикл корневой меристемы лука занимает порядка 23 ч, из которых 4 ч приходятся на митоз [17]. К концу 48-часовой экспозиции большинство клеток должны пройти как минимум два клеточных цикла и перейти к третьему. Вполне возможно, что за указанный промежуток времени в клетках корней экспериментальных образцов могли протекать все вышеперечисленные явления.
К основным типам цитологических изменений, наблюдаемым при облучении клеток меристемы, наряду с задержкой митотического цикла, потерей способности к пролиферации и гибели клеток, относится образование хромосомных аберраций, приводящих к появлению патологических митозов [33].
По результатам эксперимента было выявлено достоверное увеличение числа ана-телофазных клеток с хромосомными аберрациями, начиная с поглощенной дозы 20 мГр (табл. 3, рис. 2, а). При этом количество аномальных клеток возрастало при увеличении поглощенной дозы и времени воздействия. В нашей предыдущей работе при облучении проростков семян лука длительностью 24 ч возрастание числа аберрантных клеток происходило при дозе 50 мГр [14].
Клетка считается наиболее чувствительной к воздействию в пресинтетический и синтетический периоды [17, 18]. Поэтому аномалии митоза, наблюдаемые в эксперименте после 24-часового облучения, возникли в течение первых 16 ч в клетках, находящихся на тот момент в соответствующей стадии. В клетках, находящихся на момент облучения на стадии митоза, также могут возникать нарушения, однако зафиксировать их можно только в следующем клеточном цикле [18].
Ранее отмечалось, что наибольший вклад в долю аномальных митозов при облучении вносил такой тип нарушений, как фрагменты, который достоверно отличался от контроля почти на всех уровнях облучения (табл. 3). Это логично, так как данный тип аномалии представляется наиболее вероятным в силу простоты механизма его образования. Также следует отметить существенный вклад нарушений типа “множественные”, который составил 25% от общего числа аномалий при самой высокой поглощенной дозе (140 мГр). Данное явление свидетельствует в пользу того, что при увеличении дозы происходит накопление хромосомных аберраций в пределах одной клетки, а эффективность репарации при этом снижается.
Довольно трудно однозначно сказать, являются ли выявленные отличия цитогенетических параметров (частоты хромосомных аберраций и микроядер) от контроля следствием интенсивности или длительности радиационного воздействия. Схема проведенного эксперимента предполагает скоррелированность временнóй и дозовой переменных: величина поглощенной дозы определялась временем облучения и расстоянием проростков семян от источника излучения (мощность дозы). Как уже отмечалось, на рис. 2 представлены дозовые зависимости клеток с частотой аномальных митозов и микроядер. Дозовая зависимость частоты хромосомных нарушений (рис. 2, а) описывается одним линейным уравнением (y = 0.18x + 0.19, R2 = 0.98) при длительности облучения как 24, так и 48 ч. Однако дозовые зависимости частоты микроядер (рис. 2, б) хотя и имеют линейный характер, но различаются при разных длительностях облучения (24 и 48 ч). Это свидетельствует о том, что для образования хромосомных нарушений основным фактором является доза облучения, в то время как для выхода микроядер длительность воздействия также становится главным фактором наряду с дозовым эффектом.
Результаты эксперимента по облучению проростков семян лука показали, что наиболее чувствительным цитогенетическим параметром является частота встречаемости аберрантных клеток. Достоверные отличия от контроля зарегистрированы на уровне 20 мГр для 24 и 48 ч облучения соответственно. Микроядерный индекс показал достоверные различия только для самых больших уровней доз, используемых в эксперименте (70 и 140 мГр). При этом дозовая зависимость частоты клеток с микроядрами и хромосомными нарушениями имела линейный характер. Угнетение роста корней наблюдалось при облучении проростков в течение 2 сут при дозе 140 мГр. Подавления митотической активности обнаружено не было, однако, при дозе 140 мГр (48 ч облучения) отмечено накопление клеток на стадии профазы, что указывает на начало задержки клеточного цикла. Таким образом, на основании проведенных исследований можно ранжировать параметры биотеста в отношении малых доз γ-излучения по мере убывания чувствительности:
Список литературы
UNSCEAR 2006. Effects of Ionizing Radiation. Uni-ted Nations. Report to the General Assembly, with Scientific Annexes. Volume II: Annex C. Non-targeted and delayed effects of exposure to ionizing radiation. New York: United Nations, 2009. P. 1–79.
Zaichkina S.I., Rozanova O.M., Aptikaeva G.F. et al. Low doses of gamma-radiation induce nonlinear dose responses in mammalian and plant cells // Nonlinear. Biol. Toxicol. Med. 2004. V. 2. № 3. P. 213–221. https://doi.org/10.1080/15401420490519861
Zaka R., Chenal C., Misset M.T. Study of external low irradiation dose effects on induction of chromosome aberrations in Pisum sativum root tip meristem // Mutat. Res. / Genet. Toxicol. Environ. Mutagen. 2002. V. 517. № 1–2. P. 87–99. https://doi.org/10.1016/S1383-5718(02)00056-6
UNSCEAR 2000. Sources and Effects of Ionizing Radiation. United Nations. Report to the General Assembly, with Scientific Annexes. Volume II: Effects. Annex G. Biological effects at low radiation doses. New York: United Nations, 2000. P. 75–161.
Ильин Л.А., Рождественский Л.М., Котеров А.Н., Борисов Н.М. Актуальная радиобиология. М.: Изд. дом МЭИ, 2015. 240 с. [Il’in L.A., Rozhdestvenskij L.M., Koterov A.N., Borisov N.M. Aktual’naja radiobiologija. M.: Izdatel’skij dom MJeI, 2015. 240 p. (in Russian)]
Geras’kin S.A., Oudalova A.A., Kim J.K. et al. Cytogenetic effect of low dose γ-radiation in Hordeum vulgare seedlings: non-linear dose–effect relationship // Radiat. Environ. Biophys. 2007. № 46. 31–41. https://doi.org/10.1007/s00411-007-0094-3
George J.T., Patel B.B., Rane V.A. et al. Non-linear dose response of a few plant taxa to acute gamma radiation // Cytologia. 2014. V. 79. № 1. P. 103–109. https://doi.org/10.1508/cytologia.79.103
Leme D.M., Marin-Morales M.A. Allium cepa test in environmental monitoring: a review on its application // Mutat. Res. / Rev. Mutat. Res. 2009. V. 682. № 1. P. 71–81. https://doi.org/10.1016/j.mrrev.2009.06.002
Bonciu E., Firbas P., Fontanetti C.S. et al. An evaluation for the standardization of the Allium cepa test as cytotoxicity and genotoxicity assay // Caryologia. 2018. V. 71. № 3. P. 191–209. https://doi.org/10.1080/00087114.2018.1503496
Kovalchuk O., Kovalchuk I., Arkhipov A. et al. The Allium cepa chromosome aberration test reliably measures genotoxicity of soils of inhabited areas in the Ukraine contaminated by the Chernobyl accident // Mutat. Res. / Genet. Toxicol. Environ. Mutagen. 1998. № 415. P. 47–57. https://doi.org/10.1016/S1383-5718(98)00053-9
Tkalec M., Malari K., Pavlica M. et al. Effects of radio-frequency electromagnetic fields on seed germination and root meristematic cells of Allium cepa L. // Mutat. Res. / Genet. Toxicol. Environ. Mutagen. 2009. № 672. P. 76–81. https://doi.org/10.1016/j.mrgentox.2008.09.022
Синовец С.Ю., Пяткова С.В., Козьмин Г.В. Экспериментальное обоснование использования Аллиум-теста в радиоэкологическом мониторинге // Изв. ВУЗов. Ядерная энергетика. 2009. № 1. С. 32–38. [Sinovec S.Ju., Pjatkova S.V., Koz’min G.V. Jekspe-rimental’noe obosnovanie ispol’zovanija Allium-testa v radiojekologicheskom monitoringe // Izv. VUZov. Jadernaja jenergetika. 2009. № 1. P. 32–38. (in Russian)]
Трофимова Е.А., Дементьев Д.В., Болсуновский А.Я. Влияние γ-излучения на развитие растений из облученных семян и проростков Allium cepa L. // Радиац. биология. Радиоэкология. 2019. Т. 59. №. 3. С. 293–299. [Trofimova E.A., Dementyev D.V., Bolsu-novsky A.Ya. The Effect of γ-Rays on the Development of Plants from Irradiated Seeds and Seedlings of Allium cepa L. // Radiation biology. Radioecology. 2019. V. 59. №3. P. 293–299. (in Russian)]
Bolsunovsky A.Y., Dementyev D.V., Trofimova E.A. et al. Chromosomal aberrations and micronuclei induced in onion (Allium cepa) by gamma-radiation // J. Environ. Radioact. 2019. № 207. P. 1–6. https://doi.org/10.1016/j.jenvrad.2019.05.014
Esnault M.A., Legue F., Chenal C. Ionizing radiation: advances in plant response // Environ. Experim. Botany. 2010. V. 68. № 3. 231–237. https://doi.org/10.1016/j.envexpbot.2010.01.007
Geras’kin S., Churyukin R., Volkova P. Radiation exposure of barley seeds can modify the early stages of plants' development // J. Environ. Radioact. 2017. № 177. P. 71–83. https://doi.org/10.1016/j.jenvrad.2017.06.008
Matagne R. Chromosomal aberrations induced by dialkylating agents in Allium cepa root-tips and their relation to the mitotic cycle and DNA synthesis // Radiat. Botany. 1968. V. 8. № 6. 489–497. https://doi.org/10.1016/S0033-7560(68)80111-5
Ли Д.Е. Действие радиации на живые клетки. М.: Госатомиздат, 1963. 288 с. [Lea D.E. Actions of radiations on living cells. M.: Gosatomizdat; 1963. 288 p. (in Russian)]
ГОСТ 12038-84. Семена сельскохозяйственных культур. Методы определения всхожести. Межгосударственный стандарт. Стандарты на методы контроля. М., 2002. 28 с. [GOST 12038-84. Semena sel’skohozjajstvennyh kul’tur. Metody opredelenija vshozhesti. Mezhgosudarstvennyj standart. Standarty na metody kontrolja. M., 2002. 28 p. (in Russian)]
Bolsunovsky A., Melgunov M. Radioactive particles in the Yenisei River floodplain (Russia): characterization, leaching and potential effects in the environment // J. Environ. Radioact. 2019. V. 208–209. № 105991. P. 1–8.https://doi.org/10.1016/j.jenvrad.2019.105991
Rasband W.S. Image J. U. S. National Institutes of Health. Bethesda, Maryland, USA, 1997–2019. Ava-ilable at: https://imagej.nih.gov/ij/. Accessed February 7, 2020.
Hammer Ø., Harper D.A.T., Ryan P.D. PAST: Paleontological statistics software package for education and data analysis // Palaeontol. Electronica. 2001. V. 4. № 1. 9 p.
Иванов В.Б. Меристема как самоорганизующаяся система: поддержание и ограничение пролиферации клеток // Физиол. растений. 2004. Т. 51. № 6. С. 926–941. [Ivanov V.B. Meristem as a self-renewing system: maintenance and cessation of cell proliferation (a review) / Russian Journal of Plant Physiology. 2004. V. 51. № 6. P. 834–847. (in Russian)]
Vaijapurkar S.G., Agarwal D., Chaudhuri S.K. et al. Gamma-irradiated onions as a biological indicator of radiation dose // Radiat, Measurem. 2001. V. 33. № 5. P. 833–836. https://doi.org/10.1016/S1350-4487(01)00246-3
Clowes F.A.L. The duration of the G1 phase of the mitotic cycle and its relation to radiosensitivity // New Phytologist. 1965. V. 64. № 3. P. 355–359. https://doi.org/10.1111/j.1469-8137.1965.tb07544.x
Алов И.А. Цитофизиология и патология митоза. М.: Медицина, 1972. 263 с. [Alov I.A. Citofiziologija i patologija mitoza. M.: Medicina, 1972. 263 p. (in Russian)]
Rossi V., Varotto S. Insights into the G1/S transition in plants // Planta. 2002. V. 215. № 3. P. 345–356. https://doi.org/10.1007/s00425-002-0780-y
Лебедева Л.И., Федорова С.А., Трунова С.А. и др. Митоз. Регуляция и организация деления клеточного ядра // Генетика. 2004. Т. 40. № 12. С. 1589–1608. [Lebedeva L.I., Fedorova S.A., Trunova S.A. et al. Mitosis: regulation and organization of cell division // Russian Journal of Genetics. 2004. V. 40. № 12. P. 1313–1330. (in Russian)].
Vral A., Fenech M., Thierens H. The micronucleus assay as a biological dosimeter of in vivo ionising radiation exposure // Mutagen. 2011. V. 26. № 1. P. 11–17. https://doi.org/10.1093/mutage/geq078
Кисурина-Евгеньева О.П., Сутягина О.И., Онищенко Г.Е. Биогенез микроядер (обзор) // Биохимия. 2016. Т. 81. № 5. С. 612–624. [Kisurina-Evgenieva O.P., Sutiagina O.I., Onishchenko G.E. Biogenesis of micronuclei // Biochemistry (Moscow). 2016. V. 81. № 5. P. 453–464. (in Russian)]
Luzhna L., Kathiria P., Kovalchuk O. Micronuclei in genotoxicity assessment: from genetics to epigenetics and beyond // Front. Genet. 2013. V. 4. P. 131. https://doi.org/10.3389/fgene.2013.00131
Ma T.H., Xu Z., Xu C. et al. The improved Allium/Vicia root tip micronucleus assay for clastogenicity of environmental pollutants // Mutat. Res. / Environ. Mutagen. Relat. Subjects. 1995. V. 334. № 2. P. 185–195. https://doi.org/10.1016/0165-1161(95)90010-1
Evans H.J. Chromosome aberrations induced by ioni-zing radiations // Int. Rev. Cytol. Acad. Press. 1962. № 13. P. 221–321. https://doi.org/10.1016/S0074-7696(08)60285-5
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


