Радиационная биология. Радиоэкология, 2021, T. 61, № 2, стр. 189-196
Цитогенетические и цитотоксические эффекты действия ионизирующего излучения на эритроциты крови рыб, обитающих в водоемах на территории Полесского государственного радиационно-экологического заповедника
А. В. Гулаков 1, *, Д. Н. Дроздов 1, Д. Н. Иванцов 2
1 Гомельский государственный университет им. Франциска Скорины
Гомель, Беларусь
2 Полесский государственный радиационно-экологический заповедник
Хойники, Беларусь
* E-mail: Gulakov.andr@yandex.ru
Поступила в редакцию 13.05.2019
После доработки 04.09.2020
Принята к публикации 16.12.2020
Аннотация
В статье представлены результаты морфометрического анализа эритроцитов крови разных видов рыб, обитающих в водоемах на территории Полесского государственного радиационно-экологического заповедника. В работе показано, что у рыб разных видов различаются продольные и поперечные размеры эритроцитов. Размеры клеток характеризуются низкой вариацией, ядерно-цитоплазматическое отношение (ЯЦО) смещено в сторону ядра, что может косвенно свидетельствовать о наличии клеточной адаптации. Микроядерный тест показал достоверное различие частоты встречаемости микроядер у рыб разных видов, отличающихся способом получения пищи и содержанием 137Cs в мышечной ткани. Анализ препаратов крови рыб показал, что содержание микроядер в эритроцитах рыб разных видов распределилось следующим образом: обыкновенная щука – 3.14 ± 0.24‰, серебряный карась – 2.08 ± 0.36‰, речной окунь – 1.84 ± 0.39‰, линь – 1.26 ± 0.28‰, обыкновенная плотва – 1.13 ± 0.34‰. Частота микроядер превышала верхнюю границу спонтанного уровня, достоверные различия установлены для трех видов: обыкновенная щука, серебряный карась и речной окунь (р < 0.05). Корреляционный анализ данных удельной активности, ЯЦО и частоты микроядер показал отсутствие статистически значимой корреляционной связи, r = 0.43 (р > 0.05) и r = 0.67 (р > 0.05). Однако прослеживается тенденция, показывающая, что c увеличением удельной активности 137Cs в мышечной ткани, в эритроцитах рыб разных видов увеличивается частота микроядер: на 1000 Бк/кг удельной активности число клеток с микроядрами увеличивается на пять единиц.
Мониторинг антропогенного влияния на биоту является необходимой мерой, которая позволяет давать текущую оценку и прогнозировать возможные события, связанные с изменением экологической ситуации. Такого рода контроль важен для территорий радиоактивного загрязнения или территорий с повышенной техногенной нагрузкой со стороны предприятий ядерно-топливного цикла, химических или иных объектов [1, 2].
Фактор радиоактивного загрязнения территорий Республики Беларусь и по сегодняшний день сохраняет свое значение, в особенности для юго-восточных областей. Действие техногенного радиационного фактора сочетается с действием естественных радионуклидов, а также других антропогенных поллютантов [3–5].
Современным приоритетом в условиях меняющейся парадигмы радиационной безопасности является не только человек, но и объекты биологической среды, прежде всего естественных экологических систем, которые подвергаются воздействию со стороны не только радиационного фактора на территориях радиоактивного загрязнения, но и сочетанного воздействия всех возможных факторов антропогенного характера.
Оценка сочетанного действия на биоту представляет важную научную и практическую задачу, которую можно решить в условиях существующего в нашей стране Полесского государственного радиационно-экологического заповедника. Важной научной задачей является определение видов-индикаторов состояния биоты, выбор которых должен быть тщательно обоснован и требует строгого методологического подхода, позволяющего давать оценку не только на данный момент, но и прогнозировать вероятное развитие событий в экосистемах в перспективе.
В настоящее время накоплен большой опыт изучения влияния радиационного фактора на систему кровообращения разных видов позвоночных животных [6–9]. Ионизирующее излучение может вызывать цитотоксические и цитогенетические эффекты, которые сопровождаются изменениями, в том числе и на уровне морфологии клетки. В результате в системе кровообращения возникают формы клеток крови с цитоморфологическими изменениями, которые могут служить в качестве биологических маркеров [10].
Интерес для изучения радиационных эффектов представляет гидросфера, где происходит не только накопление, но и быстрая (по сравнению с почвой) трансформация источников загрязнения в пищевых цепях. Наиболее чувствительными к действию радиационного фактора являются планктонные организмы и ихтиофауна, занимающая верхний трофический уровень в пресноводных экосистемах. Представители пресноводной ихтиофауны различаются аккумулятивной способностью в отношении радионуклидов 137Cs и 90Sr. В работе белорусских исследователей показано, что максимальные значения удельной активности 137Cs и 90Sr в рыбе наблюдаются в непроточных водоемах, расположенных на территориях с высоким уровнем радиоактивного загрязнения, а минимальные значения – в проточных речных системах [11].
На территории Полесского государственного радиационно-экологического заповедника находятся непроточные водоемы, которые отличаются высоким уровнем радиационного загрязнения 137Cs и 90Sr. Представители аборигенной ихтиофауны данных водоемов в силу характера питания имеют существенные различия удельной активности 137Cs в мышечной и 90Sr в костной ткани. Среди представителей ихтиофауны выделяются три группы: пелагические “мирные рыбы” (линь, плотва, густера, лещ, синец), пелагические “хищные рыбы” (щука, окунь) и хищные бентофаги (карась), отличающиеся способностью аккумулировать радионуклиды. В этой связи представляется возможным оценить показатели, отражающие цитотоксическое и цитогенетическое действие радионуклидов на кроветворение рыб, в зависимости от уровня радиоактивного загрязнения водоема, а также какой вид рыбы в большей степени подходит на роль вида-индикатора.
Цель исследований – анализ цитогенетических и цитотоксических эффектов в эритроцитах крови рыб, обитающих в водоемах с разным уровнем радиоактивного загрязнения, расположенных на территории Полесского государственного радиационно-экологического заповедника.
МАТЕРИАЛЫ И МЕТОДИКА
Материалом для исследования служили данные радиоспектрометрического анализа и препараты крови рыб пяти видов: обыкновенная плотва (Rutilus rutilus L., 1758), речной окунь (Perca fluviatilis L., 1758), линь (Tinca tinca L., 1758), серебряный карась (Carassius auratus gibelio Bloch., 1782) и обыкновенная щука (Esox lucius L., 1758). Перечисленные виды являются аборигенными представителями ихтиофауны Белорусского Полесья и составляют основную массу (от 70 до 90%) небольших эвтотрофных озер [12, 13].
Отлов рыб производили в летний и осенний период 2018 г. Всего за время проведения исследований было отловлено 138 экземпляров пресноводной ихтиофауны. Сбор материала осуществляли на семи участках: четырех замкнутых непроточных водных объектов – озера Вьюры, Жартай, Лядо, Персток и трех проточных водных объектов – русло р. Несвич, Николаевский старик и Старое русло р. Припять.
В качестве орудий лова были использованы сети трехстенные “Нептун” длина 30 м, высота 1.8 м, размер ячеи 30 мм (2 шт.), 40 мм (2 шт.), 50 мм (2 шт.), 65 мм (2 шт.), 70 мм (2 шт.). При проведении лова рыб одновременно устанавливалось от двух до восьми сетей с разным размером ячеи [14]. Определение видов и анализ биологических показателей рыб проводили общепринятыми в ихтиологических исследованиях методами [15–17].
Измерение удельной активности образцов проводили в лаборатории спектрометрии и радиохимии Полесского государственного радиационно-экологического заповедника с использованием γ-β-спектрометра МКС-АТ1315.
Гематологический анализ препаратов крови осуществляли в лаборатории кафедры зоологии, физиологии и генетики Учреждения образования “Гомельский государственный университет им. Франциска” Скорины по методике МУ № 13-4-2/1487 от 1999 г. [18].
Кровь собирали в пробирки Eppendorf Tubes 5.0 мл, обработанные раствором трилона Б (Eppendorf AG, Hamburg, Германия). Для каждой особи готовили не менее двух препаратов, согласно методикам, изложенным в работах Б. Ромейс, Г.И. Роскина и Л.Б. Левинсон [19, 20].
Препараты высушивали на воздухе, фиксировали и окрашивали по Романовскому. Для анализа использовались эритроциты – клетки с плотным, вытянутым по длине сине-фиолетовым ядром и широким слоем оранжево-розовой цитоплазмы.
Микроскопию препаратов проводили с помощью светового микроскопа OPTITECH XSZ-139 (Ningbo Instrument Co., Ltd China, Китай), при увеличении 10 × 100, микролинейкой определяли продольный и поперечный размеры, оценивали форму, подсчитывали количество микроядер в цитоплазме на 1000 клеток. Данные анализа сравнивали с литературными источниками [21, 22].
При анализе количественных показателей исходили из средних значений клеток – для продольного размера 10.0–20.0 мкм, для поперечного размера 5.5–11.5 мкм; ядер – для продольного размера 3.0–8.0 мкм, для поперечного размера 2.0–3.5 мкм.
На основании полученных данных общепринятыми методами вариационной статистики определяли характеристики распределения. Для оценки достоверности различий использовали критерий Стьюдента для уровня статистической значимости p ≤ 0.05. Статистическая обработка данных проводилась с помощью пакета прикладных программ Statictica 6.0.
РЕЗУЛЬТАТЫ
Морфометрический анализ препаратов крови рыб разных видов показал, что эритроциты имеют вытянутую в продольном направлении овальную форму. Ядро ближе к сферической форме, вытянуто в продольном направлении. С помощью канонического уравнения для эллипса и данных микрометрии с соблюдением клеточных пропорций нами были построены усредненные модели эритроцитов рыб разных видов, которые представлены на рис. 1.
Рис. 1.
Пропорции эритроцитов рыб разных видов.
Fig. 1. Proportions of erythrocytes of fish of different species.
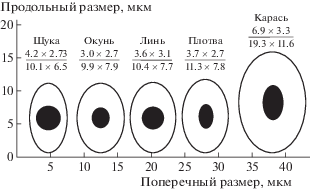
Из данных, представленных на рис. 1, видно, что наибольшие морфометрические размеры имели эритроциты серебряного карася, наименьшие – эритроциты обыкновенной щуки и речного окуня. У линя, обыкновенной щуки и речного окуня ядра имеют сферическую форму, а у обыкновенной плотвы и серебряного карася овальную.
В табл. 1 представлено распределение ядерно-цитоплазматического отношения (ЯЦО) эритроцитов у рыб разных видов в зависимости от места отлова. Из данных, приведенных в табл. 1 видно, что максимальные значения ЯЦО эритроцитов наблюдались у щуки обыкновенной, отловленной в непроточных водоемах – оз. Лядо (0.279), оз. Жартай (0.239) и оз. Вьюры (0.233).
Таблица 1.
Значения ЯЦО эритроцитов у рыб разных видов, отловленных на водных объектах с разным уровнем радиоактивного загрязнения Table 1. NCR values of erythrocytes in fish of different species caught in water bodies with different levels of radioactive contamination
| Водный объект | Вид рыбы | ||||
|---|---|---|---|---|---|
| карась | линь | окунь | плотва | щука | |
| Старое русло р. Припять, | – | 0.16 | 0.11 | 0.12 | 0.20 |
| 0.64 Бк/л* | (n = 5) ** | (n = 12) | (n = 15) | (n = 6) | |
| р. Несвич, | 0.10 | 0.14 | – | – | 0.12 |
| 6.60 Бк/л | (n = 3) | (n = 3) | (n = 3) | ||
| Николаевский старик, | 0.10 | 0.15 | – | – | 0.16 |
| 1.14 Бк/л | (n = 3) | (n = 3) | (n = 3) | ||
| оз. Персток, | 0.12 | 0.16 | 0.12 | 0.10 | 0.21 |
| 8.60 Бк/л | (n = 11) | (n = 3) | (n = 5) | (n = 6) | (n = 2) |
| оз. Жартай, | – | – | 0.12 | 0.15 | 0.24 |
| 2.25 Бк/л | (n = 10) | (n = 14) | (n = 3) | ||
| оз. Лядо | 0.12 | – | – | – | 0.28 |
| – | (n = 7) | (n = 2) | |||
| оз. Вьюры, | – | – | 0.12 | 0.08 | 0.23 |
| 1.13 Бк/л | (n = 7) | (n = 8) | (n = 3) | ||
В работах [21, 22] представлены морфометрические параметры и оценка экологической пластичности эритроцитов пресноводных рыб. Согласно данным авторов, средние значения ЯЦО эритроцитов рыб рассматриваемых нами видов распределяются следующим образом: щука – 0.154 ± 0.016, карась – 0.102 ± 0.009, линь – 0.139 ± ± 0.018, окунь – 0.107 ± 0.015, плотва – 0.113 ± 0.025.
Средние взвешенные значения ЯЦО эритроцитов рыб, полученные в ходе исследования, распределились следующим образом: щука – 0.201 ± ± 0.023, карась – 0.131 ± 0.005, линь – 0.124 ± 0.003, окунь – 0.116 ± 0.002, плотва – 0.113 ± 0.009. Сравнительный анализ показал достоверные различия между средними значениями ЯЦО эритроцитов щуки (в 1.5 раза) и карася (в 1.3 раза) с данными литературных источников. Значения ЯЦО эритроцитов остальных видов не превышали верхних границ обозначенных выше диапазонов и не имели достоверных различий (p > 0.05).
Анализ данных табл. 1 показал, что распределение средних значений ЯЦО эритроцитов рыб разных видов не зависит от удельной активности 137Cs в воде, корреляция слабая или отсутствует (r < 0.4). Не установлено достоверного различия ЯЦО эритроцитов у “мирных” пелагических видов и окуня (p > 0.05), отловленных в водоемах, расположенных на территории Полесского государственного радиационно-экологического заповедника. В то же время для пелагического хищника щуки и хищного бентофага карася имеет место достоверное различие средних значений ЯЦО в проточных и непроточных водных объектах (p < < 0.05). У особей щуки, отловленных в непроточных водных объектах, ЯЦО эритроцитов составляет 0.239 ± 0.019, в проточных объектах – 0.170 ± ± 0.024; у особей карася, отловленных в непроточных водных объектах, ЯЦО эритроцитов 0.120 ± ± 0.015, в проточных объектах – 0.050 ± 0.005.
В табл. 2 представлены значения числа микроядер (МЯ), обнаруженные в эритроцитах рыб разных видов в зависимости от места отлова.
Таблица 2.
Частота МЯ в эритроцитах у рыб разных видов, отловленных на водных объектах с разным уровнем радиоактивного загрязнения (‰) Table 2. Frequency of MN in erythrocytes of fish of different species caught in water bodies with different levels of radioactive contamination (‰)
| Водный объект | Вид рыбы | ||||
|---|---|---|---|---|---|
| карась | линь | окунь | плотва | щука | |
| Старое русло
р. Припять, 0.64 Бк/л |
– | 1.00 | 1.34 | 0.50 | 1.76 |
| р. Несвич, 6.60 Бк/л |
2.31 | 1.32 | 2.00 | – | 2.84 |
| Николаевский старик, 1.14 Бк/л |
1.33 | 0.92 | 1.61 | – | 2.67 |
| оз. Персток, 8.60 Бк/л |
1.55 | 1.80 | 2.24 | 1.23 | 3.64 |
| оз. Жартай, 2.25 Бк/л |
– | – | – | 1.29 | 3.48 |
| оз. Лядо – |
3.14 | – | – | – | 3.34 |
| оз. Вьюры, 1.13 Бк/л |
– | – | 2.00 | 1.52 | 4.26 |
Из данных, представленных в табл. 2, видно, что максимальное количество МЯ наблюдается в эритроцитах щуки, отловленной в оз. Вьюры – 4.26‰. Минимальное количество МЯ наблюдается в эритроцитах плотвы, отловленной в реке Припять – 0.5‰. Между числом МЯ в эритроцитах линя и окуня и удельной активностью воды установлена достоверная корреляция (r = 0.98 и r = 0.78, p < 0.05), для остальных рыб корреляция слабая или отсутствует (r < 0.4). Анализ данных табл. 2, проведенный с учетом пищевого поведения рыб, показал, что у “мирных” пелагических видов число МЯ составляет в среднем 1.20‰, у хищного бентофага карася 2.08‰, у пелагических хищников щуки и окуня – 2.50‰.
В современной научной литературе приводится достаточно широкий диапазон частоты образования МЯ в эритроцитах пресноводных рыб, согласно ([23], с. 253) среднегодовая спонтанная частота образования МЯ в эритроцитах рыб разных видов оценивается от 0.5 до 1.0‰. Данный показатель может сильно варьировать и зависит от сезона, насыщения кислородам воды и других факторов. В ряде исследований (Кузина, 2009) показано, что число МЯ может значительно изменяться в весенне-летний (до 0.20‰) и осенне-зимний (0.5–0.10‰) периоды [24]. Поскольку отлов рыб проводился в конце лета и преимущественно в сентябре – октябре 2018 г., мы исходили из того, что спонтанная частота образования МЯ составляет 0.5–1.0‰. В результате исследований установлено, что среднее взвешенное число МЯ в эритроцитах рыб разных видов распределяется следующим образом: щука – 3.14 ± 0.24‰, карась – 2.08 ± 0.36‰, окунь – 1.84 ± 0.39‰, линь – 1.26 ± 0.28‰, плотва – 1.13 ± 0.34‰. Полученный результат позволяет сделать вывод о том, что у пелагических и бентосных хищных рыб, обитающих на территории Полесского государственного радиационно-экологического заповедника, частота образования МЯ достоверно выше спонтанного уровня.
В табл. 3 представлены данные средней удельной активности 137Cs в мышечной ткани рыб разных видов в зависимости от места отлова.
Таблица 3.
Удельная активность 137Cs в мышечной ткани рыб, Бк/кг Table 3. Specific activity of 137Cs in muscle tissue of fish, Bq/kg
| Водоем | Вид рыбы | ||||
|---|---|---|---|---|---|
| карась | линь | окунь | плотва | щука | |
| Старое русло
р. Припять, 0.64 Бк/л |
– | 107 ± 29 | 262 ± 62 | 142 ± 37 | 346 ± 81 |
| Николаевский старик, 1.14 Бк/л |
81 ± 28 | 112 ± 31 | 340 ± 85 | 636 ± 136 | 153 ± 44 |
| р. Несвич, 6.60 Бк/л |
3650 ± 769 | 2208 ± 457 | – | – | 6382 ± 1277 |
| оз. Персток, 8.60 Бк/л |
4865 ± 973 | 2789 ± 504 | – | – | – |
| оз. Жартай, 2.25 Бк/л |
– | – | 160 ± 53 | – | – |
| оз. Лядо – |
2139 ± 428 | – | – | – | 2760 ± 552 |
| оз. Вьюры, 1.13 Бк/л |
– | – | 326 ± 77 | 142 ± 55 | – |
Как видно из данных, представленных в табл. 3, имеет место высокая вариация показателей удельной активности 137Cs в мышечной ткани особей разных видов рыб, вне зависимости от места отлова как в непроточных, так и в проточных водоемах. Максимальные значения средней удельной активности 137Cs наблюдаются у карася и щуки. Значения средней удельной активности 137Cs в мышечной ткани распределились следующим образом: карась – 2684 ± 428 Бк/кг, щука – 2410 ± 489 Бк/кг, линь – 1304 ± 255 Бк/кг, плотва – 307 ± 76 Бк/кг, окунь – 272 ± 69 Бк/кг. Высокий уровень радиоактивного загрязнения мышечной ткани 137Cs карася и щуки объясняется тем, что карась является бентофагом с высокими темпами роста (до 70 г/мес.), а обыкновенная щука – это активный пелагический хищник, занимающий верхний трофической уровень в водной экосистеме.
Вместе с тем из данных табл. 3 видно, что удельная активность мышечной ткани 137Cs таких видов, как линь, плотва, карась и щука, отловленных в проточных водоемах (Николаевский старик и Старое русло р. Припять), не превышает 150 Бк/кг. Исключение составила выборка плотвы. Среди особей, отловленных на объекте Николаевский старик, удельная активность 137Cs более чем в 1.5 раза превышает допустимый уровень. Высокая удельная активность мышечной ткани рыб разных видов наблюдается на проточном объекте р. Несвич, где отмечается высокое содержание 137Cs в воде (6.60 Бк/л) и донных отложениях 3220 Бк/кг [25].
Методом корреляционного анализа с использованием параметрического коэффициента Пирсона проведена оценка связи между удельной активностью 137Cs в мышечной ткани, величиной ЯЦО и частотой МЯ в эритроцитах рыб. Анализ статистической мощности данных удельной активности 137Cs в мышечной ткани, ЯЦО и МЯ в эритроцитах рыб, распределенных на группы по видам и водоемам, показал отрицательный результат, поскольку статистическая мощность составила менее 80% при уровне доверительной вероятности 95%, что, согласно [26], не позволяет выявить статистически значимые коэффициенты корреляции. В этой связи использовалась выборка по всем видам рыб без учета типа водоема, на котором производили отлов. Корреляционный анализ данных удельной активности 137Cs в мышечной ткани рыб, ЯЦО и частота МЯ в эритроцитах показал отсутствие статистически значимой корреляционной связи, r = 0.43 (р > 0.05) и r = 0.67 (р > 0.05) соответственно. Зависимость между удельной активностью 137Cs и частотой МЯ в эритроцитах рыб разных видов можно выразить регрессионным уравнением вида: Y = 0.0005 × X + + 1.1 (R2 = 0.46, p > 0.05), из которого следует, что количество эритроцитов с МЯ увеличивается на 5 клеток на каждые 1000 Бк/кг удельной активности 137Cs в мышечной ткани рыбы.
ОБСУЖДЕНИЕ
Морфометрический анализ эритроцитов крови рыб, отловленных в водоемах на территории Полесского государственного радиационно-экологического заповедника с разным уровнем радиоактивного загрязнения 137Cs, показал, что ЯЦО эритроцитов щуки и карася достоверно отличаются от данных литературных источников, приведенных для водных объектов с фоновым радиационным режимом. В ходе анализа также установлено, что между значениями ЯЦО эритроцитов щуки (0.201 ± 0.023) и карася (0.131 ± ± 0.005) – пелагического и бентосного хищников, отловленных в проточных и непроточных водоемах, имеет место достоверное различие средних значений (p < 0.05). Вместе с тем отсутствие достоверной корреляции между значениями ЯЦО и удельной активностью 137Cs в мышечной ткани рыб не позволяет в полной мере использовать данный показатель для оценки цитогенетического действия радионуклидов.
Согласно исследованиям [23, 24, 27], в ответ на действие различных техногенных факторов среды обитания в эритроцитах возникают мелкие (результат хромосомных аббераций) и крупные (результат повреждения веретена деления) микроядра, которые могут служить подтверждением генотоксического действия, в том числе источников радиоактивного загрязнения среды обитания. В ходе исследований установлено, что в эритроцитах рыб разных видов наблюдается повышение частоты образования МЯ, в том числе у особей щуки (3.14‰) и карася (2.08‰), отловленных в непроточных водоемах на территории Полесского государственного радиационно-экологического заповедника с разным уровнем радиоактивного загрязнения. Значения этого показателя достоверно выше спонтанного уровня, увеличение данного показателя указывает на развитие цитогенетических эффектов, которые находят отражение в клеточном метаболизме и митотической активности эритроцитов рыб, обитающих в условиях радиоактивного загрязнения.
Сравнительный анализ удельной активности 137Cs в мышечной ткани рыб разных видов показал достоверные различия между удельной активностью карася (2684 ± 420 Бк/кг) и окуня (307 ± ± 44 Бк/кг) (р = 0.02), карася (2684 ± 420 Бк/кг) и плотвы (272 ± 28 Бк/кг) (р = 0.02), линя (1304 ± ± 375 Бк/кг) и окуня (307 ± 44 Бк/кг) (р = 0.03), линя (1304 ± 375 Бк/кг) и плотвы (272 ± 28 Бк/кг) (р = 0.04), окуня (307 ± 44 Бк/кг) и щуки (2410 ± ± 620 Бк/кг) (р = 0.03), плотвы (272 ± 28 Бк/кг) и щуки (2410 ± 620 Бк/кг) (р = 0.04). В результате этого удалось разделить рыб исследуемых видов на две группы – сильные аккумуляторы 137Cs: карась, щука и линь; и слабые аккумуляторы 137Cs: окунь и плотва.
В данной связи наиболее репрезентативными видами ихтиофауны водоемов Полесского радиационно-экологического заповедника могут служить пелагический хищник щука обыкновенная и бентофаг карась серебряный, обитающие в непроточных водоемах. Независимо от уровня радиоактивного загрязнения водоема эти виды отличаются сочетанием трех условий – высокая аккумуляция радионуклидов 137Cs в мышечной ткани, сдвиг ЯЦО вправо, который может свидетельствовать о развитии эритроцитоза, и высокая частота МЯ в эритроцитах.
Список литературы
Кузина Т.В. Цитофизиологические особенности крови промысловых рыб Волго-Каспийского канала: Автореф. дис. … канд. биол. наук. Астрахань, 2011. 26 c. [Kuzina T.V. Tsitofiziologicheskie osobennosti krovi promyslovykh ryb Volgo-Kaspiiskogo kanala [dissertation]. Astrakhan’, 2011. 26 р. (In Russian)]
Лугаськова Н.В., Найсыров Р.А. Адаптивные особенности системы крови окуня и линя в условиях загрязнения и эвтрофикации водоемов // Сибирский экол. журн. 2001. Т. 8. № 6. С. 735–739. [Lugas’kova N.V., Naisyrov R.A. Adaptivnye osobennosti sistemy krovi okunya i linya v usloviyakh zagryazneniya i evtrofikatsii vodoemov // Sibirskii ekologicheskii zhurnal. 2001. V. 8. № 6. P. 735–739. (In Russian)]
Чунихин Л.А., Чеховский А.Л., Дроздов Д.Н. Картирование и оценка радоновой обстановки Гомельской, Могилевской и Витебской областей // Изв. Гомельского гос. ун-та им. Ф. Скорины. 2015. № 3 (90). С. 71–76. [Chunikhin L.A., Chekhovskii A.L., Drozdov D.N. Kartirovanie i otsenka radonovoi obstanovki Gomel’skoi, Mogilevskoi i Vitebskoi oblastei // Izvestiya Gomel’skogo gosudarstvennogo universiteta imeni F. Skoriny. 2015. V. 3. № 90. P. 71–76. (In Russian)]
Карабанов А.К., Матвеев А.В., Чунихин Л.А. и др. Радон и дочерние продукты распада в воздухе зданий на территории Беларуси // Природопользование. 2015. Вып. 27. С. 49–53. [Karabanov A.K., Matveev A.V., Chunikhin L.A. i dr. Radon i dochernie produkty raspada v vozdukhe zdanii na territorii Belarusi // Prirodopol’zovanie. 2015. V. 27. P. 49–53. (In Russian)]
Чунихин Л.А., Чеховский А.Л., Дроздов Д.Н. Карта радоновой опасности территории Республики Беларусь // Радиац. гигиена. 2016. Т. 9. № 4. С. 43–46. [Chunikhin L.A., Chekhovskii A.L., Drozdov D.N. Karta radonovoi opasnosti territorii Respubliki Belarus’ // Radiatsionnaya gigiena. 2016. V. 9. №4. P. 43–46. (In Russian)]
Al-Sabti K., Metcalfe C.D. Fish micronuklei for assessing genotoxicity in water // J. Mutat. Resort. 1995. V. 23. P. 121–135.
Cavaş T., Ergene-Gözükara S. Micronucleus test in fish cells: a bioassay for in situ monitoring of genotoxic pollution in the marine environment // J. Environ. Mol. Mutagen. 2005. V. 46. № 1. P. 64–70.
Arkhipchuk V.V., Garanko N.N. Using the nucleolar biomarker and the micronucleus test on in vivo fish fin cells // J. Ecotoxicol. Environ. Safety. 2005. V. 112. P. 215–221.
Heddele J.A. et al. Micronuclei as an index of cytogenetic damage: past, present, and future // J. Environ. Molec. Mutagen. 1991. V. 18. № 4. P. 277–291.
Козинец Г.И., Быкова И.А., Шапранова Э.Д. и др. Влияние на эритрон различных экологических факторов по данным интерферометрии эритроцитов // Гематол. и трансфузиол. 1987. Т. 32. № 11. С. 39–43. [Kozinets G.I., Bykova I.A., Shapranova E.D. i dr. Vliyanie na eritron razlichnykh ekologicheskikh faktorov po dannym interferometrii eritrotsitov // Gematologiya i transfuziologiya.1987. V. 32. №11. P. 39–43. (In Russian)]
Иванцов Д.Н., Гулаков А.В. Радиоактивное загрязнение ихтиофауны водоемов, расположенных на территории Полесского государственного радиационно-экологического заповедника // Изв. Гомельского гос. ун-та им. Ф. Скорины. 2016. № 6 (99). С. 18–23. [Ivantsov D.N., Gulakov A.V. Radioaktivnoe zagryaznenie ikhtiofauny vodoemov, raspolo-zhennykh na territorii Polesskogo gosudarstvennogo radiatsionno-ekologicheskogo zapovednika // Izvestiya Gomel’skogo gosudarstvennogo universiteta im. F. Skoriny. 2016. V. 6. № 99. P. 18–23. (In Russian)]
Костоусов В.Г. Видовое разнообразие и продуктивность ихтиоценозов малых озер и причины, их определяющие // Разнообразие животного мира Беларуси: Итоги изучения и перспективы сохранения: Мат. междунар. науч. конф. Минск, 2001. С. 217–219. [Kostousov V.G. Vidovoe raznoobrazie i produktivnost' ikhtiotsenozov malykh ozer i prichiny, ikh opredelyayushchie // Raznoobrazie zhivotnogo mira Belarusi: Itogi izucheniya i perspektivy sokhraneniya: Materialy mezhdunar. nauchnoi konf. (Conf. proc.) Minsk, 2001. Р. 217–219. (In Russian]
Власов Б.П., Рудаковский И.А., Архипенко Т.В. и др. Озера Беларуси как формирующая основа природно-ресурного потенциала территории для хозяйственного использования // Природопользование: экология, экономика, технологии: Мат. междунар. науч. конф. Минск, 2010. С. 42–48. [Vlasov B.P., Rudakovskii I.A., Arkhipenko T.V. i dr. Ozera Belarusi kak formiruyushchaya osnova prirodno-resurnogo potentsiala territorii dlya khozyaistvennogo ispol’zovaniya // Prirodopol’zovanie: ekologiya, ekonomika, tekhnologii: Materialy mezhdunar. nauchnoi konf. (Conf. proc.) Minsk, 2010. Р. 42–48. (In Russian)]
Гашев С.Н., Сазонова Н.А., Селюков А.Г. и др. Методика комплексной оценки состояния сообществ и популяций доминирующих млекопитающих, амфибий и рыб. Тюмень, ТюмГУ, 2005. 94 с. [Gashev S.N., Sazonova N.A., Selyukov A.G. i dr. Metodika kompleksnoi otsenki sostoyaniya soobshchestv i populyatsii dominiruyushchikh mlekopitayushchikh, amfibii i ryb. Tyumen’: TyumGU, 2005. 94 р. (In Russian)]
Жуков П.И. Справочник по экологии пресноводных рыб. Минск: Наука и техника, 1988. 310 с. [Zhukov P.I. Spravochnik po ekologii presnovodnykh ryb. Minsk: Nauka i tekhnika, 1988. 310 р. (In Russian)]
Правдин И.Ф. Руководство по изучению рыб. М.: Пищевая пром-сть, 1966. 376 с. [Pravdin I.F. Rukovodstvo po izucheniyu ryb. M.: Pishchevaya promyshlennost’, 1966. 376 р. (In Russian)]
Брюзгин В.Л. Методы изучения рыб по чешуе, костям и отолитам. – Киев: Наук. думка, 1969. 187 с. [Bryuzgin V.L. Metody izucheniya ryb po cheshue, kostyam i otolitam. Kiev: Naukova dumka, 1969. 187 р. (In Russian)]
Методические указания по проведению гематологического обследования рыб / Разр. ТИНРО-центр и КаспНИРХ; утв. Минсельхозпродом РФ 02.02.1999. М., 1999. [Metodicheskie ukazaniya po provedeniyu gematologicheskogo obsledovaniya ryb / Razr. TINRO-tsentr i KaspNIRKh; utv. Minsel’khozprodom RF 02.02.1999. M., 1999. (In Russian)]
Ромейс Б. Микроскопическая техника. М.: Изд-во иностр. лит-ры, 1953. 719 с. [Romeis B. Mikroskopi-cheskaya tekhnika. M.: Izdatel’stvo inostrannoi literatury, 1953. 719 р. (In Russian)]
Роскин Г.И., Левинсон Л.Б. Микроскопическая техника. М.: Советская наука, 1957. 467 с. [Roskin G.I., Levinson L.B. Mikroskopicheskaya tekhnika. M.: Sovetskaya nauka, 1957. 467 р. (In Russian)]
Житенева Л.Д., Полтавцева Т.Г., Рудницкая О.А. Атлас нормальных и патологически измененных клеток крови рыб. Ростов/Дон: Кн. изд-во, 1989. 112 с. [Zhiteneva L.D., Poltavtseva T.G., Rudnitskaya O.A. Atlas normal’nykh i patologicheski izmenennykh kletok krovi ryb. Rostov-na-Donu: Kn. izd-vo, 1989. 112 р. (In Russian)]
Физиология и биохимия водных животных / Oтв. ред. Г.М. Чуйко. Ярославль: Канцлер, 2015. Вып. 72 (75). 133 с. [Fiziologiya i biokhimiya vodnykh zhivotnykh / Otv. red. G.M. Chuyko. Yaroslavl’: Kan-tsler. 2015. V. 72 (75). 133 p. (In Russian)]
Ильинских Н.Н., Новицкий В.В., Ванчугова Н.Н. и др. Микроядерный анализ и цитогенетическая нестабильность. Томск: Изд-во Томского ун-та, 1992. 272 с. [Il’inskikh N.N., Novitskii V.V., Vanchugova N.N. i dr. Mikroyadernyi analiz i tsitogeneticheskaya nestabil’nost'. Tomsk: Izd-vo Tomskogo universiteta, 1992. 272 р. (In Russian)]
Кузина Т.В. Анализ гематологических показателей судака волго-каспийского канала // Естественные науки номер. Астрахань, 2009. № 4(29). С. 96–100. [Kuzina T.V. Analiz gematologicheskih pokazatelej sudaka volgo-kaspijskogo kanala // Estestvennye nauki nomer. Astrahan’, 2009. № 4(29). S. 96–100. (In Russian)]
Иванцов Д.Н., Гулаков А.В. Накопление и распределение по органам и тканям долгоживущих радио-нуклидов 137Cs и 90Sr в организме пресноводных рыб, обитающих в водоемах Полесского государственного радиационно-экологического заповедника // Изв. Гомельского гос. ун-та им. Ф. Скорины. Гомель: ГГУ им. Ф. Скорины. 2018. № 6 (111). С. 29–35. [Ivantsov D.N., Gulakov A.V. Nakoplenie i raspredelenie po organam i tkanyam dolgozhivu-shchikh radionuklidov 137Cs i 90Sr v organizme presnovodnykh ryb, obitayushchikh v vodoemakh Poles-skogo gosudarstvennogo radiatsionno-ekologicheskogo zapovednika // Izvestiya Gomel’skogo gosudarstvennogo universiteta imeni F. Skoriny. 2018. № 6(111). P. 29–35. (In Russian)]
Гржибовский А.М., Горбатова М.А., Наркевич А.Н., Виноградов К.А. Объем выборки для корреляционного анализа // Морская медицина. 2020. № 6(1). С. 101–106. [Grzhibovskiy A.M., Gorbatova M.A., Narkevich A.N., Vinogradov K.A. Ob"yem vyborki dlya korrelyatsionnogo analiza // Morskaya meditsina. 2020 № 6(1). P. 101–106. (In Russian)]
Абилев С.К., Глазер В.М. Мутагенез с основами генотоксикологии: учебное пособие. М.; СПб.: Нестор-История, 2015. С. 195. [Abilev S.K., Glazer V.M. Mutagenez s osnovami genotoksikologii: uchebnoye posobiye. M.; SPb.: Nestor-Istoriya, 2015. 195 p. (In Russian)]
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


