Прикладная биохимия и микробиология, 2022, T. 58, № 6, стр. 607-618
Может ли рекомбинантный химозин тупайи (Tupaia belangeri chinensis) коагулировать молоко коровы (Bos taurus)?
Д. В. Балабова 1, С. В. Беленькая 2, 3, Е. А. Волосникова 2, Т. Гермес 4, В. Ю. Чиркова 1, Е. А. Шарлаева 1, Д. Н. Щербаков 1, 2, *, А. Н. Белов 5, А. Д. Коваль 5, В. В. Ельчанинов 5
1 Алтайский государственный университет
656049 Барнаул, Россия
2 Государственный научный центр вирусологии и биотехнологии “Вектор”
Роспотребнадзора
630559 Кольцово, Россия
3 Новосибирский государственный университет
630090 Новосибирск, Россия
4 Институт эволюционной антропологии общества Макса Планка
04103 Лейпциг, Германия
5 Федеральный Алтайский научный центр агробиотехнологий, Сибирский НИИ сыроделия
656910 Барнаул, Россия
* E-mail: dnshcherbakov@gmail.com
Поступила в редакцию 12.04.2022
После доработки 09.06.2022
Принята к публикации 04.07.2022
- EDN: DPMQNI
- DOI: 10.31857/S0555109922060022
Аннотация
Впервые получен и частично охарактеризован генно-инженерный химозин тупайи (Tupaia belangeri chinensis). Целевой фермент нарабатывали в системе экспрессии Escherichia coli, штамм BL21(DE3). Показано, что рекомбинантный химозин тупайи коагулирует молоко коровы (Bos taurus). Общая и удельная молокосвертывающая активность полученного фермента составила 0.7-5.3 IMCU/мл и 8.8–16.6 IMCU/мг. Неспецифическая протеолитическая активность генно-инженерного химозина тупайи по отношению к суммарному казеину коровы оказалась на 30 и 117% выше, чем у рекомбинантных химозинов коровы и одногорбого верблюда соответственно. Обнаружено, что по сравнению с большинством известных генно-инженерных химозинов, фермент тупайи проявлял исключительно низкую термостабильность. После прогревания при 45°С коагуляционная способность рекомбинантного химозина тупайи падала более чем на 40%, а при 50°С фермент терял >90% исходной молокосвертывающей активности. Константа Михаэлиса (Km), число оборотов фермента (kcat) и каталитическая эффективность (kcat/Km) для рекомбинантного химозина тупайи, составили соответственно 6.3 ± 0.1 мкМ, 11927 ± 3169 с–1 и 1968 ± 620 мкM–1 с–1. Сравнительный анализ показал, что первичная структура химозин-чувствительного участка каппа-казеина коровы и предполагаемой аналогичной последовательности каппа-казеина тупайи различались на 75%. Способность рекомбинантного химозина тупайи свертывать молоко коровы наряду с низкой термостабильностью и высокой каталитической эффективностью по отношению к субстрату, имитирующему химозин-чувствительный участок коровьего каппа-казеина, позволяют предполагать, что этот фермент представляет потенциальный интерес для сыроделия.
Представителей класса Млекопитающие (Mammalia) объединяет общий адаптационный механизм – способность синтезировать и секретировать молоко для вскармливания потомства. Вероятно, параллельно с лактацией, возникли и неонатальные молокосвертывающие протеиназы – химозины, под действием которых молоко в желудке новорожденного превращается в сгусток, что обеспечивает его эффективное усвоение [1]. Химозины (КФ 3.4.23.4) обладают исключительно высокой специфичностью к связи F105-M106 (или её аналогу) в молекуле к-казеина (к-КЗ) и, в то же время, крайне низкой неспецифической протеолитической активностью (ПА). В результате, химозин (Хн) эффективно гидролизует единственную пептидную связь в молекуле к-КЗ, что вызывает образование молочного сгустка. В то же время фермент не атакует иммуноглобулины (Ig) и другие защитные белки, содержащиеся в молозиве и молоке, что способствует эффективному переносу пассивного иммунитета от матери к новорожденному [2].
Благодаря способности коагулировать молоко, молокосвертывающие ферменты (МФ) и, в частности Хн, играют важную роль в практической деятельности человека и любой аспект изучения биохимических свойств этих ферментов рассматривается с точки зрения возможности их технологического применения [3].
Предположительно, люди научились использовать МФ для получения сыров около 8000 лет назад [4]. С момента возникновения промышленного производства, лучшим МФ для сыроделия считался коровий Хн – кислая аспартатная эндопептидаза, синтезируемая клетками слизистой оболочки желудка новорожденного теленка [5]. Успехи генной инженерии позволили внедрить в практику сыроделия рекомбинантный Хн (рХн) коровы (Bos taurus) [6]. Комплекс биохимических свойств коровьего Хн считался оптимальным для сыроделия вплоть до 2006 г., когда был получен и исследован рХн верблюда (Camelus dromedarius) [7]. В настоящее время верблюжий рХн широко используется в сыроделии наряду с рХн коровы [3, 8–10].
Получение рХн одногорбого верблюда положило начало новому этапу исследований, направленных на изучение и понимание механизмов субстратной специфичности неонатальных гастральных протеиназ [9–14]. Кроме того, результаты изучения рХн C. dromedarius продолжают стимулировать работы, направленные на поиск и изучение новых видов Хн. Поскольку основную долю сырьевой базы сыроделия составляет молоко B. taurus, биохимическая характеристика любого нового Хн начинается с определения его молокосвертывающей активности (МА) именно по отношению к молоку коровы.
Ответ на вопрос, вынесенный в заголовок статьи, не является очевидным из-за парадокса “Хн коровы – молоко верблюда”. Его суть в том, что Хн коровы не коагулирует верблюжье молоко и это не позволяет использовать коровий фермент для производства сыров из молока верблюда [9, 15–20]. В то же время, рХн верблюда не только эффективно свертывает коровье молоко, но и превосходит рХн коровы по удельной МА по отношению к коровьему субстрату [7]. Предполагается, что причина парадокса кроется в различиях первичной структуры к-КЗ коровы и верблюда на участке 98-112 [13, 14, 20]. Парадокс “Хн коровы – молоко верблюда” наиболее известный, но не единственный случай межвидового “конфликта” молока и Хн. Химозин коровы не способен свертывать лошадиное (Equus caballus) молоко, в то время как рХн двугорбого верблюда (Camelus bactrianus) успешно справляется с этой задачей [15, 21]. Кроме верблюжьего и лошадиного молока, Хн коровы не коагулирует молоко представителя сумчатых млекопитающих – лисьего кузу (Trichosurus vulpecula) [22]. Намного медленнее, чем гомологичный субстрат, Хн коровы свертывает молоко крысы (Rattus norvegicus), кролика (Oryctolagus cuniculus), козы (Capra hircus) и северного оленя (Rangifer tarandus) [23]. Коагуляционная активность рХн кролика, измеренная на молоке осла (Equus asinus), коровы, козы, овцы (Ovis aries) и верблюда составляет, соответственно, 40.0, 10.0, 5.7, 3.1 и 2.7 IMCU/мл, т.е. минимальные и максимальные значения различается более чем на порядок [24]. Можно ожидать, что по мере получения новых видов Хн, число подобных “конфликтов” будет увеличиваться.
Парадокс “Хн коровы – молоко верблюда” позволяет условно разделить химозины на 2 типа: “универсальные”, способные одинаково эффективно коагулировать как гомологичное так и гетерологичное молоко [7, 21, 25–28] и “специализированные” – проявляющие наибольшую активность по отношению к гомологичному молоку или молоку ближайших филогенетических родственников [7, 15, 23].
Нетрудно заметить, что кроме кролика (отряд Зайцеобразные, Lagomorpha) [24] ни один из видов млекопитающих “за пределами” отряда Китопарнокопытные (Cetartiodactyla) не стал источником генов для получения и оценки биохимических свойств новых рХн. Частично охарактеризованные Хн представителей отряда Приматы (Primates) – игрунки (Callithrix jacchus) [29] и некоторых других обезьян Нового Света [30] стоят особняком, поскольку утратили важнейшую “химозиновую” функцию участия в переносе факторов пассивного иммунитета от матери новорожденному и в природе экспрессируются как пепсиноподобные ферменты с широкой протеолитической специфичностью и высокой общей ПА.
Данные о МА и специфичности Хн по отношению к гетерологичным субстратам необходимы для понимания механизма работы этих ферментов и успешного поиска высокоэффективных коагулянтов молока. В этой связи, актуальным является изучение рХн животных, относящихся к различным отрядам Млекопитающих.
Тупайи (Scandentia) – отряд плацентарных млекопитающих, представители которого обитают в тропических лесах Юго-Восточной Азии. Геном тупайи (Tupaia belangeri chinensis) или китайской древесной землеройки (Chinese tree shrew) секвенирован в 2013 году. Филогенетический анализ показал, что Tupaia belangeri chinensis (далее – T. belangeri) является весьма отдаленным родственником коровы и кластеризуется в пределах клады Эуархонты (Euarchonta), в которую также входят Шерстокрылы (Dermoptera) и Приматы. При этом структура генов тупайи имеет высокое сходство с Приматами и, в частности, с человеком [31]. По данным NCBI, аминокислотные (а.к.) последовательности Хн тупайи и коровы идентичны на 81.6%. До настоящего времени рХн тупайи не изучался.
Цель данной работы – получение рХн T. belangeri, определение его коагуляционной активности по отношению к молоку коровы и исследование некоторых биохимических свойств, важных для сыроделия.
МЕТОДИКА
Конструирование экспрессионного вектора. В работе использовали нуклеотидную последовательность прохимозина (ПроХн) тупайи, выявленную в геноме T. chinensis (NW_006159751.1) путем сравнения с референсной последовательностью гена Хн коровы. Кодонный состав нуклеотидной последовательности ПроХн оптимизировали для экспрессии в системе Escherichia coli при помощи сервиса “Codon Optimisation Tool” (“Integrated DNA Technologies”, США). Синтезированная нуклеотидная последовательность была встроена в экспрессионный вектор pET21a (“Novagen”, ФРГ) по уникальным сайтам рестрикции BamHI и HindIII. В результате получали плазмидный вектор pET21-CYM-Tup.
Получение рХн тупайи. Плазмидой pET21-CYM-Tup проводили химическую трансформацию клеток E. coli BL21(DE3). Колонии, содержащие рекомбинантные плазмиды, культивировали в течение ночи на орбитальном шейкере (“Biosan”, Латвия) при 180 об./мин в среде LB (“AppliChem”, США) при 37°C. Инокулят в соотношении 1 : 100 переносили в колбы Эрленмейера, содержащие свежую среду LB и выращивали до оптической плотности 0.8 (при λ = 600 нм). В культуральную жидкость вносили индуктор – изопропил-β-D-1-тиогалактопиранозид (ИПТГ) (“Anatrace Products”, США) до конечной концентрации 1 мМ и дополнительно культивировали штамм-продуцент на шейкере (180 об./мин) в течение 12 ч при 25°C. Контролем служила культура E. coli штамм BL21, не трансформированная плазмидой pET21-CYM-Tup.
После завершения культивирования биомассу осаждали центрифугированием в течении 20 мин при 5000 g и 4°С. Осадок ресуспендировали в буфере STET (сахароза – 8%, 50 мМ трис, 20 мM ЭДТА, тритон X-100 – 5%, pH 8.0) из расчета 20 мл на 1 г биомассы и инкубировали в течение ночи при 4°С. По окончании инкубации суспензию клеток обрабатывали ультразвуком (2000 Вт/л и 283 Вт/см2) в течение 1 мин, после чего смесь охлаждали до 4°С. Процедуру повторяли трижды. Тельца включения осаждали центрифугированием при 20 000 g в течение 20 мин при 4°С.
Солюбилизацию телец включения, рефолдинг рекомбинантного ПроХн и последующую активацию зимогена проводили в соответствии с процедурами, описанными в работе [26]. В результате активации получали препарат рХн тупайи (рХн-Tup).
Определение общей и удельной молокосвертывающей активности. В качестве субстрата использовали сборное не пастеризованное коровье молоко, в которое вносили NaN3 до 0.02% и доводили рН до 6.5. Субстрат (2.5 мл), прогретый на водяной бане при 35°С не менее 10 мин, быстро смешивали с 0.2 мл исследуемого рХн и регистрировали время образования первых хлопьев коагулята. В качестве стандарта использовали 0.5%-ный водный раствор сухого коммерческого препарата рХн коровы (“Chr. Hansen”, Дания) с заявленной МА 2201 IMCU/г (IMCU – International Milk Clotting Units). Все измерения повторяли не менее трех раз (n ≥ 3). Общую МА выражали в IMCU/мл, которую рассчитывали по формуле (1):
(1)
${\text{МА}} = {{{{{\text{М}}{{{\text{А}}}_{{{\text{Ст}}}}}} \mathord{\left/ {\vphantom {{{\text{М}}{{{\text{А}}}_{{{\text{Ст}}}}}} {200 \times {{{\text{Т}}}_{1}}}}} \right. \kern-0em} {200 \times {{{\text{Т}}}_{1}}}}} \mathord{\left/ {\vphantom {{{{{\text{М}}{{{\text{А}}}_{{{\text{Ст}}}}}} \mathord{\left/ {\vphantom {{{\text{М}}{{{\text{А}}}_{{{\text{Ст}}}}}} {200 \times {{{\text{Т}}}_{1}}}}} \right. \kern-0em} {200 \times {{{\text{Т}}}_{1}}}}} {{\text{Т}}{}_{2}}}} \right. \kern-0em} {{\text{Т}}{}_{2}}},$где: МАСт – заявленная МА стандарта в IMCU/г; 200 – фактор разведения (мл/г); Т1 – время (в с) свертывания субстрата стандартом; Т2 – время (в с) свертывания субстрата раствором исследуемого фермента.
В качестве препаратов сравнения использовали 0.5%-ный водный раствор сухого коммерческого препарата рХн коровы (рХн-Bos) и 0.4%-ный водный раствор сухого коммерческого препарата рХн одногорбого верблюда (рХн-Cam) производства компании “Chr. Hansen” (Дания).
Удельную МА рХн-ов, рассчитывали после определения общей МА и концентрации белка по Брэдфорду [32] и выражали в IMCU/мг.
Определение неспецифической протеолитической активности. В качестве субстрата использовали 0.5%-ный раствор коровьего казеината натрия (“Sigma”, США) в 20 мМ Na-ацетатном буфере (рН 5.65). Субстрат (2.0 мл) выдерживали 15 мин на водяной бане при 35°С, вносили в него раствор исследуемого рХн (0.5 мл), быстро перемешивали и отмечали время начала инкубации. Через 30, 90 и 180 мин к 2.5 мл фермент-субстратной смеси добавляли 2.5 мл 6%-ной трихлоруксусной кислоты (ТХУ), перемешивали, выдерживали 30 мин при комнатной температуре и фильтровали через бумажный фильтр. В фильтрате определяли поглощение при длине волны 280 нм (А280). Для подготовки спектрофотометрического контроля компоненты фермент-субстратной смеси вносили непосредственно в 6%-ную ТХУ. Неспецифическую ПА выражали в единицах А280. Строили график зависимости А280 от продолжительности прогревания.
Коагуляционную специфичность (протеолитическую активность, направленную только на гидролиз Хн-чувствительной связи в молекуле к-КЗ) определяли, как соотношение удельной МА и неспецифической ПА (МА/ПА). Для оценки коагуляционной специфичности препаратов рХн за ПА принимали значения А280 фермент-субстратных смесей, инкубировавшихся в течение 180 мин.
Определение протеолитической активности по отношению к изолированным α-, β-, и κ-казеинам коровы. Определение ПА рХн по отношению к изолированным казеинам (КЗ) коровьего молока проводили по методике, описанной в работе [33], в которую вносили изменения. Для исследования ПА рХн тупайи концентрировали методом ультрафильтрации до значений общей МА ≈ 8 IMCU/мл. Активность препаратов сравнения – коммерческих рХн – нормировали по МА фермента тупайи.
Готовили 0.1%-ные растворы субстратов – α-, β- и κ-КЗ (“Sigma”, С6780, С6905, С0406, США) – в 20 мМ Na-ацетатном буфере (рН 5.65). Смешивали 250 мкл субстрата c 5 мкл исследуемого рХн с активностью 8.0 IMCU/мл. В контрольные образцы вместо рХн вносили 5 мкл 20 мМ Na-ацетатного буфера (рН 5.65). Фермент-субстратные смеси и контрольные препараты инкубировали при 35°С в течение 1 ч. После завершения инкубации исследовали полипептидный состав смесей методом электрофореза в присутствии додецлсульфата натрия (ДСН) по Лэммли [34]. В качестве маркеров молекулярных масс (ММ) использовали LMW-SDS Marker Kit (“GE Healthcare”, США).
Термостабильность (ТС). Растворы исследуемых МФ прогревали при температурах 30–65°С в течение 30 мин, быстро охлаждали до комнатной температуры и определяли их остаточную МА. За 100% принимали значения МА, полученные в образцах, прогретых при 30○С. Строили график зависимости остаточной МА от температуры прогревания. Порогом термоинактивации считали температуру прогревания, при которой рХн утрачивал ≥20% от исходной МА.
Определение параметров кинетики Михаэлиса–Ментен. Константу Михаэлиса (Km), константу скорости реакции гидролиза или число оборотов фермента (kcat) и каталитическую эффективность (kcat/Km) определяли по методике, описанной в работе [35].
Статистическую обработку полученных данных проводили в вычислительной среде табличного процессора Excell 2007 (“Microsoft Corporation”, США). Результаты определения количественных переменных представлены в виде среднего арифметического (М) с указанием среднеквадратического отклонения (±SD).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Получение препарата рХн тупайи. Для получения рекомбинантного аналога Хн тупайи использовали систему на основе штамма BL21(DE3) E. coli и плазмидного экспрессионного вектора серии pET21. Нуклеотидная последовательность, соответствующая ПроХн тупайи, с кодонным составом, оптимизированным для экспрессии в системе E. coli, была клонирована в составе экспрессионного вектор pET21a таким образом, чтобы N-концевая часть содержала последовательность экспрессионного тага Т7. Корректность встроенной последовательности была проверена при помощи секвенирования полученной рекомбинантной плазмиды pET21-CYM-Tup в области встройки. После трансформации сконструированной плазмидой компетентных клеток BL21(DE3) E. coli был получен рекомбинантный штамм-продуцент. Для наработки целевого белка использовали стандартный протокол, включающий добавление индуктора ИПТГ. С целью оценки эффективности синтеза рекомбинантного ПроХн тупайи (рПроХн-Tup), а также определения его локализации, был проведен электрофоретический анализ различных белковых препаратов, полученных из клеток рекомбинантного штамма-продуцента (рис. 1).
Рис. 1.
Результаты ДСН-электрофореза белковых препаратов, полученных из клеток исходного штамма и штамма-продуцента: 1 – биомасса клеток E. coli штамм BL21 после внесения индуктора (контроль); 2 – биомасса клеток продуцента E. coli BL21_рПроХн-Tup после внесения индуктора (опыт); 3 – растворимая фракция биомассы продуцента BL21_рПроХн-Tup после обработки буфером STET; 4 – нерастворимая фракция (тельца включения) после обработки лизирующим буфером; 5 – рХн-Tup после активации; 6 – маркеры молекулярных масс.
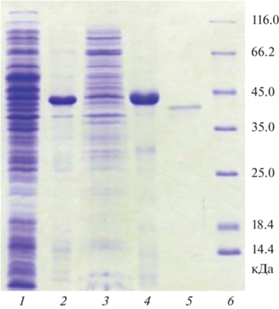
Анализ белкового состава клеток E. сoli, содержащих плазмиду pET21-CYM-Tup, после добавления индуктора, показал высокое содержание протеина, по электрофоретической подвижности совпадающего с расчетной для рПроХн-Tup (41 кДа). Его содержание составило ≥50% (рис. 1, дорожка 2) от общего количества белков клетки. Видно, что растворимая фракция биомассы E. coli после обработки буфером STET и центрифугирования (рис. 1, дорожка 3) почти не содержит целевого белка, в то время как фракция телец включения практически полностью представлена рПроХн тупайи (рис. 1, дорожка 4). Таким образом, условия экспрессии гена Хн тупайи в системе E. coli приводят к суперпродукции целевого белка, подавляющая часть которого накапливается в нерастворимой форме в тельцах включения, поэтому следующим этапом стала ренатурация рПроХн при помощи ступенчатого диализа. Попытки провести активацию зимогена до диализа окончились неудачей: препараты не проявляли коагуляционной активности. После проведения диализа, активированные препараты рПроХн-Tup демонстрировали ферментативную активность, которая свидетельствовала о том, что зимоген восстанавливает корректную третичную структуру. В результате активации было получено 3 препарата рХн-Tup – серии 1–3 – которые различались по общей и удельной МА (табл. 1).
Таблица 1.
Общая и удельная молокосвертывающая активность препаратов рХн
| Препарат рХн | Общая МА, IMCU/мл |
Концентрация белка, мг/мл | Удельная МА, IMCU/мг | Удельная МА, % |
|---|---|---|---|---|
| рХн-Tup (серия 1) | 5.3 ± 0.1 | 0.320 | 16.6 ± 0.3 | 2.6 |
| рХн-Tup (серия 2) | 0.7 ± 0.1 | 0.080 | 8.9 ± 0.3 | 1.4 |
| рХн-Tup (серия 3) | 1.4 ± 0.0 | 0.160 | 8.8 ± 0.0 | 1.4 |
| рХн-Bos | 11.0 ± 0.4 | 0.017 | 647.0 ± 23.5 | 100.0 |
| рХн-Cam | 10.9 ± 0.2 | 0.014 | 778.6 ± 14.3 | 120.3 |
Молокосвертывающая активность. Оценка биохимических свойств любого нового МФ начинается с установления его МА по отношению к коровьему молоку – основному сырью для производства сычужных сыров.
Общая МА полученных препаратов рХн-Tup варьировала в пределах 0.7–5.3 IMCU/мл. Концентрация белка в препаратах рХн-Tup оказалась, в среднем, примерно на порядок выше, чем в препаратах сравнения. В результате, по удельной МА рХн-Tup в 50–60 раз уступал коммерческим рХн коровы и одногорбого верблюда (табл. 1).
Причиной низкой удельной МА может быть неэффективный рефолдинг рХн-Tup. Известно, что восстановление корректной трехмерной структуры является проблемным этапом при получении рХн в системах экспрессии E. coli [36–39]. Вероятно, часть молекул рХн-Tup после проведения ренатурации оставалась ферментативно неактивной, что и приводило к снижению удельной МА фермента.
Таким образом, установлено, что рХн-Tup, полученный в системе экспрессии E. coli, коагулирует гетерологичный биологический субстрат – молоко коровы, но по удельной МА уступает рХн B. taurus и C. dromedarius, синтезированным в системе продукции высшего плесневого гриба Aspergillus niger var. Awamori.
Пусковым механизмом, инициирующим ферментативное свертывание коровьего молока, является гидролиз Хн-чувствительной связи F105-M106 в молекуле κ-КЗ и удаление гликомакропептида с поверхности казиновых мицелл. Способность рХн-Tup коагулировать молоко B. taurus свидетельствует о специфичности фермента как минимум к одной из пептидных связей (предположительно, F105-M106) в молекуле κ-КЗ.
Неспецифическая протеолитическая активность и соотношение МА/ПА. Протеолитическая активность Хн лежит в основе его способности свертывать молоко. Условно ПА ферментов, коагулирующих молоко можно разделить на специфическую (молокосвертывающую) и неспецифическую. Специфическая ПА (или МА) обеспечивает гидролиз Хн-чувствительной связи F105-M106 в молекуле κ-КЗ, что приводит к дестабилизации казеиновых мицелл и образованию молочного сгустка. Неспецифическая ПА, характеризует способность МФ гидролизовать любые пептидные связи, по отношению к которым он проявляет специфичность, кроме Хн-чувствительной связи κ-КЗ.
В научной периодике, посвященной проблемам изучения и практического применения МФ, для оценки технологической эффективности коагулянта молока используется отношение его МА и неспецифической ПА (МА/ПА) [7, 28]. Соотношение характеризует активность, направленную только на гидролиз Хн-чувствительной связи в молекуле κ-КЗ и приводящую к свертыванию молока. Для того чтобы избежать путаницы с ферментативной специфичностью, мы обозначили соотношение МА/ПА термином “коагуляционная специфичность”. Идеальный коагулянт молока для сыроделия должен проявлять максимальную МА при минимальной общей ПА [5]. Чем выше коагуляционная специфичность, тем универсальнее МФ и шире ассортимент сыров, для выработки которых он может использоваться.
Поскольку одной из задач данного исследования была оценка производственных перспектив рХн-Tup, для определения его неспецифической ПА (так же как и для определения МА) использовали субстрат коровьего происхождения. Неспецифическую ПА оценивали по А280 супернатантов, полученных после инкубации и осаждения компонентов фермент-субстратных смесей 3%-ной ТХУ. Пул ТХУ-растворимых компонентов содержит и продукт гидролиза Хн-чувствительной связи – гликомакропептид к-CN (f.106-169) – который не влияет на результат определения неспецифической ПА, поскольку не содержит а.к. остатков, поглощающих при 280 нм [7].
На всех стадиях инкубации фермент-субстратных смесей, рХн-Tup, проявлял более высокую ПА по отношению к коровьему КЗ, чем рХн верблюда и коровы (рис. 2).
Рис. 2.
Зависимость А280 от продолжительности прогревания фермент-субстратных смесей: 1 – рХн-Tup; 2 – рХн-Bos; 3 – рХн-Cam. На оси Х указана продолжительность прогревания при 35°С.
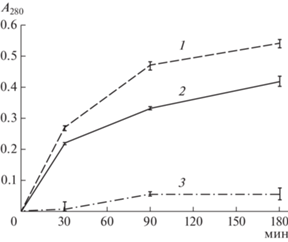
Через 180 мин инкубации, неспецифическая ПА рХн тупайи, коровы и верблюда составляла, соответственно, 0.544, 0.418 и 0.056 ед. А280. По динамике нарастания концентрации продуктов неспецифического протеолиза рХн коровы и тупайи – похожи и заметно отличаются от рХн верблюда. Наблюдавшаяся низкая неспецифическая ПА рХн одногорбого верблюда является его характерным (маркерным) биохимическим свойством и подтверждается другими исследованиями [7, 27].
Для сравнения коагуляционной специфичности рХн-Tup и коммерческих рХн использовали данные об их удельной МА (%) и неспецифической ПА (%), при этом показатели рХн коровы принимали за 100% (табл. 2). Видно, что по соотношению МА/ПА препарат рХн-Tup с наибольшей удельной МА (серия 1) катастрофически уступал ферментам сравнения.
Таблица 2.
Удельная МА, неспецифическая ПА и МА/ПА препаратов рХн
| Препарат рХн | Удельная МА, % | Неспецифическая ПА, % | МА/ПА |
|---|---|---|---|
| рХн-Tup (серия 1) | 2.6 | 130.1 | 0.02 |
| рХн Bos | 100.0 | 100.0 | 1.00 |
| рХн Cam | 120.3 | 13.4 | 8.98 |
Низкая коагуляционная специфичность фермента тупайи стала следствием малой удельной МА, которая может быть обусловлена неполным рефолдингом его зимогена, выделенного из телец включения. Возможно, использование эукариотической системы экспрессии вместо прокариотической позволит повысить выход активного рХн-Tup, его удельную МА и, как следствие, – соотношение МА/ПА.
Таким образом, неспецифическая ПА рХн-Tup, полученного в прокариотической системе продукции, оказалась на 30 и 117% выше, чем у рХн-Bos и рХн-Сam соответственно. Высокая неспецифическая ПА ограничивает сферу использования рХн-Tup производством быстросозревающих сыров с короткими (не более 14 сут) сроками хранения.
Протеолитическая активность по отношению к α-, β- и κ-казеинам коровы. Как следует из данных, представленных на рис. 3, рХн- способен гидролизовать изолированные α-, β- и κ-КЗ коровы. В условиях эксперимента генно-инженерный Хн тупайи эффективно атаковал не только κ-КЗ коровы, но и продукт его гидролиза – пара-κ-КЗ (полоса с ММ ≈ 16 кДа). В результате в фермент-субстратной смеси накапливались компоненты с ММ < 14 кДа (рис. 3, дорожка 6). Рекомбинантный Хн B.taurus полностью деградировал κ-КЗ и частично – пара-κ-КЗ. При этом в фермент-субстратной смеси появлялся продукт с ММ ≈ 14 кДа (рис. 3, дорожка 7). В отличие от тупайи и коровы, ПА рХн C. dromedarius была направлена, преимущественно, на к-КЗ и почти не затрагивала пара-к-КЗ (рис. 3, 8).
Рис. 3.
Протеолитическая активность рХн тупайи, коровы и одногорбого верблюда по отношению к α-, β- и κ-КЗ коровы: 1 – α-КЗ; 2 – β-КЗ; 3 – κ-КЗ; 4 – маркеры ММ; 5 – κ-КЗ (контроль); 6 – κ-КЗ + рХн-Tup; 7 – κ-КЗ + рХн-Bos; 8 – κ-КЗ + рХн-Cam; 9 – α-КЗ (контроль); 10 – α-КЗ + рХн-Tup; 11 – α-КЗ + рХн-Bos; 12 – α-КЗ + рХн-Cam; 13 – β-КЗ (контроль); 14 – β-КЗ + рХн-Tup; 15 – β-КЗ + рХн-Bos; 16 – β-КЗ + рХн-Cam. Cтрелками указано положение пара-к-КЗ (ММ ≈ 16 кДа) на дорожках 6–8.
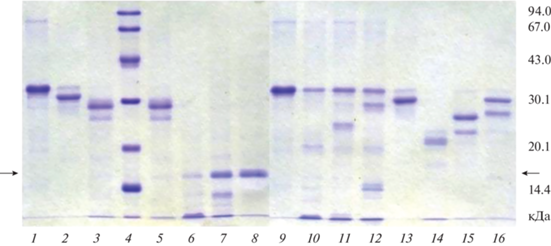
Все исследованные ферменты проявляли ПА по отношению к изолированному коровьему α-КЗ. Основная полоса α-КЗ сохранялась после 60 мин инкубации со всеми ферментами, но в случае рХн-Tup ее интенсивность была наименьшей (рис. 3, дорожки 10–12). Это свидетельствует о более высокой ПА фермента тупайи по отношению к изолированному α-КЗ, по сравнению с коммерческими рХн.
Все исследованные нами рХн различались по интенсивности протеолиза свободного β-КЗ коровы. Рекомбинантные химозины тупайи и коровы полностью гидролизовали β-КЗ, с образованием полипептидов с ММ в диапазоне 20–26 кДа, а рХн верблюда оказывает на этот субстрат наименьшее протеолитическое воздействие (рис. 3, дорожки 14–16).
Ранее, метод ЭФ уже использовался для изучения ПА рХн коровы и верблюда по отношению к индивидуальным фракциям коровьего КЗ [24, 33, 40]. По данным работ [33, 40] рХн коровы и верблюда, полученные в системе экспрессии P. pastoris проявляли ПА только по отношению к κ-КЗ, но не гидролизовали α- и β-КЗ коровы. Такое противоречие с нашими данными может объясняться различиями в постановке экспериментов по оценке специфичности рХн (чистота и МА рХн, соотношение фермента и субстрата, состав буферов, рН, температура и продолжительность инкубации фермент-субстратных смесей). В целом, полученные нами результаты хорошо согласуются с данными работы [24], авторы которой исследовали субстратную специфичность коммерческих рХн коровы и верблюда (производства компании “Chr. Hansen”), полученных в системе экспрессии A. niger.
Таким образом, по сравнению с коммерческими генно-инженерными химозинами, рХн-Tup вызывает более глубокую протеолитическую деградацию изолированных фракций КЗ коровы. По интенсивности протеолитического действия на α-, β-и κ-КЗ коровы, ферменты можно расположить следующим образом: рХн-Tup > рХн-Bos > рХн-Cam.
Можно предположить, что при использовании в качестве субстратов не изолированных фракций КЗ, а препаратов суммарного (мицеллярного) КЗ или коровьего молока, картина протеолиза и оценки специфичности рХн будут выглядеть по-другому. Если субстрат находится в форме мицелл, то экспонированные наружу, С-концевые участки к-КЗ, образующие “волосковый слой”, легко доступны для протеолитической атаки Хн (или других МФ). Напротив, МФ гораздо сложнее атаковать N-концевые участки κ-КЗ, а также молекулы α- и β-КЗ, расположенные под “волосковым слоем” и в толще мицеллы. В этой связи возникает закономерный вопрос об информативности результатов определения ПА химозинов с использованием изолированных α-, β- и κ-КЗ. Возможно, для более адекватной оценки нового рХн целесообразно исследовать его специфичность на молочном субстрате, в котором КЗ находятся в мицеллярной форме.
Термостабильность. Термостабильность является важнейшей характеристикой любого индустриального фермента. При этом для разных технологических процессов необходимы ферментные препараты с различными диапазонами ТС. Например, при производстве сыров с высокой температурой 2-го нагревания и длительными сроками созревания и хранения, востребованы коагулянты молока стабильные при температурах ≤50°С. Молокосвертывающий фермент с высокой ТС, сохраняющий активность после нагревания сырного зерна до 52–58°С, может проявлять нежелательную ПА в сыре и ухудшать его физико-химические и органолептические показатели [41, 42].
Сфера применения коагулянтов молока, которые сохраняют ПА при температурах >60°С – ограничена и распространяется, преимущественно, на производство сыров с короткими сроками созревания и хранения. Для выработки полутвердых и твердых сыров, требующих длительных сроков созревания и хранения, предпочтительны термолабильные МФ. Снижение ТС перспективного коагулянта молока может потребовать разработки специальных технологических приемов. Например, для того, чтобы максимально адаптировать натуральные молокосвертывающие эндопептидазы (мукорпепсины) плесневых грибов рода Rhizomucor к потребностям промышленного сыроделия, были специально разработаны методы их химической модификации для снижения исходно высокой ТС [43, 44].
Современные технологические рХн различаются по ТС. По данным [7, 45], рХн одногорбого верблюда термостабильнее, чем рХн коровы и сохраняет более высокую остаточную МА в диапазоне температур 50–60°С. Точки плавления рХн коровы и верблюда, составляют соответственно 57.7 и 60.7°С [9]. Наглядная демонстрация того, насколько важны различия в 3°С между порогами термоденатурации промышленных МФ, представлена в работе [41]. Показано, что увеличение температуры нагревания сгустка с 50 до 56°С приводит к значительному снижению концентрации продуктов протеолиза αs1-КЗ в сырах типа Reggianito, произведенных с применением рХн коровы и верблюда, за счет более глубокой термоинактивации МФ. При этом в сырах, выработанных с температурой нагревания сгустка 56°С и с применением более термостабильного рХн верблюда, интенсивность протеолиза была выше, чем при использовании коровьего рХн [41]. Таким образом, рХн верблюда, имеющий вчетверо меньший уровень общей ПА, чем рХн коровы, но превосходящий его по ТС, проявлял более высокую неспецифическую ПА в созревающих и хранящихся сырах.
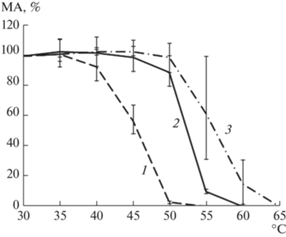
По сравнению с коммерческими и экспериментальными генно-инженерными химозинами [25], рХн-Tup выделялся необычно низкой ТС (рис. 4). Порог термоинактивации рХн-Tup составил 45°С – при этой температуре его коагуляционная способность падала более чем на 40%, а при 50°С – фермент утрачивал >90% от исходной МА. Для коммерческих коагулянтов порог термоинактивации был на 10°С выше и составлял 55°С. При этом рХн-Bos полностью инактивировался при 60°С, а рХн-Cam – при 65°С.
Рис. 4
Зависимость остаточной молокосвертывающей активности от температуры прогревания препаратов рХн: 1 – рХн-Tup; 2 – рХн-Bos; 3 – рХн-Cam.
Возможно, экстраординарная термолабильность рХн-Tup связана с особенностями терморегуляции животных этой группы млекопитающих. По данным [46] средняя температура тела T. belangeri составляет 39.6°С. Известно также, что для тупайи характерны суточные колебания температуры тела, синхронизированные с ритмами активности. Амплитуда колебаний необычайно высока и составляет около 5°С, что намного больше, чем у большинства других изученных млекопитающих. Согласно данным телеметрии, минимальная температура тела тупайи составляет 35–36°С, а максимальная – 40–41°С [47]. В этой связи, возникает вопрос: не является ли чрезвычайно низкая ТС Хн тупайи, элементом защиты факторов пассивного иммунитета от избыточной ПА этой гастральной протеиназы? Можно предполагать, что после активации зимогена в просвете желудка новорожденного, термолабильный Хн тупайи “успевает” коагулировать находящееся в нем молоко, но в дальнейшем термоинактивируется и не оказывает глубокого протеолитического действия на Ig и другие защитные белки. В результате, содержащиеся в молоке факторы пассивного иммунитета, за счет механизмов прямого трансцеллюлярного переноса в эпителии кишечника, попадают в кровь и обеспечивают иммунологическую защиту новорожденного.
Таким образом, по сравнению с рХн коровы и верблюда генно-инженерный Хн тупайи является исключительно термолабильным МФ. Что касается “сыродельных” перспектив рХн-Tup, то не исключено, что его низкая ТС может, хотя бы частично, компенсировать негативный эффект высокой ПА и позволит более широко использовать этот фермент. Например, при выработке сыров со сроками созревания и хранения 30–45 сут.
Параметры кинетики Михаэлиса-Ментен. Для определения основных параметров ферментативной кинетики использовали наиболее активный из 3 препаратов рХн-Tup (серия 1).
Основные показатели кинетики Михаэлиса-Ментен рХн-Tup заметно отличаются от значений кинетических констант, полученных для коммерческих рХн (табл. 3). По сравнению с рХн-Bos и рХн-Cam фермент T. belangeri продемонстрировал самые низкие значения Кm, что указывает на более высокую аффинность к использованному хромогенному субстрату. В отличие от ферментов сравнения, рХн-Tup в 2.3–2.5 раза быстрее освобождался от продуктов реакции и вступал в новое взаимодействие с субстратом, на что указывали более высокие значения числа оборота фермента (kcat) и его каталитической эффективности (kcat/Km). Таким образом, кинетические константы рХн-Tup свидетельствовали о том, что его ферментативная эффективность по отношению к синтетическому флуорогенному субстрату, имитирующему Хн-чувствительный участок κ-КЗ коровы, выше, чем у современных коммерческих рХн.
Таблица 3.
Основные параметры кинетики Михаэлиса–Ментен рХн
| Препарат рХн | Km, мкМ | Vmax, мкМ с-1 | kcat, с–1 | kcat/Km, мкМ–1 с–1 |
|---|---|---|---|---|
| рХн-Tup (серия 1) | 6.3 ± 1.4 | 596 ± 158 | 11927 ± 3169 | 1968 ± 620 |
| рХн-Bos | 12.0 ± 1.8 | 238 ± 3 | 4759 ± 51 | 404 ± 67 |
| рХн-Cam | 20.3 ± 4.23 | 264 ± 42 | 5287 ± 842 | 265 ± 56 |
Для того чтобы попытаться понять причины высокой каталитической эффективности генно-инженерного Хн тупайи было проведено сравнение первичной структуры κ-КЗ B. taurus, C. dromedarius и T. belangeri. Так, зрелый κ-КЗ коровы состоит из 169 а.к. (Хн-чувствительная связь расположена в позиции F105-M106), κ-КЗ верблюда – из 162 а.к. (Хн-чувствительная связь – в позиции F97-I98), а κ-КЗ тупайи содержит 164 а.к. остатка (предполагаемая Хн-чувствительная связь – L98-K99). Удивительно, но при 81.6% идентичности Хн тупайи и коровы сходство первичной структуры κ-КЗ этих видов оказалось одним из самых низких, среди уже установленных, и составило всего 41.9%. В свою очередь, а.к. последовательности κ-КЗ коровы и верблюда идентичны на 58.4%. Таким образом, κ-КЗ коровы, тупайи и верблюда демонстрируют значительные межвидовые различия.
Аминокислотные последовательности Хн-чувствительных участков κ-КЗ тупайи и коровы совпадают лишь на 25%. Они различаются по 18 аминокислотным остаткам из 24, включая две замены на участке “ключевой” пептидной связи: F105 (B. taurus) → L98 (T. belangeri), где неполярный ароматический радикал заменен на неполярный алифатический и M106 (B. taurus) → Lys99 (T. belangeri), где вместо гидрофобного серосодержаего радикала находится гидрофильный, положительно заряженный а.к. остаток (рис. 5).
Рис. 5.
Аминокислотные последовательности Хн-чувствительных участков κ-КЗ коровы, одногорбого верблюда и тупайи. В скобках после видового названия указана степень гомологии первичной структуры κ-КЗ данного вида по отношению к κ-КЗ коровы. Зеленым цветом отмечена последовательность 105–106 в молекуле κ-КЗ коровы, желтым – аминокислотные замены в κ-КЗ тупайи и верблюда по сравнению с κ-КЗ коровы, голубым цветом выделены а.к. остатки, совпадающие во всех трех последовательностях. Стрелками указаны пептидные связи, гидролизуемые гомологичными и гетерологичными химозинами. Знаком “?” обозначена предполагаемая Хн-чувствительная пептидная связь κ-КЗ тупайи. Первичные структуры к-казеинов взяты из базы данных GenBank (T. belangeri – XM_006142970; B. taurus – AY380228.1; С. dromedarius – NP_001290489.1).

Для сравнения: идентичность участков 96-119 κ-КЗ коровы и верблюда составляет 62.5%. Можно было ожидать, что серьезные различия первичной структуры аналогичных участков κ-КЗ коровы и тупайи приведут к снижению аффинности рХн T. belangeri к пептиду, имитирующему Хн-чувствительный участок гетерологичного субстрата. Однако, на практике, мы наблюдали обратное: по скорости насыщения субстратом, рХн тупайи превосходил ферменты коровы и верблюда в 1.9 и 3.2 раза соответственно. Можно предполагать, что в связывании рХн-Tup и κ-КЗ коровы задействованы иные субсайты специфичности, чем в случае рХн коровы и верблюда.
Поскольку структуры Хн-чувствительных участков κ-КЗ коровы и тупайи существенно различаются, вопрос о сайте гидролиза коровьего субстрата остается открытым. Известно, что МФ эндотиапепсин (КФ 3.4.23.22), ограниченно используемый в сыроделии, гидролизует в κ-КЗ коровы не ключевую связь F105-M106, а предшествующую ей последовательность – S104-F105, где в положении Р1 находится незаряженная полярная R-группа. И это несмотря на то, что специфичность эндотиапепсина близка к специфичности свиного пепсина, то есть предпочтительными для гидролиза являются гидрофобные R-группы аминокислот в положении Р1 и Р1' [48, 49], Поэтому, исходя из анализа кинетики гидролиза синтетического субстрата, можно утверждать лишь то, что рХн-Tup атакует κ-КЗ коровы на участке 96-119 настолько эффективно, что вызывает свертывание молока. Для точного установления сайта гидролиза коровьего κ-КЗ рХн-Tup необходимо проведение дополнительных исследований.
Особенности а.к. последовательности κ-КЗ T. belangeri поднимают и ряд других вопросов, связанных с субстратной специфичностью Хн различной видовой принадлежности. Например: какую пептидную связь гидролизуют гомологичные и гетерологичные Хн в молекуле κ-КЗ тупайи; какова специфичность рХн-Tup по отношению к Хн-чувствительным участкам κ-КЗ животных, относящихся к различным отрядам Млекопитающих?
***
Таким образом, в системе экспрессии E. coli впервые получен и частично охарактеризован генно-инженерный Хн тупайи. Показано, что, несмотря на значительные различия в структуре κ-КЗ B. taurus и T. belangeri, особенно в области Хн-чувствительной последовательности, рХн-Tup способен коагулировать коровье молоко. Неспецифическая ПА фермента тупайи по отношению к суммарной фракции КЗ коровы оказалась на 30 и 117% выше, чем у рХн коровы и верблюда соответственно. В сравнении с коммерческими генно-инженерными химозинами (C. dromedarius и B. taurus) рХн тупайи проявлял повышенную ПА по отношению к изолированным α-, β- и κ-КЗ коровьего молока. Порог термоинактивации рХн-Tup составлял 45°С, что значительно ниже, чем у подавляющего большинства коммерческих и экспериментальных рХн. Причины экстраординарной термолабильности рХн-Tup должны стать предметом отдельного исследования, поскольку его результаты могут иметь значение для инжиниринга индустриальных МФ, с целью направленного изменения их терморезистентности. Способность генно-инженерного Хн тупайи свертывать молоко коровы, наряду с высокой каталитической эффективностью по отношению к пептиду, имитирующему Хн-чувствительный участок коровьего κ-КЗ, позволяют отнести этот фермент к универсальным коагулянтам молока, которые могут представлять потенциальный интерес для сыроделия. Для полной биохимической характеристики рХн-Tup необходимо расширенное изучение его специфичности по отношению к гомологичным и гетерологичным κ-КЗ.
Авторы надеются, что результаты настоящей работы активизируют поиски и исследования новых “универсальных” химозинов среди видов, не принадлежащих к отряду Китопарнокопытные.
Финансирование. Работа выполнена в рамках государственного задания Министерства науки и высшего образования РФ (FZMW-2020-0002, “Разработка продуцентов рекомбинантных ферментов для сыроделия”).
Конфликт интересов. Авторы заявляют об отсутствии конфликтов интересов.
Соблюдение этических норм. Настоящая статья не содержит описания исследований, выполненных с участием людей или использованием животных в качестве объектов.
Список литературы
Foltmann B. // Scand. J. Clin. Lab. Invest. 1992. V. 52. P. 65–79.
Lopes-Marques M., Ruivo R., Fonseca E., Teixeira A., Castro L.F.C. // Mol. Phylogenet. Evol. 2017. V. 116. P. 78–86.
Bansal N., Drake M.A., Piraino P., Broe M.L., Harboe M., Fox P.F. et al. // Int. Dairy. J. 2009. V. 19. № 9. P. 510–517.
Fox P.F., McSweeney P.L.H. // Cheese: Chemistry, Physics and Microbiology. 2004. V. 1. P. 1–18.
Harboe M., Broe M.L., Qvist K.B. // Technology of Cheesemaking. 2010. P. 98–129.
Flamm E.L. // Nat. Biotechnol. 1991. V. 9. № 4. P. 349.
Kappeler S.R., Rahbek-Nielsen H., Farah Z., Puhan Z., Hansen E.B., Johansen E. // Biochem. Biophys. Res. Commun. 2006. V. 342. № 2. P. 647–654.
Børsting M.W., Qvist K.B., Rasmussen M., Vindeløv J., Vogensen F.K., Ardö Y. // Dairy Sci. Technol. 2012. V. 92. № 5. P. 593–612.
Jensen J.L., Mølgaard A., Poulsen J.-C.N., Harboe M.K., Simonsen J.B., Lorentzen A.M. et al. // Acta Crystallogr. D Biol. Crystallogr. 2013. V. 69. № 5. P. 901–913.
Jensen J.L., Jacobsen J., Moss M.L., Rasmussen F., Qvist K.B., Larsen S. et al. // J. Dairy Sci. 2015. V. 98. № 5. P. 2853–2860.
Ansari S.M., Coletta A., Skeby K.K., Sørensen J., Schiøtt B., Palmer D.S. // J. Phys. Chem. B. 2016. V. 120. № 40. P. 10453–10462.
Ansari S.M., Sørensen J., Schiøtt B., Palmer D.S. // Proteins Struct. Funct. Bioinforma. 2018. V. 86. № 1. P. 75–87.
Sørensen J., Palmer D.S., Qvist K.B., Schiøtt B. // J. Agric. Food Chem. 2011. V. 59. № 10. P. 5636–5647.
Sørensen J., Palmer D.S., Schiøtt B. // J. Agric. Food Chem. 2013. V. 61. № 33. P. 7949–7959.
Uniacke-Lowe T., Fox P.F. // Cheese Fourth Edi. 2017. P. 69–113.
Bayoumi S. // Kieler Milchwirtsch Forschungsberichte. 1990. V. 42. № 1. P. 3–8.
Wangoh J., Farah Z., Puhan Z. // Milchwissenschaft. 1993. V. 48. № 6. P. 322–325.
Saliha B.H., Louis L.C., Farida M.M., Saliha S.A., Nasma, M, Elkhir S.O. et al. // Emirates J. Food Agric. 2011. V. 23. № 4. P. 301–310.
Farah Z., Bachmann M.R. // Milchwissenschaft. 1987. V. 42. № 11. P. 689–692.
Kappeler S., Farah Z., Puhan Z. // J. Dairy Res. 1998. V. 65. № 2. P. 209–222.
Akishev Z., Kiribayeva A., Mussakhmetov A., Baltin K., Ramankulov Y., Khassenov B. // Heliyon. 2021. V. 7. № 5. P. e07137. https://doi.org/10.1016/j.heliyon.2021.e07137
Stasiuk S.J., Summers E.L., Demmer J. // Reprod. Fertil. Dev. 2000. V. 12. № 4. P. 215–222.
Kotts C., Jenness R. // J. Dairy Sci. 1976. V. 59. № 5. P. 816–822.
Alihanoğlu S., Ektiren D., Karaaslan M. // Protein Expr. Purif. 2021. V. 183. P. 105874. https://doi.org/10.1016/j.pep.2021.105874
Belenkaya S.V., Balabova D.V., Belov A.N., Koval A.D., Shcherbakov D.N., Elchaninov, V.V. // Appl. Biochem. Microbiol. 2020. V. 56. № 4. P. 363–372.
Belenkaya S.V., Shcherbakov D.N., Balabova D.V., Belov A.N., Koval A.D., Elchaninov, V.V. // Appl. Biochem. Microbiol. 2020 V. 56. № 6. P. 647–656.
Belenkaya S.V., Rudometov A.P., Shcherbakov D.N., Balabova D.V., Kriger A.V., Belov A.N. et al. // Appl. Biochem. Microbiol. 2018. V. 54. № 6. P. 569–576.
Filkin S.Y., Chertova N.V., Zatsepin S.S., Sadykhov E.G., Fedorov A.N., Lipkin A.V. // Appl. Biochem. Microbiol. 2021. V. 57. № 3. P. 297–302.
Kageyama T. // Biochemistry. 2004. V. 43. № 48. P. 15122–15130.
Kageyama T. // J Biochem. 2000. V. 127. № 5. P. 761–770.
Fan Y., Huang Z.-Y., Cao C.-C., Chen C.-S., Chen Y.-X., Fan D.-D., et al. // Nat. Commun. 2013. V. 5. № 1. P. 1426.
Bradford M.M. // Anal. Biochem. 1976. V. 72. № 1–2. P. 248–254.
Wang N., Wang K.Y., Li G., Guo W., Liu D. // Protein. Expr. Purif. 2015. № 111. P. 75–81.
Laemmli U.K. // Nature. 1970. V. 227. № 5259. P. 680–685.
Belenkaya S.V., Bondar A.A., Kurgina T.A., Elchaninov V.V., Bakulina A.Y., Rukhlova et al. // Biochemistry (Moscow). 2020. V. 85. № 7. P. 781–791.
Wei C., Tang B., Zhang Y., Yang K. // Biochem. J. 1999. V. 340. № 1. P. 345–351.
Chen H., Zhang G., Zhang Y., Dong, Y., Yang K. // Biochemistry. 2000. V. 39. № 40. P. 12140–12148.
Wei C., Zhang, Y., Yang K. // J. Protein Chem. 2000. V. 19. № 6. P. 449–456.
Eskandari M.H., Hosseini A., Alasvand Zarasvand S., Aminlari M. // Food Biotechnol. 2012. V. 26. № 2. P. 143–153.
Jiang X.P., Yin M.L., Chen P., Yang Q. // World J. Microbiol. Biotechnol. 2012. V. 28. № 5. P. 2087–2093.
Costabel L.M., Bergamini C.V., Pozza L., Cuffia F., Candioti M.C., Hynes E. // J. Dairy Res. 2015. V. 82. № 3. P. 375–384.
Upadhyay V.K., McSweeney P.L.H., Magboul A.A.A., Fox P.F. // Cheese: Chemistry, Physics and Microbiology. 2004. V. 1. P. 391–434.
Feijoo-Siota L., Blasco L., Rodríguez-Rama J.L., Barros-Velázquez J., de Miguel T., Sánchez-Pérez A. et al. // Recent Adv. DNA Gene Seq. 2014. V. 8. № 1. P. 44–55.
Патент Великобритании. 1982. № 4,348,482.
Vallejo J.A., Ageitos J.M., Poza M., Villa T.G. // J. Dairy Sci. 2012. V. 95. № 2. P. 609–613.
Wang J., Xu X-L., Ding Z-Y., Mao R-R., Zhou Q-X., Lv L.-B. et al. // Zoological Research. 2013. V. 34. № E2. P. E69–E74. https://doi.org/10.3724/SP.J.1141.2013.E02E69
Refinetti R., Menaker M. // J. Exp. Zool. 1992. V. 263. № 4. P. 453–457.
Bailey D., Cooper J.B., Veerapandian B., Blundell T.L., Atrash B., Jones D.M. et al. // Biochem. J. 1993. V. 289. № 2. P. 363–371.
Whitaker J.R. // Methods Enzymol. 1970. V. 19. P. 436–445.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


