Прикладная биохимия и микробиология, 2021, T. 57, № 6, стр. 621-628
Протеомная идентификация белков – потенциальных биомаркеров немясных компонентов в мясной продукции
Л. И. Ковалёв 1, *, М. А. Ковалёва 1, Л. А. Новикова 1, И. М. Чернуха 2
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
2 Федеральный научный центр пищевых систем им. В.М. Горбатова Российской академии наук
109316 Москва, Россия
* E-mail: kovalyov@inbi.ras.ru
Поступила в редакцию 07.06.2021
После доработки 30.06.2021
Принята к публикации 02.07.2021
Аннотация
При анализе эталонных и коммерческих образцов мясной продукции (вареной и консервированной) классическим методом двумерного электрофореза по O’Фарреллу идентифицировано 10 производных белков или их фрагментов, которые являлись компонентами сои, молока, яиц, тыквы и подсолнечника. Именно они могут быть биоиндикаторами в незаявленных добавках при разработке более экспрессных и чувствительных методов контроля качества.
В процессе изготовления различных видов мясной продукции в некоторых случаях используется, целый ряд белковых добавок немышечного происхождения, включающих белки яиц, молока и продуктов растительного происхождения сои, пшеницы, риса, овса, тыквы и др.
Состав коммерческого продукта всегда официально регламентирован соответствующими государственными стандартами или техническими условиями производителя. В них устанавливается предельное содержание всех компонентов, включая немышечного происхождения, присутствие или превышение уровня которых можно рассматривать как фальсификацию или нарушение условий производства.
Контроль качества таких пищевых продуктов подразумевает использование методов, позволяющих выявить специфические компоненты немышечного происхождения и оценить их качественное и количественное содержание в изготовленной продукции.
В настоящее время основная часть таких белковых добавок проходит этапы дополнительной подготовки, что в итоге приводит к потере ими части аминокислотной последовательности, а дальнейшая термообработка (вареные колбасы до 90°С, а консервы до 115°С и давлении 0.23 МПа) в присутствии посолочно-нитритной смеси может вызвать и термохимические модификации в сохранных аминокислотных структурах добавок, что еще более затрудняет выбор биоиндикаторов для контроля.
Одна из таких наиболее распространенных растительных добавок – добавка из соевых бобов. Как правило, в настоящее время они используются в виде соевого изолята или текстурата в виду большей технологичности. В то же время, соя, как и многие другие немышечные добавки (пшеничная мука, молоко, яйцо и продукты их переработки) входит в перечень аллергенов, присутствие которых в продукции должно строго контролироваться и выноситься на этикетку согласно ТР ТС 022/2011 (“Пищевая продукция в части ее маркировки”) [1].
Попытки использовать соевые белки как мишени ненормативных добавок предпринимались неоднократно, в частности для β-конглицинина [2], разных видов глицининов [3], ингибиторов трипсина типа Баумана-Бирка и Кунитца [4]. Такие разработки методов контроля ненормативных добавок в мясную продукцию продолжаются и сейчас. В настоящее время существуют два наиболее конкурирующих метода по производительности и цене – это “скорострельная”, она же панорамная, протеомика – “shortgun” [5] и иммуноферментный анализ [6]. Для панорамной протеомики важны значения m/z (коэффициент отношения массы к заряду – mass-to-charge ratio) с подтверждением аминокислотной последовательности соответствующих триптических пептидов, а для иммуноферментного анализа приоритетным является то, какая часть белка осталась сохранной и может служить в качестве мишени для антител.
Классический двумерный электрофорез по О'Фарреллу не самый производительный метод в качестве контроля качества таких образцов, но он позволяет идентифицировать именно сохранные чужеродные белки и/или их фрагменты в мясной продукции, хотя разработка количественных характеристик требует применения более тонких методов исследования [7].
Цель работы – выявление и идентификация белков/фрагментов немышечного происхождения в двух типах термообработанной мясной продукции (вареных колбасах и консервах типа тушеного мяса), как биоиндикаторов для определения ее соответствия маркировке и разработки более быстрых, экономичных и производительных методов контроля.
МЕТОДИКА
Образцы мясной продукции были представлены двумя видами: колбасы вареные “Докторская” и “Любительская” и консервированной продукцией “Говядина тушеная” и “Свинина тушеная” с более жестким режимом термообработки.
Из всего количества исследованных образцов вареных колбас (n = 40), три образца были изготовлены на базе экспериментального производства ФНЦ пищевых систем (Россия), при строгом контроле рецептуры и количества закладываемого мясного сырья, и они рассматривались как эталон. Остальные были закуплены в торговых сетях РФ и стран СНГ. В некоторых образцах помимо говядины и свинины было декларировано наличие мяса птицы, говядины, соевых добавок, сывороточных белков молока и пшеничной клетчатки, муки тыквы.
Вторая партия образцов (n = 15) представляла консервированную продукцию из свинины и говядины с более жестким режимом термообработки. Три образца были произведены на базе ФНЦ пищевых систем, при строгом контроле качества закладываемого мясного сырья, и они также рассматривались как эталон. Остальные были закуплены в торговых сетях РФ, СНГ и ЕС. В двух образцах было декларировано наличие соевых белков.
В качестве основной протеомной технологии применяли двумерный электрофорез (ДЭ) по О’Фарреллу с изоэлектрофокусированием в амфолиновом (IEF-PAGE) градиенте рН, как описано ранее [8]. Детекцию белков на двумерных электрофореграммах проводили окрашиванием кумасси голубым R-250 (СВВ R-250) и далее последовательно азотнокислым серебром [9].
Для идентификации белков отдельные фракции вырезали из сухих ДЭ, измельчали вырезанные фрагменты и проводили их трипсинолиз, как описано ранее [10]. Далее соответствующие наборы пептидов изучали методами MALDI-TOF MS и MS/MS масс-спектрометрии на MALDI – времяпролетном масс-спектрометре Ultraflex (“Bruker”, Германия) с УФ-лазером (336 нм) в режиме положительных ионов в диапазоне масс 500–8000 Да с калибровкой их по известным пикам аутолиза трипсина. Полученные масс-спектры (“пептидные фингерпринты”) расшифровывали с помощью традиционных биоинформационных технологий.
Биоинформационный анализ масс-спектрометрических “пептидных фингерпринтов” с помощью программы Mascot и других биоинформационных технологий. Анализ полученных масс-спектров триптических пептидов выполняли с помощью программы Mascot, опция Peptide Fingerprint (“Matrix Science”, США), с точностью определения массы МН+ равной 0.01%, осуществляя поиск по базам данных Национального центра биотехнологической информации США (NCBI). При проведении исследований использовалось оборудование Центра коллективного пользования “Промышленные биотехнологии” Федерального государственного учреждения “Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук”.
При сравнительном анализе протеомных профилей представленных образцов использовали информационные модули “Белки скелетной мышцы коров (Bos taurus)” и "Белки скелетной мышцы свиньи (Sus scrofa)”, базы данных “Протеомика мышечных органов” (http://mp.inbi.ras.ru).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Нарушение рецептуры мясной продукции при ее анализе ДЭ по О’Фарреллу отражается в виде появления атипичных фракций белков, которые, как правило, сразу видны на двумерных электрофореграммах при анализе коммерческой продукции (рис. 1).
Рис. 1.
Двумерные электрофореграммы белков вареных колбас: а – эталонный образец по рецептуре докторской колбасы, б – с декларируемыми добавками немышечного происхождения сои, в – с превышением добавки молока, г – с декларируемыми добавками муки тыквы есть в методике Нумерация фракций согласно табл. 1.
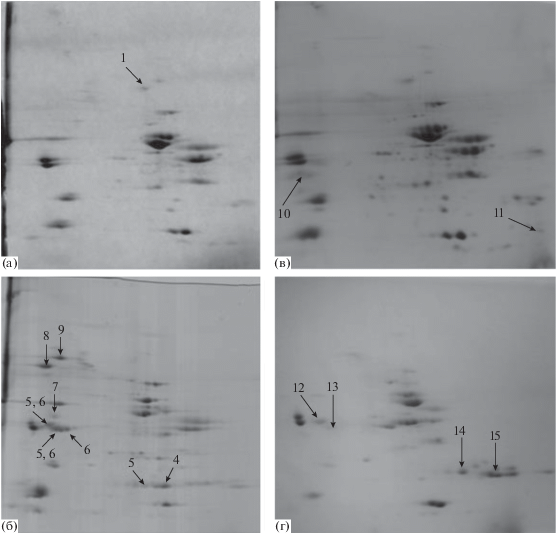
Вареные колбасы. При сравнительном анализе эталонных образцов и вареных колбас с декларируемым на этикетке присутствием белковых добавок не мышечного происхождения выявляется соответствующая панель потенциальных биомаркеров. Все белки, детектируемые в эталонных образцах, были идентифицированы и оказались белками свинины и/или говядины, за исключением фракции практически полноразмерного овотрансферрина (№ 1), которая и является биомаркером количества белков яиц, используемых при приготовлении эталонных образцов указанных вареных колбас. Овотрансферрин достаточно устойчив к термообработке. Масс-спектрометрическая идентификация показала, что сохранным остается крупный фрагмент аминокислотной последовательности (а.п.) с 44 по 673 позицию из 705.
Другой тип животных добавок, часто использующийся при производстве таких типов колбас, – белки молока. При соблюдении требований ГОСТ/ТУ в силу малого количества добавки молочного сырья обычно не детектируется на ДЭ. Однако производитель может завышать количество добавляемого молока для повышения уровня общего белка в продукции, что в ряде случаев наблюдалось и в коммерческой продукции разных производителей. Появляются дополнительные фракции, которые по результатам масс-спектрометрической идентификации оказались фрагментами двух белков молока: казеина каппа, продукта гена CSN3 – с 25 по 105 позицию из 190 а.о. и казеина CSN2, в котором детектируются две фракции, идентифицированные как фрагменты а.п. 64-224 и 121-224 из 224 а.о.
Широко используются в производстве вареных колбас растительные добавки. Наиболее распространенная добавка – это производные соевых белков. На рис. 1б показано присутствие 6 фракций соевых белков (в образце с декларируемым производителем наличием сои), которые оказались фрагментами (табл. 1) четырех белков сои – продуктами 4 генов, в виде мономорфных или смесовых фракций: глицинина A1aBx (GY1) – а.п. 321–425 из 495; глицинина A1aB1b мутантная субъединица (GY1) – 36–259 из 386, глицинина G2 (GY2) – 33–256, глицинина (A3B4) – 79–236, субъединица α β-конглицинина (CG-4) – 24–522 из 543 и субъединица α' β-конглицинина (CG-1) в виде полноразмерного белка. Продукты гена GY1 были идентифицированы в двух транскрипционных вариантах, что при количественных методах оценки может давать завышение количества сои в образце. Эти фракции были выявлены и в некоторых образцах коммерческой продукции разных производителей в варьирующихся количествах, но не декларируемых в составе.
Таблица 1.
Выявленные масс-спектрометрическими методами маркеры не мышечного происхождения в мясной продукции
| № | Наименование белка (символ гена) | Коэффициент отношения массы к заряду (m/z) выявленных триптических пептидов в порядке возрастания масс | Выявленные сохранные фрагменты аминокислотной последовательности белков в мясной продукции |
|---|---|---|---|
| Вареные колбасы | |||
| Маркеры яичных белков (Gallusgallus) | |||
| 1 | Овотрансферрин (TRFE) |
831.4; 888.4; | 44–673 |
| 912.5; 1046.5; | 275–421 | ||
| 1066.5; 1226.1; | |||
| 1307.6; 1328.7; 1330.7; 1429.7; 1443.8; 1454.8; 1515.8; 1533.8; 1651.8; 1694.8; 1745.9; 1830.1; 1893.0; 1959.0; 2055.0; 2377.2; 2569.3; 2633.3; 2953.5; 3284.6 | 266–421 | ||
| 2 | Овотрансферрин (TRFE) |
1066.5; 1328.7;
1694.8; 1745.9; 1893.0; 2055.0 |
275–421 |
| 3 | Овотрансферрин (TRFE) |
1066.5; 1694.9; 1429.7; 1745.9; 1830.1; 1893.0; 2055.0; 2569.3 | 266–421 |
| Маркеры соевых белков (Glycinemax) | |||
| 4 | Глицинин A1aBx (GY1) | 588.3; 978.5; 1101.6; 1148.6; 1424.9; 1568.9; 2619.3; 3912.0; 4853.4 | 321–425 |
| 5 | Глицинин A1aB1b мутантная субъединица (Gy1) | 711.4; 1029.5; 1039.6; 1899.9; 2340.2; 2432.3; 3140.5; 3461.6; 3901.9; 4800.3 | 36–259 |
| 6 | Глицинин G2 (GY2) | 1039.6; 1098.6; 1278.7; 1930.9; 3217.6; 3794.9 | 33–256 |
| 7 | Глицинин (A3B4) | 1325.6; 2287.1;
2622.4; 2340.2; 2728.3; 947.4; 3042.2; 4580.0 |
79–236 |
| 8 | Cубъединица α β-конглицинина (CG-4) | 563.3; 954.5; 1182.6; 1078.5; 1533.8; 1617.9; 1770.0; 2017.9; 2323.2; 2552.2; 2700.4; 2991.5; 3008.3; 3224.5; 3371.7; 3684.8; 3712.6; 3831.0; 4227.2 | 24–522 |
| 9 | Cубъединица α’ β-конглицинина (CG-4) | 563.3; 872.4; 938.5; 1078.5; 1141.6; 1222.7; 1510.8; 1533.8; 1652.9; 1740.8; 2136.0; 2449.1; 2761.5; 2935.3; 3074.5; 3114.6; 3655.8; 3770.0; 3820.0; 4188.9; 4272.2 | 1–559 |
| Маркеры белков молока (BosTaurus) | |||
| 10 | Казеин каппа (CSN3) | 970.5; 1250.7; 1979.1; 4990.1 | 25–105 |
| 11 | Казеин CSN2 (CSN2) | 741.4; 779.5; 829.5; 1012.5; 1136.6; 2185.2; 2908.6; 5355.9 | 121–224 64–224 |
| Маркеры белков семян тыквы (Cucurbitapepo) | |||
| 12 | Субъединица β 11S глобулина (LOC111464525) *gi|112677 |
643.4; 687.4; 750.5; 903.4; 973.5; 1219.7; 1429.8; 1437.8; 1463.8; 1532.8; 2430.2; 2673.3; 2717.3; 3556.8 | 47–282 |
| 13 | Субъединица β 11S глобулина (LOC111464525) *gi|112677 |
817.4; 1001.5; | 306–465 |
| 1151.6; 1320.7; | 317–468 | ||
| 1392.7; 1425.7; | |||
| 1453.9; 1542.7; 1870.1; 1893.9; 1893.9; 2350.2; 2767.3; 2911.3; 3589.9 | 348–468 |
||
| 14 | Белок 2 подобный запасному белку хранения 11S глобулину (LOC101217162) *gi|449468676 |
610.4; 804.4; 838.4; 1126.5; 2469.0; 3204.5 | 291–412 |
| 15 | Субъединица β- подобная 11S глобулину 1 (LOC111464083) *gi|659093215 |
1162.6; 1320.7; 1376.7; 1528.7; 1713.0; 2383.2; 3112.7 | 257–475 |
| Консервированная мясная продукция | |||
| Маркеры соевых белков | |||
| 16 | Глицинин сои A3B4 (A3B4) | 853.4; 1255.6; 1397.8; 542.8; 2061.0 | 361–499 |
| 17 | Глицинин G1 (GY1) | 1148.5; 1424.9; 1449.6 | 401–435 |
| Маркеры белков подсолнечника (Helianthusannuus) | |||
| 18 | Запасной G3 белок 11S глобулина (LOC110881169) *XP_021985214.1 | 760.3; 945.9; 1639.9; 1770.9; 2106.1; 2759.4 | 308–475 |
Одиннадцать фракций белков тыквы/тыквенной муки было идентифицировано в образце национального продукта из стран СНГ. Они оказались разными фрагментами N- (47–282) и С-конца (306–468) cубъединицы β 11S глобулина (480 а.о), одна фракция – запасным белком 2 подобным 11S глобулину (11S globulin seed storage protein 2-like), фрагмент 291–412 из 465 и фрагмент 257–475 из 511 а.о. субъединицы β, подобной 11S глобулину. Геном тыквы еще недостаточно аннотирован в международных базах данных и представлен только в виде конкретных локусов, но соответствующие фрагменты-мишени аминокислотной последовательности уже представлены в базе данных NCBI Рrotein под соответствующими записями.
Консервированная мясная продукция. Сравнительный анализ белкового состава консервов типа “говядина/свинина тушеная” с контролируемой закладкой сырья и декларируемой добавкой белков немышечного происхождения также позволил выявить панель потенциальных биомаркеров этих добавок, но детекция таких фракций оказалась более затруднительной (рис. 2). Более жесткий режим стерилизации консервов приводит к образованию большого количества фрагментов мышечных белков, а термохимические модификации вызывают у многих белков формирование характерных треков одноименных белков [11], различающихся по pI за счет блокады или исчезновения части, как правило, щелочных заряженных групп, что вносит свой вклад в протеомный профиль этого вида продукции. На этом фоне затруднительно детектировать чужеродные фракции. Но, тем не менее, фрагменты соевых глицининов были идентифицированы. Эти фракции идентифицируются как смесь растительных и мышечных белков. Растительный компонент оказался фрагментами глицинина G1 (GY1) – 401–435 и глицинина (A3B4) – 361–499. Молекулярная масса выявленных фрагментов составляла 17–18 кДа, что должно соответствовать фрагментам длиной около 140 а.о. Продукт гена A3B4 соответствует этому параметру, а GY1 нет.
Рис. 2.
Двумерные электрофореграммы белков консервированной мясной продукции: а – эталонный образец, б – с декларируемыми добавками не мышечного происхождения. Нумерация фракций согласно табл. 1.

При масс-спектрометрии детектируются только триптические пептиды из короткого (наиболее термохимически устойчивого) сегмента, а остальные, очевидно меняют массу вследствие термохимических модификаций и не опознаются поисковой программой.
И в консервах тушеной говядины производства стран ЕС (Франция) было детектировано наличие фрагмента 308–475 запасного G3 белка 11S глобулина из подсолнечника. Наличие такой добавки возможно за счет добавки нерафинированного подсолнечного масла, но оно не указано в составе продукта, и, следовательно, также является нарушением регламента. Только эта часть белка является наиболее устойчивой к термохимическому воздействию и может выступать в роли маркера присутствия муки из семян подсолнечника.
Сводные результаты масс-спектрометрической идентификации сохранных немышечных добавок (фрагментов аминокислотных последовательностей и m/z триптических пептидов) представлены в табл. 1.
В целом, полученные результаты показали, что спектр биоиндикаторов контроля внесения незаявленных добавок в мясную продукцию достаточно ограничен. После термообработки достоверно детектируется только овотрансферрин/его фрагмент, два вида казеинов молока (с преобладанием продукта гена CSN3), четыре производных глицининов и конглицининов сои (равнозначно представленных), а для тыквы и подсолнечника три производных белков/фрагментов 11S глобулина.
Полученные результаты позволяют существенно сузить и детализировать круг маркеров таких добавок в мясную продукцию для улучшения способов контроля ее соответствия заявленному составу, а также для предотвращения введения потребителя в заблуждение.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 19-16-00108).
Список литературы
Ahsan N., Prasad Rao R.S., Gruppuso Ph.A., Ramratnam Bh., Salomon A.R. // J. Proteomics. 2016. V. 30. № 143. P. 15–23.
Wang Y., Li Z., Pei Y., Li Q., Sun Y., Yang J., Yang Y., Zhi Y., Deng R., Hou Y., Hu X. // Food Anal. Methods. 2017. V. 10. № 7. P. 2429–2435.
Ueberham E., Spiegel H., Havenith H., Rautenberger P., Lidzba N., Schillberg S., Lehmann J. // J. Agric. Food Chem. 2019. V. 67. № 31. P. 8660–8667.
Xi J., Shi Q. // Food Anal. Methods. 2016. V. 9. № 11. P. 2998–3005.
Jira W., Münch S. // Food Chemistry. 2019. V. 275. P. 214–223.
Смирнова Н.И., Зверева Е.А., Жердев А.В., Дзантиев Б.Б. // Прикл. биохимия и микробиология. 2020. Т. 56. № 4. С. 401–406.
Шишкин С.С., Ковалев Л.И., Ковалева М.А., Иванов А.В., Еремина Л.С., Садыхов Э.Г. // Прикл. биохимия и микробиология, 2014. № 5. С. 453–465.
Ковалев Л.И., Шишкин С.С., Ковалева М.А., Иванов А.В., Вострикова Н.Л., Чернуха И.М. // Все о мясе. 2013. № 3. С. 32–34.
Ковалев Л.И., Ковалева М.А., Ковалев П.Л., Серебрякова М.В., Мошковский С.А., Шишкин С.С. // Биохимия. 2006. Т. 71. № 4. С. 554–560.
Zvereva E.A., Kovalev L.I., Ivanov A.V., Kovaleva M.A., Zherdev A.V., Shishkin S.S., Lisitsyn A.B., Chernukha I.M., Dzantiev B.B. // Meat Science. 2015. V. 105. P. 46–52.
Чернуха И.М., Федулова Л.В., Котенкова Е.А., Шишкин С.С., Ковалев Л.И., Машенцева Н.Г., Клабукова Д.Л. // Биофармацевтический журн. 2016. Т. 8. № 6. С. 38–44.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


