Прикладная биохимия и микробиология, 2021, T. 57, № 3, стр. 228-234
Получение химозина белухи (Delphinapterus leucas) в метилотрофных дрожжах Komagataella phaffii и характеристика рекомбинантного фермента
С. Ю. Филькин 1, Н. В. Чертова 1, С. С. Зацепин 1, Э. Г. Садыхов 1, А. Н. Фёдоров 1, А. В. Липкин 1, *
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: lipus57@yahoo.com
Поступила в редакцию 30.10.2020
После доработки 17.12.2020
Принята к публикации 22.12.2020
Аннотация
Получен штамм-продуцент Komagataella phaffii рекомбинантного химозина белухи Delphinapterus leucas c продуктивностью 80 мг/л, изучены физико-химические свойства фермента для возможного применения в пищевой промышленности. Удельная активность рекомбинантного химозина белухи была значительно ниже по сравнению с химозином быка и составляла 55 IMCU/мг. Химозин белухи обладал высокой неспецифической протеолитической активностью, что ухудшалое его свойства, и делало невозможным его использование в пищевой промышленности. Можно предположить, что аминокислотные замены K221M и K294Q критически важны и приводят к ослаблению связывания мицелл казеина с рекомбинантным химозином белухи.
Химозин различных жвачных животных в настоящее время активно используется в пищевом производстве. Химозин быка является аспартатной эндопептидазой и одним из наиболее изученных и востребованных ферментов в современной биохимии, широко используемый в сыроварении [1]. Более 70% используемого химозина в мировой пищевой промышленности – это рекомбинантный химозин. С большинством известных ферментов ученые ведут постоянную работу по созданию суперпродуцентов и получению мутантов с улучшенными свойствами. Поиск более активных и стабильных форм химозина из других видов животных для нужд пищевой промышленности раннее привел к открытию и использованию новых форм рекомбинантного химозина [2, 3]. Прежде всего, это относится к изучению химозина верблюда, который обладал большей термостабильностью и специфичностью: наилучшим соотношением молокосвертывающей активности (МСА) к протеолитической (ПА), MCA/ПA. Стоит отметить, что химозин яка также обладает высокой стабильностью в более широком диапазоне pH. Список химозинов других видов, охарактеризованных ранее, включает: химозин овцы, буйвола, яка, одногорбого и двугорбого верблюдов, а также альпака и марала [2, 4–8]. Однако, химозин белухи ранее не был охарактеризован. На первый взгляд, эволюционная разница между жвачными животными и китообразными велика, но химозин белухи обладает высокой гомологией с химозином быка по первичной последовательности.
Белуха (Delphinapterus leucas) это морское млекопитающее семейства нарваловых, значительная часть популяции которого живет в арктических условиях. Молоко морских млекопитающих одно из наиболее жирных по составу, поэтому молодые детеныши набирают вес быстро [9]. Кроме того, первичная последовательность казеина белухи близка к казеину быка [10]. Экстремальные условия существования этого животного позволили предположить, что его химозины могут иметь изменения в структуре, связанные с адаптацией к арктическим условиям.
В качестве экспрессирующей системы для продукции химозина белухи были выбраны метилотрофные дрожжи Komagataella phaffii (Pichia pastoris). Экспрессирующая система K. phaffii широко используется для создания рекомбинантных белков в пищевой индустрии и показывает свою состоятельность при создании рекомбинантных штаммов-продуцентов химозина быка, буйвола, верблюда и яка, что подтверждает удобство использования данной платформы [6, 11–13]. Кроме того, использование штамма-продуцента K. phaffii позволяет проверить ранее разработанный метод выделения рекомбинантного фермента на химозине белухи D. leucas.
Цель работы – получение рекомбинантного химозина белухи Delphinapterus leucas, экспрессированного в метилотрофных дрожжах K. phaffii, и исследование его физико-химических свойств для возможного применения в пищевой индустрии.
МЕТОДИКА
Материалы. В работе использовали: ДНК-полимеразу (Pfu, “Stratagene Inc.”, США), эндонуклеазы рестрикции, T4 ДНК-лигазу (“New England Biolabs”, США), зеоцин (“Thermo Fisher Scientific”, США). Олигонуклеотиды синтезированы в “Евроген” (Россия). Наборы для выделения и экстракции ДНК “Qiagen GmbH” (Германия). Использовались сорбенты DEAE-сефароза и фенил-сефароза (“GE Healthcare”, Швеция).
Штаммы микроорганизмов и вектора. Штамм Komagataella phaffii GS115 his4[mut+] и вектор pPICzα получены от “Invitrogen” (США). Для клонирования использовали штамм E. coli Xl10 Gold endA1 glnV44 recA1 thi-1 gyrA96 relA1 lac Hte Δ(mcrA)183 Δ(mcrCB-hsdSMR-mrr)173 tetR F'[proAB lacIqZΔM15 Tn10(TetR Amy CmR)] (“Stratagene”, США). Компоненты сред производства “Acros Organics” (США).
Приготовление сред. Среды были приготовлены по протоколу [12]. Чашки Петри для селекции трансформантов заливали твердой средой YPD, содержащей (%): дрожжевой экстракт – 1, пептон – 2, глюкоза – 2, агар-агар – 2. Для селекции трансформантов использовали среду YPD с концентрацией зеоцина 100 и 200 мкг/мл. Среду ВMGY, имеющую следующий состав (%): дрожжевой экстракт – 1.0; пептон – 2.0; дрожжевых азотистых оснований без аминокислот – 1.34; глицерин – 1.0; биотин – 4 × 10–5; 100 мМ фосфат калия, pH 6.0; использовали для культивирования трансформантов. Для индукции экспрессии среду BMGY заменяли средой BMMY, содержащей (%): дрожжевой экстракт – 1.0; пептон – 2.0; дрожжевые азотистые основания без аминокислот – 1.34; глицерин – 1.0, метанол – 1.0, биотин – 4 × 10–5, 100 мМ фосфат калия, pH 6.0.
Синтез гена и конструкция вектора. Кодон-оптимизированный вариант гена прохимозина белухи D. leucas (A0A2Y9P896) для К. phaffii был синтезирован “Twist Bioscience” (США). Для конструирования экспрессирующего вектора ген прохимозина ChymBe был рестрицирован по сайтам XhoI/NotI и лигирован в вектор pPICZαA по сайтам XhoI/NotI.
Трансформация K. phaffii и селекция трансформантов. Трансформацию метилотрофных дрожжей К. phaffii осуществляли методом электропорации. Электрокомпетентные клетки были приготовлены согласно протоколу: 10 мкг плазмиды pPICzα_ChymBe линеаризовали эндонуклазой рестрикции SacI и трансформировали в компетентные клетки GS-115 К. phaffii. Трансформированные клетки высевали на чашки Петри с твердой средой, содержащей 1.0% дрожжевого экстракта, 2% пептон, 2% глюкозы и 1 М сорбитол c концентрацией зеоцина 200 мкг/мл в соответствии с протоколом производителя.
Отобранные Mut+-трансформанты, устойчивые к зеоцину, анализировали на наличие вставки гена ChymBe при помощи ПЦР с олигонуклеотидными праймерами AOX1F 5'-GACTGGTTCCAATTGACAAGC-3' и AOX1R 5'-GCAAATGGCATTCTGACATCC-3'.
Первичные культуры отобранных клонов выращивали в 50 мл пробирках в среде BMGY 12–16 ч при 30°C до достижения значения ОП600 3.0–4.0. Выросшие клетки осаждали центрифугированием 10 мин при 3000 g и температуре 25°C. Клетки разбавляли средой BMMY до достижения ОП600 1.0. Экспрессию индуцировали 1%-ным метанолом. Каждые 24 ч добавляли 1%-ный раствор метанола для поддержания его постоянной концентрации. Время культивирования составляло 84 ч. Культуральную жидкость осаждали [14] ТХУ и анализировали присутствие химозина в 10%-ном ПААГ с ДНС по методу Лэммли [15].
Продукция рекомбинантного химозина белухи в ферментере. Отобранный клон культивировали в 150 мл среды BMGY до достижения ОП600 10 при 30°C. Затем инокулят переносили в ферментер “Biostat B+” (“Sartorius”, Германия) с 0.5 л минеральной среды BSM, следующего состава (г/л): глицерин – 70, KH2PO4 – 9.4, минеральная подпитка PTM1 – 4.86 мл, (NH4)2SO4, – 15.7, MgSO4 – 4.6, CaCl2– 0.35, биотин – 4 мг. Для защиты от пенообразования использовали пеногаситель “Софексил” в концентрации 0.5 г/л (“Софэкс-Силикон”, Россия). Значение pH поддерживали на уровне 4.0 при помощи титрования 10%-ными растворами серной кислоты и гидроксида аммония. После достижения максимального уровня плотности клеток проводили индукцию метанолом. В первые 48 ч добавляли 1% метанола и 2% сорбитола, затем добавляли только 1% метанола. При индукции температуру среды снижали до 26°C, а pH поднимали до уровня 5.5. Потребление метанола оценивали по уровню кислорода в культуральной жидкости, время культивирования составляло 84 ч с момента индукции метанолом.
Выделение и очистка рекомбинантного химозина. Культуральную жидкость, содержащую химозин, отделяли от клеток центрифугированием 3000 g 10 мин при 25°С. Супернатант фильтровали через (0.45 мкм) фильтр (“Millipore”, США), инкубировали с DEAE-сефарозой, предварительно уравновешенной 50 мМ Na2HPO4, pH 5.5. Связавшийся белок элюировали тем же буфером, содержащим 0.3 М NaCl. Фракции, содержащие химозин, объединяли, добавляли хлорид натрия до 3.0 М концентрации. Объединенные фракции наносили на колонку, объемом 10 мл с фенил-сефарозой, предварительно уравновешенную 50 мМ Na2HPO4 с 3 M NaCl, pH 5.5. Элюцию проводили градиентом концентрации хлорида натрия (от 3.0 → 0.0 М). Фракции, содержащие химозин, собирали, количество белка (ОП280) измеряли в каждой фракции спектрофотометрическим методом. Чистоту полученного белка подтверждали электрофорезом в ПААГ с ДНС.
Определение активности химозина. Молокосвертывающую активность определяли согласно [11]. Сухое обезжиренное молоко восстанавливали в объеме 100 мл, добавляли 50 мМ CaCl2, инкубировали при 37°C 30 мин. К 1 мл молока при 37°C добавляли 25 мкл раствора химозина. Время образования сгустка определяли в соответствии с соответствующим временем свертывания контрольного образца химозина (600 IMCU/мл). Все измерения проводили независимо в трех повторах.
Протеолитическую активность определяли согласно [7] с незначительными изменениями. В качестве субстрата использовали раствор 1%-ного казеина быка (“Biotech”, США) в 50 мМ натрий-фосфатном буфере, pH 5.5. Образцы химозина разбавляли раствором субстрата в соотношении 1 : 4 и инкубировали при 35°C в течение 0, 30, 60, 90 и 180 мин. Реакцию останавливали добавлением ТХУ. Специфичность фермента определяли, как отношение молокосвертывающей активности к протеолитической, принимая отношение активностей химозина быка за 1.0.
Гомологичное моделирование структуры химозина и филогенетический анализ. Построение модели рекомбинантного химозина белухи осуществлялось при помощи программы “Modeller 9v12”. Кристаллографическая структура химозина быка 4AA8 [16] использовалась в качестве шаблона. Для филогенетического анализа использовали программу “Clystal Omega”.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ.
Селекция трансформантов K. phaffii. Ген прохимозина белухи был синтезирован “Twist Bioscience”, США. Аминокислотная последовательность гена взята из Uniprot (A0A2Y9P896). Плазмида pPICzα содержала ген прохимзина белухи ChymBe под контролем AOX1 промотора. Для секреции рекомбинантного прохимозина использовался альфа-фактор из Saccharomyces cerevisae [17].
Электрокомпетентные клетки GS115 использовались для трансформации, селекцию трансформантов проводили на твердой среде YPD при концентрации зеоцина 100 мкг/мл. Для дальнейшего скрининга было отобрано 30 трансформантов, которые выращивались в 50 мл среды BMGY в 250 мл колбах. После 84 ч индукции, культуральную жидкость проверяли на наличие химозина и молокосвертывающую активность. Прохимозин был предварительно активирован понижением pH, как описано в методике. Активность химозина белухи составляла 3 IMCU/мл при концентрации белка 50 мг/л, что значительно меньше, чем для химозина быка, экспрессированного при тех же условиях. Клон трансформанта с максимальной активностью и наиболее высокой концентрации белка использовался для продукции прохимозина белухи в реакторе. Идентичность прохимозина белухи была подтверждали методом MALDI-масс-спектрометрии.
Культивирование химозина белухи в ферментере. Экспрессию прохимозина белухи в ферментере осуществляли, как описано в [12]. Выращивание дрожжей проводили в 0.5 л минеральной среды в течении 22 ч, при этом ОП600 достигало значения 290. Экспрессию фермента индуцировали раствором 1%-ного метанола и 2%-ного сорбитола в течении 48 ч. На втором этапе индукции добавляли только 1%-ный раствор метанола, при этом концентрация белка достигала значения 80 мг/л при массе сухих клеток 120 г/л (рис. 1). Молокосвертывающая активность составляла 5 IMCU/мл, что значительно ниже соответствующих значений, достигнутых при выращивании продуцента химозина быка [12].
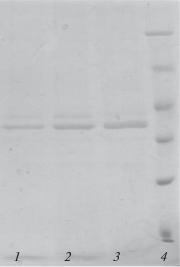
Рис. 1.
Электрофореграмма белков химозина белухи, образуемых в биореакторе в ходе ферментации pPICzα-ChymBe за 24 (1), 48 (2), 72 (3) ч от начала индукции метанолом, (4) маркеры молекулярной массы 116, 66.2, 45, 35, 25, 18.4, 10 кДа.
Выделение и очистка химозина белухи. Активацию, выделение и очистку химозина проводилась как описано в [12]. Выделение химозина осуществляли в несколько этапов: активация с понижением pH, нейтрализация, анионообменная хроматография, хроматография гидрофобных взаимодействий. Раствор активированного химозина разбавляли в соотношении 1 : 3 об./об. 50 мМ натрий-фосфатным буфером pH 5.5. При двухстадийной очистке химозина последовательно использовали хроматографию на DEAE-сефарозе и фенил-сефарозе. Результаты всех стадий очистки представлены в табл. 1.
Таблица 1.
Стадии выделения и очистки химозина
| Стадия очистки | Общее количество химозина, мг | Активность химозина, IMCU/мл | Специфическая активность, IMCU/мг | Выход химозина по белку, % | Чистота препарата по белку, % |
|---|---|---|---|---|---|
| Супернатант | 42.0 | 5.0 | 5.0 | 100 | 30 |
| Анион-обменная хроматография | 30.2 | 66 ± 10 | 37 | 71 | 60 |
| Хроматография гидрофобных взаимодействий | 25.2 | 230 ± 12 | 55 | 60 | 85–90 |
Ферментативные свойства химозина белухи. Очищенные рекомбинантные химозины из B. taurus и D. leucas обладали молокосвертывающей активностью – 220 и 55 IMCU/мг соответственно. Специфическая молокосвертывающая активность рекомбинантного химозина белухи была значительно ниже, при этом протеолитическая активность химозина белухи была выше по сравнению с соответствующей активностью химозина быка. Соотношение молокосвертывающей активности к протеолитической MCA/PA для химозина быка 1.0, при этом расчетное значение для белухи было ниже 0.2. Сравнение результатов с полученными ранее для других видов, показало, что такие химозины как химозин верблюда [16] и альпака [7] являются более специфичными по отношению к субстрату.
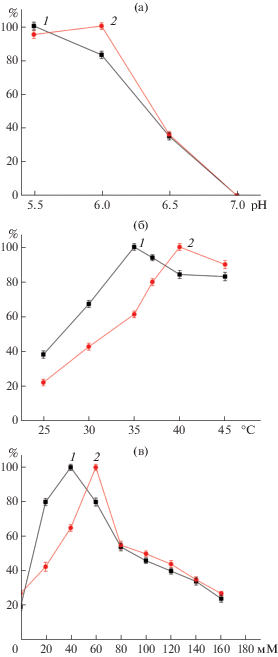
pH-оптимум химозина белухи был определен как 6.0 (рис. 2a), что немного выше оптимального значения для химозина быка (5.5–5.8). Значение температурного оптимума для рекомбинантного химозина белухи 35°C не отличалось от химозина быка (рис. 2б). Активность химозина белухи была максимальной при более низкой концентрации кальция по сравнению с химозином быка (рис. 2в), что может быть связано с морской средой обитания белухи.
Рис. 2.
Влияние pH (а), температуры (б) и хлорида кальция (в) на относительную молоко-свертывающую активность: 1 – химозин быка rChym Bos taurus, 2 – rChymBe химозин белухи D. leucas.
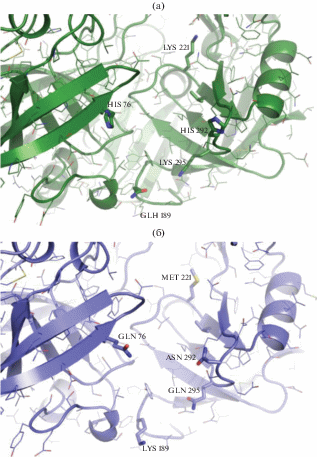
Сравнение аминокислотных последовательностей химозина быка и белухи выявило несколько замен (рис. 3, 4). Как было ранее показано в статье [16] аминокислотные замены K221M и K294Q являются критически важными для проявления активности и, возможно, вели к ухудшению связывания казеиновых мицелл с химозином (рис. 5). В дополнение к этому, рекомбинантный химозин белухи обладал более высокой неспецифической активностью, что ограничивало возможность его использования в пищевой промышленности. Вероятно, снижение специфической активности к казеиновым мицеллам связано с уменьшением общего поверхностного заряда рекомбинантного химозина белухи (+13) по сравнению с поверхностным зарядом химозина быка (+15) [16], а также положительно заряженным химозином верблюда (общий заряд +22). Другое возможное объяснение низкой активности рекомбинантного химозина белухи связано с субстратной специфичностью, так как в аминокислотных последовательностях казеинов белухи и быка имеются одиночные отличия, такие как L103P и M106L [10].
Рис. 3.
Филогенетическое дерево химозинов различных видов: CHYM_CAMELD Camelus dromedarius, CHYM_DELPH Delphinapterus leucas, CHYM_SHEEP Ovis aries, CHYM_GOAT Capra aegagrus, CHYM_BOVINE Bos taurus, CHYM_YAK Bos grunniens, CHYM_BUFFL Bubalus bubalis. Масштаб соответствует с филогенетической дистанцией.

Рис. 4.
Выравнивание белковых последовательностей химозинов различных видов: CHYM_CAMELD Camelus dromedarius, CHYM_DELPH Delphinapterus leucas, CHYM_SHEEP Ovis aries. Жирным шрифтом выделены значимые аминокислотные замены в химозине белухи, по сравнению с химозинами быка, овцы, верблюда.

Рис. 5.
Модель трехмерные структуры сайтов связывания химозина быка (а), 4AA8 [16] и белухи (б). Указаны позиции значимых аминокислотных замен в сайте связывания казеина.
В результате работы был получен штамм-продуцент с продуктивностью 80 мг/л. Однако специфическая активность рекомбинантного химозина белухи оказалась значительно ниже химозина быка и составила 55 IMCU/мг. Возможными причинами снижения удельной активности химозина белухи по сравнению с химозином быка являются аминокислотные замены K221M и K294Q, снижающие связывание отрицательно заряженной казеиновой мицеллы с химозином. При этом протеолитическая активность химозина белухи выше, что делает его непригодным для использования в пищевой промышленности.
При проведении исследований использовали оборудование Центра коллективного пользования “Промышленные биотехнологии” Федерального исследовательского центра “Фундаментальные основы биотехнологии” Российской академии наук.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации в рамках выполнения работ по соглашению от 26.11.2018 г. № 14.607.21.0207 (УИН RFMEFI60718X0207), ФЦП “Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014–2020 годы”.
Список литературы
Kumar A., Grover S., Sharma J., Batish V.K. // Crit. Rev. Biotechnol. 2010. V. 30. № 4. P. 243–258.
Kappeler, S.R., van den Brink, H.(J.) M., Rahbek-Nielsen, H., Farah, Z., Puhan, Z., Hansen, E.B., Johansen, E. // Biochem. Biophys. Res. Commun. 2006. V. 2. № 342. P. 647–654.
Беленькая С.В., Балабова Д.В., Белов А.Н., Коваль А.Д., Щербаков Д.Н., Ельчанинов В.В. // Прикл. биохимия и микробиология. 2020. Т. 56. № 4. С. 315–326.
Vallejo, J.A., Ageitos, J.M., Poza, M., Villa, T.G. // J. Dairy Sci. 2012. V. 95. № 2. P. 609–613.
Ersöz F., İnan M. // Protein Expr. Purif. 2019. V. 154. P. 126–133.
Vallejo J.A., Ageitos J.M., Poza M., Villa T.G. // J. Agric. Food Chem. 2008. V. 56. № 22. P. 10606–10610.
Беленькая С.В., Щербаков Д.Н., Балабова Д.В., Кригер А.В., Белов А.Н., Коваль А.Д., Ельчанинов В.В. // Прикл. биохимия и микробиология. 2018. Т. 54. № 6. С. 585–593.
Belen’kaya S.V., Bondar A.A., Kurgina T.A., Elchaninov V.V., Bakulina A. Yu., Rukhlova E.A., Lavrik O.I., Ilyichev A.A., Shcherbakov D.N. // Biochemistry (Moscow). 2020. V. 85. № 7. P. 916–928.
Oftedal O.T. //Encyclopedia of Dairy Sciences. /Ed. J. Fuquay, P.F. Fox and P. McSweeney, San Diego, CA.: Academic Press, 2011. V. 3. P. 563–580.
Manguy J., Shields D.C. // R. Soc. Open Sci. 2019. V. 6. № 10. P 1–17.
Noseda D.G., Recupero M., Blasco M., Bozzo J., Galvagno. M.A. // Protein Expr. Purif. 2016. V. 123. P. 112–121.
Филькин С.Ю., Чертова Н.В. Вавилова Е.А., Зацепин С.С., Эльдаров М.А., Садыхов Э.Г., Фёдоров А.Н., Липкин А.В. // Прикл. биохимия и микробиология. 2020. Т. 56. №. 6. С. 571–576.
Wang N., Wang K.Y., Li G., Guo W., Liu D. // Protein Expr. Purif. 2015. V. 111. P. 75–81.
Sagar A.J., Pandit M.W. // Biochim. Biophys. Acta. 1983. V. 743. № 3. P. 303–309.
Laemmli U.K. // Nature. 1970. V. 227. № 5259. P. 680–685.
Langholm Jensen J., Mølgaard A., Navarro Poulsen J.C., Harboe M.K., Simonsen J.B., Lorentzen A.M., Hjernø K., van den Brink J.M., Qvist K.B., Larsen S. // Acta Crystallogr. D Biol. Crystallogr. 2013. V. 69. № 5. P. 901–913.
Higgins D.R., Busser K., Comiskey J., Whittier P.S., Purcell T.J., Hoeffler J.P. // Methods Mol. Biol. 1998. V.103. P. 41–53.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


