Прикладная биохимия и микробиология, 2021, T. 57, № 2, стр. 187-195
Перспективы использования Gluconacetobacter sucrofermentas ВКПМ B-11267 в биотопливных элементах
С. Е. Тарасов 1, Ю. В. Плеханова 1, А. Г. Быков 1, А. С. Казаков 2, М. В. Вишневская 3, Ю. М. Парунова 3, П. М. Готовцев 3, А. Н. Решетилов 1, *
1 Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина,
Пущинский научный центр биологических исследований РАН
142290 Пущино, Московская обл., Россия
2 Институт биологического приборостроения РАН – обособленное подразделение “ФИЦ ПНЦБИ РАН”
142290 Пущино, Московская обл., Россия
3 Национальный исследовательский центр “Курчатовский институт”
123182 Москва, Россия
* E-mail: anatol@ibpm.pushchino.ru
Поступила в редакцию 24.09.2020
После доработки 30.10.2020
Принята к публикации 02.11.2020
Аннотация
Изучали биоэлектрохимические и спектральные свойства иммобилизованных бактерий Gluconobacter sucrofermentas ВКПМ B-11267 в присутствии и отсутствии многостенных углеродных нанотрубок (МУНТ). Полученные характеристики сравнивали с характеристиками филогенетически близких к ним и широко применяемых в биоэлектрохимии бактерий Gluconobacter oxydans. Показано, что модификация биоэлектрода углеродными нанотрубками приводила к значительному росту уровня тока (в 2.5–3 раза), а также к снижению общего сопротивления как в отсутствие субстратов, так и в их присутствии. Рассмотрена возможность использования иммобилизованных бактерий G. sucrofermentas в составе биотопливного элемента (БТЭ). Развиваемая удельная электрическая мощность БТЭ на основе иммобилизованных бактерий G. sucrofermentas оказалась ниже, чем у БТЭ на основе клеток G. oxydans. Тем не менее, полученные результаты свидетельствуют о том, что клетки G. sucrofermentas ВКПМ B-11267 могут служить основой для микробных топливных элементов.
Род бактерий Gluconacetobacter, относящийся к семейству Acetobacteraceae, имеет ряд ценных биотехнологических качеств. Одно из них, привлекающее внимание исследователей, состоит в том, что клетки осуществляют синтез бактериальной целлюлозы (БЦ) [1]. Известно, что один из штаммов рода Gluconacetobacter, G. sucrofermentas ВКПМ B-11267, является эффективным продуцентом бактериальной целлюлозы [2, 3]. БЦ широко применяется для решения различных научных и практических задач [4], в частности для создания анодов топливных элементов [5, 6]. Для повышения проводимости БЦ ее часто модифицируют, например, углеродными нанотрубками [7], палладием [8], платиной [9], наночастицами цинка [10] и др. При этом важно отметить, что не удалось найти публикаций, связанных с исследованием электрохимических свойств бактериальных клеток G. sucrofermentas ВКПМ B-11267, а также их сравнения со свойствами других штаммов. Оценка электрогенности данных бактерий и изучение их электрохимических характеристик позволит получить новые сведения об их биотехнологической ценности и расширит области их возможного использования, например в качестве основы биотопливных элементов.
Необходимо отметить, что один из представителей семейства Acetobacteraceae – Gluconobacter oxydans – широко используется в биосенсорных устройствах и в составе анодов топливных элементов [11–14]. Для бактерий G. sucrofermentas характерно полное окисление углеродсодержащих субстратов до углекислого газа и воды. Отличительной чертой широко применяемого для создания биотопливных элементов штамма Gluconobacter oxydans является неспособность к полному окислению субстратов в связи с отсутствием замкнутого цикла трикарбоновых кислот (ЦТК) [15]. Сравнение электрохимических свойств этих двух микроорганизмов позволит выяснить, каким образом метаболические особенности клеток могут сказываться на их биоэлектрохимических свойствах. Ранее было показано, что бактерии G. sucrofermentas могут быть использованы в качестве рецепторного элемента биосенсоров первого поколения на основе кислородного электрода [16]. Кроме того, был показан стимулирующий эффект углеродных нанотрубок, проявляющийся в росте тока и снижении общего сопротивления биоэлектрода на основе этого штамма [17]. Были использованы МУНТ, так как они менее токсичны для бактериальных клеток, чем одностенные углеродные нанотрубки [18].
Цель работы − детальное исследование базовых биоэлектрохимических и спектральных характеристик штамма Gluconacetobacter sucrofermentas ВКПМ B-11267, направленное на оценку перспективы его использования в биотопливных элементах, а также сравнение их с аналогичными данными, известными для Gluconobacter oxydans.
МЕТОДИКА
Реагенты. В работе использовали следующие реактивы: калий фосфорнокислый двузамещенный 3-водный, D-глюкоза, изопропиловый спирт 99.5% (“Panreac”, Испания); натрия гидроокись, натрий хлористый, дрожжевой экстракт, агар-агар бактериологический, D-сорбит, пептон, глутаминовая кислота (“Диа-М”, Россия); метиловый спирт, этиловый спирт ректификат 96% (“ОкаБиолаб”, Россия); уксусная кислота, лимонная кислота (“Мосреактив”, Россия); соляная кислота и гидрофосфат натрия (“Реахим”, Россия); натриевая соль 2,6-дихлорфенолиндофенола, гексацианоферрат калия(III), хитозан низкомолекулярный, трис(гидроксиметил)аминометан, L-арабиноза, L‑ксилоза, D-фруктоза, сукцинат натрия (“Sigma”, США); D-лактоза (“Applichem GmbH”, Германия), лактат натрия (“BioChemica”, Финляндия). В качестве рабочих использовали спектральные графитовые электроды (СГЭ, С-3М, “Полипроф-Л”, Россия) и 3 – контактные электроды, полученные методом матричной печати (ЭМП, “КолорЭлектроникс”, Россия). В качестве модифицирующего материала использовали многостенные углеродные нанотрубки “Таунит-М” (МУНТ, “НаноТехЦентр”, Россия).
Получение биоэлектродов. В работе использовали штамм Gluconobacter oxydans sbsp. industrius ВКМ B-1280 (Всероссийская коллекция микроорганизмов). Выращивание проводили по методике, описанной в работе [19].
Культивирование бактериальных клеток G. sucrofermentas ВКПМ B-11267 (штамм предоставлен сотрудниками кафедры биотехнологии, биоинженерии и биохимии Мордовского национального исследовательского университета им. Н.А. Огарева, Россия) описано в работе [16]. На рабочий графитовый электрод наносили смесь суспензии клеток (1 мг/мкл) с 2%-ным раствором хитозана, растворенном в 1%-ной уксусной кислоте [13, 20]. Объемное соотношение в смеси “клетки-хитозан” составляло 1 : 1. Затем электрод подсушивали в течение 1 ч при комнатной температуре. Концентрация клеток на поверхности электрода составляла 360 мкг/мм2. В случае модификации электрода нанотрубками вместо хитозана использовали суспензию МУНТ в хитозане (10 мг/мл). Суспензию МУНТ в хитозане обрабатывали ультразвуком с частотой 22 кГц при помощи генератора УЗГ13-0,1/22 (“УЗТ”, Россия) мощностью 100 Вт в течении 30 с. Затем смесь перемешивали в течение суток с помощью магнитной мешалки. Концентрация МУНТ на поверхности электрода составляла 3.6 мкг/мм2.
Измерения электрохимических параметров иммобилизованных бактерий по двухэлектродной схеме. В качестве измерительных электродов (анодов и катодов) использовали СГЭ площадью 75.3 мм2. Для получения мощностных характеристик создавали макет двухкамерного биотопливного элемента. Объемы анодного и катодного отделения составляли 5 мл и были разделены протонселективной мембраной МФ-4СК (“Пластполимер”, Санкт-Петербург, Россия) площадью 1.2 см2. В качестве фонового электролита использовали 25 мМ калий-фосфатный буферный раствор, рН 6.5, содержащий 10 мМ хлорида натрия, а в качестве медиаторов использовали 2,6-дихлорофенолиндофенол (ДХФИФ, 0.14 мМ) в анодном отделении и гексацианоферрат(III) калия (ГЦФ, 5 мМ) в катодном. Регистрацию циклических вольтамперных характеристик (ЦВА) проводили при скорости развертки 3 мВ/с. Измерения выполняли при постоянном перемешивании растворов при комнатной температуре.
Мощностные характеристики биотопливного элемента рассчитывали по формуле, приведенной в работе [16], и нормировали на площадь поверхности электродов.
Измерения электрохимических параметров иммобилизованных бактерий по трехэлектродной схеме. В качестве измерительных электродов использовали ЭМП. Измерения проводили в 25 мМ калий-фосфатном буферном растворе (рН 6.5), содержащем 10 мМ хлорида натрия. В качестве редокс-медиатора использовали ДХФИФ в концентрации 0.14 мМ. Импедансные измерения проводили при приложенном потенциале 200 мВ в диапазоне частот от 40 кГц до 0.02 Гц при амплитуде модуляции напряжения в 10 мВ.
Измерения вольтамперных и импедансных характеристик выполняли на гальванопотенциостате VersaSTAT 4 (“Ametek Inc.”, США).
Результирующие вольтамперные и импедансные характеристики представляли собой усредненные значения 5 одиночных измерений.
Оценка субстратной специфичности клеток. Оценку проводили по трехэлектродной схеме измерения с использованием ЭМП. Оценивали сигнал электродов на введение в измерительную ячейку субстратов в концентрации 1.0 мМ. Уровень сигнала электрода на введение 1.0 мМ глюкозы принимали за 100%, сигналы на остальные субстраты выражали в процентах относительно уровня сигнала на глюкозу [21].
Измерение размеров частиц. Измерение выполняли на спектрометре динамического светорассеяния используя Zetasizer Nano ZS (“Malvern Instruments Ltd.”, Великобритания). Обратно-рассеянный свет от 4 мВт гелий/неонового лазера собирали под углом 173°. Клетки и МУНТ находились в буферном растворе, рН 7.3, содержащем 20 мМ Трис-НCl и 100 мМ NaCl. Измерения проводили при температуре 25°C. Время накопления одиночной автокорреляционной функции составляло 15 с. Результирующая автокорреляционная функция представляла собой усреднение 40 одиночных измерений.
Спектроскопия нарушенного полного внутреннего отражения (НПВО) в инфракрасной области с преобразованием Фурье. НПВО-спектры клеток, хитозана и нанотрубок в инфракрасной области измеряли с помощью ИК-Фурье спектрометра Nicolet 6700, оснащенного приставкой Smart Orbit для измерения НПВО-спектров (“Thermo Scientific”, США). Регистрацию проводили в режиме НПВО на бриллиантовом НПВО-кристалле с длинной оптического пути 1 мкм, используя Hg1 – xCdxTe-детектор (охлаждение жидким азотом). Сканирование выполняли в диапазоне волновых чисел от 650 до 4000 см–1 с разрешением 2 см–1 и усреднением по 256 спектрам.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Эффективные размеры частиц в суспензии бактерий и кластеров МУНТ. В процессе культивирования микроорганизмы проходят через ряд стадий (лаг-фаза, экспоненциальная и стационарная фазы и затем фаза отмирания). При глубинном культивировании клетки G. sucrofermentas синтезируют БЦ в виде сфер с различным диаметром, либо в виде волокон, причем инициирование процесса биосинтеза БЦ начинается в первые же сутки культивирования в экспоненциальную фазу роста. На рис. 1 показано изменение размеров частиц в суспензии в зависимости от времени культивирования клеток. Образование БЦ в среде оценивали с помощью измерения гидродинамического радиуса (Rh) частиц в суспензии бактериальных клеток на разных стадиях роста. Было показано, что после первых суток инкубации общий размер частиц увеличивался приблизительно на 25% (с 0.80 ± 0.08 до 1.01 ± 0.08 мкм), на вторые сутки инкубации их размер постепенно начинал возвращаться к исходному. Можно предположить, что увеличение размера частиц обусловлено формированием на поверхности бактерий БЦ, которая в дальнейшем постепенно отделяется от клеток бактерий. При этом необходимо отметить, что дальнейшие измерения показали, что колебания гидродинамического радиуса бактериальных клеток не оказывало существенного влияния на электрохимические характеристики модифицированного ими электрода.
Рис. 1.
Распределение размеров (нм) частиц (а) в суспензии клеток G. sucrofermentas и средний размер частиц (б) в зависимости от времени инкубации (сут): 1 – исходные клетки, 2 – 1 сут инкубации, 3 – 2 сут инкубации, 4 – 3 сут инкубации.

Для понимания возможности сорбции бактериальных клеток на поверхности углеродных нанотрубок при модификации ими рабочих электродов, оценили размеры кластеров МУНТ. Так, если размеры кластеров МУНТ будут превышать размеры отдельных клеток, то их количество, сорбированное на кластер, не будет в высокой степени ограничиваться размером последнего. Если величины кластеров или одиночных волокон будут малы по сравнению с размерами клеток, то возможно ограничение количества ключевых контактов “бактериальная клетка - МУНТ”.
Обработка суспензии МУНТ ультразвуковым излучением должна приводить к равномерному распределению частиц наноматериала в матрице хитозана. На рис. 2 представлено распределение Rh частиц МУНТ до и после их обработки ультразвуком. Средний размер кластера МУНТ в исходном состоянии составлял 0.80 ± 0.26 мкм, после обработки ультразвуком наблюдали изменение среднего размера и получение более однородной суспензии с размерами 0.68 ± 0.09 мкм.
Рис. 2.
Интенсивность светорассеяния (%) в зависимости от гидродинамического радиуса частиц МУНТ (нм) до (1) и после (2) обработки ультразвуком.

Таким образом, соотношение размеров бактериальных частиц и МУНТ находилось в пределах единицы, что не предполагало возникновение пространственных ограничений при их сорбции на поверхности электродов, модифицированных углеродными нанотрубками.
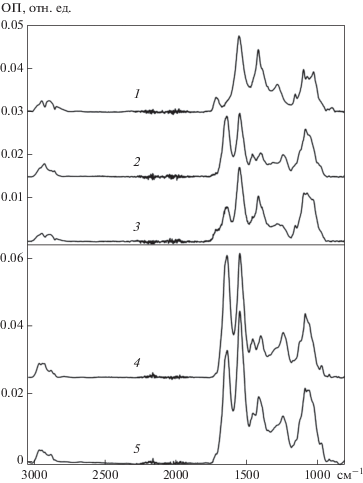
Сравнение спектральных характеристик суспензий бактерий G. sucrofermentas и G. oxydans. Два вида бактерий, рассматриваемых в работе, относятся к одному семейству Acetobacteraceae, поэтому они должны обладать схожими спектральными характеристиками. ИК-спектры для суспензий клеток двух типов и их смеси с хитозаном и МУНТ представлены на рис. 3. Видно что ИК-спектры суспензий клеток обладали характерными полосами поглощения для основных компонентов биологических объектов, таких как белки (1700–1500 см–1), сахара (1100 см–1), липиды (1000 и 1750 см–1) и нуклеиновые кислоты (1100 и 1240 см–1). Спектр смеси МУНТ и хитозана представлял собой суперпозицию отдельных спектров веществ с характерными полосами поглощения в диапазоне волновых чисел от 900 до 1750 см–1. Суммарный спектр смеси бактериальных клеток, МУНТ и хитозана также являлся суперпозицией отдельных спектров, что говорит об отсутствии химических реакций между хитозаном, МУНТ и бактериями. Таким образом, все компоненты не должны оказывать отрицательного воздействия на активность бактериальных клеток в составе биоэлектродов.
Рис. 3.
ИК-спектры смеси хитозана и нанотрубок (1), клеток G. oxydans (2), их смеси c МУНТ и хитозаном (3), клеток G. sucrofermentas (4), их смеси с МУНТ и хитозаном (5). Спектры смещены по оси ординат для наглядности.
Субстратная специфичность. Оценку субстратной специфичности биоэлектродов проводили с использованием нескольких типов субстратов – сахаров, низших спиртов, органических кислот и их солей (рис. 4). C помощью метода хроноамперометрии изучали изменение уровня тока электрода с иммобилизованными клетками при введении в измерительную кювету различных субстратов. Наиболее высокие сигналы для клеток G. sucrofermentas наблюдали в присутствии глюкозы, в то время как для клеток G. oxydans – в присутствии этанола. Для клеток G. oxydans это указывало на высокую активность алкогольдегидрогеназы, локализованной в клеточной мембране. Введение другого низкомолекулярного неразветвленного спирта – метанола – снижало уровень сигнала для G. sucrofermentas на 40%, а для G. oxydans – на 90%, как и при измерениях дыхательной активности клеток кислородным электродом типа Кларка [16]. В целом уровень сигналов электродов на основе клеток G. oxydans был выше для всех исследованных типов соединений. Это можно объяснить тем, что для клеток G. sucrofermentas характерно полное окисление субстратов до CO2 и H2O и, скорее всего, большая часть электронов, выделяемых в процессе окисления субстратов, участвует в цикле трикарбоновых кислот, не выделяясь в окружающее клетки пространство. G. oxydans содержит большое количество мембраносвязанных дегидрогеназ и соответствующие продукты неполного окисления широкого спектра углеводов и спиртов (альдегиды, кетоны и органические кислоты) практически полностью выделяются в среду [22], благодаря этому электронный перенос в данной системе обеспечивает более высокий сигнал электрода.
Рис. 4.
Субстратная специфичность клеток штаммов G. sucrofermentans B-11267 (I) и G. oxydans В-1280 (II), иммобилизованных на графитовых печатных электродах. Субстраты: 1 – этанол, 2 – метанол, 3 – изопропанол, 4 – глюкоза, 5 – арабиноза, 6 – ксилоза, 7 – фруктоза, 8 – манноза, 9 – лактоза, 10 – лактат натрия, 11 – глутаминовая кислота, 12 – сукцинат натрия. Представлены усредненные данные по 5 измерениям для каждого субстрата, ошибка измерения составляла 2–4.8%.

Импедансные спектральные зависимости. Наличие процессов электронного переноса в системе c бактериальными клетками G. sucrofermentas проверяли при помощи метода электрохимической импедансной спектроскопии (ЭИС), изучая значения внутреннего сопротивления биоэлектродов. Для этого были построены спектральные зависимости импеданса ЭМП с иммобилизованными клетками в присутствии и отсутствие субстрата (этилового спирта). Полученные результаты представлены в виде диаграмм Найквиста на рис. 5. Наблюдали значительное снижение общего сопротивления ЭМП для иммобилизованных бактерий в присутствии данного субстрата. Следует отметить, что аналогичное изменение сопротивления наблюдали в присутствии глюкозы (не приведено). Характер изменения сопротивления был аналогичен наблюдаемому для бактерий G. oxydans В-1280.
Рис. 5.
Диаграммы Найквиста для ЭМП с клетками G. sucrofermentas в присутствии и отсутствии субстрата. Ось X (Zre) − величина активного сопротивления, ось Y (Zim) – мнимого. 1 – без субстрата, 2 – 0.1 мМ этанола, 3 – 0.5 мМ этанола, 4 – 1.0 мМ этанола, 5 – 5.0 мМ этанола. Измерения проводились в присутствии 0.14 мМ 2,6-ДХФИФ. На вставке представлена использованная эквивалентная электрическая схема.

Таблица 1.
Сравнение параметров макетов БТЭ, представленных в работе, с аналогами
| Биоанод* | Стабиль-ность, сут | Генерируе-мый потенциал, мВ | Внутреннее сопротивле-ние БТЭ, кОм | Мощность | Ссылка | |
|---|---|---|---|---|---|---|
| G. oxydans/МУНТ/хитозан | 15 | 290 | 1.134 | 8 мкВт/см2 | Данная работа | |
| G. sucrofermentas/МУНТ/хитозан | 7 | 195 | 1.353 | 5 мкВт/см2 | Данная работа | |
| Суспензия G. oxydans ВКМ В-1227 | – | 250 | – | 2.3 мкВт | [23] | |
| Суспензия G. oxydans ВКМ В-1283 | – | 220 | – | 1.8 мкВт | [24] | |
| G. oxydans | Суспензия | 1 | 120 | 300 | 0.7 мкВт/см2 | [25] |
| Иммобили-зованные в ПВС клетки бактерии | 7 | 250 | 100 | 2 мкВт/см2 | [26] | |
| Смесь Acetobacter aceti и Gluconobacter roseus/никелевая пена/ПАНИ/карбид титана/хитозан | 6 | 258 | 0.046 | 18.82 мкВт/см3 | [27] | |
| Saccharomyces cerevisiae/медь/метиленовый синий/ | 2 | 820 | – | 4.48 × 10–3 мкВт/см3 | [28] | |
| Смесь Diaphorobacter и Paracoccus/графитовая ткань | 45 | 310 | – | 15.2 мкВт/см2 | [29] | |
Эквивалентная схема для электрода, содержащего иммобилизованные клетки G. sucrofermentas, представлена на вставке к рис. 5. Сопротивление электролита в ячейке отражается параметром R0, С – емкость двойного электрического слоя на поверхности электрода, R – сопротивление переноса заряда, W – элемент Варбурга. В присутствии этилового спирта происходило резкое снижение значения параметра R, что указывало на появление медиаторного электронного переноса от бактериальных клеток к электроду. Кроме того, появление на эквивалентной схеме элемента Варбурга (который проявляется на диаграммах Найквиста как прямая линия с наклоном в 45 градусов в области низких частот) в присутствии субстрата показывало, что система в данном случае лимитируется диффузионными ограничениями (скоростью доставки субстрата к реакционному центру фермента), а не кинетическими. Это можно связать с наличием вокруг клеток G. sucrofermentas слоя бактериальной целлюлозы, которая замедляла поступление субстрата к ферментным комплексам клеток и лимитировала медиаторный электронный перенос.
Вольтамперные зависимости и мощностные характеристики. Для оценки потенциала практического применения клеток G. sucrofermentas был исследован макет БТЭ на их основе. В качестве анода и катода БТЭ использовали СГЭ.
На рис. 6 представлены вольтамперные характеристики, которые характеризуют изменения токов в области отрицательных и положительных потенциалов анода, содержащего иммобилизованные бактерии G. sucrofermentas ВКПМ B-11267. Вольтамперные характеристики получены для контрольного состояния электрода, содержащего иммобилизованные в гель хитозана бактерии; для электрода, модифицированного МУНТ; для электрода, находящегося в среде, содержащей субстрат (этиловый спирт). Добавление в измерительную ячейку этилового спирта, выступающего в роли окисляемого компонента, приводит к росту токов в области положительных значений потенциала. Модификация анодов наноматериалом МУНТ вызывала дальнейший рост тока. Отметим, что аналогичные зависимости для данного субстрата наблюдали ранее для бактерий G. oxydans В-1280 [18], а также для биосенсоров на основе G. sucrofermentas [17]. Электрохимические характеристики БТЭ на основе клеток G. sucrofermentas сравнивали с аналогичными для БТЭ, содержащего клетки G. oxydans. Полученные поляризационные кривые и вычисленные на их основе мощностные характеристики БТЭ представлены на рис. 7.
Рис. 6.
Циклические вольтамперные характеристики для ЭМП с клетками G. sucrofermentas. 1 – ЭМП с клетками, 2 – ЭМП с клетками и субстратом, 3 – ЭМП с клетками и МУНТ, 4 – ЭМП с клетками, МУНТ и субстратом. На оси Х (мВ) обозначен приложенный потенциал, по оси Y (мкА) – уровень тока. Измерения проводились в присутствии 0.14 мМ 2,6‑ДХФИФ. В качестве субстрата использовался 1 мМ этанол.

Рис. 7.
Удельные мощностные характеристики (по оси Х – напряжение, мВ; по оси Y – удельная мощность БТЭ, мкВт/см2) макетов БТЭ с клетками G. sucrofermentas и G. oxydans: 1 – анод с G. sucrofermentas, 2 – анод с G. sucrofermentas и МУНТ, 3 – анод с G. oxydans, 4 – анод с G. oxydans и МУНТ. Измерения проводили в присутствии 1 мМ этанола. В катодном отделении в качестве медиатора использовали ГЦФ, в анодном – ДХФИФ. На вставке − поляризационные кривые макетов БТЭ (ось Х – напряжение, ось Y – плотность тока). Представлены усредненные данные по 3–5 измерениям для каждого макета БТЭ, ошибка измерения составляла 4–5%.

Следует отметить, что модификация анодов обоих типов БТЭ углеродными нанотрубками повышала значение тока при данном потенциале, что отражалось на поляризационных кривых и мощностных характеристиках. Можно предположить, что каталитическая активность ферментов у G. oxydans выше, чем у G. sucrofermentas, что приводило к соответствующим различиям в генерируемой мощности (5 мкВт/см2 для G. oxydans и 2 мкВт/см2 для G. sucrofermentas). Тем не менее модификация анодов БТЭ углеродными нанотрубками вызывала рост мощности в 2.7 раза в случае G. sucrofermentas, в то время как для G. oxydans – в 1.6. Различие в мощностных характеристиках может быть связано с расположением ферментных систем G. oxydans в мембранах клеток, что приводит к более быстрому медиаторному переносу электронов на электрод. Кроме того, наличие замкнутого ЦТК у G. sucrofermentas, по-видимому, приводило к переносу электронов преимущественно внутри клетки бактерии и только часть электронов могла переноситься на электрод. Внесение в систему углеродных нанотрубок, предположительно, приводило к увеличению доли электронов, поступающих на поверхность электрода в процессе окисления субстрата.
Сравнение характеристик макетов БТЭ на основе клеток G. sucrofermentas и G. oxydans с аналогами, представленными в литературе, показало, что значения параметров полученных макетов сравнимы с параметрами БТЭ на основе других микроорганизмов (табл. 1). При этом необходимо отметить, что штамм G. sucrofermentas впервые был использован в качестве основы микробного топливного элемента.
Таким образом, детальное исследование базовых биоэлектрохимических и спектральных характеристик штамма G. sucrofermentas ВКПМ B-11267 показало возможность его использования в микробных топливных элементах. Была проведена оценка эффективного размера частиц в суспензии бактериальных клеток, получены их спектральные характеристики в присутствии и отсутствии углеродных нанотрубок, а также представлен ряд электрохимических зависимостей, отражающих поведение клеток в составе биоэлектродов различного типа. Показано, что бактерии этого штамма электрохимически активны и способны окислять как сахара, так и низшие спирты. Сопряжение клеток с МУНТ позволило добиться улучшения электрохимических параметров клеток, проявляющееся в росте тока и снижении общего сопротивления биоэлектрода. При этом отметим, что БЦ, синтезируемая клетками в процессе роста, не блокирует процесс передачи заряда к электроду, однако еe наличие приводит к появлению в системе диффузионных ограничений. Получены биоэлектрохимические параметры для макетов БТЭ с иммобилизованными клетками G. sucrofermentas и проведено сравнение с аналогичными зависимостями для филогенетически близких микроорганизмов – G. oxydans. Обобщая результаты, можно отметить, что филогенетическая близость исследуемых микроорганизмов подтверждалась также сходством их биоэлектрохимических параметров.
Авторы выражают благодарность д. б. н., проф. Н.А. Кленовой (Самарский национальный исследовательский университет им. акад. С.П. Королева) за помощь в работе со штаммом G. sucrofermentas В-11267.
Исследования, связанные с оценкой спектральных характеристик бактериальных клеток выполнены при финансовой поддержке РФФИ и ДНТ в рамках научного проекта № 19-58-45011. Получение электрохимических характеристик макетов БТЭ выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-29-23024.
Список литературы
Costa A.F.S., Almeida F.C.G., Vinhas G.M., Sarubbo A.L. // Front. Microbiol. 2017. V. 8. https://doi.org/10.3389/fmicb.2017.02027
Пaтeнт PФ. 2013. № 2536973
Пaтeнт PФ. 2013. № 2523606
Mohite B.V., Patil S.V. // Biotechnol. Appl. Biochem. 2014. V. 61. № 2. P. 101–110.
Nirmale T.C., Kale B.B., Varma A.J. // Int. J. Biol. Macromol. 2017. V. 103. P. 1032–1043.
Mashkour M., Rahimnejad M., Mashkour M., Soavi F. // J. Power Sources. 2020. V. 478. https://doi.org/10.1016/j.jpowsour.2020.228822
Lv P., Feng Q., Wang Q., Li D., Zhou J., Wei Q. // Fibers Polym. 2016. V. 17. I. 11. P. 1858–1865.
Evans B.R., O’Neill H.M., Malyvanh V.P., Lee I., Woodward J. // Biosens. Bioelectron. 2003. V. 18. P. 917–923.
Yang J., Sun D., Li J., Yang X., Yu J., Hao Q., Liu W., Liu J., Zou Z., Gu J. // Electrochim. Acta. 2009. V. 54. P. 6300–6305.
Costa S.V., Gonçalves A.S., Zaguete M.A., Mazon T., Nogueira A.F. // Chem. Comm. 2013. V. 49. I. 73. P. 8096. https://doi.org/10.1039/c3cc43152e
Gupta A., Singh V.K., Qazi G.N., Kumar A. // J Mol Microbiol Biotechnol. 2001. V. 3. I. 3. P. 445–56.
Šefčovičová J., Filip J., Tkac J. // Chem. Pap. 2015. V. 69. P. 176–182
Plekhanova Y., Tarasov S., Kolesov V., Kuznetsova I., Signore M., Quaranta F., Reshetilov A. // Membranes. 2018. V. 8. № 4. P. 99. doi.org/https://doi.org/10.3390/membranes8040099
Plekhanova Y., Tarasov S., Bykov A., Prisyazhnaya N., Kolesov V., Sigaev V., Signore M.A., Reshetilov A. // Biosensors. 2019. V. 9. № 4. P. 137. doi.org/https://doi.org/10.3390/bios9040137
Macauley S., McNeil B., Harvey L.M. // Crit. Rev. Biotechnol. 2001. V. 21. № 1. P. 1–25.
Быков А.Г., Скрипачева О.В., Тарасов С.Е., Кленова Н.А., Решетилов А.Н. // Известия Тульского Государственного Университета. Естественные науки. 2020. № 1. С. 17–25.
Тарасов C.Е., Плеханова Ю.В., Быков А.Е., Кленова Н.А., Решетилов А.Н. // Российские нанотехнологии. 2020. Т. 15. № 1. С. 86–89.
Максимова Ю.Г. // Прикл. биохимия и микробиология. 2019. Т. 55. №. 1. С. 3–16.
Решетилов А.Н., Плеханова Ю.В., Тарасов С.Е., Арляпов В.А., Колесов В.В., Гуторов М.А., Готовцев П.М., Василов Р.Г. // Прикл. биохимия и микробиология. 2017. Т. 53. № 1. С. 1–8.
Wang X., Gu H., Yin F., Tu Y. // Biosens. Bioelectron. 2009. V. 24. № 5. P. 1527–1530.
Reshetilov A.N., Iliasov P.V., Fesay A.P., Ivashchenko G.V., Taranova L.A., Winther-Nielsen M., Emnéus J. // Appl. Biochem. Microbiol. 2005. V. 41. № 1. P. 56–62.
Sievers M., Swings J. The genus Gluconobacter. / Ed G.M. Garrity, D.J. Brenner, N.R. Krieg, J.T. Staley. N.Y.: Springer, 2005. P. 77–81.
Пaтeнт PФ. 2011. № 108217
Пaтeнт PФ. 2011. № 109758
Alferov S.V., Minaicheva P.R., Arlyapov V.A., Asulyan L.D., Alferov V.A., Ponamoreva O.N., Reshetilov A.N. // Appl. Biochem. Microbiol. 2014. V. 50. № 6. P. 637–643.
Алфёров С.В., Арляпов В.А., Алфёров В.А., Решетилов А.Н. // Прикл. биохимия и микробиология. 2018. Т. 54. № 6. С. 637–643.
Karthikeyan R., Krishnaraj N., Selvam A., Wong J.W.-C., Lee P.K.H., Leung M.K.H., Berchmans S. // Bioresour. Technol. 2016. V. 217. P. 113–120.
Permana D., Rosdianti D., Ishmayana S., Rachman S.D., Putra H.E., Rahayuningwulan D., Hariyadi H.R. // Procedia Chem. 2015. V. 17. P. 36–43.
Hou L., Yang Q., Li J. // Biotechnol. Bioprocess Eng. 2020. V. 25. I. 3. P. 470–476.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


