Прикладная биохимия и микробиология, 2021, T. 57, № 2, стр. 179-186
Изменения в составе жирных кислот липидов печени и головного мозга мышей при приеме нанолипидных комплексов
Н. П. Пальмина 1, *, Т. А. Мишарина 1, Н. И. Крикунова 1, А. С. Антипова 1, Е. И. Мартиросова 1, М. Г. Семёнова 1
1 Институт биохимической физики РАН
119334 Москва, Россия
* E-mail: npalm@mail.ru
Поступила в редакцию 02.09.2020
После доработки 02.10.2020
Принята к публикации 02.11.2020
Аннотация
Методом газовой хроматографии исследовали изменения в содержании жирных кислот (ЖК) в липидах печени и головного мозга 6 групп мышей в зависимости от состава липосомных нанокомплексов, введенных в напитки, заменяющие воду во время длительной (3 мес.) диеты. Компонентами 6 видов нанокомплексов, кроме фосфатидилхолина (ФХ), в разном сочетании служили: эфирное масло гвоздики (ЭМГ), рыбий жир (РЖ) и казеинат натрия (Каз-Na). Установлено, что, использование напитков с липосомальными нанокомплексами сложного состава, включающими в себя как эссенциальные полиненасыщенные жирные кислоты (ПНЖК), так и природный антиоксидант ЭМГ и пищевой белок (Каз-Na), модифицирует состав ЖК печени и головного мозга, увеличивает содержание декозагексаеновой кислоты и значительно уменьшает отношение суммы омега-6 к сумме омега-3 (Σ ϖ-6/Σ ϖ-3) ПНЖК. Такие изменения могут обеспечить повышение устойчивости организма к воспалительным процессам, снизить риск возникновения онкологических и нервно-психических заболеваний. Полученные результаты могут быть использованы при разработке современных систем доставки ПНЖК на основе ФХ-липосом.
Биологически активные липиды, такие как полиненасыщенные жирные кислоты (ПНЖК, омега-3 и омега-6) играют важную роль в поддержании многих физиологических функций в организме млекопитающих: они необходимы для нормального роста и развития; обеспечивают энергетические потребности; входят в состав фосфолипидов клеточных мембран; являются предшественниками синтеза эндогормонов и эйкозаноидов [1–6]. ПНЖК не синтезируются в организме человека и должны поступать с пищей в достаточном количестве и в наиболее полезном для здоровья (по данным доказательной медицины) соотношении (омега-6 : омега-3 ПНЖК = 1 : 1–2 : 1) [7, 8]. Чрезмерное употребление насыщенных жиров и критическое превышение омега-6 над омега-3 ПНЖК, достигающее 15 : 1–25 : 1 в высокоиндустриальных странах, являются одной из главных причин лишнего веса и сопутствующих алиментарно-зависимых заболеваний [7]. Таким образом, включение дополнительного количества ПНЖК в рацион питания в профилактических целях, наряду с общим снижением насыщенных жиров, является актуальным для большинства населения и может быть осуществлено с помощью функциональных продуктов питания. Серьeзная проблема, с которой сталкиваются исследователи, заключается в том, что высокое содержание в ПНЖК ненасыщенных углеродных связей связано с их высокой способностью к окислению и, как следствие, накоплению пероксидов и гидропероксидов, а также токсичных продуктов их разложения, таких как летучие карбонильные продукты, снижающие вкусовые качества продуктов. Кроме того, липофильная природа ПНЖК затрудняет их введение в продукты с низким содержанием жиров. Для преодоления этих ограничений предлагается вводить ПНЖК в нужном соотношении в виде липосом с добавками природных антиоксидантов и инкапсулированием в белки или биополимеры [9, 10]. В результате комплекса исследований, выполненных in vitro, были получены липосомы на основе фосфатидилхолина (ФХ) или лизофосфатидилхолина (ЛФХ), содержащие ПНЖК в соответствующем отношении, с растительными антиоксидантами (эфирное масло гвоздики (ЭМГ), кориандра, лимона; экстракты имбиря, черного перца, корицы, душистого перца), а также казеинат натрия (Каз-Na) и мальтодекстрины. Были изучены физико-химические свойства этих сложных липосом (размеры и форма, плотность, архитектура, заряд, микровязкость липидного бислоя; способность к окислению; термодинамические параметры) [11–15]. Определена биодоступность инкапсулированных липидов в процессе ферментативного гидролиза комплексов в условиях их модельного переваривания в желудочно-кишечном тракте (ротовая полость, желудок, тонкий кишечник) in vitro [16]. Были установлены основные взаимосвязи между структурными, а также термодинамическими параметрами супрамолекулярных комплексов и их функциональными свойствами [12, 16, 17]. Однако для того, чтобы предложить использование этих комплексов в качестве пищевых добавок необходимо проведение экспериментов in vivo, подтверждающих обогащение липидов органов и тканей живых организмов ПНЖК при потреблении этих продуктов.
Цель работы – установить, как введение разработанных комплексов влияет на состав жирных кислот в различных органах животных при их длительном потреблении.
МЕТОДИКА
Материалы. В работе использовали фосфатидилхолин (ФХ) (Lipoid GmbH, Германия) следующего химического состава по данным фирмы (%): фосфолипиды – фосфатидилхолин 94, фосфатидилэтаноламин 0.6, лизофосфатидилхолин 3; фосфатидилинозит 0.1; триглицериды 2; свободные жирные кислоты 0.5; α-токоферол 0.15. Содержание жирных кислот (ЖК) к общему их количеству составило (%): пальмитиновая 12–17, стеариновая 2–5; олеиновая 11–15; линолевая 59–70; линоленовая 3–7. Использовались также Каз-Na фирмы “Sigma” (Новая Зеландия); органические растворители фирмы “Merk” (Германия); ЭМГ(Plant Lipids Ltd., Индия); рыбий жир (РЖ, концентрат омега-3 “Омега-3 дети”, “Рускапс”, Россия). Содержание и состав ЖК рыбьего жира приведен в табл. 1.
Таблица 1.
Состав жирных кислот рыбьего жира в виде их метиловых эфиров (отн. %)
| Кислота | Формула | Содержание, % |
|---|---|---|
| Миристиновая | С13Н27COOH | 5.10 +\–0.26 |
| Пальмитиновая | С15Н31СООН OH | 12.42 +\–0.62 |
| Стеариновая | С17Н35СООН | 3.88 +\–0.19 |
| Ундеценовая | С10Н21COOH. | 7.30 +\–0.37 |
| Олеиновая | C17H33COOH | 8.14 +\–0.41 |
| Октадеценовая | CH3(CH2)7CH=CH(CH2)7COOH | 3.87 +\–0.19 |
| Эйкозеновая | C19H37COOH | 1.86 +\–0.09 |
| 13-Докозеновая | C21H41COOH | 1.32 +\–0.07 |
| Линолевая | С17Н35СООН . | 1.07 +\–0.05 |
| Октадекатриеновая | С17Н28COOH | 2.34 +\–0.12 |
| Арахидоновая | C19H31COOH | 1.67 +\–0.08 |
| Докозатетраеновая | C21H33COOH | 3.40 +\–0.17 |
| Эйкозопаентаеновая | C19H29COOH | 27.63 +\–1.38 |
| Докозагексаеновая | C21H31COOH | 20.00 +\–1.00 |
Приготовление растворов липосомальных нанокомплексов. В экспериментах были использованы водные растворы 6 видов липосомальных нанокомплексов в качестве напитков, заменяющих воду в диете экспериментальных животных.
Диета 1: липосомы из ФХ (концентрация в растворе –2.50 мг/мл);
диета 2: липосомы из ФХ (концентрация в растворе 2.50 мг/мл) с добавлением ЭМГ (2% от веса ФХ), весовое отношение компонентов липосомального нанокомплекса: ФХ : ЭМГ = 1 : 0.02;
диета 3: липосомы из ФХ (концентрация в растворе – 1.66 мг/мл), инкапсулированные Каз-Na (концентрацияей в растворе – 16.6 мг/мл), весовое отношение компонентов в липосомальном нанокомплексе: ФХ : Каз-Na – 1 : 10;
диета 4: липосомы из ФХ ([ФХ] = 2.50 мг/мл) с добавлением ЭМГ (2% от веса ФХ), инкапсулированные Каз-Na ([Каз–Na] = 25.0 мг/мл), весовое отношение компонентов в липосомальном нанокомплексе ФХ : ЭМГ : Каз–Na – 1 : 0.02 : 10;
диета 5: липосомы из ФХ ([ФХ] – 1.66 мг/мл) с добавлением рыбьего жира, [РЖ] = 1.66 мг/мл), инкапсулированные Каз-Na ([Каз–Na] в растворе – 33.3 мг/мл), весовое отношение компонентов в липосомальном нанокомплексе ФХ : РЖ : : Каз-Na = 1 : 1 : 20;
диета 6: липосомы из ФХ ([ФХ] = 1.66 мг/мл) с добавлением рыбьего жира [РЖ] = 1.66 мг/мл) и ЭМГ (2% от веса ФХ + РЖ), инкапсулированные Каз–Na ([Каз–Na]33.3 мг/мл). Весовое отношение компонентов в липосомальном нанокомплексе: ФХ : РЖ : ЭМГ : Каз-Na – 1 : 1 : 0. 02 : 20.
Приготовление липосом. Липосомы ФХ с добавлением ЭМГ и/или РЖ готовили по следующей методике. В стерилизованную при 110°С (30 мин) стеклянную емкость вносили необходимые навески ФХ, ЭМГ, РЖ, добавляли расчетное количество бидистиллированной воды. Смесь диспергировали в воде при помощи трeхкратной механической гомогенизации, используя гомогенизатор (Heidolph, Германия), в течение 2 мин при 20 000 об./мин. Полученную водную дисперсию ФХ/ЭМГ/РЖ дополнительно обрабатывали ультразвуком для получения наноразмерных липосомных комплексов, используя при этом ультразвуковой гомогенизатор VCX-130 (“Sonics & Materials”, США) в предварительно подобранном режиме: озвучивание в течение 5 мин при 40% мощности сигнала (отношение времени озвучивания к времени без озвучивания 30 : 30 с). При обработке образец охлаждали во льду. Для получения наноразмерных липосомных комплексов такой режим обработки ультразвуком повторяли 7 раз. После этого полученные водные растворы липосомных комплексов ФХ/ЭМГ/РЖ центрифугировали в стерильных центрифужных пробирках в течение 30 мин при 1800 g для удаления металлической стружки от ультразвукового зонда. Инкапсулирование белком Каз-Na приготовленных липосом (ФХ/ЭМГ/РЖ) проводили смешиванием их растворов в стерильных (110°С, 30 мин) бутылочках для кормления с последующим их встряхиванием (165 об./мин) в шейкере-инкубаторе GFL 3032 (GFL, Германия) при 40°С в течение 1 ч. После этого повышали температуру в шейкер-инкубаторе до 63°С и пастеризовали все приготовленные растворы в течение 30 мин при продолжающемся встряхивании (165 об./мин).
Все растворы липосомных нанокомплексов готовили на 2 сут из расчета их потребления одной мышью в объеме 7 мл ежедневно.
Животные и дизайн эксперимента. 50 мышей линии F1(C57blxDBA2\6) весом (18–20) г из вивария питомника “Столбовая” (филиал Столбовая ФГУ НЦ биомедицинских технологий Федерального медико-биологического агентства, Московская область, Чеховский район, Россия) были разделены на 8 групп по 6–7 мышей в каждой группе. Мыши содержались на диете в течение 92 сут. Первая группа животных (7 шт.) получала общевиварный рацион, печень и головной мозг были взяты в первый день эксперимента; 2 группа (6 шт.) получала диету 1; 3 группа (6шт.) – диету 2; 4 группа (6 шт.) – диету 3, 5 группа (6 шт.) – диету 4; 6 группа (6 шт.) – диету 5; 7 группа (6 шт.) – диету 6; 8 группа (7 шт.) содержалась на общевиварном рационе все 92 сут эксперимента. Через 92 сут после начала приема различных диет животные были подвергнуты декапитации, а ткани печени и головного мозга были взяты для исследования состава их ЖК.
Выделение липидов из печени и мозга. Экстракцию липидов из тканей печени и головного мозга проводили по методу Фолча в модификации Кейтса [19]. Хлороформенные экстракты липидов хранили при температуре –18°С под аргоном. Перед определением состава ЖК хлороформ удаляли в вакууме и получали чистые липиды, которые далее использовали для анализа.
Определение состава жирных кислот. Определение жирнокислотного состава клеток печени и мозга проводили методом газожидкостной хроматографии [19]. Из выделенных липидов получали метиловые эфиры жирных кислот путем метанолиза. К липидам (около 100 мг), помещенным в стеклянные пробирки с герметично завинчивающейся пробкой, добавляли по 5 мл метанола, оставляли в холодильнике на 1 ч, затем при охлаждении и интенсивном перемешивании добавляли 200 мкл ацетилхлорида и кипятили на водяной бане 1 ч. К образцу добавляли 5 мл 6%-ного водного раствора K2СО3, встряхивали, добавляли 2 мл гексана и экстрагировали метиловые эфиры жирных кислот (МЭЖК) встряхиванием в течение 5 мин, затем центрифугировали при 750 g 5 мин. Гексановую фазу, содержащую МЭЖК, анализировали на хроматографе “Кристалл 2000 М” (Кристалл, Россия) с пламенно-ионизационным детектором и кварцевой капиллярной колонкой DB-1 (50 м × 0.32 мм, слой фазы 0.25 мкм (Supelco, США). Анализ проводили при программировании температуры колонки от 120 до 270°С со скоростью 4°С/мин при температуре инжектора и детектора 270°С. Количественное содержание МЭЖК в образцах рассчитывали по отношению площади пика соответствующей кислоты к сумме площадей выбранных пиков (%).
Математическая обработка результатов. Математическую обработку проводили с помощью программ Microsoft Excel 2007 и Origin Pro 8. Стандартное отклонение средних величин из 3 измерений не превышало 5% (относительных). Достоверность различий между группами оценивали по критерию Манна-Уитни.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Основная задача работы состояла в изучении изменения состава жирных кислот липидов печени и головного мозга мышей после приёма ими в течение 3 мес. различных липосомальных нанокомплексов, содержащих ПНЖК, в виде напитков. Основным источником ПНЖК служил РЖ, для доставки которого использовали липосомы из ФХ, защищенные от окисления ЭМГ, антиокислительные свойства которого обусловлены наличием полифенола эвгенола и были хорошо изучены ранее [13, 14]. Растворимость в водной среде обеспечивали инкапсулированием липосом Каз-Na. Ранее было установлено, что ЭМГ в сочетании с Каз–Na способен защищать ПНЖК в составе липосом от окисления даже при температуре 60°С [13]. В эксперименте использовали 50 мышей – самок линии F1(CBAxC57bl\6) из питомника “Столбовая” (филиал Столбовая ФГУ Научный центр биомедицинских технологий Федерального медико-биологического агентства, Московская обл., Россия), которые получали следующую диету: 1 группа – контроль, возраст 2 мес., вес 20–22 г (7 шт.); 2 – мыши, получавшие липосомы из ФХ (6 шт.); 3 – мыши, получавшие липосомы из ФХ с ЭМГ (6 шт.); 4 – мыши, получавшие липосомы из ФХ, инкапсулированные Каз-Na (6 шт.); 5 – мыши, получавшие липосомы (ФХ + ЭМГ) инкапсулированные Каз-Na (6 шт.); 6 – мыши, получавшие липосомы (ФХ + РЖ) инкапсулированные Каз-Na (6 шт.); 7 группа – мыши, получавшие липосомы (ФХ + РЖ + ЭМГ), инкапсулированные Каз-Na – 6 шт.; 8 – мыши, получавшие воду в течение 3 месяцев (7 шт.). Через 3 мес. животные были подвергнуты декапитации, из печени и головного мозга были проэкстрагированы липиды, в которых методом газовой хроматографии был определен состав жирных кислот. На рис. 1 приведены данные о среднем количестве общих липидов/г исследованной ткани печени (а) и головного мозга (б).
Рис. 1.
Изменение содержания общих липидов (мг/г) в ткани печени (а) и головного мозга (б) мышей линии F1(CBAxC57bl\6) в зависимости от поддерживаемой в течение 3 мес. диеты. По оси Х – номера групп животных, получавших различную диету (см. раздел Методика).
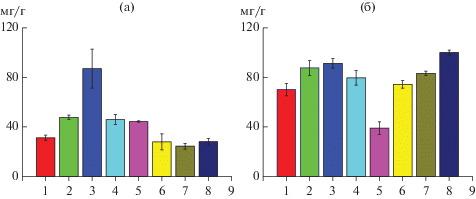
Из рис. 1 следует, что у контрольных мышей по мере увеличения их возраста (группа 1-животные в возрасте 2 мес., группа 8 – в возрасте 5 мес.) достоверно не изменялось содержание общих липидов печени и увеличивалось в головном мозге в расчете на 1 г сырой ткани. Так как животные остальных опытных групп были использованы в эксперименте через 3 мес. после его начала, то полученные величины следует сравнивать с группой 8. В печени наибольшие и статистически достоверные различия (р < 0.05) получены для 2, 3, 4 и 5 групп, в которых наблюдалось увеличение содержания общих липидов как по сравнению с 8, так и с 1 группами. Показатели для 6 и 7 групп достоверно не отличались от 1 и 8 групп. То есть, диеты с липосомами, не содержащими РЖ, увеличивали содержание общих липидов в ткани печени, в то время как липосомы, состоящие из тех же ингредиентов и РЖ (6 и 7 группы) имели такое же содержание общих липидов, как контрольные животные в 1 и 8 групп. Таким образом, мы установили, что старение животных сопряжено со статистически достоверным (р < 0.05) увеличением в головном мозге содержания общих липидов (8 группа по сравнению с 1), а использование диет, содержащих липосомы с РЖ (6 и 7 группы), снижает эту величину и приближает еe к норме контрольных 2-месячных мышей. Наибольшие отклонения от значений для 8 и даже 1 групп были получены при использовании липосом из ФХ с ЭМГ, инкапсулированных Каз-Na (5 группа). Можно заключить, что использование липосом, содержащих РЖ, благоприятно сказывается на общем содержании липидов в печени и головном мозге животных.
Основная же задача эксперимента заключалась в ответе на вопрос о том, как изменяется состав ЖК в липидах печени и головного мозга мышей после длительного получения различных липосомальных диет. Состав ЖК липидов печени приведён в табл. 2. Из таблицы видно, что увеличение возраста опытных животных с 2 до 5 мес. (1 и 8 группы, соответственно) сопровождалось возрастанием суммы мононенасыщенных жирных кислот (Σ МНЖК) на 9.5%; уменьшением содержания суммы полиненасыщенных жирных кислот (Σ ПНЖК) на 7%, в том числе докозагексаеновой (ДГК 22:6 ϖ-3) кислоты в 1.5 раза. Аналогичные данные были получены в работах [20, 21]. Использование липосомальных комплексов в группах 4 и 7 приближало содержание Σ МНЖК и Σ ПНЖК к норме, соответствующей 2-месячным животным. Особенно значительными являются изменения в содержании Σ ϖ-3 ПНЖК, которое увеличивалось в 7 группе, принимающей нанокомплексы из ФХ + РЖ + ЭМГ + Каз-Na, в 2 раза по сравнению с контрольной 8 группой и в 1.3 раза по сравнению с молодыми животными (1 группа). Столь же большое увеличение в этих же группах зафиксировано и для ДГК. Таким образом, можно констатировать, что использование сложных нанокомплексов, содержащих наряду с ФХ и РЖ как ЭМГ, так и Каз-Na, дает наилучший результат по обогащению липидов печени Σ ϖ-3 ПНЖК.
Таблица 2.
Состав и содержание жирных кислот в виде их метиловых эфиров (отн. %) в липидах печени в контрольной и в опытных группах мышей (1–8)
| Кислота | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|---|---|---|---|---|---|---|---|---|
| 16:0 | 23.8 | 25.9 | 23.8 | 21.4 | 23.8 | 27.2 | 26.0 | 23.2 |
| 17:0 | 0.2 | 0.2 | 0.3 | 0.4 | 0.2 | 0.2 | 0.2 | 0.2 |
| 18:0 | 11.4 | 8.1 | 8.5 | 8.3 | 7.8 | 9.8 | 9.7 | 8.5 |
| 20:0 | 0.2 | 0.2 | 0.2 | 0.9 | 0.3 | 0.2 | 0.2 | 0.2 |
| 22:0 | 0.2 | 0.2 | 0.1 | 3.5 | 0.1 | 0.3 | 0.9 | 1.3 |
| 23:0 | 0.1 | 0.1 | 0.2 | 0.3 | 0.4 | 0.1 | 0.2 | 0.1 |
| 24:0 | 0.2 | 0.2 | 0.1 | 0.2 | 0.2 | 0.2 | 0.2 | 0.1 |
| Σ НЖК | 36.1 | 34.9 | 33.2 | 35.0 | 32.8 | 38.0 | 37.4 | 33.6 |
| 16:1ω9 | 0.2 | 0.3 | 0.3 | 0.4 | 0.3 | 0.3 | 0.3 | 0.3 |
| 16:1ω7 | 2.4 | 2.7 | 2.3 | 2.0 | 3.0 | 1.8 | 1.9 | 2.5 |
| 18:1ω9 | 23.3 | 31.8 | 32.4 | 25.6 | 31.9 | 26.3 | 25.2 | 31.6 |
| 18:1ω7 | 3.7 | 4.0 | 3.9 | 3.7 | 4.3 | 3.1 | 3.5 | 4.2 |
| 20:1ω9 | 0.4 | 1.3 | 0.9 | 0.9 | 1.2 | 0.3 | 0.2 | 1.0 |
| 20:1ω7 | 0.1 | 0.3 | 0.1 | 0.2 | 0.2 | 0.1 | 0.1 | 0.1 |
| 24:1ω9 | 0.4 | 0.3 | 0.3 | 0.3 | 0.3 | 0.4 | 0.1 | 0.3 |
| Σ МНЖК | 30.5* | 40.7* | 40.2* | 33.1** | 41.2* | 32.3** | 31.3** | 40.0* ** |
| 18:3ω6 | 0.1 | 0.1 | 0.2 | 0.2 | 0.2 | 0.1 | 0.1 | 0.1 |
| 18:2ω6 | 13.7 | 12.3 | 13.9 | 14.3 | 11.2 | 13.7 | 14.2 | 11.7 |
| 20:4ω6 | 9.7 | 7.0 | 7.2 | 8.9 | 6.2 | 6.1 | 6.6 | 8.2 |
| 20:3ω6 | 1.2 | 0.7 | 0.6 | 1.3 | 0.8 | 1.2 | 0.9 | 1.5 |
| 20:2ω6 | 0.2 | 0.2 | 0.3 | 0.4 | 0.2 | 0.1 | 0.3 | 0.2 |
| 22:5ω6 | 0.1 | 0.1 | 0.1 | 1.8 | 3.0 | 3.5 | 0.3 | 0.2 |
| 22:6ω3 | 6.7 * | 3.6 | 4.0 | 4.5 | 4.1 | 4.3 | 8.6 ** | 4.2 * ** |
| 22:4ω6 | 1.6 | 0.3 | 0.2 | 0.4 | 0.2 | 0.3 | 0.2 | 0.2 |
| 22:5ω3 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.4 | 0.1 | 0.1 |
| Σ ПНЖК | 33.4* | 24.4* | 26.6* | 31.9** | 26.0 | 29.7 | 31.3** | 26.4* ** |
| ∑ϖ3 | 6.8* | 3.7 | 4.1 | 4.6 | 4.2 | 4.7 | 8.8** | 4.3* ** |
| ∑ϖ6 | 26.6 | 20.7 | 22.5 | 27.3 | 21.8 | 25.0 | 22.6 | 22.1 |
| ∑ϖ6\ ϖ3 | 3.9118* | 5.5946 | 5.4878 | 5.9348 | 5.1905 | 5.3192 | 2.5682*** | 5.1396* ** |
В табл. 3 представлены данные по составу ЖК липидов головного мозга мышей в зависимости от использованной липосомальной диеты. Из таблицы следует, что, в отличие от липидов печени, в головном мозге мышей возрастные изменения практически не выражены, что неудивительно, так как известно, что липидный обмен в головном мозге идет более медленно [22, 23]. Однако и в этом органе прием нанолипосомальных комплексов оказывал влияние на состав ЖК: в группах 3, 5 и 7 снижалась Σ НЖК, в группах 3 и 5 увеличивалась Σ ПНЖК, а также ДГК. Так как высокое содержание ΣНЖК и низкое – Σ ПНЖК и ДГК приводит к ожирению, сердечно-сосудистым и нервно-психическим заболеваниям [24–28], корректирующее влияние приёма водорастворимых нанолипосомальных комплексов, особенно содержащих ЭМГ, следует признать благоприятным фактом. Поскольку исходно мы ставили перед собой задачу увеличения относительного содержания ДГК в липидах, можно сказать, что она выполнена для липидов печени, в головном мозге также отмечена тенденция к желаемым изменениям. Учитывая более низкий метаболизм липидов в этом органе, можно полагать, что при более длительном приeме липосомальных комплексов можно достигнуть более выраженных изменений и здесь. Необходимо при этом подчеркнуть, что те увеличения в содержании ДГК, которые были получены нами для липидов печени, сопоставимы с результатами, полученными другими авторами при использовании диет, обогащeнных ДГК в гораздо большей степени [29, 30]. По-видимому, это может быть связано с использованием именно липосомальных нанокомплексов, так как по результатам, полученным в работе [31], ФХ увеличивает включение ДГК в липиды мембран. Значительного увеличения ДГК в головном мозге не удавалось достичь и тем экспериментаторам, которые использовали высокие концентрации ДГК в применяемой диете [24, 32, 33].
Таблица 3.
Состав и содержание жирных кислот в виде их метиловых эфиров (отн. %) в липидах головного мозга в контрольной и в опытных группах мышей (1–8)
| Кислота | Группы животных | |||||||
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| 16:0 | 21.1 | 19.8 | 16.3 | 17.6 | 13.9 | 19.3 | 18.6 | 18.4 |
| 17:0 | 0.3 | 0.8 | 0.2 | 0.3 | 0.6 | 0.4 | 0.2 | 0.5 |
| 18:0 | 21.2 | 18.8 | 16.2 | 17.7 | 16.0 | 19.9 | 16.4 | 19.6 |
| 20:0 | 0.6 | 0.6 | 0.6 | 0.6 | 0.9 | 0.6 | 0.5 | 0.5 |
| 22:0 | 0.4 | 0.2 | 0.9 | 0.7 | 0.5 | 0.6 | 0.3 | 1.9 |
| 23:0 | 0,4 | 0,1 | 0,1 | 0,2 | 0,2 | 0,1 | 0,1 | 0,1 |
| 24:0 | 0.8 | 1.2 | 1.3 | 1.3 | 0.6 | 1.6 | 1.9 | 0.4 |
| Σ НЖК | 44.8 | 41.5 | 38.9** | 41.2 | 34.6** | 42.5 | 38.0 | 41.4** |
| 16:1ω9 | 0.6 | 0.4 | 0.4 | 0.5 | 0.5 | 0.7 | 0.5 | 2.5 |
| 18:1ω9 | 16.2 | 14.2 | 13.2 | 15.6 | 14.6 | 17.0 | 13.8 | 16.3 |
| 18:1ω7 | 4,0 | 2.9 | 2.8 | 4.1 | 3.1 | 3.8 | 3.2 | 3.8 |
| 20:1ω9 | 1.6 | 2.4 | 2.4 | 2.6 | 2.8 | 2.2 | 2.0 | 2.3 |
| 20:1ω7 | 0.3 | 0.5 | 0.6 | 0.5 | 0.8 | 0.2 | 1.8 | 0.2 |
| 22:1ω9 | 0.4 | 4.9 | 5.8 | 3.4 | 7.3 | 0.5 | 1.6 | 0.2 |
| 22:1ω7 | 0.4 | 0.2 | 0.2 | 0.2 | 0.1 | 0.1 | 0.1 | 0.1 |
| 24:1ω9 | 1.8 | 4.0 | 4.1 | 3.9 | 3.0 | 4.9 | 4.9 | 2.8 |
| Σ МНЖК | 25.3 | 29.5 | 29.1 | 30.8 | 32.2 | 29.4 | 27.9 | 28.2 |
| 18:2ω6 | 0.8 | 0.9 | 0.9 | 0.7 | 0.8 | 1.2 | 0.6 | 0.6 |
| 20:4ω6 | 9.5 | 8.4 | 8.5 | 8.4 | 9.6 | 7.7 | 7.0 | 9.9 |
| 20:3ω9 | 0.4 | 0.4 | 0.4 | 0.3 | 0.4 | 0.1 | 0.2 | 0.5 |
| 20:2ω9 | 0.1 | 0.1 | 0.1 | 0.1 | 0.2 | 0.1 | 0.1 | 0.1 |
| 20:2ω6 | 0.1 | 0.1 | 0.1 | 0.1 | 0.2 | 0.1 | 0.1 | 0.1 |
| 22:6ω3 | 16.2 | 13.5 | 18.5 | 14.7 | 18.9 | 16.1 | 14.4 | 16.4 |
| 22:4ω6 | 3.3 | 2.7 | 3.5 | 3.7 | 3.1 | 2.6 | 2.4 | 3.2 |
| Σ ПНЖК | 30.4 | 29.3 | 32.0 | 28.0 | 33.2 | 27.3 | 24.8 | 30.9 |
| ∑ϖ3 | 16.2 | 13.5 | 18.5 | 14.7 | 18.9 | 16.1 | 14.4 | 16.4 |
| ∑ϖ6 | 13.7 | 12.1 | 13.0 | 12.9 | 13.7 | 11.6 | 10.1 | 13.20 |
| ∑ϖ6/∑ϖ3 | 0.8457 | 0.8963 | 0.7027 | 0.8476 | 0.7249** | 0.7205** | 0.7014** | 0.8049** |
Необходимой стадией при развитии ряда заболеваний: атеросклероза, сердечно-сосудистых и когнитивных нарушений, злокачественных новообразований [34–37] является воспаление и окислительный стресс. Установлено, что ϖ-6-ПНЖК являются предшественниками провоспалительных гормонов [38], а ϖ-3-ПНЖК участвуют в формировании противовоспалительного ответа организма [36, 38], поэтому для оценки потенциальной способности противовоспалительной активности тех или иных воздействий на организм используется такой критерий, как влияние этих воздействия на соотношение Σ ϖ-6/Σ ϖ-3 в органах и тканях [30, 37–39]. На основании полученных результатов по анализу состава ЖК липидов печени и головного мозга для всех групп животных, использованных в эксперименте, были вычислены эти соотношения. Результаты приведены в табл. 2 и 3. Из них видно, что увеличение возраста животных приводило к увеличению этого соотношения в липидах печени в 1.3 раза и не влияло на него в липидах головного мозга. Использование нанокомплексов на 15% снижало это отношение в липидах головного мозга мышей в группах 3, 5, 6 и 7. В липидах печени использование липосомального нанокомплекса (ФХ + РЖ + + ЭМГ + Каз-Na) уменьшало этот показатель в 2 раза. Таким образом, на основании полученных результатов можно сделать заключение о том, что наибольшим эффектом обладал сложный липосомальный нанокомплекс (ФХ + РЖ + ЭМГ + + Каз-Na), который сочетает в себе сразу целый ряд полезных свойств: высокое содержание длинноцепочечных ПНЖК, хорошую защищённость от окисления природным антиоксидантом и белком, водорастворимость и хорошую всасываемость в желудке и кишечнике. Особенно следует подчеркнуть, что наряду с сопоставимым эффектом на уровень индивидуальных ПНЖК и биодоступность, применение данного липосомального комплекса значительно превышало влияние ранее используемых пищевых диет на соотношение Σ ϖ-6/Σ ϖ-3 [37–39]. Можно полагать, что использование такого нанокомплекса будет способствовать повышению противовоспалительного статуса организма, а, следовательно, снижать риск целого ряда заболеваний.
Таким образом, показано, что, используя напитки с липосомальными нанокомплексами сложного состава, включающими в себя как эссенциальные ПНЖК, так природный антиоксидант и пищевой белок, можно модифицировать состав ЖК печени и головного мозга, увеличить содержание ДГК и значительно уменьшить Σ ϖ-6/Σ ϖ-3 ПНЖК, что обеспечит повышение устойчивости организма к воспалительным процессам, снизит риск возникновения онкологических и нервно-психических заболеваний. Полученные результаты могут быть использованы при разработке современных систем доставки различных нутрицевтиков на основе ФХ-липосом, так как помимо основного влияния на состав ПНЖК способ введения их в организм млекопитающих в виде водорастворимых напитков более удобен, чем применение масел.
Работа выполнена в рамках Госзадания № 1201253307.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Исследования выполнялись согласно Правилам лабораторной практики в Российской Федерации, в соответствии с правилами, принятыми Европейской Конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей (European Convention for the Protection of Vertebrate Animals Used for Experimental and other Scientific Purposes (ETS 123), Strasburg, 1986) согласно утвержденному письменному протоколу, в соответствии со стандартными операционными процедурами исследователя (СОП), а также с Руководством по лабораторным животным и альтернативным моделям в биомедицинских исследованиях [40]. Люди в качестве объектов исследования не выступали.
Список литературы
Saini R.K., Keum Y.S. // Life Sciences. 2018. V. 203. № 1. P. 255–267.
Fuentas Natividad R., Kim Eunjio, Fan Yang-Yi, Chapkin Robert S. // Molecular Aspects of Medicine. 2018. V. 64. № 1. P. 79–91.
Mensink R.P., Zock P.L., Kester A.D., Katan M.B. // Am. J. Clin. Nutr. 2003. V. 77. № 5. P. № 1146–1155.
Calder P.C. // Eur. J. Pharmacol. 2011. V. 668. Suppl. 1.1. P. 50–58.
Banni S., Di Marzo V. // Mol. Nutr. Food Res. 2010. V. 54. № 1. P. 82–92.
Wassall S.R., Stillwell W. // Biochim. Biophys. Acta. 2009. V. 1788. № 1. P. 24–32.
Candela G.C., Bermejo L.L. M., Loria K.V. // Nutr. Hosp. 2011. V. 26. № 2. P. 323–330.
Максимов В.И. // Пища и дегенеративные болезни. М.: Миклош, 2004. С. 232.
Semenova M.G., Dickinson E. // Biopolymers in Food Colloids: Thermodynamics and Molecular Interactions. Leiden, Boston: Brill, 2010. P. 356.
McClements D.J. // Nanoparticle- and Microparticlebased Delivery Systems. Encapsulation, Protection and Release of Active Compounds. London, N.Y.: Taylor & Francis Group, 2015. P. 548.
Semenova M.G., Antipova A.S., Zelikina D.V., Martirosova E.I., Plashchina I.G., Palmina N.P., Binyukov V.I., Bogdanova N.G., Kasparov V.V., Shumilina E.A., Ozerova N.S. // Food Research International. 2016. V. 88. № 1. P. 70–78.
Semenova M.G., Zelikina D.V., Antipova A.S., Martirosova E.I., Grigorovich N.V., Obushaeva R.V., Shumilina E.A., Ozerova N.S., Palmina N.P., Maltseva E.L., Kasparov V.V., Bogdanova N.G., Krivandin A.V. // Food Hydrocolloids. 2016. V. 52. № 1. P. 144–160.
Сажина Н.Н., Антипова А.С., Семенова М.Г., Пальмина Н.П. // Биоорганическая химия. 2019. Т. 45. № 2. С. 193–201.
Семёнова М.Г., Антипова А.С., Пальмина Н.П., Мишарина Т.А., Мартиросова Е.И., Зеликина Д.В., Крикунова Н.И., Каспаров В.В., Бинюков В.И., Богданова Н.Г., Чеботарёв С.А., Гуреева М.Д. // Химическая физика. 2019. Т. 38. № 12. С. 38–43.
Semenova M.G., Zelikina D.V., Antipova A.S., Martirosova E.I, Palmina N.P., Chebotarev S.A., Samuseva Y.V., Bogdanova N.G., Kasparov V.V. // Food Hydrocolloids. 2020. V. 105. № 1. 105803.
Semenova M.G., Antipova A.S., Anokhina M.S., Belyakova L.E., Polikarpov Y.N., Gigorovich N.V. et al. // Food & Function. 2012. V. 3. № 3. P. 271–282.
Semenova M.G., Antipova A.S., Belyakova L.E., Polikarpov Y.N., Anokhina M.S., Grigorovich N.V. et al. // Food Hydrocolloids. 2014. V. 42. № 1. P. 149–161.
Кейтс М. Техника липидологии. Выделение, анализ и идентификация липидов. М.: Мир., 1975. 322 с.
Мишарина Т.А., Теренина М.Б., Крикунова Н.И. // Прикл. биохимия и микробиология. 2017. Т. 53. № 5. С. 534–543
Бурлакова Е.Б., Мишарина Т.А., Фаткуллина Л.Д., Теренина М.Б., Крикунова Н.И., Ерохин В.Н., Воробьёва А.К. // Доклады Академии наук. 2011. Т. 437. № 3. С. 409–412.
Gao F., Kim H.W., Igarashi M., Kiesewetter D., Chang L., Ma K., Rapoport S.I. // Biochim. Biophys. Acta. 2011. V. 1811. № 7–8. P. 484–489.
Igarashi M., Chang L., Ma K., Rapoport S.I. // Prostaglandins, Leukotrienes and Essential FattyAcids. 2013. V. 83. № 2. P.403–412.
Chappus-McCendie H., Chevalier L, Roberge C., Plourde M. // Progress in Neuropsychopharmacology & Biological Psychiatry. 2019. V. 94. № 1. P. 1–12.
Hosomi R., Fukunaga K., Nagao T., Shiba S., Miyauchi K., Yoshida M., Takahashi K. // J. Oleo Sci. 2019. V. 68. № 8. P. 781–792.
Russo G.L. // Biochem. Pharmacol. 2009. V. 77. № 6. P. 937–46.
Soderberg M., Edlund C., Kristensson K., Dallner G. // Lipids. 1991. V. 26. № 6. P. 421–425.
Ailhaud G., Massiera F., Weill P., Legrand P., Alessandri J.M., Guesnet P. // Prog. Lipid Res. 2006. V. 45. № 3. P. 203–236.
Mocking R.J.T., Assies1 J., Ruhé1 H.G., Schene A.H. // J. Inherited Metabolic Disease. 2018. V. 41. № 4. P. 597–611.
Greupner T., Kutzner L., Nolt F., Strangmann A., Heike Kohrs H., Hahn A., Schebb N.H., Schuchardt J.P. // Food Funct. 2018. V. 9. № 3. P. 1587–1600.
Valenzuela R., Espinosa A., Llanos P., Hernandez-Rodas M.C., Barrera C., Vergara D., Romero N., Pérez F., Ruza M., Videlae L.A. // Food Funct. 2016. V. 7. № 1. P. 140–150.
van Wijk N., Balvers M., Cansev M., Maher T.J., Sijben J.W.C., Broersen L.M. // Lipids. 2016. V. 51. № 7. P. 833–846.
Lim S.Y., Suzuki H. // Int. J. Vitam. Nutr. Res. 2002. V. 72. № 1. P. 77–84.
Valentini K.J., Wiesinger C.A.P., Fenton J.A. // Int. J. Food Sci. and Nutr. 2018. V. 69. № 6. P. 705–717.
Simopoulos A.P. // Exp. Biol. Med. 2008. V. 233. № 6. P. 674–688.
Mocking R.J.T., Assies J., Ruhé H.G., Schene A.H. // Inheri. Metab. Dis. 2018. V. 41. № 4. P. 597–611.
Joffre C., Rey C., Layé S. // Frontiers in Pharmacology. 2019. V. 10. № 9. P. 1–16.
Dydjow-Bendek D., Zagozdzon P. // In vivo. 2020. V. 34. № 1. P. 423–431.
Schmitz G., Ecker J. // Prog. Lipid Res. 2008. V. 47. № 2. P. 147–155.
Bali´ A., Vlaši´D., Žužul K., Marinovi´ B., Bukvi´ Mokos Z. // Int. J. Mol. Sci. 2020. V. 21. № 2. P. 741–767.
Каркищенко Н.Н, Грачева С.В. // Руководство по лабораторным животным и альтернативным моделям в биомедицинских исследованиях. М.: Профиль, 2010. 358 с.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


