Прикладная биохимия и микробиология, 2020, T. 56, № 6, стр. 571-576
Оптимизация метода получения рекомбинантного химозина в метилотрофных дрожжах Komagataella phaffii
С. Ю. Филькин 1, Н. В. Чертова 1, Е. А. Вавилова 1, С. С. Зацепин 1, М. А. Эльдаров 2, Э. Г. Садыхов 1, А. Н. Фёдоров 1, А. В. Липкин 1, *
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
2 Институт биоинженерии, Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук
117312 Москва, Россия
* E-mail: lipus57@yahoo.com
Поступила в редакцию 15.05.2020
После доработки 30.06.2020
Принята к публикации 02.07.2020
Аннотация
Получен эффективный рекомбинантный штамм Komagataella phaffii, с высоким выходом продуцирующий прохимозин Bos taurus. Разработан метод выделения и очистки рекомбинантного химозина, включающий двухстадийную очистку методами ионнообменной и гидрофобной хроматографии. Получен препарат высокоочищенного (~90%) рекомбинантного химозина с концентрацией 4 мг/мл (1000 IMCU/мл) с выходом 62%. Разработанная методика может быть использована при промышленном производстве фермента.
Химозин (КФ 3.4.23.4) – аспартатная эндопептидаза обладает специфической протеолитической активностью в отношении пептидной связи Phe105-Met106 [1]. Результатом проявления протеолитической активности химозина является формирование молочного сгустка, что чрезвычайно важно при изготовлении продукции в сыроделии и пищевой промышленности. Штаммы-продуценты на основе Aspergillus niger [2] и Kluyveromyces lactis [3] активно используются в современной промышленности для продукции рекомбинантного химозина. Создание эффективных штаммов-продуцентов ферментов на основе Komagataella phaffii (ранее – Pichia pastoris) является важной прикладной задачей промышленной биотехнологии [4, 5].
Ранее была оптимизирована нуклеотидная последовательность для экспрессии в K. phaffii [6], получены клоны штамм-продуцентов [7], разработаны методы культивирования при использовании технического глицерина [8]. Однако, достигнутые уровни продуктивности штамм-продуцентов не соответствуют достигнутым уровням в промышленных штаммах-продуцентах A. niger и K. lactis. Существующие методы позволяют оптимизировать штаммы-продуценты K. phaffii как в результате оптимизациия метаболома с увеличением выхода промежуточных интермедиатов и конечных метаболитов; улучшения механизма геномных интеграций, позволяющих увеличить эффективность встраивания экспрессионных кассет; оптимизации мультикопийных инсерций методами генетической инженерии; геномного редактирования методами CRISPR/Cas9; коэкспрессии генов для улучшения внутриклеточного транспорта и секреции, а также коэкспрессии шаперонов для улучшения белкового фолдинга [9].
Цель работы – получение высокоэффективного штамма-продуцента химозина в K. phaffii и разработка методов выделения и очистки для использования в промышленной биотехнологии.
МЕТОДИКА
Материалы. Для получения штамма-продуцента использовали ген прохимозина B Bos taurus (GenBank: E05472.1). Оптимизация последовательности и химический синтез целевого гена выполнены компанией “Twist Bioscience” (США). Ген был получен в составе вектора pTwist (Amp). Реактивы для питательных сред – фирмы “Sigma-Aldrich” (США).
Конструирование вектора для экспрессии прохимозина. Вектор pPICZalphaA (“Thermo Fisher Scientific”, США) был использован для получения секретируемого прохимозина B. Вектор содержал промотор AOX1 и фактор внеклеточной селекции Saccharomyces cerevisiae [10]. Ген прохимозина B и экспрессионный вектор pPICZalphaA были поочередно обработаны эндонуклеазами рестрикции EcoRI и NotI (“Thermo Fisher Scientific”, США), после чего лигированы по образовавшимся “липким” концам лигазой фага Т4 (“Thermo Fisher Scientific”, США).
Трансформация P. pastoris. Вектор pPICZalphaA с встроенным геном прохимозина В был предварительно линеаризован по сайту рестрикции SacI. Для создания экспрессионного штамма использовали клетки K. phaffii штамма X-33 (“Thermo Fisher Scientific”, США).
Приготовление электрокомпетентных клеток осуществляли согласно протоколу трансформации (http://tools.thermofisher.com/content/sfsmanuals/easyselect_man.pdf). После электропорации клетки инкубировали 1 ч при 30°С в 1.0 мл 1.0 М сорбитола и высевали на чашки с агаризованной средой, следующего состава (%): дрожжевой экстракт – 1.0, пептон – 2.0, глюкоза – 2.0 и 1.0 М сорбитол, а также различные концентрации зеоцина (200, 500, 750, 1000 мкг/мл).
Селекция трансформантов. Отобранные трансформанты штамма K. phaffii X-33, устойчивые к зеоцину, анализировали на наличие вставки гена Chym1 методом ПЦР-скрининга с олигодезоксирибонуклеотидами Хим1 5'-GAATTCGCTGAAATTACTAGAATCCCATTG-3' и Хим2 5'-GCGGCCGCTTAAATAGCTTTAGC-3' (“Евроген”, Россия). По результатам селекции и ПЦР-скрининга были отобраны клоны с встроенным геном прохимозина В.
Культивирование трансформантов. Для получения инокулята трансформированные клетки выращивали в течение 24 ч при 30°C в шейкере-инкубаторе “Innova 43R”, (“New Brunswick Scientific”, США) при 250 об./мин в жидкой питательной среде YPD (%, дрожжевой экстракт – 1.0, триптон – 1.5, глюкоза – 1.0), как описано ранее [4]. Полученным инокулятом засевали пробирки со средой YPD (5 мл) в соотношении 1 : 10, и выращивали при 30°С и 250 об./мин в течение 96 ч. Через каждые 24 ч культивирования добавляли 1.0% метанола. После окончания культивации определяли активность ферментов в культуральной жидкости.
Определение активности химозина в культуральной жидкости. Для активации химозина из культуральной жидкости (КЖ) каждого выбранного клона после культивирования отбирали по 1 мл, добавляли 100 мкл 1.0 M HCl, инкубировали 2 ч, а затем восстанавливали pH до 5.5 добавлением 90 мкл 1.0 M NaOH c последующей инкубацией в течение 2 ч. Активность химозина определяли в соответствии с ранее разработанной методикой определения молоко-свертывающей активности [11]. Сухое обезжиренное молоко (“Промакс”, Россия) было восстановлено в виде 26%-ного раствора с добавлением 0.5 г/л CaCl2, pH 6.5. Молоко перемешивали при 25°С в течении 30 мин и инкубировали при 37°С 20 мин. К 1 мл восстановленного обезжиренного молока, содержащего 0.1 г/мл хлорида кальция добавляли 100 мкл КЖ после активации химозина. Определяли время образования сгустка при 37°С. В качестве положительного контроля использовали контрольный раствор с известной активностью химозина (“Proquiga”, Испания) 600 IMCU/мл (IMCU – International milk clotting units, международные единицы свертываемости молока, ГОСТ 11815-2015).
ДСН-электрофорез белков. Электрофоретический анализ белков осуществляли в денатурирующем полиакриламидном геле (ДСН-ПААГ) по Лэммли [12]. В качестве маркеров молекулярного веса использовали FastRuler Middle Range DNA Ladder (“Thermo Fisher Scientific”, США). Концентрацию химозина определяли денситометрическим методом.
Культивирование штамма – продуцента прохимозина в ферментере. Для культивирования штамма-продуцента прохимозина использовался ферментер “Biostat B+” (“Sartorius”, Германия) объемом 2 л. Для получения посевной культуры штамм-продуцент выращивали в течение 1 сут в шейкере-инкубаторе при 30°С и 250 об./мин на среде BMGY, следующего состава (%): дрожжевой экстракт – 1.0, глицерин – 1.0, пептон – 2.0, дрожжевых азотистых оснований – 1.34, 100 мМ калий-фосфатный буфер, рН 6.0. Засев ферментера осуществляли из 1 колбы (150 мл среды), культивирование проводили на минеральной среде с глицерином, следующего состава (г/л): глицерин – 70, KH2PO4 – 9.9, (NH4)2SO4 – 15.7, г/л MgSO4 – 4.6, CaCl2 – 0.35, биотин – 4.0, PTM1 – 0.972%, пеногаситель Софэксил (“Софэкс-Силикон”, Россия) – 0.1%, при 30°С. После добавления метанола температуру снижали до 26°С. При выращивании на среде с глицерином поддерживали рН среды 4.0, после индукции метанолом значение рН меняли на 5.5. Сорбитол (2.0%) добавляли одновременно с индукцией метанолом через 24 и 48 ч. Добавление метанола осуществляли раз в три часа до его содержания в среде 1.0%. Для этого использовали 50%-ный раствор метанола с 2.2%-ным PTM1. Автоматическое поддержание значения рН среды осуществляли титрованием 10%-ными растворами NH4OH и Н2SO4.
Очистка и получение химозина. Для очистки рекомбинантного химозина использовали сочетание методов ионообменной хроматографии с методами хроматографии гидрофобных взаимодействий. На первом этапе культуральную жидкость отделяли от клеток центрифугированием при 16 000 g 15 мин при 4°С. После этого культуральную жидкость разбавляли в отношении 1 : 3 50 мМ фосфатным буфером, pH 5.5, и наносили на колонку с DEAE-Sepharose (“GE Healthcare”, США), предварительно уравновешенную 50 мМ фосфатным буфером, pH 5.5. Элюцию проводили 0.3 M NaCl. К полученным активным фракциям добавляли 5 M NaCl до концентрации 2.0 M NaCl. Полученный раствор наносили на колонку с Phenyl-Sepharose (“GE Healthcare”, США), предварительно уравновешенную 2 M NaCl в 50 мМ Na2HPO4, pH 5.5. Элюцию проводили 50 мM Na2HPO4, pH 5.5. Полученные фракции объединяли и анализировали ДСН-ПААГ-электрофорезом.
Статистическая обработка результатов. Данные по ферментативной активности были измерены в 5 повторностях. Статистическая обработка проведена в “Origin 2015” (OriginLab Corporation, США). Для количественных переменных результаты представлены в виде среднего арифметического (М) с указанием среднеквадратического отклонения (±SD), на графиках указан 95% доверительный интервал (CI).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Селекция трансформантов K. phaffii. Отобранные после трансформации клоны, несущие ген прохимозина В, названные pPICzα-Сhym1, проанализировали ПЦР-скринингом на наличие вставки. Результаты представлены на рис. 1. Клоны pPICzα-Сhym1 проверяли на возможность проявлять молокосвертывающую активность. Более 75% клонов проявляли ферментативную активность в диапазоне 0.1–5 IMCU/мл (рис. 2). Клоны с наибольшей активностью химозина были получены при концентрации зеоцина 750 мкг/мл.
Рис. 1.
Результат ПЦР-скрининга клонов K. phaffii после трансформации. M – маркеры молекулярной массы, 1–12 – клоны после трансформации конструкцией pPICZα-Chym1; К+ – положительный и К– – отрицательный контроль ПЦР. Стрелка указывает положение фрагмента ДНК химозина.

Рис. 2.
Молокосвертывающая активность химозина в КЖ клонов K. phaffii, выращенных на среде YPD, содержащей зеоцин, при индукции 1%-ным метанолом в течении 72 ч. Клоны 1–10 – 200 мкг/мл зеоцина; клоны 11–20 – 500 мкг/мл зеоцина; клоны 21–60 – 750 мкг/мл зеоцина; клоны 61–85 – 1000 мкг/мл зеоцина.

Динамика экспрессии химозина. Для подбора оптимальных условий культивирования в колбах были отобраны 6 клонов с максимальной активностью химозина. При культивировании в колбах (250 об./мин, 30°С) в течении 96 ч при добавлении 50%-ного раствора метанола до конечной концентрации метанола в культуральной среде 1.0% ферментативная активность была на уровне 12.5 IMCU/мл. Индукция в среде BMMY (см. “Методику”) с добавлением 1.0% аскорбиновой кислоты не меняла активность конечного препарата. Однако, добавление 2.0 г/л сорбитола в среду BMMY с одним из выбранных клонов повышало активность конечного препарата до 20 IMCU/мл. Отобранный клон в дальнейшем использовался для оптимизации культивирования в ферментере.
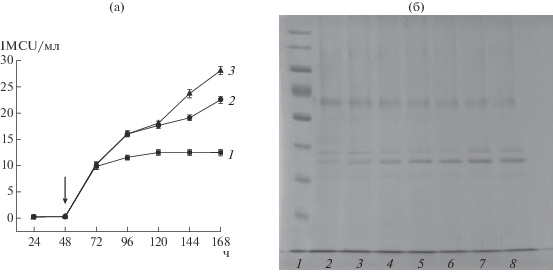
Культивирование дрожжей K. phaffii в ферментере. Дрожжи выращивали в ферментере до OD600, равной 285. При этом OD600 после индукции метанолом значительно не менялась. Для повышения выхода конечного продукта были протестированы различные режимы ферментации и варианты добавок к основной среде. Максимальный выход продукта (80 мг/л) наблюдался при ферментации pPICzα-Chym1 в течении 96 ч с двукратным добавлением раствора сорбитола 2.0 г/л через 24 и 48 ч (рис. 3). Полученный выход целевого продукта по уровню экспрессии соответствовал аналогичным разработкам [8]. Добавки сорбитола – одна из стратегий повышения уровня экспрессии при использовании AOX1 промотора [13]. Такая стратегия характерна прежде всего для штаммов-продуцентов с мультикопийной вставкой гена целевого продукта. Оптимизация соотношения метанол/сорбитол позволила добиться в целом более высокого уровня продукции химозина за счет улучшения углеродного метаболизма и увеличения биомассы.
Рис. 3.
Биосинтез химозина pPICzα-Chym1 в биореакторе (а) и электрофореграмма КЖ в процессе роста культуры (б). а: 1 – минеральная среда, 2 – та же среда с двукратным добавлением сорбитола по 1.0 г/л, 3 – та же среда с двукратным добавлением сорбитола 2 г/л; стрелкой показано остановка подпитки сорбитолом и начало индукции. б: 1 – маркеры молекулярной массы, 2–8 – 24, 48, 72, 96, 120, 144, 168 ч от начала добавления смеси метанол/сорбитол соответственно; стрелкой обозначена полоса, соответствующая зрелой форме химозина.
Очистка рекомбинантного химозина. Полученную после ферментации КЖ отделяли от клеточной массы центрифугированием и проводили pH-зависимую активацию химозина. Для этого к 400 мл КЖ добавляли 40 мл 1.0 M HCl до значения pH 2.0. При низких значениях pH происходила автокаталитическая активация прохимозина до химозина в результате отщепления N-концевого пептида из 42 аминокислотных остатков. После 2 ч инкубации pH восстанавливали до значения 5.5 добавлением 40 мл 1.0 M NaOH.
Химозин выделяли из КЖ на первом этапе методом анионообменной хроматографии на DEA-E-Sepharose. Были подобраны оптимальные условия разбавления в соотношении 1 : 3 КЖ : 50 мМ фосфатный буфер, pH 5.5, при котором удавалось добиться максимального связывания химозина с хроматографическим сорбентом с последующей его элюцией. В результате проведенной анионообменной хроматографии раствор химозина удалось сконцентрировать в 5 раз и удалить при этом большинство примесей.
Для следующего этапа очистки использовали хроматографическую колонку с Phenyl-Sepharose объемом 5 мл. К раствору химозина добавляли 5.0 М раствор NaCl до конечной 2.0 М концентрации соли. Хроматографическую колонку Phenyl-Sepharose предварительно уравновешивали 50 мМ раствором Na2HPO4, pH 5.5, с 2.0 M NaCl. После проведения элюции получали раствор химозина, очищенный в 28 раз, содержащий 85–90% активного белка (табл. 1.). Результаты хроматографической очистки приведены на рис. 4. Суммарные потери по белку на всех этапах активации, выделения и очистки составили 38% (табл. 1). Конечный образец удалось сконцентрировать в 44 раза, при этом удельная активность полученного химозина составила 220 IMCU/мг.
Таблица 1.
Стадии выделения и очистки химозина
| Стадии очистки | Общее количество химозина, мг | Активность химозина, IMCU/мл | Удельная активность химозина, IMCU/мг белка | Выход химозина по белку, % | Чистота препарата по белку, % |
|---|---|---|---|---|---|
| Супернатант КЖ | 44 | 5 | 7.8 | 100 | 30 |
| Супернатант после активации | 43.1 | 42 ± 5 | 66 | 95 | 32 |
| Анион-обменная хроматография | 34.5 | 264 ± 10 | 152 | 72 | 60 |
| Хроматография гидрофобных взаимодействий | 31.5 | 1009 ± 12 | 220 | 62 | 85–90 |
Рис. 4.
Очистка рекомбинантного химозина методом хроматографии гидрофобных взаимодействий (а), электрофореграмма фракций (б). а: 1 – OD280, 2 – градиент NaCl; б: M – маркеры молекулярной массы, кДа. 1 – фракция после очистки на DEAE-Sepharose, 2 – не адсорбировавшаяся фракция, 3–6 объединенные фракции (36–42 мл). Стрелкой указана полоса, соответствующая зрелой форме химозина.

Полученный рекомбинантный химозин быка обладал физико-химическими свойствами, сопоставимыми с природным химозином и ранее полученными рекомбинантными аналогами химозина быка в K. phaffii [8]. При этом рекомбинантный химозин проявлял максимальную активность в диапазоне температур 30–38°С при pH 5.5–5.8. Хранение очищенного фермента при температуре 4°С 30 сут приводило к незначительной потере активности. Хранение при температуре 20°С 30 сут приводило к потере 30% активности.
Использование системы экспрессии K. phaffii под контролем промотора АОХ1, индуцируемого метанолом, активно применяется в различных технологических процессах, связанных получением ферментов для промышленности [4]. Тем не менее, в будущем возможно создание штаммов-продуцентов рекомбинантного химозина в системе экспрессии K. phaffii с использованием возможно более “сильного” промотора, не требующего использования метанола в качестве индуктора. Разработка таких штаммов является основой будущих разработок.
В ходе выполнения работы был получен высокоэффективный рекомбинантный штамм метилотрофных дрожжей K. phaffii, продуцирующий функционально активный рекомбинантный прохимозин и подобраны условия автокаталитической активации прохимозина до химозина. Для рекомбинантного химозина разработан метод очистки и концентрирования до 4 мг/мл (1000 IMCU/мл).
При проведении исследований использовали оборудование Центра коллективного пользования “Промышленные биотехнологии” Федерального исследовательского центра “Фундаментальные основы биотехнологии” Российской академии наук.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации в рамках выполнения работ по соглашению от 26.11.2018 г. № 14.607.21.0207 (УИН RFMEFI60718X0207), ФЦП “Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014–2020 годы”.
Список литературы
Беленькая С.В., Балабова Д.В., Белов А.Н., Коваль А.Д., Щербаков Д.Н., Ельчанинов В.В. // Прикл. биохимия и микробиология. 2020. Т. 56. № 4. С. 315–326.
Bodie E.A., Armstrong G.L., Dunn-Coleman N.S. // Enzyme Microb. Technol. 1994. V. 16. № 5. P. 376–382.
Van den Berg J.A., van der Laken K.J., van Ooyen A.J., Renniers T.C., Rietveld K., Schaap A., Brake A.J., Bishop R.J., Schultz K., Moyer. D. // Nat. Biotechnol. 1990. V. 8. № 2. P. 135–139.
Филькин С.Ю., Чертова Н.В., Зенин В.А., Липкин А.В., Садыхов Э.Г., Фёдоров А.Н. // Прикл. биохимия и микробиология. 2019. Т. 55. № 6. С. 578–585.
Filkin S.Y., Chertova, N.V. Zenin V.A., Lipkin A.V., Sichev A.A., Bityak D.S., Sadykhov E.G., Popov V.O., Fedorov A.N. // Prep. Biochem. Biotech. 2020. V. 50. № 6. P. 549–555.
Noseda D.G., Recúpero M.N., Blasco M., Ortiz G.E., Galvagno M.A. // Protein Expr. Purif. 2013. V. 92. № 2. P. 235–244.
Noseda D.G., Blasco M., Recúpero M., Galvagno M.Á. // Protein Expr. Purif. 2014. V. 104. P. 85–91.
Noseda D.G., Recúpero M., Blasco M., Bozzo J., Galvagno. M.Á. // Protein Expr. Purif. 2016. V. 123. P. 112–121.
Peña D.A., Gasser B., Zanghellini J., Steiger M.G., Mattanovich D. // Metab. Eng. 2018. V. 50. P. 2–15.
Higgins D.R., Busser K., Comiskey J., Whittier P.S., Purcell T.J., Hoeffler J.P. // Methods Mol. Biol. 1998. V.103. P. 41–53.
Dunn-Coleman N.S., Bloebaum P., Berka R.M., Bodie E., Robinson N., Armstrong G., Ward M., Przetak M., Carter G.L., LaCost R. // Nat. Biotechnol. 1991. V. 9. № 10. P. 976–981.
Laemmli U.K. // Nature. 1970. V. 227. № 5259. P. 680–685.
Niu H., Jost L., Pirlot N., Sassi H., Daukandt M., Rodriguez C., Fickers P. // Microb. Cell Factories. 2013. V. 12. №. 33.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


