Прикладная биохимия и микробиология, 2020, T. 56, № 4, стр. 336-341
Малые РНК Mycobacterium tuberculosis в адаптации к стрессовым условиям, моделирующим инфекцию in vitro
А. А. Острик 1, *, Е. Г. Салина 1, Ю. В. Скворцова 2, А. С. Григоров 2, О. С. Быченко 2, А. С. Капрельянц 1, Т. Л. Ажикина 2
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
2 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова
Российской академии наук
117997 Москва, Россия
* E-mail: albina.ostrik@gmail.com
Поступила в редакцию 03.02.2020
После доработки 17.02.2020
Принята к публикации 25.02.2020
Аннотация
Ранее была выявлена роль малых некодирующих РНК в регуляции метаболизма Mycobacterium tuberculosis. В работе показано, что выживаемость M. tuberculosis в условиях, имитирующих попадание бактерии в организм человека при инфекции, зависела от уровня экспрессии малых РНК. Получены штаммы M. tuberculosis, гиперэкспрессирующие малые РНК MTS1338 и MTS0997, изучена их выживаемость в стрессовых условиях in vitro и в макрофагах человека. Гиперэкспрессия малой некодирующей РНК МТS1338 повышала устойчивость бактерий к стрессовому воздействию пероксида водорода, оксида азота, кислой среды и длительного ограничения питательных веществ на разных стадиях роста культуры и способствовала сохранению жизнеспособности бактерий в макрофагах. Гиперэкспрессия малой некодирующей РНК MTS0997 не оказывала существенного влияния на способность клеток переживать стрессовые условия.
Малые РНК выполняют роль транскрипционных регуляторов у бактерий, позволяя клеткам быстро реагировать на изменяющиеся условия среды [1, 2]. Многие малые РНК обнаружены у патогенных видов бактерий, и показана их роль в развитии заболеваний [3]. Туберкулез является чрезвычайно распространенной инфекцией и занимает 9 место среди причин смертности населения в мире [4]. В России в 2018 г. диагностировано более 60 тысяч новых случаев активной формы туберкулеза [https://rospotrebnadzor.ru]. Возбудитель инфекции Mycobacterium tuberculosis может длительно сохраняться в организме, обуславливая латентную инфекцию, которая способна переходить в активную форму под влиянием снижения иммунного статуса [5]. Механизмы, позволяющие микобактериям избегать факторов иммунной защиты организма хозяина, длительно сохранять жизнеспособность в условиях стрессового воздействия при внутриклеточном персистировании и переходить из покоящегося состояния в активное, обуславливают успешность M. tuberculosis как возбудителя инфекции и являются предметом тщательного изучения. Считается, что малые РНК играют важную роль в приспособлении микобактерий к паразитическому образу жизни [6]. В настоящее время у M. tuberculosis с помощью биоинформационного анализа транскриптомных профилей предсказано несколько сотен малых РНК, часть из которых подтверждена экспериментально [3, 7]. Механизм регуляторного действия, однако, установлен лишь для нескольких из них.
Впервые функция малой РНК в M. tuberculosis была установлена для малой РНК mcr7 [8]. Она является одним из транскрипционных регуляторов в двухкомпонентной системе PhoPR, которая играет важную роль в проявлении вирулентных свойств микобактерий. Mcr7 изменяет трансляцию мРНК гена tatC, тем самым влияя на активность белка Tat (Twin Arginine Translocation protein), в результате чего нарушается секреция иммунодоминантного комплекса Ag85 и бета-лактамазы BlaC. В условиях дефицита железа и, в меньшей степени, при повреждении мембран и при окислительном стрессе, в клетке возрастает концентрация малой РНК MrsI (ncRv11846, mycobacterial regulatory sRNA in iron) [9]. Посредством прямого связывания с мРНК она регулирует экспрессию железо-связывающих белков, подготавливая бактерию к существованию внутри клетки хозяина. 6C – еще одна малая РНК, для которой недавно доказан механизм действия, имеет сайт связывания с мРНК гена panD, кодирующего аспартатдекарбоксилазу, и с мРНК гена dnaB, кодирующего репликативную ДНК-хеликазу [10]. В результате взаимодействия репрессируется трансляция кодируемых белков, что приводит к замедлению роста бактерий.
Особое внимание привлекают малые РНК, индуцируемые во время инфекции. Изучение их функции может приблизить нас к пониманию механизмов патогенеза туберкулеза. К таким малым РНК относятся MTS0997 (MTB000063, mcr11) и MTS1338 (MTB000077, DrrS), которые и стали предметом исследования в работе [1, 11]. Эти малые РНК присутствуют только у патогенных видов микобактерий (M. tuberculosis complex), имеют стабильную вторичную структуру и высоко консервативны. Впервые они были обнаружены при анализе тотального транскриптома M. tuberculosis методом RNA-seq и подтверждены Нозерн-блоттингом [12].
Изучение этих малых РНК выявило некоторые закономерности их транскрипции, постранскрипционных модификаций и деградации, но механизм их действия и роль в патогенезе инфекции до сих пор не известны. MTS0997 и MTS1338 накапливаются в клетках в стационарной фазе роста, а в моделях инфекции мышей, восприимчивых к туберкулезу, уровни транскрипции данных малых РНК возрастают многократно и сравнимы с уровнем 16S рРНК [12]. Это позволяет предположить, что они регулируют ответ на стрессовое воздействие, которое микобактерии испытывают после фагоцитоза в организме хозяина.
Экспрессия малой РНК MTS0997 зависит от фазы роста микобактерий, а также от условий: уровень повышается при голодании и снижается при выращивании в кислой среде [13]. РНК MTS0997 функционально связана со смежными генами – Rv1264 и Rv1265. Rv1265 кодирует ДНК-, АТФ-связывающий белок (AbmR), увеличивающий экспрессию Mcr11 в стационарной фазе роста [14]. Предполагаемые мишени MTS0997 – мРНК генов Rv3282, fadA3 и lipB, вовлеченных в липидный метаболизм [15]. При выращивании M. tuberculosis и M. bovis в среде без источников жирных кислот штаммы с делецией малой РНК MTS0997 отставали в росте. РНК MTS1338 является очень стабильным транскриптом, время полужизни которого составляет 6 ч [16], ее экспрессия функционально связана с регулоном DosR, активирующемся при стрессовом воздействии оксида азота, свободных радикалов кислорода и гипоксии. Было показано, что малые РНК MTS0997 и МТS1338 высокоэкспрессированы в покоящихся “некультивируемых” клетках M. tuberculosis in vitro, гиперэкспрессия этих малых РНК в клетках приводит к замедлению их роста в стандартных условиях in vitro [17].
Полученные данные указывают на возможную роль малых РНК MTS0997 и МТS1338 во взаимодействии “патоген-хозяин”, в первую очередь при адаптации микроорганизмов к персистированию внутри макроорганизма. Попадая в организм человека, микобактерии фагоцитируются макрофагами, где они способны сохранять жизнеспособность на протяжении длительного времени, несмотря на агрессивную внутриклеточную среду: продукцию NO, окислительный стресс, низкие значения рН (до 5.5), а также недостаток питательных веществ.
Цель работы – изучение влияния гиперэкспрессии малых РНК MTS1338 и MTS0997 на выживаемость M. tuberculosis в условиях стресса.
МЕТОДИКА
Культивирование бактерий. Бактерии M. tuberculosis штамм H37Rv (“ЦНИИ Туберкулеза”, Россия) выращивали в жидкой среде Сотона (г/ л дистиллированной воды: L-аспарагин – 4, KH2PO4 – 0.5, MgSO4 – 1.4, железо лимоннокислое аммиачное – 0.05, натрий лимоннокислый трехзамещенный – 2, ZnSO4 – 0.1, глицерин – 60 мл, pH 7.2) в присутствии ростовой добавки альбумин-декстроза-каталаза (АДК, “HiMedia”, Индия), 0.05% твина-80 при 37°С. Культивирование проводили при перемешивании (200 об./мин) в течение 7 сут до достижения логарифмической фазы роста (оптическая плотность ОП600 = 1–1.5) или в течение 15–16 сут до достижения стационарной фазы роста (ОП600 > 10). Для штаммов, содержащих плазмиду, в среду вносили канамицин до конечной концентрации 50 мкг/мл. Исходная концентрация бактерий определялась посевом культуры на чашки с плотной питательной средой Миддлбрука 7H11 с ростовой добавкой АДК.
Гиперэкспрессия малых РНК. Штамм M. tuberculosis H37Rv трансформировали посредством электропорации плазмидой pMV-261, содержащей вставку с геном малой РНК MTS0997 (0997over) или малой РНК MTS1338 (1338 over), под микобактериальным промотором rrnB. Плазмиды были получены как описано ранее [17]. Гиперэкспрессия была подтверждена методом количественной ПЦР, сопряженной с обратной транскрипцией (ОТ-ПЦР).
Для выделения РНК клетки бактерий быстро охлаждали на льду, центрифугировали, тотальную РНК выделяли методом фенол-хлороформной экстракции, как описано ранее [18]. Клетки разрушали с помощью кремний-циркониевых бус на дезинтеграторе BeadBeater (“BioSpec Products”, США). После выделения РНК образцы обрабатывали ДНКазой I Turbo DNase (“Life Technologies”, США) для удаления примеси геномной ДНК. Для синтеза комплементарной ДНК (кДНК) использовали 1 мкг тотальной РНК, гексануклеотидные праймеры Random(dN)6 и обратную транскриптазу SuperScript III (“Life Technologies”, США) в соответствии с протоколом изготовителя. Количественную ПЦР проводили с использованием смеси реагентов qPCRmix-HS SYBR (“Evroge” Россия) и амплификатора LightCycler 480 (“Roche”, Швейцария). Условия амплификации: 20 с при 95°С, 20 с при 61°С, 30 с при 72°С, 40 циклов. Все опыты были сделаны в трех повторностях. Данные ПЦР в реальном времени обсчитывали с помощью программ LightCycler480, LC480 Conversion, LinRegPCR и Microsoft Excel. Уровень экспрессии генов малых РНК нормировали по референсному гену 16S рРНК.
Праймеры для ОТ-ПЦР:
qPCR_MTS1338_for GGGGAAACCCGGTGATCTG; qPCR_MTS1338_rev GGTAGGTCAAACCGGGTGTACAT; qPCR_MTS0997_for GAAGCAGGCCCGGTTAGTGA; qPCR_MTS0997_ rev GGCAGACCCGGCGTGACT; 16S_MTB_for TACGTAGGGTGCGAGCGTTG; 16S_MTB_rev CCCGCACGCTCACAGTTAAG.
Стрессовое воздействие. Воздействие стресса изучали, используя штамм M. tuberculosis H37Rv трансформированный плазмидой pMV-261, содержащей вставку с геном малой РНК MTS0997 (0997over) или малой РНК MTS1338 (1338over), в качестве контроля использовали штамм M. tuberculosis H37Rv трансформированный плазмидой pMV-261 без вставки. Клетки M. tuberculosis, собранные в логарифмической фазе роста (7 сут культивирования), отмывали 10 мМ фосфатно-солевым буферным раствором рН 7.4 (ФСБР) и разводили в свежей среде Сотона с ростовой добавкой АДК до оптической плотности (ОП600) 0.2, после чего добавляли Н2О2 в концентрации 5 мМ для создания условий окислительного стресса, донор оксида азота – диэтилентриамин-NO (Д-ЕТА-NO) (“Sigma”, США) в конечной концентрации 500 мкМ для создания нитрозативного стресса. Для создания кислотного стресса клетки разводили в свежей среде Сотона с ростовой добавкой АДК и рН 5.8 до оптической плотности 0.2 (OП600).
Клетки культуры осаждали при 4000 g и отмывали ФСБР, а затем разводили до оптической плотности 0.2 (OП600) в собственном супернатанте с добавлением стрессовых агентов: Н2О2 (10 мМ) или ДЕТА-NO (500 мкМ). Для кислотного стресса отмытые культуры разводили в свежей среде Сотона с ростовой добавкой AДК и 0.05% твина-80, с рН 5.8. Бактерии инкубировали со стрессовыми агентами в течение 48 ч при 37°С и перемешивании (200 об./мин). Для создания условий ограничения питательных веществ бактерии помещали в ФСБР на 28 сут при 37°С в статическом режиме.
Стрессовое воздействие оценивали по изменению уровня метаболической активности клеток, которую, в свою очередь, оценивали по уровню включения радиоактивно меченого урацила. Для этого 2 мкл 5,6,-[3H]-урацила (2 мкКи) добавляли к 1 мл культуры и инкубировали 20 ч при 37°С и перемешивании. Затем 200 мкл культуры помещали в 7%-ный раствор уксусной кислоты на 15 мин при 0°С, после чего осаждали фильтрованием на стекловолоконном микрофильтре (“Whatman”, США). Осажденные клетки промывали 3 мл 7%‑ной уксусной кислоты и 3 мл 96%-ного этанола. Фильтр помещали в сцинтилляционную жидкость Ultima Gold (“PerkinElmer”, США), подсчет импульсов осуществляли с помощью жидкостного сцинтилляционного счетчика LS analyser (“Beckman Instruments Inc.”, США). Выживаемость бактерий оценивали по изменению КОЕ при посеве на плотную питательную среду в сравнении с контрольным образцом без стрессового воздействия. Каждый опыт был сделан в трех повторностях.
Инфекция макрофагов. Культуру клеток моноцитов человека THP-1 (ATCC #TIB-202). Клеточная линия была предоставлена Копниным П.Б. (НИИ Канцерогенеза “Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина” Минздрава России, лаборатория цитогенетики) высевали в 24-луночные планшеты (“Costar”, США) и дифференцировали в присутствии 100 нг/мл форбол-12-меристат-13-ацетата (ФМА, “Sigma-Aldriсh”, США) в течение 48 ч в среде RPMI-1640 (“Gibco BRL”, США), с 10% фетальной телячьей сыворотки (ФТС) (“Gibco BRL”, США) при 5%-ном CO2, 37°C. Бактерии выращивали до логарифмической фазы роста (ОП600 = 0.5–1) в питательной среде Миддлбрука 7H9 с ростовой добавкой АДК, содержащей канамицин (50 мкг/мл) и твин-80 (0.05%). Клетки отделяли центрифугированием при 4000 g и отмывали ФСБР, затем ресуспендировали в среде R-PMI-1640 и проводили инфицирование при 37°C в течение 4 ч. Заражение проводили в лунках 24-луночного планшета (500 мкл), используя различную концентрацию бактерий (MOI 2.0 и 0.5 – множественность инфицирования макрофагов: микобактерии 1 : 2 и 1 : 0.5). После фагоцитирования макрофаги отмывали от непоглощенных микобактерий ФСБР 5 раз, далее через 4, 24, 48, и 72 ч от начала инфекции проводили лизис макрофагов 0.05%-ным раствором ДДС-Na 30 мин при 37°С и высевали микобактерии на плотную среду Миддлбрука с АДК для подсчета КОЕ. Бактерии выращивали при 37°С в течение 20–22 сут. Каждый опыт был сделан в трех повторностях.
Статистическую обработку данных проводили с помощью непарного t теста Стьюдента. За статистически достоверные принимались значения с p < 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В цитоплазме макрофагов в организме хозяина микобактерии подвергаются целому ряду стрессовых воздействий: кислая среда, перекисное окисление, присутствие оксида азота NO и нехватка питательных веществ. Изучено влияние этих стрессовых факторов на клетки M. tuberculosis, гиперэкспрессирующие малые РНК MTS0997 и MTS1338, в логарифмической и в стационарной фазе роста in vitro. Для экспрессии экзогенных копий малых РНК использовали модифицированный плазмидный вектор pMV261, содержащий ген исследуемой малой РНК под контролем промотора гена rrnB, который обеспечивает высокий уровень транскрипции [17]. Клетки M. tuberculosis трансформировали этим вектором, в качестве контроля использовали плазмиду без вставки (пустой вектор). Для подтверждения гиперэкспрессии малых РНК в полученных штаммах проводили количественную ОТ-ПЦР, которая показала, что количество транскриптов MTS0997 в логарифмической фазе роста культуры увеличивалось в 5–6 раз, MTS1338 – в 8–10.
Стрессовое воздействие на клетки, собранные в логарифмической фазе роста, оценивали путем высева на плотную питательную среду и подсчета КОЕ, сравнивая с величинами КОЕ контрольного образца клеток, не подвергавшегося стрессовому воздействию (рис. 1), а также по изменению метаболической активности клеток, регистрируемой по уровню включения радиоактивно меченного 3Н-урацила (рис. 2). Для штаммов, не подвергавшихся стрессовым воздействиям, уровень включения урацила был принят за 100%.
Рис. 1.
Выживаемость клеток M. tuberculosis логарифмической фазы роста штаммов 099 over, 1338 over и контрольного 48 ч без стрессового воздействия (1), в кислой среде (2), в присутствии Н2О2 (3) и через 28 сут голодания в фосфатно-солевом буферном растворе (4).
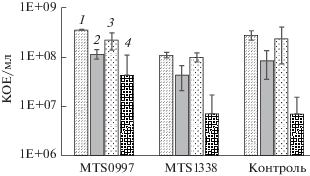
Рис. 2.
Уровни включения 3Н-урацила в клетки M. tuberculosis 0997over, 1338 over и контрольного штамма (в % к штамму без воздействия) через 48 ч после воздействия NO (1), кислой среды (2), Н2О2 (3) и через 28 сут голодания в фосфатно-солевом буферном растворе (4) для клеток в логарифмической (а) и стационарной (б) фазы роста.
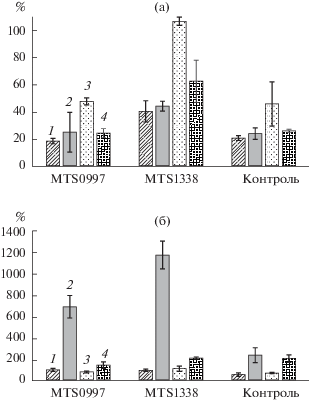
Сравнение величин КОЕ обнаружило, что низкие значения рН среды и длительное голодание в ФСБР негативно влияли на выживаемость бактерий. При сравнении КОЕ клеток, подвергшихся стрессовому воздействию, с контрольным образцом, можно заметить, что относительное снижении выживаемости было минимальным у штамма с гиперэкспрессией MTS1338 (рис. 1). Следует отметить, что пероксид водорода не оказывал существенного действия на выживаемость клеток контрольного штамма и штаммов с гиперэкспрессией MTS0997 и MTS1338, однако изменял уровень включения радиоактивно меченного 3Н-урацила (рис. 2а).
Все три штамма демонстрировали снижение уровня включения 3Н-урацила в присутствии Н2О2, однако штамм с гиперэкспрессией MTS1338 был наименее подвержен окислительному стрессу – уровень включения 3Н-урацила был сравним с таковым в отсутствии стресса. Наиболее выраженное воздействие на все исследуемые штаммы M. tuberculosis оказывал оксид азота(II). Штамм с гиперэкспрессией малой РНК MTS1338 был более устойчив к NO, чем контрольный штамм, статистически достоверных различий между штаммом, гиперэкспрессирующим MTS0997, и контрольным штаммом не было выявлено. При инкубировании бактерий в кислой среде выживаемость M. tuberculosis падала, что подтверждалось снижением уровня включения урацила. В условиях длительного голодания штамм с гиперэкспрессией малой РНК MTS1338 также демонстрировал значительную устойчивость.
При оценке изменения метаболической активности клеток стационарной фазы роста было обнаружено, что все исследуемые штаммы микобактерий были более устойчивы к воздействию стрессовых факторов по сравнению с клетками в логарифмической фазе роста (рис. 2б). Следует отметить, что культивирование в среде с низким значением рН приводило к значительной активации клеток и их делению. Вероятно, это связано с выделением микобактериями ионов аммония в результате работы таких ферментов, как аспарагиназа (Rv1538c), моноаминоксидаза (Rv3170) или деаминаза (Rv0828c) [19], что приводило к защелачиванию среды и формированию благоприятных для роста условий. При этом метаболическая активность штаммов с гиперэкспрессией малых РНК спустя 48 ч была значительно выше исходных значений (до воздействия стресса), что более выражено для гиперэкспрессии MTS1338.
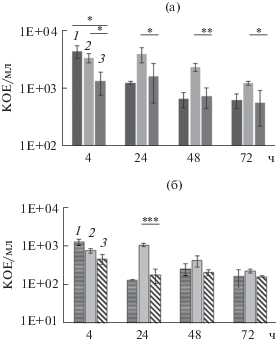
Рис. 3.
Выживаемость M. tuberculosis штаммов 0997over (1), 1338 over (2) и контрольного штамма (3) внутри макрофагов при MOI = 2 (а) и MOI = 0.5 (б); * p < 0.05, ** p < 0.01, *** p < 0.001.
Ранее было показано, что экспрессия малой РНК MTS0997 снижается в кислой среде и при воздействии оксида азота, и повышается при голодании [13], при этом накопление малой РНК не изменялось в условиях гипоксии [20]. Таким образом, дифференциальная экспрессия малой РНК MTS0997 в условиях стресса указывала на возможное ее участие в процессах адаптации. Показано, что индуцированное увеличение синтеза РНК MTS0997 в клетке существенно не отражалось на ее выживаемости в этих условиях. Напротив, гиперэкспрессия MTS1338 приводила к повышению устойчивости бактерии к стрессу, что подтвердили данные о ее роли в патогенезе M. tuberculosis [12, 21].
При экспериментальном заражении мышей M. tuberulosis в бактериальном транскриптоме накапливаются малые РНК MTS1338 и MTS0997 в высоких концентрациях, сравнимых с рибосомными РНК [12, 21]. Кроме того, экспрессия MTS1338 повышается в макрофагах, активированных γ-интерфероном [11].
Чтобы оценить вклад малых РНК в способность микобактерий приспосабливаться к внутриклеточному существованию, проводили инфекцию макрофагов человека штаммами M. tuberculosis H37Rv, гиперэкспрессирующими малые РНК MTS1338 и MTS0997. Культуру клеток THP-1, дифференцированную в макрофаги, инфицировали бактериями с MOI 2.0 и 0.5 и определяли выживаемость бактерий в разное время по высеву на твердую среду. Гиперэкспрессия MTS1338 положительно влияла на выживаемость микобактерий внутри макрофагов во всех временных точках, наиболее ярко эффект проявился при MOI 2.0. Для штамма, гиперэкспрессирующего MTS0997, не было выявлено достоверной разницы выживаемости бактерий при инфекции.
Суммируя полученные результаты, можно сделать вывод, что существует связь малой РНК MTS1338 с адаптацией микобактерии к персистированию внутри макрофагов во время инфекции M. tuberculosis. Механизм действия данной малой РНК может быть выяснен с помощью дальнейшего изучения профилей транскрипции M. tuberculosis под действием стрессовых факторов, аналогичным тем, которые бактерии испытывают в среде макроорганизма.
Исследование выполнено при финансовой поддержке гранта Российского научного фонда (проект № 18-15-00332).
Список литературы
Ажикина Т.Л., Игнатов Д.В., Салина Е.Г., Фурсов М.В., Капрельянц А. С. // Успехи биологической химии. 2015. Т. 55. С. 3–32.
Gottesman S., Storz G. //Cold Spring Harb. Symp. Quant. Biol. 2011. V. 71. P. 1–16.
Haning K., Cho S.H., Contreras L.M., Murphy E.R. // Front. Cell. Infect. Microbiol. 2014. V. 4. P. 1–11.
World Health Organization. Geneva: Global Tuberculosis Report, 2019. 283 p. ISBN 978-92-4-156571-4.
Dye C. // Lancet. 2006. V. 367. № 9514. P. 938–940.
Schwenk S., Arnvig K.B. //Pathog. Dis. 2018. V. 76. № 4. P. 1–12.
Namouchi A., Gómez-Muñoz M., Frye S.A., Moen L.V., Rognes T., Tønjum T., Balasingham S.V. // BMC Genomics. 2016. V. 17. № 1. P. 1–13.
Solans L., Gonzalo-Asensio J., Sala C., Benjak A., Uplekar S., Rougemont J., Guilhot C., Malaga W., Martı’n C., Cole S.T. // PLoS Pathog. 2014. V. 10. № 5. P. 1–17.
Gerrick E.R., Barbier T., Chase M.R., Xu R., François J., Lin V.H., Szucs M.J., Rock J.M., Ahmad R., Tjaden B., Livny J., Fortune S.M. // Proc. Natl. Acad. Sci. 2018. V. 115. № 25. P. 6464–6469.
Mai J., Rao C., Watt J., Sun X., Lin Z., Zhang L., Liu J. // Nucleic Acids Res. 2019. V. 47. № 8. P. 4292–4307.
Salina E.G., Grigorov A., Skvortsova Y., Majorov K., Bychenko O., Ostrik A., Logunova N., Ignatov D., Kaprelyants A., Apt A., Azhikina T. // Front. Cell. Infect. Microb-iol. 2019. V. 9. № 405. P. 1–11.
Arnvig K.B., Comas I., Thomson N.R., Houghton J., Boshoff H.I., Croucher N.J., Rose G., Perkins T., Parkhill J., Dougan G., Young D.B. // PLoS Pathog. 2011. V. 7. № 11. P. 1–16.
Pelly S., Bishai W.R., Lamichhane G. // Gene. 2012. V. 500. № 1. P. 85–92.
Girardin R.C., Bai G., He J., Sui H., McDonough K.A. // Mol. Microbiol. 2018. V. 110. № 5. P. 811–830.
Girardin R.C., McDonough K.A. // Mol. Microbiol. 2019. V. 111. № 5. P. 1–17.
Moores A., Riesco A.B., Schwenk S., Arnvig K.B. // PLoS One. 2017 V. 12. № 3. P. 1–27.
Ignatov D.V., Salina E.G., Fursov M.V., Skvortsov T.A., Azhikina T.L., Kaprelyants A.S. // BMC Genomics. 2015. V. 16. № 1. P. 1–13.
Rustad T.R., Roberts D.M., Liao R.P., Sherman D.R. // Methods Mol. Biol. 2009. V. 465. P. 13–21.
Shleeva M.O., Kudykina Y.K., Vostroknutova G.N., Suzina N.E., Mulyukin A.L., Kaprelyants A.S. // Tuberculosis. 2011. V. 91. № 2. P. 146–154.
DiChiara J.M., Contreras-Martinez L.M., Livny J., Smith D., McDonough K.A., Belfort M. // Nucleic Acids Res. 2010. V. 38. № 12. P. 4067–4078.
Игнатов Д.В., Логунова Н.Н., Ажикина Т.Л. // Биоорг. химия. 2014. Т. 40. № 2. С. 253–256.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


