Прикладная биохимия и микробиология, 2019, T. 55, № 6, стр. 535-541
Формирование сопутствующего окислительного стресса в клетках Escherichia coli, подвергнутых действию различных экологических стрессоров
А. В. Ахова 1, *, П. А. Секацкая 1, А. Г. Ткаченко 1
1 Пермский федеральный исследовательский центр УрО РАН,
Институт экологии и генетики микроорганизмов УрО РАН
614081 Пермь, Россия
* E-mail: akhovan@mail.ru
Поступила в редакцию 20.03.2019
После доработки 24.05.2019
Принята к публикации 20.06.2019
Аннотация
Воздействие таких стрессовых факторов, как этанол, уксусная кислота и хлорид натрия, вызывало накопление в клетках Escherichia coli пероксида водорода и активацию экспрессии генов антиоксидантной защиты OxyR-регулона. Развитие сопутствующего окислительного стресса зависело от природы и интенсивности воздействия стрессового фактора. Определение изменения чувствительности клеток к внешним воздействиям в присутствии антиоксиданта тиомочевины, нейтрализующей активные формы кислорода, показало их вовлеченность в действие осмотического и кислотного стресса. При внесении антиоксиданта наблюдалось замедление скорости гибели клеток, подвергнутых летальному стрессу (снижение КОЕ в культуре до <0.01% от исходного количества), и уменьшение жизнеспособности клеток при отсутствии активации экспрессии антиоксидантных генов в условиях менее интенсивного воздействия (снижение КОЕ до 10–0.01%). Можно предположить, что в зависимости от интенсивности стресса активные формы кислорода могут выступать либо как повреждающий агент, либо как сигнал к запуску защитных механизмов. Клетки, культивируемые в микроаэробных условиях, были более устойчивы к нагреванию и более чувствительны к воздействию уксусной кислоты по сравнению с клетками, выращенными в условиях более интенсивной аэрации.
Бактерии нередко оказываются под действием факторов и условий, способных вызвать окисление компонентов клеток. Основными прооксидантами являются ионизирующее излучение и свободные радикалы, которые в аэробных условиях представлены, в основном, активными формами кислорода (АФК). Источники АФК могут находиться как вне организма (излучения и редокс-активные соединения, а также АФК, образованные другими организмами), так и в самой микробной клетке (активность компонентов дыхательной электрон-транспортной цепи и L-аспартат оксидазы) [1–3]. Справляться с окислительным повреждением микроорганизмам позволяют сформировавшиеся в ходе эволюции механизмы адаптации, в том числе ферменты детоксикации АФК, устойчивые к окислению изоформы белков, малые антиоксидантные молекулы, системы репарации, системы выведения ксенобиотиков из клетки и ограничения транспорта в клетку. Гены антиоксидантной защиты объединены в регулоны под контролем транскрипционных регуляторов, активность которых зависит от окислительно-восстановительного статуса клетки, что обеспечивает согласованный и адекватный ответ на окислительное повреждение [4]. В случае смещения равновесия в системе “прооксиданты-антиоксиданты” в сторону прооксидантов в клетке происходит развитие окислительного стресса. Накопление свободных радикалов до уровня, превосходящего возможности антиоксидантных систем, вызывает повреждение основных макромолекул, что в крайнем случае может привести к гибели микроорганизма.
Признаки развития окислительного стресса обнаруживаются в клетках, подвергнутых воздействию различных стрессовых факторов, основной механизм повреждающего действия которых не ассоциируется с окислением клеточных компонентов. Накопление АФК, активация защитного ответа на окислительный стресс и/или окислительное повреждение макромолекул были отмечены в клетках, подвергнутых действию антибиотиков [5–8], гиперосмотического шока [9, 10], кислотного стресса [11, 12], нагревания [9, 13] и голодания по источнику углерода [13]. Таким образом, в неблагоприятных условиях среды помимо специфического повреждающего действия стрессового фактора может наблюдаться развитие, так называемого, вторичного (сопутствующего) окислительного стресса [14].
В последнее десятилетие большое внимание уделяется изучению вклада увеличения внутриклеточной продукции АФК в гибель бактериальных клеток под действием антибиотиков как потенциального способа повышения эффективности антибиотикотерапии и борьбы с резистентными формами. Развитие вторичного окислительного стресса в условиях воздействия высоких концентраций NaCl, короткоцепочечных жирных кислот и высокой температуры важно с точки зрения пищевой микробиологии, одним из направлений которой является поиск дополнительных факторов, способных усиливать антибактериальное действие основных способов обработки пищевых продуктов [15].
Если развитие вторичного окислительного стресса подтверждено, то единое мнение о его вкладе в антибактериальное действие стрессоров отсутствует. В большом количестве современных работ продемонстрирована вовлеченность АФК в антибактериальное действие антибиотиков [6, 8, 16], хотя имеются и работы, подвергающие сомнению роль окислительного повреждения как общего механизма гибели клеток под их действием [17]. Исследований, посвященных вкладу АФК в гибель клеток под действием естественных стрессовых факторов, не так много, но на их основе можно предположить участие АФК в антибактериальном действии осмотического, кислотного и теплового стрессов [18–20].
Цель работы – изучение развития вторичного окислительного стресса в бактериальных клетках, подвергнутых неблагоприятному действию внешних факторов различной интенсивности, и оценка вклада продукции АФК в эффективность антибактериального действия естественных стрессоров.
МЕТОДИКА
Микроорганизмы и условия культивирования. В работе использованы штаммы E. coli BGF940 и BGF931 генотипов MC4100 λ oxyR'::lacZ и RK4936 λ katG'::lacZ, соответственно [21], любезно предоставленные профессором Б. Демплом (Stony Brook University Medical School, Стоуни-Брук, США).
Клетки E. coli, поддерживаемые на скошенной агаризованной среде Луриа-Бертани (“Sigma”, США), переносили в пробирки с 5 мл бульона Луриа-Бертани (LB-бульон, “Amresco”, США) и культивировали без перемешивания в течение 4–6 ч при 37°C. Затем клетки переносили в колбы Эрленмейера (объемом 250 мл) с 50 мл LB-бульона или среды М9 с добавкой 0.4% глюкозы, в соотношении 1 : 1000 и культивировали без перемешивания или с перемешиванием на термостатируемом шейкере GFL 1092 (“GFL”, Германия) в течение 14–16 ч при 37°C. Ночную культуру разводили в свежей питательной среде до оптической плотности 0.1 и культивировали в LB-бульоне (рис. 2) или в среде М9 с добавкой 0.4% глюкозы без перемешивания (рис. 3) или при перемешивании (100 об./мин) (рис. 1). Стрессоры добавляли после достижения культурой оптической плотности 0.3.
Рис. 1.
Изменение экспрессии гена katG в клетках E. coli BGF931 нестрессированной культуры (1, контроль), а также в клетках, подвергнутых осмотическому стрессу (а) после внесения 10 (2), 50 (3), 150 (4) и 300 (5) мг/мл хлорида натрия, кислотному стрессу (б) после внесения 0.5 (6), 1.5 (7) и 2.0 (8) мг/мл уксусной кислоты или этанольному стрессу (в) после внесения 60 (9), 70 (10), 90 (11) и 140 (12) мг/мл этанола.
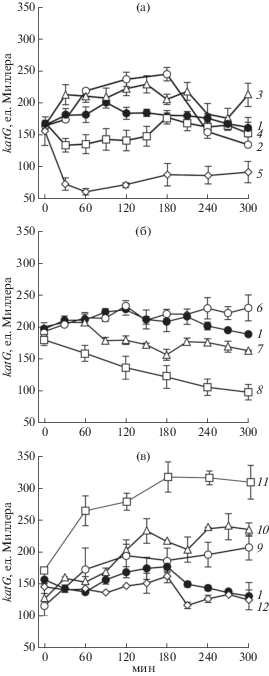
Рис. 2.
Уровень экспрессии гена katG в клетках E. coli BGF931 (а) и количество КОЕ (б, в) в нестрессированной культуре (1, контроль) и после воздействия 30 (2), 70 (3), 200 (4) и 300 (5) мг/мл хлорида натрия (осмотический стресс), а также 1 (6), 2 (7) и 5 (8) мг/мл уксусной кислоты (кислотный стресс) и нагревания при 50 (9) и 55 (10)°С (тепловой стресс) при культивировании без перемешивания (I) и с перемешиванием при 200 об./мин (II). Отсутствие статистически значимого отличия от соответствующего контроля (1) обозначено *, а статистически значимое отличие от аналогичной культуры, выращенной без перемешивания, обозначено +.

Рис. 3.
Уровень экспрессии гена oxyR в клетках E. coli BGF940 (а) в нестрессированной культуре (1, контроль) и после воздействия 50 (2) и 150 (3) мг/мл хлорида натрия, 1.5 (4) и 2 (5) мг/мл уксусной кислоты и 60 (6) и 90 (7) мг/мл этанола в течение 1 ч (I) и 4 ч (II) и влияние добавки 50 мМ тиомочевины (+ТМ) на экспрессию oxyR, активированную внесением 150 мг/мл хлорида натрия (б, 3). Статистически значимое отличие от контроля (а) и статистически значимое отличие от аналогичной культуры, выращенной без добавки тиомочевины (б) обозначены *.

При изучении влияния тиомочевины (“Sigma”, США) на выживаемость ночную культуру разводили в свежей среде М9 с добавкой 0.4% глюкозы (50 мл) до оптической плотности 0.1 и культивировали без перемешивания в течение 2 ч. Затем равные объемы культуры переносили в пробирки, содержащие тиомочевину/воду, в которые после 10 мин инкубации добавляли стрессоры (конечный объем 5 мл), и инкубировали без перемешивания при 37°C.
Оптическую плотность бактериальных культур (OП600) измеряли по величине абсорбции на 600 нм с использованием спектрофотометра UV-1650PC (“Shimadzu”, Япония).
Экспрессия генов. Уровень экспрессии генов оценивали по активности β-галактозидазы в клетках, несущих слияние промотора исследуемого гена со структурной частью гена lacZ, методом Миллера. Активность определяли в клетках, предварительно обработанных смесью ДДС-Na и хлороформа, с применением орто-нитрофенил-β-галактопиранозида (“Sigma”, США) в качестве субстрата [22].
Выживаемость бактерий. Готовили несколько последовательных разведений бактериальной культуры в физрастворе, высевали в чашки Петри по 10 мкл суспезии клеток на LB-агар и инкубировали в течение 16–18 ч при 37°C, после чего подсчитывали количество колониеобразующих единиц (КОЕ).
Продукция H2O2 бактериальными клетками. Для определения количества H2O2, выделяемой бактериальными клетками в среду культивирования, использовали флуоресцентный краситель Amplex red (“Invitrogen”, США) в реакции с пероксидазой хрена (“Sigma”, США). Культуру (0.5 мл) центрифугировали при 16 000 g в течение 2 мин, супернатант замораживали. Реакцию проводили в соответствии с рекомендациями производителя. Флуоресценцию (530/590 нм) измеряли с использованием мультимодального планшетного ридера Infinity M200 (“Tecan”, Швейцария).
Статистическая обработка результатов. Обработка результатов была проведена с использованием пакета программ Statistica 6.0 (“StatSoft Inc.”, США). Оценка статистической значимости различий средних сравниваемых групп проведена с использованием непарного t-критерия Стьюдента. Различия считали значимыми при p ≤ 0.05. На графиках отображены средние и стандартные ошибки среднего, рассчитанные на основе данных трех и более независимых экспериментов, за исключением рис. 2, на котором представлены средние и стандартные отклонения.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Развитие сопутствующего окислительного стресса в клетках E. coli, подвергнутых действию экологических стрессоров. Гиперосмотический стресс воспроизводили внесением в бактериальную культуру NaCl, кислотный стресс – добавлением уксусной кислоты. Этанол оказывал комплексное воздействие, вызывающее защитный ответ теплового шока и повреждения клеточной оболочки [23, 24]. В некоторых экспериментах тепловой шок воспроизводили путем нагревания среды. Были изучены микробные культуры, подвергнутые стрессам различной силы, которая оценивалась по изменению количества колониеобразующих единиц (КОЕ/мл) по сравнению со стартовой точкой в момент добавки стрессора. Таким образом, условно было выделено три уровня интенсивности стрессового воздействия (силы стресса): слабый стресс (ингибиторное действие), при котором количество КОЕ в культуре оставалось таким же как в момент добавки стрессора, средний – количество КОЕ уменьшалось, но оставалось на уровне не менее 103 КОЕ/мл, и летальный (бактерицидное действие) – количество КОЕ снижалось до нуля.
Для оценки вторичного окислительного стресса были измерены уровни продукции АФК и экспрессии генов защитного ответа на окислительный стресс в клетках, подвергнутых действию естественных стрессоров. Была изучена экспрессия гена katG, кодирующего каталазу, разлагающую перекись водорода, и гена oxyR, кодирующего транскрипционный регулятор. Оба эти гена входят в состав OxyR-регулона, экспрессия которого находится под контролем OxyR, переходящего в активную форму в результате окисления при непосредственном контакте с H2O2 [25]. Изменение экспрессии генов OxyR-регулона было изучено с использованием репортерных генных слияний промотора исследуемого гена со структурной частью гена lacZ, кодирующего β-галактозидазу, активность которой прямо пропорциональна уровню генной экспрессии.
Воздействие экологических стрессоров сопровождалось увеличением экспрессии изученных генов OxyR-регулона в клетках E. coli, которые выращивали на богатой или минимальной питательной среде при интенсивной аэрации или в микроаэробных условиях (рис. 1, 2а и 3). Единственным фактором, воздействие которого приводило к снижению экспрессии генов, оказалась повышенная температура. Увеличение температуры от 37 до 45–55°С сопровождалось пропорциональным снижением экспрессии генов (данные частично представлены на рис. 2а). Для всех стрессоров было характерно увеличение экспрессии антиоксидантных генов при стрессе слабой и средней силы, в то время как более сильное воздействие приводило к падению экспрессии ниже контрольного уровня. В клетках, подвергнутых действию NaCl и этанола, наблюдался более высокий уровень экспрессии по сравнению с действием ацетата. Активация антиоксидантных генов, как и проявление антибактериального действия при кислотном стрессе происходила позднее по сравнению с другими стрессовыми условиями (рис. 1, табл. 1).
Таблица 1.
Влияние антиокисданта тиомочевины на выживаемость E. coli BGF940 в условиях стрессового воздействия различных концентраций стрессоров (1–3): 1.5 (1), 3.5(2) и 6.0 (3) мМ Н2О2; 50 (1), 150 (2) и 300 (3) мг/мл NaCl; 1.5 (1), 2.0 (2) и 3.0 (3) мг/мл уксусной кислоты; 60 (1), 90 (2) и 120 (3) мг/мл этанола
| Стрессор | lg КОЕ/мл (среднее) | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | |||||||
| 1 ч | 4 ч | 24 ч | 1 ч | 4 ч | 24 ч | 1 ч | 4 ч | 24 ч | |
| Контроль* | 8.03 | 8.31 | 8.56 | – | – | – | – | – | – |
| Контроль + ТМ** | 8.03 | 8.17 | 8.44 | – | – | – | – | – | – |
| H2O2 | 7.57 | 7.80 | 8.64 | 5.82 | 6.01 | 8.51 | 5.24 | 0.83 | 0 |
| H2O2 + ТМ | 8.04 | 8.07 | 8.44 | 7.63 | 7.56 | 8.33 | 7.49 | 7.40 | 8.38 |
| NaCl | 7.67 | 7.78 | 5.95 | 6.91 | 5.79 | 2.83 | 5.40 | 3.52 | 0 |
| NaCl + ТМ | 7.63 | 7.11 | 6.20 | 6.05 | 4.73 | 1.05 | 6.09 | 4.38 | 0 |
| Уксусная к-та | 8.00 | 8.14 | 7.67 | 7.83 | 7.67 | 2.93 | 7.68 | 5.99 | 0 |
| Уксусная к-та + ТМ | 7.97 | 7.96 | 7.60 | 7.23 | 6.35 | 2.41 | 7.36 | 5.66 | 0 |
| EtOH | 7.90 | 7.68 | 6.96 | 7.91 | 7.65 | 4.67 | 6.13 | 1.20 | 0 |
| EtOH + ТМ | 7.66 | 7.87 | 7.03 | 7.61 | 7.61 | 4.62 | 5.44 | 1.31 | 0 |
Для оценки продукции АФК в клетках, подвергнутых действию внешних стрессоров, была измерена концентрация H2O2 в среде культивирования. К сожалению, удалось измерить накопление АФК только в клетках, подвергнутых субингибиторному кислотному и ингибиторному осмотическому стрессам, поскольку высокие концентрации уксусной кислоты и NaCl, присутствовавшие в реакционной смеси, ингибировали флуоресценцию красителя, по интенсивности которой оценивали концентрацию H2O2. Накопление АФК в среде по мере роста культуры не свидетельствует о повышении их продукции в клетке, поскольку количество выделяемой в среду H2O2 зависит от количества клеток. В связи с этим было проведено сравнение концентрации выделенной H2O2 за период времени, в течение которого количество клеток оставалось постоянным и одинаковым во всех изученных культурах (до 30 мин после добавления стрессора). Через 15 мин после внесения стрессора продукция H2O2 в клетках, подвергнутых осмотическому шоку, кислотному стрессу и нагреванию до 50°С, увеличивалась по сравнению с контролем примерно в 2.0, 5.0 и 1.5 раза, соответственно. Так, концентрация Н2О2 (мкМ, среднее значение ± стандартная ошибка среднего) в контроле составляла 21.0 ± 5.0, а при внесении 50 мг/мл NaCl или 0.5 мг/мл уксусной кислоты, или нагревании – 51.8 ± 3.4, 113.5 ± 49.0 и 35.6 ± 5.6 соответственно. Расчеты показали, что при нагревании отсутствовало статистически значимое отличие от контроля.
Вклад продукции АФК в гибель E. coli под действием экологических стрессоров. Одним из подходов к оценке вклада АФК в антибактериальное действие является сравнение выживаемости клеток при воздействии какого-либо фактора в условиях, приводящих к снижению/усилению внутриклеточной продукции АФК, и контрольных условиях.
Известно, что уровень внутриклеточной продукции АФК прямо пропорционален уровню аэрации среды, который, в свою очередь, зависит от интенсивности перемешивания [19]. При сравнении выживаемости клеток E. coli, культивируемых в микроаэробных условиях без перемешивания и в условиях интенсивного перемешивания (200 об./мин), не было обнаружено значительной разницы в действующих концентрациях стрессоров (рис. 2б). Тем не менее, скорость гибели клеток была различной в разных условиях аэрации. При высокой аэрации гибель клеток под действием теплового шока происходила быстрее, в то время как проявление летального эффекта кислотного стресса задерживалось примерно на 1 ч по сравнению с микроаэробными условиями (рис. 2в). Можно предположить, что наблюдаемое снижение чувствительности в условиях высокой аэрации связано с формированием преадаптации к кислотному стрессу, поскольку известно, что одна из систем кислотоустойчивости (cadAB) индуцируется в ответ на окислительный стресс [26]. В условиях проведенных экспериментов максимально возможная концентрация NaCl (300 мг/мл) не оказывала летального действия.
Другой способ оценки вклада АФК в антибактериальное действие за счет снижения их внутриклеточной концентрации основан на применении антиоксидантов. Например, в экспериментах с антибиотиками с этой целью применяют тиомочевину [6], способную нейтрализовать гидроксильные радикалы и перекись водорода [8, 27, 28]. Применение веществ и условий культивирования, способствующих снижению/повышению продукции АФК в клетках, часто приводит к замедлению скорости роста культуры, что может влиять на степень чувствительности микроорганизмов. Чтобы выявить вклад АФК были подобраны концентрации тиомочевины, полностью нейтрализующие летальное действие экзогенного пероксида водорода, но не оказывающие влияние на ростовые параметры контрольной культуры (табл. 1).
Изучение выживаемости культуры показало, что присутствие тиомочевины оказывало влияние на жизнеспособность клеток, подвергнутых действию кислотного и осмотического стрессов (табл. 1). Эффект антиоксиданта проявлялся только в условиях среднего и сильного стрессов, что позволило предположить, что продукция АФК при ингибиторном действии стрессора не играла значительной роли. Аналогичная закономерность была отмечена в экспериментах, в которых в качестве стрессовых факторов использовали антибиотики [6]. Уменьшение вторичного окислительного стресса сопровождалось усилением гибели клеток под действием экологического стресса средней силы и оказывало защитное действие в условиях летального стресса. Можно предположить, что в условиях летального стресса, в частности в случае воздействия NaCl, АФК вносили вклад в антибактериальный эффект, и снижение их количества при добавке антиоксиданта замедляло процесс гибели клеток. В то же время, усиление в присутствии антиоксиданта антибактериального эффекта стресса средней силы могло быть связано с сигнальной ролью АФК. Уменьшение в клетке содержания АФК до определенного уровня могло привести к отсутствию активации не только антиоксидантных систем (рис. 3б), но и других стрессовых ответов [29–31], что снижало адаптивные возможности клеток.
Таким образом, показано, что под действием естественных стрессовых факторов в клетках E. coli наблюдалось увеличение продукции АФК (H2O2) и повышение экспрессии антиоксидантных генов, входящих в OxyR-регулон (katG, oxyR), что свидетельствовало о развитии окислительного стресса. Признаки развития вторичного окислительного стресса обнаруживались в клетках, подвергнутых действию этанола, уксусной кислоты и NaCl. Снижение интенсивности вторичного окислительного стресса за счет добавки антиоксиданта (тиомочевина) показало, что продукция АФК не играла существенной роли в условиях слабого стресса (внешний стрессовый фактор ингибировал рост культуры, но не вызывал уменьшения количества КОЕ), но имела значение в условиях более сильного стресса, сопровождавшегося гибелью клеток. АФК в клетках, подвергнутых действию естественных стрессоров, могли выступать как в качестве повреждающих агентов, так и сигналов к запуску защитных механизмов. На основе полученных данных можно предположить, что выбор между этими двумя функциями определяется силой стресса. Замедление скорости отмирания культуры в условиях летального стресса в присутствии антиоксиданта, могло свидетельствовать с одной стороны о роли АФК как дополнительных повреждающих агентов, ответственных за гибель клеток, помимо специфического действия внешнего стрессора. С другой стороны, снижение жизнеспособности клеток, подвергнутых действию стресса средней силы, при уменьшении экспрессии генов антиоксидантной защиты, вызванной добавкой антиоксиданта, могло свидетельствовать о важности сигнальной роли АФК в этих условиях.
Авторы выражают искреннюю благодарность профессору Брюсу Демплу (Stony Brook University Medical School, Stony Brook, NY) за предоставленные штаммы E. coli.
Работа была выполнена в рамках государственного задания (№ госрегистрации темы: 01201353249) и при частичной финансовой поддержке Российского фонда фундаментальных исследований (проект № 16-34-00095).
Список литературы
Hassett D.J., Cohen M.S. // FASEB J. 1989. V. 3. № 14. P. 2574–2582.
González-Flecha B., Demple B. // J. Biol. Chem. 1995. V. 270. № 23. P. 13681–13687.
Korshunov S., Imlay J.A. // Mol. Microbiol. 2010. V. 75. № 6. P. 1389–1401.
Imlay J.A. // Annu. Rev. Biohem. 2008. V. 77. P. 755–776.
Albesa I., Becerra M.C., Battán P.C., Páez P.L. // Biochem. Biophys. Res. Commun. 2004. V. 317. № 2. P. 605–609.
Kohanski M.A., Dwyer D.J., Hayete B., Lawrence C.A., Collins J.J. // Cell. 2007. V. 130. № 5. P. 797–810.
Tkachenko A.G., Akhova A.V., Shumkov M.S., Nesterova L.Y. // Res. Microbiol. 2012. V. 163. № 2. P. 83–91.
Dwyer D.J., Belenky P.A., Yang J.H., MacDonald I.C., Martell J.D., Takahashi N., Chan C.T., Lobritz M.A., Braff D., Schwarz E.G., Ye J.D., Pati M., Vercruysse M., Ralifo P.S., Allison K.R., Khalil A.S., Ting A.Y., Walker G.C., Collins J.J. // Proc. Natl. Acad. Sci. USA. 2014. V. 111. № 20. P. 2100–2109.
Gunasekera T.S., Csonka L.N., Paliy O. // J. Bacteriol. 2008. V. 190. № 10. P. 3712–3720.
Bojanovič K., D’Arrigo I., Long K.S. // Appl. Environ. Microbiol. 2017. V. 83. № 7. pii: e03236-16.
Schellhorn H.E., Stones V.L. // J. Bacteriol. 1992. V. 174. № 14. P. 4769–4776.
Clements M.O., Watson S.P., Foster S.J. // J. Bacteriol. 1999. V. 181. № 13. P. 3898–3903.
Privalle C.T., Fridovich I. // Proc. Natl. Acad. Sci. USA. 1987. V. 84. № 9. P. 2723–2726.
Mols M., Abee T. // Environ. Microbiol. 2011. V. 13. № 6. P. 1387–1394.
Espina L., Somolinos M., Ouazzou A.A., Condón S., García-Gonzalo D., Pagán R. // Int. J. Food Microb. 2012. V. 159. № 1. P. 9–16.
Goswami M., Mangoli S.H., Jawali N. // Antimicrob. Agents Chemother. 2006. V. 50. № 3. P. 949–954.
Liu Y., Imlay J.A. // Science. 2013. V. 339. № 6124. P. 1210–1213.
Benov L., Fridovich I. // J. Bacteriol. 1995. V. 177. № 11. P. 3344–3346.
Mols M., Pier I., Zwietering M.H., Abee T. // Int. J. Food Microbiol. 2009. V. 135. № 3. P. 303–311.
Bruno-Bárcena J.M., Azcárate-Peril M.A., Hassan H.M. // Appl. Environ. Microbiol. 2010. V. 76. № 9. P. 2747–2753.
Ding H., Demple B. // Proc. Natl. Acad. Sci. USA. 1997. V. 94. № 16. P. 8445–8449.
Миллер Дж. Эксперименты в молекулярной генетике / М.: “Мир”, 1976. 436 с.
VanBogelen R.A., Kelley P.M., Neidhardt F.C. // J. Bacteriol. 1987. V. 169. № 1. P. 26–32.
Rowley G., Spector M., Kormanec J., Roberts M. // Nat. Rev. Microbiol. 2006. V. 4. № 5. P. 383–394.
Aslund F., Zheng M., Beckwith J., Storz G. // Proc. Natl. Acad. Sci. USA. 1999. V. 96. № 11. P. 6161–6165.
Kim J.S., Choi S.H., Lee J.K. // J. Bacteriol. 2006. V. 188. № 24. P. 8586–8592.
Randall L.O. // J. Biol. Chem. 1946. V. 164. № 2. P. 521–527.
Anbar M., Neta P. // Int. J. Appl. Radiat. Isot. 1967. V. 18. P. 493–523.
Dodd C.E., Richards P.J., Aldsworth T.G. // Int. J. Food Microbiol. 2007. V. 120. № 1–2. P. 46–50.
Fraud S., Poole K. // Antimicrob. Agents Chemother. 2011. V. 55. № 3. P. 1068–1074.
Ткаченко А.Г. // Прикл. биохимия и микробиология. 2018. Т. 54. № 2. С. 110–133.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


