Прикладная биохимия и микробиология, 2019, T. 55, № 5, стр. 513-520
Разработка иммуноферментного анализа для контроля суммарного содержания антибиотиков фторхинолонового ряда в молоке
И. А. Шанин 1, 2, Е. А. Зверева 3, С. А. Ерёмин 1, О. В. Свиридов 4, А. В. Жердев 3, Б. Б. Дзантиев 3, *
1 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
2 ООО “ХЕМА”
105264 Москва, Россия
3 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
4 Институт биоорганической химии Национальной академии наук Беларуси
220141 Минск, Беларусь
* E-mail: dzantiev@inbi.ras.ru
Поступила в редакцию 15.01.2019
После доработки 01.03.2019
Принята к публикации 22.04.2019
Аннотация
Предложен способ получения антител, специфически распознающих антибиотики группы фторхинолонов с одинаковым радикалом в первом положении хинолонового ядра. Охарактеризована специфичность кроличьих антисывороток, получаемых на разных циклах иммунизации при изменении структуры гаптена в составе иммуногенов. Отобранные антитела обеспечивали группоспецифический анализ 16 представителей фторхинолонов, в том числе суммы соединений – ципрофлоксацина, норфлоксацина, пефлоксацина, офлоксацина и энрофлоксацина, нормативно контролируемых в продукции животноводства. С использованием этих антител разработан непрямой конкурентный иммуноферментный анализ, характеризующийся пределом обнаружения ципрофлоксацина 0.2 нг/мл и продолжительностью 2 ч. Анализ апробирован для выявления фторхинолонов в молоке.
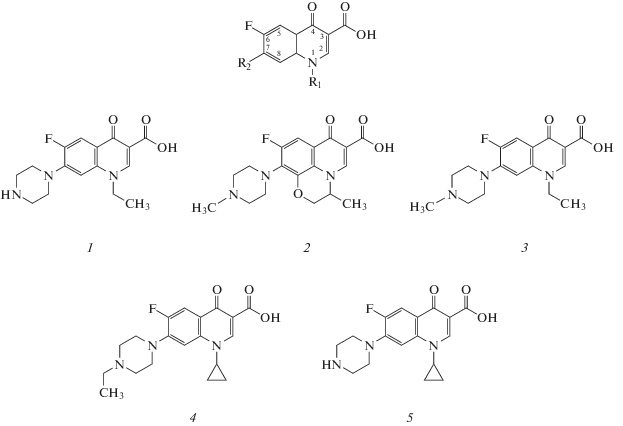
Фторхинолоны относятся к классу структурно близких синтетических противомикробных соединений (рис. 1), насчитывающий в настоящее время более 40 применяемых на практике веществ, список которых регулярно пополняется [1]. По механизму бактерицидного действия все фторхинолоны являются ингибиторами бактериальных ферментов, ДНК-гиразы и топоизомеразы II [2]. Фторхинолоны используются для лечения инфекций, вызванных грамотрицательными микроорганизмами и полирезистентными патогенами. В ветеринарии применяются лекарственные препараты на основе энрофлоксацина, флюмеквина, ломефлоксацина, офлоксацина, ципрофлоксацина, орбифлоксацина, дифлоксацина и марбофлоксацина [3, 4]. Токсическое действие фторхинолонов и риски их немедицинского попадания в организм человека с продуктами животноводства обусловили введение предельно допустимых уровней их содержания в продуктах питания [5]. Так, в странах ЕС в молоке установлен максимальный допустимый уровень (МДУ) 100 нг/мл на сумму энрофлоксацина и ципрофлоксацина [6], а в России такие же ограничения распространяются на сумму ципрофлоксацина, энрофлоксацина, пефлоксацина, офлоксацина и норфлоксацина (рис. 1) [7]. Доминирующие в современной практике хроматографические методы детекции фторхинолонов [8, 9] предполагают использование сложного дорогостоящего оборудования и в связи с этим непригодны для массового скрининга [10]. Поэтому необходимы чувствительные, производительные, быстрые, простые в применении и дешевые методики контроля суммарного содержания фторхинолонов в молоке и других продуктах питания. Наиболее эффективным решением данной проблемы стали иммунохимические методы и, в частности, иммуноферментный анализ (ИФА), активно разрабатываемые в последние годы для контроля содержания антибиотиков [11–14].
Рис. 1.
Общая формула фторхинолонов и структуры норфлоксацина (1), офлоксацина (2), пефлоксацина (3), энрофлоксацина (4) и ципрофлоксацина (5), которые нормативно контролируются в России.
Существует несколько методических подходов к разработке ИФА с групповой специфичностью, основанных на использовании либо антител, обладающих широкой специфичностью, либо смеси высокоселективных антител [15–22]. Преобладающий подход включает использование конъюгатов, получаемых при модификации вторичного атома азота пиперазинового радикала в 7-ом положении хинолонового ядра [15–18]. Однако существующие тест-системы позволяют детектировать лишь часть (не более 11–12) антибиотиков фторхинолонового ряда, что обуславливает необходимость разработки новых аналитических систем для одновременного контроля широкого спектра фторхинолонов в соответствии с принятыми нормативами.
Цель работы – получение антител для контроля суммы фторхинолонов и разработка методики ИФА, основанной на их использовании.
МЕТОДИКА
Химические вещества. В работе использовали данофлоксацин (ДАН), клинафлоксацин (КЛИ), моксифлоксацин (МОКС), офлоксацин (ОФЛ), гареноксацин (ГАР), пефлоксацин (ПЕФ), гатифлоксацин (ГАТ), сарафлоксацин (САР), ломефлоксацин (ЛОМ), тозуфлоксацин (ТОЗ), спарфлоксацин (СПА), дифлоксацин (ДИФ), пазуфлоксацин (ПАЗ), марбофлоксацин (МАР), руфлоксацин (РУФ), норфлоксацин (НОР), ципрофлоксацин (ЦИП), энрофлоксацин (ЭНР), пипемидиевую кислоту (ПИП), налидиксовую кислоту (НАЛ), оксолиниевую кислоту (ОКС), орбифлоксацин (ОРБ), эноксацин (ЭНО), надифлоксацин (НАД), флюмеквин (ФЛЮ), бычий сывороточный альбумин (БСА), овальбумин (ОВА), казеин, N-гидроксисукцинимид (ГСИ), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (ЭДК), 3,3',5,5'-тетраметилбензидин (ТМБ) и метанол (“Sigma-Aldrich”, США), а также антитела против IgG (H+L) кролика, меченные пероксидазой (“Медгамал”, Россия). Все вспомогательные реагенты (соли, кислоты, щелочи и органические растворители) – аналитической или химической чистоты.
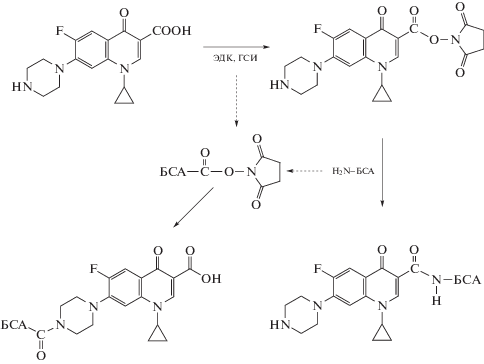
Синтез катионизированного БСА. Карбоксильные группы БСА модифицировали этилендиамином (по [23, 24] с изменениями). В 5 мл дистиллированной воды растворяли 60 мг (0.88 мкмоль) БСА и добавляли при интенсивном перемешивании 0.5 мл раствора, содержащего 16.8 мг (88 мкмоль) ЭДК и 10.2 мг (88 мкмоль) ГСИ, и инкубировали в течение 15 мин. Готовили также раствор 13.0 мг (88 мкмоль) гидрохлорида этилендиамина в 10 мл 0.05 М карбонатного буфера, pH 9.5, содержавшего 150 мкл триэтиламина. Полученный раствор добавляли к активированному белку и инкубировали в течение 5 ч при интенсивном перемешивании. Продукт диализовали против 0.05 М карбонатного буфера, pH 9.5, и хранили при –20°C.
Синтез иммунореагентов. Фторхинолоны конъюгировали с белками карбодиимидным методом (по [25] с модификациями). В 1.0 мл N,N-диметилформамида растворяли 14.7 мкмоль фторхинолона, 5.7 мг (30 мкмоль) ЭДК и 3.5 мг (30 мкмоль) ГСИ, смесь инкубировали 2 ч при перемешивании. Готовили раствор 10 мг белка в 8 мл 0.05 М карбонатного буфера, pH 9.5, содержавшего 50 мкл триэтиламина, который инкубировали в течение 1 ч при 4°C. По каплям при постоянном перемешивании к раствору белка добавляли раствор активированного фторхинолона и инкубировали при перемешивании 5 ч при 25°C в темноте. Синтезированный конъюгат очищали от низкомолекулярных примесей диализом против 0.01 М К-фосфатного буфера, рН 7.4, содержавшего 0.1 М NaCl (ФБС), и хранили при –20°C.
Конъюгаты КЛИ-NH-C5-NH-кБСА и КЛИ-NH-С5-NH-ОВА синтезировали по [17, 18]. В 8 мл дистиллированной воды растворяли 5 мг (0.11 мкмоль) овальбумина и 2.2 мг (5.6 мкмоль) КЛИ и добавляли 20 мкл триэтиламина. При интенсивном перемешивании вносили 230 мкл (5.6 мкмоль) 0.25%-ного глутарового альдегида. Раствор инкубировали при постоянном интенсивном перемешивании и комнатной температуре в течение 1 ч, затем добавляли 500 мкл (30 мкмоль) 0.22%-ного раствора боргидрида натрия и инкубировали еще 30 мин. Синтезированный конъюгат отделяли от низкомолекулярных примесей диализом против ФБС и хранили при –20°C.
Получение антител. Для получения поликлональных антител использовали самцов кроликов породы Калифорнийский кролик в возрасте 3–5 мес. Животных иммунизировали с интервалом 2 нед. свежеприготовленной эмульсией конъюгата (0.5–1.0 мг в 1.0 мл ФБС) в смеси 1 : 1 с полным адъювантом Фрейнда для первой инъекции и с неполным адъювантом Фрейнда для последующих инъекций. Эмульсию вводили подкожно в 5–10 мест в район позвоночника. Кровь отбирали из краевой вены уха в вакуумные пробирки с гелем и активатором свертывания. Сыворотку отделяли центрифугированием, а IgG-фракцию очищали трехкратным осаждением 50, 40 и 33%-ными растворами сульфата аммония при 4°C. Объем конечного препарата соответствовал исходному объему антисыворотки. Полученную фракцию IgG растворяли в ФБС, смешивали с глицерином 1 : 1 и хранили при –20°C.
Конкурентный иммуноферментный анализ. Растворы (100 мкл) конъюгатов (1 мг/мл в ФБС) иммобилизовали в лунках полистирольного 96-луночного планшета (“ХЕМА”, Россия) с высокой сорбционной способностью в течение ночи при 4°С. Затем четырехкратно промывали микропланшет ФБС, содержавшим 0.05% Тритона Х-100 (ФБСТ). Для проведения анализа в каждую лунку вносили по 50 мкл аналита (от 1 мкг/мл до 10 пг/мл) и по 50 мкл раствора антител. Микропланшет инкубировали 1 ч при 37°С, затем четырехкратно промывали ФБСТ, добавляли в лунки по 100 мкл иммунопероксидазного конъюгата (разведение 1 : 6000 в ФБСТ) и снова инкубировали 30 мин при 37°С. После промывки (трижды ФБСТ и один раз – дистиллированной водой) определяли пероксидазную активность связавшейся с носителем ферментной метки. Для этого во все лунки вносили по 100 мкл субстратной смеси (0.4 мМ раствор ТМБ в 40 мМ Na-цитратном буфере, рН 4.0, с 3 мМ Н2О2), инкубировали 15 мин и останавливали реакцию добавлением 50 мкл 2 М серной кислоты. Оптическую плотность продукта реакции измеряли при 450 нм (D450) с помощью микропланшетного фотометра “ЭФОС 9305" ("Московский завод "Сапфир”, Россия).
Аналитические характеристики ИФА. Все аппроксимации полученных концентрационных зависимостей проводили с помощью программы Origin 8.5.1 (“OriginLab Corporation”, США), используя четырехпараметрическую сигмоидную функцию y = (A–D)/(1 + (x/c)B) + D. В качестве предела обнаружения рассматривали IC10 – концентрацию, при которой аналитический сигнал (D450) уменьшался на 10% от разности между максимальным и минимальным сигналами. Нижнюю и верхнюю границы диапазона определяемых концентраций вычисляли как IC20 и IC80 – концентрации, при которых аналитический сигнал уменьшался на 20 и 80% от разности между максимальным и минимальным сигналами соответственно. Специфичность метода оценивали как процент перекрестного реагирования (ПР) с аналогами определяемого вещества (Х):
Подготовка экстрактов из проб молока. К 0.2 мл пробы молока добавляли 0.8 мл метанола и 0.2 мл гексана, перемешивали интенсивным встряхиванием в течение 2 мин и центрифугировали при 15 000 g в течение 10 мин. Отбирали водно-спиртовой слой, который находился под слоями гексана и жиров, разбавляли экстракт в 6 раз ФБСТ и использовали в анализе.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Получение иммуногенов. Для получения поликлональных антител использовали два варианта конъюгатов белков с производными ципрофлоксацина (ЦИП).
В первом варианте ЦИП конъюгировали с БСА карбодиимидным методом. Конъюгация проходила и по карбоксильной группе константной области молекулы ЦИП, и по вторичной аминогруппе пиперазинового радикала в 7-м положении хинолонового ядра (рис. 2). На втором цикле иммунизации в качестве носителя использовали карбоксилированный БСА, что минимизировало наработку антител на гаптен, конъюгированный по карбоксильной группе константной области молекулы. Полученные антисыворотки были обозначены, как АС/ЦИП-А1 и АС/ЦИП-А2 (первый и второй циклы иммунизации соответственно).
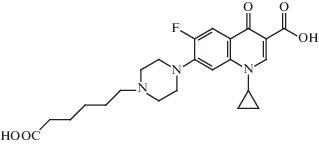
Во втором варианте в иммуноген между ЦИП и БСА вводили мостиковый участок (“спейсер”). Для этого использовали ципрофлоксацин, модифицированный 6-бромгексановой кислотой (рис. 3) аналогично ранее проводившимся модификациям САР и НОР [15, 16]. Такой гаптен мог конъюгироваться с белком по одной из двух карбоксильных групп, в то время как его вторичная аминогруппа была заблокирована. Антисыворотки, полученные с использованием данного иммуногена, были обозначены, как АС/ЦИП-Б.
ИФА на основе АС/ЦИП-А. Выбор твердофазного антигена и условий проведения анализа. В качестве твердофазного антигена тестировали конъюгаты различных фторхинолонов с альтернативным белком-носителем (ОВА), что исключало связывание содержащихся в антисыворотках антител к БСА. Были сопоставлены следующие конъюгаты: ЦИП-ОВА, МОКС-ОВА, ДАН-ОВА, ГАР-ОВА, КЛИ-ОВА, ЭНО-ОВА, НОР-ОВА, САР-ОВА, ЭНРО-ОВА, ПИП-ОВА, ЦИП-N-C5-CO-NH-ОВА и КЛИ-NH-C5-NH-ОВА, адсорбированные в лунки микропланшета в концентрации 0.5 мкг/мл. Для антител двух циклов иммунизации рассматривали связывание с конъюгатом (регистрируемая в ИФА оптическая плотность D0) и его ингибирование в присутствии высокой концентрации ЦИП – 10 нг/мл (D).
Полученные величины ΔD = (D0– D)/D0 приведены в табл. 1. По высоким величинам ΔD видно, что антитела первого цикла иммунизации в большей степени связывались со свободными молекулами гаптена. На втором этапе иммунизации ΔD резко снижался, но связывание с конъюгатами при этом сохранялось. ИФА с использованием конъюгата КЛИ-NH-С5-NH-ОВА значительно превосходил все другие по величине ΔD, он и был выбран для реализации ИФА.
Таблица 1.
Характеристика вариантов ИФА с использованием антител АС/ЦИП-А1 и АС/ЦИП-А2 и различных конъюгатов
| Конъюгат | ΔD (%) при концентрации ЦИП 10 нг/мл | |
|---|---|---|
| АС/ЦИП-А1 | АС/ЦИП-А2 | |
| ГАР-ОВА | 75 | 14 |
| МОКС-ОВА | 42 | 1 |
| ЭНРО-ОВА | 53 | 10 |
| САР-ОВА | 61 | 10 |
| НОР-ОВА | 62 | 10 |
| ДАН-ОВА | 46 | 13 |
| ЦИП-ОВА | 65 | 22 |
| КЛИ-NH-С5-NH-ОВА | 72 | 72 |
| ПИП-ОВА | 38 | 8 |
| КЛИ-ОВА | 72 | 18 |
| ЭНО-ОВА | 64 | 23 |
| ЦИП-N-C5-CO-NH-ОВА | 44 | 22 |
Были определены оптимальные параметры ИФА, обеспечивающие высокую чувствительность детекции ЦИП в сочетании с высоким уровнем аналитического сигнала. Концентрация конъюгата КЛИ-NH-C5-NH-ОВА, используемая при иммобилизации в лунках микропланшета, составила 0.25 мкг/мл, разведение антител АС/ЦИП-А1 – 1 : 4000 и АС/ЦИП-А2 – 1 : 6000.
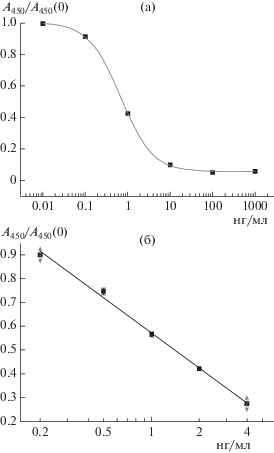
Калибровочная кривая ИФА ЦИП, полученная в оптимизированных условиях, представлена на рис. 4. Диапазон определяемых концентраций ЦИП составил 0.3–4.0 нг/мл, предел обнаружения – 0.2 нг/мл.
Рис. 4.
Общий вид градуировочного графика ИФА для определения ципрофлоксацина с антителами АС/ЦИП-А и иммобилизованным конъюгатом КЛИ-NH-C5-NH-ОВА (а) и аппроксимация линейного диапазона (б); A/A0 = (0.57 ± 0.01) – (0.49 ± 0.02) × × lg(c), R2 = 0.994, n = 3.
Выбор твердофазного антигена и оптимизация ИФА на основе антител АС/ЦИП-Б. Варианты ИФА с использованием антител против второго иммуногена и той же панели конъюгатов фторхинолонов с ОВА сравнивали по величине ΔD, определенной при концентрации ЦИП 100 нг/мл.
Конъюгат ЦИП-N-C5-CO-NH-ОВА характеризовался высоким значением ΔD и был выбран для ИФА. Показано, что оптимальная концентрация конъюгата при иммобилизации в лунках микропланшета равнялась 0.05 мкг/мл, а разведение антител – 1 : 6000. В выбранных условиях диапазон определяемых концентраций ЦИП составил 0.3–10.0 нг/мл, предел обнаружения – 0.2 нг/мл.
Определение суммы фторхинолонов. Были протестированы два описанных выше варианта ИФА. Специфичность оценивали по проценту обнаружения при анализе проб с концентрациями фторхинолонов 100 нг/мл. Для данофлоксацина, флюмеквина и марбофлоксацина тестировали пробы с концентрациями 30, 50 и 75 нг/мл, что соответствовало требованиям нормативных документов.
Результаты ИФА (табл. 2) интерпретировали на основе оценки ΔD. Выбор минимального и максимального значений ΔD позволил провести оценку уровней ΔD каждого фторхинолона. Для тест-системы АС/ЦИП-А/КЛИ-NH-C5-NH-ОВА минимальным пороговым значением ΔD оказалось 0.45 (ΔD для ЦИП согласно табл. 2), а максимальным – 0.76 (ΔD для НОР, ПЕФ, МОКС). Значения ΔD фторхинолонов, содержание которых было невозможно контролировать данным методом, в табл. 2 выделены курсивом, а величины для выявляемых количеств фторхинолонов – жирным шрифтом. Согласно приведенным в табл. 2 характеристикам для второй комплектации тест-системы соответствующие пороговые значения ΔD составляли 0.58 и 0.68.
Таблица 2.
Оценка специфичности вариантов ИФА
| Фторхинолон | МДУ, нг/мл |
Комплектация тест-системы | |||
|---|---|---|---|---|---|
| АС/ЦИП-А/КЛИ-NH-C5-NH-ОВА | АС/ЦИП-Б/ЦИП-N-C5-CO-NH-ОВА | ||||
| ΔD* | % обнаружения** | ΔD* | % обнаружения** | ||
| Ципрофлоксацин | 100 | 0.45 | 108 ± 6 | 0.58 | 102 ± 4 |
| Энрофлоксацин | 0.56 | 69 ± 3 | 0.66 | 51 ± 3 | |
| Офлоксацин | 0.75 | 35 ± 1 | 0.66 | 50 ± 2 | |
| Норфлоксацин | 0.76 | 30 ± 2 | 0.66 | 50 ± 2 | |
| Пефлоксацин | 0.76 | 32 ± 3 | 0.68 | 43 ± 3 | |
| Данофлоксацин | 30 | 0.83 | 82 ± 2 | 0.78 | 55 ± 2 |
| Флюмеквин | 50 | 0.90 | 39 ± 1 | 0.87 | 16 ± 6 |
| Марбофлоксацин | 75 | 0.93 | 22 ± 1 | 0.79 | 22 ± 2 |
| Клинафлоксацин | – | 0.60 | 58 ± 3 | 0.66 | 50 ± 2 |
| Гареноксацин | – | 0.61 | 55 ± 2 | 0.66 | 50 ± 2 |
| Надифлоксацин | – | 0.64 | 50 ± 2 | 0.70 | 34 ± 2 |
| Пазуфлоксацин | – | 0.64 | 50 ± 4 | 1.00 | <0.1 |
| Орбифлоксацин | – | 0.69 | 49 ± 2 | 1.00 | <0.1 |
| Эноксацин | – | 0.71 | 41 ± 1 | 0.86 | 18 ± 3 |
| Гатифлоксацин | – | 0.72 | 41 ± 1 | 0.71 | 30 ± 2 |
| Налидиксовая к-та | – | 0.72 | 33 ± 5 | 1.00 | <0.1 |
| Ломефлоксацин | – | 0.73 | 31 ± 2 | 0.80 | 14 ± 1 |
| Спарфлоксацин | – | 0.75 | 31 ± 1 | 1.00 | <0.1 |
| Моксифлоксацин | – | 0.76 | 30 ± 1 | 0.63 | 64 ± 2 |
| Оксолиновая к-та | – | 0.79 | 26 ± 1 | 0.75 | 23 ± 5 |
| Пипемидиевая к-та | – | 0.85 | 23 ± 2 | 0.76 | 20 ± 3 |
| Руфлоксацин | – | 0.88 | 19 ± 1 | 0.71 | 32 ± 3 |
| Дифлоксацин | – | 0.90 | 16 ± 1 | 0.78 | 17 ± 2 |
| Тозуфлоксацин | – | 1.00 | <0.1 | 0.77 | 19 ± 6 |
| Сарафлоксацин | – | 1.00 | <0.1 | 0.73 | 26 ± 2 |
Из представленных данных следует, что рассматриваемые варианты позволили контролировать сумму фторхинолонов, но не выявляли три соединения – данофлоксацин, флюмеквин и марбофлоксацин, имеющие индивидуальные МДУ и требующие дополнительного высокоселективного анализа. Наиболее широкой специфичностью к соединениям класса фторхинолонов (16 соединений) обладала тест-система, в которой использовались антитела АС/ЦИП-А и конъюгат КЛИ-NH-C5-NH-ОВА.
Поскольку при тестировании проб было неизвестно, какой фторхинолон (или смесь нескольких фторхинолонов) в них содержался, большое значение приобретал выбор критериев интерпретации результатов ИФА, которые позволяли бы сделать наиболее достоверные заключения, несмотря на ограниченность имеющейся информации (табл. 3). Установлено, что, если для данной системы в качестве порогового значения ΔD принять 0.45, то заключение о присутствии фторхинолона будет соответствовать ситуации, когда индивидуальные концентрации 16 исследованных фторхинолонов (ципрофлоксацина, энрофлоксацина, офлоксацина, норфлоксацина, пефлоксацина, клинафлоксацина, гареноксацина, надифлоксацина, пазуфлоксацина, орбифлоксацина, эноксацина, гатифлоксацина, ломефлоксацина, спарфлоксацина, моксифлоксацина и налидиксовой кислоты) окажутся достоверно выше, чем МДУ (100 нг/мл). При высоких уровнях ΔD, вплоть до значения 0.76, необходимо проводить подтверждающее исследование, поскольку сумма фторхинолонов может, как превышать, так и не превышать МДУ. Если ΔD оказалось больше 0.76, то концентрация 16-ти изученных фторхинолонов была достоверно меньше 100 нг/мл. Для второй комплектации тест-системы критерии принятия решений (табл. 3) основывались на пороговых уровнях ΔD, равных 0.58 и 0.68, которые были выбраны, исходя из данных табл. 2.
Таблица 3.
Интерпретация результатов групп-специфического ИФА
| Интерпретация | Комплектация тест-системы | |
|---|---|---|
| АС/ЦИП-А / КЛИ-NH-C5-NH-ОВА | АС/ЦИП-Б / ЦИП-N-C5-CO-NH-ОВА | |
| Σ(ФХ) > 100 нг/мл | ΔD < 0.45 | ΔD < 0.58 |
| Необходимо дополнительное тестирование | 0.45 ≤ ΔD ≤ 0.76 | 0.58 ≤ ΔD ≤ 0.68 |
| Σ(ФХ) удовлетворяет МДУ | 0.76 < ΔD | 0.68 < ΔD |
Следует отметить, что сравнение ΔD с двумя пороговыми значениями позволило сделать доказательные выводы о превышении МДУ независимо от того, какие из 16 фторхинолонов и в каком соотношении присутствовали в пробе. Эта возможность представляет существенное преимущество предлагаемой методики для практики, поскольку описанные ранее методики ИФА фторхинолонов характеризуются более узкой специфичностью и позволяют контролировать не более 11–12 соединений.
Тестирование проб молока. Методики ИФА были апробированы на 83 пробах молока и молочных смесей разных производителей. В качестве экстрагента для пробоподготовки был выбран метанол, обеспечивающий наиболее полную экстракцию различных фторхинолонов. Все протестированные пробы не содержали фторхинолонов в количестве, превосходящем нормативные требования регламента Таможенного Союза.
Работа выполнена при частичной финансовой поддержке Российского фонда фундаментальных исследований (грант 18-58-00038) и Белорусского республиканского фонда фундаментальных исследований (грант Х18Р-060).
Список литературы
Ezelarab H.A.A., Abbas S.H., Hassan H.A., Abuo-Rahma G.E.A. // Arch. Pharm. (Weinheim). 2018. V. 351. № 9. e1800141. https://doi.org/10.1002/ardp.201800141
Blondeau J.M. // Surv. Ophthalmol. 2004. V. 49. № 2. P. S73–S78.
Gouvea R., Dos S.F.F., Aquino M.H.C.D., Pereira V.L.D. // Bras. J. Poultry Sci. 2015. V. 17. № 1. P. 1–10.
Brown S.A. // J. Vet. Pharm. Therapeutics. 1996. V. 19. № 1. P. 1–14.
Stahlmann R., Lode H.M. // Expert Opin. Drug Saf. 2013. V. 12. № 4. P. 497–505.
Council Regulation (EEC) No 2377/90 of 26 June 1990 laying down a Community procedure for the establishment of maximum residue limits of veterinary medicinal products in foodstuffs of animal origin.
Единые санитарно-эпидемиологические и гигиенические требования к товарам, подлежащим санитарно-эпидемиологическому надзору (контролю). Утверждены Решением Комиссии Таможенного Союза от 28 мая 2010 года № 299.
De A.K., Bera A.K., Pal B. // Int. J. Pharm. Sci. Research. 2016. V. 7. № 2. P. 531–542.
Sousa J., Alves G., Fortuna A., Falcao A. // Anal. Bioanal. Chem. 2012. V. 403. № 1. P. 93–129.
Lehotay S.J., Chen Y.B. // Anal. Bioanal. Chem. 2018. V. 410. № 22. P. 5331–5351.
Xu F., Ren K., Yang Y.Z., Guo J.P., Ma G.P., Liu Y.M., Lu Y.Q., Li X.B. // J. Integr. Agriculture. 2015. V. 14. № 11. P. 2282–2295.
Duffy G.F., Moore E.J. // Anal. Lett. 2017. V. 50. № 1. P. 1–32.
Gaudin V. // Biosens. Bioelectron. 2017. V. 90. P. 363–377.
Dzantiev B.B., Byzova N.A., Urusov A.E., Zherdev A.V. // Trends Anal. Chem. 2014. V. 55. P. 81–93.
Tittlemier S., Gélinas J.-M., Dufresne G., Haria M., Querry J., Cleroux C., Godefroy S.B. // Food Anal. Methods. 2008. V. 1. № 1. P. 28–35.
Huet A.-C., Charelier C., Tittlemier S. A., Singh G., Benrejeb S., Delahaut P. // J. Agric. Food Chem. 2006. V. 54. № 8. P. 2822–2827.
Liu Y.Z., Zhao G.X., Wang P., Liu J., Zhang H.C., Wang J.P. // J. Environ. Sci. Health. Part B. 2013. V. 48. № 2. P. 139–146.
Li Y., Ji B., Chen W., Liu L., Xu C., Peng C., Wang L. // Food Agric. Immunol. 2008. V. 19. № 4. P. 251–264.
Wang Z., Zhu Y., Ding S., He F., Beier R.C., Li J., Shen J. // Anal. Chem. 2007. V. 79. № 12. P. 4471–4483.
Bucknall S., Silverlight J., Coldham N., Thorne L., Jackman R. // Food Additives Contam. 2003. V. 3. № 3. P. 221–228.
Burkin M.A. // Food Agric. Immunol. 2008. V. 19. № 2. P. 131–140.
Wen K., Nölke G., Schillberg S., Wang Z., Zhang S., Wu C., Shen J. // Anal. Bioanal. Chem. 2012. V. 403. № 9. P. 2771–2783.
Lu S., Zhang Y., Liu J., Zhao C., Liu W., Xi R. // J. Agric. Food Chem. 2006. V. 54. № 19. P. 6995–7000.
Chu F.S., Lau H.P., Fan T.S., Zhang G.S. // J. Immunol. Methods. 1982. V. 55. № 3. P. 73–78.
Liu Z.Q., Lu S.X., Zhao C.H., Ding K., Cao Z.Z., Zhan J.H., Ma C., Liu J.T., Xi R.M. // J. Sci. Food Agric. 2009. V. 89. № 7. P. 1115–1121.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология