Прикладная биохимия и микробиология, 2019, T. 55, № 5, стр. 506-512
Патогенность и липидный состав мицелия гриба Stagonospora cirsii ВИЗР 1.41, полученного на жидкой питательной среде с различными источниками азота
М. Фролова 1, С. В. Сокорнова 1, А. О. Берестецкий 1, *
1 Всероссийский научно-исследовательский институт защиты растений
196608 Пушкин, Санкт-Петербург, Россия
* E-mail: aberestetskiy@vizr.spb.ru
Поступила в редакцию 04.04.2018
После доработки 16.11.2018
Принята к публикации 22.04.2019
Аннотация
Изучено влияние источника азота в среде на рост, патогенность и липидный состав мицелия гриба Stagonospora cirsii Davis ВИЗР 1.41 – потенциального микогербицида для биологической борьбы с бодяком полевым (Cirsium arvens (L.) Scop). Удельная скорость роста гриба на сахарозо-соевой среде (СС) была в 2 раза выше, чем на среде Чапека (СЧ). Максимальной патогенностью характеризовался мицелий в экспоненциальной фазе роста на 3 сут культивирования на среде СС и на 6 сутки – на СЧ. Листья бодяка поражались мицелием, полученным на среде СС, на 25% сильнее, чем мицелием, выращенным на среде СЧ. В мицелии S. cirsii, полученном на СС, содержание общих липидов было ниже в 1.7 раза, соотношение неполярных липидов к полярным ниже в 3 раза, по сравнению с мицелием гриба, выращенном на СЧ. Установлены значительные различия в составе стеринов, жирных кислот и сфинголипидов в мицелии в зависимости от источника азота в питательной среде. Повышенное содержание стеринов, свободных жирных кислот и некоторых гликоцерамидов в мицелии S. cirsii, полученном на среде СС, может быть связано с более высоким уровнем его патогенности и может служить одним из возможных маркеров качества микогербицида.
Мицелий микромицета Stagonospora cirsii Davis – возбудителя пятнистости листьев бодяка полевого (Cirsium arvense (L.) Scop), может быть использован как действующий компонент микогербицида, направленного на борьбу с этим широко распространенным трудноискоренимым сорным растением [1, 2]. Для разработки технологии получения и применения любого биопрепарата необходимы четкие критерии оценки его качества. Традиционно качество биопрепаратов для защиты растений определяется концентрацией жизнеспособных пропагул, а также их эффективностью в лабораторных и полевых опытах [3].
Поскольку биологическая активность и устойчивость клеток грибов к внешним стрессам связаны с их химическим составом, особое внимание обращают на определение содержания белков, липидов, углеводов и осмолитов в биоматериале, входящим в состав биопестицидов [4, 5]. Хорошо известно, что биохимический состав и биологическую активность грибной клетки можно регулировать изменением состава питательной среды, временем и условиями культивирования [6].
Среди многочисленных химических внутриклеточных компонентов, позволяющих оценить, как патогенность, так и физиологическое состояние мицелия фитопатогенных грибов, особая роль принадлежит липидам. Они выполняют разнообразные структурные, защитные, запасные, регуляторные функции, участвуют в клеточных процессах метаболизма, онтогенеза и морфогенеза и могут играть заметную роль в заражении растений [7]. Липидный состав грибов может влиять на чувствительность грибов к фунгицидам [8] и, возможно, к фитоалексинам – антимикробным метаболитам растений [9]. Оксилипины, являющиеся производными простых липидов, регулируют морфогенез грибов и образование биологически активных соединений [10]. Эргостерол и его гликозид, участвуют в распознавании патогена хозяином и индуцируют иммунный ответ растения (реакцию сверхчувствительности – гибель клеток вокруг места инфицирования), что облегчает заражение растений некротрофами. Фосфатидная кислота, лизофосфолипиды, свободные жирные кислоты и оксилипины, участвуют в передаче внутриклеточной сигнальной информации в месте инфицирования [7].
Цель работы − изучение степени патогенности S. cirsii в зависимости от источника азота, используемого в период роста гриба, фазы роста, а также липидного состава мицелия для поиска возможных биохимических маркеров, коррелирующих со способностью мицелия инфицировать листья бодяка.
МЕТОДИКА
Оценка роста и патогенности. В работе использовали штамм гриба Stagonospora cirsii ВИЗР 1.41 из коллекции микроорганизмов Всероссийского научно-исследовательского института защиты растений (Санкт-Петербург, Россия). Штамм хранили при 5°C в пробирках на скошенном картофельно-глюкозном агаре. В качестве посевного материала использовали 10-суточноую культуру гриба, выращенную на стандартном картофельно-глюкозном агаре при температуре 24°С.
Для культивирования гриба использовали две жидкие питательные среды, различающиеся источниками азота. Одна из них – модифицированная среда Чапека (СЧ) имела следующий состав (г/л): сахароза – 30, NaNO3 – 3.5, KH2PO4 – 1, MgSO4 – 0.5, дрожжевой экстракт – 1.0, pH 6.0. Вторая среда – сахарозо-соевая (СС) отличалась от СЧ тем, что нитрат натрия в ее составе был заменен на соевую муку в концентрации 12 г/л.
Мицелий S. cirsii получали, выращивая в конических колбах емкостью 250 мл с 50 мл жидкой питательной среды. В качестве посевного материала использовали агаровые блоки 2 шт. (d – 5 мм)/колбу, вырезанные пробочным сверлом из активно растущей зоны посевной культуры. Инкубацию проводили при температуре 24°С на качалке (180 об./мин) в течение 9 сут.
Для изучения динамики роста и оценки патогенности мицелия каждые 24 ч снимали колбы с культурой гриба для анализа. Мицелий отделяли от культуральной жидкости фильтрованием через бумажный фильтр (красная лента) с помощью вакуумного насоса. Мицелий тщательно отмывали от остатков питательной среды дистиллированной водой и отжимали. Для определения выхода сухой биомассы его переносили в чашку Петри и сушили (1–2 мм) в сушильном шкафу с вентиляцией (ШС-80-01, Смоленское СКТБ СПУ, Россия) в течение 12 ч при температуре 35°С. Удельную скорость роста гриба (μ) на двух средах рассчитывали по формуле dC/dt = μC [11].
Для оценки патогенности 1 г сырого мицелия измельчали в 20 мл 0.01%-ного раствора Твин-80 с помощью бытового погружного блендера (MQ520, “Braun”, Польша) на максимальной скорости в течение 30 с.
Высечки (1 см в диаметре) из хорошо развитых листьев бодяка полевого (Cirsium arvense) помещали в герметичные прозрачные пластиковые контейнеры (30 × 20 × 4 см) на увлажненную стерильной водой фильтровальную бумагу адаксиальной стороной вверх по 12 штук на повторность опыта. На каждую высечку наносили 5 мкл водной суспензии измельченного мицелия S. cirsii в концентрации 50 мг/мл и инкубировали при температуре 24°C при периодическом освещении (12 ч в сутки) в климатостате (KBW400, “Binder”, Германия). Оценку патогенности мицелия проводили, определяя площадь некроза, образовавшегося на листовых высечках через 48 ч инкубации при 24°С и переменном искусственном освещении 12 ч в сутки [12].
Экстракция липидов. Для экстракции липидов был использован мицелий в середине экспоненциальной фазы роста гриба на 3 и 6 сут роста в среде СС и СЧ соответственно. Экстракцию липидов проводили согласно методу Фолча [13]. Высушенный в течение 3 ч при 35°С и измельченный мицелий двукратно экстрагировали смесью хлороформ–метанол (2 : 1 об./об.) в ультразвуковой ванне (S30Н, “Elma”, Германия) при 30°С в течение 30 мин. Для выделения прочносвязанных полярных липидов третью экстракцию проводили с добавлением в экстрагирующую смесь растворителей муравьиной кислоты (1 об. %). Объединенные экстракты промывали 0.9%-ным раствором хлорида калия, обезвоживали над сульфатом натрия и упаривали на роторном испарителе до постоянного веса. Содержание липидов в сухом мицелии определяли гравиметрическим методом.
Фитотоксическую активность экстрактов мицелия определяли методом листовых высечек [14]. Объединенный сухой остаток растворяли в этаноле и доводили водой до концентрации экстракта 5 мг/мл, а этанола – 0.5%. На поврежденные в центре иглой высечки из листьев бодяка полевого наносили 10 мкл экстракта. Учет диаметра некротического пятна проводили через 48 ч инкубации при температуре 24°С и искусственном освещении.
Выделение отдельных классов липидов осуществляли методом твердофазной экстракции, согласно [15]. Картридж (1 г силикагеля, “Диапак”, Россия), предварительно промывали 8 мл 1%-ного раствора муравьиной кислоты в метаноле и 10 мл хлороформа. Экстракты липидов в хлороформе (100–200 мкл) в пределах концентраций 50–100 мг вносили в картридж, липиды разделяли на нейтральные липиды (НЛ), сфинголипиды (СЛ) и фосфолипиды (ФЛ) путем последовательного элюирования хлороформом, ацетоном и метанолом (по 10 мл каждого). Фракции упаривали до постоянного веса, и относительное содержание классов липидов определяли, как среднее значение трех экспериментов. Чистоту фракций проверяли методом ТСХ на пластинах TLC Silica gel 60 F254 (10 × 20 см, “Merck”, Германия) в двух системах растворителей согласно [16]: 1) хлороформ–метанол–аммиак–бензол (65:30:6:10, об./об.) на высоту 5 см от старта; 2) гексан–диэтиловый эфир–уксусная кислота (70:30:1, об./об.) на высоту 9 см от старта. Пластины проявляли реагентом (20 г CuSO4, 200 мл метанола, 8 мл H2SO4, 8 мл Н3РО4) при нагревании в течение 5 мин при 150°С.
Анализ липидов. Выделенные фракции липидов анализировали при помощи инструментальной системы для проведения высокоэффективной тонкослойной хроматографии (ВЭТСХ) фирмы “Camag” (Швейцария), снабженной автоматическим аппликатором (Sampler 4), хроматографической камерой (ADC 2), спектроденситометром (Scanner 4) и программным обеспечением winCATS. Использовали следующие стандарты: триацилглицериды (ТАГ), диацилглицериды (ДАГ), фосфатидилсерин (ФС), фосфатидилинозитол (ФИ) (“Sigma”, Германия), глюкоцереброзид сои (ГлюЦер) (GluCer 98%, “Avanti Polar Lipids Inc.”, США), смесь цереброзидов (Цер) бычьего мозга (“Larodan”, Швеция). Индивидуальные фосфатидилэтаноламин (ФЭ) и фосфатидилхолин (ФХ) были выделены из смеси соевых фосфолипидов (L-α-Lecithin Type II-S, Soybean, 20% FC, “Sigma”, США).
Анализ НЛ проводили методом ВЭТСХ в режиме трехэтапного элюирования [16], используя пластинки HPTLC Silica gel 60 F254 (10 × 20 см, “Merck”, Германия) и системы растворителей (об./об.): хлороформ–метанол–аммиак–бензол (65 : 30 : 6 : 10) на высоту 2 см от старта; гексан–диэтиловый эфир–уксусная кислота (70 : 30 : 1) – 8 см от старта; гексан–диэтиловый эфир (97 : 3) – 9 см от старта. Пластинку проявляли реагентом, как описано выше. Стерины идентифицировали специфическим реагентом смесью серной и уксусной кислот 1 : 1 об./об. при нагревании 70°С, ТАГ и ДАГ – с помощью стандартных образцов. Анализ НЛ проводили в режиме поглощения 550 нм (лампа “W” денситометра Scanner 4). Содержание липидов определяли по высоте и площади пиков с полиномиальной регрессией в программе winCATS.
Качественный анализ ФЛ и СЛ проводили методом 2D ТСХ (ТLC Silica gel 60, “Merck”, США) в системах растворителей (об./об.): первое направление – хлороформ–метанол–аммиак–бензол (65 : 30 : 6 : 10), второе направление – хлороформ–метанол–ацетон–уксусная кислота–вода–бензол (70 : 30 : 5 : 4 : 1 : 10). Идентификацию индивидуальных липидов проводили с использованием стандартных образцов и специфических реагентов на отдельные функциональные группы: молибдатный реактив Васьковского (на фосфор), нингидрин (на аминогруппу), реактив Драгендорфа (на холиновую группу) и резорцин (на гликолипиды).
Количественный анализ ФЛ и ГлЦер проводили методом ВЭТСХ в режиме автоматического многократного элюирования. Пластинку (HPTLC Silica gel 60 F254, 10 × 20 см, “Merck”) промывали смесью хлороформ-MeOH (2 : 1, об./об.) и активировали при 140°С в течение 15 мин. Фракции липидов (10 мкл при концентрации 2.5 мг/мл) наносили на пластинку. Подбор оптимальных условий разделения липидов проводили в системе растворителей метанол–хлористый метилен (об./об.) с использованием четырех различных градиентов: 1) 8 ступеней от 65 : 35 до 0 : 100; 2) 10 ступеней от 55 : 45 до 10 : 90; 3) 12 ступеней от 55 : 45 до 10 : 90; 4) 14 ступеней от 50 : 50 до 10 : 90. Идентификацию веществ осуществляли с помощью стандартных образцов. Проявление пластинки и количественный анализ липидов проводили, как описано выше.
Статистическую обработку результатов трех независимых экспериментов проводили стандартными методами с помощью программы Statistica 6.0.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Рост и патогенность мицелия. На питательной среде СС с органическим источником азота скорость роста гриба S. cirsii была выше, чем на СЧ с минеральным источником азота. Максимальное накопление биомассы в начале стационарной фазы роста на СС достигалось на 6 (35 г/л), а на СЧ на 9 сут (30 г/л) культивирования соответственно (рис. 1). Удельная скорость роста мицелия S. cirsii в экспоненциальной фазе на СЧ составила 0.012, на СС – 0.027 г/ч.
Рис. 1.
Влияние продолжительности культивирования на средах с различными источниками азота СС (а) и СЧ (б), на патогенность и динамику роста мицелия S. cirsii ВИЗР 1.41. 1 – площадь некрозов, %, НСР0.05 = 8.0; 2 – сухая биомасса, г/л, НСР0.05 = 0.9

Максимальное развитие болезни на листовых высечках (площадь некроза 100%) бодяка полевого наблюдали при нанесении мицелия гриба, взятого в середине экспоненциальной фазы роста на среде СС на 3 сут, а на среде СЧ – на 6 сут, при этом площадь некроза составила 75% от общей площади листовых высечек. Второй, меньший по значению пик патогенности грибного мицелия наблюдался на 6 сут культивирования на СС (площадь некроза ~85%) в начале стационарной фазы роста (рис. 1). Заражение листовых высечек мицелием S. cirsii сопровождалось образованием спор гриба в тканях растения уже через 3–4 сут после инокуляции.
Анализ липидов. Влияние состава питательной среды на накопление липидов оценивали на мицелии S. cirsii, вызывающим наибольшее поражение листовых тканей бодяка в одной и той же фазе роста на 3 сут на среде СС и на 6 сут – на СЧ. Важно подчеркнуть, что при этом патогенность мицелия, полученного на среде СС, была достоверно (более чем в 1.3 раза) выше, по сравнению с патогенностью мицелия, выращенного на СЧ (рис. 1).
Содержание липидов в мицелии гриба и их качественный состав зависели от формы использованного азота в питательной среде. Так, при культивировании S. cirsii на среде СС общее содержание липидов было в 1.7 раза ниже по сравнению с их содержанием в мицелии на среде СЧ − 7 и 12% от сухой массы соответственно. В концентрации 5 мг/мл экстракты мицелия глубинных культур S. cirsii, полученных на обеих питательных средах в различные сроки культивирования, не проявляли фитотоксической активности на высечках из листьев бодяка полевого.
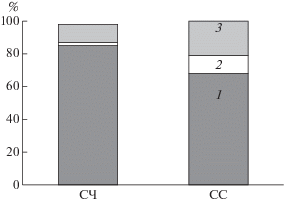
Анализ отдельных классов липидов показал, что независимо от состава питательной среды, доминирующими липидами в мицелии S. cirsii были НЛ. Введение в питательную среду соевой муки сопровождалось увеличением доли ПЛ: соотношение НЛ к ПЛ снижалось с 6 : 1 (на среде СЧ) до 2 : 1 ( на среде СС). При этом наибольшее накопление ПЛ наблюдалось во фракции СЛ (с 2 до 11%) (рис. 2).
Рис. 2.
Относительное содержание основных классов липидов мицелия S. cirsii ВИЗР 1.41 в экспоненциальной фазе роста, выращенного на питательных средах с различными источниками азота (НСР0.05 = 2.2). 1 – ФЛ, 2 – СЛ, 3 – НЛ.
Многократный процесс хроматографии позволил добиться эффективного разделения сложной смеси НЛ. Полученные значения Rf ацилглицеридов (АцГ) совпадали со значениями, взятыми из литературы [16]. Помимо АцГ во фракции НЛ присутствовали стерины (СТ), идентификация которых была проведена с помощью специфической реакции на этот класс соединений.
Состав питательной среды оказывал влияние также на биосинтез некоторых НЛ. При культивировании на среде СС содержание ТАГ в мицелии S. cirsii было в 1.5 раза ниже, а содержание СТ и жирных кислот (ЖК) выше – (в 3 и 5 раз, соответственно) по сравнению с их содержанием в мицелии гриба, выращенным на СЧ. Уровень ДАГ и моноацилглицерида (МАГ) в мицелии гриба при его культивировании на разных средах различался незначительно (табл. 1).
Таблица 1.
Влияние питательной среды на состав НЛ в мицелии S. cirsii ВИЗР 1.41
| Липиды | Rf | Доля во фракции НЛ, % | ||
|---|---|---|---|---|
| [16] | эксперимент | СЧ | СС | |
| МАГ | 0.05 | 0.06 | 3.0 | 2.6 |
| СТ | – | 0.13 | 3.9 | 13.0 |
| 1,3-ДАГ | 0.23 | 0.25 | 9.2 | 8.5 |
| 1,2-ДАГ | 0.26 | 0.28 | 9.5 | 9.0 |
| ЖК | 0.45 | 0.47 | 0.4 | 4.6 |
| ТАГ | 0.70 | 0.74 | 54.3 | 35.0 |
| НВ | – | – | 19.7 | 27.3 |
Качественное определение ПЛ при помощи двумерной ТСХ показало, что доминирующими ФЛ в мицелии S. cirsii были ФХ и ФЭ, остальные ФС ФИ, ФК, присутствовали в минорных количествах. В составе ПЛ также обнаружены два ГлЦер и гликолипид, который давал характерное окрашивание c реагентом на углеводы.
Оптимальное разделение ПЛ было достигнуто в результате использования 14-ступенчатого градиента − метанол–хлористый метилен от 50 : 50 до 10 : 90 об./об. Результаты количественного определения ПЛ показали, что не зависимо от питательной среды доминирующими ФЛ в мицелии S. сirsii являлись ФХ и ФЭ. Соотношение ФХ/ФЭ было близким к 3 : 1. Различия, наблюдаемые среди минорных ФС, ФИ и ФК, были незначительными (табл. 2).
Таблица 2.
Влияние питательной среды на состав ФЛ и ГлЦер в мицелии S. сirsii ВИЗР 1.41
| ФЛ/СЛ | Rf свидетелей |
СЧ | СС | ||
|---|---|---|---|---|---|
| Rf | % | Rf | % | ||
| Фракция ФЛ | |||||
| ФХ | 0.33 | 0.34 | 56.5 | 0.37 | 43.8 |
| ФС | 0.51 | 0.49 | 2.9 | 0.50 | 5.0 |
| ФИ | 0.53 | 0.54 | 6.4 | 0.53 | 5.3 |
| ФЭ | 0.61 | 0.62 | 17.1 | 0.61 | 14.4 |
| ФК | 0.71 | 0.73 | 3.0 | 0.72 | 2.8 |
| НВ* | – | – | 14.1 | – | 28.7 |
| Фракция СЛ | |||||
| ГлЦер-1 | 0.74 | 0.73 | 59.0 | 0.72 | 34.1 |
| ГлЦер-2 | 0.77 | 0.76 | 9.9 | 0.76 | 20.7 |
| ГлЦер Х | – | 0.86 | 10.1 | 0.87 | 30.3 |
| НВ* | – | – | 21.0 | – | 14.9 |
Основными компонентами фракции СЛ были два ГлЦер-1 и ГлЦер-2, хроматографическая подвижность которых совпадала с Rf стандартных образцов ГлюЦер сои и Цер бычьего мозга, а также неидентифицированный ГлЦер-Х. Их содержание в мицелии гриба, в отличие от ФЛ, существенно зависело от среды культивирования. Для мицелия, выращенного на среде СС, характерен примерно одинаковый уровень (20–30%) всех трех вышеуказанных липидов, в то время как в мицелии, выращенном на среде СЧ, наблюдали повышенный уровень ГлЦер-1 (около 60%) и пониженное содержание двух других СЛ (табл. 2).
Микогербициды – биопрепараты на основе инфекционного материала (спор, мицелия или его видоизменений) фитопатогенных грибов для борьбы с сорными растениями, применяемые в тех случаях, когда химические гербициды неэффективны и/или их применение ограничено [17]. Нами была показана возможность использования мицелия пикнидального гриба S. cirsii в качестве перспективной инфекционной основы микробного препарата для борьбы с бодяком полевым [1, 2, 18]. Мицелий фитопатогенных грибов Phoma macrostoma и Sclerotinia minor является действующим компонентом коммерческих биогербицидов таких, как Phoma™ и Sarritor™ [19, 20]. Мицелий может быть также инфекционной единицей для многих грибных патогенов культурных растений (Rhizoctonia solani, Laetisaria fusiformis, Mycosphaerella fijiensis и многих др.) [21–23], а также насекомых [24] и человека [25], поэтому выявление биохимических маркеров его вирулентности представляет практический и общетеоретический интерес.
В работе показано, что источник азота в модифицированной среде Чапека оказывал существенное влияние на накопление биомассы грибом S. cirsii и его патогенность. На среде СС гриб накапливал биомассу значительно быстрее, чем на среде с нитратом натрия, проявляя при этом более высокую патогенность. Эти результаты согласуются с данными литературы: для многих микромицетов показано, что высокопатогенные штаммы, которые инфицируют хозяина вегетативным мицелием, обычно характеризуются более быстрым ростом, чем слабопатогенные [21, 26, 27].
Некоторые работы, направленные на повышение эффективности биопестицидов продемонстрировали, что эффективный в полевых условиях грибной биоматериал характеризуется определенным содержанием липидов. Так, в вирулентных конидиях потенциального микогербицида Colletotrichum truncatum и спорах энтомопатогена Paecilomyces fumosoroseus с высоким уровнем всхожести содержалось существенно меньше липидов, чем в менее вирулентных и менее жизнеспособных пропагулах [28, 29]. У S. cirsii ВИЗР 1.41 выход липидов и их количественный состав зависел от формы использованного азота в питательной среде (рис. 2). Так, в фазе активного роста гриба на среде СЧ содержание липидов в мицелии было в 1.7 раза выше по сравнению с выходом липидов из мицелия, полученного на СС. Выход общих липидов мицелия S. cirsii находится в пределах 7–12% от сухой биомассы и соответствовал их содержанию в мицелии различных таксонов грибов [30]. Источник азота оказывал значительное влияние на накопление липидов у Pellicularia filamentosa var. solani. При выращивании на среде с нитратом калия выход липидов был в 6 раз выше, чем на при культивировании гриба на среде с сульфатом аммония [31].
Анализ отдельных классов липидов (рис. 2) свидетельствовал о доминирующем содержании в мицелии S. cirsii НЛ. В высокопатогенном мицелии, полученном на среде СС, отмечен более низкий уровень НЛ. При этом, во фракции НЛ отмечено примерно трехкратное повышенное содержание свободных ЖК и стеринов, по сравнению с их содержанием в менее патогенном мицелии, полученном на среде СЧ. Известно, что ЭС и свободные ЖК являются элиситорами иммунных реакций растений в отношении фитопатогенных грибов [7]. Кроме того, содержание стеринов определяет функциональные возможности мембран грибов [32]. Было обнаружено существенное влияние состава питательной среды, в частности источника углерода, на содержание липидов (2.5–14% от массы мицелия) и на концентрацию ЖК (7–29% от НЛ) у штаммов Verticillium dahlia, тогда как в содержании липидов и составе НЛ у авирулентных и вирулентных штаммов различия были нечеткими [33].
Результаты количественного анализа ПЛ показали, что независимо от питательной среды доминирующими ФЛ в мицелии S. сirsii являлись матричные липиды (ФХ и ФЭ). Соотношение ФХ/ФЭ, характеризующее структурно-механические свойства клеточной мембраны, примерно одинаково (около 3 : 1), что косвенно указывало на то, что мицелий, полученный на разных средах, находился в одной фазе роста. Содержание ГлЦер-Х в мицелии S. cirsii, полученном на СС, превышало в 3 раза его содержание в мицелии, выращенном на СЧ.
Некоторые ПЛ рассматриваются как факторы вирулентности ряда фитопатогенных и патогенных для человека грибов. Так, показан существенный вклад ГлЦер в вирулентность фитопатогена Fusarium graminearum [34]. ГлЦер из мицелия Magnaporthe grisea является элиситором, вызывающим реакцию сверхчувствительности в листьях риса [35]. У грибного патогена человека Cryptococcus neofomans образование инозитол фосфорилцерамида через цепь сигналов ведет к стимуляции биосинтеза меланина как одного из факторов вирулентности этого гриба [36].
Таким образом, при использовании источника азота органического происхождения (соевой муки) скорость роста и патогенность S. cirsii были выше, чем при использовании неорганического источника азота (нитрата натрия). При этом наблюдали существенные различия в соотношении НЛ и ПЛ: высокопатогенный мицелий, полученный на среде СС, характеризовался пониженным содержанием НЛ и повышенным стеринов и свободных ЖК во фракции НЛ, некоторых СЛ из фракции ПЛ. Дальнейшее изучение роли указанных липидов в заражении листьев бодяка грибом S. cirsii позволит разработать научно обоснованные маркеры качества микогербицида.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 16-16-00085).
Список литературы
Пaтeнт PФ. 2014. № 2515899.
Пaтeнт PФ. 2015. № 2543665.
Ravensberg W.J. A Roadmap to the Successful Development and Commercialization of Microbial Pest Control Products for Control of Anthropods. Dordrecht, Heidelberg, London, New York: Springer Science+Business Media, 2011. 383 p.
Берестецкий А.О., Сокорнова С.В. // Микология и фитопатология 2009. Т. 43. № 6. С. 473–489.
Magan N. The Mycota IV. Environmental and Microbial Relationships. Fungi in Extreme Environments / Eds. Kubicek C.P., Druzhinina I.S. Berlin, Heidelberg: Springer-Verlag, 2007. V. 4. P. 85−103.
Tormo J.R., Asensio F.J., Bills G.F. // Methods Mol. Biol. 2012. V. 944. P. 59– 78
Siebers M., Brands M., Wewer V., Duan Y., Hölzl G., Dörmann P. // Biochem. Biophys. Acta. 2016. V. 1861. P. 1379–1395.
Wise C., Falardeau J., Hagberg I., Avis T.J. // Phytopathology. 2014. V. 104. P. 1036–1041.
Morrissey J.P., Osbourn A.E. // Microbiol. Mol. Biol. Rev. 1999. V. 63. P. 708–724.
Гесслер Н.Н., Филиппович С.Ю., Бачурина Г.П., Харченко Е.А., Гроза Н.В., Белозерская Т.А. // Прикл. биохимия и микробиология. 2017. Т. 53. № 6. С. 568–579.
Перт С.Дж. Основы культивирования микроорганизмов и клеток. M.: Мир, 1978. 330 с.
Сокорнова С.В., Берестецкий А.О. // С.-х. биол. 2018. Т. 53. № 5. С. 1054–1061.
Folch G., Lees M., Sloane, Stanley G.H. // J. Biol. Chem. 1957. V. 226. P. 497–509.
Берестецкий А.О., Юзихин О.С., Каткова А.С., Добродумов А.В., Сивогривов Д.Е., Коломбет Л.В. // Прикл. биохимия и микробиология. 2010. Т. 46. № 1. С. 84–88.
William H.F. // Biochem. Mol. Biol. 2005. V. 33. P. 357–360.
Fuchs B., Rosmarie Suß., Teuber K., Eibisch M., Schiller J. // J. Chromatogr. A. 2011. V. 1218. P. 2754–2774.
Берестецкий А.О. // Вестник защиты растений. 2017. Т. 91. С. 5–12.
Сокорнова С.В., Хютти А.В., Берестецкий А.О. // Вестник защиты растений. 2011. № 3. С. 54–56.
Европейский патент. 2010. № 1401284 B1
Патент США. 2013. № 8557735 B2
Carling D.E., Uiner R.H. // Plant Dis. 1990. V. 74. P. 901–903.
Berestetski A., Ehrig T., Kastirr U. // Plant Breeding. 2002. V. 121. P. 493–500.
Donzelli, B. G. G, and Churchill, A. C. L. // Phytopathol. 2007. V. 97. P. 916–929.
Патент США. 2013. № 20130287829 A1
Paisley D., Robson G.D., Denning D.W. // Med. Mycol. 2005. V. 43. P. 397–401.
Zhou T., Boland G.J. // Can. J. Plant Pathol. 1999. V. 21. P. 93–99.
Romón P., Hatting H., Goldarazena A., Iturrondobeitia J.C. // Fungal Biol. 2017. V. 121. P. 189–197.
Jackson M.A., Schisler D.A. // App. Environ. Microbiol. 1992. V. 58. P. 2260–2265.
Cliquet S., Jackson M.A. // J Ind Microbiol Biotechnol. 2005. V. 32. P. 204–210.
Meeuwse P., Sanders J.P.M., Tramper J., Rinzema, A. // Biofuels, Bioprod. Bioref. 2013. V. 7. P. 512–524.
Suzuki O., Yokochi T., Nakasato S. // JAOCS. 1984. V. 61. P. 1856–1861.
Bossche H.V. Biochemistry of Cell Walls and Membranes in Fungi / Eds. Kuhii P.J. et al. Berlin, Heidelberg: Springer-Verlag, 1990. P. 327.
Ten L.N., Tyshchenko A.A., Stepanichenko N.N., Gusakova S.D., Mukhamedzhanov S.Z., Otroshchenko O.S., Kasyanenko A.G. // Chem. Nat. Comp. 1977. V. 13. P. 524–527.
Rittenour W.R., Chen M., Cahoon E.B., Harris S.D. // PLoS ONE. 2011. V. 6. № 4. e19385.
Umemura K., Ogawa N., Yamauchi T., Iwata M., Shimura M., Koga J. // Plant Cell Physiol. 2000. V. 41. P. 676–683.
Rhome R., Del Poeta M. // Annu. Rev. Microbiol. 2009. V. 63. P. 119–131.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


