Прикладная биохимия и микробиология, 2019, T. 55, № 3, стр. 211-221
Состав микробного сообщества на разных стадиях компостирования, перспектива получения компоста из муниципальных органических отходов (обзор)
А. Н. Ножевникова 1, *, В. В. Миронов 1, Е. А. Бочкова 1, Ю. В. Литти 1, Ю. И. Русскова 1
1 Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии Российской академии наук”
119071 Москва, Россия
* E-mail: nozhevni@mail.ru
Поступила в редакцию 01.11.2018
После доработки 03.12.2018
Принята к публикации 18.12.2018
Аннотация
В работе обобщены современные представления о меняющемся составе микробного сообщества компоста в соответствии с температурными стадиями процесса и исследована роль ассоциаций микроорганизмов в биодеградации и детоксикации компонентов органических отходов. Уделено внимание процессу создания в компостной массе баланса между активными аэробными и анаэробными микроорганизмами, что позволяет сохранять азот в готовом компосте и снижать затраты на аэрацию. Показано, что добавка природных минералов, в частности цеолита, положительно влияет на процесс компостирования и улучшает качество компоста, обеспечивает содержание в компосте кремния в биодоступной форме, препятствует выбросам аммиака и снижает концентрацию тяжелых металлов. Особое внимание уделено перспективе компостирования уплотненных сырых и анаэробно обработанных осадков сточных вод с добавлением органической фракции твердых коммунальных отходов и лигноцеллюлозных отходов.
Компостирование – экзотермический процесс биологического окисления, в котором органический субстрат подвергается биодеградации смешанной популяцией микроорганизмов, включающий бактерии, археи и грибы. При этом происходит повышение температуры в компостируемом материале до 50–60°С и выше, при относительно низкой влажности: около 60% в начале процесса и 40–50% в конце созревания компоста. В настоящее время компостирование признано экологичным, экономически выгодным способом переработки органических отходов, особенно сельскохозяйственных, и соответствует концепции разумного потребления и устойчивого развития (“Sustainable Development”). В Японии и некоторых других странах сжигание биоразлагаемых отходов запрещено, и компостирование является широко распространенным экологичным способом их утилизации, не представляющим угрозу здоровью человека и окружающей среде, поскольку при компостировании не вырабатываются вредные газообразные продукты (NОx, SOx) [1, 2]. Полученный в результате переработки отходов компост насыщен гумусовыми кислотами и служит удобрением с высокой агрономической ценностью. Сырьем (субстратом) для получения компоста, традиционного удобрения в России и других странах с умеренным климатом, служат отходы животноводства, птицеводства и растениеводства, включая лигноцеллюлозные. Несмотря на то, что процесс компостирования считается достаточно хорошо изученным, его микробиология исследована недостаточно. В процессе компостирования принимают участие множество микроорганизмов: идентифицировано более 2000 известных видов бактерий, не менее 100 видов грибов [3, 4], также в компосте присутствуют археи. Молекулярно-биологическими методами показано, что большинство бактерий, архей и микроскопических грибов в микробном сообществе компоста представлено некультивируемыми видами (не выделены в чистые культуры). Значительное влияние на интенсивность процесса компостирования и скорость окисления органических веществ оказывают температура, влажность компостируемой массы, пористость (мультидисперсность) субстрата, обеспечивающая аэрацию, а также присутствие азота в доступной форме.
Муниципальные коммунальные органические отходы, поддающиеся биодеградации, состоят из пищевых отходов (до 40%), картонных и бумажных упаковочных материалов, древесных остатков санитарной обрезки насаждений, опада, осадков сточных вод (ОСВ) и являются нетрадиционным сырьем для получения компоста. ОСВ состоят из смеси осадка первичного отстойника до поступления сточной воды на очистку и вторичного осадка – избыточного активного ила аэротенков из вторичных отстойников, и характеризуются высоким содержанием биодеградабельных органических веществ. На крупных современных станциях очистки сточных вод проводится стабилизация ОСВ – анаэробная обработка в метантенках при температуре 52–53°С, при этом уничтожаются патогены, а легко разлагаемая органика сбраживается с образованием метана и углекислоты. Сброженная масса уплотняется на пресс-фильтрах или центрифугах и размещается на полигонах твердых коммунальных отходов (ТКО) [5], а также частично используется в качестве субстрата для озеленения в городах и лесопосадках. Перспективным методом для получения полноценного высококачественного удобрения является компостирование уплотненных обработанных осадков сточных вод.
Цель обзора – обобщение информации о составе микробного сообщества компоста, температурном режиме компостирования традиционных сельскохозяйственных органических отходов, а также анализ возможности применения процесса компостирования для переработки свежих и анаэробно стабилизированных уплотненных осадков муниципальных сточных вод, органической фракции ТКО, с добавлением лигноцеллюлозных отходов и природных цеолитов.
Температурная динамика и состав микроорганизмов на разных этапах компостирования. Температурный режим устанавливается в результате саморазогрева за счет деятельности микроорганизмов и является индикатором развития процесса компостирования. Условно принято разделять процесс на четыре температурные стадии (рис. 1): мезофильная (до 40°С), термофильная (до 60°С), остывание (до 40°С) и созревание (до разницы не более 10°С между средней температурой массы и температурой окружающей среды) [6, 7]. Считается, что при повышении температуры в пределах от 10 до 50°С на каждые 10°С микробные процессы ускоряются в 2–3 раза. Показано, что за счет активного разложения органического вещества смеси свиного навоза с опилками в течение термофильной стадии компостирования температура поднимается до 70°C и выше [8]. Сообщается о высокотемпературном (до 110°С) компостировании, при котором быстро разлагаются осадки сточных вод и отходы животноводства, включая кости животных [1]. Из высокотемпературного компоста (95–110°C) выделены два новых термофильных микроорганизма YMO81 (T) и YMO722 (T) [9]. Штаммы строго аэробные, классифицированы как экстремальные термофилы, способные расти при температурах выше 80°C, оптимальная температура роста 72°C или выше. Филогенетический анализ подтвердил предположение о том, что изоляты являются членами нового рода семейства Bacillaceae, порядка Bacillales, класса Bacilli, Philum Firmicutes. Следует отметить, что при сильном саморазогреве компоста до 65–85°С обычно наблюдается снижение скорости биодеградации органического субстрата, поскольку такие температуры выше оптимальных для умеренно термофильных микроорганизмов, простейших и беспозвоночных обитателей компоста.
Рис. 1.
Различные стадии компостирования как функция времени, вида биоты, температуры и химических характеристик субстрата (на основе [6, 7]): 1 – температура; 2 – мезофилы; 3 – термофилы; 4 – баланс углерода; 5 – рН; 6 – ${\text{NH}}_{4}^{ + }$-N; А – использование лабильных субстратов; В – минерализация клеточных стенок, ${\text{NH}}_{4}^{ + }$ минерализация; С – смена мезофилов на термофилов; D – образование гуминовых веществ; Е – появление почвенной фауны; ось К – количество клеток на 1 г субстрата; С, % – содержание углерода к исходному; t – время компостирования, сут; I – мезофильная стадия; II – термофильная стадия; III – стадия остывания; IV – стадия созревания.
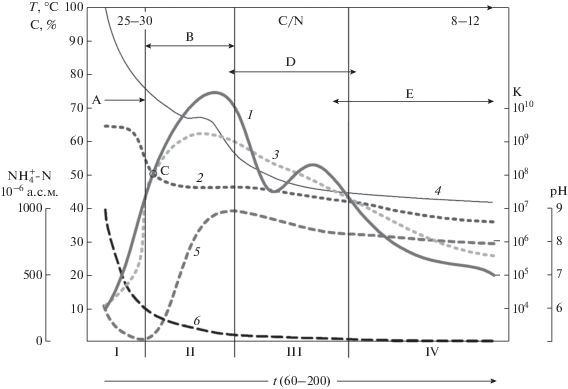
Процесс компостирования в изменяющихся температурных условиях осуществляется при участии разнообразных микроорганизмов, в основном представителей четырех бактериальных фил: Firmicutes, Proteobacteria, Bacteroidetes и Actinobacteria, которые составляют 85% всех идентифицированных и классифицированных микроорганизмов в исследованных образцах компостов [10].
Первую мезофильную стадию компостирования осуществляют мезофильные бактерии и грибы, которые при повышении температуры замещаются термофилами. Представители обширного семейства Enterobacteriales (Proteobacteria) являются факультативными анаэробами, обитают в почве и в желудочно-кишечном тракте людей и животных и активны на ранних стадиях компостирования. Умеренно термофильные бактерии семейства Lactobacillales (Firmicutes) активны в начале процесса разогрева компоста и после повторного рыхления компостного материала в начале стадии остывания. В термофильной стадии компостирования (45–60°C) различные бациллы семейства Bacillus (Firmicutes) могут составлять более 80% от общего числа бактерий, и наиболее часто обнаруживаются Bacillus subtilis, B. licheniformis и B. circulans. Представители рода Thermus растут при температуре 65–82°С и участвуют в разложении различных макромолекул [11]. В стабилизированных слоях компоста наиболее многочисленны представители бактериальных родов Thermobifida, Bacillus и микроскопических грибов родов Thermomyces и Aspergillus [12]. На третьей стадии снижения температуры и на стадии созревания компоста становятся активными актиномицеты (Actinomycetales) и бактерии, относящиеся к родам семейств Enterobacteriales и Pseudomonadales, которые способствуют более полной деградации остаточного органического сырья [10].
Важную роль в процессе компостирования играют микроскопические грибы (микромицеты), на активность и рост которых сильное влияние оказывает температура. Многие микромицеты инактивируются при повышении температуры до 55°С, а при понижении температуры они вновь распространяются из более холодных зон по всему объему компостируемой массы. Ряд термофильных микромицетов Ascomycota наряду с термофильными актинобактериями принимают участие в разложении лигнина, и они активны на второй стадии процесса компостирования, в температурном интервале 40–50°С [11]. Показано, что количество микроскопических грибов в компосте уменьшается при повышении температуры, а при 64°C они практически не обнаруживаются. Thermomyces lanuginosus при высокой температуре способен выделять экзоферменты гемицеллюлазы, лигниназы и целлюлазы в большом количестве и играет ведущую роль в разложении геми- и лигноцеллюлозы [13]. Кроме температуры, лимитирующим фактором роста для грибов является концентрация питательных веществ и доступного азота. Наиболее важной группой для процессов компостирования считаются нитевидные грибы из-за их физиологических возможностей и гифального способа роста [14]. Многие нитевидные грибы разлагают макромолекулярные субстраты, особенно углеводы. Нитевидные грибы родов Mucor, Rhizopus и Aspergillus продуцируют амилазы, а производителями целлюлазы являются Trichoderma reesi, Trichoderma lignorum, Chaetomium cellulolyticum и аскомицеты белой гнили. Гифальный способ роста обеспечивает нитчатым грибам главное преимущество над одноклеточными микроорганизмами при колонизации твердых субстратов и использовании доступных питательных веществ.
Лигнин наиболее устойчив к действию ферментов, и разлагать его способна только небольшая группа высших грибов.
В компостируемой массе встречаются микроскопические эукариоты-простейшие, а также вирусы. Многие ультрамикроскопические облигатные паразиты вызывают заболевания растений, животных и человека. Если зараженный материал подвергается компостированию, количество патогенных вирусов в нем резко снижается на термофильной стадии компостирования.
Деградация трудно разлагаемых субстратов компостируемого сырья. В процессе разложения полимеров из растительных остатков выделяются вещества-предшественники компонентов гумуса [15]. В основном за деградацию лигноцеллюлозной биомассы при компостировании ответственны бактерии с низким содержанием пар Г + Ц, в частности, относящиеся к Bacillales, Clostridiales, Actinomycetales и Thermoanaerobacterales [10, 16]. Согласно результатам метапротеомного анализа бактериальное сообщество осуществляет деградацию целлюлозы, причем 44% целлюлаз образуется бактериями рода Thermobifida [12]. В разложении лигниноцеллюлозы принимают участие умеренно термофильные актинобактерии Thermoactinomyces vulgaris, Actinobifida chromogena, Micromonospora carbonacea, а также Streptomyces thermovulgaris, S. lincolnensis, S.variegatus, S. lusitanus и др. [4]. Следует отметить, что большинство актинобактерий-лигнолитиков способны лишь солюбилизировать (разжижать) и модифицировать структуру молекулы лигнина, а их возможности к минерализации лигнина ограниченны, в отличие от плесневых грибов белой гнили [11, 17]. При компостировании актинобактерии растут медленнее, чем большинство бактерий и микромицетов и на ранних стадиях компостирования не составляют им конкуренции, когда их численность ниже численности бактерий, однако, в термофильной стадии актинобактерии играют значительную роль [18]. Следует отметить способность многих актинобактерий к синтезу антибиотиков, за счет чего в почве уничтожаются их антагонисты – многие виды микробных патогенов растений, что важно для их защиты. Известно также, что некоторые актиномицеты синтезируют вещества-индукторы роста растений, стимулирующие их созревание [4].
При буртовом методе компостирования отмечено, что ферментативная активность микроорганизмов в компостируемой массе по высоте бурта неравномерна: амилазная активность (разложение углеводов) наблюдается преимущественно в нижней четверти бурта, а активность коллагеназы (разложение белков) преобладает в его верхней половине [1].
Микроорганизмы цикла азота. Азотфиксаторы (или диазотрофы) развиваются в компосте и играют важнейшую роль в обеспечении почвенного плодородия за счет способности фиксировать молекулярный азот атмосферы благодаря наличию ферментного комплекса нитрогеназы. Из компостной массы были выделены диазотрофы – представители бактериальных родов: Azotobacter, Klebsiela, Pseudomonas, Xanthomonas, Alcaligenes, Stenotrophomonas, Caulobacter, Achromobacter, Clostridium, участвующие в процессах разложения органических веществ компоста [19, 20]. Способность к азотфиксации также обнаружена у некоторых архей, присутствующих в компосте [4]. Именно за счет азотофиксации происходит поступление из атмосферы азота – ключевого элемента питания растений, обычно находящегося в почве в дефиците [21].
Нитрификаторы представляют группу микроорганизмов цикла азота, обеспечивающих растения доступными окисленными азотными соединениями и активны во время стадии созревания компоста [22]. В процессе компостирования популяция Nitrosospira наблюдалась в начале процесса компостирования, далее на термофильной стадии превалировали бактерии Nitrosomonas europaea, а затем во время стадии охлаждения была вновь восстановлена популяция Nitrosospira [23, 24]. Сomammox-бактерия Nitrospira inopinata (бинарная культура, содержащая представителя рода Nitrospira и бактерию-спутник), осуществляющая аэробное двухстадийное окисление аммония в нитрит в компостируемом органическом субстрате (содержит гены аммиак-монооксигеназы, гидроксиламин-оксидоредуктазы и нитрит-оксидоредуктазы), проявляет оптимальную активность при 37°C [25].
Первую фазу – окисление солей аммония до солей азотистой кислоты (нитритов) – осуществляют аммоний-окисляющие бактерии (АОБ) родов Nitrosomonas, Nitrosococcus, Nitrosolobus и др.
(1)
${\text{NH}}_{4}^{ + } + 1.5{{{\text{O}}}_{2}} \to {\text{NO}}_{2}^{ - } + {{{\text{Н }}}_{2}}{\text{О }} + 2{{{\text{Н }}}^{ + }}.$Вторую фазу – окисление нитритов до нитратов – осуществляют нитритокисляющие бактерии, относящиеся к родам Nitrobacter, Nitrococcus и др.
(2)
${\text{NO}}_{2}^{ - } + {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{{\text{O}}}_{2}} \to {\text{NO}}_{3}^{ - }.$Аммоний-окисляющие бактерии (АОБ) и археи (АОА) активны в компосте при концентрациях кислорода в диапазоне 1–10 об. %, но существует разница в занимаемых нишах AOA и AOБ. Молекулярно-биологическими методами было подтверждено, что архейный ген amoA присутствовал на протяжении всего процесса компостирования, в то время как бактериальный ген amoA не определялся на термофильной стадии и стадии остывания, что указывает на наличие активных архей с толерантностью к относительно высокой температуре [26, 27]. AOA потенциально могут иметь большое экофизиологическое разнообразие и, следовательно, археи могут получить конкурентное преимущество в условиях высокого температурного стресса и низкого содержания кислорода во время термофильной стадии компостирования. Кроме того, геномный анализ показывает, что AOA могут функционировать как миксотрофы, используя углекислый газ и органические материалы в качестве источников углерода. AOA имеют более высокий температурный оптимум, и их вклад в нитрификацию при компостировании увеличивается с повышением температуры, а такие факторы, как концентрация кислорода, рН и температура могут повлиять на распределение АОА и их активность [28]. Кроме того, мелкие клетки архей, небольшой геном и олиготрофный образ жизни, могут способствовать высокому содержанию АОА в почве, где источники энергии более ограничены [29].
Недавние исследования показали, что нитрификация происходит не только в конце процесса компостирования, когда проникновение кислорода в массу увеличивается, а температура снижается, но и на термофильной стадии, где активны АОА при пониженном уровне рН и относительно олиготрофных условиях. В дальнейших исследованиях необходимо оценить активность окисления аммония при изменении параметров процесса и определить вклад АОА в процесс нитрификации при компостировании в термофильном режиме (45–60°С) и при повышении температуры до 65°С и выше.
Микроорганизмы цикла фосфора. В компосте, как и в почве, весьма многочисленны микроорганизмы, участвующие в деструкции органического вещества, которые параллельно вносят вклад и в высвобождение (растворение) фосфатов. В определенных условиях они могут составлять до 50% общей микробной популяции [4]. Помимо бактерий, среди фосфат-солюбилизирующих микроорганизмов обнаружены микромицеты, однако считается, что их вклад в обеспечение почвы и компоста доступным фосфором гораздо ниже, чем у бактерий [30]. Солюбилизация фосфатов бактериями основана на снижении рН среды за счет способности микроорганизмов выделять органические кислоты в процессе своей жизнедеятельности. В свою очередь, кислоты взаимодействуют с нерастворимыми в воде минералами, апатитами, фосфатами кальция и т.п., переводя фосфаты в доступную форму для ассимилирования растениями и микроорганизмами [4]. У микроскопических грибов превращение фосфора происходит по принципиально другому механизму. Некоторые виды рода Penicillum имеют кислотные и щелочные фосфатазы, гидролизующие нерастворимые в воде фосфаты. Большинство микромицетов продуцируют фитазы – особые ферменты, относящиеся к фосфатазам, которые осуществляют высвобождение фосфат-иона из органических фосфат-содержащих соединений. В результате гидролиза фитиновой кислоты образуются низшие кислоты, содержащие менее шести остатков фосфорной кислоты, которые являются основной формой запасания фосфора в организме растений [30].
Образование гумусовых кислот в процессе компостирования. Гумус – наиболее ценный компонент, образующийся в процессе компостирования и содержащий полезные вещества для питания высших растений. Гумификация представляет собой ряд последовательных стадий химического и биологического превращения органических веществ-предшественников в полимеры-компоненты гумуса. В этом процессе принимают участие бактерии родов Bacillus, Lactobacillus и грибы родов Chaetomium, Trichoderma, Candida [31–33]. Считается, что формирование полиароматических компонентов гумуса происходит за счет активности микробных ферментов фенолоксидаз, лакказ, пероксидаз. В процессах гумификации при компостировании лакказоподобные ферменты играют важнейшую роль в реакциях спонтанной полимеризации при формировании полифенолов [15, 34]. Образование гумуса, происходящее также в почвах, при компостировании идет значительно быстрее, главным образом, за счет активности микроорганизмов в термофильной стадии [31, 35]. При компостировании различных типов отходов образуется разное количество ценных гумусовых кислот. Наиболее богаты гумусовыми веществами компосты на основе отходов ферм, птицефабрик и пищевых производств [36]. Образование гумуса можно ускорить добавлением биопрепаратов, содержащих микроорганизмы-гумификаторы, а также комбинированием отходов различного происхождения [32].
Факторы, ускоряющие компостирование и повышающие качество компоста. Помимо температуры, влажности компостируемой массы, рыхлости субстрата, необходимой для эффективной аэрации и присутствия азота в доступной форме чрезвычайно важным для эффективного компостирования является отношение углерода к азоту (C/N) [2]. Оптимальное для развития микроорганизмов соотношение C/N должно находиться в интервале от 26 до 35, а для ТКО 30-35, при более высокой концентрации азота активны микроорганизмы, образующие азот в виде молекулярного азота (N2) [37]. В компостах такие источники азота как белки, аминокислоты, азотистые основания лимитированы и компостная смесь активируется внесением мочевины, солей аммония. Именно поэтому обеззараживание ОСВ введением хлористого аммония и безводного аммиака является позитивным приемом.
Перспективным направлением повышения ценности компоста является добавление к исходной смеси природных минералов, обладающих сорбирующими свойствами. Природный цеолит представляет собой большую группу микропористых, гидратированных алюмосиликатных минералов, которые обладают способностью уменьшать выбросы и соленость различных газов и увеличивают биодоступность минеральных питательных веществ во время компостирования [38]. В ряде работ показано, что добавление минеральных наполнителей, таких как модифицированный аттапульгит [39] и клиноптилолит [40, 41], позволяет за счет удержания аммоний-катиона и аммиака повысить содержание аммонийного азота в компосте из отходов свиноводства и птицеводства. Имеются данные, что природный цеолит, добавленный в исходную компостную смесь, поглощает значительное количество тяжелых металлов, что обеспечивает улучшение характеристик компоста [42]. Введение цеолита обеспечивает присутствие в компосте кремния (Si) в биодоступной форме, однако, цеолит может также адсорбировать значимую для компостирования и полезную для почвенных процессов микробиоту, а из-за недоступности аммония снижать активность процесса нитрификации. Таким образом, необходимо более тщательно исследовать влияние цеолита на всех стадиях процесса и определить наиболее рациональные варианты его использования. Необходимо также контролировать образование NH3 и N2O, которое связано со скоростью окисления аммиака и структурой сообщества АОБ и АОА.
Аэрация и анаэробные условия. Процесс компостирования преимущественно аэробный. Поэтому режим и интенсивность аэрации чрезвычайно важны. Однако в компостируемой массе формируются микроаэрофильные и анаэробные микрониши внутри очень мелких частиц, в которых из-за ограниченного поступления кислорода развиваются анаэробные микроорганизмы. Доля анаэробов в общем числе микроорганизмов, участвующих в компостировании, в значительной степени зависит от состава исходного сырья, режимов его предварительной обработки, влажности и режима аэрации при компостировании. По некоторым сведениям, анаэробы составляют всего от 1 до 10% микроорганизмов, при этом скорость синтеза и эффективность экзоферментов, синтезируемых анаэробами, могут быть даже выше, чем у аэробных микроорганизмов [43]. Экспериментальные данные подтверждают наличие строго анаэробной ферментации органических веществ в компосте представителями рода Clostridium [44]. Анаэробные микроорганизмы в отличие от аэробных выделяют в 10 раз меньше тепла при разложении одного и того же количества органического вещества. Деградация органического вещества в анаэробных условиях включает 4 стадии: гидролитическую – расщепление сложных биополимерных молекул на более простые олиго- и мономеры, ферментативное расщепление мономеров до ЛЖК, спиртов, СО2 и Н2, ацетогенную – образование непосредственных предшественников метана: ацетата, водорода и углекислоты, и собственно метаногенную – образование метана (СН4). Стадия образования метана требует наличия строго анаэробных условий и создания очень низкого окислительно-восстановительного потенциала (ОВП), от –200 до –300 мВ и ниже. Однако образование метана при компостировании крайне нежелательно, так как метан является горючим газом и его воспламенение может вызвать возгорание. При периодическом ворошении или продувке воздухом компостных буртов достижение такого низкого ОВП не происходит, и анаэробное разложение органических веществ останавливается на стадии образования ЛЖК, снижающих рН среды, СО2 и Н2. Создание более благоприятных условий для жизнедеятельности анаэробных микроорганизмов может положительно повлиять на снижение рН компостируемой массы, сохранение в ней аммонийного азота, соответственно увеличение вклада анаэробных процессов, не требующих подачи кислорода, может представлять собой один из действенных способов снижения затрат на аэрацию компоста и повышение энергетической эффективности процесса компостирования в целом. Однако необходимо выбирать оптимальный режим аэрации компоста, который должен строго соблюдаться. Кроме того, создание в компостной массе баланса между активными аэробными и анаэробными микроорганизмами с помощью различных микробиологических и технических приемов является одним из действенных способов сохранения азота в готовом компосте без существенного снижения скорости компостирования, а значит, повышения агрономической ценности биоудобрения из отходов и общей энергоэффективности процесса компостирования.
Таким образом, процесс компостирования, несмотря на использование принудительной или естественной аэрации, является аэробно-анаэробным процессом, поскольку даже в условиях активной аэрации, образуются анаэробные микрозоны, в которых обитают анаэробные бактерии, продукты жизнедеятельности которых могут служить субстратами для аэробных бактерий и наоборот. Эти процессы недостаточно исследованы. Присутствие в компосте аэробных и анаэробных микроорганизмов обеспечивает стабильность компостирования при изменении условий среды. Изучение разложения органических веществ при чередовании режимов анаэробного сбраживания и активного окисления может позволить интенсифицировать компостирование и улучшить качество получаемого конечного продукта.
Компостирование органической фракции твердых коммунальных отходов. Органическая фракция (ОФ) составляет до 40% массы твердых бытовых отходов, поэтому компостирование имеет потенциал для значительного сокращения количества перевозимых отходов на свалки и мусоросжигательные заводы.
Исследованиями авторов работы [23] процесса компостирования ОФ-ТКО в лабораторном реакторе показано, что 16% азота терялось в форме NH3 и менее 1% азота от исходного терялось в форме N2. Выбросы NH3 достигали максимума, когда рН начинал увеличиваться. При этом было отмечено образование небольших количеств N2O и CH4. Потенциальная скорость окисления аммиака, определяемая методом ингибирования хлората, увеличивалась в 4 раза в течение первых 9 дней и далее оставалась высокой. Первоначально были выявлены популяции Nitrosospira и Nitrosomonas с использованием DGGE-анализа специфических для АОБ-фрагментов 16S рРНК. В термофильных условиях была обнаружена только Nitrosomonas europaea, а популяции Nitrosospira обнаружены во время фазы охлаждения. Термофильные условия благоприятствовали высоким уровням окисления аммиака и снижению выбросов NH3, но между тем авторами указывается, что значимость различных АОБ, обнаруженных в компосте для окисления аммиака, осталась не выясненной.
При компостировании смеси ОФ-ТКО, ОСВ и древесных опилок сообщается [45] об обнаружении мезофильных Lactobacillus spp. и Acetobacter spp., которые являются основными бактериальными группами на мезофильной стадии компостирования. Также обнаружены Gluconobacter, что связано с содержанием в органической фракции ТКО остатков пищи, в том числе фруктов и овощей. В первый день компостирования был обнаружен Dipodascus australiensis, происхождение которых также связывают с органической фракцией ТКО в исходной компостной смеси.
При компостировании ОФ-ТКО происходят изменения концентраций ферментов, таких как амилаза, целлюлаза, протеаза, фосфатаза, дегидрогеназа и ксиланаза, что может служить показателем активности микробной биодеградации [46]. Считается, что различные гидролитические ферменты контролируют скорости деградации различных субстратов, и они являются основными медиаторами различных процессов деградации [26].
Амилаза играет ключевую роль в гидролизе альфа-1,4-гликозидных связей полисахаридов различных крахмалистых субстратов, при этом образуются декстрины, олигосахариды, мальтоза и D-глюкоза [46]. Активность амилазных ферментов в процессе компостирования ОФ-ТКО постепенно увеличивается (от 1.15 до 3.19 мг глюкозы г–1 сухой массы ч–1), причем максимальная активность амилазы была обнаружена на 21 сут. Результаты исследования Аваши с соавт. [46] показали, что максимальная деградация крахмальных субстратов происходила на 14–21 день. Наличие углеродосодержащего наполнителя увеличивает рост микробной биомассы и стимулирует секретирование ферментов целлюлазы, по этой же причине снижение отношения C/N на более поздней стадии компостирования вызывало снижение активности целлюлазы. Сообщается также, что компостирование ОФ-ТКО (75% на сухой вес) со скошенной травой (25%) стимулирует ферментативную активность, благоприятствует росту микроорганизмов, обеспечивая источник углерода и хорошую аэрацию в течение начальной фазы компостирования.
Максимальная концентрация аммонийного азота генерировалась во время термофильной фазы компостирования, когда наиболее интенсивно аммоний был получен путем минерализации органического азота [46]. Под воздействием высокой температуры и рН ${\text{NH}}_{4}^{ + }$ переходил в NH3, который улетучивался из бурта на 10–21 сут компостирования. Концентрация общего азота в начале снижалась из-за улетучивания аммиака, но к концу компостирования была максимальной (1.98% на сухую массу) из-за фиксации азота бактериями. Активность протеазы тесно связанно с азотным циклом, и разрушением комплекса азотных соединений, или более простых короткоцепочечных полипептидных фракций, образовавшихся в течение активной фазы компостирования. Активность протеазы в значительной степени коррелирует с водорастворимой формой азота и производством аммиака.
Активность фосфатазы (от 1.74 до 4.38 мг п-нитрофенилфосфата г–1 сухой массы ч–1) при компостировании ОФ-ТКО связана с гидролизом органических соединений фосфора в различные неорганические формы, которые растения могут усваивать [46]. Эта ферментативная активность играет критическую роль в циклах фосфора и считается общим показателем микробной активности, хотя некоторые фосфатазы синтезируются не только микроорганизмами, но и растениями.
Мониторинг биологической активности при компостировании ОФ-ТКО возможен с помощью определения ферментативной активности дегидрогеназы [47]. Максимальная активность дегидрогеназы была обнаружена в конце термофильной стадии компостирования в пределах 0.5–0.7 мг г–1 сухой массы ч–1. Кроме того, указывается на возможность соотнесения активности дегидрогеназы с индексом статического дыхания во время стадии созревания.
Сообщается об использовании ОФ-ТКО в качестве субстрата для роста Bacillus thuringiensis (Bt) в нестерильных условиях в 10-литровом твердофазном реакторе для получения биопестицидов путем твердофазного брожения [48]. Концентрации 1.7 × 107 – 2.2 × 107 и 1.3 × 107 – 2.1 × 107 КОЕ г–1 сухой массы для жизнеспособных клеток Bt и спор соответственно, были получены в конечном материале.
Сообщается также об использовании при компостировании ОФ-ТКО микробных инокулятов, состоящих из чистых культур двух лигноцеллюлозных грибковых видов Phanerochaete chrysosporium (Microbial Type Culture Collection и Gene Bank, MTCC, MTCC787), Trichoderma viride MTCC793 и одного бактериального вида Pseudomonas aeruginosa MTCC2295 [46]. Выбор штаммов был сделан на основе взаимной совместимости для наилучшей ферментативной активности и производительности консорциума. Микробный консорциум вышеуказанных грибковых штаммов, культивирован на картофельном декстрозном агаре и получена суспензия спор. Бактериальные штаммы выращены в среде бульона Луриа (DifcoTM). Микробная суспензия консорциума выращена на ОФ-ТКО с размером частиц <2 см3 при 37 ± 2°C в течение 1 сут до концентрации 5.7 × 108 КОЕ г–1 (P. aeroginosa) и при 28 ± 2°C в течение 6 сут до 6.8 × 106 КОЕ г–1 (P. chrysosporium и T. viride).
Компостирование уплотненных сырых и анаэробно обработанных осадков сточных вод. На муниципальных очистных сооружениях (ОС) сточных вод образуются ОСВ, состоящие из первичного (отстойного) и вторичного (избыточный активный микробный ил) осадков, которые подвергают компостированию с углеродсодержащим наполнителем.
Гонзалес с соавт. [49] получили эмпирическое отношение микробных вариаций как функцию температуры (MVR(T)) в процессе компостирования смеси уплотненных необработанных осадков сточных вод, первичного и вторичного (избыточного активного ила) и древесных опилок в открытых буртах
MVR увеличился на первом 15-дневном этапе, далее наблюдалось постепенное снижение как температуры, так и концентрации микроорганизмов. Наблюдаемое увеличение MVR в конечном образце, связано с увеличением температуры бурта, вызванном значительным увеличением температуры окружающей среды. После завершения процесса деградации биоразлагаемых органических веществ окружающие метеорологические условия оказывают большее влияние на температуру и процесс компостирования в целом.
Первичные и вторичные ОСВ на крупных ОС подвергаются анаэробной обработке в метантенках. Такая анаэробная переработка сырых ОСВ в метантенках даже в термофильных условиях, при которых погибают патогенные микроорганизмы и яйца глист, не позволяет получить хорошо стабилизированный продукт, вследствие неполного разложения органических соединений. Соответственно анаэробно сброженный осадок сточных вод имеет неприятный запах, привлекает насекомых и представляет риск для здоровья людей. В настоящее время наиболее распространенным методом утилизации анаэробно обработанных осадков сточных вод является их уплотнение и захоронение на полигонах ТКО [5, 42]. Полигоны являются санитарно небезопасными объектами: на них происходят выбросы биогаза, состоящего из CH4, CO2 и большого количества примесей с неприятным запахом (меркаптанов и др.), идет выщелачивание солей тяжелых металлов и трудноразлагаемых органических веществ в грунтовые воды. При этом теряется органическое вещество, которое могло бы быть превращено в удобрение.
Компостирование анаэробно обработанных осадков сточных вод с добавлением лигноцеллюлозных отходов, обеспечивающих необходимую рыхлую структуру обрабатываемой массы, служит рациональным методом для получения полноценного удобрения. Анаэробно обработанные осадки сточных вод с низким соотношением C/N целесообразно компостировать с богатыми углеродом отходами сельскохозяйственных или промышленных производств, а также с органической фракцией ТКО: пищевые отходы, измельченные картон и бумага, древесные опилки, стружка и растительные остатки, создающие рыхлую структуру компостной смеси [50], причем наилучшим компонентом считается измельченная солома [4, 11]. Совместное компостирование богатых азотом осадков сточных вод и богатых углеродом лигноцеллюлозных отходов позволяет не только уменьшить запах и стабилизировать органическое вещество осадков, но и увеличить концентрацию гуминовых веществ в получаемом биоудобрении, поскольку компост только из анаэробно обработанных осадков сточных вод имеет низкое содержание гуминовых кислот [5, 36].
Получение компоста из сырых и анаэробно обработанных осадков сточных вод является новым перспективным методом. При этом снижается нагрузка на полигоны ТКО и получается компост, который может быть использован в лесонасаждениях и озеленительных хозяйствах, а при отсутствии или содержании тяжелых металлов в пределах допустимых норм, и в сельском хозяйстве. В табл. 1 приведены физико-химические свойства анаэробно сброженных осадков сточных вод [5, 50–53]. В качестве недостатков для компостирования анаэробно обработанных осадков сточных вод отмечены: низкое содержание биодоступного углерода, низкое отношение C/N (около 7), высокое содержание влаги (79%) и соответственно плохая пористость (высокая насыпная плотность 1.09 кг/л). Кроме того, анаэробно обработанные осадки сточных вод характеризуются присутствием в составе веществ с фитотоксическими свойствами в значительной концентрации. В связи с этим рекомендуется добавление лигноцеллюлозных отходов в соотношении 1 : 3 для увеличения содержания углерода и создания рыхлой структуры компостной смеси [50]. Повысить эффективность обработки анаэробно обработанных осадков сточных вод методом компостирования возможно внесением микробного биопрепарата, содержащего клетки бактерий Bacillus, Lactobacillus, Trichoderma, Candida, что позволяет увеличить скорость и интенсивность образования гумусовых кислот по сравнению с контролем [32].
Таблица 1.
Физико-химические свойства и состав анаэробно сброженного осадка сточных вод
| Показатель | Россия [5] | Италия [51] |
Австралия [52] |
Бразилия [53] |
Испания [50] |
|---|---|---|---|---|---|
| Влажность, % | 46 | нд | нд | 42.1 | 74.1 |
| pH | 12.6* | 8.4 | 7.2 | 11.6* | 7.9 |
| Общий органический углерод (TOC), % | 24 | 24.5 | 30.9 | 12.5 | 26.2 |
| Азот общий, % | 0.52 | 2.9 | 5.76 | 1.07 | 5.65 |
| C/N | 46.2 | 8.4 | 5.4 | 13.3 | нд |
| P2O5, % | 0.9 | нд | нд | 0.26 | 6.04 |
| K2O, % | 0.08 | нд | нд | 0.16 | 0.43 |
| CaO, % | 19.8 | нд | нд | 19.85 | нд |
| Cu, мг кг–1 | 82 | 234 | 835 | 73 | 216 |
| Zn, мг кг–1 | 170 | 853 | 930 | 219 | 2195 |
| Pb, мг кг–1 | 42 | 57 | 207 | 28,9 | 111 |
| Cd, мг кг–1 | 10.1 | 0.63 | 25 | 0.57 | 26 |
| Cr, мг кг–1 | 270 | 650 | 116 | 28.1 | 31 |
| Hg, мг кг–1 | нд | 0.92 | 2 | 0.52 | нд |
| Ni, мг кг–1 | нд | 45 | 23 | 18 | 24 |
* * *
В обзоре обобщены результаты современных исследований процесса компостирования как способа преобразования коммунальных органических отходов, в частности, органической фракции твердых бытовых отходов и уплотненных анаэробно сброженных осадков сточных вод, в биоудобрение. Биодеградация и детоксикация компонентов органических отходов, а также формирование гумуса при компостировании протекает за счет активности микробных ассоциаций. Обогащение компоста доступными для растений соединениями азота осуществляется за счет активности АОБ и АОА. Необходимо более полное исследование влияния добавок природных минералов на компостирование и качество компоста. Использование для получения компоста уплотненных анаэробно сброженных осадков сточных вод обеспечит изначально присутствие большого количества анаэробных микроорганизмов. Дальнейшее исследование аэробно-анаэробного режима компостирования органических отходов позволит оптимизировать параметры аэрации, достаточные для эффективной стабилизации компостной смеси из уплотненного анаэробно обработанного осадка сточных вод с добавлением органической фракции ТКО и лигноцеллюлозного наполнителя.
Исследование выполнено при частичной финансовой поддержке РФФИ в рамках проекта № 18-29-25 035.
Список литературы
Oshima T., Moriya T. //Ann. N. Y. Acad. Sci. 2008. V. 1125. № 1. P. 338–344.
Wang X., Cui H., Shi J., Zhao X., Zhao Y., Wei. // Biores. Technol. 2015. V. 198. P. 395–402.
De Gannes V., Eudoxie G., Hickey W.J. // Frontiers in Microbiology. 2013. V. 6. Art. 164. P. 1–9.
Sánchez Ó.J., Ospina D.A., Montoya S. // Waste Manag. 2017. V. 69. P. 136–153.
Пахненко Е.П. Осадки сточных вод и другие нетрадиционные органические удобрения. 3-е изд. М.: БИНОМ. Лаборатория знаний, 2015. 314 с.
Mironov V.V., Ivanov Y.A. //Agricultural Mechanization in Asia, Africa, and Latin America. 2018. V. 49. № 3. P. 86–90
Smith J.L., Collins H.P. Soil Microbiology, Ecology and Biochemistry. 3 Ed. Academic Press, 2007. P. 483–486.
Huang G.F., Wu Q.T., Wong J.W., Nagar B.B. // Biores. Technol. 2006. V. 97. P. 1834–1842.
Moriya T., Hikota T., Yumoto I., Ito T., Terui Y., Yamagishi A., Oshima T. // Int. J. Syst. Evol. Microbiol. 2011. V. 61. P. 631–636.
Antunes L.P., Martins L.F., Pereira R.V., Thomas A.M., Barbosa D., Lemos L.N., Silva G.M., Moura L.M., E-pamino G.W., Digiampietri L.A., Lombardi K.C., Ramos P.L., Quaggio R.B., de Oliveira J.C., Pascon R.C., Cruz J.B., da Silva A.M., Setubal J.C. // Sci. Rep. 2016. V. 6. Art. № 38915
Tuomela M., Vikman M., Hatakka A., Itävaara M. // Biores. Technol. 2000. V. 72. № 2. P. 169–183.
Zhang L.L., Zhang H.Q., Wang Z.H., Chen G.J., Wang L.S. // Biores. Technol. 2016. V. 203. P. 1–10.
Zhang L., Ma H., Zhang H., Xun L., Chen G., Wang L. // Biores. Technol. 2015. V. 197. P. 266–275.
Environmental Bioengineering / Eds. Wang L., Tay J-Y. V. 11. New York, Dordrecht, Heidelberg, London: Springer, Humana Press, 2010. P. 179.
Sánchez-Monedero M.A., Roig A., Cegarra J., Bernal M.P. // Biores. Technol. 1999. V. 70. № 2. P. 193–201.
Ueno Y., Haruta S., Ishii M., Igarashi Y. // Appl. Microbiol. Biotechnol. 2001. V. 57. № 4. P. 555–562.
Kausar H., Sariah M., Mohd H., Zahangir M., Razi M. // Biodegradation. 2011. V. 22. P. 367–375.
Steger K., Jarvis A., Vasara T., Romantschuk M., Sundh I. // Res. Microbiol. 2007. V. 158. P. 617–624
Pepe O., Ventorino V., Blaiotta G. // Waste Manag. 2013. V. 33. № 7. P. 1616–1625.
Yin Y., Gu J., Wang X., Zhang K., Hu T., Ma J., Wang Q. // Biores. Technol. 2018. V. 255. P. 257–265.
Velmourougane K., Prasanna R., Saxena A.K. // J. Basic Microbiol. 2017. V. 57. № 7. P. 548–573.
Cáceres R., Malińska K., Marfà O. // Waste Manag. 2017. V. 72. P. 119–137
Jarvis A., Sundberg C., Milenkovski S., Pell M., Smårs S., Lindgren P.E., Hallin S. // J Appl Microbiol. 2009. V. 106. № 5. P. 1502–1511.
Yamamoto N., Otawa K., Nakai Y. // Microbial. Ecol. 2010. V. 60. № 4. P. 807–815.
Kits K.D., Sedlacek C.J., Lebedeva E.V., Han P., Bulaev A., Pjevac P., Daebeler A., Romano S., Albertsen M., Stein L.Y., Daims H., Wagner M. // Nature. 2017. V. 549. P. 269–272.
Zeng G., Zhang J., Chen Y., Yu Z., Yu M., Li H., Liu Z., Chen M., Lu L., Hu C. // Biores. Technol. 2011. V. 102. P. 9026–9032.
Yamamoto N., Asano R., Yoshii H., Otawa K., Nakai Y. // Appl. Microbiol. Biotechnol. 2011. V. 90. P. 1501–1510.
Ouyang Y., Norton J.M., Stark J.M. // Soil Biol. Biochem. 2017. V. 113. P. 161–172.
Mushinski R.M., Gentry T.J., Dorosky R.J., Boutton T.W. // Soil Biol. Biochem. 2017. V. 112. P. 216–227.
Khan M.S., Zaidi A., Wani P.A. // Agronomy for Sustainable Development. 2007. V. 27. № 1. P. 29–43.
Chefetz B., Chen Y., Hadar Y. // Appl. Environ. Microbiol. 1998. V. 64. № 9. P. 3175–3179.
Wei Z., Xi B., Zhao Y., Wang S., Liu H., Jiang Y. // Chemosphere. 2007. V. 68(2). P. 368–374.
Villar I., Alves D., Garrido J., Mato S. // Waste Manag. 2016. V. 54. P. 83–92.
Wu J., Zhao Y., Zhao W., Yang T., Zhang X., Xie X., Wei Z. // Biores. Technol. 2017. V. 226. P. 191–199.
Van Fan Y., Klemeš J.J., Lee C.T., Ho C.S. // Clean Technologies and Environmental Policy, 2018. V. 20. № 3. P. 517–527.
Wei Z., Zhao X., Zhu C., Xi B., Zhao Y., Yu X. // Chemosphere. 2014. V. 95. P. 261–267.
Kumar S. // Crit. Rev. Biotechnol. 2011. V. 31. № 2. P. 112–136.
Munthali M.W., Kabwadza-Corner P., Johan E., Matsue N. // J. Mater. Sci. Chem. Eng. 2014. V. 2. P. 1–5.
Xie K., Jia X., Xu P., Huang X., Gu W., Zhang F., Yang S., Tang S. // J. Air Waste Manag. Assoc. 2012. V. 62. № 10. P. 1174–1181.
Venglovsky J., Sasakova N., Vargova M., Pacajova Z., Placha I., Petrovsky M., Harichova D. // Biores. Technol. 2005. V. 96. P. 181–189.
Latifah O., Ahmed O.H., Susilawati K., Majid N.M. // Waste Manag. Res. 2015. V. 33. № 4. P. 322–331.
Zorpas A.A., Loizidou M. // Biores. Technol. 2008. V. 99. P. 7545–7552.
Atkinson C.F., Jones D.D., Gauthier J.J. // J. Ind. M-icrobiol. Biot. 1996. V. 16. № 3. P. 182–188.
Reinhardt T. // Microbiology of Composting / Eds. Insam H., Riddech N., Klammer S. Berlin Heidelberg GmbH: Springer-Verlag, 2002. P. 177–188.
Galitskaya P., Biktasheva L., Saveliev A., Grigoryeva T., Boulygina E., Selivanovskaya S. // PLoS One. 2017. V. 12(10). P. e0186051.
Awasthi M.K., Pandey A.K., Bundela P.S., Khan J. // Bioresour. Technol. 2015. V. 182. P. 200–207.
Barrena R., Va’zquez F., Sa’nchez A. // Biores. Technol. 2008. V. 99. P. 905–908
Ballardo C., Barrena R., Artola A., Sánchez A. // Waste Manag. 2017. V. 70. P. 53–58.
González I., Robledo-Mahón T., Silva-Castro G.A., Rodríguez-Calvo A., Gutiérrez M.C., Martín M.Á., Chica A.F., Calvo C.J. Clean. Prod. 2016. V. 115. P. 245–254.
Banegas V., Moreno J.L., Moreno J.I., Garcia C., Leon G., Hernandez T. // Waste Manag. 2007. V. 27. № 10. P. 1317–1327.
Negre M., Mozzetti Monterumici C., Vindrola D., Piccone G. // J. Environ. Sci. Health A Tox. Hazard. Subst. Environ. Eng. 2011. V. 46. № 5. P. 509–517.
Belyaeva O.N., Haynes R.J., Sturm E.C. // Waste Manag. 2012. V. 32. P. 2248–2257.
LeBlanc R.J., Matthews P., Richard R.P. // Global Atlas of Excreta, Wastewater Sludge, and Biosolids Management: Moving Forward the Sustainable and Welcome Uses of a Global Resource. United Nations Human Settlements Program 2008 (UN-HABITAT). Nairobi, Kenya. P. 135. ISBN: 978-92-1-132009-1
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


