Прикладная биохимия и микробиология, 2019, T. 55, № 3, стр. 222-230
Взаимодействие лизоцима с каррагинанами
Ю. А. Антонов 1, *, И. Л. Журавлёва 1
1 Институт биохимической физики им. Н.М. Эмануэля РАН
119334 Москва, Россия
* E-mail: chehonter@yandex.ru
Поступила в редакцию 04.07.2018
После доработки 14.09.2018
Принята к публикации 18.12.2018
Аннотация
Взаимодействие лизоцима с каппа- и лямбда-каррагинанами и его термостабильность в комплексе изучены методами динамического светорассеяния, турбидиметрии и дифференциальной сканирующей микрокалориметрии. Показано, что комплексы лизоцима с каппа-каррагинаном стабилизировались кулоновскими и вторичными взаимодействиями, а его комплексообразование с лямбда-каррагинаном протекало только с участием сил электростатической природы. Стехиометрический состав комплексов при pH 7.0 и ионной силе I = 0.01 составлял 0.3 : 1 (вес/вес) или 1 : 120 (моль/моль) и изменялся монотонно до более высокого содержания каррагинана в смеси при увеличении I. Влияние I на комплексообразование носило не монотонный характер при q = 0.1 и q = 0.3. При комплексобразовании наблюдалась потеря термостабильности фермента (более значительная в случае лямбда-каррагинана), что предполагало большее сродство каррагинанов к его денатурированной форме, чем к нативной.
Полисахариды, особенно обладающие зарядом, которые взаимодействуют с белком, широко применяются в пищевой промышленности для улучшения функциональных свойств и текстуры многокомпонентных пищевых систем [1]. Каррагинан, относящийся к одному из наиболее важных из них, используется при получении различных пищевых продуктов, включая желе, молочные десерты и мясные продукты [2, 3]. В настоящее время известно, что большое количество различных белков взаимодействуют с каппа-каррагинаном (ККГ). К ним можно отнести овальбумин [4, 5], казеин [6], белки молока [7], бета-лактоглобулин [8, 9], желатину [10, 11] и лизоцим (ЛИЗ) [12]. Одно из следствий комплексообразования белков с сульфатированными полисахаридами связано с повышением стабильности белка и потерей растворимости в результате тепловой обработки [4, 5, 13]. Защитный эффект вызван, вероятно, блокированием гидрофобных участков белка полисахаридом [14]. Способность сульфатированных полисахаридов селективно осаждать липопротеины низкой плотности из сыворотки широко использовалось для их выделения и фракционирования [15, 16]. Однако липопротеины связывают сульфатированные полисахариды по специфическому участку, который отсутствует в молекуле ЛИЗ.
Представляло определенный интерес изучение взаимодействия каррагинанов с этим белком, для которого использовали методы турбидиметрического титрования, динамического светорассеяния (ДС) и дифференциальной сканирующей микрокалориметрии (ДСК). Каррагинаны относятся к группе сульфатированных полисахаридов, экстрагируемых из красных водорослей и широко используемых в промышленности в качестве гелеобразующих, стабилизирующих, текстурирующих и суспендирующих агентов [17]. Их структура состоит из чередующихся звеньев (1 → 3)-β-D-галактозы-4SO3–(1 → 4)-3,6,ангидро-α-D-галактозы.
Цель работы – характеристика и сравнение процессов комплексообразования ЛИЗ c двумя видами каррагинанов: каппа (ККГ) и лямбда (ЛКГ), различающихся линейной плотностью заряда и конформационной структурой в растворах.
МЕТОДИКА
Препараты и приготовление растворов. ЛИЗ (КФ 3.2.1.17) куриного белка (диализованный и лиофилизованный продукт, “Sigma-Aldrich”, США) использован без дополнительной очистки. ККГ (“SanofiBio-Industrie”, Франция) имел следующий состав: 94% сухого вещества, 17.03% золы, 5.28% Na+, 0.33% K+, 0.006% Ca++ и 0.009% Mg++, степень сульфатирования составляла 0.2179, dn/dc − 0.115 см3/г, Mw – 567 кДа и Mn – 356 кДа (в 0.1 MLiNO3, 60°C), ионы Cl– не были обнаружены. Средневязкостная молекулярная масса ЛКГ (“Sigma-Aldrich”, США), определенная по характеристической вязкости, как описано ранее [18], составляла 520 кДа ± 50. Использовали воду, очищенную на Milli-Q ультра. Исходные растворы биополимеров готовили диспергированием сухих веществ в воде при перемешивании в течение 1 ч при комнатной температуре с последующим центрифугированием (50 000 g и 23°C) в течение 1 ч для удаления нерастворимых частиц.
Полисахариды перед центрифугированием дополнительно нагревали в течение 20 мин при 80°С. Содержание белка в растворе оценивали методом УФ-спектроскопии при 280 нм, используя коэффициент экстинкции, равный 2.64 млмг−1 см−1 [19]. Концентрацию каррагинанов в растворе определяли после высушивания до постоянного веса при 104°C. Для поддержания требуемых значений рН и ионной силы использовали натриевые или калиевые моно/бифосфатные буферы, рН 7.0 исходной ионной силы 0.60 или 0.317 М, которые добавляли в соответствующем количестве к водным растворам. Смеси белка и полисахарида готовили путем смешивания их растворов с требуемыми концентрациями и перемешивания этих смесей в течение 1 ч при 23°С.
Турбидиметрия. Зависимости мутности систем от весового отношения ККГ/ЛИЗ и ЛКГ/ЛИЗ в смеси (q) получены с помощью спектрометра Unico 2800 UV/VIS (“Unico”, США) при 500 нм. Погрешность измерения составляла 2−3%. В течение роста q определяли точки, характеризующие процесс комплексообразования и переходы от отсутствия к образованию водорастворимых комплексов (qOnset), от водорастворимых к водонерастворимым комплексам (qϕ) и их фазовому разделению, а также точку максимального выхода комплекса (qmax) [20].
Динамическое светорассеяние. Функции “интенсивность светорассеяния – распределение по размерам” для ЛИЗ, ККГ, ЛКГ, и смесей ККГ/ЛИЗ и ЛКГ/ЛИЗ определяли в прямоугольных кюветах (1 см) с помощью “Malvern Zetasizer Nano-ZS” (“Malvern”, Англия), повторяя измерения 7 раз.
Растворы ЛИЗ перед измерением очищали через фильтры DISMIC-25cs (ацетат целлюлозы) c размером пор 0.22 мкм (“Johnson Scientific”, Сингапур). Каррагинаны и их смеси с ЛИЗ использовали без предварительной очистки. Данные по интенсивности светорассеяния обрабатывали по программе, установленной в Malvern Zetasizer Nano.
Дифференциальная сканирующая калориметрия. Термическую денатурацию ЛИЗ в водных растворах в отсутствии и присутствии каррагинанов осуществляли на высокочувствительном дифференциальном сканирующем калориметре “DASM-4M” (“Институт биологического приборостроения, РАН, Россия). Термограммы были получены в интервале 10–100°C при скорости сканирования 2°C/мин и избыточном давлении над жидкостью в ячейке, равном 0.22 МPa. Полученные данные обрабатывали с помощью сервисной программы WSCAL, версия 2.0, основанной на принципах, описанных ранее [21]. Энтальпия денатурации Ван’т Гоффа (приведенная) рассчитывалась согласно [22]:
где R – универсальная газовая постоянная, равная 8.314 Дж К–1 моль–1, Tm – температура максимума пика в К, ΔCm – высота пика в Дж K–1 моль–1, и ΔHcal – экспериментальная энтальпия (площадь под калориметрическим пиком) в Дж моль–1.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Параметры комплексообразования qOnset, qϕ, и qmax. Метод турбидиметрии был применен для изучения влияния условий смешивания компонентов на образование и растворимость комплексов каррагинан/ЛИЗ при pH 7.0 и ионной силе (I) = 0.01. Растворы биополимеров (0.04 вес. %) смешивали до достижения равновесных условий в течение 90 мин при 23°C. При pH 7.0 ς-потенциал ЛИЗ равнялся +6.4 mV, что практически соответствовало литературным данным [23], в то время как ς-потенциалы ККГ и ЛКГ в тех же условиях составляли –28.6 и –50 mV соответственно.
Зависимости мутности при 500 нм (τ500) для системы ККГ/ЛИЗ от q представлены на рис. 1а, а ЛКГ/ЛИЗ – на рис. 1б. Значения мутности при 500 нм (τ500) растворов ЛИЗ и каррагинанов (0.04 вес. %) оказались равными 0.002. При смешивании ЛИЗ с каррагинанами значительно возрастало τ500 (рис. 1а, 1б), что свидетельствовало об образовании комплексов. Выход комплекса зависел от q, поскольку максимум τ500 наблюдался для систем ККГ/ЛИЗ и при q = 0.304, ЛКГ/ЛИЗ – при q 0.304 и 0.309 соответственно, а поведение смесей – от весового соотношения каррагинан/ЛИЗ и, следовательно, от соотношения зарядов биополимеров.
Рис. 1.
Зависимость мутности при 500 нм (τ500) от весового соотношения (а) ККГ/ЛИЗ и (б) ЛКГ/ЛИЗ в смесях при pH 7.0, I = 0.01, 23°C и концентрации ЛИЗ, ККГ и ЛКГ до смешивания 0.04 вес. %; qOnset и qϕ – переходы между отсутствием комплексообразования и образованием водорастворимых комплексов (a'), а также образованием растворимых и нерастворимых комплексов (б')
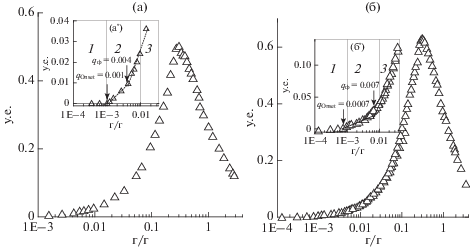
Молярное соотношение компонентов в смеси изучаемых систем может быть определено на основе молекулярных масс ЛИЗ [24], ККГ и ЛКГ, которые составляют 14.3, 567 и 520 кДа соответственно. Расчет показал, что молярное соотношение компонентов составляло 1 : 129 для ККГ/ЛИЗ и 1 : 119 для ЛКГ/ЛИЗ. Эти значения оказались неожиданно близки друг к другу, в то время как плотность заряда молекулы ККГ равна 0.92 сульфатной группы на дисахаридное звено, что более чем в 2 раза меньше, чем ЛКГ [35 ] . Однако при рН 7.0 (условия эксперимента) все катионные группы ЛИЗ и анионные группы каррагинанов должны быть ионизированы. Это свидетельствовало о том, что не все сульфатные группы ЛКГ оказались доступными для комплексообразования. Действительно, в противном случае положение максимума турбидиметрии в ЛКГ/ЛИЗ должно было соответствовать меньшей доли каррагинана в смеси по сравнению с его положением в ККГ/ЛИЗ. При этом интересно отметить, что выход ЛИЗ в комплексную фазу при q = qmax составлял 99.6% для ККГ/ЛИЗ и 99.8% для ЛКГ/ЛИЗ.
Измерение мутности в интервале значений q от 10–4 до 4.0 позволило обнаружить три характерных области комплексообразования (рис. 1a', 1б'), соответствующих отсутствию комплексообразования (1), образованию растворимых комплексов (2) и фазовому разделению нерастворимого комплекса (3) [20]. Фазовые границы характеризовались параметрами qOnset, и qϕ. Так, при одинаковом же значении рН и ионной силы величина qOnset для системы ЛКГ/ЛИЗ (0.0007) оказалась несколько меньше, чем соответствующее значение для системы ККГ/ЛИЗ (0.001), а также системы декстрансульфат/ЛИЗ (0.001), изученной ранее [26].
Размеры частиц комплекса. Размер частиц комплекса определяли методом ДС. На рис. 2 приведены функции интенсивности светорассеяния от распределения частиц по размерам для растворов ЛИЗ и ККГ и смесей ККГ/ЛИЗ (рис. 2а), а также для растворов ЛКГ и его смесей с ЛИЗ (рис. 2б). Как видно на рис. 2а, ЛИЗ присутствовал в растворе в основном как мономер с очень небольшим количеством агрегатов (<0.2%), которые крайне трудно удалить [27]. Определенный средний радиус молекулы ЛИЗ (1.9 нм) соответствовал литературным данным [28]. Оба типа каррагинана характеризовались значительной полидисперсностью. Так, ККГ образовывал два компонента: основной со средним радиусом 59 нм и минорный значительно меньший по интенсивности светорассеяния (804 нм), состоящий из агрегатов его молекул. Анализ функции интенсивности светорассеяния по объему частиц ККГ показал, что объемная фракция этих агрегатов не превышала 10% (данные не представлены). Поскольку основной пик компонента ЛИЗ со средним радиусом 1.9 нм расположен далеко от основного пика компонента ККГ, то после комплексообразования могут быть определены возможные изменения каждого их них. Как видно на рис. 2а, присутствие незначительных количеств ККГ в растворе ЛИЗ (q = 0.02) приводило к появлению пика нового основного компонента, обладающего средним радиусом 800 нм. При этом часть ЛИЗ оставалась не связанной с ККГ. При q = 0.05 свободный ЛИЗ не обнаруживался и пик основного компонента со средним радиусом 860 нм располагался в области 360–4000 нм. При дальнейшем возрастании q наблюдалось многократное увеличение среднего размера ($ \gg $10 мкм) частиц комплекса.
Рис. 2.
Функции интенсивности светорассеяния от распределения частиц по радиусу, полученные при pH 7.0, 23°C и I = 0.01; а – для растворов ЛИЗ (1) и ККГ (2) и их смесей для q = 0.02 (3) и 0.05 (4); б – для растворов ЛИЗ (1) и ЛКГ (2) и их смесей для q = 0.002 (3), 0.003 (4), 0.006 (5) и q = 0.05 (6).
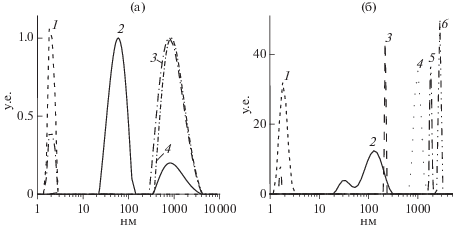
ЛКГ представлен также двумя компонентами, основным со средним размером 129 нм, и минорным значительно меньшим по интенсивности при 34 нм (рис. 2б, кривая 2). Функция интенсивности светорассеяния частиц ЛКГ/ЛИЗ от их распределения по размерам в целом подобна той, которая была получена для смесей ККГ/ЛИЗ. Одно существенное отличие состояло в том, что частицы образовавшегося комплекса характеризовались значительно меньшей полидисперсностью. Таким образом, полученные комплексы ЛКГ/ЛИЗ оказались более монодисперсными по сравнению с комплексами ККГ/ЛИЗ.
Данные оптической микроскопии, полученные при тех же концентрациях ЛИЗ в смесях ККГ/ЛИЗ и ЛКГ/ЛИЗ, представлены на рис. 3. Они свидетельствовали о значительном различии морфологии двух изученных комплексных систем. Комплексы ККГ/ЛИЗ представляли собой асимметричные волокнообразные частицы, количество которых увеличивалось при росте q, достигая максимума при q = 0.3 (рис. 3б). При дальнейшем возрастании q уменьшалось как их количество, так и размер (рис. 3г). Смеси ЛКГ/ЛИЗ характеризовались наличием больших агрегатов, состоящих из сотен маленьких частиц с низкой асимметрией (рис. 3д–3з). Их общий средний размер достигал максимума при q = 0.3 (qmах на рис. 1б), а при больших значениях q уменьшался до размера маленьких частиц (рис. 3з). Таким образом, данные ДС и микроскопии указывали на значительное различие морфологии и структуры комплексных частиц в смесях ККГ/ЛИЗ и ЛКГ/ЛИЗ.
Рис. 3.
Микрофотографии комплексов смесей ККГ/ЛИЗ (а–г) и ЛЛГ/ЛИЗ (д–з) при значениях q, равных (a, д) 0.05, (б, е) 0.3, (в, ж) 1.0 и (г, з) 3.0, pH 7.0, 23°C и I = 0.01 (полная длина изображения 320 мкм).

Рис. 4.
Зависимости мутности при 500 нм (τ500) от q смесей (а) ККГ/ЛИЗ, полученные при значениях ионной силы I 0.001 (1), 0.01 (2), 0.02 (3), 0.03 (4), 0.1 (5), 0.5 (6) и (б) смесей ЛКГ/ЛИЗ – при ее значениях 0.01 (1), 0.02 (2), 0.03 (3), 0.1 (4), 0.2 (5), 0.3 (6), 0.35 (7) и 0.4 (8) при концентрации ККГ, ЛКГ, и ЛИЗ до смешения 0.04%, pH 7.0, 23°C и (а1 и б1) зависимости qmax от ионной силы.
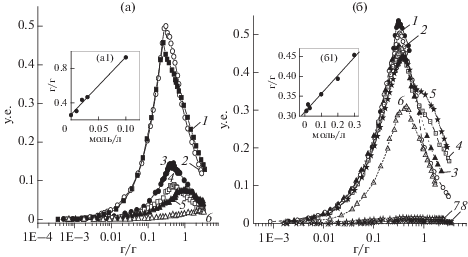
Влияние ионной силы. Для изучения природы сил, стабилизирующих образование нерастворимых комплексов, было изучено влияние ионной силы на процесс комплексообразования. На рис. 4 приведены зависимости мутности τ500 от величины q для обеих систем, полученные при различных ионных силах (I). Как следует из полученных данных для смеси ККГ/ЛИЗ (рис. 4а), ее мутность немонотонно изменялась с увеличением ионной силы. При низкой ионной силе мутность возрастала с ростом I, в то время как при I > 0.01 она резко уменьшалась с ростом I, а при I = 0.5 становилась минимальной. Дальнейшее увеличение ионной силы не приводило к уменьшению мутности системы. Изменение мутности системы ЛКГ/ЛИЗ с ростом I носило другой характер (рис. 4б). С одной стороны мутность системы падала монотонно с возрастанием ионной силы, а с другой – при I ≥ 0.5 становилась равной значению мутности растворов индивидуальных ЛКГ и ЛИЗ. Таким образом, минимальное значение I, выше которого подавлялось комплексообразование, (Iset) равнялось 0.5.
На рис. 4a и 4б, кривые 1 представлены зависимости величины qmax от I для обеих смесей, которые хорошо описывались линейной функцией. Увеличение ионной силы приводило к значительному изменению в них стехиометрии комплекса (максимумы мутности сдвигались к более высоким концентрациям каррагинана). Такие изменения стехиометрии комплекса могли происходить в результате уменьшения заряда каррагинана при высокой ионной силе при его взаимодействии с катионными группами нейтральной соли [29].
Можно предположить, что, поскольку мутность комплекса в смеси KКГ/ЛИЗ всегда оставалась выше, чем мутность растворов индивидуальных ККГ и ЛИЗ (рис. 4а), то в комплексообразовании этих биополимеров значительную роль играли не электростатические силы, а гидрофобные взаимодействия и (или) водородные связи. Для подтверждения этой гипотезы, были определены зависимости значений τ500 от I в присутствии 6 M мочевины и без нее (рис. 5a и 5б). Высокая ионная сила способна препятствовать только электростатическим взаимодействиям между биополимерами, тогда как мочевина – гидрофобным, а также образованию водородных связей. Это позволит анализировать вклад различных межмолекулярных связей в процесс комплексообразования. Из данных, представленных на рис. 5, видно, что значение мутности изменялось не монотонно с ростом ионной силы, как для q = 0.1, так и для q = 0.3. Максимум комплексообразования наблюдался при значении I = 0.025. Поскольку ЛИЗ, как известно, обладает мультиполярным распределением зарядов [30], то можно предположить, что наличие максимума комплексообразования на рис. 5 обусловлено комбинацией короткодействующих межмолекулярных сил притяжения с длительно действующими межмолекулярными силами отталкивания. При низкой ионной силе влияние соли экранировало как отталкивание противоионов, так и усиление ассоциации, тогда как при более высоких ионных силах, соответствующих небольшой длине ДеБайа, добавление соли ослабляло ассоциацию, подавляя комплексообразование.
Рис. 5.
Зависимость мутности τ500 смесей ККГ/ЛИЗ от ионной силы I при q = 0.1 (a), и q = 0.3 (б), смесей ЛКГ/ЛИЗ (в) при отсутствии (1) и присутствии 6 M мочевины (2), pH 7.0, 23°C и концентрации биополимеров в смесях 0.04 вес. %. (Ионную силу изменяли после смешивания растворов биополимеров с низкой ионной силой, 0.01).
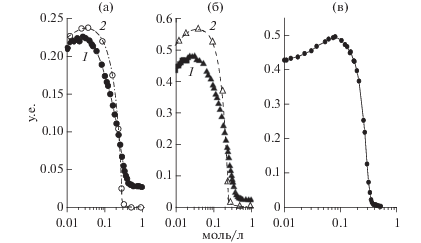
Титрование солью смеси ЛКГ/ЛИЗ также указывало на ее существенное отличие от смеси ККГ/ЛИЗ (рис. 5в). Мутность комплексов ЛКГ/ЛИЗ становилась равной мутности растворов индивидуальных ЛКГ и ЛИЗ, начиная с ионной силы 0.5. Это подтверждало предположение о том, что процесс комплексообразования в данной смеси определялся только электростатическим взаимодействием компонентов.
Термостабильность лизоцима в комплексе. Для изучения термостабильности ЛИЗ в комплексе с ККГ и ЛКГ была использована ДСК. Термограммы ЛИЗ и комплексов ККГ/ЛИЗ приведены на рис. 6. Были рассмотрены три композиции комплексной смеси. Одна их них содержала избыток ЛИЗ (q = 0.1), вторая – максимальный выход комплекса (q = 0.3, рис. 1), а третья – равное количество обоих биополимеров (q = 1.0). В термоскане ККГ присутствовал один асимметричный пик при ~45.8°C, который характеризовался энтальпией перехода 42.3 Дж/г (рис. 6). Этот пик соответствовал плавлению двойной спирали ККГ [36 ] . Термограмма ЛИЗ включала единственный переход с температурой плавления (Тm) 75.2°С (рис. 6) и энтальпией денатурации 36.3 Дж/г или 521 kДж/моль. Полученные результаты практически соответствовали литературным данным [29]. Отношение калориметрической энтальпии к энтальпии Вант-Гоффа составляло 1.27, что свидетельствовало о денатурации молекулы ЛИЗ как одной кооперативной единицы [26].
Рис. 6.
Парциальная удельная теплоемкость ЛИЗ при pH 7.0 в растворах 0.25.%-ным ЛИЗ (1) и ККГ (2), в комплексах в смеси ККГ/ЛИЗ (3) при q = 0.1 и 0.25.%-ном ЛИЗ (a), q = 0.3 и 0.417 вес. % ЛИЗ (б) и q = 1.0 и 0.125 вес. % ЛИЗ (в).
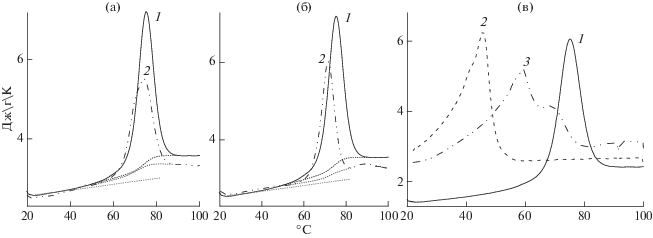
Термограммы комплексов смесей ККГ/ЛИЗ при q = 0.1 и 0.3 характеризовались присутствием пиков с температурами плавления Tm = 74.8 и 71.4°C соответственно, и энтальпиями денатурации 26.5 и 23.6 Дж/г соответственно, которые оказались заметно меньше, чем для свободного ЛИЗ.
Полученные данные, позволили сделать заключение, что ККГ в комплексах смеси ККГ/ЛИЗ при q = 0.1 и 0.3 влиял на термодинамические параметры белка, а ЛИЗ в свою очередь – на термопереход ККГ. Термограмма комплексов смеси при q = 1.0 (высокое содержание ККГ) описывалась двумя взаимно перекрывающимися пиками. Высокотемпературный пик (Tm = 67.8°C) можно было отнести к плавлению ЛИЗ в комплексе, поскольку переход чистого ККГ в растворе с концентрацией, равной концентрации ККГ в смеси ККГ/ЛИЗ при q = 1.0, заканчивался при 58°С (рис. 7). Можно предположить, что ККГ уменьшал стабильность ЛИЗ при термоденатурации. Согласно данным работы [32 ] , уменьшение температуры плавления при связывании белка с лигандом указывает на более высокое сродство лиганда к денатурированному белку, чем нативному. Полученные данные хорошо соответствовали полученными ранее результатами изучения комплексообразования ЛИЗ с такими анионными полиэлектролитами, как гепарин [30], поливинилсульфат [30, 33 ] и полиакриловая и метакриловая кислоты [34 ] . Форма низкотемпературного пика (Tm = 59.4°C), приведенного на рис. 6в подобна форме пика раствора ККГ (Tm = 45.8°C), у которого на левой стороне присутствовало небольшое плечо. В связи с этим низкотемпературный пик смеси ККГ/ЛИЗ при q = 1.0 можно отнести к термопереходу свободного или частично связанного с белком ККГ. Можно также предположить, что более высокие значения Tm связанного ККГ по сравнению со свободным отражали увеличение конформационной стабильности спиральной структуры полисахарида, связанного в комплекс с ЛИЗ. Термограммы комплексов смесей ЛКГ/ЛИЗ при различных значениях q, полученные в тех же условиях, как и для смесей ККГ/ЛИЗ (рН 7.0, I = 0.01), представлены на рис. 8 . Отношение калориметрической энтальпии к van’tHoff энтальпии во всех случаях оказалось равным 1.0 ± 0.2. Это предполагало, что и свободный, и связанный в комплекс с ЛКГ фермент денатурировал как одна кооперативная единица. Поэтому все термограммы могут быть описаны одним переходом. Были рассмотрены пять составов комплексной смеси, содержащей избыток ЛИЗ (q = 0.1), максимальный выход комплекса (согласно данным турбидиметрии на рис. 1б) (q = 0.3), равное количество биополимеров в смеси (q = 1.0) и избыток ЛКГ (q = 2 и 5).
Рис. 7.
Избыточная удельная теплоемкость ЛИЗ при pH 7.0 в растворе, содержащем 0.125% (1), и растворах комплексов в смесях ЛКГ/ЛИЗ для q: 0.1 (2), 0.3 (3), 1.0 (4), 2.0 (5) и q = 5.0 (6), содержащих одинаковое количество ЛИЗ.
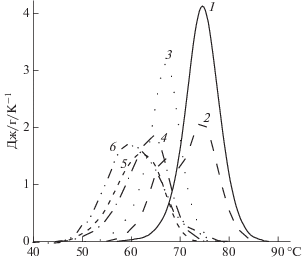
На термограмме комплексов смеси ЛКГ/ЛИЗ при q = 0.1 присутствовал пик плавления Tm = 74.5°C с плечом при 67°C. Энтальпия денатурации смеси составляла 382.55 кДж\моль или 26.75 Дж/г, что оказалось значительно меньше, чем в случае свободного ЛИЗ. Таким образом, стабильность ЛИЗ к термоденатурации существенно уменьшалась даже при незначительной доли ЛКГ в смеси при q = 0.1. Термограммы комплексов смесей ЛКГ/ЛИЗ при q = 0.3, 1.0, 2.0 и 5.0 также содержали симметричные пики, значения Tm которых (67.3, 64.5, 61.8 и 59.8°C соответственно) уменьшались с ростом q. В то же время энтальпия денатурации ЛИЗ в этих смесях также уменьшалась с ростом q от 363.16 кДж\моль (25.4 Дж/г) при q = 0.3 до 263.09 кДж\моль (18.4 Дж/г) при q = 2.0 (рис. 7). При одинаковых значениях рН, ионной силы и q термостабильность ЛИЗ в комплексе с ЛКГ снижалась значительно существенней по сравнению с менее заряженным ККГ. Можно предположить, что это происходило в результате сильного взаимодействия ЛКГ с ЛИЗ, обусловленного более высокой плотностью заряда ЛКГ по сравнению с ККГ.
Таким образом, полученные данные позволили установить общие закономерности и различия во взаимодействии молекул каррагинанов с различной плотностью заряда с белком (ЛИЗ), который не обладал специфическим центром связывания с сульфатированными полисахаридами. Было показано, что комплексы ЛИЗ с ККГ стабилизировались как кулоновскими, так и вторичными взаимодействиями, в то время как комплексообразование ЛИЗ с ЛКГ протекало только с участием сил электростатической природы. При pH 7.0 и ионной силе I = 0.01 состав смесей ККГ/ЛИЗ и ЛКГ/ЛИЗ составлял 0.3 : 1 (вес/вес) или 1 : 120 (моль/моль) соответственно, и с увеличением ионной силы в них монотонно увеличивалось содержание каррагинана. Образующиеся комплексы ККГ/ЛИЗ и ЛКГ/ЛИЗ сильно различались по морфологии. Первые из них содержали сильно асимметричные волокнообразные частицы, а вторые – симметричные мелкие частицы, образующие между собой более крупные конгломераты большего размера. Влияние ионной силы на комплексообразование носило не монотонный характер. Оно приводило к потере термостабильности ЛИЗ (более значительной в случае системы ЛКГ/ЛИЗ). Это указывало на большее сродство каррагинанов к денатурированной форме ЛИЗ, чем к нативной. Полученные результаты могут быть использованы в процессах переработки белка. Так, при низкой ионной силе молекулы ЛИЗ могут обратимо связывать каррагинаны и высвобождаться из комплекса при добавлении соли или мочевины. Это позволит использовать данные смеси в биотехнологии в качестве переносчиков ферментов.
Список литературы
Tolstogusov V.B. // Food Hydrocolloids. 1991. V. 4. № 6. P. 429–468.
Piculell L. Food Polysaccharides and Their Applications. / Ed. A.M. Stephan. N.Y.: Marcel Dekker, 1995. P. 205–244.
Guiseley K.B., Stanley N.F., Whitehouse P.A. Handbook of Water-Soluble Gums and Resins / Ed. R.L. Davidson. N.Y.: McGraw–Hill, 1980. P. 5–11.
Galazka V.B., Ledward D.A., Sumner I.G., Dickinson E. // J. Agric. Food Chem. 1997. V. 45. № 9. P. 3465–3471.
Galazka V.B., Smith D., Ledward D.A., Dickinson E. // Food Hydrocolloids. 1999. V.13. № 2. P. 81–88.
Bourriot S., Garnier C., Doublier J-L. // Carbohydr. Polym. 1999. V. 40. № 2. P. 145–157.
Langendorff V., Cuvelier G., Michon C., Launay B., Parker A., de Kruif C.G. // Food Hydrocolloids. 2000. V. 14. № 3. P. 273–280.
OuldEleya M.M., Turgeon S.L. // Food Hydrocolloids. 2000. V. 14. № 1. P. 29–40.
OuldEleya M.M., Turgeon S.L. // Food Hydrocolloids. 2000. V. 14. № 3. P. 245–251.
Antonov Y.A., Gonçalves M.P. // Food Hydrocolloids. 1999. V. 13. № 6. P. 517–524.
Michon C., Vigouroux F., Boulenger P., Cuvelier G., Launay B. // Food Hydrocolloids. 2000. V. 14. № 3. P. 203–208.
Antonov Y.A., Zhuravleva I.L., Cardinaels R., Moldenaer P. // Food Hydrocolloids. 2017. V. 70. № 1. P. 8–13.
Imeson A.P., Ledward D.A., Mitchell J.R. // J. Sci. Food Agric. 1977. V. 28. № 8. P. 661–667.
Dickinson E. // Trends Food Sci. Tech. 1998. V. 9. № 10. P. 347–354.
Cornvell D.G., Kruger F.A. // J. Lipid. Res. 1961. V. 2. № 2. P. 110–134.
Oncley J.I., Walton K.W., Cornwell D.G. //. J. Amer. Chem. Soc. 1957. V. 79. № 17. P. 4666–4671.
van de Velde F. // Food Hydrocolloids. 2008. V. 22. № 5. P. 727–734.
Rochas C., Rinaudo M., Laundry S. // Carbohydr. Polym. 1990. V. 12. № 3. P. 255–266.
Aune K.C., Tanford C. // Biochem. 1969. V. 8. № 11. P. 4579–4585.
Carlsson F., Linse P., Malmsten M. // J. Phys. Chem. B. 2001. V. 105. № 38. P. 9040–9049.
Филимонов В.В., Потехин С.А., Матвеев С.В., Привалов П.Л. // Молекулярная биология. 1982. Т. 16. № 3. С. 551–562.
Velicelebi G., Sturtevant, J. // Biochem. 1979. V. 18. № 7. P. 1180–1186.
Kuehner D.E., Engmann J., Fergg F., Wernick M., Blanch H.W., Prausnitz J.M. // J. Phys. Chem. B., 1999. V. 103. № 8. P. 1368–1374.
Rezwan K., Meier L.P., Gauckler L.J. // Biomaterials. 2005. V. 26. № 21. P. 4351–4357.
Hugerth A., Sundelöf L.O. // Biopolymers. 2001. V. 58. № 2. P. 186–194.
Antonov Y.A., Zhuravleva I.L., Cardinaels R., Moldenaers P. // Food Hydrocolloids. 2015. V. 44. № 1. P. 71–80.
Bruzzesi M.R., Chianconi E., Antonini E. // Biochem. 1965. V. 4. № 9. P. 1797–1800.
Parmar A.S., Muschol M. // Biophys. J. 2009. V. 97. № 2. P. 590–598.
Takemasa M., Nishinari K. // Colloids Surfaces B: Biointerfaces. 2004. V. 38. № 3. P. 231–240.
Van de Weert M., Andersen M.B., Frokjaer S. // Pharm. Res. 2004. V. 21. № 12. P. 2354–2359.
Grinberg V.Y., Grinberg N.V., Usov A.I., Shusharina N.P., Khokhlov A.R., de Kruif K.G. // Biomacromolecules. 2001. V. 2. № 3. P. 864–873.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


