Палеонтологический журнал, 2021, № 1, стр. 80-93
Распространение и дифференциация по отпечаткам крыльев ископаемых видов Oecophylla (Hymenoptera: Formicidae)
К. С. Перфильева *
Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: ksenperf@mail.ru
Поступила в редакцию 05.05.2020
После доработки 22.05.2020
Принята к публикации 22.05.2020
Аннотация
В коллекции Палеонтологического института им. А.А. Борисяка РАН имеется 10 образцов с отпечатками из среднего миоцена Ставропольского края, принадлежащих Oecophylla Smith, 1860. Описаны отличительные признаки жилкования крыльев этого рода, позволяющие идентифицировать ископаемых представителей. Предложен способ дифференциации однотипных отпечатков передних крыльев представителей Formicinae на примере Oecophylla, основанный на исследованиях рецентных муравьев. Представляется, что наиболее древние отпечатки Oecophylla имеются в эоценовых местонахождениях Северной Америки, где в настоящее время экофиллы не обитают, несмотря на подходящие климатические условия. Предложено объяснение особенностей исторического распространения муравьев-портных на основании особенностей их экологии, поведения и конкурентных отношений в мирмекокомплексах.
ВВЕДЕНИЕ
Отпечатки муравьев из местонахождений среднего миоцена у Сенгилеевского озера Ставропольского края – Вишневая Балка, расположенного в 18 км к западу от г. Ставрополя вдоль р. Вишневой, и Темнолесская, расположенного рядом с одноименным населенным пунктом у р. Егорлык (колл. ПИН, №№ 224, 254) – были описаны Г.М. Длусским (1981). При первом описании в числе других был выделен паратаксон “Camponotites” в ранге рода с типовым видом C. macropterus Dlussky, 1981. Паратаксон включал в себя описания отпечатков отдельных крыльев, сходных с типом жилкования переднего крыла представителей Camponotus: наличие замкнутых ячеек 3r, 1 + 2r и отсутствие ячеек rm и mcu; ветви RS и M выходят из одного узелка, поперечная cu‑a расположена проксимальнее развилка M и Cu на расстоянии не менее длины cu-a (номенклатуру жилкования см. табл. IX , фиг. 1, 2; см. вклейку). Подобные крылья у Formicinae имеются у представителей нескольких триб (Camponotini, Oecophyllini, Gigantiopini, Plagiolepidini), а также у представителей с небольшими размерами тела других триб (напр., самцы Lasius, Lasiini). Позднее выяснилось, что название этого формального таксона преоккупировано: Г. Штейнбах (Steinbach, 1967) описал вид муравьев Camponotites silvestris Steinbach, 1967 из позднего плиоцена Виллерхаузена, Сев. Германия (Нижняя Саксония). Таким образом в этот формальный таксон также вошли ранее описанный C. silvestris и C. steinbachi Dlussky, Karl et Brauckmann, 2011 из этого же местонахождения, а также C. kraussei Dlussky et Rasnitsyn, 1999 из нижнего эоцена Северной Америки (Формация Клондайк Маунтин, г. Рипаблик, шт. Вашингтон, США) (Steinbach, 1967; Длусский, Расницын, 1999; Dlussky et al., 2011). Несмотря на то, что экземпляры C. silvestris и C. steinbachi – это тела самок с крыльями, различимые некрыловые признаки не позволяли достоверно отнести отпечатки к какому-либо роду, поэтому диагноз паратаксона “Camponotites” основывается исключительно на жилковании переднего крыла. Руководствуясь особенностями жилкования крыльев и другими характерными признаками, мы перенесли C. kraussei и C. macropterus в род Oecophylla (Перфильева и др., 2017).
Рис. 1.
Результаты анализа изменчивости жилкования передних крыльев представителей Formicinae методами геометрической морфометрии: а – изменчивость, характеризующаяся однородной компонентой (UNI2), отражает отличия крыльев самок от самцов в выборке Formica+Lasius; б – локальные отличия по маркерным точкам между крыльями Lasius и Formica (RW1); в – половые и видовые различия между видами Camponotus (самцы обозначены темными значками); г–ж – группирование в пространстве векторов однородной компоненты (г и д) и первых двух относительных деформаций без учета однородной компоненты (е и ж) выборок Formica + Lasius и усредненных (консенсусных) конфигураций выборок Camponotus + Lasius (самцы обозначены квадратами, самки – кружками).
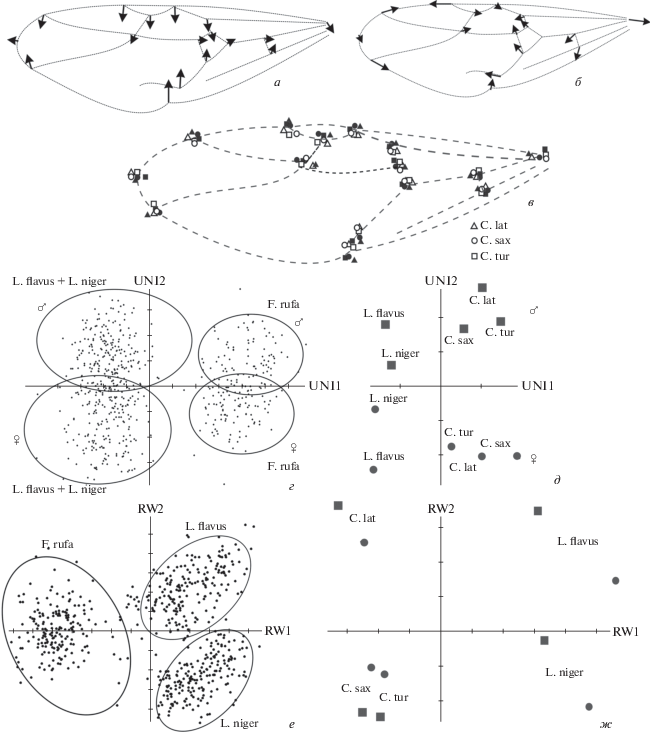
Рис. 2.
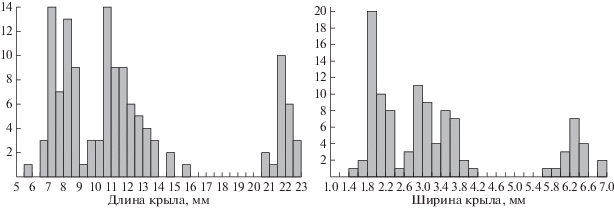
Распределение по длине и ширине крыла отпечатков крыльев Oecophylla (Бембридж, Великобритания).
В настоящей работе мы описываем обнаруженные нами и ранее не описанные (три отпечатка), либо отнесенные к “Camponotites” или Formicidae incertae sedis отпечатки (семь отпечатков) Oecophylla из местонахождений Вишневая балка и Темнолесская (средний миоцен, Ставропольский край, Россия). Представляем обобщение имеющихся на сегодня данных по палеонтологическим находкам Oecophylla. На примере ископаемых представителей этого рода предлагаем способ анализа жилкования крыльев при исследовании палеонтологических остатков муравьев.
Результаты обработки массовых отпечатков передних крыльев частично были опубликованы нами ранее (Perfilieva, 2008; Antropov et al., 2014), но описание способа дифференциации отпечатков крыльев, представляющее самостоятельную ценность, мы не публиковали до настоящего времени. Согласно нашим данным, среди отпечатков крыльев позднеэоценовых мергелей Бембриджа из коллекции Музея естественной истории (Лондон, Великобритания) около 60% составляют крылья Oecophylla (304 отпечатка из 485). Распределение по длине крыльев побудило первых исследователей предположить наличие трех видов (O. megarche, O. atavina, O. perdita) и даже больше (Cockerell, 1915; Donisthorpe, 1920). В работе Т. Коккереля описанные три вида представлены типовыми экземплярами самок с длиной крыла 7 (O. atavina), 12.75, 11 (O. perdita) и 20.5 мм (O. megarche), и одним самцом (O. perdita) с длиной крыла 7 мм.
Как следует из описания, виды, выделенные Коккерелем, отличаются по размерам особей (крыльев) самок, но не самцов O. atavina и O. perdita и соотношением участков 1RS и 1M. Форма вершины ячейки 1 + 2r, по его собственному замечанию, не является специфичной, т. к. может быть различной на разных сторонах тела у одного экз. Camponotus novaeboracensis (Fitch, 1855), сходного с Oecophylla по типу жилкования. Х. Донисторп определил 42 экз. с длиной крыла в пределах 22–24.5 мм, как самок O. megarche (Donisthorpe, 1920). Остальные 245 экз. были значительно меньше последних. Однако разделить их согласно коккерелевским видам не удалось, т.к. значения различных параметров крыльев этой выборки сильно варьировали. Донисторп не мог предложить на тот момент способа для выделения видов в этой выборке, но предполагал, что, возможно, эти новые виды будут совпадать или перекрывать виды, выделенные Коккерелем. Таким образом, несмотря на большое число экземпляров, принадлежащих данному роду, не было описания признаков выделенных видов.
МАТЕРИАЛ И МЕТОДЫ
Материалом для данной работы послужили отпечатки муравьев из местонахождений Вишневая балка и Темнолесская среднего миоцена Ставропольского края из коллекции лаб. артропод Палеонтологического ин-та им. А.А. Борисяка РАН (ПИН).
Количественный анализ различий проведен на отпечатках крыльев Oecophylla из верхнеэоценовых мергелей о. Уайт, Бембридж, Великобритания, хранящихся в Музее естественной истории (Лондон) (Antropov et al., 2014). Для анализа были взяты наиболее хорошо сохранившиеся отпечатки передних крыльев Oecophylla как с телами муравьев, так и отдельные. С помощью окуляр-микрометра измеряли длину (FWL) и ширину крыла, где это было возможно. Промерены 130 экз. (125 для FWL, 105 для ширины крыла, на некоторых отпечатках можно было точно определить только один из этих параметров), из которых 64 наиболее хорошо сохранившихся были оцифрованы.
Результаты анализа изменчивости жилкования передних крыльев шести рецентных видов Formicinae с разными типами жилкования [Formica rufa L., 1761, Lasius niger (L., 1758), L. flavus (Fabricius, 1782), Camponotus saxatilis Ruzsky, 1895, C. lateralis (Olivier, 1792), C. turkestanicus Emery, 1887] взяты из ранее опубликованных работ (Перфильева, 2007, 2008).
Анализ изменчивости жилкования был проведен пакетом программ геометрической морфометрии (TPSdig, TPSrelw, GRF) (Rohlf, 1998; Pavlinov, 2001). Основным преимуществом данного анализа является возможность количественной оценки различия форм объектов независимо от различий в размерах сравниваемых объектов, а также графическое отображение различий. Форма объектов, в данном случае изображения крыльев, описывается не линейными промерами или их производными, а декартовыми координатами меток, расставленных на изображение объекта. Метки (маркерные точки) расставляются на объекте по усмотрению исследователя, согласно поставленной задаче. Метод не ограничивает числа меток, что позволяет охватить и оценить большое количество признаков. Исключение влияния абсолютных размеров происходит благодаря процедуре выравнивания исследуемых объектов относительно усредненного для данной выборки объекта. Выравнивание объектов осуществляется за счет изометрического сжатия-растяжения, а также вращения объектов друг относительно друга, при которых по принципу наименьших квадратов минимизируется разница значений координат по всем меткам. При сравнении заданных таким образом объектов взаимные преобразования форм представляются, как смещения заданных меток относительно друг друга. Следовательно, дается наглядное представление о характере различий форм и величине изменчивости в конкретных областях объекта. Метод позволяет сравнивать как выборки объектов, так и усредненные (консенсусные) конфигурации выборок.
Методы геометрической морфометрии позволяют выделить так называемую однородную компоненту. Она отражает долю нелокализуемых изменений формы, т.е., изменений одинаковых в окрестностях всех меток (например, относительное сужение объекта). Все вычисления, а также графическое отображение результатов сравнения производятся пакетом программ, находящихся в свободном доступе в сети интернет.
В программе-дигитайзере на цифровые изображения крыльев были проставлены маркерные точки по максимально возможному числу узловых мест, описывающих жилкование данного типа крыльев (пересечение жилок, метки, характеризующие длину и ширину крыла) (табл. IX , фиг. 1). При сравнении разных типов жилкования лишние маркерные точки, обозначающие положение поперечной жилки m-cu, убирали из анализа. Анализ результатов проводился в программе TPSrelw, позволяющей оценить относительные смещения маркерных точек у разных выборок.
Статистический анализ частотных распределений промеров (длины и ширины крыла) проводился в программе Statistica 6.0.
ОПИСАНИЕ ОТПЕЧАТКОВ ИЗ СТАВРОПОЛЬСКОГО КРАЯ
Среди отпечатков из местонахождений Вишневая балка и Темнолесская, имеющихся на данный момент в коллекции лаб. артропод ПИН, помимо ранее описанных Длусским (1981) отпечатков в ранге паратаксона “Camponotites” (№№ 254/2880, 254/2414, 254/2847, 254/2853, 254/2418), в ранге Formicidae incertae sedis (№№254/1106, 254/2522), было найдено три дополнительных ранее не описанных отпечатка (№№ 254/997, 254/2395, 254/2911), принадлежащих муравьям рода Oecophylla. Один отпечаток переднего крыла, экз. № 254/2880, ранее был перенесен нами в Oecophylla (Перфильева и др., 2017).
СЕМЕЙСТВО FORMICIDAE LATREILLE, 1802
ПОДСЕМЕЙСТВО FORMICINAE LATREILLE, 1802
Диагноз (по крыльям). В передних крыльях ячейка 3r всегда замкнута. У мелких представителей (FWL < 4 мм) Brachymyrmex может выглядеть незамкнутой, поскольку жилка 5RS не достигает края крыла и 4R1 и в самой верхушке ячейки становится спектральной (несклеротизирована). Жилка 2r-rs относительно длинная и всегда отчетливо наклонная (узел соединения 2r-rs с радиус-сектором и медиальной жилкой всегда дистальнее места соединения с птеростигмой). Свободные ветви RS и M расходятся из одного узелка. Наиболее примитивный тип переднего крыла с медиокубитальной ячекой (mcu), без кубитоанальной ячейки (2cua), но иногда имеется жилка Cu2. В подавляющем большинстве случаев ячейка mcu относительно небольшая и трапециевидная, находится заметно проксимальнее птеростигмы. Медиокубитальная ячейка обычно отсутствует у представителей триб Plagiolepidini, Camponotini, Oecophylini, но m-cu может быть редуцирована и у мелких представителей (часто у самцов) других триб, представители которых обычно имеют m-cu. Поперечная cu-a расположена на значительном расстоянии от развилка Cu и M и близко к основанию крыла, так что индексы Icu = 1.6–2.8, Icua = 1.2–2.411.
Задние крылья имеют две продольные ветви RS и Cu, иногда имеется нерегулярная дистальная часть медиальной жилки. Югальная лопасть и срединные крючки отсутствуют.
Замечания. Подсемейство, включающее 51 современный и 31 вымерший род и 3179 видов (AntWeb, 2020), характеризуется всего двумя типами жилкования передних крыльев: три дистальные замкнутые ячейки – 1 + 2r (которая у всех формицин является результатом слияния трех ячеек – 1r + 2r + rm), 3r и mcu (трибы Lasiini, Formicini, Gesomyrmecini) или только две радиальные – 1 + 2r и 3r (трибы Camponotini, Plagiolepidini, Oecophyllini) (табл. IX , фиг. 2). Иногда представители одной и той же трибы могут иметь разное жилкование. Например, самки Prenolepis imparis (Say, 1836) или Lasius niger (L., 1758) (Lasiini) имеют m-cu, в то время как самцы зачастую нет (Перфильева, 2000). По причине однообразия типов жилкования и нестрогости их распределения по таксонам различать роды и виды формицин по фрагментам крыльев у ископаемых форм весьма затруднительно. Характерные особенности жилкования крыльев Oecophylla позволяют однозначно определять представителей этого рода. Однако с другими таксонами этого подсемейства невозможно однозначно трактовать принадлежность крыльев из-за слабой изученности изменчивости жилкования внутри Formicinae. Для таких случаев предложено использовать описание отпечатков крыльев в рамках паратаксонов (Расницын, 1986).
Род Oecophylla F. Smith, 1860
Типовой вид: Oecophylla smaragdina (Fabricius, 1775), современный.
Диагноз (по крыльям; табл. IX , фиг. 2). Передние крылья с замкнутыми 3r и 1 + 2r ячейками, ячейки rm и mcu отсутствуют. Ячейка 3r по длине приблизительно как 1 + 2r, но значительно уже, т.к. нижний край, ограниченный 5RS, заметно (характерно) вогнут. Ячейка 1 + 2r снизу ограничена выпуклым отрезком RS + M, иногда в дистальной части значительно изогнутым; 2R1 значительно короче 1R1, основная (почти вся) часть верхней границы ячейки 1 + 2r сформирована 1R1. Птеростигма узкая. Проксимальная часть птеростигмы относительно места отхождения 2r‑rs обычно короче, чем дистальная. Таким образом, большая часть птеростигмы расположена в ячейке 3r. Поперечная 2r-rs значительно наклонена нижним концом к вершине крыла. Жилки 5RS и 4M выходят из одного узелка. 1RS и 1M лежат на одной линии.
Задние крылья без продольной M. Поперечная cu-a расположена так, что 1M + Cu не короче 2M + Cu. Отрезок 1RS хорошо выражен и, по крайней мере, у некоторых видов отчетливо наклонный. Поперечная жилка, образованная 1M и rs-m значительно (характерно) вогнутая.
Размеры крылатых самок чаще крупные или средние. Половой диморфизм по размерам хорошо выражен, поэтому крылья самок значительно больше, чем у самцов.
Видовой состав. До недавнего времени выделяли два современных вида – O. smaragdina, распространенный в Ориентальной области и Индо-Малайском регионе, и O. longinoda (Latreille, 1802), обитающий в Афротропическом регионе. В 2015 г. описан третий вид, O. kolhapurensis Kurane, Bhoje et Sathe, 2015, по 8 экземплярам (1 голотип и 7 паратипов) рабочих особей, собранных на юге Индии (Kurane et al., 2015). На данный момент описано 16 ископаемых видов этого рода. Наиболее древние находки из раннего эоцена (Формация Клондайк Маунтин, шт. Вашингтон, США: Длусский, Расницын, 1999): Camponotites kraussei Dlussky et Rasnitsyn, 1999, который по характерным признакам жилкования переднего крыла и удлиненному петиолюсу мы отнесли к Oecophylla (Перфильева и др., 2017). Из нижнего и среднего эоцена Европы описаны два вида: O. longiceps Dlussky, 2008 (Мессель, Германия) и O. eckfeldiana Dlussky, 2008 (Экфельд, Германия) (Dlussky et al., 2008), из верхнего эоцена – шесть: O. brischkei Mayr, 1868 и O. crassinoda Wheeler, 1922 (=O. brevinodis Wheeler, 1915) (балтийский янтарь: Mayr, 1868; Wheeler, 1915, 1922), O. praeclara Forster, 1891 (Брунштадт, Германия: Förster, 1891), O. bartoniana Cockerell, 1920 (Борнмут, Великобритания: Cockerell, 1920), O. atavina Cockerell, 1915 и O. megarche Cockerell, 1915 (Бембрижд, Великобритания: Cockerell, 1915; Antropov et al., 2014).
Из олигоценовых отложений Европы описаны O. superba Theobald, 1937 (Кляйнкембс, Франция: Theobald, 1937) и O. sicula Emery, 1891 (сицилийский янтарь: Emery, 1891).
Из миоцена известны O. obesa (Heer, 1849) (Хорватия: Heer, 1849; Dlussky, Putyatina, 2014), O. leakeyi Wilson et Taylor, 1964 (Кения: Wilson, Taylor, 1964), O. grandimandibula Riou, 1999 (Montagne d’Andance, Ardeche, France), O. macroptera (Dlussky, 1981) и O. taurica Perfilieva, Dubovikoff et Dlussky, 2017 (Крым, Россия: Перфильева и др., 2017).
Сравнение. Некоторые признаки жилкования могут встречаться у представителей других родов, но сочетание признаков однозначно указывает на принадлежность к экофилле. Например, в переднем крыле Colobopsis leonardi (Emery, 1889) ячейка 3r очень узкая и имеет характерный изгиб 5RS, однако, в отличие от крыла Oecophylla, ячейка 1 + 2r значительно короче, чем 3r, а также соотношение 2R1/1R1 гораздо больше (табл. IX , фиг. 2).
Замечания. Из нижнего и среднего эоцена Северной Америки, по нашим оценкам опубликованных изображений отпечатков муравьев, в роде Oecophylla необходимо описать экземпляры: SFU Q-04-09 (самка, FWL около 21 мм, Quilchena, British Columbia: Archibald, Mathewes, 2000, рис. 12 ) (табл. IX , фиг. 3); BC1-361 (самец, FWL около 8 мм) и BC1-025B (переднее крыло FWL около 13 мм) (Benton, Tallahatta Formation, Mississippi: Johnston, 1993, табл. 1, фиг. 6 , табл. 2, фиг. 8 ).
Рис. 3.
Географическое распространение современных и ископаемых представителей Oecophylla. Область распространения современных видов дана серым цветом. Местонахождения ископаемых видов отмечены звездочками и пронумерованы: 1 – Бентон, формация Таллахата, Миссисипи, США (средний эоцен); 2 – Рипаблик, формация Клондайк Маунтин, Вашингтон, США (ранний эоцен); 3 – Квилчена, формация Колдуотер бедс, Британская Колумбия, Канада (ранний эоцен); 4 – Борнмут и Бембрижд (о. Уайт), Великобритания (поздний эоцен); 5 – Ардеш, Montagne d’Andance, Франция (миоцен); 6 – Кляйнкембс, Франция (олигоцен) и Брунштадт, Германия (поздний эоцен); 7 – Мессель и Экфельд, Германия (средний эоцен); 8 – биттерфельдский (саксонский) янтарь (поздний эоцен); 9 – балтийский янтарь (поздний эоцен); 10 – сицилийский янтарь (олигоцен); 11 – Радобой, Хорватия (миоцен); 12 – п-ов Крым, Россия (поздний миоцен); 13 – Ставропольский край, Россия (средний миоцен); 14 – Mfwangano Island, Кения, Африка (миоцен).
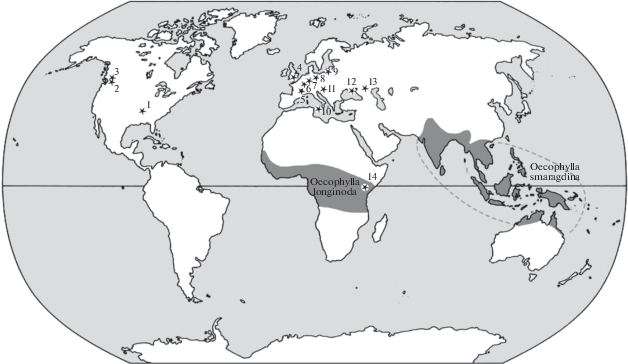
Таблица 1.
Средние значения и другие характеристики распределения по длине передних крыльев (мм) в исследованных выборках
| Выборка | Число особей | Среднее | Минимальное значение | Максимальное значение | Дисперсия |
|---|---|---|---|---|---|
| Camponotus saxatilis (♀) | 15 | 15.2 ± 0.15 | 13.5 | 15.8 | 0.36 |
| C. saxatilis (♂) | 30 | 8.3 ± 0.11 | 6.8 | 9.4 | 0.37 |
| C. lateralis (♀) | 38 | 7.4 ± 0.03 | 7.0 | 7.8 | 0.04 |
| C. lateralis (♂) | 60 | 4.5 ± 0.03 | 4.1 | 5.2 | 0.07 |
| C. tukestanicus (♀) | 25 | 13.1 ± 0.06 | 12.4 | 13.8 | 0.09 |
| C. tukestanicus (♂) | 42 | 6.5 ± 0.05 | 6.0 | 7.4 | 0.12 |
| Lasius flavus (♂) | 100 | 4.0 ± 0.02 | 3.5 | 4.6 | 0.03 |
| L. flavus (♀) | 100 | 8.4 ± 0.02 | 8.0 | 8.8 | 0.03 |
| Formica rufa (♂) | 84 | 8.8 ± 0.04 | 7.8 | 9.5 | 0.11 |
| F. rufa (♀) | 100 | 9.3 ± 0.03 | 8.7 | 10.1 | 0.08 |
| L. niger (♂) | 100 | 5.0 ± 0.02 | 4.5 | 5.4 | 0.04 |
| L. niger (♀) | 98 | 8.8 ± 0.02 | 7.8 | 9.3 | 0.06 |
Таблица 2.
Коллекционные номера, длина крыльев и предполагаемый пол отпечатков средней группы по результатам анализа методами ГМ
| Коллекционный номер отпечатка/ пол согласно анализу | Порядковый номер на рис. | Длина переднего крыла, мм |
|---|---|---|
| 8703/♂ | 1 | 10.6 |
| 8729/♂ | 4 | 11.4 |
| 17349/♂ | 11 | 14.8 |
| 24864/♂ | 19 | 10.6 |
| 24908/♂ | 20 | 12.5 |
| 25011/♂ | 22 | 12.3 |
| 25090/♂ | 26 | 7.2 |
| 25153/♀ | 30 | 13.1 |
| 25165/♂ | 31 | 13.7 |
| 25167/♂ | 32 | 10.6 |
| 25172/♀ | 33 | 12.8 |
| 25183/♂ | 40 | 7.5 |
| 25347/♀ | 34 | 11.4 |
| 25749/♀ | 35 | 10.6 |
| 43482/♂ | 41 | 7.7 |
| 61420/♀ | 37 | 12.8 |
| 61421/♀ | 38 | 12.0 |
Длусский сообщил об обнаружении им видов O. brischkei и O. crassinoda в биттерфельдском (саксонском янтаре) (Dlussky et al., 2008). O. bartoniana и O. praeclara описаны по изолированным передним крыльям, поэтому они могут принадлежать одному из описанных видов. Вызывает сомнение отнесение Длусским (Dlussky, Putyatina, 2014) к Oecophylla двух экз. самцов Attopsis anthracina (Heer) (GBA № 2009/016/0634) и A. nigra (Heer) (GBA № 2009/016/0118) из Радобоя (Хорватия), описанных О. Хеером (Heer, 1849) как Attopsis.
Выделение нового рецентного вида O. kolhapurensis на основании представленного авторами (Kurane et al., 2015) описания признаков слабо аргументировано, поэтому этот вид нуждается в синонимизации с O. smaragdina или переописании.
Oecophylla macroptera (Dlussky, 1981)
Табл. IX , фиг. 4–9
“Camponotites” macropterus: Длусский, 1981, с. 76, рис. 53 е.
Голотип – ПИН, № 254/2880, прямой и обратный отпечатки переднего крыла самки; Ставропольский край, Вишневая балка, обн. № 3, слой IX; средний миоцен, караганский горизонт, 13 Ма.
Описание. Передние крылья самки с ячейками 3r, 1 + 2r. Вершины ячейки 3r не видно. 2r-rs начинается вблизи основания птеростигмы. Положение жилки cu-a: Icua 1.7. Жилка RS + M слабо и плавно выгнута в дистальной части крыла, в проксимальной части почти прямая. В заднем крыле cu-a расположена так, что первый и второй отрезки M + Cu приблизительно равны. Поперечная жилка, образованная 1M и rs-m выгнута несколько больше, чем Cu. Свободная ветвь Cu слегка загибается дистальным концом внутрь крыла, 2A прямая.
Петиолюс самца удлиненный, длина его видимой части до слабо выраженного узелка более чем в 2.2 раза больше ширины.
У крыльев экз. №№ 254/997 и 2418 не видно особенностей 3r, отнесены к этому виду по пропорциям других частей крыла.
Размеры в мм. Переднее крыло самки около 17.2; самцы: переднее крыло 8–9.2, заднее крыло 5–6.3. Видимая часть груди самца № 254/2911: длина 2.9, ширина 1.9, длина петиолюса до узелка 1.1. Длина груди самца 254/2414 3.2, ширина 2.1, петиолюс – длина 1.1, ширина в районе узелка 0.5, длина тела без головы 7.8 (экз. придавлен, поэтому прижизненный размер тела несколько меньше).
Материал. Вишневая балка: экз. ПИН, № 254/2414 – самец с крыльями без головы, № 254/2847 – отпечаток части головы и переднее крыло. Передние крылья – №№ 254/2853, 254/997, 254/2418; задние крылья 254/2395, 254/1106, 254/2522. Темнолесская: экз. № 254/2911 – отпечаток части груди самца с петиолюсом и задним крылом.
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ ОТПЕЧАТКОВ КРЫЛЬЕВ ИЗ БЕМРИДЖА
Мы проанализировали изменчивость крыловых признаков у представителей Formicinae на примере шести рецентных видов, имеющих разную выраженность полового диморфизма и разные типы жилкования (табл. 1) (Перфильева, 2007). Полное жилкование с медиокубитальной ячейкой имеют Formica, самки и частично самцы Lasius; без медиокубитальной ячейки крылья Camponotus, частично самцы Lasius. Наиболее выраженный половой диморфизм по размерам крылатых особей у видов Camponotus, наименьший у Formica (табл. 1). Различие по типу жилкования между полами наблюдается у видов Lasius: более 80% самок обоих исследованных видов имеют в передних крыльях медиокубитальную ячейку, 82% самцов L. flavus и 45% самцов L. niger не имеют медиокубитальной ячейки хотя бы на одном из передних крыльев (за счет редукции поперечной жилки m-cu).
Сравнение средних по критерию t-Стьюдента показало наличие значимых (p < 0.05) различий по длине переднего крыла между самками и самцами одного вида для всех исследованных видов. Однако даже когда выборки значимо различаются по длине крыла, распределения могут значительно перекрываться (напр., самки и самцы Formica), более того, иногда одинаковые по типу крыла выборки не различимы по распределению длины крыла (самцы F. rufa и самки L. niger).
Анализ особенностей жилкования передних крыльев был проведен методами геометрической морфометрии (рис. 1; табл. IX , фиг. 1). Мы показали, что вне зависимости от типа жилкования, от размеров особей и от выраженности полового диморфизма у Formicinae имеются отличия, однозначно характеризующие межполовые различия – крылья самок всегда относительно более узкие, чем у самцов (рис. 1, а, в–д). При этом разделение по этому признаку в пространстве векторов однородной компоненты демонстрировали не только одновидовые выборки, но и выборки, включающие виды одного рода и смешанные по родам и типам жилкования выборки, т.е. даже в том случае, если самки (одного вида) мельче самцов (другого вида) и имеют различные типы жилкования (рис. 1, г, д). Также нами было показано, что, несмотря на межполовые различия в жилковании, характеризующиеся однородной компонентой, локальными отличиями и даже изменением типа жилкования (самки и самцы Lasius), крылья исследованных формицин имеют видоспецифические признаки, одинаковые для обоих полов, вне зависимости от выраженности полового диморфизма (рис. 1, б, в, е, ж).
Проведенное нами исследование различий крыльев не выявило аналогичной закономерности межполовой изменчивости у Dolichoderinae (неопубликованные данные) и Myrmicinae (частично опубликовано: Перфильева, 2007, 2008). Позже подобные представителям Formicinae межполовые различия передних крыльев обнаружили у вымерших Formiciinae (Katzke et al., 2018). Наличие этой закономерности, по нашему мнению, является еще одним аргументом, наряду с показанными нами ранее сходными тенденциями в редукции жилкования (укорочение и сокращение rs-m, укорочение RS + M в медиокубитальной ячейке, уменьшение ячейки rm), в пользу версии о близких филогенетических отношениях Formiciinae и Formicinae (Перфильева, 2010).
Выявленные особенности – наличие специфической межполовой и межвидовой изменчивости у видов формицин – позволили опробовать метод разделения однотипных отпечатков ископаемых Oecophylla из коллекции Музея естественной истории (Perfilieva, 2008; Antropov et al., 2014). Среди имеющихся отпечатков с характерными для Oecophylla особенностями жилкования (отсутствие mcu, зауженная ячейка 3r, положение 2r-rs относительно птеростигмы и пр.) были отобраны наиболее полные и недеформированные отпечатки (N = 130). Распределение по длине крыла в этой выборке имеет три выраженных группы с модами 7.5, 11 и 22 мм (рис. 2). Диапазоны изменчивости по длине крыла в группах можно определить как 3.5 мм (6–9.5), 6 мм (10–16), 2 мм (21–23). В группе наиболее коротких крыльев 48 особей, средних – 55, крупных – 22. Диапазон изменчивости по длине крыла средней группы (как в абсолютных, так и в относительных значениях) несколько больше двух других, что свидетельствует в пользу предположения о неоднородности этой группы. Распределение по ширине крыла обнаружило наличие четырех групп с модами 2, 3, 3.6 и 6.4 мм (рис. 2). Исходя из представления, что самки формицин имеют более узкие крылья, чем самцы, мы предположили, что средняя по длине крыльев группа распалась на две выборки по ширине крыла, поскольку может включать самок и самцов (разных видов) со сходной длиной крыла.
Ни у одного из представителей группы с самыми большими крыльями тело не сохранилось. Самые мелкие особи, тела которых сохранились, были представлены только самцами. Средняя группа включает отпечатки, предварительно определенные нами по телам, как самцов, так и самок: самка № 8711 (без крыльев, но подходящего размера), самец № 8703 (FW = 10.6 мм).
Для анализа методами геометрической морфометрии мы использовали расстановку меток, которая отражает компромиссный вариант между наибольшим количеством подходящих отпечатков и наибольшим числом хорошо распознаваемых мест для расстановки меток (табл. IX , фиг. 10 ). Таким образом, для анализа был отобран 41 отпечаток переднего крыла, в том числе, экземпляры из трех размерных групп (15 – мелкие крылья, 16 – средняя размерная группа, 10 – крупные).
В пространстве первых двух относительных деформаций крупные и маленькие крылья четко группируются относительно оси ординат (табл. IX , фиг. 11, 12 ). Вторая относительная деформация (ось ординат) характеризует относительную ширину крыла: в нижней части графика расположены крылья с более узкими ячейками 3r и 1 + 2r (табл. IX , фиг. 11 ). Такие признаки, как относительное сужение костального края крыла (сужение ячеек 3r и 1 + 2r), как правило, соответствуют у формицин самкам. Поэтому с достаточной долей уверенности особей, сгруппированных в нижней части графика, можно отнести к самкам, в верхней – к самцам. Действительно, все крылья, принадлежащие отпечаткам тел, идентифицированных до начала анализа как самцы, оказались в верхней группе (табл. IX , фиг. 12 ). Крылья из средней группы довольно четко разделились по ординате (табл. IX , фиг. 12 ; табл. 2). Таким образом, результаты нашего анализа свидетельствуют о наличии двух видов Oecophylla в этом местонахождении, которые мы описали как O. atavina и O. megarche (Antropov et al., 2014).
Мы определили качественные признаки жилкования, которые можно было бы использовать для дифференциации остальных отпечатков Oecophylla этого местонахождения, опираясь на результаты приведенного анализа. По нашим данным, самцы более крупного по размерам вида O. megarche имеют длину крыла 10–15.9 мм и отличаются более широкой ячейкой 1 + 2r, благодаря более выраженному изгибу RS + M в дистальной части ячейки. В переднем крыле самок более мелкого вида O. atavina с FWL 8.5–13.7 мм ячейка 1 + 2r имеет более острый дистальный угол, поскольку изгиб RS + M в дистальной части ячейки менее выражен, чем у самцов O. megarche (табл. IX , фиг. 13 ).
Сложность интерпретации результатов анализа геометрической морфометрии ископаемых отпечатков можно объяснить четырьмя основными причинами. Первая заключается в недостаточном числе маркирующих меток на исследованных крыльях, поскольку, как правило, сохранность материала не позволяет поставить достаточное их количество. На этот вывод наталкивает сравнение результатов анализа крыльев современных Camponotus с 9 маркирующими точками, как в данной работе, и 12 и более (Перфильева, 2007, 2008). Границы однородных выборок, совершенно четкие при анализе по 12 (и более) меткам, размываются при анализе выборки по 9 меткам. Основными “недостающими метками” являются метки основания крыла, дистального и нижнего края крыла, которые у ископаемых экземпляров сохраняются редко. Второй причиной является невозможность у многих экземпляров определить точное место расстановки многих меток, а это одно из важнейших условий использования методик геометрической морфометрии. Следующая причина заключается в том, что крылья в той или иной степени деформированы, причем в разной степени, тогда как методика геометрической морфометрии предполагает анализ объектов, подготовленных совершенно одинаковым образом (например, расправленные крылья). Это влияет на отражение соотношений длин разных участков и, как следствие, вызывает изменение позиции особи в пространстве форм (относительных деформаций). И последняя по порядку, но не по значению причина, очевидно, в том, что величина различий между крыльями разных полов и видов у разных таксонов различна. В том случае, когда различия в жилковании хорошо выражены (как, например, у Camponotus), указанные выше факторы могут меньше искажать ситуационную картину; если различия слабые (например, как у Formica rufa, или между таксономически близкими видами (Перфильева, 2007), то искажение, возникающее из-за выше названных причин, не позволит интерпретировать результаты.
ИСКОПАЕМЫЕ OECOPHYLLA
В настоящее время род Oecophylla (муравьи-портные) представлен тремя (?) видами. O. longinoda занимает тропические области Африканского континента, O. smaragdina заселяет тропическую Индию и Юго-Восточную Азию (рис. 3). Третий вид описан недавно по нескольким рабочим особям, поэтому здесь мы не рассматриваем его экологические характеристики. Современные виды в значительной степени морфологически изменчивы, и на данный момент выделяют 12 подвидов. Однако характеристики экологических ниш и общие размеры как половых особей, так и рабочих (учитывая внутрисемейный полиморфизм), очень сходны: дендробионты с агрессивным доминирующим поведением, сочетающие содержание колоний трофобиотических Hemiptera и хищничество, имеющие большие моногинные семьи с относительно крупными (FWL около 14 и 17 мм), массивными самками.
К настоящему моменту описано 16 ископаемых видов муравьев-портных. До наших исследований все находки этого рода, начиная с середины эоцена до миоцена, были известны в отложениях или в смолах только с европейской территории (Франция, Хорватия, Германия, Великобритания, балтийский и сицилийский янтари), и одна уникальная находка (гнездо с расплодом) сделана в миоценовых отложениях Кении (Африка). Однако характерные признаки жилкования и их сочетание в крыльях половых особей этого рода демонстрируют эволюционное постоянство, что позволяет уверенно судить о принадлежности экземпляра не только на основании морфологии тела, но даже по отпечатку части крыла. Более того, удалось определить число видов и половой состав выборки ископаемых отпечатков крыльев (Бембридж, Великобритания). Наши исследования дают основания полагать, что самые ранние находки представителей этого рода оказываются в отложениях раннего и среднего эоцена Северной Америки (Формация Голдуотер бедз, Британская Колумбия, Канада; Формация Клондайк Маунтин, шт. Вашингтон; Формация Таллахатта, шт. Миссисипи, США). Хорошо представлены экофиллы в Европе от среднего эоцена до миоцена (Великобритания, Германия, Франция, балтийский янтарь, Хорватия, сицилийский янтарь), и в миоцене появляются представители экофилл в Африке и на Северном Кавказе (рис. 3). Интересно, что в верхнеэоценовых отложениях Дальнего Востока (Большая Светловодная), а также в отложениях и смолах Китая представителей этого рода пока не обнаружено, несмотря на довольно обильные находки муравьев (Hong, 1984, 2002; Zang, 1989; Zhang et al., 1994; Dlussky et al., 2015). До настоящего момента в миоценовых отложениях и смолах Сев. Америки также не обнаружено представителей этого рода (Grimaldi, Triplehorn, 2008; Durán-Ruiz et al., 2013). Таким образом, наблюдается значительное разнообразие видов муравьев-портных в прошлые геологические периоды и на территориях, в настоящее время не заселенных муравьями этого рода. Находки позволяют судить о закономерностях морфологической эволюции, связанной с адаптивным приспособлением сообразно образу жизни этих муравьев, и делать заключения об эволюции биоценозов.
Современные муравьи-портные живут в кроне деревьев тропических лесов. В середине прошлого века экспериментально было показано, что современные O. smaragdina не выдерживают даже относительно незначительного понижения температуры, а при 0°C погибают, данные полевых исследований также говорят о явной термофилии современных экофилл (Way, 1954). По-видимому, именно эти ограничения лежат в основе отсутствия муравьев-портных в зоне горных влажных лесов Юго-Восточной Азии, тогда как в этих же регионах вне зоны гор они являются явными доминантами, способными оказывать конкурентное влияние не только на популяции беспозвоночных, но и на сообщество, например, певчих птиц, конкурирующих с муравьями за питание (Supriya et al., 2020). Обнаружение этих теплолюбивых обитателей древесного яруса в широтах, где в настоящее время наблюдается ярко выраженная сезонность, говорит о принципиальном отличии климатических условий прошлого (с середины эоцена до миоцена) и настоящего времени. Существование более мягкого и ровного климата в эоцене и миоцене сейчас является неоспариваемым фактом, однако детализация временного и пространственного аспектов изменений могут быть отслежены по изменениям состава биоценозов (Archibald, Mathewes, 2000; Greenwood et al., 2005; Archibald et al., 2006, 2011, 2018; Mathewes et al., 2016). На данный момент понятно, что эоценовые экофиллы Европы при похолодании смогли обосноваться (или сохраниться) в более теплых регионах Африки, Азии, Австралии, а вот североамериканские не появились в более низких широтах своего континента и не перешли в Азию (через Восточную Палеарктику). Похожая ситуация наблюдается и с некоторыми другими теплолюбивыми видами муравьев: Formiciinae (гигантские муравьи эоцена), Myrmeciinae (муравьи-бульдоги) и Aneuretinae (реликтовый муравей с о. Цейлон) (Archibald et al., 2006, 2011). Виды из этих трех подсемейств и Oecophylla встречаются в эоцене и в Северной Америке, и в Европе в разных сочетаниях: в формации Грин-Ривер присутствуют представители мирмециин, анеуретин и формициин, но пока не описано экофилл, в балтийском янтаре отсутствуют Formiciinae (возможно, по причине гигантских размеров), а в германском Месселе не обнаружено Aneuretinae (табл. 3). Совместное присутствие этих элементов говорит о схожести мирмекокомплексов и высокой интенсивности обменных процессов между фаунами муравьев Северной Америки и Западной Палеарктики в эоцене – во время эоценового температурного оптимума. Анеуретины и мирмециины в это время есть и в Восточной Палеарктике, но там отсутствуют экофиллы и формициины (Dlussky et al., 2015).
Таблица 3.
Доли представителей разных подсемейств муравьев в эоценовых ископаемых комплексах (%) (данные из Dlussky et al., 2015, с изменениями)
| Мессель | Бембридж | Большая Светловодная | Гррин-Ривер | Флориссант | Балтийский янтарь | Биттерфельдский янтарь | Ровенский янтарь | |
|---|---|---|---|---|---|---|---|---|
| Formiciinae | 48.3 | 0 | 0 | 0.1 | 0 | 0 | 0 | 0 |
| Aneuretinae | 0 | 0.1 | 3.5 | 2.9 | 0 | 0.01 | 0.2 | 0 |
| Dolichoderinae | 10.4 | 8.5 | 17.9 | 71.5 | 62.6 | 55.9 | 52.9 | 53.2 |
| Formicinae | 30.6** | 88.2** | 41.1 | 2.9 | 32.5 | 39.6** | 34** | 39 |
| Myrmicinae | 1.4 | 0.4 | 21.4 | 2 | 4.8 | 2.8 | 9.5 | 4.6 |
| Poneromorpha | 8.4 | 2.8 | 10.7 | 9.8 | 0 | 1.3 | 1.3 | 1.6 |
| Myrmeciinae | 1.4 | 0 | 3.6 | 10.8 | 0 | 0.01 | 0.1 | 0 |
| Pseudomyrmecinae | 0.5 | 0 | 0 | 0 | 0 | 0.3 | 1.3 | 1.5 |
| Cerapachyinae | 0.2 | 0 | 1.8 | 0 | 0 | 0.1 | 0.3 | 0.2 |
| Изучено экземпляров | 432* | 630 | 56 | 102 | 5592 | 1948 | 1105 | 1202 |
К миоцену, следующему температурному оптимуму, картина мирмекокомплексов значительно меняется и наблюдается несколько разных сценариев распространения на примере этих теплолюбивых элементов. Полностью исчезают гигантские формициины, что, по-видимому, стоит связывать и с олигоценовым похолоданием, и с понижением уровня кислорода в атмосфере. Экофиллы в миоцене еще встречаются в Европе, есть в Африке, а также обнаружены в миоценовых местонахождениях Крыма и Северного Кавказа. Мирмециины и анеуретины исчезают в Северной Америке и Европе (отсутствуют в богатых миоценовых местонахождениях Европы и Западной Палеарктики), а также в Африке (рецентные формы на ее территории также отсутствуют).
Эволюционные изменения фаун муравьев, наблюдаемые нами в Северной Америке и Западной Палеарктике с эоцена до миоцена и вплоть до современности, очевидно, спровоцированы изменяющимся климатом (похолодание, понижение концентрации углекислого газа и кислорода в атмосфере, аридизация и пр.). Однако различия реакции мирмекофаун на климатические пертурбации обусловлены особенностями, сложившимися в локальных мирмекокомплексах эоцена. Мы предполагаем, что экофилла не смогла удержаться в Северной Америке, в отличие от Западной Палеарктики, из-за конкуренции с “профессинальными” дендробионтами Dolichoderinae. Действительно, доля долиходерин в эоценовых североамериканских местонахождениях по числу экземпляров от всех отпечатков муравьев значительно больше, чем в известных на данный момент палеарктических, и сравнима (и даже выше) с таковой в эоценовых янтарях Европы (балтийский, ровенский, биттерфельдский), в которых доля дендробионтов заведомо завышена из-за специфики тафономических условий (см. табл. 3).
С учетом гигантских семей и доминирующего положения муравьев-портных в современных биоценозах, утверждение кажется слабо обоснованным. Действительно, современные виды Oecophylla обитают большими моногинными семьями в кронах деревьев тропических лесов и строят гнезда из листьев, скрепленных паутинными нитями, выделяемыми личинками. С древесным образом жизни связаны особенности морфологии этих муравьев. Длинные конечности и антенны позволяют легко передвигаться в кроне. Своеобразное строение петиолюса обеспечивает способность поднимать брюшко вверх для большей маневренности при прыжках. Большие плоские мандибулы приспособлены к разрезанию листьев при постройке гнезда. Однако сравнительно-морфологический анализ ископаемых экофилл показал, что увеличение размера семьи (судя по общим размерам самок и относительному размеру метасомы), как и характеристики маневренности и ориентации в древесном ярусе (пропорции тела, антенн, глаз, поднятие брюшка), формировались в процессе эволюции постепенно, и не всегда были присущи им в той же самой степени, что современным представителям этого рода (Wilson, Taylor, 1964; Dlussky et al., 2008). Другая особенность тафоценозов дает еще один повод для нового взгляда на прошлое экофилл – это наличие в эоценовых местонахождениях пар симпатрических видов Oecophylla в Бембридже и в балтийском янтаре. Совместно обитающие виды демонстрируют морфологические признаки, маркирующие экологические различия (значительное различие в размерах половых особей в случае с парой O. magarche/O. atavina, строение мандибул и пропорции тела у O. crassinoda/O. brischkei), т.е., явное разделение экологических ниш.
Утверждение о полной и абсолютной доминирующей роли экофилл в современных биоценозах является также явным упрощением. Исследования распределения доминирующих видов муравьев в тропических лесах показывают, что экофиллы, являясь организующим участником “мозаики видов” (Tropical Ant Mosaic), явления, объясняющего сосуществование нескольких доминирующим видов на сопряженных территориях (Holldobler, 1983), тем не менее, в определенных условиях уступают в конкурентной борьбе другим видам, таким как Crematogaster, Philidris и др., и предпочитают определенные типы микроусловий для обитания семьи, избегая неподходящих (Way, 1954; Jackson, 1984; Floren, Linsenmair, 2000; Зрянин, 2009, 2015; Arnan et al., 2011; личн. наблюдения Д. Дубовикова, 2018).
Перечисленные нами соображения позволяют предположить конкурентное вытеснение экофилл преобладающими в эоценовых североамериканских мирмекокомплексах разнообразными Dolichoderinae на фоне похолодания в олигоцене. Потеря сухопутного моста между Европой и Северной Америкой закрепила возникшие особенности фаун муравьев.
Мы сознательно оставляем здесь без внимания судьбу мирмециин и анеуретин на североамериканском континенте, поскольку решение этого вопроса требует дополнительной аргументации. Не менее интересны для подробного исследования различия между фауной муравьев Восточной Палеарктики с одной стороны, и Западной Палеарктики и Северной Америки с другой, обмены и сходство между которыми, судя по таксономическому составу и соотношению жизненных форм муравьев, существенно ограничены, и представители экофилл являются одним из элементов, подтверждающих это разобщение (см. табл. 3).
* * *
Автор признателена сотрудникам лаб. артропод ПИН РАН и лично А.П. Расницыну за предоставленный материал и помощь при работе с ним, Д. Дубовикову (СПбГУ) за обсуждение некоторых вопросов экологии муравьев, А.Ю. Журавлеву (МГУ) за помощь при работе с текстом. Работа выполнена в рамках госзадания Ч. 2 № ЦИТИС АААА-А16-116021660031-5.
Список литературы
Длусский Г.М. Миоценовые муравьи (Hymenoptera, Formicidae) СССР // Новые ископаемые насекомые с территории СССР. М.: Наука, 1981. С. 64–83.
Длусский Г.М., Расницын А.П. Два новых вида жалящих перепончатокрылых (Vespidae = Hymenoptera) из среднего эоцена США // Палеонтол. журн. 1999. № 5. С. 72–75.
Зрянин В.А. Структура сообщества муравьев муссонного тропического леса (Южный Вьетнам) // Матер. XIII Всеросс. мирмекологического симпозиума “Муравьи и защита леса”. Нижний Новгород, 2009. С. 166–170.
Зрянин В.А. Анализ мирмекокомплексов тропического муссонного леса на основе изотопной метрики // Тр. РЭО. 2015. Т. 86. № 2. С. 41–56.
Перфильева К.С. Аномалии крыльев у половых особей муравьев (Hymenoptera, Formicidae) с разной стратегией брачного поведения // Зоол. журн. 2000. Т. 79. № 11. С. 1311–1312.
Перфильева К.С. Характеристика изменчивости количественных признаков крыльев на примере некоторых видов муравьев (Hymenoptera, Formicidae) // Успехи совр. биол. 2007. Т. 127. № 2. С. 147–156.
Перфильева К.С. Эволюция жилкования крыльев муравьев (Hymenoptera: Formicidae). Дисс. … канд. биол. наук. М., 2008. 153 с.
Перфильева К.С. Тенденции в эволюции жилкования крыльев муравьев (Hymenoptera, Formicidae) // Зоол. журн. 2010. Т. 89. № 8. С. 965–977.
Перфильева К.С., Дубовиков Д.А., Длусский Г.М. Муравьи (Hymenoptera, Formicidae) из миоценовых отложений полуострова Крым // Палеонтол. журн. 2017. № 4. С. 54–64.
Расницын А.П. Паратаксон и параноменклатура // Палеонтол. журн. 1986. № 3. С. 11–21.
Antropov A.V., Belokobylskij S.A., Compton S.G. et al. The wasps, bees and ants (Insecta: Vespida = Hymenoptera) from the Insect Limestone (Late Eocene) of the Isle of Wight, UK // Earth Envir. Sci. Trans. Roy. Soc. Edinb. 2014. V. 104. № 3–4. P. 335–446.
AntWeb. Version 8.25.1. California Academy of Science, online at https://www.antweb.org. Accessed 20 April 2020.
Archibald B.S., Cover S.P., Moreau C.S. Bulldog ants of the Eocene Okanagan Highlands and history of the subfamily (Hymenoptera: Formicidae: Myrmeciinae) // Ann. Entomol. Soc. Amer. 2006. V. 99. № 3. P. 487–523.
Archibald S.B., Johnson K.R., Mathewes R.W., Greenwood D.R. Intercontinental dispersal of giant thermophilic ants across the Arctic during early Eocene hyperthermals // Proc. R. Soc. B. 2011. V. 278. P. 3679–3686.
Archibald S.B., Mathewes R.W. Early Eocene insects from Quilchena, British Columbia and their paleoclimatic implications // Can. J. Zool. 2000. V. 78. P. 1441–1462.
Archibald S.B., Rasnitsyn A.P., Brothers D.J. et al. Modernisation of the Hymenoptera: ants, bees, wasps, and sawflies of the early Eocene Okanagan Highlands of western North America // Can. Entomol. 2018. V. 150. № 2. P. 205–257.
Arnan X., Gaucherel C., Andersen A.N. Dominance and species co-occurrence in highly diverse ant communities: a test of the interstitial hypothesis and discovery of a three-tiered competition cascade // Oecologia. 2011. V. 166. P. 783–794.
Cockerell T.D.A. British fossil insects // Proc. US Nat. Mus. 1915. № 49. P. 469–499.
Cockerell T.D.A. Fossil arthropods in the British Museum // Ann. Mag. Natur. Hist. 1920. V. 9. № 5. P. 273–279.
Dlussky G., Karl H.-V., Brauckmann C. et al. Two ants (Insecta: Hymenoptera: Formicidae: Formicinae) from the Late Pliocene of Willershausen, Germany, with a nomenclatural note on the genus Camponotites // Paläontol. Z. 2011. V. 85. № 4. P. 449–455.
Dlussky G.M., Putyatina T.S. Early Miocene ants (Hymenoptera, Formicidae) from Radoboj, Croatia // N. Jb. Geol. Paläontol. Abh. 2014. V. 272. № 3. P. 237–285.
Dlussky G.M., Rasnitsyn A.P., Perfilieva K.S. The ants (Hymenoptera: Formicidae) of Bol’shaya Svetlovodnaya (Late Eocene of Sikhote-Alin, Russian Far East) // Caucasian Entomol. Bull. 2015. V. 11. P. 131–152.
Dlussky G. M., Wappler T., Wedmann S. New middle Eocene formicid species from Germany and the evolution of weaver ants // Acta Palaeontol. Pol. 2008. V. 53. № 4. P. 615–626.
Donisthorpe H. British Oligocene ants // Ann. Mag. Natur. Hist. 1920. V. 9. № 6. P. 81–94.
Durán-Ruiz C., Riquelme F., Coutiño-José M. et al. Ants from the Miocene Totolapa amber (Chiapas, Mexico), with the first record of the genus Forelius (Hymenoptera, Formicidae) // Can. J. Earth Sci. 2013. V. 50. № 5. P. 495–502.
Emery C. Le formiche dell’ambra Siciliana nel Museo Mineralogico dell’Università di Bologna // Mem. R. Accad. Sci. Ist. Bologna. 1891. V. 5. № 1. P. 141–165.
Floren A., Linsenmair K. Do ant mosaics exist in Pristine lowland rain forests? // Oecologia. 2000. V. 123. № 1. P. 129–137.
Förster B. Die Insekten des “Plattigen Steinmergels” von Brunstatt // Abh. Geol. Spezialkarte Elsass-Loth. 1891. Bd 3. S. 333–594.
Greenwood D.R., Archibald S.B., Mathewes R.W. et al. Fossil biotas from the Okanagan Highlands, southern British Columbia and northern Washington State: climates and ecosystems across an Eocene landscape // Can. J. Earth Sci. 2005. V. 42. P. 167–185.
Grimaldi D., Triplehorn D. Insects from the Upper Miocene Grubstake Formation of Alaska // Amer. Mus. Novit. 2008. № 3612. P. 1–19.
Heer O. Die Insektenfauna der Tertiargebilde von Oeningen und von Radoboj in Croatien. Zweiter Theil: Heuschrecken, Florfliegen, Aderfluger, Schmetterlinge und Fliegen. Leipzig: W. Engelmann, 1849. 264 s.
Holldobler B. Territorial behavior in the green tree ant (Oecophylla smaragdina) // Biotropica. 1983. V. 15. № 4. P. 241–250.
Hong Y.-C. Fossil insects in the diatoms of Shanwang // Bull. Tianjin Inst. Geol. Miner. Res. 1984. V. 8. P. 1–12 [In Chinese].
Hong Y.-C. Amber insects of China. Beijing: Sci. Press, 2002. 631 p. [in Chinese].
Jackson D.A. Ant distribution patterns in a Cameroonian cocoa plantation: investigation of the ant mosaic hypothesis // Oecologia. 1984. V. 62. P. 318–324.
Johnston J.E. Insects, spiders, and plants from the Tallahatta Formation (Middle Eocene) in Benton County, Mississippi // Mississippi Geol. 1993. V. 14. № 4. P. 71–82.
Katzke J., Barden Ph., Dehon M. et al. Giant ants and their shape: revealing relationships in the genus Titanomyrma with geometric morphometrics // PeerJ. 2018. 6:e4242; https://doi.org/10.7717/peerj.4242
Kurane S., Bhoje P.M., Sathe T.V. On a new species of the genus Oecophylla // Flora and Fauna. 2015. V. 21. P. 37–40.
Mathewes R.W., Greenwood D.R., Archibald S.B. Paleoenvironment of the Quilchena flora, British Columbia, during the early Eocene Climatic Optimum // Can. J. Earth Sci. 2016. V. 53. P. 574–590.
Mayr G. Die Ameisen des baltischen Bernsteins // Beitr. Naturk. Preuss. V. 1868. № 1. S. 1–102.
Pavlinov I.Ya. Geometric morphometrics, a new analytical approach to comparison of digitized images // Information technologies in biodiversity research. St. Petersburg, 2001. P. 40–64.
Perfilieva K. The attempt of differentiation of fossil Formicinae species (Hymenoptera, Formicidae) on the wings // XXIII Intern. Congr. of Entomology, Durban, South Africa, 2008. P. 1811.
Rohlf F.J. TPSrelw: relative warps, version 1.20. N.Y.: State Univ. at Stony Brook, 1998.
Steinbach G. Zur Hymenopterenfauna des Pliozäns von Willershausen // Westharz. Bericht der Naturhist. Ges. Hannover. 1967. V. 111. S. 95–102.
Supriya K., Price T.D., Moreau C.S. Competition with insectivorous ants as a contributor to low songbird diversity at low elevations in the eastern Himalaya // Ecol. Evol. 2020. V. 10. № 10. P. 4280–4290.
Théobald N. Les Insectes Fossiles des Terrains Oligocènes de France. Nancy: G. Thomas, 1937. 473 p.
Way M.J. Studies of the life history and ecology of the ant Oecophylla longinoda Latreille // Bull. Entomol. Res. 1954. V. 45. P. 1–93.
Wheeler W.M. The ants of the Baltic Amber // Schr. Phys.-Ökon. Ges. Königsberg. 1915 (1914). Bd 55. S. 1–142.
Wheeler W.M. Ants of the American Museum Congo expedition // Bull. Amer. Mus. Natur. Hist. 1922. V. 45. 1139 p.
Wilson E.O., Taylor R.W. A fossil ant colony: new evidence of social antiquity // Psyche. 1964. V. 71. P. 93–103.
Zhang J. Fossil insects from Shanwang, Shandong, China. Jinan, China: Shandong Sci. and Technology Publ. House, 1989. 459 p. [In Chinese].
Zhang J., Sun B., Zhang X. Miocene insects and spiders from Shanwang, Shandong. Beijing: Sci. Press, 1994. 298 p. [In Chinese].
Дополнительные материалы отсутствуют.
Инструменты
Палеонтологический журнал


