Палеонтологический журнал, 2021, № 1, стр. 3-21
Современные исследования коэволюционных связей ископаемых растений и грибов: успехи, проблемы, перспективы
Н. П. Маслова a, *, А. В. Тобиас b, **, Т. М. Кодрул c, ***
a Палеонтологический институт им. А.А. Борисяка РАН
Москва, Россия
b Санкт-Петербургский государственный университет
С.-Петербург, Россия
c Геологический институт РАН
Москва, Россия
* E-mail: paleobotany_ns@yahoo.com
** E-mail: atobias@yandex.ru
*** E-mail: kodrul@mail.ru
Поступила в редакцию 28.04.2020
После доработки 15.06.2020
Принята к публикации 15.06.2020
Аннотация
Изучение консортивных связей растений и грибов в историческом аспекте способствует пониманию закономерностей и процессов, связанных с эволюцией представителей этих двух царств, а также функционированием экосистем и формированием существующего биоразнообразия. Представленный обзор современных палеомикологических исследований сфокусирован на анализе их основных направлений, задач и перспектив. Рассмотрены основные типы сохранности ископаемых микромицетов и возможности их изучения с применением современной исследовательской техники. Показано значение палеомикологических исследований для палеоэкологических интерпретаций и палеоклиматических реконструкций. Обсуждается дальнейшее совершенствование классификационных систем типов повреждений ископаемых растений различными агентами, в частности, грибами.
ВВЕДЕНИЕ
Растения и грибы, представители двух царств живых организмов – Plantae и Fungi, относятся к принципиально различным, авто- и гетеротрофным компонентам экосистем, и характеризуются существенными различиями в структурной и физиологической организации, способах питания и роли в биосферных процессах. Они имеют длительную историю сосуществования и становления многоплановых типов взаимодействия, в значительной степени определяющих направления эволюции обеих групп, а также формирование существующего биоразнообразия. Если растениям традиционно отводилась важнейшая роль в становлении биоты и формировании биосферы Земли, то участие грибов в этих процессах долгое время не было должным образом подтверждено и признано. Тем не менее, представители царства Fungi являются неотъемлемым компонентом современных биоценозов Земли, их роль в функционировании и устойчивости экосистем в некоторых случаях является ключевой. Разнообразные грибы обеспечивают разложение освоенного ими субстрата, являясь посредниками между органическими и неорганическими веществами биосферы, в связи с чем было предложено рассматривать их в рамках особого экогоризонта (Каратыгин, 1994).
В основе коэволюционных связей грибов и растений лежат трофические связи. Эволюция субстрата (растений) определяла эволюцию организмов-редуцентов (грибов) и, наоборот, грибы, оказывая прямое или опосредованное влияние на обменные процессы растения-хозяина, обусловливали многовариантность их возможных приспособлений к различным экологическим средам. Кроме того, следует отметить все более укрепляющиеся представления о роли в эволюции биоты горизонтального переноса генов между разными видами и даже царствами живых организмов, в том числе растений и грибов (Marienfeld et al., 1997; Rosewich, Kistler, 2000; Richards et al., 2009; Li et al., 2018 и др.).
Переход грибов на сушу в позднем докембрии (около 720 млн лет назад) способствовал в дальнейшем колонизации суши эмбриофитами (Pirozynski, Malloch, 1975; Heckman et al., 2001; Lutzoni et al., 2018). Молекулярно-генетическими исследованиями установлено, что возникновение в геологической истории арбускулярных микоризных грибов (Glomeromycotina) совпадает по времени с диверсификацией эмбриофитов (Lutzoni et al., 2018). Современные гломеромицеты являются наземными грибами, из которых практически все (за исключением одного вида, ассоциирующего с цианобактериями рода Nostoc) образуют арбускулярные микоризы (АМ) с корнями высших растений или подобные АМ ассоциации с некорневыми структурами, например, ризоидами бриофитов (Lutzoni et al., 2018). Ископаемые споры Glomeromycotina известны из ордовика (Redecker et al., 2000), но наиболее ранние палеоботанические свидетельства симбиоза арбускулярных микоризных грибов и наземных растений датируются ранним девоном (Remy et al., 1994). Как отмечает И.В. Каратыгин (2007), именно в девонских экосистемах были сформированы все основные механизмы взаимоотношений между авто- и гетеротрофами, являющиеся определяющими для функционирования наземных экосистем. Возникновение и диверсификация различных экологических групп грибов коррелируется с рядом ключевых событий в эволюции растений, включающих появление лесной растительности, настоящих корней, семян и, наконец, покрытосеменных растений (Lutzoni et al., 2018). К концу мелового периода покрытосеменные стали основными составляющими наземных экосистем. Разнообразие жизненных форм цветковых растений, их таксономическое многообразие и высокая пластичность, а также способность к адаптации к существованию в разнообразных биоценозах определили во многом формирование экологических ниш для грибов различных таксономических категорий и трофических предпочтений. В то же время грибы, способные жить и развиваться в самых разных средах – при высоких и низких температурах, при переувлажнении и засухе, в аэробных условиях и при чрезвычайно малом содержании кислорода, могут осваивать различные ниши практически в любых биосферных условиях.
К настоящему времени описано примерно 100 тыс видов ныне живущих грибов, что по оценкам микологов составляет лишь небольшую часть имеющегося разнообразия (Taylor et al., 2015a, b; Hawksworth, Lücking, 2017). Первая попытка количественного анализа современной микобиоты была предпринята на основе соотношения известных к тому времени грибов и видов растений в тех регионах, где грибы считались хорошо изученными (Hawksworth, 1991). Результатом этого исследования стало представление о возможной полуторамиллионной численности видов современных грибов. Так как к началу 90-х гг. ХХ в. было описано всего около 70 тыс. видов, такая высокая предположительная общая численность мотивировала микологов к поиску ранее неизвестных форм. Более поздние выводы, базирующиеся на результатах молекулярно-генетических исследований, показали существование в современной микобиоте около 5.1 млн видов (O’Brien et al., 2005; Taylor et al., 2010; Blackwell, 2011). Это число, однако, было скорректировано на основании комбинации различных методов (оценка известного разнообразия грибов, экстраполяция этих данных на разнообразие растений, а также методы секвенирования), и были приведены данные о более вероятном числе видов, колеблющемся в пределах 2.2–3.8 млн (Hawksworth, Lücking, 2017).
Беглый взгляд на историю исследования биоразнообразия современных грибов показывает, с одной стороны, насколько многочисленна эта группа организмов сегодня, а с другой – какой короткий период времени приходится на их активное разноплановое изучение. Лишь в последние десятилетия развитие новых технологий в световой микроскопии (СМ) и сканирующей электронной микроскопии (СЭМ) обеспечило дополнительные возможности для детального исследования морфологии микроскопических грибов.
Для идентификации современных грибов нередко необходимо иметь представления об их онтогенезе. В первую очередь это касается грибов из отдела Ascomycota. Именно для сумчатых грибов характерен плеоморфизм – наличие в цикле развития морфологически различных стадий, связанных с половым (телеоморфа) и бесполым (анаморфа) размножением. При этом связь между стадиями развития часто неочевидна. Кроме того, в разных условиях, в разное время и в разных географических зонах могут формироваться морфологически различные анаморфы (Hughes, 1979). Нередко морфологически сходные анаморфные стадии могут иметь телеоморфы из разных систематических групп и, наоборот, некоторые телеоморфные группы грибов чрезвычайно богаты анаморфами разного строения (Shenoy et al., 2007). Широкое применение в последние десятилетия методов молекулярно-генетического анализа позволило скорректировать представления о связи телеоморфной и анаморфной стадий многих аскомицетов, что повлекло за собой во многих случаях изменение представлений об объеме родов и видов и положении в системе многих представителей анаморфных сумчатых грибов. Тем не менее, в большинстве случаев связь между телеоморфой и анаморфой остается не выявленной, а лавинообразно растущий объем информации в области молекулярной филогенетики и сравнительной геномики грибов требует сопоставления этих современных данных с результатами, полученными традиционными сравнительно-морфологическими методами, в связи с чем эта область знаний нуждается в дальнейшем развитии.
Палеомикология – наука, посвященная изучению ископаемых грибных остатков, по мнению Т. Тейлора с соавт. (Taylor et al., 2015a), до сих пор находится на начальной стадии во многом из-за описанной выше ситуации с исследованием современных аналогов, на которые, прежде всего, опираются палеонтологи при идентификации фоссилий. Кроме этого, неполнота палеонтологической летописи, сохранение в ископаемом состоянии разрозненных грибных структур, не позволяющее восстановить грибной организм и стадии его жизненного цикла в полном объеме, а также невозможность применения к палеонтологическим объектам методов молекулярно-генетического анализа усложняют работу в этом научном направлении. Тем не менее, от первых описаний ископаемых грибных остатков, выполненных еще в начале XIX в. (Sternberg, 1820; Eichwald, 1830; Göppert, 1836 и др.), до настоящего момента уже накоплен существенный массив данных, касающихся биоразнообразия в прошлом практически всех крупных систематических групп грибов (Каратыгин, Снигиревская, 2004; Каратыгин, 2007; Taylor et al., 2015a, b; Samarakoon et al., 2019 и др.). Истории становления палеомикологии как науки, обзору изученных ископаемых остатков грибов, а также анализу коэволюционных связей растений и грибов в различных аспектах посвящен ряд монографий и обзорных статей (Каратыгин, 1993, 1994, 2007; Taylor et al., 2015a и др.). Целью настоящей статьи является обзор ряда проблем, возникающих в процессе палеомикологических исследований и касающихся идентификации микроскопических грибов, их классификации, трактовки возможного палеоэкологического и палеоклиматического значения, а также значения коэволюционных связей грибов и растений для филогении обеих групп.
Авторы благодарны О.А. Орловой (МГУ) и Н.З. Завьяловой (ПИН РАН) за предоставленные фотографии спор Svalbardia и за конструктивное обсуждение результатов исследования. Мы также благодарим проф. Ц. Цзинь (Ун-т Сунь Ят-сеня, Гуанчжоу, Китай) за предоставление материала для изучения. Исследование выполнено при финансовой поддержке РФФИ в рамках научных проектов № 19-14-50327 и № 19‐04‐00046.
ДИСПЕРСНЫЕ ГРИБНЫЕ ОСТАТКИ В ПАЛЕОПАЛИНОСПЕКТРАХ
Самые ранние остатки грибных структур обнаружены в палиноспектрах докембрия (Tyler, Barghoorn, 1954; Heckman et al., 2001; Horodyskyj et al., 2012 и др.), а значительный рост разнообразия микобиоты регистрируется, начиная с раннего мезозоя (Kalgutkar, Jansonius, 2000; Tripathi, 2009; Taylor et al., 2015a). В мезозое сформировались все основные известные сегодня морфологические типы грибных спор (Tripathi, 2009), а их возросшая морфологическая сложность и большая частота встречаемости отмечаются в спектрах кайнозойского возраста (Elsik, 1970). Возможность распознавать дисперсные споры грибов возрастает с усложнением их морфологии, следовательно, возрастает их ценность для решения вопросов палеоэкологии и палеоклиматологии (Kalgutkar, 1993).
Микромицеты в палеопалиноспектрах чаще всего представлены отдельными гифами, спорами, реже плодовыми телами и их зародышами. В состав клеточных стенок гифов, спор и покровов плодовых тел грибов входит хитин – природный биополимер, который устойчив к воздействию химических реагентов при мацерации ископаемых растительных остатков и обработке палеопалинологических проб. Присутствие грибов в палиноспектрах, таким образом, может быть очень существенным.
Идентификация грибов часто затруднена из-за их конвергентного сходства, отсутствия уникальных морфологических признаков или сходства некоторых структур грибов с таковыми у многих других групп организмов (главным образом, у водорослей и протистов). В связи с этим значение грибных остатков, обнаруженных в палеопалиноспектрах, долгое время недооценивалось для решения проблем систематики грибов и оценки палеоэкологических и палеоклиматических обстановок.
Споры. Ископаемые споры грибов, обнаруживаемые преимущественно в палиноспектрах, используются для биостратиграфических целей, а также позволяют получить ценную информацию об условиях палеосреды, включая климат, гидрологические условия, тип растительности и характер взаимодействия грибов с другими организмами (van Geel, Aptroot, 2006; Taylor et al., 2015a, b). Многочисленные публикации последних лет демонстрируют прогрессирующий рост морфологического и таксономического разнообразия ископаемых спор в палиноспектрах (напр., Jansonius, Kalgutkar, 2000; Ferreira et al., 2005; van Geel, Aptroot, 2006; Kalgutkar, Braman, 2008; Singh, Chauhan, 2008; El Atfy et al., 2013; Sahay et al., 2016; Miao et al., 2017; Luz et al., 2019 и др.). Идентификация систематической принадлежности дисперсных спор часто вызывает затруднения из-за недостаточности отличительных признаков. Однако некоторые споры грибов, большей частью кайнозойские, благодаря специфическим чертам, могут быть соотнесены с современными семействами и даже родами грибов. Так, например, двуклеточные споры с характерными нерегулярно расположенными по экватору порами, морфологически близкие к спорам современного рода Amphisphaerella (Ascomycota, Sordariomycetes, Xylariomycetidae, Amphisphaeriales, Amphisphaeriaceae), были описаны из миоцена Индии как Palaeoamphisphaerella keralensis Ramanujam et Srisailam (Ramanujam, Srisailam, 1978) и из миоцена Северной Америки (Jarzen et al., 2010) как Palaeoamphisphaerella sp., а в нижнеголоценовых отложениях Нидерландов были обнаружены подобные аскоспоры, отнесенные к современному виду Amphisphaerella dispersella (Nyl.) O. Eriksson (van Geel, Aptroot, 2006). Однако большая часть ископаемых дисперсных грибных спор не может быть классифицирована в рамках естественной системы, для них в разное время были предложены варианты искусственных систем, основанных на морфологических признаках (van der Hammen, 1956; Clarke, 1965; Elsik, 1968, 1976; Pirozynski, Weresub, 1979).
Использование ископаемых спор грибов в биостратиграфии усложняется ввиду уже упомянутого их конвергентного сходства или широкого временного диапазона существования. Однако многие морфотипы спор отличаются уникальной морфологией и отмечаются в ограниченном стратиграфическом интервале, что, наряду с другими палиноморфами, позволяет датировать вмещающие породы (Kalgutkar, 1993; Visscher et al., 2011 и др.). Так, характерные двуклеточные споры Fusiformisporites (anamorphic Ascomycota) с выраженными продольными ребрами (Martínez-Hernández, Tomasini-Ortiz, 1989; Kumar, 1990; Parsons, Norris, 1999 и др.), как и сложно устроенные споры Pesavis Elsik et Jansonius (Smith, Crane, 1979; Kalgutkar, Sweet, 1988), не встречаются ранее палеогена и могут быть индикаторами кайнозойского возраста.
Традиционным методом изучения дисперсных остатков грибов в палинопробах остается световая микроскопия, потенциал сканирующей электронной микроскопии в полной мере еще не реализован. Ряд структурных признаков грибных спор (напр., скульптура оболочек) может быть более информативно описан только при исследованиях с применением СЭМ. Очевидно, что перспективным направлением в будущем может стать также изучение ультраструктуры оболочек грибных спор с использованием трансмиссионной электронной микроскопии (ТЭМ). Такие работы применительно к грибным остаткам практически отсутствуют, однако, по аналогии с результатами подобных исследований, выполненных в последние десятилетия для пыльцевых зерен и спор высших растений, можно ожидать получение дополнительной информации, существенной для идентификации грибных спор.
Зародыши плодовых тел (примордии). Процесс развития грибов от спор до плодовых тел недостаточно описан и проиллюстрирован даже для современных представителей царства Fungi. Формирование плодового тела у грибов может происходить различным образом. Так, у представителей отдела Ascomycota, например, существенно различаются способы образования асколокулярных стром (псевдотециев) и настоящих аскокарпов (Luttrell, 1951). Варианты развития как псевдотециев, так и настоящих плодовых тел аскомицетов во многих случаях остаются не исследованными, поскольку незрелые плодовые тела практически не принимаются во внимание в систематике современных микромицетов. В этом отношении больший прогресс достигнут в палеомикологии, где важно описать все имеющиеся в распоряжении исследователей структуры. Д. Дилчер подробно описал стадии развития зародышей тириотециев представителей Microthyriaceae, выделив их в самостоятельную формальную группу “Young forms (germlings) of microthyriaceous fungi” (Dilcher, 1965). Основанием для выделения такой группы стало обнаружение многочисленных примордиев микромицетов в разных стадиях развития на одном листе покрытосеменного растения Sapindus Tourn. ex L. (эоцен Теннесси, США) вместе со зрелыми тириотециями, принадлежащими к различным родам микротириевых. Поскольку начальные стадии развития разных тириотециев практически одинаковы, определить на раннем этапе, какое плодовое тело сформируется в итоге, не представляется возможным. До выхода работы Дилчера (Dilcher, 1965) найденные в палиноспектрах зародыши плодовых тел определялись как водоросли (напр., Köck, 1939) или именовались родовым названием обнаруженных в тех же пробах зрелых плодовых тел (напр., Altehenger, 1959). Впоследствии в статьях, посвященных анализу палеопалиноспектров, эти структуры стали активно изображаться и определяться как зародыши плодовых тел в понимании формальной группы, предложенной Дилчером (Jain, Gupta, 1970; Ramanujam, Rao, 1973; Selkirk, 1975; Greenwood, 1994; Conran et al., 2016; Sahay et al., 2016 и др.). Отметим, что практически все данные, касающиеся зародышей грибных плодовых тел, получены с использованием СМ. Очевидно, что и в этом случае применение СЭМ может дать новые возможности для изучения морфологии и модусов развития этих структур (рис. 1, а, б).
Рис. 1.
Микромицеты на листьях ископаемых растений, СЭМ: а, б – примордии в разных стадиях развития, экз. MMJ3-2346; в – плодовое тело Callimothallus sp., экз. MMJ3-2371; г – гифы с апрессориями, Melioliales, экз. MMJ3-2371; д – внешняя поверхность листа Dacrycarpus, видно выводное отверстие плодового тела, развитого под кутикулой листа, Xylariales, экз. GP-198; е – внутренняя поверхность кутикулы листа Dacrycarpus, плодовое тело со спорами, Xylariales, экз. GP-198. а–г: Южный Китай, бассейн Маомин; поздний эоцен; д, е – Южный Китай, бассейн Гуйпин; миоцен.
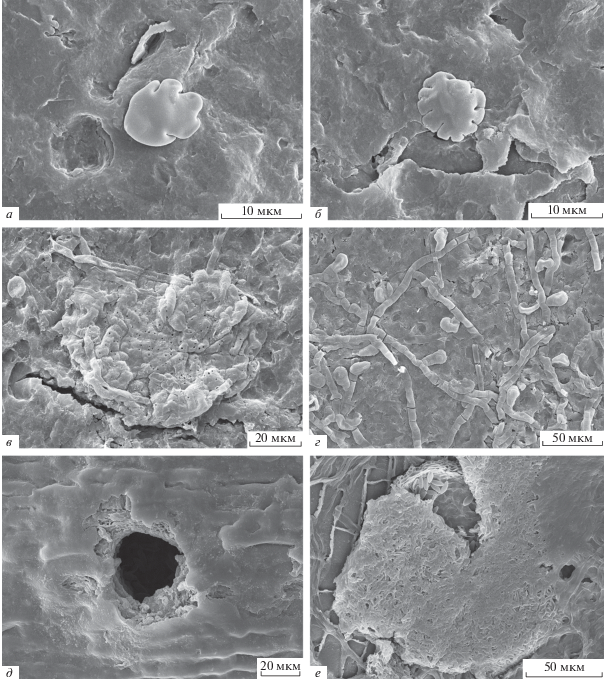
Плодовые тела. Развитые плодовые тела некоторых микромицетов уверенно определяются среди других палиноморф. Прежде всего, это касается представителей Ascomycota из порядка Microthyriales (Kar et al., 1972; Eriksson, 1978; Lange, 1978; Prasad, 1986; Saxena, Misra, 1990; Kalgutkar, 1997; Erdei, Lesiak, 1999–2000; García-Massini et al., 2004; Ferreira et al., 2005; Limaye et al., 2007; Kalgutkar, Braman, 2008; Singh, Chauhan, 2008; Jha, Aggarwal, 2011; El Atfy et al., 2013; Velayati, 2013; Worobiec, Worobiec, 2013, 2017; Александрова и др., 2015), чьи плодовые тела имеют характерное строение. Такие признаки строения тириотециев, как способ организации клеток покрова плодового тела, размеры клеток и особенности их оболочек, наличие/отсутствие пор на антиклинальных стенках клеток, характер края плодового тела, а также способ освобождения спор (отсутствие/наличие и способ организации остиоля или форма выводного отверстия у безостиолятных тириотециев), позволяют довольно точно установить систематическую принадлежность таких структур. Отметим, что изучение плодовых тел микромицетов только с помощью СМ бывает недостаточным. Так, например, мельчайшие поры в клетках тириотециев иногда могут быть видны только при использовании СЭМ (рис. 1, в).
Гифы. Фрагменты гифов грибов – обычный и часто значительный компонент палиноспектров. Эти остатки практически невозможно отнести к какой-либо таксономической группе грибов, ввиду их малоинформативной морфологии. Представители зигоспоровых грибов (в частности, микромицеты отдела Mucoromycota), а также грибоподобные организмы из отдела Oomycota (Pseudofungi) обладают несептированными гифами, остальные грибы имеют септированные гифы, которые могут многократно ветвиться. Те элементы палеопалиноспектров, которые могут быть отнесены лишь к царству грибов, без более точной систематической привязки (напр., некоторые морфотипы спор и плодовых тел, фрагменты гифов), тем не менее, заслуживают внимания палеонтологов. По имеющимся признакам (размерные характеристики и форма спор и плодовых тел, степень септирования и ветвления гифов) может быть оценено их многообразие в спектрах, что будет свидетельствовать о возможном таксономическом разнообразии микобиоты прошлого и косвенно подтверждать суждение о многообразии субстратов (растений, животных и др.), на которых эти грибы могли развиваться.
МИКРОМИЦЕТЫ НА ИСКОПАЕМЫХ РАСТЕНИЯХ
В палеонтологической летописи следы взаимодействий растений и грибов представлены в виде отпечатков, а также могут быть выявлены при микроструктурных исследованиях фитолейм или мумифицированных растительных остатков. Также большой интерес представляют остатки растений с грибами в янтаре (см. обзор литературы в: Halbwachs, 2019; Tischer et al., 2019) и минерализованные фитофоссилии, сохраняющие объекты, в том числе сопутствующие им грибы, в анатомической 3D-форме (Cevallos-Ferriz, Stockey, 1989; Lepage et al., 1994; Klymiuk et al., 2013a, b и др.). Грибы отмечены на всех органах ископаемых растений: корнях, стеблях, листьях и на различных репродуктивных структурах. Есть мнение, что, например, современные эпифитные микромицеты не имеют предпочтений в отношении растения-хозяина или его органов (Phadtare, 1989), однако, кажется очевидным, что количество изученных на сегодня примеров взаимодействия этой группы грибов с субстратом явно недостаточно для такого рода общих заключений.
Микориза. В заключительной публикации (Kidston, Lang, 1921) из серии работ Р. Кидстона и У. Лэнга, посвященных изучению девонских растений родов Rhynia Kidston et Lang, Asteroxylon Kidston et Lang и Horneophyton Barghoorn et Darrah из кремнистых сланцев Райни в Шотландии, были описаны обнаруженные в осадочном матриксе и в тканях этих растений грибы. По наличию несептированных гифов, толстостенных покоящихся спор и везикул в клетках растений Кидстон и Лэнг первыми отметили сходство ископаемых грибов из Райни с современными эндотрофными микоризными грибами. Последующие исследования, продолжающиеся и поныне, дополняют представления о таксономическом разнообразии, морфологии и экологических особенностях девонской микобиоты Райни (Taylor et al., 1992, 1995, 2004, 2005; Remy et al., 1994; Berbee, Taylor, 2007; Krings et al., 2007; Strullu-Derrien et al., 2017; Edwards et al., 2018 и др.).
Известно, что корни 80–90% видов современных высших растений образуют с мицелием грибов симбиотические ассоциации, разнообразные как по происхождению, так и по характеру установленных между кобионтами связей (Каратыгин, 1994; Lepage et al., 1997; Taylor et al., 2015a; Berruti et al., 2016), следовательно, можно ожидать большого разнообразия ископаемых форм микоризных взаимоотношений в геологическом прошлом. Наряду с изучением таксономического разнообразия ископаемых растений и микоризообразующих грибов, также важна оценка симбиотических взаимодействий на уровне растительности и экосистем в целом.
Микромицеты на листьях и репродуктивных структурах растений. Находки ископаемых микромицетов, связанных с органами растений, особенно интересны, так как позволяют более точно определить их систематическую принадлежность, благодаря потенциальной возможности изучения разных стадий развития грибов и характера их связи с субстратом. Грибы могут быть узкоспециализированными или не иметь строгой приуроченности к растению-хозяину, следовательно, знание особенностей тандема “растение-хозяин – микромицет” у современных аналогов может способствовать идентификации как ископаемого растения, так и обитающего на нем гриба. Проблема заключается в том, что далеко не все, а точнее, лишь некоторые, в первую очередь хозяйственно значимые для человека современные растения изучены в аспекте их связей с грибами. Также, анализируя имеющиеся представления о консортивных связях растений и развивающихся на них микромицетов в историческом аспекте, необходимо учитывать возможную смену консортов в современной биоте.
К настоящему моменту описано множество ископаемых микромицетов, обитающих как на поверхности листьев (эпифитные грибы), так и внутри их тканей (эндофитные грибы) (Cookson, 1947; Dilcher, 1965; Alvin, Muir, 1970; Phipps, Rember, 2004; Shi et al., 2010; Ding et al., 2011; Du et al., 2012 и др.). Наиболее информативны находки грибных плодовых тел, морфологические особенности которых позволяют наиболее точно приблизиться к определению систематической принадлежности микромицета. Представители порядка Microthyriales (в частности, семейств Microthyriaceae и Micropeltidaceae), благодаря характерным особенностям строения тириотециев, могут быть легко диагностированы и поэтому считаются на сегодняшний день наиболее изученными в плане их эволюционной истории (Kalgutkar, Jansonius, 2000; Tripathi, 2009; Saxena, Tripathi, 2011 и др.).
Ископаемые микромицеты, связанные с репродуктивными органами растений, известны не так широко, что отчасти обусловлено большей редкостью находок этих структур по сравнению, например, с листьями. Перспективными в этом отношении являются репродуктивные структуры, сохранившие фитолеймы. Так, плодовые тела эндофитных аскомицетов недавно были обнаружены в плодах Burretiodendron из олигоцена Южного Китая (Xu et al., 2020). Примеры поражения аскомицетами минерализованных плодов и семян известны из мела Индии (гифы и пикниды на плодах однодольного растения Viracarpon) (Kalgutkar et al., 1993), эоцена Канады [гифы и псевдотеции на плодах и семенах Decodon (Lythraceae), гифы и склероции на семенах Allenbya (Nymphaeaceae), гифы и пикниды на плодах и семенах Princetonia (familia inсertae sedis)] (Lepage et al., 1994). Представители Chytridiomycota обнаружены внутри мешковых пыльцевых зерен из карбона Северной Америки (Millay, Taylor, 1978) и из перми Индии (Vijaya, Meena, 1996), а также на поверхности мешковых пыльцевых зерен из перми Индии (Srivastava et al., 1999). Необходимо отметить большое конвергентное сходство зооспорангиев хитридиевых с орбикулами – производными тапетума, встречающимися на поверхности спор и пыльцевых зерен ряда высших растений. Избежать ошибки могут помочь исследования таких структур с применением ТЭМ. Так, О.А. Орловой с соавт. (Orlova et al., in prep.) показано, что морфологически сходные с зооспорангиями Chytridiomycota сферические образования (рис. 2, а–в), найденные на поверхности микро- и мегаспор Svalbardia (Archaeopteridales) из девона Северного Тимана (Россия), имеют однородную внутреннюю структуру, выполненную спорополленином, электронная плотность которого идентична таковой у остальной спородермы (рис. 2, г), и, следовательно, являются орбикулами.
Рис. 2.
Мегаспоры и микроспоры Svalbardia sp., Archaeopteridales: а, б – микроспора, виден отпечаток орбикулы, экз. 88-04-01-11(2), СЭМ; в – орбикулы на поверхности мегаспоры, экз. 88-4-01-02(2), СЭМ; г – срез через мегаспору, видны орбикулы (стрелки), идентичные по электронной плотности остальной части спородермы, экз. 88-4-01-02(1), ТЭМ; Россия, Северный Тиман; девон.

ПРОБЛЕМЫ ИДЕНТИФИКАЦИИ СЛЕДОВ ПОВРЕЖДЕНИЙ ИСКОПАЕМЫХ РАСТЕНИЙ ГРИБАМИ
Трудности идентификации типов повреждений ископаемых растений различными агентами во многом обусловлены недостаточной изученностью фитопатологических состояний современных растений из тех же систематических групп. Фитопатологи отдают предпочтение изучению возбудителей заболеваний кормовых культур, интродуцированных с целью озеленения городов деревьев и кустарников, а также других хозяйственно значимых растений. Вследствие этого при определении типов повреждений ископаемых растений не всегда имеется возможность получить сравнительную информацию, касающуюся фитопатологии современных аналогов в природных местообитаниях. При этом определение контаминанта, вызвавшего поражение, во многом зависит от знания его консортивной связи с растением-хозяином. Ситуация осложняется тем, что разные стадии развития инвазии различными агентами, как правило, выражены морфологически сходной реакцией растения. Соответственно, фиксированная стадия развития инвазионного процесса (а именно с такой ситуацией чаще всего и сталкивается палеоботаник) часто не может быть уверенно идентифицирована.
На сегодняшний день найдены свидетельства существования в прошлом представителей всех отделов царства Fungi (Каратыгин, 2007). Основными признаками, по которым различаются отделы, считаются особенности размножения, строение и развитие репродуктивных структур и особенности жизненных циклов. Информация о способах размножения и жизненных циклах у ископаемых грибов весьма ограничена, чаще она попросту недоступна. Точную систематическую принадлежность грибных остатков установить очень трудно, так как вегетативные структуры грибов мало информативны, а репродуктивные структуры сохраняются реже и не в полном объеме.
Следы грибов на отпечатках растений. Следы повреждений грибами органов ископаемых растений, представленных в виде отпечатков, диагностировать довольно сложно. Даже у современных растений определение агента, вызвавшего ряд патологических состояний их органов (в частности, различные пятнистости), вызывает трудности в силу сходства реакций растения на воздействие грибов, бактерий или вирусов. Пятнистости проявляются в образовании на пораженных органах участков в виде пятен различных размеров, формы, цвета и структуры. Опираясь исключительно на морфологию таких проявлений, надежно идентифицировать их причину практически невозможно из-за перекрывания фенотипических признаков. Для корректного выявления повреждающего агента, вызвавшего видоизменения тканей, необходимы специальные микробиологические исследования, возможные только у современных растений.
Иллюстрированный каталог типов повреждений ископаемых растений опубликован К. Лабандейрой с соавт. (Labandeira et al., 2007). На базе пермских, позднемеловых и раннепалеогеновых флор Северной Америки, а также позднетриасовых флор Южной Африки было выделено, кратко описано и проиллюстрировано 150 типов повреждений (DT). Впоследствии число описанных типов увеличилось, что отражено в серии статей (напр., Donovan et al., 2014; Adroit et al., 2018). Для характеристики типа повреждения использовались следующие признаки: размер, форма, особенности внутренней структуры, положение повреждения на поверхности органа, а также тип и степень развития реакции растения на повреждение и наличие сохранившихся копролитов. На основе этих признаков повреждения объединены в следующие группы – проедания в виде отверстий (Hole feeding), краевые погрызы (Margin feeding), скелетирование (Skeletonization), поверхностные проедания (Surface feeding), следы от колющих и сосущих агентов (Piercing-and-sucking), яйцекладки (Oviposition), мины (Mining), галлы (Galling), проедания семян (Seed predation), повреждения грибами (Fungal) и группа повреждений неопределенной природы (Incertae sedis).
Группа повреждений грибами в этом каталоге включает всего один тип – DT58. Морфологический тип реакции растения на инвазию, сходный с DT58, у современных растений характерен также для бактериальных и вирусных повреждений. Некротическая поверхность листовой пластинки может быть ограничена видимым рубцом ткани листа или такой рубец может отсутствовать. Наличие выраженного рубца зависит в большей степени от специфики иммунной реакции самого растения.
Ряд повреждений из группы Galling (Labandeira et al., 2007) в виде очень мелких (около 1 мм и менее), чаще разновеликих, иногда сливающихся вздутий на отпечатках листьев может принадлежать как галлам галлиц (Sohn et al., 2017) или микроскопических клещей, так и плодовым телам некоторых эпифитных и эндофитных микромицетов. Выходное отверстие галла на отпечатках морфологически сходно с выводным отверстием остиоля плодового тела гриба. Отпечатки не дают возможности провести структурный анализ этих форм повреждений, но при наличии фитолеймы он может быть выполнен, и тогда определение типа повреждения будет корректным. Природа подобных образований (рис. 3, а), описанных первоначально на основании внешней морфологии как галлы членистоногих (Василенко и др., 2015), позднее в результате микроструктурных исследований была скорректирована в пользу микромицетного заражения (Maslova et al., 2018). Форма плодового тела и наличие устьицеподобной поры, обращенной к поверхности эпидермиса, позволили предположить, что эти плодовые тела принадлежат грибам отдела Ascomycota (рис. 3, б). Такими морфологическими особенностями могут обладать как аскомы (перитеции или асколокулярные стромы), так и конидиомы пикнидиального типа.
Рис. 3.
Микромицеты на листьях Taxodium sp.: а – внешняя поверхность листа, видны округлые плодовые тела под кутикулой, экз. 5142/2, СМ; б – плодовое тело; экз. 4867-AB1-606, СЭМ; Россия, Амурская обл., Архаро-Богучанское буроугольное месторождение; ранний палеоцен.

Внешнее сходство мелких галлов и вздутий пластинки листа в местах развития плодовых тел микромицетов отмечено и для современных растений (Ho, Hyde, 1996). Микроструктурное изучение листьев показало, что напоминающие галлы структуры на самом деле вызваны развитием аскомат, принадлежащих семейству Phyllachoraceae (класс Sordariomycetes). Несколько примеров, иллюстрирующих вышесказанное, также приводится в статье Я. Ли с соавт. (Li et al., 2011).
Не всегда однозначно можно идентифицировать некоторые повреждения из групп Hole feeding и Margin feeding (Labandeira et al., 2007). На примере листьев современного Liquidambar chinensis Champ. можно наблюдать различные стадии развития реакции растения на воздействие микромицетов (рис. 4), итогом которого могут являться отверстия после выпадения высохших фрагментов листовой пластинки, как во внутренней ее части, так и в краевой. Они иногда выглядят сходными с теми повреждениями, которые образуются в результате проедания или объедания листьев членистоногими. Морфологически сходные повреждения наблюдаются и в группе Surface feeding. Ряд повреждений из группы Piercing-and-sucking проявляет сходство с плодовыми телами микромицетов, а повреждения из группы Mining в виде округлых или полигональных мин с редкими дисперсными копролитами могут оказаться повреждениями грибной природы с остатками микроскопических плодовых тел (см. для сравнения рис. 4, д).
Рис. 4.
Liquidambar chinensis Champ.: а–в – листья, поврежденные микромицетами, видны различные стадии повреждения; г – нижняя поверхность листовой пластинки, виден развитый мицелий, СЭМ; д – поражение листа микромицетом, нижняя поверхность листовой пластинки, видны плодовые тела; е – верхняя поверхность листовой пластинки, видно округлое повреждение в начальной стадии и отверстие после выпадения разрушенной ткани листа. Гербарий авторов, собран на г. Нанькунь, провинция Гуандун, Южный Китай.

Обобщая сказанное, отметим, что типы повреждений фитофоссилий, которые представлены исключительно отпечатками и характеризуются лишь внешними признаками морфологии, требуют особого подхода к их идентификации и классификации. Вероятно, такого рода повреждения ископаемых растений целесообразнее было бы отнести к общей, более широкой морфологической группе, ввиду невозможности точного определения инвазирующего агента. Необходимо отметить, что микромицеты могут проникать в растения, разрушая растительные покровы путем собственного ферментативного воздействия, через эпидермальные структуры (устьица, гидатоды и др.), механические повреждения целостности тканей, а также проколы и раны, нанесенные насекомыми или иными патогенами. В связи с последним обстоятельством результат реакции растения может быть интегрированным: насекомые могут быть переносчиками грибных спор, бактерий или вирусов, которые вызывают вторичное поражение участков, сначала подвергшихся нападению насекомых. Часть галлиц (Diptera: Cecidomyiidae) откладывают яйца в ткани растения вместе с конидиями симбиотических грибов, вызывающих образование галлов, в которых развиваются личинки (Rohfritsch, 2008; Kobune et al., 2012). Некоторые критерии разграничения типов повреждений, вызванных грибами, бактериями и вирусами, представлены Лабандейрой и Р. Превек (Labandeira, Preveс, 2014). Эти авторы отмечают, что совершенствование в данном направлении может быть достигнуто с применением в палеоботанике новых исследовательских методов, таких как рентгеноспектральный анализ, компьютерная томография, спектроскопия и др.
Микромицеты, сохранившиеся в фитолеймах и мумифицированных и минерализованных остатках. Возможность изучения микроструктурной организации трехмерно сохранившихся фитофоссилий определила большой прогресс в идентификации ассоциирующих с ними грибных остатков. Наиболее изученным отделом в плане исторического развития считаются аскомицеты (Kalgutkar, Jansonius, 2000; Taylor et al., 2015a). Но важный диагностический признак аскомицетов – строение асков – ввиду очень тонкой организации сумки, не сохраняющейся при фоссилизации, практически недоступен для изучения. Более того, в ископаемом состоянии часто сложно определить даже стадию развития аскомицета (анаморфа/телеоморфа), так как аскокарпы (в первую очередь, перитеции и пикниды) морфологически сходны, и в отсутствии сумок трудно понять, с какой из структур мы имеем дело.
При идентификации ископаемых микромицетов, развивавшихся на растениях, кроме совокупности характерных признаков имеющихся грибных структур, применяется анализ растения-хозяина у современных аналогов. При отсутствии близких современных грибов-аналогов выделяется новый род микромицета с произвольным названием (напр., Dilcher, 1965), а если таковые имеются, используется родовое название современного гриба с добавлением суффикса -ites (напр., Currah et al., 1998; Phipps, Rember, 2004; Ma et al., 2015).
Крайне редки находки грибных плодовых тел с сохранившимися в них спорами, которые дали бы более полную информацию об ископаемом микромицете. В качестве примера можно привести плодовые тела эндофитных аскомицетов со спорами внутри, развивавшиеся на листьях Dacrycarpus (Podocarpaceae) из миоцена Южного Китая (Wu et al., 2019; детальное описание находок будет представлено в отдельной публикации). Округлые плодовые тела с остиолем имеют многослойную стенку, образованную прозоплектенхимой; внутри расположены одноклеточные веретеновидные, слегка неравнобокие споры с гладкой оболочкой и заметной продольной бороздкой (рис. 1, е). Совокупность признаков позволяет относить эти плодовые тела к порядку Xylariales (Ascomycota, Sordariomycetes).
Чаще описывают плодовые тела без сопутствующих гифов и спор или в ассоциации с дисперсно расположенными на кутикулах спорами, нередко – с различными типами спор (Phipps, Rember, 2004; Shi et al., 2010; Saxena, Tripathi, 2011; Vishnu et al., 2017; Kodrul et al., 2018 и др.). Мы можем предположить, что повреждения, вызванные микромицетами, были более разнообразными и широко представленными в биоте прошлого, чем это очевидно сегодня. Безусловно, идентификация структурно сохранившихся ископаемых грибных остатков наиболее точна, а исследования таких остатков в будущем расширят представления об эволюции этих организмов.
ЗНАЧЕНИЕ ИСКОПАЕМЫХ МИКРОМИЦЕТОВ ДЛЯ РЕШЕНИЯ ЗАДАЧ ПАЛЕОЭКОЛОГИИ И ПАЛЕОКЛИМАТОЛОГИИ
Палеоэкологические интерпретации и палеоклиматические реконструкции в большой степени опираются на соответствующие данные, касающиеся современных аналогов. Грибы, наряду с бактериями, имеют фундаментальное значение в наземных экосистемах, являясь активными деструкторами как органического, так и неорганического вещества, и связующими звеньями в биологических циклах. Так, например, почвенные микромицеты в значительной мере определяют структурные и химические характеристики почв и тем самым опосредованно влияют на состав почвенной и наземной биоты (Чернов, Марфенина, 2010).
По способу питания грибы, развивающиеся на растительном субстрате, разделяются на две группы – биотрофы (облигатные паразиты и симбиотрофы) и сапротрофы (Левкина, 2010; Kemen, Jones, 2012). Особую группу составляют грибы-некротрофы (Oliver, Ipcho, 2004), поселяющиеся на живом растении и убивающие его клетки выделяемыми токсинами, а затем использующие мертвые и ослабленные ткани хозяина в качестве источника питания. Кроме того, исходя из потенциала грибного организма, можно выделить группы факультативных сапротрофов и факультативных паразитов (Agrios, 2005; Дьяков, 2007), способных в определенных условиях переходить от паразитизма к сапротрофности и наоборот. Условия перехода определяются состоянием растения-хозяина, конкурентными взаимоотношениями и абиотическими факторами. Таким образом, один и тот же гриб в разных условиях может занимать разные экологические ниши, а его корректное отнесение к той или иной эколого-трофической группе часто требует исследования полного цикла развития, что невозможно для ископаемых грибов. Таким образом, уверенное отнесение ископаемого микромицета к какой-то определенной эколого-трофической группе существенно затруднено.
О паразитических свойствах ископаемых микромицетов более или менее уверенно можно судить по наличию гаусторий в клетках растения-хозяина или по сильно видоизмененным клеткам тканей хозяина (разного рода разрастаниям, изменениям клеточных стенок или специфическим разрушениям). Фактическое расположение плодовых тел и гифов микромицетов внутри тканей растения не может однозначно рассматриваться как признак паразитического образа жизни гриба, так как невозможно достоверно определить, за счет чего питался этот гриб – за счет живых клеток хозяина, за счет клеток, которые по тем или иным причинам, иногда не связанным с воздействием гриба, начали отмирать (некротрофы и сапротрофы), или путем поглощения веществ, накапливающихся в межклетниках в процессе жизнедеятельности растения (эндофиты).
Некоторые современные микромицеты, например, виды рода Trichothyrina (Petr.) Petr. (Microthyriaceae), являются гиперпаразитами, развиваясь на других эпифитных микромицетах. В то же время они могут быть обнаружены и на растительном субстрате (Hughes, 1953; Ellis, 1977). Дилчер (Dilcher, 1965) показал разнообразие ископаемых эпифитных микромицетов, в частности, представителей семейств Microthyriaceae и Melioliaceae, на листьях покрытосеменного растения Sapindus sp., и высказал предположение, что какие-то из описанных им форм могли быть гиперпаразитами, однако веских доказательств не было обнаружено.
В большинстве случаев невозможно судить о том, к какой группе принадлежит ископаемый микромицет. Метод актуализма, хотя и с известными допущениями, широко применяется для оценки экологических предпочтений ископаемых организмов, однако микологические данные в этом аспекте стали использоваться сравнительно недавно и требуют тщательной верификации.
Фитопатогенные грибы являются важной составной частью биоценозов, оказывая существенное влияние на рост и развитие растений в разных стадиях вегетации. Различные грибы могут предпочитать разные жизненные формы растений, различные ярусы в фитоценозах; может быть различна топография развития микромицета в пределах кроны и/или листа крупного дерева. Кроме того, грибы часто тесно ассоциированы со специфическими растениями. Таким образом, если мы имеем дело с находками определенных микромицетов на ископаемых растениях, в ряде случаев можно делать заключения о жизненной форме и габитусе растения, а также можно предположить, являлось ископаемое растение вечнозеленым или листопадным. Обнаружение ассоциаций тех или иных растений и грибов в ископаемом состоянии может предполагать существование их консортивных связей в геологическом прошлом (Leppik, 1973; Saxena, Tripathi, 2011). При сравнении ископаемых микофоссилий с современными аналогами следует учитывать, что сведения об экологии современных грибов пока далеко не полные, постоянно описываются новые таксоны грибов, расширяются представления об их растениях-хозяевах и географии распространения.
Примером использования метода актуализма в палеомикологии может быть определение вероятного, не подтвержденного находками листьев или иных органов, присутствия в голоценовой флоре Нидерландов растения-хозяина тополя по наличию в палиноспектре спор гриба Amphisphaerella dispersella, облигатно развивающегося на листьях современного Populus (van Geel, Aptroot, 2006). Поскольку жизненный цикл микромицетов может занимать очень длительный промежуток времени, присутствие или отсутствие плодовых тел грибов и их зародышей на листьях может быть дополнительным показателем вечнозеленого или листопадного статуса растения-хозяина (Sherwood-Pike, Gray, 1988).
Закономерности вертикального распределения микромицетов в пределах одного растения, произрастающего в условиях современных тропических и субтропических лесов, были показаны Р. Пхадтаре (Phadtare, 1989). Выяснилось, что эпифитные микромицеты предпочитают в основном нижнюю поверхность листьев, расположенных в верхней части кроны, при этом они развиваются на обеих поверхностях листьев, расположенных в нижней и центральной частях кроны. Как прямой солнечный свет, так и открытое положение по отношению к аэропотокам пагубно влияют на развитие грибных зародышей. На основе этих данных можно предположить, что топография микромицетов на листовых поверхностях обусловлена расположением листьев в кроне дерева, не является характерным признаком, и не имеет значения для определения систематической принадлежности гриба. Эпифитные микромицеты также более разнообразны на листьях растений, расположенных в нижней части кроны (Gilbert et al., 2007). Есть также мнение, что влажность и температура являются определяющими для обилия сапротрофных грибов, в то время как распределение паразитарных форм в большей степени контролируется хозяевами (Phadtare, 1989).
Так как многие организмы характеризуются относительно ограниченной экологической амплитудой, изменения состояния окружающей среды влекут за собой смену характера биоты. Учитывая это, экологические и климатические условия прошлого могут быть оценены на основании присутствия тех или иных представителей флоры, фауны и микробиоты, и особенно ассоциаций разных групп организмов. При реконструкции палеоклиматов существенную роль играет анализ сообществ эпифитных микромицетов. Среди них в настоящее время наиболее изучены микромицеты порядков Microthyriales и Melioliales, современные представители которых являются паразитами на листьях высших растений тропических и субтропических зон, растущих в районах с высокой влажностью и относительно стабильной температурой в течение года (Kalgutkar, 1985; Prasad, 1986; Phadtare, 1989; Schmiedeknecht, 1995; Hosagoudar et al., 1998a, b, c; Tripathi, 2009; Piepenbring et al., 2011; Worobiec, Worobiec, 2013 и др.). Благодаря специфической морфологии плодовых тел современных представителей Microthyriales (рис. 1, в), характерным особенностям мицелия с аппрессориями (рис. 1, г), плодовых тел и спор, присущих грибам Melioliales, а также приуроченности грибов этих групп к тропическим и субтропическим регионам, они легко идентифицируются и являются потенциально полезными для палеоэкологических и палеоклиматических заключений. Так, на примере современных грибов семейства Microthyriaceae (Microthyriales) было показано, что их паразитические формы, как правило, встречаются в субтропиках и тропиках, тогда как сапротрофные и гиперпаразитарные – в умеренных районах (Hofmann, 2009). Отметим, однако, что идентификация плодовых тел микротириевых может быть затруднена из-за их морфологического сходства, например, с водорослями. Примерами такого конвергентного сходства могут служить зеленые водоросли рода Ulvella P. Crouan et H. Crouan (Hansen, 1980) и красные водоросли рода Caloglossa (Harvey) G. Martens (Tripathi, 2009).
Использование сравнительных данных по современным аналогам микромицетов для палеоклиматических построений несколько ограничено в силу того, что современные грибы наиболее изучены из регионов с умеренным климатом, тогда как ископаемые микромицеты описаны большей частью из субтропических и тропических регионов (Stubblefield, Taylor, 1988). За последние десятилетия этот пробел был существенно восполнен (напр., Reynolds, Gilbert, 2005; Thaung, 2006; Hofmann, 2009; Piepenbring et al., 2011), однако мнение С. Стaбблфилда и Т. Тейлора, что данная ситуация лимитирует выводы, касающиеся эволюции и разнообразия микроскопических грибов, по-прежнему актуально и сегодня.
Развиваясь на поверхности органов растений, эпифитные микромицеты оказываются зависимыми не только от состояния самого растения-хозяина, но и в большой степени от таких абиотических факторов среды, как влажность и температура. Наличие влаги (высокая годовая норма осадков, относительно продолжительный влажный период) абсолютно необходимо для полноценного роста мицелия гриба, формирования и развития из зародышей грибных плодовых тел (Selkirk, 1975; Limaye et al., 2007). Это обстоятельство дает основания для оценки регионального палеоклимата как такового с повышенной влажностью.
Ископаемые зародыши тириотециев Microthyriaceae считаются надежными индикаторами палеоклиматов (Lange, 1976). Зародыши микротириевых грибов на различных стадиях развития использовались для палеоклиматических интерпретаций в ряде исследований (напр., Dilcher, 1965; Wells, Hill, 1993; Carpenter et al., 1994; Greenwood, 1994; Tripathi, 2009; Saxena, Tripathi, 2011; Du et al., 2012; Conran et al., 2016; Paruya et al., 2017) как индикаторы влажных тропических местообитаний растений-хозяев.
Что касается температурного фактора, то, как показывают исследования (Dilcher, 1965; Selkirk, 1975; Tripathi, 2009), эпифитные микромицеты некоторых современных родов способны развиваться и в высоких широтах. Дилчер (Dilcher, 1965) и Д. Селкирк (Selkirk, 1975) первыми указали, что к экологическим интерпретациям теплых условий, основанным на находках эпифитных микромицетов, следует относиться осторожно. Они отметили, что, хотя большинство ископаемых эпифитных микромицетов связывается с субтропической растительностью, изолированные плодовые тела встречаются в широком широтном диапазоне в плейстоценовых отложениях Северной Америки (Rosendahl, 1943), а также в широком диапазоне климатических условий в Британии (Godwin, Andrew, 1951).
Большинство исследователей поддерживает высказанное ранее Дилчером (Dilcher, 1965) мнение, что любые палеоэкологические и палеоклиматические выводы должны основываться не только на экологическом анализе ископаемых и сходных современных эпифитных грибов, но и ассоциирующих фоссилий – палиноморф, листьев, репродуктивных органов, древесины и др. Однако, по мнению М. Шервуд-Пайк и Дж. Грея (Sherwood-Pike, Gray, 1988), изобилие и разнообразие эпифитных грибов является более чувствительным показателем палеоклимата, чем состав палиноспектров и морфология листьев.
Заключения о теплом и влажном палеоклимате в многочисленных палеоботанических исследованиях были подтверждены присутствием грибных плодовых тел и спор как в палиноспектрах, так и в ассоциации с растениями-хозяевами (напр., Dilcher, 1965; Rao, Nair, 1998; Tripathi, 2009; Mandal et al., 2011; Du et al., 2012; Ma et al., 2015; Bannister et al., 2016; Paruya et al., 2017; Wang et al., 2017; Kodrul et al., 2018; Khan et al., 2019; Singh et al., 2019; Wu et al., 2019). В последнее время для реконструкции палеоклиматических условий активно используется метод CLAMP (Climate Leaf Analysis Multivariate Program, http://clamp.ibcas.ac.cn/). Палеоклиматические реконструкции на основе комплексных исследований фитофоссилий и ископаемых микромицетов с привлечением данных, полученных методом CLAMP, были успешно представлены в ряде работ (напр., Conran et al., 2016; Kodrul et al., 2018). Очевидно, что реконструкции палеоклиматических условий должны опираться на совокупность данных, полученных различными методами, с учетом всего спектра имеющихся макрофоссилий и палиноморф, включая остатки грибов.
ЗАКЛЮЧЕНИЕ
Палеомикологические исследования, наиболее продуктивно развивающиеся в последние десятилетия, показали взаимодействие различных таксономических групп грибов и растений на протяжении их общего исторического развития. Сегодня очевидно, что коэволюционные отношения растений и грибов, вероятно, еще недооцененные в их историческом аспекте, выступали в роли мощного фактора, проявившего себя в ключевые моменты развития биоты Земли. Грибы играли существенную роль в формировании палеопочв, становлении и эволюции наземных растений, возникновении первых фитоценозов и эволюционном развитии растительных сообществ.
Эволюционные механизмы формирования отличающейся столь высоким таксономическим и морфологическим разнообразием группы остаются во многом непознанными. В этой связи палеомикологические исследования могут быть успешно использованы в качестве индикаторов достоверности представлений о систематике царства Fungi, происхождении грибов и становлении основных ветвей их филогенетического древа, базирующихся на результатах классических морфологических исследований современной микобиоты и данных геносистематики. Палеомикологическая летопись, хотя и не лишенная ряда существенных недостатков и ограничений, документирует важнейшие этапы в становлении микобиоты Земли как особой эволюционной группы организмов, предоставляя важные свидетельства в пользу возникших на ранних этапах исторического развития коэволюционных связей грибов и различных организмов – представителей других царств живых существ. Дальнейшее совершенствование научного палеомикологического направления, в первую очередь, путем более широкого применения современной исследовательской техники, несомненно, прольет свет на ключевые вопросы систематики и филогении грибов, коэволюции грибов и других групп организмов, что также существенно для развития эволюционной теории в целом.
Список литературы
Александрова Г.Н., Кодрул Т.М., Цзинь Ц.Х. Краткий очерк палинологического и палеоботанического изучения палеогеновых отложений бассейна Маомин, Южный Китай // Стратигр. Геол. корреляция. 2015. Т. 23. № 3. С. 69–95.
Василенко Д.В., Соколова А.Б., Кодрул Т.М. Новая форма повреждений на листьях рода Taxodium Richard из нижнепалеоценовых отложений Приамурья // Современная палеонтология: классические и новейшие методы. М.: Изд-во ПИН РАН, 2015. С. 11.
Дьяков Ю.Т. Курс альгологии и микологии. М.: Изд-во МГУ, 2007. 559 с.
Каратыгин И.В. Коэволюция грибов и растений. СПб.: Гидрометеоиздат, 1993. 118 с.
Каратыгин И.В. Грибные организмы и их роль в эволюции экосистем // Ботан. журн. 1994. Т. 79. № 2. С. 13–20.
Каратыгин И.В. Микофоссилии: современное состояние проблемы // Микология сегодня. Том 1. М.: Национальная акад. микологии, 2007. С. 10–28.
Каратыгин И.В., Снигиревская Н.С. Палеонтологические свидетельства о происхождении основных таксономических групп грибов // Микол. и фитопатол. 2004. Т. 38. № 5. С. 15–31.
Левкина М.Н. Основы микологии. Горно-Алтайск: РИО ГАГУ, 2010. 85 с.
Чернов И.Ю., Марфенина О.Е. Палеопочвы и индикаторы континентального выветривания в истории биосферы // Серия “Гео-биологические системы в прошлом”. М.: ПИН РАН, 2010. С. 95–111.
Adroit B., Girard V., Kunzmann L. et al. Plant-insect interactions patterns in three European paleoforests of the late-Neogene – early-Quaternary // Peer J. 2018. 6:e5075 https://doi.org/10.7717/peerj.5075
Agrios G.N. Plant Pathology. Oxford: Elsevier Acad. Press, 2005. 921 p.
Altehenger A. Floristisch belegte Klimaschwankungen im mitteleuropäischen Pliozän der Reuver-Stufe // Palaeontogr. Abt. B. 1959. Bd 106. S. 11–77.
Alvin K.L., Muir M.D. An epiphyllous fungus from the Lower Cretaceous // Biol. J. Linn. Soc. 1970. V. 2. № 1. P. 55–59.
Bannister J.M., Conran J.G., Lee D.E. Life on the phylloplane: Eocene epiphyllous fungi from Pikopiko Fossil Forest, Southland, New Zealand // New Zeal. J. Bot. 2016. V. 54. № 4. P. 412–432.
Berbee M.L., Taylor J.W. Rhynie chert: a window into a lost world of complex plant-fungus interactions // New Phytologist. 2007. V. 174. № 3. P. 475–479. https://doi.org/10.1111/j.1469-8137.2007.02080.x
Berruti A., Lumini E., Balestrini R., Bianciotto V. Arbuscular mycorrhizal Fungi as natural biofertilizers: Let’s benefit from past successes // Front. Microbiol. 2016. V. 6. https://doi.org/10.3389/fmicb.2015.01559
Blackwell M. The fungi: 1, 2, 3 … 5.1 million species? // Amer. J. Bot. 2011. V. 98. № 3. P. 426–438.
Carpenter R.J., Hill R.S., Jordan G.J. Cenozoic vegetation in Tasmania: macrofossil evidence // History of the Australian Vegetation: Cretaceous to Recent. Cambridge: Cambridge Univ. Press, 1994. P. 276–298.
Cevallos-Ferriz S.R.S., Stockey R.A. Permineralized fruits and seeds from the Princeton chert (Middle Eocene) of British Columbia: Nymphaeaceae // Bot. Gaz. 1989. V. 150. № 2. P. 207–217.
Clarke R.T. Fungal spores from Vermejo Formation coal beds (Upper Cretaceous) of central Colorado // Mountain Geologist. 1965. V. 2. № 2. P. 85–93.
Conran J.G., Bannister J.M., Reichgelt T., Lee D.E. Epiphyllous fungi and leaf physiognomy suggest an ever-wet humid mesothermal (subtropical) climate in the late Eocene of southern New Zealand // Palaeogeogr., Palaeoclimatol., Palaeoecol. 2016. V. 452. P. 1–10.
Cookson I.C. Fossil fungi from Tertiary deposits in the southern hemisphere. Part I // Proc. Linn. Soc. New South Wales. 1947. V. 72. P. 207–214.
Currah R.S., Stockey R.A., LePage B.A. An Eocene tar spot on a fossil palm and its fungal hyperparasite // Mycologia. 1998. V. 90. № 4. P. 667–673.
Dilcher D.L. Epiphyllous fungi from Eocene deposits in western Tennessee, USA // Palaeontogr. Abt. B. 1965. V. 116. P. 1–54.
Ding S.-T., Sun B.-N., Wu J.-Y., Li X.-C. Miocene Smilax leaves and associated epiphyllous fungi from Zhejiang, East China and their paleoecological implications // Rev. Palaeobot. Palynol. 2011. V. 165. № 3–4. P. 209–223.
Donovan M.P., Wilf P., Labandeira C.C. et al. Novel insect leaf-mining after the End-Cretaceous extinction and the demise of Cretaceous leaf miners, Great Plains, USA // PLoS ONE. 2014. V. 9. № 7. P. 1–35.
Du B.-X., Yan D.-F., Sun B.-N. et al. Cunninghamia praelanceolata sp. nov. with associated epiphyllous fungi from the upper Miocene of eastern Zhejiang, S.E. China and their palaeoecological implications // Rev. Palaeobot. Palynol. 2012. V. 182. P. 32–43.
Edwards D., Kenrick P., Dolan L. History and contemporary significance of the Rhynie cherts – our earliest preserved terrestrial ecosystem // Phil. Trans. R. Soc. Lond. B. Biol. Sci. 2018. V. 373 (1739): 20160489. doi.org/https://doi.org/10.1098/rstb.2016.0489
Eichwald K.E. Naturhistorische Skizze von Lithauen, Volynien und Podolien in geognostischmineralogischer, botanischer und zoologischer Hinsicht. Vilnius: J. Zawadzki, 1830. 255 p.
El Atfy H., Brocke R., Uhl D. A fungal proliferation near the probable Oligocene/Miocene boundary, Nukhul Formation, Gulf of Suez, Egypt // J. Micropalaeontol. 2013. V. 32. P. 183–195.
Ellis J.P. The genera Trichothyrina and Actinopeltis in Britain // Trans. Brit. Mycol. Soc. 1977. V. 68. № 2. P. 145–155.
Elsik W.C. Palynology of a Paleocene Rockdale lignite, Milam County, Texas, I. Morphology and taxonomy // Pollen Spores. 1968. V. 10. № 2. P. 263–314.
Elsik W.C. Palynology of a Paleocene Rockdale lignite, Milam County, Texas, III. Errata and taxonomic revisions // Pollen Spores. 1970. V. 12. № 1. P. 99–101.
Elsik W.C. Microscopic fungal remains and Cenozoic palynostratigraphy // Geosci. Man. 1976. V. 15. № 1. P. 115–120.
Erdei B., Lesiak M. A study of dispersed cuticles, fossil seeds and cones from Sarmatian (Upper Miocene) deposits of Sopron-Piusz Puszta (W Hungary) // Studia Bot. Hungarica. 1999–2000. V. 30/31. P. 5–26.
Eriksson B. Fossi microthyriaceous fungi from Tervola, northern Finland // Ann. Bot. Fennici. 1978. V. 15. № 2. P. 122−127.
Ferreira E.P., de Aravjo Carvalho M., Viviers M.C. Palinologia (fungos) da Formacao Calumbi, Paleoceno da Bacia de Sergipe, Brasil // Arq. Mus. Nac. Rio de J. 2005. V. 63. № 3. P. 395–410.
García-Massini J.L., Zamaloa M. del C., Romero E.J. Fungal fruiting bodies in the Cullen Formation (Miocene) in Tierra del Fuego, Argentina // Ameghiniana. 2004. V. 41. № 1. P. 83–90.
Gilbert G.S., Reynolds D.R., Bethancourt A. The patchiness of epifoliar fungi in tropical forests: host range, host abundance, and environment // Ecology. 2007. V. 88. № 3. P. 575–581.
Godwin H., Andrew R. A fungal fruit body common in post-glacial peat deposits // New Phytol. 1951. V. 50. № 2. P. 179–183.
Göppert H.R. Die fossilen Farrnkräuter. Breslau, Bonn: E. Webers Buchhandlung zu Bonn, 1836. 486 p. (Verh. Kais. Leopoldinisch-Carolinischen Akad. Naturforsch. Bd 17. Suppl.).
Greenwood D.R. Palaeobotanical evidence for Tertiary climates // History of the Australian Vegetation: Cretaceous to Recent. Cambridge: Cambridge Univ. Press, 1994. P. 44–59.
Halbwachs H. Fungi trapped in amber—a fossil legacy frozen in time // Mycol. Progr. 2019. V. 18. № 7. P. 879–893.
Hansen J.M. Morphological characterization of encrusting, palynomorph green algae from the Cretaceous-Tertiary of central West Greenland and Denmark // Grana. 1980. V. 19. № 1. P. 67–77.
Hawksworth D.L. The fungal dimension of biodiversity: Magnitude, significance, and conservation // Mycol. Res. 1991. V. 95. № 6. P. 641–655.
Hawksworth D.L., Lücking R. Fungal diversity revisited: 2.2 to 3.8 Million species // Microbiol. Spectr. 2017. V. 5. № 4. https://doi.org/10.1128/microbiolspec.FUNK-0052-2016
Heckman D.S., Geiser D.M., Eidell B.R. et al. Molecular evidence for the early colonization of land by fungi and plants // Science. 2001. V. 293. № 5532. P. 1129–1133.
Ho W.H., Hyde K.D. Pterosporidium gen. nov. to accommodate two species of Anthostomella from mangrove leaves // Canad. J. Bot. 1996. V. 74. № 11. P. 1826–1829.
Hofmann T.A. Plant parasitic Asterinaceae and Microthyriaceae from the Neotropics (Panama). PhD thesis. Frankfurt am Main, 2009. 408 p.
Horodyskyj L.B., White T.S., Kump L.R. Substantial biologically mediated phosphorus depletion from the surface of a Middle Cambrian paleosol // Geology. 2012. V. 40. № 6. P. 503–506. https://doi.org/10.1130/g32761.1
Hosagoudar V., Abraham T., Goos R. Meliolaceae of Kerala, India–II // Mycotaxon. 1998a. V. 66. P. 103–108.
Hosagoudar V., Abraham T., Goos R. Meliolaceae of Kerala, India–III // Mycotaxon. 1998b. V. 66. P. 109–113.
Hosagoudar V., Abraham T., Goos R. Meliolaceae of Kerala, India–IV // Mycotaxon. 1998c. V. 66. P. 115–119.
Hughes S.J. Fungi from the Gold Coast. II // Mycol. Papers. 1953. V. 50. P. 1–104.
Hughes S.J. Relocation of species of Endophragmia auct. with notes on relevant generic names // New Zeal. J. Bot. 1979. V. 17. № 2. P. 139–188.
Jain K.P., Gupta R.C. Some fungal remains from the tertiaries of Kerala coast // Palaeobotanist. 1970. V. 18. № 2. P. 177–182.
Jha N., Aggarwal N. First find of Trichothyrites, Notothyrites and Frasnacritetrus from Permian Gondwana sediments of Godavari Graben, India // Phytomorphology. 2011. V. 61. № 3–4. P. 61–67.
Jansonius J., Kalgutkar R.M. Redescription of some fungal spores // Palynology. 2000. V. 24. P. 37–47.
Jarzen D.M., Corbett S.L., Manchester S.R. Palynology and paleoecology of the Middle Miocene Alum Bluff flora, Liberty County, Florida, USA // Palynology. 2010. V. 34. № 2. P. 261–286.
Kalgutkar R.M. Fossil fungal fructifications from Bonnet Plume Formation, Yukon Territory // Current Res. Geol. Surv. Canada. Pt B. 1985. Pap. 85-18. P. 259–268.
Kalgutkar R.M. Paleogene fungal palynomorphs from Bonnet Plume Formation, Yukon Territory // Bull. Geol. Surv. Canada. 1993. V. 444. P. 51–105.
Kalgutkar R.M. Fossil fungi from the lower Tertiary Iceberg Bay Formation, Eukeka Sound Group, Axel Heiberg Island, Northwest Territories, Canada // Rev. Palaeobot. Palynol. 1997. V. 97. № 1–2. P. 197–226.
Kalgutkar R. M., Braman D.R. Santonian to ?earliest Campanian (Late Cretaceous) fungi from the Milk River Formation, southern Alberta, Canada // Palynology. 2008. V. 32. № 1. P. 39–61.
Kalgutkar R.M., Jansonius J. Synopsis of Fossil Fungal Spores, Mycelia and Fructifications. Dallas: Amer. Assoc. of Stratigraphic Palynologists Foundation, 2000. 429 p.
Kalgutkar R.M., Nambudiri E.M.V., Tidwell W.D. Diplodites sweetii sp. nov. from the Late Cretaceous (Maastrichtian) Deccan Intertrappean Beds of India // Rev. Palaeobot. Palynol. 1993. V. 77. № 1–2. P. 107–118.
Kalgutkar R.M., Sweet A.R. Morphology, taxonomy and phylogeny of the fossil fungal genus Pesavis from northwestern Canada // Contrib. Canad. Paleontol. Geol. Surv. 1988. Bull. 379. P. 117–133.
Kar R.K., Singh R.Y., Sah S.C.D. On some algal and fungal remains from Tura Formation of Garo Hills, Assam // Palaeobotanist. 1972. V. 19. № 2. P. 146–154.
Kemen E., Jones J.D.G. Obligate biotroph parasitism: can we link genomes to life styles? // Trends Plant Sci. 2012. V. 17. № 8. P. 448–457.
Khan M.A., Bera M., Bera S. A new meliolaceos foliicolous fungus from the Plio-Pleistocene of Arunachal Pradesh, eastern Himalaya // Rev. Palaeobot. Palynol. 2019. V. 268. P. 55–64.
Kidston R., Lang W. H. On Old Red Sandstone plants showing structure, from the Rhynie Chert Bed, Aberdeenshire. Part V. The Thallophyta occurring in the peat-bed; the succession of the plants throughout a vertical section of the bed, and the conditions of accumulation and preservation of the deposit // Trans. R. Soc. Edinb. 1921. V. 52. № 33. P. 855–902.
Klymiuk A.A., Taylor T.N., Taylor E.L., Krings M. Paleomycology of the Princeton chert. I. Saprotrophic hyphomycetes associated with an Eocene angiosperm, Eorhiza arnoldii // Mycologia. 2013a. V. 105. № 3. P. 521–529.
Klymiuk A.A., Taylor T.N., Taylor E.L., Krings M. Paleomycology of the Princeton chert. II. Dark septate fungi in the aquatic angiosperm Eorhiza arnoldii indicate a diverse assemblage of root-colonizing fungi during the Eocene // Mycologia. 2013b. V. 105. № 5. P. 1100–1109.
Köck C. Fossile Kryptogamen aus der eozänen Braunkohle des Geiseltales // Nova Acta Leopoldina. 1939. V. 6. № 40. P. 333–359.
Kobune S., Kajimura H., Masuya H., Kubono T. Symbiotic fungal flora in leaf galls induced by Illiciomyia yukawai (Diptera: Cecidomyiidae) and in its mycangia // Microb. Ecol. 2012. V. 63. № 3. P. 619–627.
Kodrul T., Gordenko N., Sokolova A. et al. A new Oligocene species of Cunninghamia R. Brown ex Richard et A. Richard (Cupressaceae) from the Maoming Basin, South China // Rev. Palaeobot. Palynol. 2018. V. 258. P. 234–247.
Krings M., Taylor T.N., Hass H. et al. Fungal endophytes in a 400-million-yr-old land plant: infection pathways, spatial distribution, and host responses // New Phytologist. 2007. V. 174. № 3. P. 648–657.
Kumar P. Fungal remains from the Miocene Quilon beds of Kerala State, South India // Rev. Palaeobot. Palynol.1990. V. 63. № 1–2. P. 13–28.
Labandeira C.C., Prevec R. Plant paleopathology and the roles of pathogens and insects // Intern. J. Paleopathol. 2014. V. 4. P. 1–16.
Labandeira C.C., Wilf P., Johnson K.R., Marsh F. Guide to insect (and other) damage types on compressed plant fossils. Version 3.0. Washington, D.C.: Smithson. Inst., 2007. 25 p.
Lange R.T. Fossil epiphyllous ‘germlings’, their living equivalents and their palaeohabitat indicator value // N. Jb. Geol. Paläontol. Abh. 1976. V. 151. P. 142–165.
Lange R.T. Southern Australian Tertiary epiphyllous fungi: modern equivalents in the Australasian region, and habitat indicator value // Can. J. Bot. 1978. V. 56. № 5. P. 532–541.
Lepage B.A., Currah R.S., Stockey R.A. The fossil fungi of the Princeton Chert // Int. J. Plant Sci. 1994. V. 155. № 6. P. 828–836. https://doi.org/10.1086/297221
Lepage B.A., Currah R.S., Stockey R.A., Rothwell G.W. Fossil ectomycorrhizae from the middle Eocene // Amer. J. Bot. 1997. V. 84. № 3. P. 410–412.
Leppik E.E. Origin and evolution of conifer rusts in the light of continental drift // Mycopathol. Mycol. Applicata.1973. V. 49. P. 121–136.
Li M., Zhao J., Tang N. et al. Horizontal gene transfer from bacteria and plants to the arbuscular mycorrhizal fungus Rhizophagus irregularis // Front. Plant Sci. 2018. V. 9: 701. https://doi.org/10.3389/fpls.2018.00701
Li Y., Wu H., Chen H., Hyde K.D. Morphological studies in Dothideomycetes: Elsinoe (Elsinoaceae), Butleria, and three excluded genera // Mycotaxon. 2011. V. 115. № 1. P. 507–520. https://doi.org/10.5248/115.507
Limaye R.B., Kumaran K.P.N., Nair K.M., Padmalal D. Non-pollen palynomorphs as potential palaeoenvironmental indicators in the Late Quaternary sediments of the west coast of India // Current Sci. 2007. V. 92. № 10. P. 1370–1382.
Luttrell E.S. Taxonomy of Pyrenomycetes // Univ. Mo. Stud., Sci. ser. 1951. V. 24. № 3. P. 1–120.
Lutzoni F., Nowak M.D., Alfaro M.E. et al. Contemporaneous radiations of fungi and plants linked to symbiosis // Nat. Commun. 2018. V. 9: 5451. https://doi.org/10.1038/s41467-018-07849-9
Luz C.F.P., Barros M.A., Misumi S.Y. et al. Microfósseis não polínicos como indicadores de mudanças ambientais no Holoceno médio da Lagoa Comprida, Parque Nacional da Restinga de Jurubatiba, Estado do Rio de Janeiro, Brasil // Hoehnea. 2019. V. 46: e782018. https://doi.org/10.1590/2236-8906-78/2018
Ma F.-J., Sun B.-N., Wang Q.-J. et al. A new species of Meliolinites associated with Buxus leaves from the Oligocene of Guangxi, southern China // Mycologia. 2015. V. 107. № 3. P. 505–511. https://doi.org/10.3852/14-270
Mandal A., Samajpati N., Bera S. A new species of Meliolinites (fossil Meliolales) from the Neogene sediments of sub-Himalayan West Bengal, India // Nova Hedwigia. 2011. V. 92. № 3. P. 435–440.
Marienfeld J.R., Unseld M., Brandt P., Brennicke A. Viral nucleic acid sequence transfer between fungi and plants // Trends Genet. 1997. V. 13. № 7. P. 260–261.
Martínez-Hernández E., Tomasini-Ortiz A.C. Spores, hyphae and other fungal remains from the Fuentes-Rio Escondino Carboniferous basin (Campanian-Maastrichtian), Coahuila State, Mexico // Univ. Nac. Auton. Mex. Ins. Geol. Rev. 1989. V. 8. P. 235–242.
Maslova N.P., Sokolova A.B., Vasilenko D.V. et al. Endophytic micromycetes on the leaves of the genus Taxodium Richard (Cupressaceae) from the Lower Paleocene of the Amur Region // Paleontol. J. 2018. V. 52. № 12. P. 1473–1479.
Miao Y.F., Warny S., Liu C. et al. Neogene fungal record from IODP Site U1433, South China Sea: Implications for paleoenvironmental change and the onset of the Mekong River // Mar. Geol. 2017. V. 394. P. 69–81.
Millay M.A., Taylor T.N. Chytrid-like fossils of Pennsylvanian age // Science. 1978. V. 200. № 4346. P. 1147–1149.
O’Brien B.L., Parrent J.L., Jackson J.A. et al. Fungal community analysis by large-scale sequencing of enviromental samples // Applied Environ. Microbiol. 2005. V. 71. № 9. P. 5544–5550.
Oliver R.P., Ipcho S.V.S. Arobidopsis pathology breathes new life into the necrotrophs-vs-biotrophs classification of fungal pathogens // Mol. Plant Pathol. 2004. V. 5. № 4. P. 347–352.
Parsons M.G., Norris G. Paleogene fungi from the Caribou Hills, Mackenzie Delta, northern Canada // Palaeontogr. Abt. B. 1999. V. 250. P. 77–167.
Paruya D.K., Ghosh R., Bismas O. et al. Dispersed fungal remains from the Neogene Siwalik forest of subHimalayan Arunachal Pradesh, India and their palaeoenvironmental indicative values // J. Mycopathol. Res. 2017. V. 55. № 3. P. 303–307.
Piepenbring M., Hofmann T.A., Kirschner R. et al. Diversity patterns of Neotropical plant parasitic microfungi // Ecotropica. 2011. V. 17. № 1. P. 27–40.
Pirozynski K.A., Malloch D. The origin of land plants: a matter of mycotrophism // Bio Syst. 1975. V. 6. № 3. P. 153–164.
Pirozynski K.A., Weresub L.K. The classification and nomenclature of fossil fungi // The Whole Fungus, the Sexual-Asexual Synthesis. Proc. of the 2nd Intern. Mycological Conf., Univ. of Calgary, Kananaskis, Alberta, Canada, V. 2. Ottawa: Nat. Museum of Natur. Sci., National Museums of Canada, Kananaskis Foundation, 1979. P. 653–688.
Phadtare N.R. Palaeoecologic significance of some fungi from the Miocene of Tanakpur (U. P.) India // Rev. Palaeobot. Palynol. 1989. V. 59. № 1–4. P. 127–131.
Phipps C.J., Rember W.C. Epiphyllous fungi from the Miocene of Clarkia, Idaho: Reproductive structures // Rev. Palaeobot. Palynol. 2004. V. 129. № 1. P. 67–79.
Prasad M.N.V. Fungal remains from the Holocene peat deposits of Tripura state, Northeastern India // Pollen Spores. 1986. V. 28. № 3–4. P. 365–390.
Ramanujam C.G.K., Rao K.P. On some microthyriaceous fungi from a Tertiary lignite of south India // Palaeobotanist. 1973. V. 20. № 2. P. 203–209.
Ramanujam C.G.K., Srisailam K. Fossil fungal spores from the Neogene beds around Cannanore in Kerala state // Botanique (Nagpur). 1978. V. 9. P. 119–138.
Rao M.R., Nair K.K. Palynological investigation of Miocene sediments exposed in Kannanellur–Kundara area, Quilon District, Kerala // Geophytology. 1998. V. 27. № 1–2. P. 49–59.
Redecker D., Kodner R., Graham L.E. Glomalean fungi from the Ordovician // Science. 2000. V. 289. № 5486. P. 1920–1921.
Remy W., Taylor T.N., Hass H., Kerp H. Four hundred-million-year-old vesicular arbuscular mycorrhizae // Proc. Nat. Acad. Sci. USA. 1994. V. 91 № 25. P. 11841–11843.
Reynolds D.R., Gilbert G.S. Epifoliar fungi from Queensland, Australia // Aust. Syst. Bot. 2005. V. 18. № 3. P. 265–289.
Richards T.A., Soanes D.M., Foster P.G. et al. Phylogenomic analysis demonstrates a pattern of rare and ancient horizontal gene transfer between plants and fungi // Plant Cell. 2009. V. 21. № 7. P. 1897–1911.
Rohfritsch O. Plants, gall midges, and fungi: A three-component system // Entomol. Exp. App. 2008. V. 128. № 1. P. 208–216.
Rosendahl C.O. Some fossil fungi from Minnesota // Bull. Torrey Bot. Club. 1943. V. 70. № 2. P. 126–138.
Rosewich U.L., Kistler H.C. Role of horizontal gene transfer in the evolution of fungi // Ann. Rev. Phytopathol. 2000. V. 38. P. 325–363.
Sahay V.K., Samant B., Mude S.N. Palaeoclimatic significance of fungal remains from marine green shales of the Naredi cliff section (Early Eocene), Kutch, Gujarat, India // Int. Basic Appl. Res. J. 2016. V. 2. № 5. P. 10–15.
Samarakoon M.C., Hyde K.D., Hongsanan S. et al. Divergence time calibrations for ancient lineages of Ascomycota classification based on a modern review of estimations // Fungal Divers. 2019. V. 96. P. 285–346.
Saxena R.K., Misra N.K. Palynological investigation of the Ratnagiri Beds of Sindhu Durg District, Maharashtra // Palaeobotanist. 1990. V. 38. P. 263–276.
Saxena R.K., Tripathi S.K.M. Indian fossil fungi // Palaeobotanist. 2011. V. 60. № 1. P. 1–208.
Schmiedeknecht M. Environmental tolerance range of Meliolales as mirrored in their horizontal and vertical distribution patterns // Microbiol. Res. 1995. V. 150. № 3. P. 271–280.
Selkirk D.R. Tertiary fossil fungi from Kiandra, New South Wales // Proc. Linn. Soc. N.S.W. 1975. V. 100. № 1. P. 70–94.
Shenoy B.D., Jeewon R., Hyde K.D. Impact of DNA sequence-data on the taxonomy of anamorphic fungi // Fungal Divers. 2007. V. 26. P. 1–54.
Sherwood-Pike M., Gray J. Fossil leaf-inhabiting fungi from northern Idaho and their ecological significance // Mycologia. 1988. V. 80. № 1. P. 14–22.
Shi G.L., Zhou Z.Y., Xie Z.M. A new Cephalotaxus and associated epiphyllous fungi from the Oligocene of Guangxi, South China // Rev. Palaeobot. Palynol. 2010. V. 161. № 3–4. P. 179–195.
Singh Y.R., Singh K.A., Sarkar S. Palaeoecological significance of a palynofloral assemblage from Surma Group (Late Miocene) of Tamenglong area, Manipur, northeast India // J. Earth Syst. Sci. 2019. V. 128. № 2. https://doi.org/10.1007/s12040-018-1059-4
Singh S.K., Chauhan M.S. Fungal remains from the Neogene sediments of Mahuadanr valley, Latehar district, Jharkhand, India and their palaeoclimatic significance // J. Palaeontol. Soc. India. 2008. V. 53. № 1. P. 73–81.
Smith P.H., Crane P.R. Fungal spores of the genus Pesavis from the Lower Tertiary of Britain // Bot. J. Linn. Soc. 1979. V. 79. № 3. P. 243–248.
Sohn J., Kim N., Choi S. Morphological and functional diversity of foliar damage on Quercus mongolica Fisch. ex Ledeb. (Fagaceae) by herbivorous insects and pathogenic fungi // J. Asia Pac. Biodivers. 2017. V. 10. № 4. P. 489–508.
Srivastava S.C., Srivastava A.K., Bhattacharyya A.P., Tewari R. Degraded Permian palynomorphs from North-East Himalaya, India // Permophiles. 1999. V. 33. P. 32–36.
Sternberg K.M. Versuch einer geognostischen botanischen Darstellung der Flora der Vorwelt. V. 1(1). Leipzig: F. Fleischer, 1820. 24 s.
Strullu-Derrien C., Spencer A.R.T., Goral T. et al. New insights into the evolutionary history of Fungi from a 407 MA Blastocladiomycota fossil showing a complex hyphal thallus // Phil. Trans. R. Soc. B. 2017. V. 373.https://doi.org/10.1098/rstb.2016.0502
Stubblefield S.P., Taylor T.N. Recent advances in palaeomycology // New Phytologist. 1988. V. 108. P. 3–25.
Taylor D.L., Herriott I.C., Stone K.E. et al. Structure and resilience of fungal communities in Alaskan boreal forest soils // Can. J. Forest Res. 2010. V. 40. № 7. P. 1288–1301.
Taylor T.N., Hass H., Kerp H. et al. Perithecial ascomycetes from the 400 million year old Rhynie chert: an example of ancestral polymorphism // Mycologia. 2005. V. 97. № 1. P. 269–285.
Taylor T.N., Hass H., Remy W., Kerp H. The oldest fossil lichen // Nature. 1995. V. 378. № 6554. P. 244.
Taylor T.N., Klavins S.D., Krings M. et al. Fungi from the Rhynie Chert: a view from the dark side // Trans. Roy. Soc. Edinb. Earth Sci. 2004. V. 94. P. 457–473.
Taylor T.N., Krings M., Taylor E.L. Fossil Fungi. L.: Acad. Press, 2015a. 382 p.
Taylor T.N., Krings M., Taylor E.L. Fungal diversity in the fossil record // Systematics and Evolution. The Mycota. Berlin, Heidelberg: Springer, 2015b. P. 259–278 (A comprehensive treatise on fungi as experimental systems for basic and applied research. V. 7B).
Taylor T.N., Remy W., Hass H. Fungi from the Lower Devonian Rhynie chert: Chytridiomycetes // Amer. J. Bot. 1992. V. 79. № 11. P. 1233–1241.
Thaung M.M. Biodiversity of phylloplane ascomycetes in Burma // Australas. Mycol. 2006. V. 25. № 1. P. 5–23.
Tischer M., Gorczak M., Bojarski B. et al. New fossils of ascomycetous anamorphic fungi from Baltic amber // Fungal Biol. 2019. V. 123. № 11. P. 804–810.
Tripathi S.K.M. Fungi from palaeoenvironments: their role in environmental interpretation // Fungi from Different Environments. Enfield: Sci. Publishers, 2009. P. 1–27.
Tyler S.A., Barghoorn E.S. Occurrence of structurally preserved plants in pre-Cambrian rocks of the Canadian Shield // Science. 1954. V. 119. № 3096. P. 606–608.
van Geel B., Aptroot A. Fossil ascomycetes in Quaternary deposits // Nova Hedwigia. 2006. V. 82. № 3–4. P. 313–329.
van der Hammen T. A palynological systematic nomenclature // Boletín Geol. 1956. V. 4. № 2–3. P. 63–101.
Velayati S. The first report of fungal fruit body from north of Iran “Gorgan’s Schists” // J. Amer. Sci. 2013. V. 9. P. 36–43.
Vijaya, Meena K.L. Corpuscules in the Permian pollen from India // J. Palaeontol. Soc. India. 1996. V. 41. P. 57–61.
Vishnu A., Khan M.A., Bera M. et al. Fossil Asterinaceae in the phyllosphere of the eastern Himalayan Neogene Siwalik forest and their palaeoecological significance // Bot. J. Linn. Soc. 2017. V. 185. № 2. P. 147–167.
Visscher H., Sephton M.A., Looy C.V. Fungal virulence at the time of the end-Permian biosphere crisis? // Geology. 2011. V. 39. № 9. P. 883–886.
Wang Z., Sun B., Sun F. et al. Identification of two new species of Meliolinites associated with Lauraceae leaves from the middle Miocene of Fujian, China // Mycologia. 2017. V. 109. № 4. P. 676–689.
Wells A.K., Hill R.S. Epiphyllous microorganisms as palaeoclimate estimators: the developmental sequence of fungal ‘germlings’ on their living host // Austral. Syst. Bot. 1993. V. 6. № 5. P. 377–386.
Worobiec G., Worobiec E. Epiphyllous fungi from the Oligocene shallow-marine deposits of the Krabbedalen Formation, Kap Brewster, central East Greenland // Acta Palaeobot. 2013. V. 53. № 2. P. 165–179.
Worobiec G., Worobiec E. Epiphyllous fungi from Miocene deposits of the Bełchatów Lignite Mine (Central Poland) // Mycosphere. 2017. V. 8. № 8. P. 1003–1013.
Wu X.-K., Zavialova N.E., Kodrul T.M. et al. Northern Hemisphere megafossil of Dacrycarpus (Podocarpaceae) from Miocene of South China and its evolutionary and palaeoecological implication // J. Syst. Evol. 2020. https://doi.org/10.1111/jse.12534
Xu S.L., Kodrul T.M., Wu Y. et al. Early Oligocene fruits and leaves of Burretiodendron (Malvaceae s.l.) from South China // J. Syst. Evol. 2020. https://doi.org/10.1111/jse.12577
Дополнительные материалы отсутствуют.
Инструменты
Палеонтологический журнал


