Журнал общей биологии, 2023, T. 84, № 4, стр. 243-262
Размерно-морфологическая структура и экологические стратегии прокариотопланктона крупного горного озера Севан (Армения)
Е. В. Кузнецова 1, *, Д. Б. Косолапов 1, Н. Г. Косолапова 1, М. Ю. Скопина 1
1 Институт биологии внутренних вод им. И.Д. Папанина РАН
152742 Борок, Некоузский р-н, Ярославская обл., Россия
* E-mail: kuzel@ibiw.ru
Поступила в редакцию 17.11.2022
После доработки 20.02.2023
Принята к публикации 04.08.2023
- EDN: ANBXFD
- DOI: 10.31857/S0044459623040048
Аннотация
Изучена динамика размерно-морфологических групп гетеротрофного прокариотопланктона самого крупного пресного водоема Кавказа – оз. Севан (Армения), – позволяющая объяснить его пространственно-временную организацию и сукцессию. Для этого озера характерно чередование стабильных и нестабильных периодов существования гидробионтов из-за резких изменений экологических условий, вызванных главным образом деятельностью человека. В сообществе планктонных прокариот озера выделяли следующие размерно-морфологические группы: мелкие кокки и коккобациллы, мелкие палочки и вибрионы, среднеразмерные кокки и коккобациллы, крупные палочки и вибрионы, нити, а также клетки, ассоциированные с детритными частицами. Основной вклад (в среднем 55.5%) в формирование биомассы прокариотопланктона озера вносили мелкие палочки и вибрионы. Биомасса каждой из групп колебалась во времени и пространстве в относительно узких пределах, и развитие групп происходило в тесной взаимосвязи друг с другом. По-видимому, разные размерно-морфологические группы прокариот адаптированы к существованию в пределах сходных эколого-филогенетических ниш и совместно и последовательно выполняют общие функции в минерализации органических веществ и трофических взаимодействиях в озере. Вместе с тем эти группы реализуют различные экологические стратегии, которые могут быть успешными в разные периоды существования экосистемы.
Пресноводный прокариотопланктон (бактерии и археи) отличается разнообразием фенотипов, генотипов и физиологических свойств. Таксоны разного ранга, в частности представители широко распространенного в водоемах филума Actinobacteria, могут поддерживать определенные морфологические характеристики в течение всего онто- и филогенеза (Young, 2006; Schuech et al., 2019; Bergeijk et al., 2020). Изменения морфологии клеток – это “способ выживания бактерий в среде”, “инструмент для получения конкурентного преимущества”, т.е. адаптация, которая генетически предопределена и должна подвергаться естественному отбору (Павлова и др., 2021). Выделяют три “первичных” фактора существования прокариот: получение клетками питательных веществ, деление клеток и выедание прокариот консументами (Young, 2006). Характерной особенностью прокариот является высокое отношение площади поверхности их клеток к объему, что позволяет им поддерживать скорость биохимических процессов на оптимальном уровне. Заданные генетически размеры прокариот реализуются в ходе конкуренции за субстраты и соединения биогенных элементов (контроль “снизу”). Победителями в конкурентной борьбе становятся мелкие и вытянутые клетки прокариот, имеющие наиболее высокое отношение площади поверхности к объему. Кроме контроля “снизу” количество, активность и структура сообщества водных прокариот контролируются также “сверху” консументами и вирусами (Jurgens, Matz, 2002; Weinbauer et al., 2007). Важными регулирующими факторами являются также температура и концентрация растворенного кислорода (Garcia et al., 2013).
Разные факторы окружающей среды действуют одновременно и вызывают сложные и случайные комбинации ответов (Corno et al., 2008). Поэтому изменения таксономической и размерно-морфологической структуры сообщества прокариот трудно предсказать. Несколько действующих одновременно факторов могут вызывать различные изменения размеров и форм клеток (Young, 2006). Однако даже в олиготрофных водах, где прокариоты регулируются в основном ресурсами, активность консументов и вирусов является основой для формирования и существования сообществ (Corno et al., 2008).
Группы планктонных прокариот, имеющие сходные размеры и морфологию, вероятно, соответствуют определенным таксонам высокого ранга (Павлова и др., 2021) и способны успешно размножаться и конкурировать с другими группами в условиях дефицита ресурсов. Существуют две экологические стратегии прокариот, различающиеся по затратам энергии, необходимым для размножения: одни размножаются и растут быстро (r-стратеги), другие – медленно (K-стратеги) (Andrews, Harris, 1986). В нестабильной окружающей среде преобладает r-стратегия, так как в этом случае ключевую роль играет способность быстрого размножения, а адаптационные механизмы, позволяющие конкурировать с другими организмами, из-за быстро изменяющихся условий существования не столь важны. Характерными чертами r-стратегов являются высокая скорость роста, небольшие размеры, относительно короткое время жизни поколения и способность к быстрому и широкому распространению. K-стратеги преобладают в местообитаниях с относительно постоянными условиями окружающей среды (или по крайней мере предсказуемыми и повторяющимися для определенных периодов), где на первое место выходит способность успешно конкурировать за ресурсы с другими микроорганизмами. Популяция K-стратегов, как правило, постоянна и близка к максимально возможной в условиях данного водоема. Для них характерны большие размеры, сравнительно долгий промежуток жизни и низкие темпы размножения. Если r-стратеги обычно преобладают на ранних стадиях сукцессии, то K-стратеги – на ее поздних стадиях.
Вероятно, гены, ответственные за основные катаболические и анаболические процессы, были распределены среди микроорганизмов задолго до того, как клеточная дифференциация и вертикальный перенос генов стали осуществляться так, как это происходит в настоящее время (Falkowski et al., 2008). Поэтому микроорганизмы имеют общие гены главных метаболических процессов, что объясняет их функциональную избыточность в современных сообществах. Поступление субстратов вызывает изменения в структуре микробных сообществ, которые могут быть направленными, специфичными для данной экосистемы или случайными (Comte et al., 2006). Метаболическая пластичность и функциональная избыточность рассматриваются как фундаментальные свойства микробных сообществ, которые определяют их реакцию на изменение условий окружающей среды, а также взаимосвязь между структурой сообщества и его функциями. Между уровнем функциональной избыточности и метаболической пластичностью существует прямая зависимость, что предполагает влияние одних и тех же факторов и свидетельствует о том, что связь между структурой и функциями сообщества может изменяться от очень тесной до слабой или отсутствовать вовсе.
Согласно теории “консерватизма филогенетических ниш”, большое количество видов прокариот способны выполнять в водоемах одни и те же функции (Martiny et al., 2013; Salcher, 2014). Но вопрос о том, есть ли среди них наиболее приспособленные, которые в действительности осуществляют те или иные функции, пока остается без ответа. Если таксономическая структура прокариот в контексте концепции “функциональной избыточности” находится в центре внимания водных микробиологов, то исследования их размерно-морфологической структуры сейчас проводятся сравнительно редко (Fischer, Velimirov, 2000; La Ferla et al., 2005; Posch et al., 2009). Хотя эти исследования трудоемки, данные, полученные с их помощью, важны для понимания взаимоотношений бактерий с другими гидробионтами и их функций в водных экосистемах. Положительные эффекты в одном направлении, когда один вид выигрывает за счет другого, например, взаимоотношения хищника и жертвы, возможны, однако типичным результатом адаптации к другим видам микроорганизмов в условиях влияния сходных факторов среды будут конкурентные, а не кооперативные фенотипы (Foster, Bell, 2012).
Большинство горных озер – это экстремальные экосистемы, водная толща которых характеризуется низким содержанием органических веществ и биогенных элементов и невысокой температурой. Они подвержены резким сезонным изменениям температуры, освещенности и концентрации растворенного кислорода, большую часть года покрыты льдом, а в период открытой воды испытывают сильное воздействие ультрафиолетового излучения. Это сравнительно просто организованные экосистемы с низким видовым разнообразием и доминированием в трофических сетях микроорганизмов. Севан – самое большое озеро Кавказа и одно из крупнейших горных озер в мире. В отличие от многих других горных озер, имеющих меньшие размеры и расположенных в труднодоступных местах, экосистема Севана испытывает мощное антропогенное воздействие (Озеро Севан…, 2016). В середине прошлого века уровень воды в озере понизился на 20 м, что привело к резким изменениям условий существования и структурно-функциональной организации сообществ гидробионтов. В 1930-е гг. в озеро был интродуцирован сиг (Coregonus lavaretus), который стал основным промысловым видом рыб и вызвал значительную трансформацию трофических сетей. В XXI в. начался постепенный подъем уровня Севана, что привело к затоплению участков суши. Запасы находившегося на верхнем уровне трофической сети озера сига к 2011–2012 гг. из-за браконьерского перевылова резко сократились. В результате произошло увеличение количества и разнообразия зоопланктона, в составе которого массовое развитие получили ветвистоусые ракообразные. В этот период в озере появился и начал доминировать крупный вид Daphnia magna, но с увеличением плотности сига в последующие годы он быстро исчез (Крылов и др., 2021). Регулярные микробиологические исследования оз. Севан, проводившиеся с середины прошлого века, с распадом СССР в 1990-х гг. прекратились и были возобновлены в начале XXI в. (Косолапов, 2016).
Цель работы – изучить распределение и динамику гетеротрофного прокариотопланктона и его размерно-морфологических групп, реализующих разные экологические стратегии в сходных эколого-филогенетических нишах, и выявить особенности его структурно-функциональной организации, регуляции и сукцессии в крупном горном пресном озере (оз. Севан, Армения).
МАТЕРИАЛЫ И МЕТОДЫ
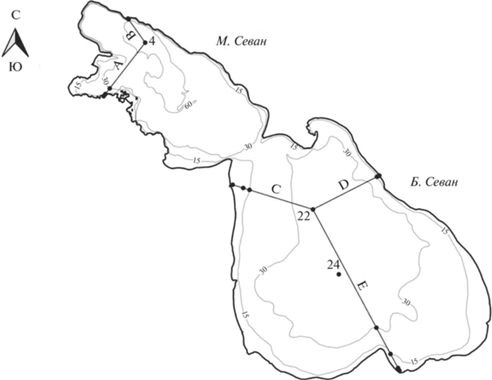
Исследования на оз. Севан (Армения) проводили в июле и октябре 2018–2019 гг. Озеро расположено между 40°19′ с.ш. и 45°21′ в.д. на высоте 1900 м над ур. м. Площадь его зеркала составляет ~1262 км2, водосборного бассейна ~1240 км2, объем – 34.8 км3, максимальная глубина – 81.4 м, средняя глубина – 26.8 м. В озеро впадает 28 рек и ручьев длиной от 10 км, а вытекает только одна река – р. Раздан. Озеро состоит из двух частей – Малого и Большого (М. и Б.) Севана.
Станции отбора проб располагались на пяти разрезах, направленных от берега в глубоководную часть озера: двух в М. Севане (А и В) и трех в Б. Севане (С, D и E) (рис. 1). На каждом разрезе отбирали четыре станции (№ 1, 2, 3 и 4), приуроченные к глубинам 2, 7, 15 и 30 м соответственно. Кроме того, пробы воды получали на трех станциях, расположенных в глубоководной части озера: ст. 4 (глубина ~64 м) в М. Севане и ст. 22 (~33 м) и 24 (~33 м) в Б. Севане. Получали интегральные пробы, смешивая воду с каждого метра водной толщи озера. На глубоководных станциях проводили изучение вертикального распределения прокариот.
Концентрацию растворенного кислорода, температуру и электропроводность воды измеряли с использованием портативного зонда YSI Model 55 (YSI Inc., США).
Сразу после отбора воду помещали в стерильные пластиковые флаконы объемом 60 мл, фиксировали 37%-ным формалином, предварительно профильтрованным через мембранный фильтр (0.2 мкм), до конечной концентрации 2% и хранили до анализа в темноте при температуре 4°C.
В течение месяца в лаборатории определяли общую численность и размеры гетеротрофного бактериопланктона и его размерно-морфологических групп методом эпифлуоресцентной микроскопии с использованием флуорохрома ДАФИ и окрашенных судановым черным ядерных фильтров с диаметром пор 0.17 мкм (Porter, Feig, 1980). Препараты просматривали при увеличении в 1000 раз и освещении ультрафиолетовыми лучами под эпифлуоресцентным микроскопом Olympus BX51 (Olympus Optical Co., Япония), соединенным с цифровой камерой ColorView III. Изображение преобразовывалось в цифровую форму с помощью программного обеспечения CellF и использовалось для последующего подсчета и измерения бактериальных клеток различной морфологии. На каждом фильтре подсчитывали не менее 400 бактериальных клеток в 10–20 случайно выбранных полях зрения и измеряли не менее 100 клеток. Объемы клеток вычисляли по формуле объема цилиндра с закругленными концами или шара (W = L): V = (π/4) × W2 × (L – (W/3)), где V – объем клетки (мкм3), W и L – ее диаметр и длина (мкм) (Krambeck et al., 1981). Сырую биомассу микроорганизмов получали путем умножения их численности на средний объем клеток. Содержание углерода в клетках прокариот (С, фг С/кл) рассчитывали с использованием следующего аллометрического уравнения: С = 120 × V0.72 (Norland, 1993).
Также определяли численность и биомассу следующих размерно-морфологических групп гетеротрофного прокариотопланктона: мелких одиночных кокков и коккобацилл (диаметром <0.35 мкм), мелких палочек (длиной <2 мкм), среднеразмерных кокков и коккобацилл (диаметром 0.35–0.5 мкм), крупных кокков (диаметром >0.5 мкм), крупных палочек и вибрионов (длиной ≥2 мкм); нитевидных и прикрепленных к детриту.
Численность и размеры гетеротрофных нанофлагеллят определяли методом эпифлуоресцентной микроскопии с использованием флуорохрома примулин (Caron, 1983). На каждом фильтре подсчитывали и измеряли не менее 50 организмов. Выделяли два размерных класса гетеротрофных флагеллят: мелкие (<5 мкм) и крупные (≥5 мкм). Их объемы рассчитывали с использованием формул объемов шара, цилиндра или эллипсоида. Для перевода биомассы флагеллят в единицы углерода применяли коэффициент, равный 183 фг C/мкм3 (Caron et al., 1995).
Вариабельность параметров оценивали с помощью коэффициента вариации (CV, %). Связь между показателями бактериопланктона, его размерно-морфологических групп и абиотическими и биотическими характеристиками окружающей среды оценивали с помощью непараметрического рангового коэффициента корреляции Спирмена. Оценку вклада физико-химических параметров в формирование размерно-морфологической структуры прокариотопланктона проводили с помощью канонического анализа соответствий с использованием R-статистики.
РЕЗУЛЬТАТЫ
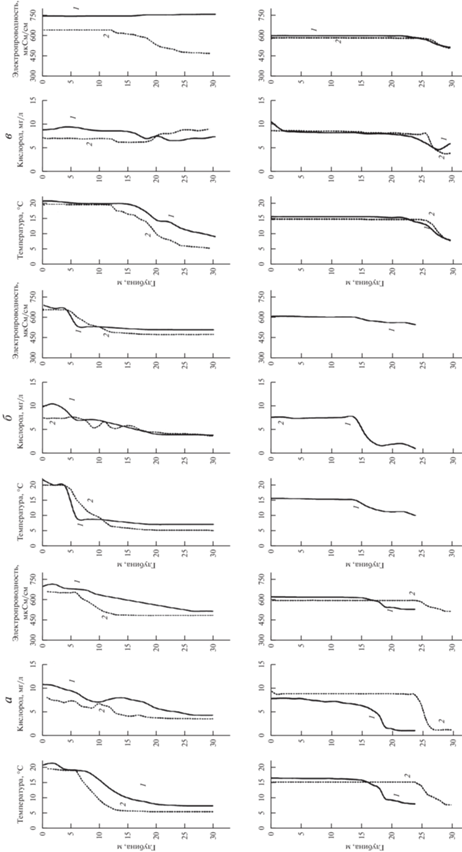
Гидрологические характеристики обычно существенно различались в поверхностном и придонном горизонтах водной толщи оз. Севан, особенно летом (рис. 2). С увеличением глубины прослеживалось снижение температуры, концентрации растворенного кислорода и электропроводности. В июле 2019 г. и в Малом, и в Большом Севане эти параметры статистически значимо коррелировали друг с другом (p < 0.05).
Рис. 2.
Вертикальное распределение температуры, концентрации растворенного кислорода и электропроводности в верхнем 30-м слое водной толщи на ст. 22 (а) и ст. 24 (б) в Б. Севане и ст. 4 (в) в М. Севане в июле (вверху) и октябре (внизу) 2018 (1) и 2019 (2) гг.
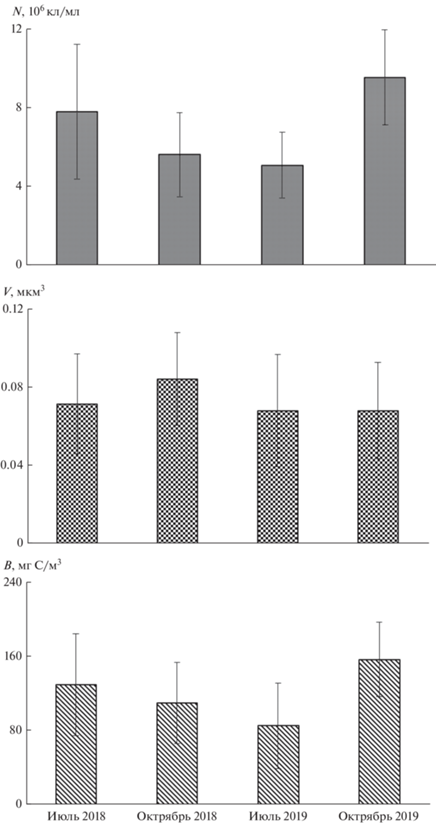
Количество и биомасса планктонных прокариот в оз. Севан в июле и октябре 2018 и 2019 гг. колебались в пределах (2.4–16.6) × 106 кл/мл и 33.3–325.1 мг С/м3 соответственно. Коэффициенты вариации (CV) этих параметров оказались равными 43.5 и 44.6% соответственно. В 2019 г. средние значения общей численности и биомассы в октябре были выше, чем в июле, в 2018 г. наблюдалась обратная картина (рис. 3). Кроме межгодовых различий это, вероятно, связано и с тем, что летом 2019 г. исследования проводили на неделю позже, чем в 2018 г.
Рис. 3.
Общая численность (N), средний объем клеток (V) и биомасса (B) прокариотопланктона в оз. Севан в июле и октябре 2018 и 2019 гг.
Численность и биомасса мелких кокков в 2018 г. варьировали в среднем в 1.5–2 раза сильнее, чем в 2019 г. (табл. 1 и 2). Крупные палочки и вибрионы достигали наибольших значений численности и биомассы в июле 2019 г., когда их вклад в формирование общей биомассы прокариотопланктона оказался в 2 раза выше по сравнению с другими периодами наблюдений. CV общей биомассы летом 2019 г. также существенно увеличился. В этот период на фоне обильного количественного развития крупных палочек и вибрионов наблюдалась наименьшая представленность других групп: среднеразмерных кокков и коккобацилл, крупных кокков, мелких палочек и вибрионов. Поскольку мелкие палочки и вибрионы доминировали среди размерно-морфологических групп во все периоды наблюдений озера, то в июле 2019 г. общая численность и биомасса прокариот были ниже, чем в остальные периоды. В октябре 2019 г. увеличение численности и биомассы прокариот в значительной степени происходило также за счет мелких палочек и вибрионов. Самая низкая представленность в сообществе и одновременно самая высокая вариабельность была характерна для агрегированных прокариот. Нитевидные формы вносили незначительный вклад в формирование общей биомассы прокариот, что отмечалось и в предыдущие годы (Косолапов, 2016).
Таблица 1.
Общая численность прокариотопланктона (N∑, 103 кл/мл), численность его размерно-морфологических групп (N, 103 кл/мл), вклад этих групп в формирование общей численности прокариотопланктона (N/N∑, %) и коэффициенты вариации параметров (CV, %) в оз. Севан в июле и октябре 2018 и 2019 гг.
| Группа | 2018 | 2019 | В среднем | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| июль | октябрь | июль | октябрь | |||||||||||
| N | N/N∑ | СV | N | N/N∑ | СV | N | N/N∑ | СV | N | N/N∑ | СV | N | N/N∑ | |
| Весь прокариотопланктон | 7841 | 100 | 43.7 | 5657 | 100 | 37.9 | 5117 | 100 | 32.8 | 9584 | 100 | 25.1 | 7050 | 100 |
| Мелкие кокки и коккобациллы | 3769 | 48.1 | 61.3 | 2180 | 38.5 | 62.4 | 2224 | 43.5 | 38.5 | 3421 | 35.7 | 33.0 | 2899 | 41.8 |
| Мелкие палочки и вибрионы | 2174 | 27.7 | 63.8 | 1702 | 30.1 | 28.1 | 1508 | 29.5 | 42.3 | 3401 | 35.5 | 31.0 | 2196 | 30.6 |
| Среднеразмерные кокки и коккобациллы | 1456 | 18.6 | 55.8 | 1351 | 23.9 | 39.9 | 982 | 19.2 | 36.5 | 2094 | 21.8 | 35.3 | 1471 | 20.8 |
| Крупные кокки | 262 | 3.3 | 81.5 | 272 | 4.8 | 100.5 | 181 | 3.5 | 65.3 | 437 | 4.6 | 51.6 | 288 | 4.0 |
| Крупные палочки и вибрионы | 111 | 1.4 | 49.0 | 89 | 1.6 | 43.2 | 176 | 3.4 | 110.4 | 112 | 1.1 | 45.7 | 122 | 1.8 |
| Нити | 23 | 0.3 | 92.9 | 19 | 0.3 | 70.5 | 13 | 0.3 | 75.4 | 25 | 0.3 | 79.8 | 20 | 0.3 |
| Прикрепленные к детриту | 46 | 0.6 | 98.5 | 44 | 0.8 | 86.1 | 33 | 0.6 | 85.2 | 94 | 1.0 | 64.5 | 54 | 0.7 |
Таблица 2.
Общая биомасса прокариотопланктона (В∑, мг С/м3), биомасса его размерно-морфологических групп (B, мг С/м3), вклад этих групп в формирование общей биомассы прокариотопланктона (В/В∑, %) и коэффициенты вариации параметров (CV, %)
| Группа | 2018 | 2019 | В среднем | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| июль | октябрь | июль | октябрь | |||||||||||
| B | В/В∑ | СV | B | В/В∑ | СV | B | В/В∑ | СV | B | В/В∑ | СV | B | В/В∑ | |
| Весь прокариотопланктон | 128.7 | 100 | 42.4 | 109.6 | 100 | 39.8 | 85.5 | 100 | 53.8 | 156.8 | 100 | 25.5 | 120.2 | 100 |
| Мелкие кокки и коккобациллы | 19.7 | 15.3 | 60.6 | 11.9 | 10.8 | 59.6 | 11.3 | 13.2 | 37.9 | 18.0 | 11.5 | 31.9 | 15.2 | 12.7 |
| Мелкие палочки и вибрионы | 71.8 | 55.8 | 59.3 | 61.6 | 56.2 | 46.2 | 43.9 | 51.4 | 60.3 | 92.0 | 58.7 | 103.8 | 67.3 | 55.5 |
| Среднеразмерные кокки и коккобациллы | 18.2 | 14.1 | 70.3 | 16.3 | 14.9 | 42.3 | 11.1 | 13.0 | 36.3 | 21.1 | 13.4 | 36.7 | 16.7 | 13.8 |
| Крупные кокки | 8.7 | 6.8 | 86.8 | 10.6 | 9.7 | 104.0 | 4.6 | 5.4 | 64.5 | 13.7 | 8.7 | 57.3 | 9.5 | 7.7 |
| Крупные палочки и вибрионы | 8.0 | 6.2 | 53.3 | 6.5 | 5.9 | 48.5 | 12.5 | 14.6 | 115.3 | 8.4 | 5.3 | 41.8 | 8.9 | 8.0 |
| Нити | 1.3 | 1.0 | 92.6 | 1.5 | 1.4 | 65.5 | 1.4 | 1.6 | 76.3 | 1.8 | 1.2 | 86.1 | 1.5 | 1.3 |
| Прикрепленные к детриту | 1.0 | 0.8 | 102.2 | 1.2 | 1.1 | 108.2 | 0.7 | 0.8 | 121.5 | 1.8 | 1.2 | 75.0 | 1.1 | 1.0 |
Средние доли каждой группы в общей биомассе планктонных прокариот в разные сезоны различались незначительно (табл. 2). Наиболее стабильными были биомасса и доля в общей биомассе среднеразмерных кокков и коккобацилл. Осенью, когда по сравнению с летом происходило снижение доли мелких кокков и крупных палочек, доля среднеразмерных кокков и коккобацилл незначительно увеличивалась.
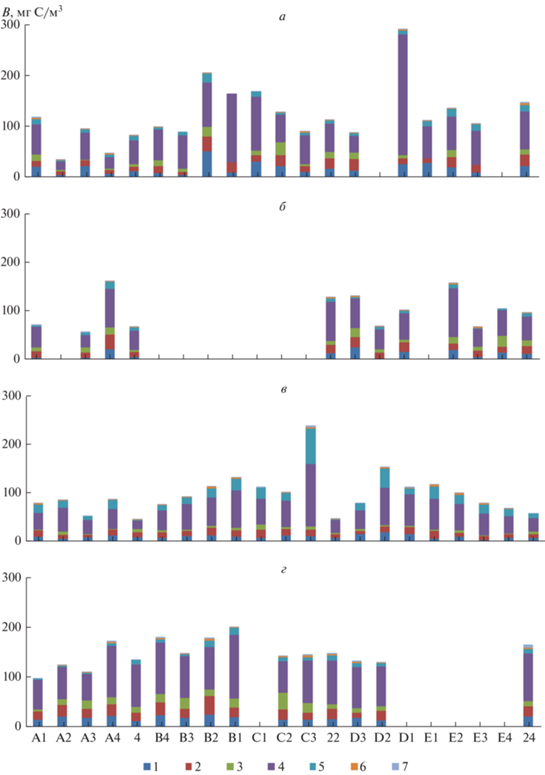
В биомассе прокариотопланктона литорали озера высоким было содержание крупных и мелких палочек и вибрионов. С увеличением глубины озера общая биомасса прокариот уменьшалась, и в ней увеличивалась доля мелких кокков. Летом 2018 г. наблюдалась обратная зависимость общей численности (r = –0.66, р = 0.0022) и биомассы (r = –0.56, р = 0.0126) прокариот с глубиной озера (рис. 4). Летом 2019 г. с глубиной негативно коррелировали биомассы крупных палочек (r = –0.59, р = 0.0053), мелких палочек и вибрионов (r = –0.67, р = 0.0009), среднеразмерных кокков и коккобацилл (r = –0.61, р = 0.0037) и нитевидных бактерий (r = –0.55, р = 0.0095). Осенью 2019 г. выявлена положительная взаимосвязь глубины с биомассой прокариот, ассоциированных с детритом (r = 0.58, р = 0.0235).
Рис. 4.
Горизонтальное распределение биомассы (B, мг С/м3) различных размерно-морфологических групп прокариотопланктона в июле (а) и октябре (б) 2018 г. и в июле (в) и октябре (г) 2019 г. А1–24 – станции отбора проб. Здесь и на рис. 5 и 6: 1 – мелкие кокки и коккобациллы, 2 – среднеразмерные кокки и коккобациллы, 3 – крупные кокки, 4 – мелкие палочки и вибрионы, 5 – крупные палочки и вибрионы, 6 – нити, 7 – ассоциированные с детритом.
В Севане не выявлено корреляционных связей между общей численностью и биомассой планктонных прокариот и таковыми гетеротрофных нанофлагеллят. В июле 2018 г. установлена обратная зависимость между общей численностью нанофлагеллят и биомассой прокариот, прикрепленных к детриту (r = –0.63, р = 0.0042), а также прямая – между общей биомассой нанофлагеллят и биомассой мелких кокков (r = 0.46, p = 0.0462). В июле 2019 г. биомасса крупных кокков коррелировала с биомассой крупных (≥5 мкм) нанофлагеллят (r = 0.50, р = 0.0259), а численность нитевидных бактерий обратно коррелировала с общей численностью нанофлагеллят (r = –0.49, p = 0.0256), а также численностями как крупных (r = –0.51, p = 0.0225), так и мелких (r = –0.61, p = 0.0043) нанофлагеллят.
Были установлены тесные взаимосвязи между разными размерно-морфологическими группами прокариот, причем все они оказались положительными, и в 2019 г. их было больше, чем в 2018 г. (табл. 3). В терминах биомассы летом мелкие кокки коррелировали с агрегированными прокариотами, а осенью – со среднеразмерными кокками и коккобациллами. Последние коррелировали с мелкими палочками и вибрионами осенью 2018 г. и летом 2019 г. Кроме того, среднеразмерные кокки и коккобациллы летом 2019 г. коррелировали с крупными палочками и вибрионами, нитевидными формами и прокариотами, прикрепленными к детриту, а осенью 2019 г. – с нитями. Мелкие палочки и вибрионы коррелировали с крупными палочками, нитевидными и агрегированными прокариотами, которые также развивались во взаимосвязи друг с другом.
Таблица 3.
Статистически достоверные коэффициенты корреляции Спирмена (r) при соответствующем уровне значимости (p) (в скобках) между биомассами разных размерно-морфологических групп прокариотопланктона: 1 – мелкие кокки и коккобациллы, 2 – среднеразмерные кокки и коккобациллы, 3 – крупные кокки, 4 – мелкие палочки и вибрионы, 5 – крупные палочки и вибрионы, 6 – нити, 7 – ассоциированные с детритом, в оз. Севан в июле и октябре 2018 и 2019 гг.
| 2018 | 2019 | 2018 | 2019 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| июль | октябрь | ||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | ||
| 1 | 0.58 (0.0063) |
1 | 0.64 (0.0097) |
||||||||||||
| 2 | 0.60 (0.0043) |
0.54 (0.0122) |
0.44 (0.0451) |
0.67 (0.0008) |
2 | 0.78 (0.0030) |
0.78 (0.0120) |
||||||||
| 3 | 3 | ||||||||||||||
| 4 | 0.76 (0.0001) |
0.64 (0.0016) |
0.77 (0.0001) |
4 | 0.81 (0.0014) |
0.73 (0.0065) |
0.69 (0.0044) |
0.53 (0.0424) |
|||||||
| 5 | 0.47 (0.0357) |
0.66 (0.0011) |
0.69 (0.0005) |
5 | 0.74 (0.0016) |
0.56 (0.0282) |
|||||||||
| 6 | 0.48 (0.0281) |
6 | 0.78 (0.0006) |
||||||||||||
| 7 | 0.78 (0.0001) |
0.52 (0.0185) |
7 | ||||||||||||
Однако закономерности в горизонтальном распределении прокариот и гетеротрофных нанофлагеллят проявлялись не на всех участках озера (рис. 4). Так, летом и осенью в литорали М. Севана общая численность и биомасса прокариот были минимальными, а вдоль разреза с увеличением глубины озера количественные показатели резко возрастали и вновь уменьшались. Подобным же образом изменялись численность и биомасса гетеротрофных флагеллят. Летом и осенью 2019 г. в глубоководных районах озера также регистрировались сравнительно высокие значения численности и биомассы прокариот при относительно низких численности и биомассе нанофлагеллят.
При изучении вертикального распределения прокариотопланктона в пелагиали озера оказалось, что среди всех групп распределение мелких кокков в наименьшей степени зависело от глубины (рис. 5 и 6). Летом они составляли значительную долю биомассы сообщества на всех горизонтах водной толщи, но больше их было до глубины 20 м и в придонном горизонте. Численность среднеразмерных кокков и коккобацилл увеличивалась на глубинах 7 (5–10) м, 20 м и у дна. В глубоководной части М. Севана (ст. 4, 64 м) их наибольшее количество регистрировалось в слое 30–40 м. Осенью при снижении температуры воды и нарушении стратификации распределение всех размерно-морфологических групп носило хаотичный характер. Однако в тех слоях водной толщи, где летом численность прокариот была низкой (40 м на ст. 4 и 20 м на ст. 22), осенью она достигала высоких значений.
Рис. 5.
Распределение по глубине вклада различных размерно-морфологических групп в формирование общей биомассы прокариот (В, мг С/м3) в пелагиали оз. Севан в 2018 г. на ст. 4 (а – в июле, г – в октябре), ст. 22 (б – в июле, д – в октябре) и ст. 24 (в – в июле, е – в октябре).
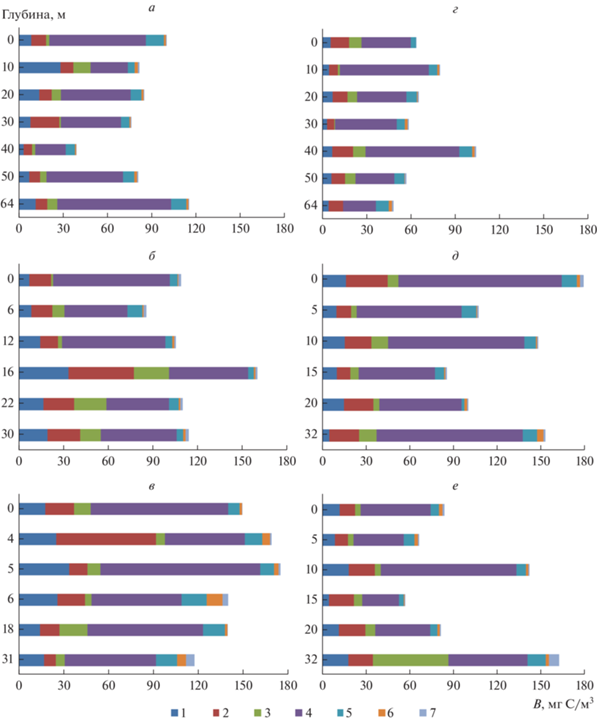
Рис. 6.
Распределение по глубине вклада различных размерно-морфологических групп в формирование общей биомассы прокариот (В, мг С/м3) в пелагиали оз. Севан в 2019 г. на ст. 4 (а – в июле, г – в октябре), ст. 22 (б – в июле, д – в октябре) и ст. 24 (в – в июле, е – в октябре).
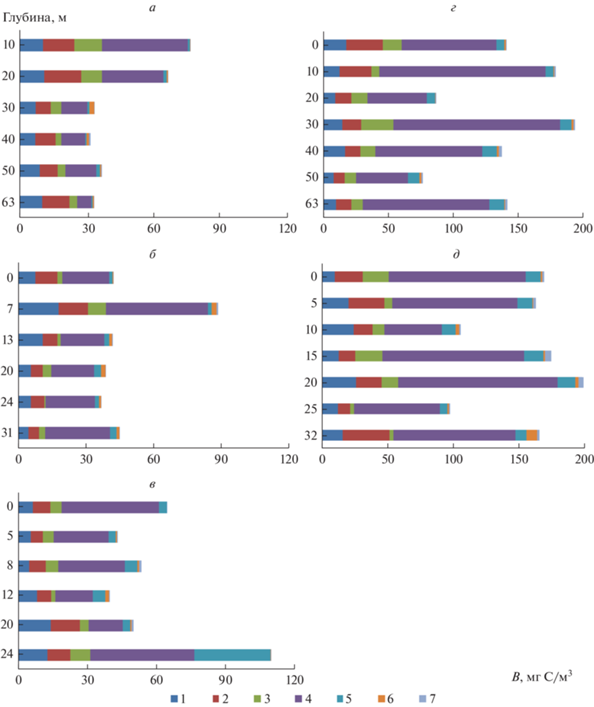
Биомасса прокариот в глубоководной части озера в 2018 г. была выше, чем в 2019 г. На ст. 22 (~33 м) в Б. Севане летом слой температурного скачка в 2018 и 2019 гг. располагался на глубине 7–8 м, однако характер вертикального распределения биомассы прокариот в эти годы различался. В 2018 г. максимальная биомасса (176 мг С/м3) регистрировалась в слое под термоклином, а минимальная (89.1 мг С/м3) – в термоклине. В 2019 г. пики биомассы были приурочены к слоям над термоклином (96.8 мг С/м3) и у дна (48.8 мг С/м3). Если в зоне термоклина основной вклад (51%) в формирование общей биомассы прокариотопланктона вносили палочки и вибрионы, то ниже термоклина – кокки разного диаметра (63%).
В зоне низкотемпературного купола в Б. Севане (ст. 24, ~33 м), где наблюдается подъем холодных вод гиполимниона к поверхности, вызванный в основном циклонической циркуляцией, слой температурного скачка в июле 2018–2019 гг. находился на глубине около 5 м. В 2018 г. в этой зоне регистрировался максимум биомассы прокариот (209 мг С/м3), причем основной вклад в формирование биомассы вносили палочковидные бактерии (66%), тогда как в подповерхностном слое – среднеразмерные кокки и коккобациллы (40%). В 2019 г. пики биомассы, в основном за счет палочек и вибрионов, наблюдались в поверхностном и придонном горизонтах: 68.2 и 117 мг С/м3 соответственно.
Осеннее распределение прокариотопланктона на ст. 24 в Б. Севане было изучено в 2018 г. В этот период его биомасса достигала наибольших значений у дна (161 мг С/м3) и на глубине 10 м (132 мг С/м3) и была минимальной (58.9 мг С/м3) на глубине 15 м. На ст. 22 в пелагиали Б. Севана в октябре 2018 г. высокие значения биомассы прокариотопланктона регистрировались в поверхностном горизонте водной толщи, на глубине 10 м и у дна: 200, 169 и 165 мг С/м3 соответственно. В 2019 г. осенний максимум биомассы в этой части озера (216 мг С/м3) отмечался на глубине 20 м.
На ст. 4 в М. Севане в июле зона температурного скачка начиналась с глубины 15 м. В этот период в 2018 и 2019 гг. максимальные значения биомассы прокариот отмечались в поверхностном (113 и 82.5 мг С/м3 соответственно) и придонном (131 и 40.1 мг С/м3 соответственно) слоях. Минимальная биомасса регистрировалась на глубине 30–40 м: 40.4 и 33.3 мг С/м3 соответственно. В июле 2018 г. термоклин был выражен менее четко, и распределение размерно-морфологических групп прокариот было более равномерным, чем в 2019 г. Межгодовые различия в характере вертикального распределения прокариотопланктона и его размерно-морфологических групп частично были обусловлены тем, что исследования летом 2019 г. проводили на неделю позже, чем в 2018 г.
Осенью 2018 г. на ст. 4 в М. Севане максимум биомассы планктонных прокариот (116 мг С/м3) наблюдали на глубине около 40 м, тогда как летом в этом слое регистрировали минимум. Подповерхностный пик биомассы на глубине 10 м был слабо выражен – 87.9 мг С/м3. В сообществе доминировали мелкие палочковидные клетки, составлявшие в этих слоях соответственно 60.8 и 75.4% общей биомассы прокариот. В 2019 г. максимум биомассы (216 мг С/м3) наблюдался на глубине 30 м, где летом был минимум. Подповерхностный пик биомассы был более заметен (195 мг С/м3), чем в предыдущий год. Как и в 2018 г., оба пика биомассы были обусловлены в основном развитием мелких палочек и вибрионов (66.2 и 71.3% общей биомассы соответственно).
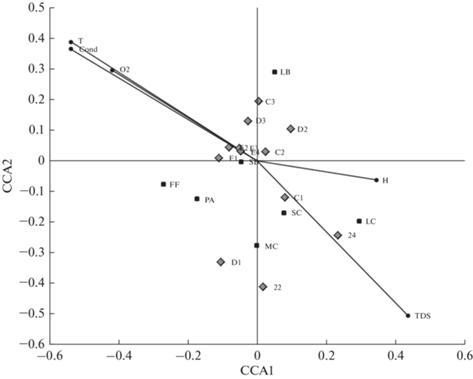
Канонический анализ соответствий выявил, что учтенные в анализе факторы среды (температура воды, концентрация растворенного кислорода, электропроводность) описывают около 35% вариабельности морфологической структуры бактериопланктона Б. Севана в июле 2019 г., когда были получены наиболее обширные данные (рис. 7). На неучтенные или случайные факторы приходится 65% изменчивости сообщества. Станции отбора проб в озере кластеризовались в одной области, за исключением самых глубоководных и самых мелководных. Размерно-морфологические группы бактериопланктона располагались на диаграмме на расстоянии. Тем не менее статистически значимых факторов при p < 0.05 зарегистрировано не было. Это позволяет предполагать, что размерно-морфологические группы прокариот регулируются одними и теми же факторами. Вероятно, обособление этих групп происходит не столько в пространстве, сколько во времени.
Рис. 7.
Экологическая ординация размерно-морфологической структуры гетеротрофного прокариотопланктона разных участков Б. Севана в пространстве факторов среды в июле 2019 г. Обозначения размерно-морфологических групп: SC – мелкие кокки, MC – среднеразмерные кокки и коккобациллы, LC – крупные кокки, SB – мелкие палочки и вибрионы, LB – крупные палочки и вибрионы, FF – нитевидные формы, PA – бактерии, прикрепленные к детритным частицам. Векторы указывают на факторы среды и их относительное влияние на размерно-морфологические группы прокариотопланктона: Т – температура воды, Н – глубина, Cond – электропроводность, TDS – минерализация, O2 – концентрация растворенного кислорода.
Одним из дестабилизирующих и важных событий в летние периоды 2018–2019 гг. являлось интенсивное цветение воды цианобактериями р. Dolichospermum/Anabaena по всей акватории озера, в результате которого выделялись токсины групп микроцистина и анатоксина, изменялись показатели прозрачности, растворенного кислорода и температуры (Сахарова и др., 2020; Hambaryan et al., 2020; Asatryan et al., 2022). Это оказывало значительное влияние на стратегии развития бактериопланктона и взаимоотношения между его размерно-морфологическими группами, а также на связи бактерий с абиотическими и биотическими характеристиками водной среды.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для планктонных прокариот характерны мелкие размеры – объем клеток многих из них не превышает 0.03 мкм3 (Batani et al., 2016). Такие объемы имеют, например, кокки диаметром ≤0.35 мкм. Ряд авторов относят к мелким прокариотам кокки и коккобациллы с линейными размерами до 0.5 мкм и объемами до 0.1 мкм3 (Lebaron et al., 2001). Мы в наших исследованиях в оз. Севан относили планктонных прокариот, имеющих линейные размеры 0.35–0.5 мкм, к среднеразмерной фракции на том основании, что у них по сравнению с более мелкими кокками существенно ниже отношение площади поверхности к объему, а следовательно, и скорость метаболических процессов. Из-за чего они при отсутствии каких-либо клеточных адаптаций проигрывают конкурентную борьбу за ресурсы мелким коккам. Еще менее приспособлены к конкурентной борьбе кокки диаметром 0.5–0.8 мкм и объемом 0.06–0.27 мкм3, которых некоторые авторы относят к среднеразмерным (Lebaron et al., 2001). Мы считали такие кокки крупными, а палочки с такими линейными размерами – мелкими. Мелкие палочки и вибрионы, длина которых не превышает 2 мкм, могут в зависимости от условий окружающей среды (концентрации субстратов) изменять свои размеры и увеличивать отношение площади поверхности к объему клеток, тем самым повышая конкурентоспособность.
В прокариотопланктоне оз. Севан в период наших наблюдений доминировали мелкие палочки и вибрионы, составлявшие в среднем 55.5% от общей биомассы сообщества. Этот морфотип доминирует также и в других горных озерах. Например, в бактериопланктоне одного из озер, расположенных в австрийских Альпах, преобладали мелкие палочки и кокки, линейные размеры которых не превышали 0.6 мкм, а средний объем составлял 0.024 мкм3 (Posch et al., 2009).
При исследовании многих водных экосистем было показано, что наиболее активным компонентом их прокариотопланктона являются крупные палочки и вибрионы (Gasol et al., 1995). Они быстро растут и делятся, но их развитие строго контролируется “сверху” гетеротрофными нанофлагеллятами и другими консументами. Последние оказывают значительное влияние на формирование размеров каждого филотипа прокариот, избирательно выедая крупные клетки и тем самым интенсифицируя развитие мелких форм (Rothhaupt, 1997; Salcher et al., 2007). Другими адаптациями прокариот, защищающими их от выедания фаготрофными протистами, служат вытягивание клеток в крупноразмерные нити, прикрепление к различным субстратам и образование агрегатов (Pernthaler et al., 1998; Pernthaler, 2005; Batani et al., 2016). Нитчатые и агрегированные прокариоты устойчивы к выеданию протистами, но могут потребляться многоклеточным зоопланктоном (Sanders et al., 1989; Langenheder, Jurgens, 2001; Pernthaler et al., 2004). Образование нитевидных морфотипов является фенотипической адаптацией бактерий, препятствующей их выеданию протистами, но, вероятно, существуют и другие причины, вызывающие удлинение клеток. Нитчатые гетеротрофные бактерии, объединяющие представителей Proteobacteria, Bacteroidetes и других филумов, обнаружены во многих пресных водоемах, включая горные озера (Hahn, Hofle, 1999; Schauer, Hahn, 2005; Salcher et al., 2007). Нитевидные формы составляют обычно не более 11% общего количества бактериопланктона, но их биомасса может превышать 40% его общей биомассы (Kirschner, Velimirov, 1997; Schauer, Hahn, 2005). Агрегированные клетки также могут составлять значительную часть общей биомассы морского и пресноводного прокариотопланктона, особенно в периоды массового отмирания фитопланктона (Simon et al., 2002). В периоды проведения наших исследований в оз. Севан нитевидные и агрегированные бактерии не достигали высокого уровня количественного развития и были минорными компонентами прокариотопланктона.
Планктонные прокариоты разной морфологии и размеров инфицируются вирусами с разной интенсивностью. В большинстве пресных и морских водоемов основную часть инфицированного прокариотопланктона составляют палочковидные клетки. Так, в песчаном карьере (Франция) в бактериопланктоне преобладали (90% его общей численности) палочковидные морфотипы. Они же составляли большую часть (89%) бактерий, инфицированных вирусами, причем 45% инфицированных клеток составляли удлиненные палочки (Pradeep Ram et al., 2010). В крупном и глубоком пресном оз. Бива (Япония) среди инфицированных вирусами морфотипов прокариот короткие палочки доминировали в периоды перемешивания водной толщи (54%) и в периоды стратификации в поверхностном слое (63%), тогда как в периоды стратификации в глубинных слоях доминировали удлиненные палочки (56%). В северной части Адриатического моря было инфицировано вирусами 30% бактериопланктона. Среди инфицированных бактериальных морфотипов также преобладали палочки (84.1%), а кокки и спириллы составляли соответственно 10.7 и 5.2% численности инфицированного бактериопланктона. Большая часть бактериофагов внутри палочковидных и спирилловидных клеток была меньше 60 нм, тогда как внутри кокков большая часть фагов имели размеры от 60 до 110 нм. В поверхностном микрослое воды морского залива (Вьетнам) вирусы инфицировали различные бактериальные морфотипы: удлиненные, толстые и короткие палочки, кокки и нити. Но среди них доминировали палочки, составлявшие 61% инфицированных клеток, тогда как на долю кокков приходилось 36%, а на долю нитей – только 4% (Pradeep Ram et al., 2018). Эти данные свидетельствуют о генетических и физиологических различиях бактериальных морфотипов. Кроме того, воздействие бактериофагов на бактерии в значительной степени зависит от метаболической активности последних. Поскольку взаимоотношения бактерий и фагов видоспецифичны (Borsheim, 1993), вполне возможно, что изменения доминирующих бактериальных видов во времени обусловлены развитием специфических фагов.
При изучении распределения размерно-морфологических групп гетеротрофных прокариот в водной толще оз. Севан были выявлены две основные особенности. Во-первых, биомасса каждой группы прокариот изменялась в относительно узких пределах. Во-вторых, развитие групп происходило в тесной взаимосвязи друг с другом. По-видимому, прокариоты разных размеров и морфологии занимали одни и те же эколого-филогенетические ниши в водной толще озера, находились в состоянии жесткой конкуренции за ресурсы и контролировались бактериотрофными организмами и вирусами.
При исследовании таксономического состава большого количества высокогорных соленых и пресных озер были выявлены семь доминирующих групп бактериопланктона: Betaproteobacteria, Bacteroidetes, Gammaproteobacteria, Actinobacteria, Alphaproteobacteria, Cyanobacteria и Firmicutes. Доминирующие группы бактерий используют различные адаптационные стратегии, чтобы выжить в экстремальных условиях. Представители этих таксонов доминируют в бактериопланктоне эпилимниона не только горных, но и равнинных озер (Newton et al., 2011).
Основные сдвиги в морфологической и филогенетической структуре бактериального сообщества небольшого олиготрофного высокогорного озера в Альпах (Австрия) были связаны с резкими сезонными изменениями гидрологических условий, такими как весеннее таяние льда, летняя стратификация и осеннее перемешивание водной толщи (Pernthaler et al., 1998). В сообществе доминировали представители трех таксономических групп Actinobacteria, Betaproteobacteria и Bacteroidetes, которые испытывали существенные и предсказуемые сезонные изменения. Максимум относительной численности Betaproteobacteria был связан с таянием снега и льда и весенним перемешиванием. За ним следовал пик Actinobacteria в середине лета, тогда как увеличение относительной численности Bacteroidetes приходилось на периоды весеннего и осеннего перемешивания водной толщи озера.
Исследования таксономической и размерно-морфологической структуры прокариотопланктона крупного оз. Бурже (Франция) показали, что в начале весны доминировали мелкие кокки и крупные палочки (Comte et al., 2006). Последние принадлежали в основном к кластеру Cytophaga–Flavobacterium (сейчас это филум Bacteroidetes). Весной и в начале лета основными потребителями бактерий были гетеротрофные и миксотрофные жгутиконосцы. В начале лета, когда количественно увеличивались представители классов α- и β-Proteobacteria, наблюдалось максимальное выедание палочковидных бактерий миксотрофными протистами Cryptomonas sp. и Dinobryon sp. Интенсивность выедания прокариот существенно варьировала, и их развитие, по-видимому, регулировалось главным образом “снизу” запасами субстратов.
Условия окружающей среды сами по себе не определяют фенотип прокариот, которые, занимая одну и ту же экологическую нишу, могут существенно различаться по морфологии и размерам (Young, 2006; Jia, Whalen, 2020). Из этого следует, что отношение площади поверхности к объему клетки – это очень важное, но не единственное свойство, необходимое для успешного существования прокариот (Beveridge, 1988). Важны также сродство бактериальных ферментов к субстратам, способных к поглощению широкого спектра веществ транспортными системами бактерий, возможность клеток накапливать запасные вещества и др. Одни формы прокариотических клеток (палочки и нити) дают им конкурентное преимущество в местообитаниях с высокими концентрациями субстратов и биогенных элементов. Другие формы (кокки) обуславливают их диффузное распространение в окружающей водной среде (Schulz, Jørgensen, 2001). Кроме того, от размеров и формы клеток зависит скорость их перемещения и осаждения в толще воды. Скорость движения самых маленьких прокариот не достаточно высока, чтобы постоянно находиться в оптимальном диапазоне концентрации субстратов, а крупные клетки, обладающие более высокой скоростью движения, быстро выедаются консументами или оседают на дно (Walsby, 2005).
Максимальные и минимальные размеры, а также экологические стратегии бактерий в природе, вероятно, предопределены генетически (Schulz, Jørgensen, 2001; Павлова и др., 2021). Бактерии с высокими скоростями метаболизма (r-стратеги) быстрее растут и достигают биологической цели жизни – оставления потомства (Young, 2006). И в этом отношении размеры и форма клеток являются очень важными параметрами. Размеры и форма клеток характеризуют таксоны высокого ранга, что говорит о большой адаптивной ценности этих параметров в эволюционных процессах и необходимости их определения в этом контексте (Павлова и др., 2021).
Ранее была выдвинута гипотеза о том, что первые прокариоты имели палочковидную форму, а кокки – это вырожденные формы (Siefert, Fox, 1998). Нам эта гипотеза не кажется убедительной. Палочковидным прокариотам свойственен быстрый метаболизм, но медленные темпы размножения, что характеризует их как K-стратегов. Самые мелкие кокки, так же как и палочки, имеют высокие скорости метаболизма, но в отличие от палочек размножаются быстро и относятся к r-стратегам (Andrews, Harris, 1986). Согласно упомянутой выше гипотезе, мелкие кокки произошли от палочек, стали быстрее размножаться, не достигая крупных объемов, и перестали быть приоритетными пищевыми объектами для протистов. Но при этом необходимо учитывать, что в водных экосистемах количество, активность и структура прокариот регулируются вирусами в не меньшей степени, чем протистами и метазоопланктоном (Fuhrman, Noble, 1995), а вирусы появились на Земле, вероятно, не позднее бактериотрофных организмов. Увеличение плотности популяций прокариот за счет ускоренных темпов размножения привело бы к их массовому заражению вирусами и отмиранию (Thingstad, 2000). Из этого следует, что конкурентных преимуществ, кроме возможности массового диффузного расселения за счет быстрого размножения, мелкие кокки не получили.
Среднеразмерные кокки и коккобациллы, несмотря на их близкую к сферической форму, также не являются деградирующими формами. Они характеризуются медленным метаболизмом и размножением и относятся к K-стратегам. Объем этих среднеразмерных клеток меньше, чем у палочек, но больше, чем у мелких кокков, а отношение площади поверхности к объему значительно меньше, чем у палочек и мелких кокков. Кто бы ни был их предком, такой путь эволюционного развития также не кажется очень успешным. Однако среднеразмерные кокки и коккобациллы менее привлекательны для консументов, по сравнению с палочками, и не образуют такие плотные популяции клеток, как мелкие кокки, избегая тем самым массового заражения и лизиса фагами. Но они, как и прокариоты других размерно-морфологических групп, регулируются “сверху”, поскольку в периоды уменьшения в сообществе палочек и мелких кокков, их численность и биомасса также снижаются (Pernthaler et al., 2001; Hahn, 2003). Однако главный механизм регуляции среднеразмерных кокков и коккобацилл, доля которых в прокариотопланктоне оз. Севан наиболее постоянна среди всех групп, – это контроль “снизу”, т.е. жесткая конкуренция за дефицитные ресурсы. Это подтверждается тем, что разные размерно-морфологические группы прокариотопланктона развиваются в тесной взаимосвязи друг с другом. Из-за того, что среднеразмерные прокариоты проигрывают конкуренцию за субстраты палочкам и вибрионам и мелким коккам, они растут медленнее и не делятся до тех пор, пока по разным причинам не происходит элиминация их конкурентов. При ослаблении конкуренции метаболизм среднеразмерных клеток ускоряется, однако темпы их роста остаются умеренными, а их объем практически постоянен. Затем они начинают делиться, немного увеличивая свою численность, что показано в экспериментах (Batani et al., 2016). Поскольку среднеразмерных кокков и коккобацилл в водоемах немало, то их бесконтрольное размножение привело бы к резкому увеличению численности прокариотопланктона, чего не происходит, так как они сразу же попадают под контроль “сверху” (Pernthaler et al., 1996). Затем этот цикл повторяется вновь. По-видимому, структурно-функциональная организация прокариотопланктона основана на совместном и последовательном выполнении общих функций всеми его размерно-морфологическими группами, способными успешно существовать в одних и тех же эколого-филогенетических нишах.
При изучении “разреженной бактериальной биосферы” (rare bacterial biosphere) водоемов были установлены закономерности, связанные с трофическими стратегиями прокариот. Так, постоянно редкие таксономические группы могут состоять из олиготрофов, адаптированных к существованию в условиях дефицита ресурсов, тогда как условно редкие или распространенные таксоны могут быть представлены копиотрофами, способными к быстрому росту при высокой концентрации субстратов, как это было показано, например, для оз. Мичиган (Newton, Shade, 2016). Трофические стратегии микроорганизмов в значительной степени влияют на их количественное развитие и функции в круговоротах биогенных элементов и структурно-функциональной организации водных экосистем.
В Севане в XXI в. происходили резкие колебания плотности доминирующего вида рыб – сига, что отражалось на численности метазойного планктона и структуре всей планктонной сети озера (Крылов и др., 2021). Популяция сига из-за браконьерского перелова уменьшилась, и, когда к 2012 г. этот планктофаг почти исчез из озера, в составе зоопланктона появился и начал доминировать крупный вид ветвистоусых Daphnia magna, который оказывал значительный пищевой пресс на фитопланктон и микробное сообщество. Этот вид относится к тонким фильтраторам, характеризуется широким спектром кормовых объектов и способен использовать в пищу гетеротрофные и автотрофные организмы, находящиеся на всех уровнях планктонной трофической сети (Lampert, 2011). Как было показано ранее, дафнии могут выедать бактерий, в основном крупных и агрегированных, а также оказывать на них опосредованное влияние, в том числе стимулирующее, через действие трофического каскада.
В опытах, проведенных в небольшом безрыбном пресноводном пруду, было показано, что после удаления доминанта D. magna усиливалось выедание бактериопланктона гетеротрофными флагеллятами, и происходила его сукцессия от быстрорастущих мелких бактерий к крупным, устойчивым к выеданию морфотипам (Jurgens et al., 1999). Увеличилась также доля мелкоразмерных палочек и кокков – представителей β-Proteobacteria и Cytophaga–Flavobacterium, но их продукция быстро потреблялась флагеллятами. В сообществе стали доминировать крупные палочки длиной 3–6 мкм из класса α-Proteobacteria, которые не выедались жгутиконосцами. Кроме того, развивались также устойчивые к выеданию нитевидные бактерии, относящиеся к таксономическим группам β-Proteobacteria и Cytophaga–Flavobacterium.
С 2013 г. в оз. Севан плотность сига начала постепенно увеличиваться, что привело к быстрому исчезновению D. magna. В период проведения наших исследований в 2018–2019 гг. этот вид ветвистоусых ракообразных в озере отсутствовал. В результате контроль протистов “сверху” со стороны многоклеточного зоопланктона в разные годы и сезоны то усиливался, то ослабевал, и вследствие этого количество гетеротрофных нанофлагеллят и их бактериотрофная активность испытывали значительные межгодовые и сезонные вариации. Как было показано ранее, нанофлагелляты являются главными потребителями гетеротрофного бактериопланктона во многих водоемах (Sanders et al., 1989).
Во все сезоны наблюдений в оз. Севан клетки, прикрепленные к частицам детрита и образующие микроколонии, были минорной группой прокариотопланктона. Одной из причин этого может являться их выедание метазойным планктоном. В этих условиях роль в сообществе каждой размерно-морфологической группы, а особенно одиночных клеток, многократно возрастает. При низкой плотности сига и возрастании количества зоопланктона в 2013–2014 гг. большая часть прокариотопланктона была представлена мелкими одиночными клетками (Косолапов, 2016). В эти годы осенью происходило возрастание количества крупных палочковидных клеток, как одиночных, так и образующих скопления, а также нитевидных форм, составлявших значительную часть общей биомассы прокариот, чего не наблюдалось при возросшей плотности сига в 2018–2019 гг. В этот период в прокариотопланктоне Севана преобладали K-стратеги: мелкие палочки и среднеразмерные кокки и коккобациллы. Однако r-стратеги, такие как мелкие кокки, более приспособленные к резким изменениям условий окружающей среды, успешно конкурировали с K-стратегами, и их доля в сообществе была также весьма значительной.
Экосистемы горных озер чувствительны к потеплению климата и его последствиям. Как было установлено в экспериментальных микрокосмах, в бактериопланктоне при высоких температурах (25 и 35°C) начинали доминировать так называемые ультрамикробактерии, к которым относят бактерий, имеющих объемы пролиферирующих клеток менее 0.1 мкм3 и малые размеры геномов, включающие Actinobacteria, Polynucleobacter sp., кластеры LD12 (Alphaproteobacteria) и LD28, а также представителей подкластера I Methylophilus. Ультрамикробактерии обладают большой удельной поверхностью и поэтому преимуществами при потреблении субстратов, а также при взаимодействии с большинством консументов (Hahn, Hofle, 2001) и вирусами (Weinbauer, 2004). Также при увеличении температуры воды в составе бактериопланктона происходили резкие изменения, особенно при высоком содержании соединений биогенных элементов. Таким образом, получены экспериментальные доказательства того, что при повышении температуры уменьшаются размеры клеток бактериопланктона, в его составе начинают доминировать ультрамикробактерии, и сообщество становится нестабильным. Вероятно, при дальнейшем потеплении климата подобные изменения прокариотопланктона можно ожидать и в оз. Севан.
ЗАКЛЮЧЕНИЕ
Колебания численности и биомассы различных размерно-морфологических групп пресноводного прокариотопланктона в пространстве и во времени носят закономерный и предсказуемый характер. Для лучшего понимания механизмов функционирования, регуляции и сукцессии прокариотического сообщества необходимо изучать его размерно-морфологическую структуру во взаимосвязи с таксономической структурой. Вероятно, даже таксоны высокого ранга преимущественно имеют in situ определенные размеры и форму, поэтому большинство клеток какого-либо морфотипа – это представители определенных филумов и классов. В таком случае можно утверждать, что крупные таксоны гетеротрофных прокариот имеют определенные экологические стратегии, в ходе реализации которых они в условиях функциональной избыточности последовательно получают преимущество в совместно занимаемых эколого-филогенетических нишах и выполняют общие для всех прокариот функции, обеспечивая сукцессию сообщества в крупном пресном горном озере.
Список литературы
Косолапов Д.Б., 2016. Бактериопланктон озера Севан // Озеро Севан. Экологическое состояние в период изменения уровня воды. Ярославль: Филигрань. С. 79–92.
Крылов А.В., Айрапетян А.О., Овсепян А.А., Сабитова Р.З., Габриелян Б.К., 2021. Межгодовые изменения весеннего зоопланктона пелагиали озера Севан (Армения) в ходе повышения ихтиомассы // Биология внутр. вод. № 1. С. 95–98. https://doi.org/10.31857/S032096522101006X
Озеро Севан. Экологическое состояние в период изменения уровня воды, 2016 / Отв. ред. Крылов А.В. Ярославль: Филигрань. 328 с.
Павлова М.Д., Асатурова А.М., Козицын А.Е., 2021. Форма клеток бактерий. Некоторые особенности ультраструктуры, эволюции и экологии // Журн. общ. биологии. Т. 82. № 4. С. 270–282. https://doi.org/10.31857/S0044459621040047
Сахарова Е.Г., Крылов А.В., Сабитова Р.З., Цветков А.И., Гамбарян Л.Р. и др., 2020. Горизонтальное и вертикальное распределение фитопланктона высокогорного озера Севан (Армения) в период летнего цветения цианопрокариот // Сиб. экол. журн. № 1. С. 76–88. https://doi.org/10.15372/SEJ20200106
Andrews J.H., Harris R.F., 1986. r- and K-selection and microbial ecology // Advances in Microbial Ecology. N.-Y.: Springer Science+Business Media. P. 99–147.
Asatryan V., Stepanyan L., Hovsepyan A., Khachikyan T., Mamyan A., Hambaryan L., 2022. The dynamics of phytoplankton seasonal development and its horizontal distribution in Lake Sevan (Armenia) // Environ. Monit. Assess. V. 194. Art. 757. https://doi.org/10.1007/s10661-022-10446-5
Batani G., Pérez G., Martínez de la Escalera G., Piccini C., Fazi S., 2016. Competition and protist predation are important regulators of riverine bacterial community composition and size distribution // J. Freshwat. Ecol. V. 31. № 4. P. 609–623. https://doi.org/10.1080/02705060.2016.1209443
Bergeijk D.A., van, Terlouw B.R., Medema M.H., Wezel G.P., van, 2020. Ecology and genomics of Actinobacteria: new concepts for natural product discovery // Nat. Rev. Microbiol. V. 18. P. 546–558. https://doi.org/10.1038/s41579-020-0379-y
Beveridge T.J., 1988. The bacterial surface: General considerations towards design and function // Can. J. Microbiol. V. 34. № 4. P. 363–372. https://doi.org/10.1139/m88-067
Borsheim K.Y., 1993. Native marine bacteriophages // FEMS Microbiol. Ecol. V. 102. P. 141–159. https://doi.org/10.1016/0378-1097(93)90197-A
Caron D.A., 1983. Technique for enumeration of heterotrophic and phototrophic nanoplankton, using epifluorescence microscopy, and comparison with other procedures // Appl. Environ. Microbiol. V. 46. № 2. P. 491–498. https://doi.org/10.1128/aem.46.2
Caron D.A., Dam H.G., Kremer P., Lessard E.J., Madin L.P. et al., 1995. The contribution of microorganisms to particulate carbon and nitrogen in surface waters of the Sargasso Sea near Bermuda // Deep Sea Res. V. 42. P. 943–972. https://doi.org/10.1016/0967-0637(95)00027-4
Comte J., Jacquet S., Viboud S., Fontvieille D., Millery A. et al., 2006. Microbial community structure and dynamics in the largest natural French lake (Lake Bourget) // Microb. Ecol. V. 52. P. 72–89. https://doi.org/10.1007/s00248-004-0230-4
Corno G., Caravati E., Callieri C., Bertoni R., 2008. Effects of predation pressure on bacterial abundance, diversity, and size-structure distribution in an oligotrophic system // J. Limnol. V. 67. № 2. P. 107–119. https://doi.org/10.4081/jlimnol.2008.107
Falkowski P.G., Fenchel T., Delong E.F., 2008. The microbial engines that drive Earth’s biogeochemical cycles // Science. V. 320. № 5879. P. 1034–1039. https://doi.org/10.1126/science.1153213
Fischer U.R., Velimirov B., 2000. Comparative study of the abundance of various bacterial morphotypes in an eutrophic freshwater environment determined by AODC and TEM // J. Microbiol. Methods. V. 39. № 3. P. 213–224. https://doi.org/10.1016/S0167-7012(99)00121-9
Foster K.R., Bell T., 2012. Competition, not cooperation, dominates interactions among culturable microbial species // Curr. Biol. V. 22. № 19. P. 1845–1850. https://doi.org/10.1016/j.cub.2012.08.005
Fuhrman J.A., Noble R.T., 1995. Viruses and protists cause similar bacterial mortality in coastal seawater // Limnol. Oceanogr. V. 40. P. 1236–1242. https://doi.org/10.4319/lo.1995.40.7.1236
Garcia A., Goñi P., Cieloszyk J., Fernandez M.T., Calvo-Beguería L. et al., 2013. Identification of free-living amoebae and amoeba-associated bacteria from reservoirs and water treatment plants by molecular techniques // Environ. Sci. Technol. V. 47. № 7. P. 3132–3140. https://doi.org/10.1021/es400160k
Gasol J.M., Giorgio P.A., del Massana R., Duarte C.M., 1995. Active versus inactive bacteria: Size-dependence in a coastal marine plankton community // Mar. Ecol. Prog. Ser. V. 128. P. 91–97. https://doi.org/10.3354/meps128091
Hahn M.W., 2003. Isolation of strains belonging to the cosmopolitan Polynucleobacter necessarius cluster from freshwater habitats located in three climatic zones // Appl. Environ. Microbiol. V. 69. P. 5248–5254. https://doi.org/10.1128/AEM.69.9.5248-5254.2003
Hahn M.W., Hofle M.G., 1999. Flagellate predation on a bacterial model community: Interplay of size-selective grazing, specific bacterial cell size, and bacterial community composition // Appl. Environ. Microbiol. V. 65. P. 4863–4872. https://doi.org/10.1128/AEM.65.11.4863-4872.1999
Hahn M.W., Hofle M.G., 2001. Grazing of protozoa and its effect on populations of aquatic bacteria // FEMS Microbiol. Ecol. V. 35. P. 113–121. https://doi.org/10.1111/j.1574-6941.2001.tb00794.x
Hambaryan L.R., Stepanyan L.G., Mikaelyan M.V., Gyurjyan Q.G., 2020. The bloom and toxicity of cyanobacteria in Lake Sevan // Proc. YSU B: Chem. Biol. Sci. V. 54. № 2. P. 168–176. https://doi.org/10.46991/PYSU:B/2020.54.2.168
Jia Yu., Whalen J.K., 2020. A new perspective on functional redundancy and phylogenetic niche conservatism in soil microbial communities // Pedosphere. V. 30. № 1. P. 18–24. https://doi.org/10.1016/S1002-0160(19)60826-X
Jurgens K., Matz C., 2002. Predation as a shaping force for the phenotypic and genotypic composition of planktonic bacteria // Antonie van Leeuwenhoek. V. 81. P. 413–434. https://doi.org/10.1023/a:1020505204959
Jurgens K., Pernthaler J., Schalla S., Amann R., 1999. Morphological and compositional changes in a planktonic bacterial community in response to enhanced protozoan grazing // Appl. Environ. Microbiol. V. 65. № 3. P. 1241–1250. https://doi.org/10.1128/AEM.65.3.1241-1250.1999
Kirschner A.K.T., Velimirov B., 1997. Seasonal study of bacterial community succession in a temperate backwater system indicated by variation in morphotype numbers, biomass and secondary production // Microb. Ecol. V. 34. P. 27–38. https://www.jstor.org/stable/4251501
Krambeck C., Krambeck H.-J., Overbeck J., 1981. Microcomputer-assisted biomass determination of plankton bacteria on scanning electron micrographs // Appl. Environ. Microbiol. V. 42. № 1. P. 142–149. https://doi.org/10.1128/aem.42.1
La Ferla R., Azzaro F., Azzaro M., Caruso G., Decembrini F. et al., 2005. Microbial contribution to carbon biogeochemistry in the Central Mediterranean Sea: Variability of activities and biomass // J. Mar. Syst. V. 57. № 1–2. P. 146–166. https://doi.org/10.1016/j.jmarsys.2005.05.001
Lampert W., 2011. Daphnia: Development of a Model Organism in Ecology and Evolution. Oldendorf; Luhe: IEI Publishers. 250 p.
Langenheder S., Jurgens K., 2001. Regulation of bacterial biomass and community structure by metazoan and protozoan predation // Limnol. Oceanogr. V. 46. P. 121–134. https://doi.org/10.4319/lo.2001.46.1.0121
Lebaron P., Servais P., Agogue H., Courties C., Joux F., 2001. Does the high nucleic acid content of individual bacterial cells allow us to discriminate between active cells and inactive cells in aquatic systems? // Appl. Environ. Microbiol. V. 67. P. 1775–1782. https://doi.org/10.1128/AEM.67.4.1775-1782.2001
Martiny A.C., Treseder K., Pusch G., 2013. Phylogenetic conservatism of functional traits in microorganisms // ISME J. V. 7. P. 830–838. https://doi.org/10.1038/ismej.2012.160
Newton R.J., Jones S.E., Eiler A., McMahon K.D., Bertilsson S., 2011. A guide to the natural history of freshwater lake bacteria // Microbiol. Mol. Biol. Rev. V. 75. № 1. P. 14–49. https://doi.org/10.1128/MMBR.00028-10
Newton R.J., Shade A., 2016. Lifestyles of rarity: Understanding heterotrophic strategies to inform the ecology of the microbial rare biosphere // Aquat. Microb. Ecol. V. 78. P. 51–63. https://doi.org/10.3354/ame01801
Norland S., 1993. The relationship between biomass and volume of bacteria // Handbook of Methods in Aquatic Microbial Ecology. Boca Raton: Lewis Publishers. P. 303–308.
Pernthaler A., Pernthaler J., Amann R., 2004. Sensitive multi-color fluorescence in situ hybridization for the identification of environmental microorganisms // Molecular Microbial Ecology Manual. Dordrecht; Boston; London: Kluwer Academic Press. P. 711–726.
Pernthaler J., 2005. Predation on prokaryotes in the water column and its ecological implications // Nat. Rev. Microbiol. V. 3. P. 537–546. https://doi.org/10.1038/nrmicro1180
Pernthaler J., Glockner F.-O., Unterholzner S., Alfreider A., Psenner R., Amann R., 1998. Seasonal community and populations dynamics of pelagic bacteria and Archaea in a high mountain lake // Appl. Environ. Microbiol. V. 64. P. 4299–4306. https://doi.org/10.1128/AEM.64.11.4299-4306.1998
Pernthaler J., Posch T., Simek K., Vrba J., Pernthaler A. et al., 2001. Predator-specific enrichment of Actinobacteria from a cosmopolitan freshwater clade in mixed continuous culture // Appl. Environ. Microbiol. V. 67. № 5. P. 2145–2155. https://doi.org/10.1128/AEM.67.5.2145-2155
Pernthaler J., Sattler B., Simek K., Schwarzenbacher A., Psenner R., 1996. Top-down effects on the size biomass distribution of a freshwater bacterioplankton community // Aquat. Microb. Ecol. V. 10. P. 255–263. https://doi.org/10.3354/ame010255
Porter K.G., Feig Y.S., 1980. The use of DAPI for identifying and counting aquatic microflora // Limnol. Oceanogr. V. 25. № 5. P. 943–948. https://doi.org/10.4319/lo.1980.25.5.0943
Posch T., Franzoi J., Prader M., Salcher M.M., 2009. New image analysis tool to study biomass and morphotypes of three major bacterioplankton groups in an alpine lake // Aquat. Microb. Ecol. V. 54. P. 113–126. https://doi.org/10.3354/ame01269
Pradeep Ram A.S., Mari X., Brune J., Torréton J.P., Chu V.T. et al., 2018. Bacterial-viral interactions in the sea surface microlayer of a black carbon-dominated tropical coastal ecosystem (Halong Bay, Vietnam) // Elem. Sci. Anth. V. 6. Art. 13. https://doi.org/10.1525/elementa.276
Pradeep Ram A.S., Nishimura Y., Tomaru Y., Nagasaki K., Nagata T., 2010. Seasonal variation in viral-induced mortality of bacterioplankton in the water column of a large mesotrophic lake (Lake Biwa, Japan) // Aquat. Microb. Ecol. V. 58. P. 249–259. https://doi.org/10.3354/ame01381
Rothhaupt K.O., 1997. Nutrient turnover by freshwater bacterivorous flagellates: Differences between a heterotrophic and mixotrophic chrysophyte // Aquat. Microb. Ecol. V. 12. P. 65–70. https://doi.org/10.3354/ame012065
Salcher M.M., 2014. Same but different: Ecological niche partitioning of planktonic freshwater prokaryotes // J. Limnol. V. 73. P. 74–87. https://doi.org/10.4081/jlimnol.2014.813
Salcher M.M., Hofer J., Hornák K., Jezbera J., Sonntag B. et al., 2007. Modulation of microbial predator-prey dynamics by phosphorus availability. Growth patterns and survival strategies of bacterial phylogenetic clades // FEMS Microbiol. Ecol. V. 60. P. 40–50. https://doi.org/10.1111/j.1574-6941.2006.00274.x
Sanders R.W., Porter K.G., Bennett S.J., DeBiase A.E., 1989. Seasonal patterns of bacteriovory by flagellates, ciliates, rotifers and cladocerans in freshwater planktonic community // Limnol. Oceanogr. V. 34. P. 673–687. https://doi.org/10.4319/lo.1989.34.4.0673
Schauer M., Hahn M.W., 2005. Diversity and phylogenetic affiliations of morphologically conspicuous large filamentous bacteria occurring in the pelagic zones of a broad spectrum of freshwater habitats // Appl. Environ. Microbiol. V. 71. № 4. P. 1931–1940. https://doi.org/10.1128/AEM.71.4.1931-1940.2005
Schuech R., Hoehfurtner T., Smith D.J., Humphries S., 2019. Motile curved bacteria are Pareto-optimal // Proc. Natl. Acad. Sci. USA. V. 116. № 29. P. 14440–14447. https://doi.org/10.1073/pnas.1818997116
Schulz H.N., Jørgensen B.B., 2001. Big bacteria // Annu. Rev. Microbiol. V. 55. P. 105–137. https://doi.org/10.1146/annurev.micro.55.1.105
Siefert J.L., Fox G.E., 1998. Phylogenetic mapping of bacterial morphology // Microbiology. V. 144. P. 2803–2808. https://doi.org/10.1099/00221287-144-10-2803
Simon M., Grossart H.-P., Schweitzer B., Ploug H., 2002. Microbial ecology of organic aggregates in aquatic ecosystems // Aquat. Microb. Ecol. V. 28. P. 175–211. https://doi.org/10.3354/ame028175
Thingstad T.F., 2000. Element of a theory for the mechanisms controlling abundance, diversity, and biogeochemical role of lytic bacterial viruses in aquatic system // Limnol. Oceanogr. V. 45. P. 1320–1328. https://doi.org/10.4319/lo.2000.45.6.1320
Walsby A.E., 2005. Stratification by cyanobacteria in lakes: A dynamic buoyancy model indicates size limitations met by Planktothrix rubescens filaments // New Phytol. V. 168. P. 365–376. https://doi.org/10.1111/j.1469-8137.2005.01508.x
Weinbauer M.G., 2004. Ecology of prokaryotic viruses // FEMS Microbiol. Rev. V. 28. P. 127– 181. https://doi.org/10.1016/j.femsre.2003.08.001
Weinbauer M.G., Hornák K., Jezbera J., Nedoma J., Dolan J.R., Simek K., 2007. Synergistic and antagonistic effects of viral lysis and protistan grazing on bacterial biomass, production and diversity // Environ. Microbiol. V. 9. P. 777–788. https://doi.org/10.1111/j.1462-2920.2006.01200.x
Young K.D., 2006. The selective value of bacterial shape // Microbiol. Mol. Biol. Rev. V. 70. № 3. P. 660–703. https://doi.org/10.1128/MMBR.00001-06
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии