Журнал общей биологии, 2022, T. 83, № 5, стр. 336-345
Воздействие доминантов на видовое богатство растительных сообществ в контексте энергетической гипотезы
В. В. Акатов 1, *, Т. В. Акатова 2, Д. Ф. Афанасьев 3, Т. Г. Ескина 2, Н. М. Сазонец 1, Е. Г. Сушкова 3, С. Г. Чефранов 1
1 Майкопский государственный технологический университет
385000 Майкоп, ул. Первомайская, 191, Россия
2 Кавказский государственный природный биосферный заповедник
385000 Майкоп, ул. Советская, 187, Россия
3 Азово-Черноморский филиал Всероссийского научно-исследовательского института рыбного хозяйства и океанографии (“АзНИИРХ”)
344002 Ростов-на-Дону, ул. Береговая, 21б, Россия
* E-mail: akatovmgti@mail.ru
Поступила в редакцию 18.04.2022
После доработки 13.05.2022
Принята к публикации 30.05.2022
- EDN: MPMELA
- DOI: 10.31857/S0044459622040030
Аннотация
Мы сопоставили участие доминантов, биомассу и число сопутствующих видов в сериях проб биомассы, отобранных на 69 участках наземных растительных сообществ Западного Кавказа и Предкавказья (высокогорные и нижнегорные луга и степи, сообщества пустырей, старых залежей и т.д.), а также на семи участках макрофитобентоса верхней сублиторали Черного и Азовского морей. Результаты показали, что рост участия доминирующих видов ведет к существенному снижению видового богатства на небольших участках наземных сообществ, но не оказывает на него значимого влияния в морских. При этом как в наземных, так и в морских сообществах сходная биомасса сопутствующих видов, отобранная на участках с разным участием доминантов, включает преимущественно сходное число таких видов. Этот результат можно рассматривать в качестве аргумента в пользу правомерности энергетической гипотезы Райта. Он также свидетельствует, что связь между биомассой и числом сопутствующих видов является основным механизмом воздействия доминантов на видовое богатство растительных сообществ. Это может означать, что их воздействие на сопутствующие виды носит преимущественно неизбирательный характер. Соответственно, размер видового пула участков сообществ с высоким и низким участием доминантов должен быть примерно одинаковым.
Согласно энергетической (species-energy) гипотезе (Wright, 1983) и объясняющей ее гипотезе “большего числа индивидуумов” (larger number of individuals) (Srivastava, Lawton, 1998), количество доступной энергии (продуктивность среды обитания) может ограничивать число сосуществующих видов путем сокращения плотности их особей: меньше доступных ресурсов, ниже продукция и биомасса сообществ, ниже плотность особей, ниже вероятность, что эти особи будут относиться ко многим видам. Это означает, что менее продуктивные сообщества должны включать меньшее число видов, чем более продуктивные, а в сообществах со сходной продукцией (биомассой, числом особей) видовое богатство должно быть примерно одинаковым (Wright, 1983; Currie, Paquin, 1987; Currie, 1991; Latham, Ricklefs, 1993; Bhattarai et al., 2004; Hurlbert, Stegen, 2014).
Результаты полевых исследований преимущественно подтверждают первое из этих предсказаний, по крайней мере на части градиента продукции от низкой до средней (Grime, 1973; Tilman, 1988; Moore, Keddy, 1989; Waide et al., 1999; Cornwell, Grubb, 2003; Bhattarai et al., 2004; Adler et al., 2011; Fraser et al., 2015; Twist et al., 2020). Однако они оказались неопределенными в отношении второго предсказания, поскольку видовое богатство сообществ разных типов, но с одинаковой продукцией (биомассой), часто существенно различается (Garsía et al., 1993; Bhattarai et al., 2004; Adler et al., 2011; Šímová et al., 2013; Fraser et al., 2015; Akatov et al., 2022). Разная скорость видообразования, так же как разные эволюционный возраст сообществ и частота их нарушений в историческом прошлом, обычно рассматриваются в качестве причины этого явления (Garsía et al., 1993; Latham, Ricklefs, 1993; Ricklefs et al., 1999; Kaspari et al., 2003; Longino, Colwell, 2011; Акатов, Чефранов, 2014; Akatov et al., 2022).
Из гипотезы Райта (Wright, 1983) также следует, что чем выше участие доминантов в растительных сообществах (степень доминирования), тем меньше ресурсов остается другим (сопутствующим) видам, тем ниже суммарная биомасса и число таких видов. Данный механизм предполагает, что рост участия доминантов ведет к неизбирательному (случайному) вытеснению из участков других (сопутствующих) видов. Результатом такого воздействия может стать существенное снижение их встречаемости, однако любой из этих видов будет иметь ненулевую вероятность быть обнаруженным на любом участке сообщества с любым участием доминанта. Это означает, что размер видового пула этих участков будет примерно одинаковым. В этом случае определенная биомасса сопутствующих видов растений, отобранная на участках сообщества с высоким участием доминанта, должна включать примерно такое же число видов, как и сходная по запасу биомасса, отобранная на участках с низкой степенью его доминирования.
Однако доминанты могут влиять на сопутствующие виды и другими способами, например, путем трансформации экотопа (накопление ветоши, изменение светового и гидрологического режимов, физико-химических свойств почвы и т.д.) или аллелопатии (Работнов, 1983; Levine et al., 2003; Callaway, Ridenour, 2004; Lanta et al., 2013; Bartha et al., 2014; Blackburn et al., 2019). Доминанты, способные существенно изменять условия произрастания для других видов, называются эдификаторами (Работнов, 1983), в инвазивной экологии – “видами-трансформерами” (Richardson et al., 2000; Виноградова и др., 2009). Их средообразующая деятельность может препятствовать произрастанию в сообществах одних видов, но не оказывать существенного влияния на другие (избирательный характер воздействия). Соответственно, рост участия таких доминантов в фитоценозах будет сопровождаться последовательным исключением из их состава сначала наименее, а затем все более устойчивых видов растений (упорядоченное вымирание; Solan et al., 2004; Gross, Cardinale, 2005). Это означает, что размер видового пула участков сообществ с разной степенью доминирования будет разным. В этом случае определенная биомасса сопутствующих видов растений, отобранная на участках сообщества с высоким участием доминанта, должна включать меньшее число таких видов, чем сходная по запасу биомасса, отобранная на участках с низкой степенью его доминирования.
Таким образом, если воздействие доминантов на видовое богатство растительных сообществ можно объяснить связью между биомассой и числом сопутствующих видов (т.е. на основе энергетической гипотезы), то его последствия будут проявляться только на относительно небольших участках растительного покрова. В противном случае (если присутствуют другие механизмы воздействия) – в более крупном пространственном масштабе. Но насколько широко эти механизмы распространены в природе? Сделано предположение, что среди чужеродных видов растений только около 10% могут быть отнесены к “трансформерам” (Rejmánek et al., 2013). Однако их способность избирательно воздействовать на другие виды растений требует проверки. Информация о том, какая часть аборигенных доминантов обладает такими возможностями в том или ином регионе, нам не известна.
Ранее мы тестировали правомерность гипотезы Райта (Wright, 1983), а также характер (избирательный, неизбирательный) воздействия доминантов на сопутствующие виды на примере 15 участков растительных сообществ разных типов (Акатов и др., 2021). Правомерность энергетической гипотезы проверяли путем сравнения числа видов в группах проб надземной биомассы с разным участием доминанта, но со сходной суммарной биомассой сопутствующих видов (благодаря разному числу проб в группах). Характер воздействия доминантов на сопутствующие виды (избирательный или неизбирательный) оценивали путем сравнения структуры распределения видов на градиенте степени доминирования в сериях проб биомассы и в соответствующих им сериях модельных ценозов со случайным распределением видов. Правомерность энергетической гипотезы и признаки неизбирательного (случайного) вытеснения доминантами сопутствующих видов были выявлены на 11 из 15 участков, обратная ситуация – на трех. Несогласованный результат был получен на одном участке. В данной статье мы оценили правомерность гипотезы Райта (Wright, 1983) на примере 69 участков наземных сообществ (Западный Кавказ, Предкавказье) и семи участков макрофитобентоса Черного и Азовского морей.
МАТЕРИАЛ И МЕТОДИКА
Методы сбора фактического материала
Район исследования включает предгорье и горные массивы Западного Кавказа в бассейнах рек Белая, Малая и Большая Лаба, Шахе, Хоста и Абин (Краснодарский край, Республика Адыгея, 200–2500 м над ур. м.), Ставропольскую возвышенность (Ставропольский край, 585 м над ур. м.), западную часть Кубано-Приазовской низменности (Краснодарский край), прибрежные участки шельфа Черного моря и мелководные участки Таманского залива Азовского моря (Краснодарский край, глубины от 0.1 до 2 м).
Объектом изучения явились однородные по условиям среды участки растительных сообществ с хорошо выраженным доминированием определенного вида, расположенные на наземных нелесных природных (NAT) и антропогенных (с доминированием аборигенных видов – DISTa, чужеродных – DISTex) местообитаниях, а также в верхней сублиторали Черного и Азовского морей (BENT). В том числе: сообщества альпийского и субальпийского поясов с доминированием Alchemilla retinervis (1 участок), A. persica (1), Calamagrostis arundinacea (5), Chamaenerion angustifolium (1), Kobresia macrolepis (1), Geranium gymnocaulon (1), Inula orientalis subsp. grandiflora (1); нижнегорные луговые и степные сообщества с доминированием Agropyron cristatum subsp. sclerophyllum (1), Botriochloa ischaemum (2), Brachypodium pinnatum (1), Calamagrostis epigeios (2), Geranium sanguineum (1); травяной ярус лесов с доминированием аборигенных видов – Allium ursinum (1), Equisetum telmateia (1), Matteuccia struthiopteris (1), Oplismenus undulatifolium (1); чужеродного – Duchesnea indica (1); сообщества залежей, пустырей, местообитаний с отсутствием почвенного покрова, обезлесенных участков с доминированием аборигенных видов – Botriochloa ischaemum (3), Calamagrostis epigeios (3), Cynanchum acutum (1), Echinochloa crus-galli (1), Echium vulgare (1), Glycyrrhiza glabra (1), Medicago falcata (5), Melilotus officinalis (1), Trifolium arvense (1), Trifolium pratense (1), Rubus caesius (5), Setaria viridis (1), Sisymbrium loeselii (1); чужеродных – Ambrosia artemisiifolia (5), Asclepias syriaca (2), Bidens frondosa (1), Helianthus tuberosus (1), Impatiens glandulifera (1), Parthenocissus quinquefolia (2), Paspalium thunbergii (1), Silfium perfoliatum (1), Solidago сanadensis (6), Xanthium albinum (1); макрофитобентос горизонта фотофильной растительности сублиторали Черного моря с доминированием Ericaria bosphorica и Gongolaria barbata (Cystoseira sensu lato) (3) и Азовского моря с доминированием Zostera noltei и Z. marina (4). Как видно, воздействие нескольких доминантов на видовое богатство сообществ было изучено на нескольких участках: Solidago сanadensis – на шести; Calamagrostis arundinacea, C. epigeios, Botriochloa ischaemum, Rubus caesius, Medicago falcata и Ambrosia artemisiifolia – на пяти; Zostera noltei и Z. marina – на четырех; Ericaria bosphorica и Gongolaria barbata – на трех; Asclepias syriaca и Parthenocissus quinquefolia – на двух. Это позволило нам оценить воздействие определенных доминантов на растительные сообщества разных местообитаний.
В пределах каждого из участков сообществ было заложено по 25–30 площадок размером 0.5 × 0.5 м. Часть площадок была заложена регулярным способом в виде одной или двух трансект, включающих по 10 площадок; другие – сериями по 5–10 штук на участок. Во втором случае выбирали варианты сообществ с высоким и низким проективным покрытием доминирующих видов, которое оценивали визуально. С каждой площадки была отобрана проба надземной биомассы. Для каждой из них были определены: 1) сырая биомасса в целом (W), биомасса доминирующего вида (Wd) и сопутствующих видов (Ws); 2) число сопутствующих видов (Ss); 3) степень доминирования (D = Wd/W). Кроме того, для каждой серии проб определяли общее число сопутствующих видов ($N_{s}^{'}$). Для проб макрофитобентоса показатель Wd отражал совместную биомассу Ericaria bosphorica и Gongolaria barbata, так же как Zostera noltei и Z. marina. Кроме того, поскольку цистозиры (Cystoseira sensu lato) и зостеры могут оказывать как отрицательное (конкуренция), так и положительное (как субстрат) воздействие на другие виды, соотношение между биомассой и числом сопутствующих видов анализировали только для макроводорослей эпилитов (т.е. без учета эпифитов). Общее число изученных участков сообществ составило 76, отобранных и обработанных проб – 2165. Среди них 69 участков наземных и 7 морских сообществ.
Номенклатура сосудистых растений дана по А.С. Зернову (2006), макроводорослей – основана на глобальной таксономической базе данных и номенклатуре водорослей AlgaeBase (https://www.algaebase.org/).
Методы анализа фактического материала
Для каждого участка сообщества сформировали группы из пяти проб с наименьшим участием доминанта (LD) и для каждой из этих групп определили суммарную биомассу сопутствующих видов. Сформировали группы проб с наиболее высоким участием этого вида (HD), в которых суммарная надземная биомасса сопутствующих видов примерно соответствовала значениям этой характеристики в группах проб с низким его участием. Сопоставили среднее (Ss) и общее (Ns) число сопутствующих видов в группах проб с LD и HD.
Мы предположили, что в случае, если энергетическая гипотеза является основным механизмом воздействия доминантов на видовое богатство растительных сообществ, следует ожидать: 1) число сопутствующих видов (Ns), выявленных в группах проб с LD, будет статистически незначимо отличаться от числа таких видов, выявленных в группах проб с HD; 2) число участков сообществ с более высокими и более низкими значениями Ns в группах проб с LD, чем в группах проб с HD, должно быть примерно одинаковым. Соотношение числа видов, обнаруженных (Ns) и необнаруженных ($N_{s}^{'}$ − Ns) в пробах с LD, отобранных с определенных участков сообществ, рассматривали как ожидаемое для проб с HD, отобранных с тех же участков. Статистическую значимость различий этих соотношений оценивали с использованием критерия χ2. Этот же критерий использовали для оценки статистической значимости отклонения соотношения между числом участков сообществ с более высокими и более низкими значениями Ns в группах проб с LD и HD от 1 : 1. Разницу средних значений Ss в группах проб с LD и HD оценивали с использованием однофакторного дисперсионного анализа (ANOVA).
РЕЗУЛЬТАТЫ
Информация о среднем числе сопутствующих видов растений в отдельных пробах (Ss) и общем числе таких видов в их группах (Ns) для участков сообществ разных типов (NAT, DISTa, DISTex и BENT) представлена в табл. 1 и на рис. 1–3. Группы проб сформированы на основе двух признаков: 1) существенно разное участие доминанта (наиболее низкое – LD, наиболее высокое – HD); 2) примерно равная суммарная (для групп проб) надземная биомасса сопутствующих видов растений, благодаря разному числу проб в группах. Группы проб с LD, отобранные с участков наземных сообществ (средние для типов сообществ значения D меньше 0.32), состояли из пяти проб, с HD (D более 0.77) – из 8–21 пробы (табл. 1). Как видно из табл. 1, а также рис. 1а и 2а, среднее число сопутствующих видов (Ss) в пробах с LD, отобранных с участков наземных сообществ (NAT, DISTa, DISTex), в среднем и в подавляющем большинстве случаев (в 67 из 69) выше, чем в пробах с HD. На 52 участках эта разница является статистически значимой (табл. 1, рис. 2а). Однако общее число видов (Ns) в группах проб с LD и HD отличается разнонаправленно (табл. 1, рис. 1б, 3а). В целом из 69 изученных участков наземных сообществ на шести участках в группах проб с HD обнаружено такое же число видов, как и в группах проб с LD, на 29 участках – меньшее число видов, на 34 участках – большее (соотношение статистически не значимо отличается от 1 : 1, χ2 = 0.397) (рис. 3а).
Таблица 1.
Характеристика среднего видового богатства и общего числа видов в группах проб биомассы с разным участием доминантов, отобранных в растительных сообществах разных типов
| Сооб- щества |
m | Низкое участие доминанта (LD) | Высокое участие доминанта (HD) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| n1 | D | Ws | Ss | Ns | n2 | D | Ws | Ss | Ns | ||
| NAT | 22 | 5 | 0.31 | 828.5 | 13.4/22/17 | 27.0/10/4 | 8–20 | 0.77 | 828 | 9.3/0/0 | 28.3/12/5 |
| DISTa | 26 | 5 | 0.24 | 1206 | 9.9/25/21 | 21.6/13/5 | 9–20 | 0.77 | 1201 | 6.1/1/0 | 21.0/8/3 |
| DISTex | 21 | 5 | 0.32 | 1367 | 9.3/20/14 | 18.5/6/2 | 10–21 | 0.82 | 1369 | 6.0/1/0 | 20.1/14/5 |
| BENT | 7 | 5 | 0.57 | 625 | 5/7/1 | 8.4/0/0 | 11–25 | 0.92 | 624 | 4.2/0/0 | 10.7/7/2 |
Примечание. m – число изученных участков сообществ разных типов; n1 и n2 – число проб в группах; D – средняя для участков степень доминирования в группах проб биомассы с низким (LD) и с высоким (HD) участием доминирующего вида; Ws – средняя для участков суммарная биомасса сопутствующих видов в группах проб с LD и с HD (в граммах на 0.25 м2). Параметры Ss и $N_{s}^{'}$ характеризуются: средними значениями для участков/числом участков с более высокими значениями этих характеристик в группах проб с LD или с HD/числом участков с достоверно (Р < 0.05) более высокими значениями этих характеристик в группах проб с LD или HD. Сообщества: NAT – наземные природные, DISTa – антропогенных местообитаний с доминированием аборигенных видов, DISTex – такие же с доминированием чужеродных видов, BENT – макрофитобентос верхней сублиторали Черного и Азовского морей.
Рис. 1.
Среднее (Ss) и общее (Ns) число видов в группах проб с относительно низким (LD) и относительно высоким (HD) участием доминирующих видов, отобранных в наземных растительных сообществах Западного Кавказа и Предкавказья и макрофитобентосе Черного и Азовского морей. Показаны средние, минимальные и максимальные значения Ss (а) и Ns (б) для участков сообществ разных типов. Черные кружки – средние значения Ss и Ns для групп проб с LD, черные квадраты – для групп проб с HD. NAT – наземные природные сообщества, DISTa – сообщества антропогенных местообитаниях с доминированием аборигенных видов, DISTex – такие же сообщества с доминированием чужеродных видов, BENT – макрофитобентос.
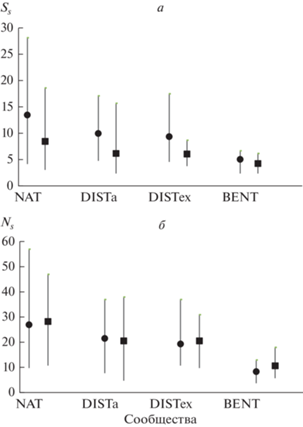
Рис. 2.
Отклонение среднего видового богатства (Ss) в группах проб с высоким уровнем доминирования (SsHD) от значений данной характеристики в соответствующих им по суммарной биомассе группах проб с низким уровнем доминирования (SsLD). Прямая линия построена в соответствии с равенством SsHD = = SsLD. Участки сообществ со значимо (Р < 0.05) более высокими или низкими значениями этой характеристики в группах проб с HD, чем в группах проб с LD, обозначены белыми кружками, незначимо – черными. а – наземные растительные сообщества Западного Кавказа и Предкавказья, б – макрофитобентос Черного и Азовского морей.
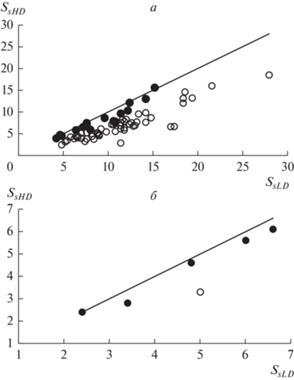
Рис. 3.
Отклонение общего числа видов (Ns) в группах проб с высоким уровнем доминирования (NsHD) от значений данной характеристики в соответствующих им по суммарной биомассе группах проб с низким уровнем доминирования (NsLD). Прямая линия построена в соответствии с равенством NsHD = NsLD. Участки сообществ со значимо (Р < 0.05) более высокими или низкими значениями этой характеристики в группах проб с HD, чем в группах проб с LD, обозначены белыми кружками, незначимо – черными. а – наземные растительные сообщества Западного Кавказа и Предкавказья, б – макрофитобентос Черного и Азовского морей.
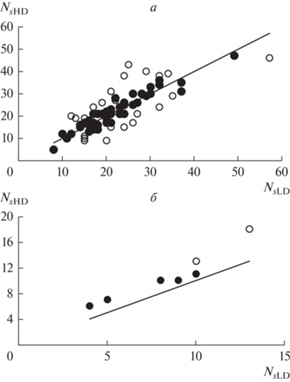
Значимо меньшее число видов (Ns) в группах проб с HD, чем в соответствующих им по суммарной биомассе группах проб с LD, выявлено на 11 участках (табл. 1, рис. 3а). В том числе на трех участках с доминированием Rubus caesius (DISTa), по одному – с доминированием Allium ursinum, Calamagrostis arundinacea, Equisetum telmateia и Geranium gymnocaulon (NAT), Glycyrrhiza glabra и Trifolium arvense (DISTa), а также Asclepias syriaca и Solidago canadensis (DISTex). Обратная ситуация (т.е. число видов в группах проб с HD значимо выше, чем в группах проб с LD) выявлена на тринадцати участках: на двух участках с доминированием Calamagrostis arundinacea (NAT), на одном – с доминированием Brachypodium pinnatum (NAT), на двух – с Botriochloa ischaemum (NAT, DISTa), на трех – с Ambrosia artemisiifolia (DISTex), по одному – с Echium vulgare, Sisymbrium loeselii, Bidens frondosa и Solidago canadensis (DISTa, DISTex). При этом из шести изученных участков сообществ с доминированием Solidago canadensis на одном из них значение Ns было значимо выше, а на другом значимо ниже в группах проб с LD, чем в группах проб с HD (табл. 2). Сходная ситуация выявлена на участках с доминированием Calamagrostis arundinacea: на одном из пяти участков значение Ns было значимо выше в группах проб с LD, на двух – в группах проб с HD. Напротив, иная ситуация была обнаружена на участках с доминированием Rubus caesius: значение Ns было значимо выше в группах проб с LD, чем с HD, на трех из пяти участков.
Таблица 2.
Характеристика среднего видового богатства и общего числа видов в группах проб биомассы с разным участием Calamagrostis arundinacea, Rubus caesius и Solidago canadensis
| № | $N_{s}^{'}$ | Низкое участие доминанта (LD) | Высокое участие доминанта (HD) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n | D | Ws | Ss | Ns | n | D | Ws | Ss | Ns | χ2 | ||
| Calamagrostis arundinacea (NAT) | ||||||||||||
| 1 | 38 | 5 | 0.25 | 2683 | 10.6 | 22 | 18 | 0.77 | 2685 | 7.1 | 28 | 4.891 |
| 2 | 42 | 5 | 0.15 | 1567 | 14.8 | 32 | 20 | 0.73 | 1563 | 8.7 | 36 | 3.11 |
| 3 | 42 | 5 | 0.24 | 1222 | 18.4 | 30 | 19 | 0.74 | 1222 | 12.0 | 33 | 1.27 |
| 4 | 73 | 5 | 0.13 | 1128 | 21.6 | 57 | 14 | 0.67 | 1126 | 16.0 | 46 | 7.112 |
| 5 | 55 | 5 | 0.22 | 707.6 | 18.6 | 29 | 12 | 0.78 | 709.2 | 14.6 | 40 | 11.093 |
| Rubus caesius (DISTa) | ||||||||||||
| 1 | 27 | 5 | 0.23 | 1426 | 9.0 | 20 | 10 | 0.78 | 1424 | 4.5 | 9 | 20.173 |
| 2 | 32 | 5 | 0.16 | 785 | 11.4 | 26 | 18 | 0.77 | 787.4 | 2.8 | 17 | 10.162 |
| 3 | 34 | 5 | 0.17 | 1446 | 7.6 | 18 | 17 | 0.69 | 1440 | 3.8 | 21 | 1.12 |
| 4 | 31 | 5 | 0.21 | 528 | 6.4 | 18 | 9 | 0.65 | 524 | 4.3 | 16 | 0.52 |
| 5 | 29 | 5 | 0.14 | 610 | 9.0 | 24 | 10 | 0.62 | 608 | 4.8 | 15 | 11.193 |
| Solidago canadensis (DISTex) | ||||||||||||
| 1 | 31 | 5 | 0.56 | 1089 | 12.0 | 20 | 11 | 0.83 | 1101 | 8.3 | 22 | 0.63 |
| 2 | 33 | 5 | 0.46 | 1042 | 11.4 | 24 | 18 | 0.87 | 1042 | 6.1 | 25 | 0.17 |
| 3 | 17 | 5 | 0.36 | 806.6 | 6.4 | 15 | 17 | 0.83 | 806.2 | 5.8 | 17 | 2.27 |
| 4 | 30 | 5 | 0.26 | 1075 | 11.4 | 22 | 14 | 0.85 | 1083 | 8.1 | 27 | 9.262 |
| 5 | 33 | 5 | 0.38 | 857.8 | 11.8 | 27 | 14 | 0.85 | 855.8 | 5.8 | 21 | 7.332 |
| 6 | 22 | 5 | 0.34 | 1009 | 9.8 | 16 | 14 | 0.86 | 1002 | 5.4 | 13 | 1.69 |
Примечание. № – номер участка; n – число проб в группах; D – средняя для пробы степень доминирования; Ws – суммарная биомасса сопутствующих видов в группах проб в граммах; Ss – среднее для пробы число сопутствующих видов; $N_{s}^{'}$ – общее число сопутствующих видов в сериях проб; Ns – число сопутствующих видов, обнаруженных в группах проб с разным участием доминанта. Соотношение Ns и ($N_{s}^{'}$ − Ns) в группах проб с высоким участием доминанта ниже или выше, чем в группах проб с низким его участием, причем это различие значимо для: 1– Р < 0.05, 2– Р < 0.01, 3– Р < 0.001.
Информация о видовом богатстве эпилитных макроводорослей в группах проб с LD и HD, отобранных с участков донных морских сообществ Черного и Азовского морей, представлена в табл. 1 и на рис. 1–3. Группы проб с LD состояли из пяти проб, с HD – из 11–25. Из табл. 1 и рис. 1 видно, что среднее число видов в пробах с LD несколько выше, а общее число видов в них немного ниже, чем в группах проб с HD. На всех участках группы проб с LD характеризуются более высокими значениями Ss и более низкими значениями Ns, чем группы проб с HD (табл. 1, рис. 2б, 3б). При этом значения Ss, значимо более высокие в группе проб с LD, чем с HD, выявлены только на одном из участков макрофитобентоса с доминированием цистозир. Значения Ns значимо более низкие в группе проб с LD, чем с HD, выявлены на двух участках – по одному с доминированием цистозир и зостер.
ОБСУЖДЕНИЕ
Итак, мы сопоставили биомассу и число сопутствующих видов на 76 участках растительных сообществ разных типов (наземных нелесных и донных морских) с доминированием видов разной систематической принадлежности и разного происхождения. Как следует из полученных результатов, рост участия доминантов ведет к существенному снижению числа сопутствующих видов на небольших участках наземных сообществ, но не оказывает значимого влияния на видовое богатство донных морских сообществ. При этом как в наземных, так и в морских сообществах сходная биомасса сопутствующих видов, отобранная на участках с высоким и низким участием доминантов, включает преимущественно сходное число таких видов (разница статистически незначима). Признаки избирательного вытеснения доминантами сопутствующих видов (их число в группах проб с HD значимо ниже, чем в группах проб с LD) обнаружены только на 16% от 69 изученных наземных участков и ни на одном из семи морских сообществ. На некоторых из участков, где такие признаки были обнаружены, доминируют виды, способные формировать высокие и густые заросли, предположительно малопригодные для произрастания неустойчивых к затенению растений (Equisetum telmateia, Glycyrrhiza glabra, Asclepias syriaca и Solidago canadensis). Кроме того, высказано предположение, что Solidago сanadensis способен выделять в среду дитерпеноиды, которые ингибируют рост сеянцев других видов (Weber, 2000; Виноградова и др., 2009). Однако обратим внимание на то, что для изучения Asclepias syriaca было использовано два участка, а Solidago сanadensis – шесть. При этом только на одном из участков с доминированием ваточника, так же как и золотарника, значение Ns было значимо выше в группах проб с LD, чем в группах проб с HD. Как указывалось выше, аналогичная ситуация была выявлена на пяти участках с доминированием Calamagrostis arundinacea. Возможно, воздействие одних и тех же доминантов может иметь разные последствия в разных сообществах (Hejda et al., 2017; Vítková et al., 2017). Однако нельзя исключить предположение, что отдельные случаи более высокого видового богатства групп проб с LD, чем групп проб с HD, так же как отдельные случаи обратной ситуации, могут быть связаны со случайными процессами.
Поскольку в качестве объектов исследования использовано значительное число участков сообществ существенно разных типов местообитаний, полученный нами результат позволяет рассматривать гипотезу Райта (Wright, 1983) как очень важный и широко распространенный механизм воздействия доминантов на видовое богатство, по крайней мере не лесных растительных сообществ. С другой стороны, это может означать, что доминанты, способные избирательно воздействовать на другие виды, скорее всего, не имеют широкого распространения в растительном покрове. Соответственно, рост участия доминантов в большинстве случаев может вызвать полное исчезновение некоторых других видов только на относительно небольших участках растительного покрова. Причем, как следует из наших данных, это в равной мере касается как аборигенных, так и чужеродных доминантов. Такой результат можно считать неожиданным, поскольку из-за длительного периода совместного сосуществования (сопряженной эволюции) местных видов с местными доминантами они должны быть к ним более устойчивы, чем к чужеродным (Работнов, 1983; Meiners et al., 2001; Hejda et al., 2017; Blackburn et al., 2019). Однако аргументы в пользу такого представления не были найдены и некоторыми другими авторами (Houlahan, Findlay, 2004; Gaertner et al., 2009; Powell et al., 2011, 2013; Веселкин, Дубровин, 2019; Czarniecka-Wiera et al., 2019; Hejda et al., 2021). В частности, в обзорах Гертнер с соавторами (Gaertner et al., 2009) и Пауэлл с соавторами (Powell et al., 2011) показано, что хотя чужеродные доминанты часто сильнее снижают видовое богатство на небольших участках ценозов, чем аборигенные, сила этого эффекта ослабевает по мере увеличения пространственного масштаба исследования, а на участках более 25–100 м2 разница становится практически незаметной.
При этом на трех из пяти участков сообществ с доминированием аборигенного кустарника Rubus caesius правомерность энергетической гипотезы не была подтверждена. Это может свидетельствовать о преимущественно избирательном воздействии этого доминанта на другие виды. Ранее такой же результат мы получили путем сопоставления серий проб с доминированием R. caesius с сериями модельных ценозов со случайным распределением видов (Акатов и др., 2021). Можно предположить, что плотный полог, образуемый над травяным покровом стелющимися и укореняющимися побегами этого низкого кустарника, существенно снижает освещенность для других растений и механически препятствует их росту вверх. С целью проверить, является ли такой характер воздействия на травянистые растения общим для всех доминантов, образующих полог, мы специально включили в число объектов исследования сообщества с доминированием североамериканского вида Parthenocissus quinquefolia (два участка) и аборигенного – Сynanchum acutum (один участок). Однако мы не обнаружили на этих участках признаков избирательного вытеснения видов.
Несмотря на то, что результаты анализа серий проб биомассы, отобранных на участках макрофитобентоса, преимущественно не противоречат энергетической гипотезе (на пяти из семи участков разница между значениями Ns для групп проб с LD и HD статистически незначима), они оказались менее определенными, чем аналогичные результаты по участкам наземных сообществ (на всех изученных участках Ns в группах проб с HD выше, чем в группах проб с LD). Это может быть связано с двумя причинами. Во-первых, многие виды макроводорослей могут испытывать со стороны доминантов (цистозир и зостер) как отрицательное (конкуренция), так и положительное (защита, субстрат для прикрепления) воздействие. Поэтому в нашем исследовании мы исключили из анализа эпифитные виды. Однако отделение эпифитов от эпилитов, учитывая наличие переходных форм, задача довольно сложная и не имеющая однозначного решения. Во-вторых, бентосные макрофиты Черного и Азовского морей произрастают в довольно суровых условиях среды: относительно низкая соленость и прозрачность воды, неблагоприятный температурный режим, значительное волновое воздействие (Афанасьев и др., 2017). При этом известно, что чем суровее условия произрастания, тем, как правило, слабее негативное влияние доминантов на другие виды, но чаще проявляются положительные взаимоотношения между растениями (Миркин, Наумова, 2012; Онипченко, 2013; Акатов и др., 2018, 2019; Афанасьев, Акатов, 2021). Ранее мы показали, что только половина облигатных эпилитов, обнаруженных на участках макрофитобентоса с доминированием цистозир, характеризуется более высокой встречаемостью на участках с низкой степенью их участия. Остальные эпилиты не показывают особых предпочтений в этом отношении (Афанасьев, Акатов, 2021). Встречаемость большинства видов макроводорослей, обнаруженных в сообществах с доминированием Z. noltei и Z. marina, также слабо связана с плотностью особей этих морских сосудистых растений (Afanasyev, Akatov, 2021).
ЗАКЛЮЧЕНИЕ
Знания о роли межвидовых взаимодействий в организации биологических сообществ важны для формирования осознанного отношения к угрозе сокращения биоразнообразия из-за изменения численности (биомассы, покрытия) определенных видов, особенно доминантов, как аборигенных, так и чужеродных, как в наземных, так и в водных экосистемах (Hillebrand et al., 2008; Hejda et al., 2021, и др.). Наше исследование касается одного из аспектов этой проблемы. Мы показали, что сходная биомасса сопутствующих видов, отобранная на участках растительных сообществ с разным участием доминантов, независимо от их таксономической принадлежности и происхождения, включает преимущественно сходное число таких видов. Этот результат хорошо согласуется с предсказаниями гипотезы Райта (Wright, 1983). Он также свидетельствует о том, что связь между биомассой и числом сопутствующих видов является очень важным механизмом воздействия доминантов на видовое богатство растительных сообществ. Это может означать, что их воздействие на сопутствующие виды носит преимущественно неизбирательный характер, а соответственно, может стать причиной полного исчезновения некоторых из этих видов только на относительно небольших участках растительного покрова.
Список литературы
Акатов В.В., Чефранов С.Г., 2014. Эффект компенсации плотностью в сообществах деревьев Западного Кавказа // Журн. общ. биологии. Т. 75. № 1. С. 48–61. [Akatov V.V., Chefranov S.G., 2014. Density compensation effect in arboreal communities of the West Caucasus // Biol. Bull. Rev. V. 4. № 5. Р. 421–432].
Акатов В.В., Акатова Т.В., Чефранов С.Г., 2018. Связь доминирования и выравненности с продуктивностью и видовым богатством в растительных сообществах разных моделей организации // Экология. № 4. С. 264–274. [Akatov V.V., Akatova T.V., Chefranov S.G., 2018. The relationship of dominance and evenness with productivity and species richness in plant communities with different organization models // Russ. J. Ecol. V. 49. № 4. Р. 296–305].
Акатов В.В., Акатова Т.В., Чефранов С.Г., 2019. Растительные сообщества суровых и благоприятных местообитаний: особенности организации, структура доминирования и ее связь с видовым богатством // Журн. общ. биологии. Т. 80. № 2. С. 145–160. [Akatov V.V., Akatova T.V., Chefranov S.G., 2020. Plant communities in harsh and favorable environments: characteristics of their organization, their dominant structure and its relationship to species richness // Biol. Bull. Rev. V. 10. № 3. P. 215–229].
Акатов В.В., Акатова Т.В., Афанасьев Д.Ф., Сушкова Е.Г., Чефранов С.Г., 2021. Результат воздействия доминантов на видовое богатство растительных сообществ: упорядоченное или случайное исчезновение видов? // Экология. № 4. P. 243–253. [Akatov V.V., Akatova T.V., Afanasyev D.F., Eskina T.G., Sushkova E.G., Chefranov S.G., 2021. Result of impact of dominants on species richness of plant communities: ordered or random species loss? // Russ. J. Ecol. V. 52. № 4. P. 257–266].
Афанасьев Д.Ф., Акатов В.В., 2021. Влияние видов Cystoseira sensu lato (Fucales: Phaeophyceae) на сообщества макрофитобентоса полуострова Абрау (Чёрное море) // Океанология. Т. 61. № 2. С. 276–285. [Afanasyev D.F., Akatov V.V., 2021. Effects of biomass of Abrau Peninsula shelf macrophytobenthic communities (Black Sea) // Oceanology. V. 61. № 2. Р. 244–253].
Афанасьев Д.Ф., Камнев А.Н., Сеськова Д.В., Сушкова Е.Г., 2017. Сезонная динамика сообществ морских водорослей с доминированием Cystoseira crinita Duby, 1830 (Fucales: Phaeophyceae) в северо-восточной части Черного моря // Биол. моря. Т. 43. № 6. С. 393–402. [Afanasyev D.F., Kamnev A.N., Seskova D.V., Sushkova E.G., 2017. The seasonal dynamics of Cystoseira crinita Duby, 1830 (Fucales: Phaeophyceae) – Dominated communities in the Northeastern Black Sea // Russ. J. Mar. Biol. V. 43. № 6. P. 431–441].
Веселкин Д.В., Дубровин Д.И., 2019. Разнообразие травяного яруса урбанизированных сообществ с доминированием инвазивного Acer negundo // Экология. № 5. С. 323–331. [Veselkin D.V., Dubrovin D.I., 2019. Diversity of the grass layer of urbanized communities dominated by invasive Acer negundo // Russ. J. Ecol. V. 50. № 5. Р. 413–421].
Виноградова Ю.К., Майоров С.Р., Хорун Л.В., 2009. Черная книга флоры Средней России Чужеродные виды растений в экосистемах Средней России. М.: ГЕОС. 494 с.
Зернов А.С., 2006. Флора Северо-Западного Кавказа. М.: Т-во науч. изд. КМК. 664 с.
Миркин Б.М., Наумова Л.Г., 2012. Современное состояние основных концепций науки о растительности. Уфа: АН РБ, Гилем. 488 с.
Онипченко В.Г., 2013. Функциональная фитоценология: синэкология растений. M.: Красанд. 640 с.
Работнов Т.А., 1983. Фитоценология. М.: Изд-во МГУ. 296 с.
Adler P.B., Seabloom E.W., Borer E.T., Hillebrand H., Hautier Y. et al., 2011. Productivity is a poor predictor of plant species richness // Science. V. 333. P. 1750–1753.
Afanasyev D., Akatov V., 2021. Influence of Zostera marina L. and Z. noltei Hornem. (Zosterales: Liliopsida) on the composition, species richness and coenotic diversity of the phytobenthos of the Azov Sea // BIO Web Conf. V. 38. https://doi.org/10.1051/bioconf/20213800001
Akatov V.V., Afanasyev D.F., Akatova T.V., Chefranov S.G., Eskina T.G., Sushkova E.G., 2022. Small-scale species richness of plant communities with similar biomass: The influence of habitat types in the context of historical hypothesis (Western Caucasus and Ciscaucasia, Black and Azov Seas, Russia) // Botanica Pacifica. V. 11. № 1. https://doi.org/10.17581/bp.2022.11106
Bartha S., Szentes Sz., Horváth A., Házi J., Zimmermann Z. et al., 2014. Impact of mid-successional dominant species on the diversity and progress of succession in regenerating temperate grasslands // Appl. Veg. Sci. V. 17. № 2. P. 201–213.
Bhattarai K.R., Vetaas O.R., Grytnes J.A., 2004. Relationship between plant species richness and biomass in an arid sub-alpine grassland of the Central Himalayas, Nepal // Folia Geobot. V. 39. P. 57–71.
Blackburn T.M., Bellard C., Ricciardi A., 2019. Alien versus native species as drivers of recent extinctions // Front. Ecol. Environ. V. 17. № 4. P. 203–207.
Callaway R.M., Ridenour W.M., 2004. Novel weapons: a biochemically based hypothesis for invasive success and the evolution of increased competitive ability // Front. Ecol. Environ. V. 2. P. 433–436.
Cornwell W.K., Grubb P.J., 2003. Regional and local patterns in plant species richness with respect to resource availability // Oikos. V. 100. P. 417–428.
Currie D.J., 1991. Energy and large-scale patterns of animal and plant-species richness // Am. Nat. V. 137. P. 27–40.
Currie D.J., Paquin V., 1987. Large – scale biogeographical patterns of species richness of trees // Nature. V. 329. P. 326–327.
Czarniecka-Wiera M., Kacki Z., Chytry M., Palpurina S., 2019. Diversity loss in grasslands due to the increasing dominance of alien and native competitive herbs // Biodivers. Conserv. V. 28. P. 2781–2796.
Fraser L.H., Pither J., Jentsch A., Sternberg M., Zobel M. et al., 2015. Worldwide evidence of a unimodal relationship between productivity and plant species richness // Science. V. 349. № 6245. P. 302–305.
Gaertner M., Breeyen A.D., Hui C., Richardson D.M., 2009. Impacts of alien plant invasions on species richness in Mediterranean-type ecosystems: a meta-analysis // Prog. Phys. Geogr. V. 33. P. 319–338.
Garsía L.V., Maranόn T., Moreno F., Clemente L., 1993. Above-ground biomass and species richness in a Mediterranean salt march // J. Veg. Sci. V. 4. № 3. P. 417–424.
Grime J.P., 1973. Competitive exclusion in herbaceous vegetation // Nature. V. 242. P. 344–347.
Gross K., Cardinale B.J., 2005. The functional consequences of random vs. ordered species extinctions // Ecol. Lett. V. 8. P. 409–418.
Hejda M., Štajerová K., Pyšek P., 2017. Dominance has a biogeographical component: Do plants tend to exert stronger impacts in their invaded rather than native range? // J. Biogeogr. V. 44. P. 18–27.
Hejda M., Sádlo J., Kutlvašr J., Petřík P., Vítková M. et al., 2021. Do invasive alien plants impact the diversity of vegetation more compared to native expansive dominants? // Invasion of Alien Species in Holarctic. Borok-VI: Sixth International Symposium. Book of abstracts / Eds Dgebuadze Yu.Yu., Krylov A.V., Petro-syan V.G., Karabanov D.P. Kazan: Buk. P. 88–89.
Hillebrand H., Bennett D.M., Cadotte M.W., 2008. Consequences of dominance: A review of evenness effects on local and regional ecosystem processes // Ecology. V. 89. № 6. P. 1510–1520.
Houlahan J.E., Findlay C.S., 2004. Effect of invasive plant species on temperate wetland plant diversity // Conserv. Biol. V. 18. № 4. P. 1132–1138.
Hurlbert A.H., Stegen J.C., 2014. When should species richness be energy limited, and how would we know? // Ecol. Lett. V. 17. P. 401–413.
Kaspari M., Yuan M., Lecanne A., 2003. Spatial grain and the causes of regional diversity gradients in ants // Am. Nat. V. 161. № 3. P. 459–477.
Lanta V., Hyvonen T., Norrdahl K., 2013. Non-native and native shrubs have differing impacts on species diversity and composition of associated plant communities // Plant Ecol. V. 214. № 12. P. 1517–1528.
Latham R.E., Ricklefs R.E., 1993. Continental comparisons of temperate-zone tree species diversity // Species Diversity in Ecological Communities: Historical and Geographical Perspectives / Eds Ricklefs R.E., Schluter D. Chicago: Chicago Univ. Press. P. 294–315.
Levine J.M., Vila M., D’Antonio C.M. et al., 2003. Mechanisms underlying the impacts of exotic plant invasions // Proc. R. Soc. Lond. B. V. 270. P. 775–781.
Longino J.T., Colwell R.K., 2011. Density compensation, species composition, and richness of ants on a neotropical elevational gradient // Ecosphere. V. 2. № 3. P. 1–20.
Meiners S.J., Pickett S.T.A., Cadenasso M.L., 2001. Effects of plant invasions on the species richness of abandoned agricultural land // Ecography. V. 24. P. 633–644.
Moore D.R.J., Keddy P.A., 1989. The relationship between species richness and standing crop in wetlands: the importance of scale // Vegetatio. V. 79. P. 99–106.
Powell K.I., Chase J.M., Knight T.M., 2011. A synthesis of plant invasion effects on biodiversity across spatial scales // Am. J. Bot. V. 98. № 3. P. 539–548.
Powell K.I., Chase J.M., Knight T.M., 2013. Invasive plants have scale-dependent effects on diversity by altering species-area relationships // Science. V. 339. P. 316–318.
Rejmánek M., Richardson D.M., Pyšek P., 2013. Plant invasions and invasibility of plant communities // Vegetation Ecology, 2nd Edition / Eds Maarel E., van der, Chichester J.F. Chichester: Wiley and Sons, Ltd. P. 387‒424.
Richardson D.M., Pyšek P., Rejmánek M., Barbour M.G., Panetta F.D., West C.J., 2000. Naturalization and invasion of alien plants: Concepts and definitions // Divers. Distrib. V. 6. P. 93–107.
Ricklefs R.E., Latham R.E., Qian H., 1999. Global patterns of tree species richness in moist forests: Distinguishing ecological influences and historical contingency // Oikos. V. 86. P. 369–373.
Šímová I., Li Y.M., Storch D., 2013. Relationship between species richness and productivity in plants: The role of sampling effect, heterogeneity and species pool // J. Ecol. V. 101. P. 161–170.
Solan M., Cardinale B.J., Downing A.L., Engelhardt K.A.M., Ruesink J.L., Srivastava D.S., 2004. Extinction and ecosystem function in the marine benthos // Science. V. 306. P. 1177–1180.
Srivastava D.S., Lawton J.H., 1998. Why more productive sites have more species: An experimental test of theory using tree-hole communities // Am. Nat. V. 152. P. 510–529.
Tilman D., 1988. Plant Strategies and the Dynamics and Structure of Plant Communities. (Monogragraphs in Population Biology. V. 26). Princeton: Princeton Univ. Press. 362 p.
Twist B.A., Kluibenschedl A., Pritchard D., Desmond M.J., D’Archino R., et al., 2020. Biomass and species richness relationships in macroalgal communities that span intertidal and subtidal zones // Mar. Ecol. Prog. Ser. V. 654. P. 67–78.
Vítková M., Müllerová J., Sádlo J., Pergl J., Pyšek P., 2017. Black locust (Robinia pseudoacacia) beloved and despised: A story of an invasive tree in Central Europe // For. Ecol. Manag. V. 384. P. 287–302.
Waide R.B., Willig M.R., Steiner C.F., Mittelbach G., Gough L. et al., 1999. The relationship between productivity and species richness // Annu. Rev. Ecol. Syst. V. 30. P. 257–300.
Weber E., 2000. Biological flora of Central Europe: Solidago altissima L. // Flora. V. 195. P. 123–134.
Wright D.H., 1983. Species-energy theory: An extension of species-area theory // Oikos. V. 41. P. 496–506.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


