Журнал общей биологии, 2022, T. 83, № 4, стр. 268-287
Вклад генов и симбиотической микробиоты в увеличение продолжительности жизни мух Drosophila melanogaster, отбираемых на позднее размножение
Е. Ю. Яковлева 1, *, Д. С. Мерзликин 1, А. Е. Завьялов 1, А. А. Маслов 1, Е. А. Миронова 1, А. В. Марков 1, 2, **
1 Московский государственный университет им. М.В. Ломоносова
119234 Москва, Ленинские горы, 1, Россия
2 Палеонтологический институт им. А.А. Борисяка РАН
117997 Москва, ул. Профсоюзная, 123, Россия
* E-mail: e.u.yakovleva@gmail.com
** E-mail: markov_a@inbox.ru
Поступила в редакцию 20.06.2022
После доработки 03.07.2022
Принята к публикации 08.07.2022
- EDN: BAJQEH
- DOI: 10.31857/S004445962204008X
Аннотация
Drosophila melanogaster – удобный модельный организм для изучения факторов, влияющих на продолжительность жизни (ПЖ) и другие параметры жизненного цикла. В настоящей работе мы протестировали мух из разных лабораторных линий, в том числе подвергающихся искусственному отбору на позднее размножение, и показали, что эволюционные изменения ПЖ могут быть связаны не только с изменениями генофонда подопытной линии дрозофил. Вопреки ожиданиям, вклад генетической составляющей в увеличение ПЖ мух под действием отбора на позднее размножение, по-видимому, относительно невелик. Его сложно выделить в чистом виде, так как он маскируется влиянием других факторов, прежде всего симбиотической микробиоты. Полученные результаты согласуются с предположением о том, что различия по ПЖ между линиями дрозофил, содержащимися в разных условиях, могут в значительной степени определяться компонентами их микробиоты. Отбор дрозофил на позднее размножение (равно как и другие средовые воздействия) может влиять на ПЖ мух не только “напрямую”, т.е. через эволюционные изменения генофонда подопытной линии насекомых, но и опосредованно – через изменения микробиоты. Данный пример иллюстрирует “хологеномную теорию эволюции”, показывая, что единицей отбора в ряде случаев корректнее считать не индивидуальный организм, а холобионт, т.е. комплекс, включающий макроорганизм и ассоциированную с ним микробиоту.
Дрозофилы – классический модельный объект в экспериментальной и теоретической геронтологии. Лабораторные популяции мух Drosophila melanogaster широко используются для изучения факторов, влияющих на параметры жизненного цикла (life history traits), такие как средняя или медианная продолжительность жизни (ПЖ), темпы старения (возрастная динамика смертности, о которой можно судить по форме кривых выживания) и возрастная динамика плодовитости (Pearl, Parker, 1922; Rose, 1984; Stearns et al., 2000; He, Jasper, 2014; Piper, Partridge, 2018).
Параметры жизненного цикла подвержены наследственной изменчивости, т.е. наблюдаемая изменчивость по этим параметрам (как в природных популяциях, так и в лабораторных линиях) отчасти объясняется генетическими различиями между особями. Благодаря этому параметры жизненного цикла могут эволюционировать под действием отбора. Одним из классических подходов к изучению эволюционно-генетических основ ПЖ и других параметров жизненного цикла являются эксперименты по искусственному отбору.
Так, в ряде экспериментов изучалось действие искусственного отбора на позднее и раннее размножение. Длительный эксперимент на лабораторных линиях D. melanogaster был поставлен Роузом и его коллегами в 1975 г. (Rose, Charlesworth, 1981a). ПЖ и возрастная динамика плодовитости сравнивались у дрозофил, которые в течение 180 поколений жили в режиме 14-дневного жизненного цикла (такой режим ведет к отбору на быстрое развитие и раннее размножение), и у мух из произведенных от них линий, которые в течение двух лет подвергались отбору на позднее размножение (возраст имаго, допущенных к репродукции, постепенно увеличивали от 28 до 70 сут). Отбор на позднее размножение привел к значимому росту средней ПЖ (с 33 до почти 43 сут у самок и с 38 до 44 сут для самцов), а максимум плодовитости самок сдвинулся на более поздний возраст (Rose, 1984). В другом подобном эксперименте отбор на позднее размножение привел к еще более впечатляющим результатам, увеличив среднюю ПЖ с 35 до 70 сут за 21 поколение (Luckinbill, Clare, 1985). Исследование по отбору самцов D. melanogaster на отсроченное старение показало, что такие самцы характеризуются повышенной защищенностью сперматозоидов от влияния семенной жидкости других самцов, а угнетения репродуктивной функции в раннем возрасте обнаружено не было (Service, Fales, 1993) (такого угнетения можно было ожидать в соответствии с идеей Уильямса (Williams, 1957) об антагонистической плейотропии генов, контролирующих баланс ресурсов организма, направляемых на размножение и жизнеобеспечение в разных возрастах).
В ряде экспериментов было показано, что отбор на позднее размножение увеличивает ПЖ дрозофил, повышает плодовитость самок в позднем возрасте и продлевает репродуктивный период, но при этом, в соответствии с упомянутой выше идеей Уильямса, снижает плодовитость в молодом возрасте и средний темп откладки яиц (mean egg-laying rate) (Rose, Charlesworth, 1981b). Отбор на раннее размножение в аналогичных экспериментах приводит лишь к росту плодовитости в молодом возрасте, но, по-видимому, не влияет на ПЖ (Rose, Charlesworth, 1981b; Luckinbill et al., 1984; Partridge et al., 1999).
Результаты подобных экспериментов традиционно интерпретируются в классическом эволюционном духе как следствие изменений генофонда подопытных линий дрозофил под действием отбора. Однако есть и другая точка зрения, согласно которой следует проявлять большую осторожность при интерпретации наблюдаемых результатов отбора на позднее или раннее размножение и не приписывать их “по умолчанию” изменениям генофонда подопытных линий, поскольку другие факторы тоже могут на них влиять (Baret et al., 1996; Arora et al., 2020). Результаты, полученные в наших экспериментах, заставляют прислушаться к данному мнению.
Факторы, влияющие на параметры жизненного цикла дрозофил, многообразны. В ходе эволюционных экспериментов на параметры жизненного цикла могут влиять, помимо генетических изменений, различные абиотические, трофические и социальные факторы, а также состав и структура ассоциированный микробиоты. Рассмотрим каждый из факторов подробнее.
Внешние абиотические и трофические факторы: температура, световой режим, влажность, диета. ПЖ мух может значительно варьировать под влиянием абиотических факторов среды. Так, показано, что ПЖ сокращается при увеличении температуры (Miquel et al., 1976; Бычковская и др., 2017). Также выявлено, что ПЖ сокращается при увеличении светового дня, что может быть связано с продлением ежесуточного периода активности (Москалев и др., 2006). Влияние на ПЖ оказывает состав корма. Например, даже умеренная концентрация поваренной соли (2–4%) в корме вызывает повышенную смертность D. melanogaster (Te Velde et al., 1988; Stergiopoulos et al., 2009), однако дрозофилы способны за несколько десятков поколений адаптироваться к соленому кормовому субстрату, что ведет к снижению смертности (Марков и др., 2015; Дмитриева и др., 2016; Панченко и др., 2017; Dmitrieva et al., 2019). Также показано, что диета с высоким содержанием жиров или сахара приводит к ожирению и снижению ПЖ (Gáliková, Klepsatel, 2018).
Социальные факторы: связанные с плотностью популяции (например, с плотностью личинок в кормовом субстрате), а также с индивидуальными взаимодействиями между особями (прежде всего это относится к половому поведению). Показано, что высокая плотность личинок ведет к росту средней ПЖ у имаго D. melanogaster, причем этот эффект может проявляться и как модификационная изменчивость в пределах нормы реакции (фенотипическая пластичность), и как устойчивый эволюционный результат адаптации к развитию в условиях высокой плотности личинок (Shenoi et al., 2016). Другие исследования показывают, что при повышенной плотности личинок происходит увеличение ПЖ мух, вышедших из куколок на 8–9-е сутки после откладки яиц, в сравнении с контрольной группой, чьи личинки развивались при нормальной плотности (примерно четыре яйца на квадратный сантиметр (Miller, Thomas, 1958)). У мух, вышедших из куколок позднее, не наблюдается значимых различий по ПЖ в сравнении с контрольной группой (Вайсерман и др., 2017). Конфликт полов, проявляющийся в различных стратегиях полового поведения, также может влиять на ПЖ, как напрямую, через социальное взаимодействие особей, так и косвенно, за счет генов, ассоциированных как со старением, так и с половым поведением. Например, показано, что агрессивные ухаживания и конкуренция между самцами негативно сказываются на ПЖ самок и способствуют их ускоренному репродуктивному старению (Carazo et al., 2014). В репродуктивной борьбе между самцами, проявляющейся в уничтожении или удалении чужих сперматозоидов, принимают участие продукты клеток придаточной железы (accessory gland). Показано негативное воздействие этих продуктов на самок и сокращение их ПЖ при повышенной частоте спариваний (Chapman et al., 1995; Sirot et al., 2011; Billeter et al., 2018). Самки генетически различаются по устойчивости к этому негативному воздействию со стороны самцов, а самцы, в свою очередь, генетически различаются по силе этого воздействия (Friberg, 2005).
Факторы, связанные с микробиотой. Важнейшими компонентами микробиоты дрозофил являются бактерии и дрожжи, переносимые мухами в кишечнике и на поверхности тела (Broderick, Lemaitre, 2012; Erkosar et al., 2013; Trinder et al., 2017; Douglas, 2018). Показано, что симбиотические микробы важны не только для питания (микроорганизмы могут служить непосредственным источником пищи и влиять на эффективность использования питательных веществ, содержащихся в кормовом субстрате) (Cooper, 1960; Ridley et al., 2012), но и оказывают многоплановое влияние на иммунитет, темпы личиночного развития, выживаемость (Chippindale et al., 1993; Brummel et al., 2004; Ryu et al., 2010; Blum et al., 2013; Martino et al., 2017) и даже на поведение (Schretter et al., 2018), в том числе при выборе брачного партнера (Markov et al., 2009; Sharon et al., 2010; Leftwich et al., 2018). Микробиота влияет на параметры жизненного цикла макроорганизма-хозяина (Maynard, Weinkove, 2018), и мухи не исключение (Arora et al., 2020). Еще в 1927 г. Штейнфельд выяснил, что дрозофилы, пищеварительный тракт которых лишен микробиоты, живут дольше, чем контрольные мухи (цит. по: Gould et al., 2018). В 2015 г. Кларк с соавторами (Clark et al., 2015) показали, что изменения в микробиоте предсказывают возникновение дисфункции кишечного барьера у пожилых дрозофил, приводя к гибели. В исследовании Гульда и коллег (Gould et al., 2018) показано, что лабораторные дрозофилы, лишенные характерной для их кишечника (стабильно поддерживающейся) бактериальной микробиоты, живут значимо дольше, чем мухи, содержащиеся при тестировании на субстрате, засеянном некоторыми видами этих бактерий или разными их комбинациями. Однако плодовитость самок с более низкой ПЖ выше, чем у “долгожительниц”, так что итоговая приспособленность оказывается примерно одинаковой у долгоживущих безмикробных самок и короткоживущих самок с нормальной микробиотой (или ее компонентами). Уолтерс с соавторами (Walters et al., 2020) показал, что та же закономерность наблюдается и у диких дрозофил (выловленных в природе и протестированных в лаборатории).
В данном исследовании мы провели отбор дрозофил на позднее размножение. Обнаружив значимое увеличение ПЖ в отбираемой линии по сравнению с предковой линией, содержавшейся в стандартных условиях и не подвергавшейся искусственному отбору (эксперимент № 1), мы попытались оценить относительный вклад генетических, социальных и микробиотических факторов в наблюдаемые различия по ПЖ. Для этого мы сравнили ПЖ самцов и самок мух из трех линий (опытной и двух контрольных, различающихся по условиям содержания и ПЖ) при совместном проживании с самками и самцами из той же самой или другой линии, в разных комбинациях (эксперимент № 2). Этот опыт показал, что наблюдаемое увеличение ПЖ у мух, отбираемых на позднее размножение, по сравнению с предковой линией, невозможно объяснить одними лишь генетическими факторами, и что социальные и (или) микробиотические факторы, по-видимому, вносят существенный вклад в наблюдаемые различия по ПЖ. Прямая экспериментальная оценка влияния перечисленных факторов на изменчивость параметров жизненного цикла дрозофил затрудняется тем, что эффекты разных факторов могут быть сложным образом переплетены, и во многих случаях их трудно отделить друг от друга. В связи с этим мы провели еще один эксперимент (№ 3), в котором, манипулируя микробным населением дрозофил и их кормовой среды, более прицельно охарактеризовали роль микробиоты в изменении ПЖ под действием отбора.
Полученные результаты согласуются с хологеномной теорией эволюции и показывают, что изменение ПЖ в результате отбора на долголетие может происходить не только и не столько за счет изменений в генофонде подопытной популяции макроорганизмов (как предполагают классические эволюционные модели), сколько за счет изменений микробиоты, которая также подвергается отбору и может существенно влиять на ПЖ хозяина. Таким образом, мы показали, что эволюционные изменения существенных фенотипических признаков макроорганизма, таких как его ПЖ, может происходить за счет изменений “хологенома”. Этот новый результат отличает настоящее исследование от других работ, в которых также велся отбор дрозофил на продление жизни.
МАТЕРИАЛЫ И МЕТОДЫ
1. Подопытные линии мух
Исходная популяция D. melanogaster получена в сентябре 2014 г. от 30 диких особей, пойманных на юго-западе г. Москвы (Марков и др., 2015). До января 2015 г. популяция культивировалась на благоприятной (нормальной) кормовой среде (обозначается Н). Затем из этой популяции были произведены различные подопытные линии. Мухи содержались при температуре 22–25°С и естественном освещении в боксах из оргстекла (Yakovleva et al., 2016). Корм, в зависимости от линии, подавался в пробирках или чашках Петри, также в каждом боксе находилась поилка – небольшая емкость со смоченной ватой. В настоящем исследовании использовались следующие линии дрозофил:
Линия Мн – контрольная линия, культивируемая с 2015 г. в боксах на стандартной кормовой среде Н (60 г инактивированных дрожжей, 35 г манной крупы, 50 г сахара, 45 г измельченного изюма, 8 г агара, 2 г пропионовой кислоты на 1 л корма) и не подвергавшаяся искусственному отбору.
Линия Мбд – “бездрожжевые” мухи, популяция, произведенная от Мн в ноябре 2018 г. и культивируемая на субстрате Н с добавлением антигрибкового препарата нистатина из расчета 1 таблетка (25 г, 500 000 ЕД) на 0.5 л корма Н.
Линиям Мн и Мбд корм подавался в 12 открытых цилиндрических стеклянных пробирках диаметром 22 мм и высотой 100 мм, содержащих по 10 мл корма. Еженедельно в бокс добавлялись четыре пробирки со свежим кормом и удалялись четыре пробирки, простоявшие в боксе три недели.
Линия Ма – популяция мух, отбираемых на позднее размножение, получена в начале 2018 г. от мух из линии Мн в возрасте 80–83 дней (под “возрастом” здесь и далее понимается время с момента выхода мухи из куколки). Линия Ма представляет собой последовательно сменяющие друг друга когорты, т.е. популяции мух примерно одного возраста, полученные от когорты предыдущего поколения в возрасте от 72 до 85 дней. Линия культивировалась на корме Н, корм подавался в трех чашках Петри диаметром 35 мм и заменялся на новый каждые три дня.
2. Эксперимент № 1: предварительное тестирование результатов отбора на позднее размножение (далее Предварительный эксперимент)
Чтобы оценить эффективность проведенного отбора на позднее размножение, потомки мух из линии Ма и предковой к ней линии Мн одновременно тестировались на ПЖ. Для тестирования в линии Ма брались потомки не старых родителей, а родителей в возрасте 14–17 дней. Яйца для получения тестируемой когорты линии Мн были собраны в популяционном боксе, в котором обитают мухи разных возрастов, поэтому возраст родителей не отслеживался. Однако ранее нами было показано, что пик плодовитости самок в линии Мн приходится на возраст 2–4 недели, поэтому можно считать, что в данном эксперименте участвовали мухи, полученные от родителей сопоставимого возраста, и такой фактор, как возраст родителей, вряд ли мог сильно повлиять на результаты тестирования (Yakovleva et al., 2016; Gorshkova et al., 2019).
Все мухи в течение одного поколения перед тестированием выращивались в одинаковых условиях: в стандартных пробирках с кормом Н, закрытых ватными пробками. Это делалось для снятия прямого влияния условий содержания и возможных материнских эффектов на параметры жизненного цикла (Mousseau et al., 2009; Марков и др., 2015).
Тестирование на ПЖ проводилось следующим образом. Мухи, вышедшие из куколок в течение трех дней (за это время удавалось накопить достаточное количество мух для тестирования), выпускались в такой же бокс, как и те, в которых содержатся исходные линии. “Датой рождения” тестируемых мух условно считали второй день трехдневного интервала. Все тестируемые когорты подготавливались и выпускались в боксы одновременно, чтобы случайные флуктуации неконтролируемых факторов среды действовали синхронно на все тестируемые линии.
В тесте использовалось два бокса: с мухами Ма (122 особи) и мухами Мн (135 особей). Самцы и самки содержались вместе на протяжении всего теста. Тестирование проводилось на корме Н. Корм подавался в боксы в чашках Петри диаметром 35 мм и высотой 7 мм и заменялся каждые три дня в вечернее время. Поилка заменялась каждые две недели. Ежедневно производился учет погибших мух, вплоть до гибели последней особи. Мертвые мухи удалялись из бокса, после чего у них определялся пол.
3. Эксперимент № 2: оценка влияния социальных и микробиотических факторов на ПЖ дрозофил в опыте с совместным проживанием мух из разных линий (далее Эксперимент на совместное проживание)
Обнаружив в предварительном эксперименте значительные различия по ПЖ между контрольной (Мн) и экспериментальной (Ма) линиями мух, мы поставили задачу выяснить, обусловлено ли это только генетическими факторами (связанными с отбором аллелей генов, ассоциированных с долголетием), которые исторически предполагаются в таких случаях по умолчанию, или вклад иных факторов также присутствует. Тестирование мух в одинаковых условиях, одновременно и на одинаковом корме позволило нивелировать разнонаправленное влияние абиотических и трофических факторов на ПЖ. Для детекции влияния социального (связанного с половым поведением) и микробиотического факторов, наряду с генетическим, мы сравнили ПЖ мух из трех лабораторных линий единого происхождения, но с разной историей культивирования и искусственного отбора. Причем тестировали мух при совместном проживании с особями противоположного пола либо из той же самой (“своей”), либо из другой (“чужой”) линии.
В эксперименте использовались мухи из линий Мн, Ма и Мбд. Тестировалось шесть вариантов совместного проживания: самцы Мн с самками Мн (♂Мн♀Мн), ♂Мн♀Мбд, ♂Мбд♀Мн, ♂Ма♀Ма, ♂Ма♀Мбд, ♂Мбд♀Ма.
Мухи готовились к тестированию так же, как в предварительном эксперименте. В каждый бокс выпускалось от 86 до 101 самки и от 64 до 80 самцов в зависимости от имеющегося количества особей, выращенных в стандартных условиях. Тестирование проводилось на корме Н. Корм помещался в боксы в чашках Петри диаметром 35 мм и высотой 7 мм и заменялся каждые три дня в вечернее время. Ежедневно производился учет погибших мух, вплоть до гибели последней мухи. Поилка заменялась каждые две недели.
Вариант теста ♂Мбд♀Мбд не рассматривался, так как в эксперименте не ставилась задача измерить ПЖ мух из линии Мбд. Данная линия использовалась лишь в качестве вспомогательной, чтобы оценить ПЖ самцов и самок Мн и Ма при совместном проживании со “своими” и “чужими” партнерами.
Ожидаемые эффекты социальных, микробиотических и генетических факторов были следующими:
1) В случае значительной роли социальных факторов (таких как различия между линиями по степени агрессивности мужской конкуренции и ухаживания) мы ожидали увидеть, что самки из одной и той же линии будут демонстрировать разную ПЖ при совместном проживании с разными самцами. Влияние самок на ПЖ самцов представляется менее вероятным, однако дизайн эксперимента позволяет выявить и его тоже: в этом случае самцы из одной и той же линии будут демонстрировать разную ПЖ при совместном проживании с разными самками.
2) В случае значительной роли микробиоты, учитывая ее потенциальную заразность (горизонтальную передачу), мы ожидали увидеть сильное и однотипное (однонаправленное) влияние партнеров обоего пола из определенной линии на ПЖ как самцов, так и самок из другой линии. Например, если у линии X присутствует микробиота, негативно влияющая на ПЖ, то можно ожидать, что мухи обоего пола из других линий будут жить меньше, если их партнерами являются мухи из линии X.
3) Если наследственная изменчивость по ПЖ в исходной природной популяции была высока, то отбор на долголетие (позднее размножение) должен оказаться эффективным, что соответствует значительной роли генетических факторов. В этом случае мы ожидаем увидеть, что у самцов и самок из линии, отбираемой на долголетие, средняя ПЖ окажется значительно больше, чем в двух других линиях, не подвергавшихся искусственному отбору.
4. Эксперимент № 3: оценка ПЖ самок с обедненной собственной микробиотой в присутствии микробиоты Ма или Мн (далее Эксперимент на самках)
Эксперимент нацелен на проверку влияния микробиоты мух Ма и Мн на ПЖ самок из линий Ма, Мн и Мбд. В данном случае тестировались мухи только одного пола (самки), чтобы нивелировать влияние на ПЖ социальных факторов, связанных с половым поведением и конфликтом полов.
В работе А.С. Дмитриевой и соавторов (2021) было показано, что самая богатая микробиота характерна для дрозофил в возрасте около недели, тогда как у мух, только что вышедших из куколки, микробиота резко обеднена. Иными словами, из куколки выходит муха почти без микробов и приобретает свою микробиоту в процессе жизни на освоенном другими мухами субстрате. Эти данные определили дизайн эксперимента: процесс получения мух с обедненной микробиотой и дальнейшее содержание их в присутствии мух-доноров тестируемой микробиоты.
В эксперименте использовались мухи из линий Ма и Мн в качестве доноров микробиоты и когорты мух с обедненной микробиотой из линий Ма, Мн и Мбд в качестве акцепторов микробиоты. Мухи-доноры выращивались на корме Н и содержались до 7-дневного возраста в исходных пробирках с кормом, освоенным мухами из их линии. Далее в линиях мух-доноров были отобраны самки, для маркировки им были отрезаны кончики крыльев. По 20–25 мух-доноров были за четыре дня до тестирования экспериментальных когорт выпущены в боксы для распространения соответствующей микробиоты.
Для получения экспериментальных когорт мух-акцепторов микробиоты, чья ПЖ измерялась в эксперименте, пробирки со стандартным субстратом Н помещались в соответствующие популяционные боксы с линиями Ма, Мн и Мбд на три дня, в течение которых мухи могли откладывать в эти пробирки яйца. Еще через три дня в пробирки были вертикально помещены плашки из плотного картона. После того, как на плашках окуклилось достаточное число личинок (это заняло еще три дня), плашки были перенесены в пробирки с кормом Н с добавлением фунгицидного препарата нистатина и антибиотика сульфадиметоксина, что должно было затормозить развитие микробиоты на корме в то время, пока мухи завершают метаморфоз и выходят из куколок. Такая процедура потребовалась, чтобы минимизировать контакт выплаживающихся мух с субстратами, заселенными микробами, и, таким образом, получить мух с сильно обедненной микробиотой.
В течение трех дней после выхода из куколки первого имаго мухи накапливались в пробирке в нужном количестве для эксперимента, далее были отобраны только самки. Они помещались в заранее приготовленные и засеянные микробиотой (с помощью мух-доноров) боксы для тестирования по 100–110 особей.
В тестировании использовалось семь боксов: когорта самок Ма с обедненной микробиотой и самки с обрезанными крыльями, распространяющие микробиоту Ма (Ма/Ма), аналогично Мбд/Ма, Мн/Ма, Ма/Мн, Мбд/Мн, Мн/Мн и Мбд/Мбд. Вариант Мбд/Мбд – контроль, в качестве мух-доноров использовались мухи из популяционного бокса.
Корм Н подавался в двух чашках Петри диаметром 35 мм и высотой 7 мм, каждые два дня из бокса вынималась чашка с четырехдневным кормом и заменялась на новую, чтобы постоянно поддерживать источник микробиоты в боксе. Поилка заменялась каждые две недели. Подсчет умерших мух проводился ежедневно вплоть до гибели последней мухи. С помощью бинокуляра определялось состояние крыльев и, соответственно, устанавливалось, умерла ли тестируемая муха-акцептор или муха-донор. Для дальнейшего анализа использовались только данные по мухам-акцепторам (ПЖ мух, которые были донорами микробиоты, не анализировалась).
5. Статистическая обработка данных
Данные по возрастной динамике смертности представлены в виде кривых выживания – графиков, на которых по горизонтальной оси откладывается возраст имаго (от момента выхода из куколки), а по вертикальной – процент особей, доживших до данного возраста (рис. 1–3). По данным о ПЖ рассчитывали среднюю ПЖ, медианную ПЖ (Me) и ПЖ 25, 75 и 95% мух в когорте (Q1, Q3 и Qmax соответственно, так как ПЖ 95% мух в когорте нередко используют в качестве оценки максимальной ПЖ), а также стандартное отклонение (SD), коэффициент вариации (CV) и квартильный коэффициент вариации (quartile coefficient of dispersion, QCD) ((Q3 – Q1)/2Me) × 100% (Francis, 2008) в каждой из подопытных линий, для каждого из полов в отдельности.
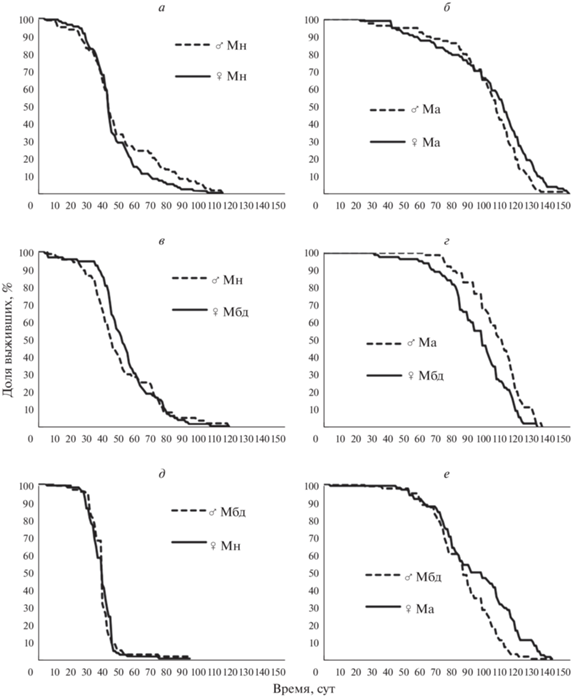
Рис. 1.
Кривые выживания для самцов (а) и самок (б) из линий Ма и Мн из предварительного эксперимента.
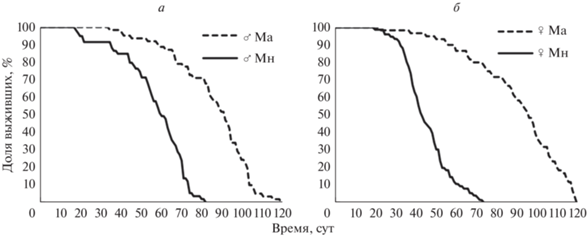
Рис. 3.
Кривые выживания самок из линий Мн (а), Ма (б) и Мбд (в), живущих в присутствии микробиоты Мн, Ма и Мбд.
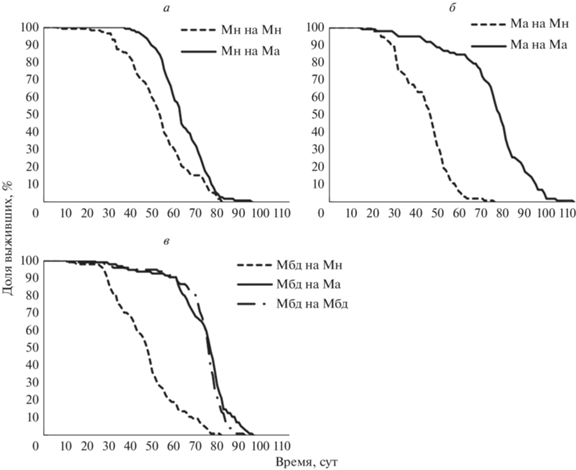
Таблица 1.
Параметры жизненного цикла когорт мух из предварительного эксперимента
| Показатель, сут | ♂Ма♀Ма | ♂Мн♀Мн | ||
|---|---|---|---|---|
| ♂ | ♀ | ♂ | ♀ | |
| Средняя ПЖ | 87.2 | 92.5 | 58.0 | 46.3 |
| SD | 19.3 | 23.1 | 16.2 | 11.8 |
| CV | 22.1 | 25.0 | 28.0 | 25.6 |
| Q1 | 75 | 78.5 | 50.5 | 38 |
| Me | 93 | 98 | 61 | 44 |
| Q3 | 101 | 109.3 | 71 | 53 |
| Qmax | 108 | 121 | 75.2 | 68.5 |
| QCD | 14.0 | 15.7 | 16.8 | 17.0 |
Таблица 2.
Параметры жизненного цикла 12 когорт мух, тестируемых на совместное проживание
| Показатель, сут | ♂Мн♀Мн | ♂Мн♀Мбд | ♂Мбд♀Мн | ♂Ма♀Ма | ♂Ма♀Мбд | ♂Мбд♀Ма | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | |
| Средняя ПЖ | 50.8 | 47.0 | 51.3 | 54.7 | 39.8 | 39.1 | 103.9 | 106.1 | 109.0 | 97.6 | 87.8 | 95.8 |
| SD | 24.2 | 17.2 | 22.2 | 18.7 | 9.7 | 8.4 | 24.8 | 29.1 | 17.2 | 20.9 | 20.0 | 26.4 |
| CV | 47.6 | 36.6 | 43.2 | 34.1 | 24.3 | 21.4 | 23.8 | 27.4 | 15.8 | 21.5 | 22.8 | 27.6 |
| Q1 | 37.5 | 38 | 37.75 | 45 | 36 | 35 | 94.5 | 91.5 | 100 | 85.5 | 75.5 | 77 |
| Me | 44 | 44 | 46 | 53 | 40 | 40 | 109 | 114 | 113 | 100 | 88 | 93 |
| Q3 | 60.5 | 55 | 66.5 | 63.8 | 42.8 | 44 | 121 | 125.8 | 121 | 113.5 | 103.5 | 118 |
| Qmax | 101.2 | 81 | 86 | 85.3 | 50.5 | 47 | 132.1 | 141 | 134 | 124.8 | 116.3 | 135 |
| QCD | 26.1 | 19.3 | 31.3 | 17.7 | 8.4 | 11.3 | 12.2 | 15.0 | 9.3 | 14.0 | 15.9 | 22.0 |
Таблица 3.
Проверка значимости различий по ПЖ в когортах мух, тестируемых на совместное проживание
| № сравнения | Пары для сравнения | Медианная ПЖ, сут | p-value | Значимость различий по ПЖ на 5% уровне значимости |
|---|---|---|---|---|
| Различия по ПЖ мух в линиях Мн и Ма (как в предварительном эксперименте) | ||||
| 1 | ♂Мн, жившие с ♀Мн/ ♂Мa, жившие с ♀Ма |
44/109 | $ \ll $0.001 | Да |
| 2 | ♀Мн, жившие с ♂Мн/ ♀Мa, жившие с ♂Ма | 44/114 | $ \ll $0.001 | Да |
| Сопоставление ПЖ разнополых когорт, тестируемых вместе (исходные данные) | ||||
| 3 | ♂Мн♀Мн | 44/44 | 0.138 | Нет |
| 4 | ♂Мн♀Мбд | 46/53 | 0.450 | Нет |
| 5 | ♂Мбд♀Мн | 40/40 | 0.953 | Нет |
| 6 | ♂Мa♀Мa | 109/114 | 0.060 | Нет |
| 7 | ♂Ма♀Мбд | 113/100 | 0.006 | Да |
| 8 | ♂Мбд♀Ма | 88/93 | $ \ll $0.001 | Да |
| Влияние на ПЖ социальных факторов (совместного проживания с мухами из своей или чужой линии) | ||||
| 9 | ♂Мн, жившие с ♀Мн/ ♂Мн, жившие с ♀Мбд | 44/46 | 1 | Нет |
| 10 | ♀Мн, жившие с ♂Мн/ ♀Мн, жившие с ♂Мбд | 44/40 | <0.001 | Да |
| 11 | ♂Мa, жившие с ♀Мa/ ♂Мa, жившие с ♀Мбд | 109/113 | 0.450 | Нет |
| 12 | ♀Мa, жившие с ♂Мa/ ♀Мa, жившие с ♂Мбд | 114/93 | 0.005 | Да |
| Влияние мух-сожителей на ПЖ мух из линии Мбд | ||||
| 13 | ♂Мбд, жившие с ♀Мн/ ♂Мбд, жившие с ♀Ма | 40/88 | $ \ll $0.001 | Да |
| 14 | ♀Мбд, жившие с ♂Мн/ ♀Мбд, жившие с ♂Мa | 53/100 | $ \ll $0.001 | Да |
| Сопоставление ПЖ мух из линий Мн и Ма, живущих с мухами из линии Мбд | ||||
| 15 | ♂Мн, жившие с ♀Мбд/ ♂Мa, жившие с ♀Мбд | 46/113 | $ \ll $0.001 | Да |
| 16 | ♀Мн, жившие с ♂Мбд/ ♀Мa, жившие с ♂Мбд | 40/93 | $ \ll $0.001 | Да |
| Сопоставление ПЖ мух из линий Мбд и Ма | ||||
| 17 | ♂Мa, жившие с ♀Мбд/ ♂Мбд, жившие с ♀Ма | 113/88 | $ \ll $0.001 | Да |
| 18 | ♀Ма, жившие с ♂Мбд/ ♀Мбд, жившие с ♂Ма | 93/100 | 0.450 | Нет |
Сопоставление кривых выживания проводили на основе логарифмического рангового критерия (log-rank test, для краткости таже будем называть его логранговым критерием) – статистического метода для оценки различий по уровню выживаемости в двух и более независимых группах организмов. Логранговый критерий – непараметрический, а значит, не подразумевает никаких предпосылок о распределении данных, поэтому нормальное распределение данных не требуется и не проверялось. Кроме того, критерий является ранговым, в связи с этим некорректно на его основании говорить, что в изучаемых когортах различается (или не различается) средняя или медианная ПЖ, правильнее делать вывод в целом, различается ли ПЖ в двух когортах. Выживаемость особей в когорте изображается с помощью кривых выживания (см. выше), поэтому критерий можно интерпретировать как способ сравнения кривых выживания (Peto et al., 1977; Clark et al., 2003). В случае множественных сравнений (Multiple comparisons problem) результаты логрангового критерия были скорректированы путем введения поправки Бенджамини–Хохберга (Benjamini, Hochberg, 1995; R Core Team, 2015). Результаты попарных сравнений и p-уровень значимости представлены далее в таблицах, значимыми считались отличия при скорректированном р-значении меньше 5%.
Таблица 4.
Параметры жизненного цикла семи когорт самок, живущих в присутствии различной микробиоты
| Показатель, сут | Вариант теста (линия/микробиота) | ||||||
|---|---|---|---|---|---|---|---|
| Ма/Ма | Мбд/Ма | Мн/Ма | Ма/Мн | Мбд/Мн | Мн/Мн | Мбд/Мбд | |
| Средняя ПЖ | 76.4 | 73.8 | 64.7 | 44.7 | 47.4 | 54.0 | 73.3 |
| SD | 18.33 | 13.81 | 11.04 | 11.83 | 14.71 | 14.85 | 12.98 |
| CV | 0.24 | 0.19 | 0.17 | 0.26 | 0.31 | 0.28 | 0.18 |
| Q1 | 71 | 67.25 | 57 | 33.5 | 35.25 | 43 | 72 |
| Me | 80 | 77 | 64 | 47 | 48 | 54 | 76 |
| Q3 | 87 | 81 | 73.5 | 53 | 56 | 63 | 79.25 |
| Qmax | 100.2 | 91.35 | 80.7 | 61.45 | 74.35 | 79 | 85 |
| QCD | 10.0 | 8.9 | 12.9 | 20.7 | 21.6 | 18.5 | 4.8 |
Таблица 5.
Проверка значимости различий по ПЖ в когортах самок, живущих в присутствии различной микробиоты
| № сравнения | Пары для сравнения | Медианная ПЖ, сут | p-value | Значимость различий по ПЖ на 5% уровне значимости |
|---|---|---|---|---|
| Сопоставление ПЖ самок разных линий, живущих на своей микробиоте (аналогично предварительному эксперименту) | ||||
| 1 | Ма/Ма–Мн/Мн | 80/54 | $ \ll $0.001 | Да |
| 2 | Ма/Ма–Мбд/Мбд | 80/76 | $ \ll $0.001 | Да |
| 3 | Мн/Мн–Мбд/Мбд | 54/76 | $ \ll $0.001 | Да |
| Сопоставление ПЖ самок в присутствии различной микробиоты | ||||
| 4 | Ма/Ма–Ма/Мн | 80/47 | $ \ll $0.001 | Да |
| 5 | Мн/Ма–Мн/Мн | 64/54 | $ \ll $0.001 | Да |
| 6 | Мбд/Ма–Мбд/Мн | 77/48 | $ \ll $0.001 | Да |
| 7 | Мбд/Ма–Мбд/Мбд | 77/76 | 0.100 | Нет |
| 8 | Мбд/Мн–Мбд/Мбд | 48/76 | $ \ll $0.001 | Да |
| Сопоставление ПЖ самок разных линий, живущих в присутствии микробиоты Ма | ||||
| 9 | Ма/Ма–Мн/Ма | 80/64 | $ \ll $0.001 | Да |
| 10 | Ма/Ма–Мбд/Ма | 80/77 | 0.002 | Да |
| 11 | Мн/Ма–Мбд/Ма | 64/77 | $ \ll $0.001 | Да |
| Сопоставление ПЖ самок разных линий, живущих в присутствии микробиоты Мн | ||||
| 12 | Мн/Мн–Ма/Мн | 54/47 | $ \ll $0.001 | Да |
| 13 | Мн/Мн–Мбд/Мн | 54/48 | 0.002 | Да |
| 14 | Ма/Мн–Мбд/Мн | 47/48 | 0.065 | Нет |
РЕЗУЛЬТАТЫ
1. Предварительный эксперимент по тестированию результатов отбора на позднее размножение. Сопоставление ПЖ мух в контрольной линии (Мн) и линии, отбираемой на позднее размножение (Ма)
В табл. 1 и на рис. 1 приведены параметры жизненного цикла когорт мух из линий Мн и Ма. Медианная ПЖ самок из линии Ма составила 98 сут против 44 сут для самок из линии Мн, для самцов те же показатели составили 93 и 61 сут соответственно. Согласно логранговому тесту, различия по ПЖ между линиями значимы как для самцов, так и для самок (p < 0.001). Поскольку мухи из линии Ма произошли от мух из линии Мн путем отбора на позднее размножение, можно предположить, что значимые различия по ПЖ – результат отбора. Следующие эксперименты призваны прояснить, какие именно факторы повлияли на изменение ПЖ мух в линии Ма.
2. Оценка ПЖ дрозофил в эксперименте на совместное проживание
В табл. 2 и на рис. 2 приведены параметры жизненного цикла когорт мух из линий Мн и Ма, живших с партнерами из своей линии или из чужой для них обеих линии Мбд. В табл. 3 представлены попарные сравнения ПЖ дрозофил из различных вариантов теста.
У мух из линии Мн в зависимости от пола и партнеров медианная ПЖ составила от 40 до 46 сут, у мух Ма – от 93 до 114 сут. Таким образом, мухи из линии Ма прожили в 2–2.5 раза дольше мух из линии Мн, являющейся для них предковой (табл. 2; табл. 3, сравнения 1–2). Данный результат согласуется с результатами предварительного эксперимента (табл. 1). Заметим, что сопоставлять значения ПЖ мух в тестах, проведенных в разное время, не вполне корректно, так как на ПЖ мух могут влиять неконтролируемые абиотические факторы (например, атмосферное давление) – проблема, которая снимается при одновременном тестировании.
Самцы и самки мух из линии Мбд, жившие с линией Мн, имели медианную ПЖ 40 и 53 сут, с линией Ма – 88 и 100 сут. Таким образом, медианная ПЖ одной и той же линии (Мбд) различается в 2–2.5 раза в зависимости от того, с какой из линий мух (Мн или Ма) она сожительствовала (табл. 2). Мухи из линии Мбд при совместном проживании с короткоживущими мухами Мн прожили намного меньше, чем в случае совместного проживания с долгоживущими мухами Ма.
Не наблюдается значимой разницы по ПЖ между самками и самцами ни в линии Мн, ни в линии Ма, когда мухи живут с партнерами из своей линии. Также нет значимых различий по ПЖ между самками и самцами в боксах ♂Мн♀Мбд и ♂Мбд♀Мн, но мухи из линии Ма живут достоверно дольше своих партнеров из линии Мбд в вариантах теста ♂Ма♀Мбд и ♂Мбд♀Ма (табл. 3, сравнения 3–8).
2.1. Влияние социальных факторов: зависит ли ПЖ самцов и самок Ма и Мн от совместного проживания с партнерами из своей или чужой линии?
Чтобы понять, как влияют партнеры противоположного пола на ПЖ тестируемых мух, мы провели попарные сравнения ПЖ для самцов и самок из линий Ма и Мн, живущих с партнерами из своей и чужой линий (в роли чужой линии выступала линия Мбд). Из табл. 3 (сравнения 9–12) видно, что ПЖ самцов из обеих линий мало зависит от того, с самками из какой линии они живут. Однако самки из линий Ма и Мн со своими самцами живут значимо дольше, чем с чужими. Медианная ПЖ самок из линии Мн сократилась на 9% в результате жизни с самцами из линии Мбд (с 44 до 40 сут), а медианная ПЖ самок из линии Ма в тех же условиях сократилась на 18% (со 114 до 93 сут). Таким образом, жизнь с чужими самцами сокращает продолжительность жизни самок, в то время как сожительство с чужими самками не влияет значимо на ПЖ самцов.
2.2. Влияние микробиоты: зависит ли ПЖ мух из линии Мбд от того, с какой из двух других линий (Ма или Мн) они проживают вместе?
Микробиота у дрозофил передается как вертикально (от родителей к потомкам), так и горизонтально. Происходит это через субстрат, на котором питаются мухи и на который они откладывают яйца. Логично предположить, что если мухи из разных линий живут вместе, то их микробиота смешивается. Из табл. 3 (сравнения 13–14) видно, что самцы из бокса ♂Мбд♀Мн живут в 2.2 раза меньше, чем самцы из бокса ♂Мбд♀Ма (40 сут против 88 сут). Как отмечалось выше, поведение самок вряд ли сильно влияет на ПЖ самцов, поэтому наблюдаемый эффект логичнее отнести на счет микробиоты. Та же закономерность верна и для самок Мбд: ПЖ самок Мбд, живущих с самцами Мн, почти в 2 раза меньше, чем ПЖ самок Мбд, живущих с самцами Ма (53 против 100 сут). Хотя поведение самцов может влиять на ПЖ самок, в данном случае, вероятнее всего, ведущую роль играют микробиотические факторы.
Эти результаты согласуются с предположением о том, что либо микробиота Мн сокращает ПЖ мух, либо микробиота Ма – продлевает ее (для выбора одного из этих вариантов нужны дополнительные данные). Получается, что мухи из линии Мбд как бы перенимают ПЖ у мух из линии, с которой живут – ПЖ оказалась “заразным” признаком. Однако микробиота Мбд, скорее всего, не влияет на ПЖ дрозофил, поскольку ПЖ самцов Мн в присутствии своих самок и самок Мбд различается не значимо (сравнение 9); так же и ПЖ самцов Ма в присутствии своих самок и самок Мбд различается не значимо (сравнение 11).
2.3. Вклад генетических изменений, обусловленных отбором на долголетие, в продление жизни мух из линии Ма
Сравнения 1 и 2 в табл. 3 (как и результаты предварительного эксперимента, табл. 1) свидетельствуют о наличии значимых различий по ПЖ между самцами линий Ма и Мн и между самками линий Ма и Мн. Чтобы исключить влияние поведения и микробиоты полового партнера на ПЖ мух, сравним ПЖ самцов Мн и Ма, живущих с самками Мбд (исключено возможное влияние самок на ПЖ самцов) и ПЖ самок Мн и Ма, живущих с самцами Мбд (исключено возможное влияние различий микробиоты, полового поведения и состава семенной жидкости самцов на ПЖ самок) (сравнения 15–16 в табл. 3). Различия также остаются значимыми. Безусловно, такие сравнения не позволяют исключить влияние собственной микробиоты на ПЖ тестируемых мух в данной постановке эксперимента, а выше мы показали, что влияние микробиоты в линиях Мн и Ма на ПЖ может быть весьма значительным.
Сопоставим ПЖ самцов Мбд и Ма и самок из тех же линий при проживании с партнерами из другой линии (сравнения 17–18 из табл. 3). Самцы Ма живут значимо дольше самцов Мбд (на 28%). У самок ПЖ отличается не значимо (медианная ПЖ самок Ма на 7% меньше, чем у Мбд), но в этом случае не исключено влияние самцов на ПЖ самок, так как результаты из табл. 3 позволяют предположить, что жизнь с чужими самцами сокращает жизнь самкам Ма, что мешает оценить вклад генетического фактора в результаты отбора на долголетие.
Таким образом, ответ на поставленный в заголовке параграфа вопрос – мы не можем сделать однозначный вывод о роли генетического фактора, исходя из дизайна эксперимента, так как влияние различных факторов переплетено. Однако можем заключить, что эффект вряд ли является сильным, в противном случае мы бы наблюдали превышение ПЖ мух из линии Ма во всех вариантах тестов, а это не так (сравнение 18 из табл. 3).
Выделить в чистом виде эффект генетического фактора (и показать, что он не может полностью объяснить увеличение ПЖ мух в линии Ма) без влияния социальных и микробиотических факторов затруднительно, поэтому мы пошли другим путем. Мы поставили цель оценить вклад микробиотического фактора в наблюдаемое увеличение ПЖ мух Ма (по сравнению с предковой линией Мн), произошедшее в результате отбора на долголетие. Для этого мы протестировали на ПЖ самок дрозофил с обедненной собственной микробиотой в присутствии микробиоты из разных линий мух.
Подтверждение значимого вклада микробиоты в изменения ПЖ в эксперименте важно для эволюционной биологии, поскольку означало бы, что эволюционные изменения могут происходить не только за счет изменения частот аллелей в генофонде подопытной популяции макроорганизмов, да и рассматривать особь без ее микробиома в качестве единицы отбора может быть некорректно.
3. Эксперимент на самках: сопоставление ПЖ самок с обедненной собственной микробиотой в присутствии микробиоты дрозофил из разных линий
Результаты эксперимента на самках отражены на рис. 3 и в табл. 4 и 5.
Как и в двух предыдущих экспериментах (предварительном эксперименте и эксперименте на совместное проживание), самки мух из линии Ма прожили значимо дольше самок из линии Мн (табл. 5, сравнение 1). ПЖ самок Мбд немного (на 5%) ниже ПЖ самок Ма и на 41% выше ПЖ самок Мн, различия в обоих случаях статистически значимы (сравнения 2–3).
3.1. Различия ПЖ самок в присутствии микробиоты из разных линий мух
ПЖ самок Ма на своей микробиоте Ма на 70% выше, чем в присутствии микробиоты Мн (80 сут против 47 сут, различия значимы). ПЖ самок Мн на микробиоте Ма почти на 18% выше, чем в присутствии своей микробиоты Мн (64 сут против 54 сут, различия значимы). Присутствие разной микробиоты значимо влияет также и на ПЖ мух Мбд (p $ \ll $ 0.001). Самки Мбд на микробиоте Ма и Мбд живут значимо дольше, чем в присутствии микробиоты Мн (76 и 77 сут против 48 сут соответственно). Различия по ПЖ самок Мбд на микробиоте Ма и Мбд незначимы (сравнения 4–8 в табл. 5).
Таким образом, микробиота Мн сокращает ПЖ мух из всех трех линий, в том числе и мух из “своей” линии Мн. При переходе со своей микробиоты на микробиоту Ма мухи Мн живут значимо дольше, а ПЖ самок Мбд не отличается на своей микробиоте (Мбд) и микробиоте Ма, из чего можно заключить, что микробиота Ма сама по себе не продлевает жизнь, а рост ПЖ самок Мн при их переходе с микробиоты Мн на микробиоту Ма объясняется частичным снятием негативного влияния микробиоты Мн на ПЖ.
3.2. Сравнение ПЖ самок из разных линий в присутствии той же микробиоты
Согласно логранговому критерию, ПЖ самок из разных линий значимо отличается в присутствии той же микробиоты (p $ \ll $ 0.001 как для микробиоты Ма, так и для микробиоты Мн). Иными словами, различия по ПЖ объясняются не только привнесенной микробиотой, но и особенностями мух каждой линии, включая в том числе и остаточную собственную микробиоту (напомним, что у мух из тестируемых когорт “своя” микробиота была обеднена, а экспериментальные боксы засеивались микробиотой мух-доноров).
В присутствии микробиоты Ма ПЖ самок всех трех линий значимо различается (сравнения 9–11 в табл. 5). Поскольку тестировались только самки, было исключено влияние самцов на ПЖ самок; мухи для тестирования выводились при сопоставимой плотности личинок (минимизация влияния социальных факторов). Мы рассматриваем ПЖ мух на одинаковой микробиоте, а влияние микробиоты Ма на ПЖ мух не подтвердилось (см. п. 3.1.). Из этого следует, что различия по ПЖ самок, тестируемых в присутствии микробиоты Ма, по-видимому, обусловлены в основном генетическим фактором, а также остаточной собственной микробиотой самок. Дольше всех, 80 сут, живут самки из линии Ма, подвергшейся отбору на позднее размножение. Самки Мбд живут 77 сут, что значимо меньше, чем ПЖ самок Ма, однако по абсолютному значению различия невелики (4%). Линия Мбд не отбиралась на позднее размножение, но содержалась на корме с антигрибным препаратом, что должно было повлиять на состав микробиоты. Самки Мн живут 64 сут, что на 20% меньше, чем ПЖ самок в линии Ма. Негативное влияние микробиоты Мн статистически обосновано в п. 3.1. Обобщая описанные факты, значимые различия по ПЖ между самками линий Ма и Мбд при выращивании в присутствии привнесенной микробиоты Ма можно интерпретировать как слабый, но все-таки значимый вклад генов в результаты отбора на позднее размножение, а значимые различия по ПЖ между самками Мбд и Мн означают значительный вклад микробиотического фактора в эволюцию ПЖ мух.
В присутствии микробиоты Мн ПЖ самок Мн значимо выше, чем самок Ма и Мбд, 54 сут против 47 и 48 соответственно (или на 13 и 15% соответственно). ПЖ самок Ма и Мбд в присутствии микробиоты Мн различается незначимо (сравнения 12–14 в табл. 5). Можно предположить, что мухи Мн, хоть и обладают относительно низкой ПЖ, но негативный эффект их микробиоты на ПЖ частично скомпенсирован приспособленностью мух к ней. Тогда как негативный эффект микробиоты Мн на ПЖ мух, к этой микробиоте неприспособленных, настолько ощутим, что небольшие различия по ПЖ между самками Ма и Мбд, обусловленные генетически, полностью нивелируются в ее присутствии.
ОБСУЖДЕНИЕ
Во всех трех экспериментах ПЖ мух из линии Ма, отбираемой на позднее размножение, оказалась намного больше, чем ПЖ мух из линии Мн, являющейся предковой к Ма и не подвергавшейся искусственному отбору (табл. 1; табл. 3, сравнение 1–2; табл. 5, сравнение 1). По умолчанию считается, что изменение признака, находящегося под отбором, происходит за счет роста частоты аллелей, связанных с предпочитаемым фенотипическим проявлением данного признака. Однако, сопоставляя ПЖ трех родственных лабораторных линий дрозофил в разных ситуациях, мы постарались показать, что увеличение ПЖ мух в линии, находящейся под отбором, нельзя объяснить только генетическими факторами. На такой сложный признак, как ПЖ, очевидно, влияют и другие факторы. Вклад некоторых из них в изменение ПЖ мы протестировали.
1. Социальные факторы (связанные с половым поведением). В ряде исследований показано, что агрессивные ухаживания и конкуренция между самцами негативно сказываются на ПЖ самок (Carazo et al., 2014). В состав семенной жидкости самцов входят вещества, влияющие на физиологию и поведение самок, делая их менее привлекательными для других самцов и менее склонными к повторному спариванию, причем эти вещества могут негативно сказываться на здоровье самок (Sirot et al., 2011; Billeter et al., 2018). По-видимому, именно по этим причинам мы наблюдаем значимое сокращение медианной продолжительности жизни самок из линии Мн (на 9%) и самок из линии Ма (на 18%) при совместном проживании с самцами из чужой для них линии (Мбд). Тот факт, что именно половое поведение самцов (а не, например, микробиота мух Мбд) повлияло на ПЖ самок, подтверждается тем, что сожительство самцов как из линии Мн, так и из линии Ма с чужими самками из линии Мбд не привело к значимому изменению ПЖ самцов (табл. 3, сравнения 9 и 11).
Можно предположить, что сокращение ПЖ самок в обеих тестируемых линиях, живших с самцами Мбд, связано с большей активностью самцов Мбд по сравнению с самцами Ма и Мн. Линия Мбд содержится на корме с антигрибным препаратом и характеризуется обедненным дрожжевым микробиомом. Известно, что самки, живущие на среде с обедненной микробиотой, откладывают меньше яиц (Gould et al., 2018), поэтому самцам в линии Мбд может быть особенно выгодно проявлять бóльшую активность, чтобы спариться с бóльшим числом самок и оставить больше потомства. С другой стороны, ПЖ самок в результате жизни с чужими партнерами, вне зависимости от их активности, может сокращаться по той причине, что самки не адаптированы к вредным веществам, содержащимся в семенной жидкости самцов (тогда как негативный эффект от веществ, содержащихся в семенной жидкости самцов из своей линии, сглаживается выработавшимися защитными адаптациями).
2. Микробиологические факторы, оказалось, могут играть очень важную роль в формировании различий по ПЖ между линиями. В пользу этого свидетельствуют результаты эксперимента на совместное проживание и эксперимента на самках.
В эксперименте на совместное проживание нам удалось показать, что ПЖ – “заразный” признак: мухи Мбд не обладают микробиотой, влияющей на ПЖ мух Ма и Мбд, но ПЖ самок и самцов Мбд различается двукратно в зависимости от того, принадлежат ли их партнеры к линии Ма или линии Мн. Это можно объяснить тем, что либо мухи Мн “заражают” своих партнеров склонностью к короткой жизни, либо, наоборот, мухи Ма обладают “заразным” долголетием. Прояснить ситуацию удалось в последующем эксперименте.
В эксперименте на самках, чтобы получить мух с обедненной собственной микробиотой, мы воспользовались тем фактом, что имаго дрозофил приобретают свою микроботу в основном после метаморфоза из субстрата (а не “наследуют” от личинки). Хотя существуют методики получения полностью безмикробных дрозофил, и такие насекомые в принципе жизнеспособны в благоприятных условиях, изучение параметров жизненного цикла, как правило, ведется не на них, а на дрозофилах с микробиотой, обычно не контролируемой (а чаще всего просто игнорируемой) в ходе экспериментов. Отчасти это связано с трудностью строгого контроля микробиоты (или проведения всего эксперимента на безмикробных мухах в стерильных условиях), а отчасти с тем, что безмикробная муха – довольно-таки неестественный модельный объект, в природе не существующий. К тому же, теоретически, отсутствие микробов само по себе может сильно повлиять на то, как другие факторы будут сказываться на изучаемых параметрах жизненного цикла.
В эксперименте на самках удалось показать, что мухи из линий Ма и Мбд живут в присутствии микробиоты Мн значимо меньше, чем в присутствии своей микробиоты. Мухи Мбд в присутствии микробиоты Ма живут столько же, сколько на своей микробиоте. Мухи Мн живут на микробиоте Ма дольше, чем на своей, но на своей микробиоте они живут значимо дольше, чем мухи из двух других линий. Эти факты, по-видимому, означают, во-первых, что микробиота Ма сама по себе жизнь не продлевает, а во-вторых, в микробиоте мух Мн присутствуют компоненты (бактерии или дрожжи), сильно сокращающие жизнь мух, поэтому малая ПЖ мух Мн “заразна”.
Тот факт, что на микробиоте Мн мухи Мн живут дольше, чем мухи других линий, согласуется с предположением о том, что мухи Мн адаптировались к негативному влиянию своей микробиоты. То, что самки Мн на микробиоте Ма живут дольше, чем на микробиоте Мн, вероятно, означает, что эта адаптация неполна и микробиота Мн сокращает жизнь мухам из всех трех линий, включая линию Мн.
Безусловно, тесты, основанные на горизонтальной передаче микробиоты от одних мух к другим, не лишены недостатков: с их помощью мы пока не можем сказать, какие компоненты микробиома мух Мн приводят к сокращению ПЖ и как они действуют. Поэтому необходим поиск дополнительных методических подходов к изучению вклада микробиоты в формирование параметров жизненного цикла на модельных организмах.
3. Генетические факторы. Результаты эксперимента на совместное проживание показывают, что трудно отделить влияние генетического фактора от вклада микробиоты в наблюдаемые различия по ПЖ мух из линий Мн и Ма. Влияние генетического фактора можно было бы считать достоверно ненулевым, если бы мухи из линии Ма имели повышенную ПЖ по сравнению с обеими линиями, не подвергавшимися искусственному отбору (Мн и Мбд). Мы наблюдаем значительное (до 2.5 раз) превышение ПЖ мух из линии Ма над ПЖ мух из линии Мн, однако сильная изменчивость ПЖ мух Мбд при смене линии сожителей указывает на то, что эти различия в значительной степени объясняются особенностями микробиоты линии Мн (табл. 2, 3).
В табл. 3 сопоставлена ПЖ самцов и самок из линий Мбд и Ма, которые жили с партнерами из противоположной линии (сравнения 17–18). Самцы в линии Ма живут значимо дольше самцов Мбд, причем это, по-видимому, не связано ни с самками, ни с микробиотой. Это согласуется с гипотезой об эффективности отбора на долголетие. Однако ПЖ самок Мбд и Ма (живущих с чужими партнерами) значимо не различается. Это не означает, что отбор на долголетие не был эффективен, а, скорее, указывает на то, что самцы Ма досаждают своими ухаживаниями самкам Мбд меньше, чем самцы Мбд – самкам Ма (и в результате жизнь самок Ма сокращается). Иными словами, результаты, полученные в ходе эксперимента на совместное проживание, не доказывают отсутствия генетической компоненты в наблюдаемом увеличении ПЖ мух линии Ма, а лишь не позволяют вычленить ее в явном виде.
Дизайн эксперимента на самках был в первую очередь ориентирован на то, чтобы выявить роль микробиоты в наблюдаемом изменении ПЖ мух Ма, но после того, как удалось показать, что микробиота Ма не влияет на ПЖ сама по себе, он также позволил сделать выводы о вкладе генетической компоненты в изучаемый процесс. В данном эксперименте удалось дополнить результат предыдущего эксперимента (где показано, что самцы Ма живут значимо дольше самцов Мбд) и подтвердить, что самки Ма тоже живут значимо дольше самок Мбд в сопоставимых условиях (при исключении влияния самцов), хотя различие совсем небольшое по абсолютной величине.
По всей видимости, такое небольшое влияние генетического фактора легко может быть замаскировано влиянием микробиоты. Мы показали, что негативный эффект микробиоты Мн на ПЖ мух, к ней не приспособленных, настолько ощутим, что небольшие различия по ПЖ между самками Ма и Мбд, обусловленные генетически, полностью нивелируются в присутствии этой микробиоты (табл. 5, сравнение 14).
Таким образом, на основе двух последних экспериментов можно заключить, что результаты отбора на долголетие имеют генетическую компоненту, но сила эффекта оказалась невелика. Возможно, это объясняется тем, что в исходной популяции диких дрозофил не было значительного полиморфизма по аллелям, влияющим на ПЖ. Можно предположить, что гены, мутации в которых могут влиять на ПЖ, в природных популяциях находятся под сильным стабилизирующим отбором, т.е. отбор эффективно элиминирует мутации в них, потому что они негативно влияют на приспособленность диких мух. Поэтому у таких генов низкий уровень полиморфизма. В природе мухи, скорее всего, не живут так долго, как в лаборатории, а умирают гораздо раньше от внешних причин. Тем не менее гены, влияющие на ПЖ, могут влиять также и на общую жизнеспособность, что в лабораторных условиях может проявиться, в частности, в замедленном старении и повышенной ПЖ.
Небольшое отличие по ПЖ между мухами Ма и Мбд и значительное увеличение ПЖ мух Мбд по сравнению с предковой линией Мн может быть отчасти объяснено особенностями диеты мух Мбд. Жизнь на субстрате с обедненной дрожжевой микробиотой предполагает ограниченную диету (поскольку белковый компонент диеты дрозофил обеспечивается в основном дрожжами), что продлевает жизнь мухам (Chippindale et al., 1993; Zheng et al., 2005; Tatar et al., 2014; Kapahi et al., 2017; Flatt, 2020). Несмотря на отсутствие искусственного отбора на увеличение ПЖ в линии Мбд, жизнь в условиях обедненного микробиома повышает шансы прожить долгую жизнь, что, согласно гипотезе Уильямса (Williams, 1957), может вести к усилению естественного отбора на долголетие.
Открытыми остаются вопросы, по какой причине и в какой момент линия Мн приобрела микробиоту, сокращающую жизнь, или в какой момент линии, произошедшие от линии Мн, ее утратили. Например, линия Мбд могла утратить часть своей микробиоты в результате содержания на кормовом субстрате с антигрибным препаратом, а линия Ма – в связи с отбором на долголетие, в ходе которого потомки могли “наследовать” микроботу только от старых родителей. Известно, что микробиота дрозофил сильно меняется с возрастом (Erkosar et al., 2013). Можно предположить, что доживают до позднего возраста в основном те мухи, чья микробиота благоприятствует долгой жизни. В этом случае отбор мух на долголетие неизбежно ведет и к отбору соответствующей микробиоты. В дальнейших исследованиях мы изучим состав микробиоты рассматриваемых линий и постараемся выяснить, какие ее компоненты могут влиять на ПЖ и каков может быть механизм такого воздействия.
ВЫВОДЫ
Полученные данные указывают на значительный вклад микробиотического фактора в результаты отбора на увеличение ПЖ дрозофил из линии Ма. Резкое снижение ПЖ разных линий мух в присутствии микробиоты Мн свидетельствует в пользу того, что в микробиоте мух Мн присутствуют компоненты (бактерии или дрожжи), сильно сокращающие жизнь мух. В результате низкая ПЖ мух Мн оказывается “заразным” признаком. Вопрос, какие именно компоненты микробиоты влияют на ПЖ и за счет каких механизмов это происходит, требует дальнейшего исследования.
В увеличении ПЖ мух Ма при отборе на позднее размножение есть генетическая составляющая, однако ее эффект оказался не очень сильным. В определенных ситуациях он легко маскируется другими, более сильными, факторами, например, социальным (самки Ма живут меньше, чем самки Мбд, если проживают с самцами Мбд) или микробиотическим (ПЖ самок Ма и Мбд различается незначимо в присутствии микробиоты Мн).
Таким образом, проведенные эксперименты позволили частично декомпозировать наблюдаемое превышение ПЖ мух Ма, отбираемых на позднее размножение, над ПЖ мух из предковой линии Мн. Мухи Ма живут значимо дольше мух из родственной им линии Мбд (не отбираемых на позднее размножение, но имеющих обедненную микробиоту) за счет генетического фактора, и дольше мух из линии Мн, как за счет генетического, так и за счет микробиотического факторов.
Подтверждено значимое влияние социальных (поведенческих) факторов на наблюдаемые различия по ПЖ. Проживание с чужими самцами значимо сократило ПЖ самок. Сожительство со своими или чужими самками на ПЖ самцов не повлияло.
Из полученных результатов следует важный методологический вывод. В большинстве исследований, связанных с тестированием дрозофил на ПЖ и другие параметры жизненного цикла, микробиота мух игнорируется (или, по крайней мере, никак не контролируется), что может приводить к ошибочным выводам. Влияние микробиоты может быть настолько значительным, что на его фоне становится трудно выделить эффекты других факторов. Так, если бы мы ограничились простым сравнением ПЖ у линий Мн и Ма (а в большинстве исследований опытная (Ма) и контрольная (Мн) линии просто сопоставляются между собой), то пришли бы к ошибочному выводу об очень высоком вкладе генов в формирование признака “продолжительность жизни” в целом и в эффективность отбора на долголетие в частности, и не выявили бы влияние других факторов. Следовательно, в подобных экспериментах необходимо учитывать возможное влияние микробиоты.
Полученные результаты – очередное подтверждение состоятельности хологеномной теории эволюции (Margulis, Fester, 1991; Zilber-Rosenberg, Rosenberg, 2008). Мы показали, что результатом отбора на долголетие могут быть не только изменения на уровне генофонда подопытной популяции макроорганизмов (хотя такие изменения тоже имеют место), но и изменения микробиоты, которые могут существенным образом влиять на наблюдаемые эволюционные изменения признака организма-хозяина, находящегося под отбором (в данном случае таким признаком является ПЖ). Дальнейшее осмысление этого вывода в рамках хологеномной теории эволюции требует ответа на вопрос, как часто и в каких случаях может быть эффективным отбор по признакам макроорганизма, изменчивость которых детерминируется в большей степени микробиотой, чем генотипом макроорганизма.
Список литературы
Бычковская И.Б., Мыльников С.В., Опарина Т., 2017. О дискретности кривых дожития у Drosophila melanogaster линии Canton-S. Сообщение 4. Воздействие пониженной температурой на раннем этапе имагинального развития // Успехи геронтологии. Т. 30. № 3. С. 323–331.
Вайсерман А.М., Загуба Г.О., Писарчук А.В., Кошель Н.М., Козерецкая И.А., Караман А.С., 2017. Влияние повышенной плотности популяции на личиночной стадии развития на продолжительность жизни Drosophila melanogaster // Проблемы старения и долголетия. Т. 26. № 1–2. С. 34–42.
Дмитриева А.С., Ивницкий С.Б., Марков А.В., 2016. Адаптация Drosophila melanogaster к неблагоприятному кормовому субстрату сопровождается расширением трофической ниши // Журн. общ. биологии. Т. 77. № 4. С. 249–261.
Дмитриева А.С., Максимова И.А., Качалкин А.В., Марков А.В., 2021. Возрастные изменения дрожжевой составляющей микробиома Drosophila melanogaster // Микробиология. Т. 90. № 2. С. 226–235.
Марков А.В., Ивницкий С.Б., Корнилова М.Б., Наймарк Е.Б., Широкова Н.Г., Перфильева К.С., 2015. Материнский эффект маскирует адаптацию к неблагоприятным условиям и затрудняет дивергенцию у Drosophila melanogaster // Журн. общ. биологии. Т. 76. № 6. С. 429–437.
Москалев А.А., Шосталь О.А., Зайнуллин В.Г., 2006. Генетические аспекты влияния различных режимов освещения на продолжительность жизни дрозофилы // Успехи геронтологии. № 18. С. 55–58.
Панченко П.Л., Корнилова М.Б., Перфильева К.С., Марков А.В., 2017. Симбиотическая микробиота вносит вклад в адаптацию Drosophila melanogaster к неблагоприятной кормовой среде // Изв. РАН. Сер. биол. № 4. С. 341–351.
Arora J., Brisbin M.A.M., Mikheyev A.S., 2020. Effects of microbial evolution dominate those of experimental host-mediated indirect selection // PeerJ. V. 8. https://doi.org/10.7717/peerj.9350
Baret P.V., Le Bourg E., Lints F.A., 1996. Selection for increased longevity in Drosophila melanogaster: reflections on new data // Gerontology. V. 42. № 1. P. 14–17. https://doi.org/10.1159/000213765
Benjamini Y., Hochberg Y., 1995. Controlling the false discovery rate: A practical and powerful approach to multiple testing // J. Roy. Stat. Soc. Ser. B. V. 57. P. 289–300. https://doi.org/10.1111/j.2517-6161.1995.tb02031.x
Billeter J.C., Wolfner M.F., 2018. Chemical cues that guide female reproduction in Drosophila melanogaster // J. Chem. Ecol. V. 44. P. 750–769. https://doi.org/10.1007/s10886-018-0947-z
Blum J.E., Fischer C.N., Miles J., Handelsman J., 2013. Frequent replenishment sustains the beneficial microbiome of Drosophila melanogaster // mBio. V. 4. № 6. https://doi.org/10.1128/mBio.00860-13
Broderick N.A., Lemaitre B., 2012. Gut-associated microbes of Drosophila melanogaster // Gut Microbes. V. 3. № 4. P. 307–321. https://doi.org/10.4161/gmic.19896
Brummel T., Ching A., Seroude L., Simon A.F., Benzer S., 2004. Drosophila lifespan enhancement by exogenous bacteria // PNAS. V. 101. P. 12974–12979. https://doi.org/10.1073/pnas.0405207101
Carazo P., Tan C.K.W., Allen F., Wigby S., Pizzari T., 2014. Within-group male relatedness reduces harm to females in Drosophila // Nature. V. 505. P. 672–675. https://doi.org/10.1038/nature12949
Chapman T., Liddle L.F., Kalb J.M., Wolfner M.F., Partridge L., 1995. Cost of mating in Drosophila melanogaster females is mediated by male accessory gland products // Nature. V. 373. P. 241–244. https://doi.org/10.1038/373241a0
Chippindale A.K., Leroi A.M., Kim S.B., Rose M.R., 1993. Phenotypic plasticity and selection in Drosophila life-history evolution. I. Nutrition and the cost of reproduction // J. Evol. Biol. V. 6. P. 171–193. https://doi.org/10.1046/j.1420-9101.1993.6020171.x
Clark R.I., Salazar A., Yamada R., Fitz-Gibbon S., Morselli M., et al., 2015. Distinct shifts in microbiota composition during Drosophila aging impair intestinal function and drive mortality // Cell Rep. V. 10. P. 1656–1667. https://doi.org/10.1016/j.celrep.2015.08.004
Clark T.G., Bradburn M.J., Love S.B., Altman D.G., 2003. Survival analysis part I: Basic concepts and first analyses // Br. J. Cancer. V. 89. № 2. P. 232–238. https://doi.org/10.1038/sj.bjc.6601118
Cooper D.M., 1960. Food preferences of larval and adult Drosophila // Evolution. V. 14. P. 41–55. https://doi.org/10.1111/j.1558-5646.1960.tb03055.x
Dmitrieva A.S., Ivnitsky S.B., Maksimova I.A., Panchenko P.L., Kachalkin A.V., Markov A.V., 2019. Yeasts affect tolerance of Drosophila melanogaster to food substrate with high NaCl concentration // PLoS One. № 11. https://doi.org/10.1371/journal.pone.0224811
Douglas A.E., 2018. The Drosophila model for microbiome research // Lab Anim. V. 47. P. 157–164. https://doi.org/10.1038/s41684-018-0065-0
Erkosar B., Storelli G., Defaye A., Leulier F., 2013. Host-intestinal microbiota mutualism: “Learning on the fly” // Cell Host Microbe. V. 13. P. 8–14. https://doi.org/10.1016/j.chom.2012.12.004
Flatt T., 2020. Life-history evolution and the genetics of fitness components in Drosophila melanogaster // Genetics. V. 214. № 1. P. 3–48. https://doi.org/10.1534/genetics.119.300160
Francis A., 2008. Business Mathematics and Statistics. 6th ed. L.: Cengage learning EMEA. 666 p.
Friberg U., 2005. Genetic variation in male and female reproductive characters associated with sexual conflict in Drosophila melanogaster // Behav. Genet. V. 35. P. 455–462. https://doi.org/10.1007/s10519-004-1246-8
Gáliková M., Klepsatel P., 2018. Obesity and aging in the Drosophila model // Int. J. Mol. Sci. V. 19. № 7. https://doi.org/10.3390/ijms19071896
Gorshkova A.A., Fetisova E.S., Yakovleva E.U., Naimark E.B., Markov A.V., 2019. Impact of spatial heterogeneity on Drosophila melanogaster adaptation to unfavorable food media: The results of an experimental evolution study // Biol. Bull. Rev. V. 9. № 1. P. 29–41. https://doi.org/10.1134%2FS207908641901002X
Gould A.L., Zhang V., Lamberti L., Jones E.W., Obadia B. et al., 2018. Microbiome interactions shape host fitness // PNAS. V. 115. № 51. P. E11951–E11960. https://doi.org/10.1073/pnas.1809349115
He Y., Jasper H., 2014. Studying aging in Drosophila // Methods. V. 68. № 1. P. 129–133. https://doi.org/10.1016/j.ymeth.2014.04.008
Kapahi P., Kaeberlein M., Hansen M., 2017. Dietary restriction and lifespan: Lessons from invertebrate models // Ageing Res. Rev. V. 39. P. 3–14. https://doi.org/10.1016/j.arr.2016.12.005
Leftwich P.T., Hutchings M.I., Chapman T., 2018. Diet, gut microbes and host mate choice: Understanding the significance of microbiome effects on host mate choice requires a case by case evaluation // BioEssays. V. 40. № 12. https://doi.org/10.1002/bies.201800053
Luckinbill L.S., Clare M.J., 1985. Selection for life span in Drosophila melanogaster // Heredity. V. 55. P. 9–19. https://doi.org/10.1038/hdy.1985.66
Luckinbill L.S., Arking R., Clare M.J., Cirocco W.C., Buck S.A., 1984. Selection for delayed senescence in Drosophila melanogaster // Evolution. V. 38. P. 996–1003. https://doi.org/10.1111/j.1558-5646.1984.tb00369.x
Margulis L., Fester R., 1991. Symbiosis as a Source of Evolutionary Innovation: Speciation and Morphogenesis. Boston: MIT Press. 454 p.
Markov A.V., Lazebny O.E., Goryacheva I.I., Antipin M.I., Kulikov A.M., 2009. Symbiotic bacteria affect mating choice in Drosophila melanogaster // Anim. Behav. V. 77. P. 1011–1017. https://doi.org/10.1016/j.anbehav.2009.01.011
Martino M.E., Ma D., Leulier F., 2017. Microbial influence on Drosophila biology // Curr. Opin. Microbiol. V. 38. P. 165–170. https://doi.org/10.1016/j.mib.2017.06.004
Maynard C., Weinkove D., 2018. The gut microbiota and ageing // Subcell. Biochem. V. 90. P. 351–371. https://doi.org/10.1007/978-981-13-2835-0_12
Miller R.S., Thomas J.L., 1958. The effects of larval crowding and body size on the longevity of adult Drosophila melanogaster // Ecology. V. 39. № 1. P. 118–125. https://doi.org/10.2307/1929973
Miquel J., Lundgren P.R., Bensch K.G., Atlan H., 1976. Effects of temperature on the life span, vitality and fine structure of Drosophila melanogaster // Mech. Ageing Dev. V. 5. № 5. P. 347–370. https://doi.org/10.1016/0047-6374(76)90034-8
Mousseau T.A., Uller T., Wapstra E., Badyaev A.V., 2009. Evolution of maternal effects: past and present // Philos. Trans. R. Soc. B. V. 364. P. 1035–1038. https://doi.org/10.1098/rstb.2008.0303
Partridge L., Prowse N., Pignatelli P., 1999. Another set of responses and correlated responses to selection on age at reproduction in Drosophila melanogaster // Proc. R. Soc. Lond. B Biol. Sci. V. 266. P. 255–261. https://doi.org/10.1098/rspb.1999.0630
Pearl R., Parker S.L., 1922. Experimental studies on the duration of life. II. Hereditary differences in duration of life in line-breed strains of Drosophila // Am. Nat. V. 56. P. 174–187. https://doi.org/10.1086/279857
Peto R., Pike M.C., Armitage P., Breslow N.E., Cox D.R., et al., 1977. Design and analysis of randomized clinical trials requiring prolonged observation of each patient. II. Analysis and examples // Br. J. Cancer. V. 35. P. 1–39. https://doi.org/10.1038/bjc.1976.220
Piper M., Partridge L., 2018. Drosophila as a model for ageing // Biochim. Biophys. Acta. Mol. Basis Dis. V. 1864. № 9A. P. 2707–2717. https://doi.org/10.1016/j.bbadis.2017.09.016
R Core Team, 2015. R: A language and environment for statistical computing, R Foundation for Statistical Computing, Vienna, Austria. https://www.r-project.org/
Ridley E., Wong A., Westmiller S., Douglas A., 2012. Impact of the resident microbiota on the nutritional phenotype of Drosophila melanogaster // PLoS One. V. 7. https://doi.org/10.1371/journal.pone.0036765
Rose M., 1984. Laboratory evolution of postponed senescence in Drosophila melanogaster // Evolution. V. 5. P. 1004–1010. https://doi.org/10.2307/2408434
Rose M.R., Charlesworth B., 1981a. Genetics of life history in Drosophila melanogaster. I. Sib analysis of adult females // Genetics. V. 97. P. 173–186. https://doi.org/10.1093/genetics/97.1.187
Rose M.R., Charlesworth B., 1981b. Genetics of life history in Drosophila melanogaster. II. Exploratory selection experiments // Genetics. V. 97. P. 187–196. https://doi.org/10.1093/genetics/97.1.187
Ryu J.H., Ha E.M., Lee W.J., 2010. Innate immunity and gut-microbe mutualism in Drosophila // Devel. Compar. Immun. V. 4. P. 369–376. https://doi.org/10.1016/j.dci.2009.11.010
Schretter C.E., Vielmetter J., Bartos I., Marka Z., Marka S., et al., 2018. A gut microbial factor modulates locomotor behaviour in Drosophila // Nature. V. 563. P. 402–406. https://doi.org/10.1038/s41586-018-0634-9
Service P.M., Fales A.J., 1993. Evolution of delayed reproductive senescence in male fruit flies: sperm competition // Genetica. V. 91. № 1–3. P. 111–125. https://doi.org/10.1007/BF01435992
Sharon G., Segal D., Ringo J.M., Hefetz A., Zilber-Rosenberg I., Rosenberg E., 2010. Commensal bacteria play a role in mating preference of Drosophila melanogaster // PNAS. V. 107. P. 20051–20056. https://doi.org/10.1073/pnas.1009906107
Shenoi V.N., Ali S.Z., Prasad N.G., 2016. Evolution of increased adult longevity in Drosophila melanogaster populations selected for adaptation to larval crowding // J. Evol. Biol. V. 29. № 2. P. 407–417. https://doi.org/10.1111/jeb.12795
Sirot L.K., Wolfner M.F., Wigby S., 2011. Protein-specific manipulation of ejaculate composition in response to female mating status in Drosophila melanogaster // PNAS. V. 108. P. 9922–9926. https://doi.org/10.1073/pnas.1100905108
Stearns S.C., Ackermann M., Doebeli M., Kaiser M., 2000. Experimental evolution of aging, growth, and reproduction in fruitflies // PNAS. V. 97. № 7. P. 3309–3313. https://doi.org/10.1073/pnas.97.7.3309
Stergiopoulos K., Cabrero P., Davies S.A., Dow J.A., 2009. Salty dog, an SLC5 symporter, modulates Drosophila response to salt stress // Physiol. Genomics. V. 37. P. 1–11. https://doi.org/10.1152/physiolgenomics.90360.2008
Tatar M., Post S., Yu K., 2014. Nutrient control of Drosophila longevity // Trends Endocrinol. Metab. V. 25. № 10. P. 509–517.
Te Velde J.H., Molthoff C.F.M., Scharloo W., 1988. The function of anal papillae in salt adaptation of Drosophila melanogaster larvae // J. Evol. Biol. V. 1. № 2. P. 139–153. https://doi.org/10.1046/j.1420-9101.1988.1020139.x
Trinder M., Daisley B.A., Dube J.S., Reid G., 2017. Drosophila melanogaster as a high-throughput model for host–microbiota interactions // Front. Microbiol. V. 8. https://doi.org/10.3389/fmicb.2017.00751
Walters A.W., Matthews M.K., Hughes R.C., Malcolm J., Rudman S. et al., 2020. The microbiota influences the Drosophila melanogaster life history strategy // Mol. Ecol. V. 29. № 3. P. 639–953. https://doi.org/10.1111/mec.15344
Williams G.C., 1957. Pleiotropy, natural selection, and the evolution of senescence // Evolution. V. 11. P. 398–411. https://doi.org/10.1126/sageke.2001.1.cp13
Yakovleva E.U., Naimark E.B., Markov A.V., 2016. Adaptation of Drosophila melanogaster to unfavorable growth medium affects lifespan and age-related fecundity // Biochemistry (Moscow). V. 81. № 12. P. 1445–1460. https://doi.org/10.1134/S0006297916120063
Zheng J., Mutcherson R., Helfand S.L., 2005. Calorie restriction delays lipid oxidative damage in Drosophila melanogaster // Aging Cell. V. 4. № 4. P. 209–216. https://doi.org/10.1111/j.1474-9726.2005.00159.x
Zilber-Rosenberg I., Rosenberg E., 2008. Role of microorganisms in the evolution of animals and plants: The hologenome theory of evolution // FEMS Microbiol. Rev. V. 32. P. 723–735. https://doi.org/10.1111/j.1574-6976.2008.00123.x
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии