Журнал общей биологии, 2022, T. 83, № 3, стр. 208-219
Поведенческое и генетическое обособление городской популяции кряквы (Anas platyrhynchos) в центральной России: миф или реальность?
К. В. Авилова 1, *, В. А. Скобеева 1, И. В. Артюшин 1, Т. Б. Голубева 1, С. Ю. Фокин 2
1 Московский государственный университет им. М.В. Ломоносова, биологический факультет
119234 Москва, Ленинские горы, 1, Россия
2 Русское общество сохранения и изучения птиц (РОСИП)
109052 Москва, Нижегородская ул., 70, стр. 1, Россия
* E-mail: wildlife@inbox.ru
Поступила в редакцию 13.01.2022
После доработки 27.02.2022
Принята к публикации 05.03.2022
- EDN: EJUILG
- DOI: 10.31857/S0044459622030034
Аннотация
Анализировали поведенческие и генетические особенности городской группировки крякв Московского зоопарка в сравнении с птицами из природных популяций Московской и Владимирской областей. Были поставлены следующие вопросы: а) есть ли отличия в поведении крякв в городе и в природной среде обитания? б) есть ли генетические отличия крякв Московского зоопарка и природной популяции Владимирской области? Определяли дистанцию вспугивания и предпочитаемую дистанцию по отношению к человеку в Москве и Московской области. Дистанции вспугивания и предпочитаемые дистанции в природе и в городе различались в среднем в 20 раз с высокой степенью достоверности (p < 0.01). Ткани для анализа ДНК брали у крякв в Московском зоопарке, а также у добытых охотниками на р. Клязьме во Владимирской области. ДНК выделяли фенол-хлороформным методом, для постановки ПЦР использовали 12 праймеров. Результативность прохождения ПЦР контролировали путем постановки агарозного электрофореза, фрагментный анализ проводили с помощью прибора QIAxcel Advanced. Cравнение ДНК было проведено по шести микросателлитным локусам. Обработка результатов в среде R, пакет hierstat, выявила сниженную, в сравнении с ожидаемой, гетерозиготность в каждой из исследуемых популяций по сравнению с популяцией, полученной путем их объединения, а также наличие небольших, но значимых различий в частотах аллелей между городскими и дикими популяциями (индекс Фишера 0.037–0.128). Мера генетического расстояния по Нею между птицами из городской и природной популяций составила 0.24. Таким образом, у крякв из оседлой городской группировки проявляются значительные отличия поведения от птиц, обитающих в Московской области, и признаки генетического обособления от птиц из мигрирующих природных популяций Владимирской области.
Даже среди специалистов нередко встречается представление о том, что фауну города составляют только синантропные виды диких животных или виды, сохранившиеся как “реликты” прошлого, вынужденные некоторое время жить в стесненных условиях рудиментарных ландшафтных “островов”. С другой стороны, показано, что ряд популяций различных видов птиц и зверей активно осваивает урбанизированную территорию и быстро приобретает характерные особенности, отличающие их от природных популяций (Стольберг, 2000; Luniak, 2004; Marzluff et al., 2008; Фридман, Еремкин, 2009; Gil, Brumm, 2014; McCleery et al., 2014; Схилтхейзен, 2021; Фридман, Суслов, 2021; Salmón et al., 2021; Caizergues et al., 2022, и др.).
Ослабление пассивно-оборонительной реакции на человека служит ключевым свойством, позволяющим отдельным популяциям эффективно заселять город (Gil, Brumm, 2014). В последние десятилетия освоение городов и рост численности происходили, например, у черного дрозда в Польше (Luniak et al., 1990; Luniak, 2004), ушастой совы, дрозда-рябинника и восточного соловья в Москве (Воронецкий, Леонов, 2003; Морозов, Худяков, 2016; Неслуховский, Кияткина, 2018), ястреба-тетеревятника в Киеве (Матус, 2013), вяхиря во Львове (Сеник, Хорняк, 2003), грача в Южном Приднестровье (Тищенков и др., 2002), кряквы в Москве (Авилова, 2016), обыкновенного хомяка в Симферополе (Феоктистова и др., 2016) и у многих других видов.
Формируются ли устойчивые группировки городских птиц не только в силу пластичности, свойственной этим видам, но и в процессе естественного отбора в малых популяциях? Наша работа, как и перечисленные выше, пытается приблизиться к ответу на этот вопрос.
В городах обычно снижено генетическое разнообразие особей внутри популяций и увеличено – между ними (Johnson et al., 2017). Относительно автономные городские популяции некоторых видов cо временем обнаруживают значимые генетические отличия от природных. Так, наследуемые изменения длины клюва обнаружены у больших синиц городской популяции Великобритании (Bosse et al., 2017), формы клюва – у городской североамериканской мексиканской чечевицы (Badyaev et al., 2008), устойчивости к загрязнениям – у североамериканской городской серебристой чайки (Yauk, 2000), индивидуальных черт поведения – у европейского черного дрозда (Miranda et al., 2013; Mueller et al., 2013). Гены, связанные с урбанизацией, отвечают за дивергенцию поведения, в частности, у птиц ген HTR7 кодирует рецептор нейромедиатора серотонина, ослабляющего стрессовую реакцию (Salmón et al., 2021).
Однако во многих случаях характер и глубина городских адаптаций остается неясной. Так, у птиц из городских популяций крякв в Италии обнаружены значимые генетические отличия от природных при отсутствии биологических и поведенческих отличий между ними (Baratti et al., 2014). Такие же различия были выявлены между мигрирующими и оседлыми популяциями кряквы в разных местах восточной части Балтийского региона (Sruoga et al., 2005; Svazas et al., 2006). В то же время оседлые (или городские) кряквы в Испании не обнаружили различий с представителями мигрирующих популяций (Kraus et al., 2016). Причины таких различий не совсем ясны, для их интерпретации необходимо накопление сравнительных данных из разных городов и их природных окрестностей. Автономия городских популяций проявляется в первую очередь в регионах с мягким климатом, часто – независимо в разных городах (Evans et al., 2009, 2010; Minias, 2015; Minias et al., 2017).
Наша цель состояла в анализе биологических и генетических особенностей городской популяции кряквы города Москвы в сравнении с природными популяциями на примере Московской и Владимирской области. Задачи работы были направлены на поиски ответа на следующие вопросы: а) есть ли отличия в биологии и поведении городских крякв Москвы от крякв в природной обстановке Московской области; б) есть ли генетические отличия крякв оседлой городской группировки Московского зоопарка от перелетных крякв из Владимирской области.
МАТЕРИАЛ И МЕТОДИКА
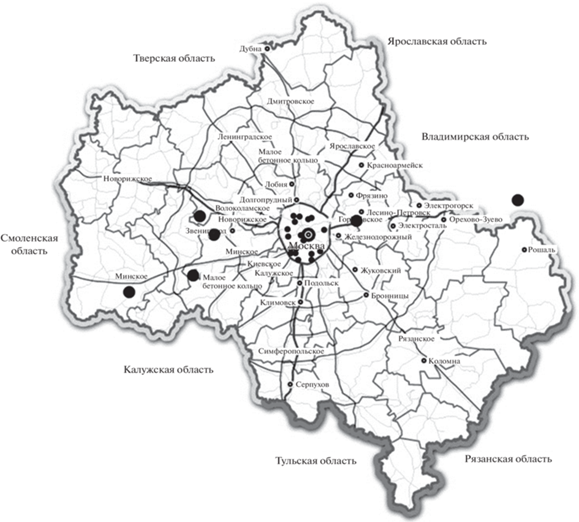
Дистанцию вспугивания определяли как расстояние от человека до взлетающей или уплывающей птицы во время неторопливого подхода и в отсутствии пристального внимания к ней. В случае отсутствия активной реакции на человека (преимущественно на воде) оценивали расстояние до птицы как “предпочитаемую” дистанцию. Наблюдения за поведением особей-членов городской и природной популяций были проведены в июне–июле 2018–2019 гг. в Москве и Московской области. Определение дистанций по общепринятой методике (Резанов, 2002) проводили в сезон размножения (конец мая–июль) в Москве на городских речках Городне, Очаковке и прудах Ясенева, Царицына, Новодевичьих, Очаковских, Олимпийской деревни, Серебряного бора, Михалкова, ул. Красных Зорь, Обручева, Андреевских, Бирюлева, Измайлова, Воронцова, Оленьих (Сокольники), Мещерских, МСХА, Капотни (рис. 1). Все эти водоемы сильно преобразованы благоустройством и в значительной мере утратили необходимые для защиты выводков водоплавающих птиц заросли околоводной растительности. На их берегах постоянно находятся люди, а часто и домашние животные.
В Московской области поведение крякв фиксировали на прудах рыборазводных хозяйств Малая Истра, Бисерово, Нарские пруды, Большие Парфенки, с частично заболоченными берегами и с хорошо развитым поясом околоводных растений, и на Москве-реке близ Звенигородской биостанции МГУ, с островами и пойменными зарослями деревьев и кустарников (рис. 1). Их посещаемость людьми гораздо ниже, чем в Москве, а защитные свойства выражены значительно лучше. Таким образом, в Москве среда обитания сильно обеднена, а антропогенная нагрузка увеличена по сравнению с перечисленными водными объектами Московской области.
Важно, что на рыбоводных прудах, где проводили наблюдения, не выпускают искусственно разведенных крякв перед сезоном охоты. Фермерские кряквы, выведенные искусственно и скрещивающиеся с дикими, могли бы существенно осложнить генетический анализ.
Водоемы, заселенные кряквами, посещали преимущественно в ранние утренние часы, когда вероятность помех в наблюдениях была минимальна. Перед тем, как подойти к птицам на расстояние, вызывающее бегство, определяли их число, пол и возраст по методике Ю.А. Исакова (1963). Расстояния до птиц на берегу оценивали шагами (шаг = 70 см), на воде – длиной корпуса утки (50 см).
Было проанализировано 127 дистанций вспугивания в Москве и 47 – в Московской области.
Статистическую значимость различий показателей оценивали в пакете Statistica 10.0 методом непараметрической статистики, так как распределение данных не соответствовало нормальному.
Поведение по отношению к человеку подмосковных крякв в некоторых случаях может быть обратимо, поскольку вблизи Москвы могут появляться и залетные из города птицы с толерантным поведением по отношению к людям. Поэтому пробы тканей для сравнительного анализа ДНК брали у перелетных крякв, добытых охотниками на удаленных от Москвы природных водоемах Владимирской области (Петушинский р-н, пойма р. Клязьмы). Образцы тканей (кровь, перья, яйца) городских крякв были получены в Московском зоопарке. Ненасиженные яйца закладывали в инкубатор. При инкубировании яиц брали образцы тканей эмбрионов и подскорлуповые оболочки для выделения ДНК.
Было использовано 22 образца тканей городских уток и 33 – уток из природной популяции Владимирской области, фиксированных в 96% этаноле или в 0.5 молярном растворе ЭДТА. ДНК выделяли фенол-хлороформным методом (Sambrook, Russell, 2006), для постановки ПЦР использовали 12 праймеров, сконструированных по Мааку с соавт. (Maak et al., 2003). В работе использовались те же микросателлитные локусы, которые были описаны в работе Маака с соавт. (Maak et al., 2003). Последовательности праймеров и режим ПЦР для амплификации исследованных локусов также были идентичны таковым, использованным в работе Маака с соавт. (Maak et al., 2003).
Результативность прохождения ПЦР контролировали путем постановки агарозного электрофореза, после чего образцы направляли на фрагментный анализ с помощью прибора QIAxcel Advanced для вертикального гель-электрофореза. Результаты фрагментного анализа обрабатывали при помощи пакета Rhierfstat (Goudet, 2005; Jombart, 2008; Jombart et al., 2010).
РЕЗУЛЬТАТЫ
Дистанции вспугивания и предпочитаемые дистанции
Кряквы, привыкшие к подкормке, в Москве проявляют навязчиво положительную реакцию на человека. Реже они стараются избежать контакта, нередко вообще не выказывают никакой реакции, предпочитая оставаться на одном месте, особенно на воде. Такое пассивное поведение чаще проявляется у самок. У самцов за время наблюдений нами были отмечены единичные случаи “равнодушия” к человеку как в Москве, так и на Бисеровском и Мало-Истринском рыбоводных прудах (рыбхозах) Московской области. Тем не менее при этом дистанции сильно отличались в городе (2–4 м) и в рыбхозах (15–100 м). При бегстве утки в Москве не спеша сходят на воду или отплывают от берега, в рыбхозах взлетают почти вертикально или с коротким разбегом. У всех птиц, за которыми велись наблюдения, в Москве и в рыбхозах дистанции различались с высокой степенью достоверности (рис. 2). Для всех птиц дистанция вспугивания составляла соответственно в рыбхозах и в Москве – 59 ± 11.7 и 3.07 ± 0.28 м (тест Манна–Уитни при U = 3.0; Z = 6.44; p < 0.001; n = 69), предпочитаемая дистанция соответственно в рыбхозах и в Москве – 57.7 ± 5.9 и 3.5 ± 0.43 м (тест Манна–Уитни при U = 16; Z = 7.36; p < 0.001; n = 93).
Рис. 2.
Дистанции вспугивания и предпочитаемая дистанция крякв (без разделения по полу) в природе и в городе.

Разброс показателей дистанции вспугивания на прудах рыбхозов больше (С = 52.3), чем в Москве (С = 2), а у самцов – больше (С = 52.7), чем у самок (С = 6.6) как в целом, так и по отдельности в рыбхозах и в Москве. То же относится к предпочитаемой дистанции.
Из приведенных соотношений можно сделать вывод, что кряквы на рыбоводных прудах Московской области в условиях, близких к природным, ведут себя гораздо осторожнее, чем в городе, не подпускают человека на близкое расстояние, предпочитая подниматься в воздух или, реже, оставаясь на воде, никогда не приближаются по собственной инициативе. Этим они сильно отличаются по поведению от крякв, обитающих в Москве. Последние чаще положительно реагируют на человека, чем стараются скрыться. Самки в природе, независимо от наличия выводка, менее осторожны, чем самцы. Они вступают в более тесный контакт с человеком и проявляют более пассивное и менее разнообразное поведение при беспокойстве.
Результаты исследования микросателлитов
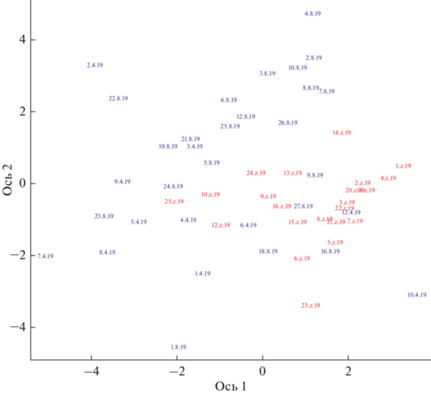
Cравнение ДНК, выделенной из образцов тканей, взятых у птиц, проведено по шести микросателлитным локусам. Обработка результатов в среде R (пакет hierstat) выявила сниженную, в сравнении с ожидаемой, гетерозиготность по всем локусам (табл. 1), а также наличие небольших, но значимых различий в частотах аллелей между городскими и дикими популяциями по данным локусам (табл. 2). Две пробы были исключены из анализа из-за аномальных значений: одна из природной популяции (20.8.19) и одна – из выборки зоопарка (17.Z.19). В природной популяции это может быть связано с присутствием фермерской кряквы. В выборке зоопарка – с залетом кряквы из природной популяции, привлеченной массой птиц на прудах. Анализ частот аллелей исследованных локусов методом главных компонент (principal component analysis, PCA) после исключения аномальных значений показывает, что птицы из популяции зоопарка и из популяции Владимирской области довольно сильно различаются по преобладающим аллелям микросателлитов (рис. 3).
Таблица 1.
Характеристика локусов, использованных в работе
| Характеристики | Локус | |||||
|---|---|---|---|---|---|---|
| AP12 | AP13 | AP16 | AP20 | AP22 | AP25 | |
| Число аллелей в локусе | 10 | 10 | 7 | 11 | 11 | 6 |
| Наблюдаемая гетерозиготность | 0.43 | 0.19 | 0.44 | 0.65 | 0.5 | 0.43 |
| Ожидаемая гетерозиготность | 0.8 | 0.54 | 0.65 | 0.81 | 0.84 | 0.63 |
Таблица 2.
Показатели генетической подразделенности популяций
| Показатели | Локусы | |||||
|---|---|---|---|---|---|---|
| AP12 | AP13 | AP16 | AP20 | AP22 | AP25 | |
| Наблюдаемая гетерозиготность (H0) | 0.39 | 0.18 | 0.46 | 0.64 | 0.50 | 0.39 |
| Гетерозиготность внутри популяций (Hs) | 0.81 | 0.50 | 0.65 | 0.80 | 0.75 | 0.59 |
| Гетерозиготность в объединенной популяции (Ht) | 0.81 | 0.52 | 0.67 | 0.81 | 0.83 | 0.62 |
| Генетическое разнообразие между популяциями (Dst) | 0.006 | 0.024 | 0.02 | 0.01 | 0.08 | 0.02 |
| Скорректированная гетерозиготность в объединенной популяции (Htp) | 0.82 | 0.55 | 0.7 | 0.83 | 0.91 | 0.64 |
| Скорректированное разнообразие между популяциями (Dstp) | 0.013 | 0.05 | 0.05 | 0.02 | 0.16 | 0.05 |
| Индекс фиксации Фишера (Fst) | 0.008 | 0.05 | 0.03 | 0.01 | 0.1 | 0.04 |
| Скорректированный индекс фиксации (Fstp) | 0.016 | 0.09 | 0.07 | 0.03 | 0.17 | 0.07 |
| Коэффициент инбридинга (Fis) | 0.51 | 0.64 | 0.29 | 0.19 | 0.33 | 0.33 |
| Оценка актуальной дифференциации (Dest) | 0.07 | 0.10 | 0.13 | 0.12 | 0.65 | 0.11 |
Рис. 3.
Анализ главных компонент по частотам аллелей микросателлитных локусов. Синим выделены пробы ДНК крякв из Владимирской области, красным – из Московского зоопарка. Сильно отклоняющиеся значения (20.8.19 для дикой популяции и 17.Z.19 для городской) не представлены.
Индекс фиксации Фишера Fst принимает значения от 0.008 до 0.1 по различным локусам, интегральное значение равно 0.1. Это различие значимо, бутстрэпные оценки дают для индекса Фишера значения от 0.037 до 0.128. Масштаб выявленных различий подтверждается расчетом дистанции по Нею. Дистанция между популяцией зоопарка и популяцией Владимирской области равна 0.24. Этот уровень различий можно считать значимым.
Реальный уровень гетерозиготности значительно, по некоторым локусам практически в 2 раза, снижен в сравнении с ожидаемым.
Это может свидетельствовать о широком распространении инбридинга. Коэффициент инбридинга различается между разными локусами, в объединенной выборке он варьирует от 0.18 до 0.62 (табл. 2), что соответствует значительному инбридингу.
Два из использованных в нашей работе локуса (AP16 и AP25) были также описаны в работе итальянских исследователей (Baratti et al., 2014) при изучении генетической подразделенности природных и урбанизированных популяций кряквы. Оседлые группировки кряквы как в Московском зоопарке (табл. 2), так и во Флоренции характеризуются более низкой гетерозиготностью, чем птицы из природных популяций. Показатель инбридинга крякв Флоренции (0.58) приближается к максимальному, полученному в нашей работе для локуса АР13 (0.64) крякв Московского зоопарка.
В популяции Владимирской области разнообразие аллелей в каждом локусе больше, чем в популяции зоопарка. Последняя генетически более мономорфна, что понятно, если учесть, что она ведет свою историю от ограниченного числа особей. Некоторые локусы у птиц из популяции зоопарка более инбредны (AP12), некоторые менее (AP220) (табл. 3). Такая разница в инбридинге между локусами также может быть отнесена на счет эффекта основателя и относительно небольшого количества времени, прошедшего с момента основания популяции. Тем не менее в среднем по всем локусам популяция Московского зоопарка характеризуется несколько более высоким уровнем инбридинга, чем кряквы Владимирской области (табл. 3). Подразделенность объединенной популяции кряквы также можно объяснить за счет эффекта Валунда.
Таблица 3.
Наблюдаемая гетерозиготность (H0) и коэффициент инбридинга (Fis) по популяциям и локусам
| Локус | Городская популяция | Природная популяция | ||
|---|---|---|---|---|
| H0 | Fis | H0 | Fis | |
| AP12 | 0.2273 | 0.7294 | 0.5625 | 0.2823 |
| AP13 | 0.1364 | 0.6337 | 0.2188 | 0.6500 |
| AP16 | 0.5455 | 0.2555 | 0.3750 | 0.3339 |
| AP20 | 0.6364 | 0.1901 | 0.6562 | 0.1988 |
| AP22 | 0.5455 | 0.1724 | 0.4688 | 0.4461 |
| AP25 | 0.2273 | 0.5012 | 0.5625 | 0.2212 |
| Средняя | 0.3864 | 0.3971 | 0.47397 | 0.3477 |
ОБСУЖДЕНИЕ
Кряква – самый известный и широко распространенный вид уток, как правило, совершающих регулярные сезонные миграции (Cramp, Simmons, 1977; Миграции птиц…, 1997; Кривенко, Виноградов, 2008; Носков и др., 2016, и др.).
Филогеографический анализ (исследование внутривидовых генных потоков) показал, что в целом для кряквы в Евразии характерна слабая генетическая дифференциация популяций и низкая межпопуляционная изменчивость (Kulikova et al., 2005, 2012; Куликова и др., 2012; Журавлев, Куликова, 2014).
На основании данных секвенирования контрольного региона митохондриальной ДНК крякв дальневосточной, североевропейской и индийской популяций, в дальневосточной популяции было выявлено более высокое гаплотипическое и нуклеотидное разнообразие, чем в двух других (Куликова и др., 2012). Вероятно, это обусловлено гибридизацией обыкновенной и пестроносой кряквы Anas zonorhyncha. Североевропейская и дальневосточная популяции различались крайне незначительно (F = 0.0029). В то же время отмечается некоторая генетическая обособленность индийской популяции, что возможно объясняется оседлостью большей части составляющих ее птиц. Генетический анализ алеутской популяции кряквы при сравнении с выборками Аляски, Дальнего Востока и Европейской России показал частичную изоляцию, предположительно также связанную с отсутствием сезонных миграций (Kulikova et al., 2005). Таким образом, оседлые популяции проявляют признаки автономии от мигрирующих.
“Потеря перелетности”, или редукция миграционного этапа – главный показатель адаптации и обязательный этап в процессе урбанизации мигрирующих видов птиц (Благосклонов, 1995; Luniak, 2004; Tryjanowski et al., 2013). Отказ от сезонных миграций, как правило, служит первым этапом внутривидовой дифференциации (Носков, Рымкевич, 2010; Носков, 2011). Вместе с поведенческими различиями оседлость может инициировать процесс микроэволюции в обособляющихся городских популяциях (Фридман, Симкин, 2000). Переходя к оседлому городскому образу жизни, популяция оказывается во фрагментированной среде обитания с быстрыми и непредсказуемыми по скорости, степени и формам изменениями. В таких “ложно-островных” условиях микроэволюционные преобразования ускоряются (Alberti et al., 2017; Схилтхейзен, 2021). Это показано, в частности, на 88 видах млекопитающих (Milleien, 2006). У городских крякв по сравнению с птицами из природы были выявлены также морфофизиологические различия (Габузов и др., 1991; Byers, Cary, 1991).
Относительно генетической автономии урбанизированных популяций кряквы существуют противоречивые данные. Сравнение оседлых (городских) и мигрирующих крякв Испании не привело к обнаружению различий между ними (Kraus et al., 2016). В то же время литовскими исследователями обнаружены отличия городских и природных популяций кряквы в разных точках восточной части Балтийского региона (Slavėnaitė et al., 2004; Sruoga et al., 2005; Svazas et al., 2006). Исследователями из Италии (Baratti et al., 2009) были проведены полевые наблюдения на десятикилометровом участке двух рек в городе Флоренция, чтобы выявить динамику популяции, изменения биологического цикла и репродуктивного поведения кряквы, связанные с урбанизацией. Обнаружено увеличение численности кряквы на 30–84% после сезона размножения, а также преобладание самцов над самками на всем выбранном для наблюдений протяжении рек. Число утят в выводке уменьшалось с возрастом, а на двух обследованных реках не различалось. Таким образом, биологических и поведенческих особенностей у городских крякв за период наблюдений в 2002–2004 гг. не было обнаружено. Тем не менее были найдены значимые генетические различия с природной популяций крякв, добытых на озере Массачукколи в районе Пизы. Они подтвердились позднее на более обширном материале из того же региона (Baratti et al., 2014). Важный показатель прогрессирующей урбанизации животных – изменение дистанции вспугивания или бегства (flight initiation distance, FID), на которое исследователи из Италии не обратили внимания. Расстояние, начиная с которого дикое животное обращается в бегство, может служить индикатором степени его осторожности (Hediger, 1934; Юргенсон, 1962). На основании этого показателя неоднократно выявляли пониженную степень осторожности городских птиц по сравнению с представителями тех же видов в сельской местности (Резанов, 2002; Bonier et al., 2007; Møller, 2008; Møller, Ibáñez-Álamo, 2012; Lin et al., 2012; Sol et al., 2013; Сорокина, Немчинов, 2015; Samia et al., 2017, и др.). Ослабленная реакция на фактор беспокойства параллельно с генетическими различиями показана и для городских популяций водоплавающих птиц, в частности для лысухи и черного лебедя (Dongen et al., 2015; Minias, 2015). У крякв, за которыми велись наблюдения в Москве и на водоемах Московской области, дистанции различались с высокой степенью достоверности (см. выше).
Наши многолетние наблюдения за размножением городских крякв в Москве с 1998 г. по настоящее время позволили выявить не только различия в дистанции вспугивания, но и основные направления трансформации годового цикла (Авилова, 2016). Эти изменения затронули их разные этапы. В первую очередь это касается редукции сезонных миграций. В Москве кряквы стали с каждым годом приступать к гнездованию в более ранние сроки (r = –0.60; p = 0.008; n = 18). В годы с ранним наступлением весны время начала размножения кряквы в Москве (22.03–19.04) соответствует его началу в южных регионах России (в Крыму и в Ростовской области – конец марта, в дельте Волги – первая половина апреля). Удлинился и общий период размножения (r = 0.56; р < 0.05; n = 18). Период размножения удлиняется благодаря смещению сроков гнездования на более ранние, за счет более позднего гнездования самок, приступающих к кладке последними, в конце июня, а также за счет частого разорения гнезд и увеличения числа повторно гнездящихся самок. Удлинению способствует и рост общего числа гнездящихся в Москве самок с 250 до 900 за 18 лет. Общая длина периода гнездования в городе превосходит большинство полученных в природе показателей. В Москве она составляет 61–93 дня, в природе – от 25 до 50 дней. Таким образом, изменение толерантности к человеку – только одна из характерных особенностей городских крякв, отличающая их от особей из природных популяций.
Основными факторами, определившими привлекательность городской среды обитания, стали изменение климата, отсутствие постоянного преследования со стороны человека и доступные источники корма (Авилова, 2017, 2018). В Москве с конца 1960-х – начала 1970-х гг. сложилась оседлая гнездящаяся группировка крякв, ядро которой с 1930-х гг. было сосредоточено в Московском зоопарке, но почти уничтожено во время войны 1941–1945 гг. (Кудрявцев, 1967). С расширением города после 1960 г. кряквы стали увеличивать область распространения (Авилова, 2005). Это происходило параллельно с их массовой урбанизацией в Восточной Европе (Viksne et al., 2010).
В городах Западной Европы с мягким климатом предпосылки появления обособленных группировок крякв возникли гораздо раньше, чем в Восточной Европе и в России (Viksne et al., 2010). На это указывает и выявление генетически отличимых городских популяций в Литве и Италии (Slavėnaitė et al., 2004; Sruoga et al., 2005; Svazas et al., 2006; Baratti et al., 2014).
Полученная нами оценка генетической дистанции двух популяций кряквы (0.24) характерна для групп подвидового статуса. Мера генетического расстояния или дистанции (D), основанная на идентичности генов между популяциями, используется с 1972 г. (Nei, 1972). Она позволяет измерить накопленные аллельные различия в каждом локусе. Так, генетические дистанции между подвидами домовых мышей, Mus musculus musculus и M. m. domesticus, принимают наименьшее значение 0.13 (Nei, 1972), между породами коров – 0.2 (Čítek et al., 2018). Дистанции 0.3–0.4 разделяют традиционные и коммерчески выращиваемые породы индеек (Kamara et al., 2007). Наименьшая дистанция между двумя подвидами пищевого растения чечевицы (Lens culinaris culinaris и L. с. orientalis) составляет 0.146 (Dikshit et al., 2015). Учитывая, что на всем Евразийском континенте кряква принадлежит к единому подвиду, выделение изолированной популяции в отдельный подвид было бы по меньшей мере преждевременным. Это скорее говорит о значительной роли эффекта основателя в генетическом своеобразии популяции крякв Московского зоопарка.
Нетрудно представить, что генетическое обособление городских популяций происходит мозаично, а не по всему ареалу одновременно. В местности с мягким климатом, где больше оседлых птиц, переход к оседлости происходил раньше, чем в более суровых по климатическим показателям районах. Такие места создавали более благоприятные условия для микроэволюционных проявлений. Они могли возникать независимо в разных точках, как и само формирование городских популяций, которые образуются в разных городах и пополняются из близлежащих природных группировок (Evans et al., 2009, 2010; Minias, 2015; Minias et al., 2017). В настоящее время склонные к оседлости группировки крякв населяют многие города Евразии (Kelcey, Rheinwald, 2005; Храбрый, 2012). Поиск таких перспективных зон мог бы привести к более глубокому пониманию динамики внутривидовых процессов.
Таким образом, мы получили положительный ответ на оба поставленных вопроса. Выявлены различия двух исследованных группировок крякв по поведению и по нейтральным генетическим маркерам. Но если поведение при пассивно-оборонительной реакции различается в среднем в 20 раз, то по генетическим маркерам различия умеренные. Оседлая группировка крякв Московского зоопарка, сложившаяся более 50 лет назад, генетически обособлена от природной популяции Владимирской области. Поскольку генетическое разнообразие кряквы на пространстве ареала невелико, то предположительно существует обособленность и от населения других регионов. Возможно, частоты аллелей микросателлитов в изученной группировке зоопарка с начала ее формирования в первой половине XX в. отличались от показателей природных популяций. Это могло произойти благодаря эффекту основателя, формированию группы с отклоняющимся от среднего генетическим (аллельным) разнообразием, впоследствии размножившейся и распространившейся по городским водоемам. Открытым остается вопрос, есть ли генетические различия по нейтральным локусам между оседлыми группировками московских уток помимо зоопарка и природными популяциями. Возможно, исследование генотипа крякв, обитающих на городских водоемах, в разной степени удаленных от зоопарка, позволит его прояснить.
Список литературы
Авилова К.В., 2005. История формирования городской группировки кряквы в Москве // Казарка. № 7. С. 240–255.
Авилова К.В., 2016. Жизненный цикл и динамика численности городской популяции кряквы (Anas platyrhynchos, Anseriformes, Aves) в Москве // Зоол. журн. Т. 95. № 12. С. 1427–1440.
Авилова К.В., 2017. Особенности годового цикла водоплавающих птиц в 2016 году на примере кряквы (Anas platyrhynchos) // Эколого-климатические характеристики атмосферы Москвы в 2016 г. по данным метеорологической обсерватории МГУ имени М.В. Ломоносова / Под ред. Незваль Е.И., Сошинской И.В. М.: Изд-во МАКС-Пресс. С. 213–226.
Авилова К.В., 2018. Структура и долговременная динамика зимнего населения кряквы (Anasp latyrhynchos, Anseriformes, Anatidae) в Москве // Зоол. журн. Т. 97. № 3. С. 309–320.
Благосклонов К.Н., 1995. Гнездование и привлечение птиц в сады и парки. М.: Изд-во МГУ. 251 с.
Воронецкий В.И., Леонов А.П., 2003. Особенности процесса урбанизации в популяции ушастой совы Asio otus (на примере Москвы) // Животные в городе. Мат-лы 2-й науч.-практ. конф. М.: ИПЭЭ, МСХА. С. 161–164.
Габузов О.С., Фокин С.Ю., Чернов В.В., 1991. Морфобиологические особенности разных форм кряквы // Дичефермы и зоопитомники: мат-лы науч. тр. ЦНИЛ Главохоты РСФСР. М.: ЦНИЛ Главохоты РСФСР. С. 97–110.
Журавлев Ю.Н., Куликова И.П., 2014. Популяционная структура водоплавающих птиц: данные филогеографического анализа // Ареалы, миграции и другие перемещения животных. Мат-лы междунар. науч.-практ. конф. 25–27 ноября 2014 г. Владивосток: ТИГ ДВО РАН. С. 88–96.
Исаков Ю.А., 1963. Учет и прогнозирование численности водоплавающих птиц // Организация учета численности птиц и вредных грызунов. М.: Изд-во АН СССР. С. 36–90.
Кривенко В.Г., Виноградов В.Г., 2008. Птицы водной среды и ритмы климата Северной Евразии. М.: Наука. 588 с.
Кудрявцев С.М., 1967. Утки Московского зоопарка, живущие на полной свободе // Животное население Москвы и Подмосковья, его изучение, охрана и рациональное преобразование. М.: Изд-во МГУ. С. 86–89.
Куликова И.В., Пойса Х., Журавлев Ю.Н., 2012. Филогеографический анализ кряквы Евразии по данным секвенирования контрольного района мтДНК // Генетика. Т. 7. № 48. С. 835–843.
Матус А.А., 2003. Ястреб-тетеревятник в Киеве // Беркут. Т. 12. № 1–2. С. 66–69.
Миграции птиц Восточной Европы и Северной Азии. Пластинчатоклювые. Речные утки, 1997. М.: Наука. 318 с.
Морозов Н.С., Худяков В.В., 2016. Дрозд-рябинник (Turdus pilaris) в Москве в 2015 г.: сроки гнездования и последствия двух аномальных метеорологических явлений // Эколого-климатические характеристики атмосферы в 2015 г. по данным метеорологической обсерватории МГУ им. М.В. Ломоносова. М.: МАКС Пресс. С. 220–268.
Неслуховский И.Ю., Кияткина Н.П., 2018. Оценка влияния благоустройства в парках Москвы на численность птиц // Актуальные проблемы охраны птиц. Мат-лы Всерос. науч.-практ. конф., посвященной 25-летию Союза охраны птиц России (Москва, 10–11 февраля 2018 г.) / Отв. ред. Салтыков А.В. М.; Махачкала: Союз охраны птиц России. С. 192–197.
Носков Г.А., 2011. Изменчивость параметров миграционной активности в годовом цикле сезонных явлений птиц и ее роль в микроэволюционном процессе // Тр. Мензбировского орнитол. о-ва. Мат-лы XIII Междунар. орнитол. конф. Северной Евразии. Т. 1. Махачкала: Алеф. С. 17–30.
Носков Г.А., Рымкевич Т.А., 2010. Регуляция параметров годового цикла и ее роль в микроэволюционном процессе у птиц // Успехи соврем. биологии. Т. 130. № 4. С. 346–359.
Носков Г.А., Рымкевич Т.А., Гагинская А.Р., 2016. Миграции птиц Северо-Запада России. Неворобьиные. СПб.: Изд-во НПО “Профессионал”. 656 с.
Резанов А.А., 2002. К методике оценки дистанции вспугивания у птиц // Экология врановых птиц в антропогенных ландшафтах: мат-лы междунар. конф. Саранск: Мордов. гос. пед. ин-т. С. 100–102.
Сеник М.А., Хорняк М.М., 2003. Сучаснi змiни в орнiтофаунi Львова // Беркут. Т. 12. № 1–2. С. 1–13.
Сорокина А.В., Немчинов М.Ю., 2015. Сравнительная этологическая характеристика популяций сороки в различной степени трансформированных территорий // Молодежный научный форум: Естественные и медицинские науки: мат-лы XXV междунар. студ. науч.-практ. конф. № 6 (24). С. 23–36.
Стольберг Ф.В., 2000. Экология города: Учебник. Киев: Либра. 464 с.
Схилтхейзен М., 2021. Дарвин в городе: как эволюция продолжается в городских джунглях. М.: Изд-во “Эксмо”. 352 с.
Тищенков А.А., Аптеков А.А., Тучакова Л.П., 2002. Распространение и экология грача в Южном Приднестровье // Беркут. Т. 11. № 1. С. 79–83.
Феоктистова Н.Ю., Мещерский И.Г., Суров А.В., Богомолов П.Л., Товпинец Н.Н., Поплавская Н.С., 2016. Генетическая структура городской популяции обыкновенного хомяка (Cricetuscricetus) // Генетика. Т. 52. № 2. С. 221–230.
Фридман В.С., Еремкин Г.С., 2009. Урбанизация “диких” видов птиц в контексте эволюции урболандшафта. М.: Книжный дом ЛИБРОКОМ. 235 с.
Фридман В.С., Симкин Г.Н., 2000. Города как арены микроэволюционных процессов (чем обеспечивается устойчивость популяций в нестабильной, мозаичной и изменчивой среде) // Экополис 2000: экология и устойчивое развитие города. Мат-лы III междунар. конф. (Москва, МГУ, 24–25 ноября 2000 г.). М.: Изд-во РАМН. С. 162–170.
Фридман В.С., Суслов В.В., 2021. Микроэволюционные изменения при урбанизации “диких” видов птиц // Соц.-экол. технологии. Т. 11. № 1. С. 75–120.
Храбрый В.М., 2012. Птицы городов России. М.; СПб.: Т-во науч. изд. КМК. 513 с.
Юргенсон П.Б., 1962. Роль фактора беспокойства в экологии зверей и птиц // Зоол. журн. Т. 73. № 7. С. 1056–1060.
Alberti M., Correa C., Marzluff J.M., Hendry A.P., Palkovacs E.P. et al., 2017. Global urban signatures of phenotypic change in animal and plant populations // PNAS. V. 114. № 34. P. 8951–8956. https://doi.org/10.1073/pnas.1606034114
Badyaev A.V., Young R.L., Oh K.P., Addison C., 2008. Evolutionon a local scale: Developmental, functional, and genetic bases of divergence in bill form and associated changes in song structure between adjacent habitats // Evolution. V. 62. P. 1951–1964. https://doi.org/10.1111/j.1558-5646.2008.00428.x
Baratti M., Cordaro M., Dessì-Fulgheri F., Vannini M., Fratini S., 2009. Molecular and ecological characterization of urban population of the Mallard (Anas platyrhynchos) in Italy // Ital. J. Zool. V. 76. № 3. P. 330–339. https://doi.org/10.1080/11250000802566624
Baratti M., Baccetti N., Cordaro M., Mori A., Dessì-Fulgheri F., 2014. Investigating the puzzling genetic structure of mallard populations (Anas platyrhynchos L.) in Italy // Eur. J. Wildl. Res. V. 61. P. 81−89. https://doi.org/10.1007/s10344-014-0876-2
Bonier F., Martin P.R., Wingfield J.C., 2007. Urban birds have broader environmental tolerance // Biol. Lett. V. 3. № 6. P. 670–673. https://doi.org/10.1098/rsbl.2007.0349
Bosse M., Spurgin L.G., Laine V.N., Cole E.F., Firth J.A. et al., 2017. Recent natural selection causes adaptive evolution of an avian polygenic trait // Science. V. 358. № 6361. P. 365–368. https://doi.org/10.1126/science.aal3298
Byers S.M., Cary J.R., 1991. Discrimination of Mallard strains on the basis of morphology // J. Wildl. Manag. V. 55. № 4. P. 580–586.
Caizergues A.E., Le Luyer J., GrégoireA., SzulkinM. et al., 2022. Epigenetics and the city: Non-parallel DNA methylation modifications across pairs of urban-forest Great tit populations // Evol. Appl. V. 15. № 1. P. 149–166.
Čítek J., Panicke L., Řehout V., Procházková H., 2018. Study of genetic distances between cattle breeds of Central Europe // Czech J. Anim. Sci. V. 51. P. 429–436.
Cramp S., Simmons K.E.L., 1977. Handbook of the Birds of Europe, the Middle East and North Africa. V. 1. Oxford: Oxford Univ. Press. 722 p.
Dikshit H.K., Singh A., Singh D., Aski M.S., Prakash P. et al., 2015. Genetic diversity in Lens species revealed by EST and genomic simple sequence repeat analysis // PLoS One. V. 10. № 9. https://doi.org/10.1371/journal.pone.0138101
Dongen W.F.D., van, Robinson R.W., Weston M.A., Mulder R.A., Guay P.-J., 2015. Variation at the DRD4 locus is associated with wariness and local site selection in urban black swans // BMC Evol. Biol. V. 15. https://doi.org/10.1186/s12862-015-0533-8
Evans K.L., Hatchwell B.J., Parnell M., Gaston K.J., 2010. A conceptual framework for the colonization of urban areas: The blackbird Turdus merula as a case study // Biol. Rev. V. 85. P. 643–667. https://doi.org/10.1111/j.1469-185X.2010.00121.x
Evans K.L., Gaston K.J., Frantz A.C., Simeoni M., Sharp S.P. et al., 2009. Independent colonization of multiple urban centers by a formerly forest specialist bird species // Proc. Roy. Soc. Lond. Ser. B. V. 276. P. 2403–2410.
Gil D., Brumm H., 2014. Avian Urban Ecology. Behavioral and Physiological Adaptations. Oxford: Oxford Univ. Press. 218 p.
Goudet J., 2005. Hierfstat, a package for R compute and testhiearchieal F-statistics // Mol. Ecol. Notes. V. 5. № 1. P. 184–186.
Hediger H., 1934. Zur Biologie und Psychologie der Flucht bei Tieren // Biol. Zbl. V. 54. P. 21–40.
Johnson M.T.G., Munshi-South J., 2017. Evolution of life in urban environments // Science. V. 358. https://doi.org/10.1126/science.aam8327
Jombart T., 2008. Adegenet: a R package for the multivariate analysis of genetic markers // Bioinformatics. V. 24. № 11. P. 1403–1405.
Jombart T., Devillard S., Balloux F., 2010. Discriminant analysis of principal components: A new method for the analysis of genetically structured populations // BMC Genet. V. 11. https://doi.org/10.1186/1471-2156-11-94
Kamara D., Gyenai K.B., Geng T., Hammade H., Smith E.J., 2007 Microsatellite marker-based genetic analysis of relatedness between commercial and heritage turkeys (Meleagris gallopavo) // Poult. Sci. V. 86. № 1. P. 46–49. https://doi.org/10.1093/ps/86.1.46
Kelcey J.G., Rheinwald G., 2005. Birds in European Cities. St. Katharinen: Ginster Verlag. 486 p.
Kraus R.H., Figuerola J., Klug K., 2016. No genetic structure in a mixed flock of migratory and non-migratory Mallards // J. Ornithol. V. 157. № 3. P. 919–922. https://doi.org/10.1007/s10336-016-1354-2
Kulikova I.V., Poysa H., Zhuravlev Y.N., 2012. Phylogeography of the mallard Anas platyrhynchos from Eurasia inferred from sequencing of the mtDNA control region // Russ. J. Genet. V. 48. P. 705–712. https://doi.org/10.1134/S1022795412070095
Kulikova I.V., Drovetski S.V., Gibson D.D., Harrigan R.I., Rohwer S. et al., 2005. Phylogeography of the Mallard (Anas platyrhynchos): Hybridization, dispersal and lineage sorting contribute to complex geographic structure // Auk. V. 122. № 3. P. 949–965. https://doi.org/10.1093/auk/122.3.949
Lin T., Coppackc T., Lin Q., Kulemeyerc Ch., Schmidtc A. et al., 2012. Does avian flight initiation distance indicate tolerance towards urban disturbance? // Ecol. Indic. V. 15. № 1. P. 30–35. https://doi.org/10.1016/j.ecolind.2011.09.018
Luniak M., 2004. Synurbization – adaptation of animal wildlife to urban development // Proc. 4th Int. Urban Wildlife Symp. / Eds Shaw W.W., Harris L.K., VanDruff L. Tucson: Univ. Arizona. P. 50–55.
Luniak M., Mulsow R., Walasz K., 1990. Urbanization of the European Blackbird – expansion and adaptation of urban population // Urban Ecological Studies in Central and Eastern Europe / Ed. Luniak M. Wrocław: Ossolineum. P. 187–200.
Maak S., Wimmers K., Weigend S., Neumann K., 2003. Isolation and characterization of 18 microsatellites in the Peking duck (Anas platyrhynchos) and their application in other waterfowl species // Mol. Ecol. Notes. V. 3. P. 224–227. https://doi.org/10.1046/j.1471-8286.2003.00405.x
Marzluff J.M., Shulenberger E., Endlicher W., Alberti M., Bradley G. et al., 2008. Urban Ecology. Boston: Springer. 807 p.
McCleery R.A., Moorman C.E., Peterson M.N., 2014. Urban Wildlife Conservation. Theory and Practice. Boston: Springer. 406 p.
Milleien V., 2006. Morphological evolution is accelerated among island mammals // PLoS Biol. V. 4. № 10. https://doi.org/10.371/journal.pbio.0040384
Minias P., 2015. Successful colonization of a novel urban environment is associated with an urban behavioural syndrome in a reed-nesting waterbird // Ethology. V. 121. P. 1178–1190. https://doi.org/10.1111/eth.12433
Minias P., Włodarczyk R., Minias A., Dziadek J., 2017. How birds colonize cities: Genetic evidence from a common waterbird, the Eurasian coot // J. Avian Biol. V. 48. № 8. P. 1095–1103. https://doi.org/10.1111/jav.01334
Miranda A.C., Schielzeth H., Sonntag T., Partecke J., 2013. Urbanizationand its effects on personality traits: A result of microevolution or phenotypic plasticity? // Glob. Change Biol. V. 19. P. 2634–2644. https://doi.org/10.1111/gcb.12258
Møller A.P., 2008. Flight distance of urban birds, predation, and selection for urban life // Behav. Ecol. Sociobiol. V. 63. P. 63–75. https://doi.org/10.1007/s00265-008-0636-y
Møller A.P., Ibáñez-Álamo J.D., 2012. Escape behaviour of birds provides evidence of predation being involved in urbanization // Anim. Behav. V. 84. P. 341–348. https://doi.org/10.1016/j.anbehav.2012.04.030
Mueller J.C., Partecke J., Hatchwell B.J., Gaston K.J., Evans K.L., 2013. Candidate gene polymorphisms for behavioural adaptations during urbanization in blackbirds // Mol. Ecol. V. 22. P. 3629–3637. https://doi.org/10.1111/mec.12288
Nei M., 1972. Genetic distance between populations // Am. Nat. V. 106. № 949. P. 283–292.
Salmón P., Jacobs A., Ahrén D., Biard C., Dingemanse N.J. et al., 2021. Continent-wide genomic signatures of adaptation to urbanisation in a songbird across Europe // Nat. Commun. V. 12. https://doi.org/10.1038/s41467-021-23027-w
Sambrook J., Russell D.W., 2006. Purification of nucleic acids by extraction with phenol:chloroform // Cold Spring Harb. Protoc. V. 2006. № 1. https://doi.org/10.1101/pdb.prot4455
Samia D.S., Blumstein D.T., Díaz M., Grim T., Ibáñez-Álamo J.D. et al., 2017. Rural-urban differences in escape behavior of European birds across a latitudinal gradient // Front. Ecol. Evol. V. 5. https://doi.org/10.3389/fevo.2017.00066
Slavėnaitė S., Butkauskas D., Sruoga A., Mozalienė E., 2004. Comparative investigations of Mallard duck (Anas platyrhynchos) genomic DNA using chicken and duck specific microsatellite primers // Vet. ir Zootech. V. 26. № 48. P. 89–92.
Sol D., Lapiedra O., Gonzales-Lagos C., 2013. Behavioral adjustments for a life in the city // Anim. Behav. V. 85. № 5. P. 1101–1112. https://doi.org/10.1016/j.anbehav.2013.01.023
Sruoga A., Švažas S., ButkauskasD., Paulauskas A., Mozalienė E., Slavėnaitė S., 2005. Long-term genetic investigations – background for research on wildfowl populations in the changing environmental conditions // Acta Zool. Lituan. V. 15. https://doi.org/10.1080/13921657.2005.10512397
Svazas S., Butkauskas D., Sruoga A., Kozulin A., Varna K., 2006. Analysis of recent changes within the genetic structure of Mallard populations in Eastern Europe // J. Ornithol. V. 147. № 5. P. 122–123.
Tryjanowski P., Sparks T.H., Kuzniak S., Czechowski P., Jerzak L., 2013. Bird migration advances more strongly in urban environments // PloS One. V. 8. № 5. https://doi.org/10.1371/journal.pone.0063482
Viksne J., Svazas S., Czajkowski A., Janaus M., Mischenko A. et al., 2010. Atlas of Duck Population in Eastern Europe. Vilnius: “Akstis”. 199 p.
Yauk C.L., Fox G.A., McCarry B.E., Quinn J.S., 2000. Induced minisatellite germline mutations in herring gulls (Larus argentatus) living near steel mills // Mutat. Res. V. 452. P. 211–218. https://doi.org/10.1016/S0027-5107(00)00093-2
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии