Журнал общей биологии, 2021, T. 82, № 2, стр. 129-142
Генетические основы и механизмы формирования вариаций активности изоферментов цитоплазматической малатдегидрогеназы севрюги (Acipenser stellatus) и большого амударьинского лопатоноса (Pseudoscaphirhynchus kaufmanni)
Е. В. Кузьмин *
Институт биологии внутренних вод им. И.Д. Папанина РАН
152742 Ярославская обл., пос. Борок, Россия
* E-mail: kuzmev@ibiw.ru
Поступила в редакцию 26.08.2020
После доработки 10.12.2020
Принята к публикации 24.12.2020
Аннотация
Денситометрический анализ электрофоретических спектров цитоплазматической малатдегидрогеназы (МДГ, КФ 1.1.1.37) севрюги (Acipenser stellatus) и большого амударьинского лопатоноса (Pseudoscaphirhynchus kaufmanni) показал, что количественная изменчивость интенсивности окрашивания изоферментов у этих видов носит дискретный характер. Данный феномен позволил предположить, что вариабельность признака генетически детерминирована. Фактически наблюдаемая изменчивость наиболее корректно описывается исходя из предположения, что синтез субъединиц фермента контролируется комплексом из восьми генов, представленных различными аллелями, в том числе и их нулевыми вариантами. Субъединицы, продукты разных локусов, по-разному ведут себя в процессе ассоциации в активные димерные молекулы. Одни из них рекомбинируют свободно и независимо, в то время как другие объединяются избирательно. В итоге на зимограммах проявляется результат суммирования этих двух независимых процессов. Предлагаемая гипотеза образования нативных молекул МДГ позволяет трактовать с генетических позиций все наблюдаемые примеры вариаций активности изоферментов. В ряде случаев разные генотипы могут проявляться в виде спектров, идентичных как по количеству, так и по соотношению интенсивности окрашивания фракций.
Электрофоретические методы, позволяющие производить массовый анализ биохимических маркеров в больших выборках, благодаря своей относительной простоте и дешевизне давно стали рутинной методикой в практике ихтиологических исследований. За многолетний период изучения большого числа белков и ферментов накоплены обширные базы данных о популяционно-генетической структуре различных видов рыб. Эти данные могут служить ориентиром при проведении работ по поддержанию численности, биоразнообразия и генетической чистоты природных популяций. Полученные результаты имеют особую ценность, когда речь идет о некогда существовавшем уровне и характере биохимического полиморфизма утраченных популяций редких и исчезающих видов, к которым относятся практически все представители сем. Acipenseridae.
В настоящее время в результате резкого снижения промысловых запасов в мире интенсивно развивается товарное осетроводство. Биохимические маркеры широко используются для постоянного мониторинга генетической структуры маточных стад и паспортизации производителей при промышленном разведении осетровых, что необходимо для обеспечения максимального выхода продукции, предотвращения генетического загрязнения и вырождения используемых в аквакультуре видов. Немаловажен тот факт, что для большинства биохимических маркеров известны их биологические функции, что позволяет осознанно планировать интродукционные мероприятия, проводимые с целью восстановления популяций, находящихся на грани исчезновения. Мониторинг, основанный на анализе биохимических маркеров, наиболее эффективен в случае, когда достаточно хорошо изучена не только фенотипическая изменчивость этих маркеров, но также выявлена их генетическая детерминация. Для ряда белков осетровых рыб установлены схемы их наследования. Эта информация служит основой для контроля характеристик выпускаемой рыбоводными заводами молоди, а также маточных и коллекционных стад (Никоноров и др., 1985; Кирпичников, 1987; Рябова, Кутергина, 1990; Кузьмин, Кузьмина, 1998; Демкина, 2005; Рябова и др., 2008; Рябова, 2013; Шишанова и др., 2014; Мамонова и др., 2015).
Необходимость тщательного контроля генетической структуры стад элитных производителей связана еще и с тем, что в последние годы все чаще стали появляться сведения о неожиданных и нежелательных изменениях кариотипов осетровых в процессе их доместификации. В частности, у сибирского осетра Acipenser baerii, относящегося к группе многохромосомных осетровых, являющихся функциональными тетраплоидами октоплоидного происхождения (4n ≈ 240) (Rodzen, May, 2002; Fontana et al., 2007; Vasil’ev, 2009; Vasil’ev et al., 2010), зафиксировано появление жизнеспособных, но имеющих пониженную фертильность пентаплоидных (5n), гексаплоидных (6n) и гептаплоидных (7n) особей, в естественных условиях ранее не встречавшихся. Увеличение численности подобных особей неизбежно ведет к загрязнению генофонда маточных стад рыбоводных заводов. При этом с особой остротой встает проблема выбраковки производителей с нежелательными характеристиками еще до момента включения их в репродуктивные или реинтродуктивные программы (Ludwig et al., 2009; Havelka et al., 2013, 2014, 2016; Trifonov et al., 2016). Реально существующая опасность попадания девиантных особей в открытые водоемы может привести к негативным последствиям также и для сохранившихся аборигенных популяций.
При проведении популяционных исследований анализ гетерогенности и полиморфизма электрофоретических спектров в ряде случаев позволяет сделать предварительные заключения о генетической детерминации наблюдаемых фенотипов. Однако при интерпретации спектров биохимических маркеров осетровых возникают трудности, связанные с целым комплексом причин. Одна из основных проблем заключается в том, что привлечение для этих целей популяционных данных не всегда корректно из-за ограничений применимости формулы Харди–Вайнберга, которая обычно используется для проверки выдвигаемых гипотез. К таким ограничениям относятся обязательное наличие панмиктичности, отсутствие отбора, ассортативности спаривания особей и сочетания гамет и т.д. (Ли, 1978; Лобашев и др., 1979; Животовский, 1991). В этой связи следует отметить, что у проходных видов осетровых, которые отличаются сложным жизненным циклом, панмиксия отсутствует, так как у них существует внутривидовая дифференциации различных биологических групп и рас, использующих различные нерестилища в различное время (Гербильский, 1972; Лукьяненко и др., 1988). Фактор отбора также может оказывать влияние на структуру природных популяций осетровых. Примеры избирательной подверженности рыб с различными фенотипами альбуминов сыворотки крови такой патологии, как “расслоение мышечной ткани”, описаны в литературе (Бараев, 1990). Проходные виды осетровых рыб отличаются большой продолжительностью жизни, в течение которой они неоднократно совершают нерестовые миграции. По этой причине состав нерестовых стад (из которых обычно отбираются пробы для анализа) ежегодно меняется, так как на нерест одновременно идут особи разных генераций (Батычков, 1979; Лукьяненко, Кулик, 1994).
Вполне вероятно, что наличие такого количества ограничивающих применимость формулы факторов, часть из которых со всей очевидностью имеет место у многих видов осетровых, может повлечь за собой достоверные отклонения фактических частот генотипов от теоретически ожидаемых даже в том случае, если проверяемая гипотеза верна.
Трудности расшифровки генетически обусловленного полиморфизма биохимических маркеров осетровых связаны также с чрезвычайно сложным характером устройства их кариотипов. Имеются данные, говорящие о том, что за длительную историю своего существования представители сем. Acipenseridae неоднократно проходили стадии полиплоидизации и обратной диплоидизации. При этом последняя осуществлялась несинхронно для разных белковых систем (Алтухов, 1983; Васильев, 1985; Кузьмин, 2002; Fontana et al., 2007; Vasil’ev, 2009; Havelka et al., 2013). Показано также, что модели наследования различных микросателлитных систем белого осетра могут быть локусоспецифичными: дисомическими, тетрасомическими и даже октосомическими (Rodzen, May, 2002). У стерляди цитогенетическими методами была выявлена частичная палеотетраплоидность генома, который у нее представляет собой комплексную мозаичную структуру, состоящую из диплоидных и тетраплоидных хромосомных сегментов (Romanenko et al., 2015). Аналогичное явление описано для Hox генов представителя отряда Acipenseriformes – веслоноса (Symonova et al., 2017).
Однако в литературе имеются также и данные об отсутствии достоверных отличий фактических частот генотипов от теоретически ожидаемых в соответствии с предлагаемой гипотезой, основанной на визуальном анализе электрофоретических спектров. Примером может служить аспартатаминотрансфераза севрюги (Рябова, Кутергина, 1990). У стерляди, которая не совершает отдаленных миграций и образует, как правило, отдельные локальные популяции, неспецифические эстеразы (Кузьмин, Лукьяненко, 1986), альбумины сыворотки крови волжской, окской и сибирской стерляди, в подавляющем большинстве выборок также показали недостоверность различий между фактическими и теоретически ожидаемыми частотами генотипов (Кузьмин, 1991а, б, 1996; Кузьмин, Кузьмина, 2005). Приведенные примеры, возможно, говорят о том, что условия, ограничивающие применение формулы Харди–Вайнберга, в данных случаях отсутствуют либо не оказывают существенного влияния на структуру популяций.
Денситометрический анализ индивидуальных спектров неспецифических эстераз в различных органах и тканях русского осетра позволил выделить две группы локусов. Представители одной из них, в которую входят простые белковые системы, представленные небольшим числом фракций, показывали практически идеальное совпадение с распределением Харди–Вайнберга. Другие же, полиаллельные, демонстрировали достоверное отклонение от теоретически ожидаемых частот (Кузьмин, 2002). В дальнейшем на основании данных денситометрии удалось предложить непротиворечивые гипотезы о генетической детерминации креатинкиназы русского и сибирского осетров (Кузьмин, 2008; Кузьмин, Кузьмина, 2012), а также одного из локусов миогенов русского, сибирского и амурского осетров (Кузьмин, Кузьмина, 2014), однако во всех этих случаях получены статистически значимые отклонения от распределения Харди–Вайнберга.
Возможно, различие в проявлении белковых систем у одного и того же вида связано с эффектом неодновременного прохождения процесса обратной диплоидизации разных локусов при наличии возмущающих факторов, ограничивающих применимость формулы Харди–Вайнберга.
Полимерная структура биохимических маркеров, к которым относится и димерная цитоплазматическая малатдегидрогеназа (МДГ), тоже является фактором, усложняющим выявление их генетической детерминации. Молекулы таких белков, состоящие из субъединиц разного типа, могут иметь одинаковую электрофоретическую подвижность. На проявление генетической составляющей могут накладывать свой отпечаток также и особенности объединения субъединиц в активные молекулы. Совокупность же этих параметров как раз и определяет фенотипическое проявление фракций на электрофореграммах (Кирпичников, 1987; Кузьмин, Кузьмина, 1987; Цветненко и др., 1987; Рябова, Кутергина, 1990; Кузьмин, 1991a, б).
Кроме всего прочего, у осетровых обнаружены признаки наличия нулевых аллелей, на что указывает отсутствие определенных полос в фенотипах МДГ русского осетра (Кузьмин, Кузьмина, 1987), а также полное отсутствие у нескольких особей севрюги ферментативной активности димерной креатинкиназы, которая интенсивно проявлялась у всех остальных особей исследованной выборки (Кузьмин, 2008). У белого осетра также было выявлено наличие нулевых аллелей (Rodzen, May, 2002). Нулевые субъединицы присутствуют в общем пуле, но судить об их существовании можно только в случае объединения в димерную молекулу двух таких неполноценных субъединиц.
На первоначальных этапах исследования гетерогенности и полиморфизма биохимических маркеров осетровых основное внимание исследователей было сосредоточено на описании качественной изменчивости спектров и анализе частот встречаемости фенотипов. Вариации интенсивности окрашивания полос обычно не оценивались, хотя в ряде работ можно найти обобщенные данные денситометрического анализа спектров исследованных выборок. При этом авторы, как правило, отмечали значительную индивидуальную изменчивость интенсивности окрашивания фракций (Слынько, 1976; Кузьмин, Кузьмина, 1987, 1998; Цветненко и др., 1987; Рябова, Кутергина, 1990; Кузьмин, 1991a, в).
Цитоплазматическая МДГ, которая обсуждается в настоящей работе, относится к группе “проблемных” биохимических маркеров. Гетерогенность, полиморфизм и фенотипическое разнообразие этого фермента осетровых рыб подробно изучены и описаны. Однако до сих пор не существует целостной гипотезы о его наследовании. В литературе имеются единичные примеры попыток проведения скрещиваний с целью выявления схем наследования МДГ у русского (Цветненко и др., 1987) и сибирского (Рябова и др., 2012) осетров, однако эти опыты не дали однозначных результатов, позволяющих предложить гипотезу генетической трактовки всего разнообразия выявляемых спектров. В настоящий момент с достаточной долей уверенности мы можем судить лишь о том, какие аллельные варианты субъединиц участвуют в образовании спектров МДГ и какие варианты молекул могут находиться в составе образующих эти спектры фракций (Кузьмин, Кузьмина, 1987). При этом генотипы конкретных особей остаются неизвестными, так как отсутствуют данные о дозах генов, детерминирующих образование различных типов субъединиц и принципах их объединения в димерные молекулы.
Цель работы заключалась в том, чтобы на основании данных денситометрического анализа интенсивности окрашивания изоферментов индивидуальных электрофоретических спектров предложить гипотезу о генетической составляющей цитоплазматической МДГ двух малохромосомных видов осетровых: севрюги и лопатоноса. Спектры этих видов у подавляющего большинства особей имеют по три изофермента, но при этом характеризуются высокой степенью индивидуальной изменчивости интенсивности окрашивания фракций.
При решении поставленной задачи мы основывались на данных, известных из литературных источников, о том, что цитоплазматическая МДГ осетровых рыб представляет собой димер, синтез белковых субъединиц которого кодируется двумя полиаллельными локусами, которые в ряде случаев могут быть дуплицированными. При формировании четвертичной структуры изоферментов в нативную молекулу могут объединяться как одинаковые, так и разные варианты субъединиц. На зимограммах гетеродимерные молекулы располагаются посередине между двумя соответствующими гомодимерными фракциями. Некоторые фракции электрофоретических спектров могут состоять из разных вариантов димерных молекул, имеющих одинаковую электрофоретическую подвижность. В генофонде осетровых рыб возможно наличие генов, которые в результате мутаций детерминируют образование дефектных (нулевых) вариантов субъединиц. Такие субъединицы, объединяясь попарно при формировании четвертичной структуры молекул МДГ, как в гомодимерном, так и в гетеродимерном состоянии друг с другом, образуют молекулы, не имеющие ферментативной активности (Слынько, 1976; Cross, Ward, 1980; Fisher et al., 1984; Кирпичников, 1987; Кузьмин, Кузьмина, 1987; Цветненко и др., 1987; Рябова и др., 2008).
МАТЕРИАЛЫ И МЕТОДЫ
В настоящем исследовании были использованы имеющиеся в нашем распоряжении архивы высушенных по разработанной нами методике блоков полиакриламидных гелей (Кузьмин, 1983), полученных в результате многолетнего изучения белкового полиморфизма природных популяций осетровых.
Объектами исследования служили два представителя сем. Acipenseridae: севрюга (Acipenser stellatus Pallas) и большой амударьинский лопатонос (Pseudoscaphirhynchus kaufmanni Bogdanov). Эти виды среди осетровых являются наиболее близкими по митохондриальным геномам (Sheraliev, Peng, 2020).
Севрюгу отлавливали в период с 1984 по 1999 год в бассейнах Каспийского и Азовского морей. Пробы отбирали как у рыб, идущих на нерест в реки Волгу, Урал и Кубань, так и у выловленных в нагульный период в водах самих морей. Амударьинский лопатонос был отловлен в мае 1986 г. в среднем течении р. Аму-Дарьи в районе пос. Керки (в настоящее время г. Атамурат). Отлавливали половозрелых особей, степень зрелости половых продуктов у которых оценивали визуально по общепринятой схеме (Киселевич, 1922). В общей сложности подвергли денситометрическому анализу зимограммы 427 особей севрюги и 29 большого амударьинского лопатоноса. Для анализа брали аддуктор грудного плавника (белая мускулатура). До момента проведения электрофореза пробы мышц хранили не более двух недель в замороженном состоянии при –18°С.
Анализировали цитоплазматическую НАД+-зависимую МДГ (КФ 1.1.1.37). Этот димерный фермент локализован в цитоплазме, участвует в процессе гликолиза и обеспечивает транспорт метаболитов через клеточную мембрану (Ленинджер, 1974; Мусил и др., 1984; Кирпичников, 1987). Для отделения цитоплазматической МДГ от митохондриальной использовали метод дифференциального центрифугирования. Для этого навески мышц гомогенизировали при температуре около 0°С в десятикратном объеме электродного трис-глицинового буфера рН 8.3 (основной раствор разбавляли в 20 раз). После суточной экстракции при 4°С пробы центрифугировали в течение часа при 0°С и 10000 g. Митохондрии с локализованной в них митохондриальной МДГ выпадали в осадок вместе с ядрами и другими клеточными органеллами. Цитоплазматическая МДГ оставалась в надосадочной жидкости, которую отбирали для последующего анализа. Фракционирование белков производили методом диск-электрофореза в блоках 7%-ного полиакриламидного геля. Учитывая, что молекула МДГ представляет собой димер, электрофорез проводили в максимально щадящих условиях, при низкой температуре, исключая применение детергентов и наличия ультрафиолетового облучения. Подробности приготовления проб, особенности фракционирования и выявления мышечной МДГ были описаны ранее (Кузьмин, Мензиков, 1988; Кузьмин, 1994). Денситометрирование проводилось путем сканирования высушенных гелей на микроденситометре MD-100 (“Carl Zeiss”, Jena). Оцифровку полученных денситограмм и определение соотношения площадей пиков проводили при помощи специально разработанной оригинальной компьютерной программы.
Электрофоретические методы не позволяют установить место локализации генов в хромосомах, они лишь констатируют наличие продуктов их активности. Гены могут располагаться в хромосомных локусах в разных комбинациях, но в результате активности этих генов образуется пул субъединиц. При четко определенных правилах объединения их в биологически активные димеры после фракционирования и выявления ферментативной активности изоферментов мы наблюдаем спектры с соответствующим соотношением интенсивности окрашивания фракций.
Денситометрия позволяет оценить дозы различных субъединиц (в том числе и нулевых) и предложить возможные способы их объединения при образовании конкретных анализируемых спектров. Запись генотипов в этом случае осуществляется в обобщенном виде, с указанием дозы и способов объединения субъединиц. Следует отметить, что практически в любой фракции могут присутствовать димеры, образованные как полноценными субъединицами, так и молекулами, у которых нулевой является одна, или даже обе субъединицы, так как все эти варианты молекул имеют одинаковую электрофоретическую подвижность. На это указывает тот факт, что у рыб с трехкомпонентными спектрами фракции значительно различаются по характеру выраженности изоферментов без изменения расположения полос относительно друг друга.
Фракции МДГ обозначали заглавными буквами латинского алфавита (A, B, C, C', D, E), как это было принято ранее при первоначальном описании спектров севрюги и лопатоноса (Кузьмин, Кузьмина, 1998).
Во избежание путаницы и недопонимания, в тексте аллельные варианты субъединиц, образующие нативные димерные молекулы МДГ, отмечали курсивом. Субъединицы, свободно и независимо рекомбинирующие между собой, обозначали заглавными буквами латинского алфавита со звездочкой (*A, *B, *C), а аллельные варианты субъединиц, избирательно объединяющиеся в димеры, обозначали прописными буквами, также со звездочкой (*a, *b). Знаком “//” разделяли группы аллелей, различающиеся по способу объединения в димеры, знаком “/” – как отдельные аллели, так и пары аллелей с предпочтительной ассоциацией. Знак “↔” показывает, какие именно аллели избирательно объединяются друг с другом. Ноль в нижнем регистре (“0”) справа от обозначения аллеля указывает на то, что этот его вариант является нулевым. Коэффициент перед буквенным обозначением аллелей показывает дозу субъединиц этого типа у особей, имеющих данный генотип. В своей работе мы старались придерживаться номенклатуры, рекомендованной для использования при проведении генетических исследований рыб (Shaklee et al., 1990).
Обрабатывая полученные данные, проводили теоретические расчеты, проверяя все возможные варианты объединения субъединиц в димерные молекулы в соответствии с тестируемой гипотезой, с последующим сравнением результатов с характеристиками реально наблюдаемых спектров. Полученные фактические данные о соотношении интенсивности окрашивания полос распределялись по соответствующим теоретически возможным группировкам. Особи, не имеющие точного теоретического эквивалента, присоединялись к наиболее близкому из статистических рядов. Затем полученные данные обрабатывали статистическими методами. Для выборок, включающих более пяти особей, вычисляли средние значения (x̄) и доверительные интервалы (±tsx̄) для 5%-ного уровня значимости (Лакин, 1980). Для редко встречающихся спектров приводили только средние значения.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследованные представители сем. Acipenseridae относятся к группе малохромосомных осетровых (2n ≈ 120), которые согласно “современной шкале” относятся к диплоидным видам (Васильев, 1985; Васильев и др., 2009; Vasil’ev et al., 2010; Kovalev et al., 2014). Существует предположение, что в эволюции осетрообразных произошло два последовательных удвоения хромосомного набора с последующей обратной диплоидизацией. Мы взяли за основу для своих построений гипотезу, согласно которой севрюга и лопатонос являются функциональными диплоидами, у которых не исключена вероятность дуплицирования отдельных генов (Васильев, 1985; Ludwig et al., 2001; Васильев и др., 2009).
На рис. 1 показаны характерные примеры вариаций интенсивности окрашивания изоферментов МДГ севрюги и лопатоноса. Спектры МДГ у подавляющего большинства особей севрюги и у всех особей лопатоноса представлены тремя фракциями, сформированными двумя типами субъединиц (Никоноров и др., 1985; Рябова, Кутергина, 1990; Кузьмин, Кузьмина, 1998). Детерминированные тремя аллельными вариантами многокомпонентные спектры у севрюги встречаются достаточно редко, а у амударьинского лопатоноса не обнаружено ни одной такой особи. Трехкомпонентные спектры МДГ детерминированы двумя типами аллелей, а многокомпонентные – тремя. Фракции A, C и E состоят из гомодимерных молекул, а фракции B, C' и D – гетеродимерных, образованных в результате попарного сочетания различающихся аллельных вариантов субъединиц.
Рис. 1.
Примеры количественной изменчивости электрофоретических спектров МДГ севрюги (а) и большого амударьинского лопатоноса (б). Общие характеристики спектров, выделенных в отдельные группы: I. A ≈ B ≈ C; II. A < B > C; III. A ≈ B > C; IV. A > B ≈ C; V. A > B < C; VI. A < B ≈ C; VII. A > B > C; VIII. A > B $ \gg $ C; IX. A ≈ B ≈ C' > D > E; X. A > B ≈ ≈ C' > D > E; XI. A ≈ B > C' > C > D > E.
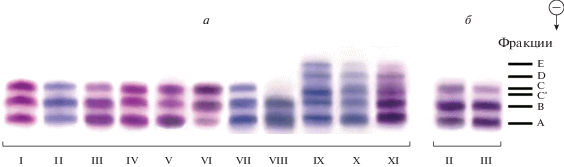
Встречаемость вариантов спектров МДГ севрюги не зависела ни от места вылова, ни от пола, ни от стадии зрелости гонад. Совершенно одинаковые варианты спектров наблюдались у рыб с разной степенью зрелости гонад, как в реках, так и в морях. У большого амударьинского лопатоноса, среди рыб с одинаковыми спектрами МДГ, также можно было встретить и самцов и самок с различной стадией зрелости гонад. Вероятно, эти данные указывают на то, что цитоплазматическая МДГ не зависит от физиологического состояния исследованных рыб.
Попытки объяснить индивидуальную вариабельность окрашивания изоферментов севрюги и лопатоноса свободной и независимой рекомбинацией субъединиц в случае их детерминации различным числом генов (что вполне возможно у осетровых) не смогли удовлетворительно объяснить наблюдаемую на практике изменчивость. Из всех проверенных вариантов наибольшее сходство с фактически наблюдаемой картиной спектров получено при проверке гипотезы о восьмигенном кодировании синтеза субъединиц, хотя и эта гипотеза не позволяла трактовать значительную часть реально встречаемых зимограмм.
Предположение о том, что различия в интенсивности окрашивания индивидуальных фракций изоферментов МДГ вызваны тем, что гетеродимерные молекулы, в состав которых входит одна нулевая субъединица, обладают пониженной ферментативой активностью, не подтвердилось, в том числе и для гипотезы о восьмигенном кодировании синтеза субъединиц. Проверка показала, что такие молекулы обладают довольно высокой ферментативной активностью, но каких-либо закономерностей в их проявлении выявить не удалось. Если же теоретически рассчитать последствия существенного снижения активности гетеродимеров (50%; 75%), в которых одна из субъединиц является нулевой, то в реально наблюдаемых спектрах не обнаруживаются соответствующие аналоги. Вероятно, существуют какие-то компенсаторные механизмы, которые позволяют димерным молекулам МДГ достаточно успешно осуществлять свои функции даже в случае присутствия в их составе одной нулевой субъединицы.
Присутствие в генотипах севрюги нулевых аллелей субъединиц, характерной особенностью которых является отсутствие ферментативной активности у гомодимерных молекул, так же как и при объединении с другим вариантом нулевой субъединицы, особенно ярко проявляется у рыб с многокомпонентным спектром IX (рис. 1). Отсутствие фракции C указывает на то, что у таких рыб все аллели *В и *b, которые в виде димеров обеспечивают проявление активности этой фракции, в данном случае представлены только нулевыми вариантами субъединиц *B0 и *b0. Наличие интенсивно окрашенной фракции E, а также присутствие четко выраженной промежуточной фракции D, образованной димерами, один из которых обязательно должен быть нулевым, свидетельствует о том, что гетеродимерные молекулы, в которых один из двух аллелей является нулевым, обладают ферментативной активностью. Наличие интенсивной фракции B подтверждает это предположение, поскольку в этой фракции расположены гетеродимеры, в состав которых входят молекулы, одной из субъединиц которых непременно является вариант *B0 или *b0. Появление в многокомпонентных спектрах фракций С' и D позволяет сделать еще одно важное заключение. Редкий аллель *С, димеры которого образуют фракцию Е, относится к группе, детерминирующей субъединицы, свободно и независимо объединяющиеся между собой в активные молекулы МДГ.
Аналогичные выводы можно сделать и анализируя спектры группы X (рис. 1), также состоящие из пяти фракций, но с несколько отличающимся соотношением интенсивности их окрашивания.
На присутствие у севрюги нулевых вариантов субъединиц в трехкомпонентных спектрах указывает анализ довольно часто встречающихся рыб группы VIII (рис. 1), в которой явно доминируют нулевые варианты субъединиц *B0 и *b0, образующие едва выраженную фракцию С.
Наличие в спектрах слабо или совсем не выраженных фракций, образованных димерами, состоящими из двух нулевых субъединиц, и одновременное присутствие в тех же спектрах интенсивно окрашенных фракций, в составе которых находятся в том числе и молекулы, где лишь одна из субъединиц является нулевой, невольно вызывает вопрос об интенсивности ферментативной активности таких молекул МДГ. Однако ответ на этот вопрос требует отдельного подробного исследования.
Обобщая полученные результаты, мы пришли к заключению, что существует еще какой-то фактор (или факторы), не учтенные нами, но влияющие на образование активных молекул МДГ. Наиболее вероятным из таких факторов мы сочли наличие ассортативности при объединении субъединиц в димеры. Тем более что ранее эффект избирательного объединения субъединиц МДГ, детерминированных двумя локусами, один из которых возник в результате дупликации, был обнаружен при изучении неравномерности окраски фракций у двух видов трипаносоматид (Крылов, Белова, 1984).
Исходя из этого предположения, была проверена гипотеза, основанная на том, что после дупликации двух исходных локусов аллельные субъединицы (*Ai, $*A_{i}^{'}$, *Bi, $*B_{i}^{'}$) – продукты анцестральных генов, – сохранили способность объединяться в димеры свободно и независимо, в то время как аллели (*ai, $*a_{i}^{'}$ и *bi, $*b_{i}^{'}$), детерминированные генами-дупликантами, потеряли возможность свободного и независимого объединения и стали образовывать димеры исключительно с субъединицами-дериватами своего аналога из гомологичной хромосомы. В таком случае на зимограммах МДГ будет наблюдаться результат суммирования активности молекул, образующихся при свободной и независимой рекомбинации субъединиц анцестральных генов и активности димеров, образующихся в результате избирательного объединения субъединиц-дериватов генов- дупликантов.
В общем виде схема предлагаемой нами гипотезы механизма возникновения наблюдаемой изменчивости проявления изоферментов МДГ на электрофореграммах представлена на рис. 2.
Рис. 2.
Схема механизмов, обеспечивающих возникновение количественной изменчивости интенсивности окрашивания изоферментов МДГ севрюги и большого амударьинского лопатоноса. *Ai, $*A_{i}^{'}$, *Bi, $*B_{i}^{'}$ – анцестральные гены, детерминирующие синтез аллельных вариантов субъединиц, случайно и независимо объединяющихся между собой в димерные молекулы МДГ. *ai, $*a_{i}^{'}$, *bi, $*b_{i}^{'}$ – гены-дупликанты, детерминирующие синтез аллельных вариантов субъединиц, избирательно ассоциирующихся в димерные молекулы МДГ. n, n' – гомологичные хромосомы.
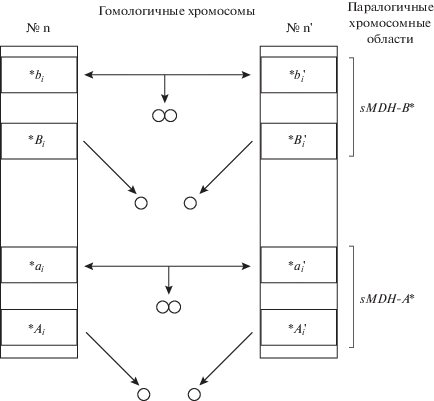
Следует отметить, что в случае, если современные малохромосомные севрюга и лопатонос сохранили отдельные черты палеотетраплоидности, как это было показано на стерляди (Romanenko et al., 2015), то паралогичные гены МДГ могут располагаться в разных хромосомах. Такое распределение не противоречит заявленной гипотезе.
Предлагаемая нами схема позволяет дать объяснение наблюдаемых характеристик всех без исключения выявленных спектров МДГ, в том числе и многокомпонентных. Как было сказано выше, аллельная субъединица *С относится к группе субъединиц, свободно и независимо объединяющихся в димерные молекулы. Только в этом случае наблюдается достаточно близкое совпадение теоретических и фактических соотношений интенсивности окрашивания изоферментов даже для немногочисленных многокомпонентных особей.
При описании количественной изменчивости спектров, подобно тому как это делалось при изучении индивидуальных различий поведения рыб (Будаев и др., 2015) по их характеристикам, всех исследованных особей, как это показано на рис. 1, мы разделили на группы. Внутри выделенных групп наблюдается дополнительная подразделенность, основанная на таком показателе, как индивидуальное соотношение интенсивности окрашивания изоферментов.
Исходя из принципов, принятых нами за основу для выдвигаемой гипотезы, мы рассчитали все теоретически возможные варианты генотипов (в общей сложности их оказалось 1705) и соответствующие им характеристики интенсивности проявления изоферментов. Фактические соотношения интенсивности окрашивания фракций каждой особи проверяли на соответствие тем или иным теоретически ожидаемым параметрам, после чего рыбы распределялись по подгруппам. В случае, если фактические соотношения не совпадали в точности с теоретически ожидаемыми, спектры распределяли в подгруппу с наиболее близкими характеристиками. Суммарно в исследованной выборке севрюги было выделено 29 подгрупп трехкомпонентных спектров, а в выборке лопатоноса – 4. Все подгруппы лопатоноса имели аналоги среди трехкомпонентных спектров севрюги. Результаты статистического анализа характеристик сгруппированных в подгруппы рыб представлены в табл. 1.
Таблица 1.
Теоретически ожидаемые и фактические соотношения интенсивности окрашивания фракций спектров МДГ севрюги и большого амударь-инского лопатоноса, а также перечень генотипов, определяющих данные соотношения фракций, исходя из предлагаемой гипотезы формирования спектров
| № группы |
№ п/п |
n | Соотношения интенсивности окрашивания фракций |
Генотипы | |
|---|---|---|---|---|---|
| теоретические | фактические | ||||
| Севрюга | |||||
| I | 1 | 30 | 1 : 1 : 1 1.1 : 1.1 : 1 1 : 1.1 : 1.1 |
(1.14 ± 0.02) : (1.09 ± 0.02) : (1.01 ± 0.02) | 2A/2B//1a ↔ 1a /1b ↔ 1b; 1A/1A0 /1B/1B0 //1a ↔ 1a0 /1b ↔ 1b0 ; 2A/1B/1B0 //1a ↔ 1a0 /1b ↔ 1b; 2A/2B//1a ↔ 1a /1b ↔ 1b0 ; 2A/2B//1a ↔ 1a0 /1b ↔ 1b; 1A/1A0 /2B//1a ↔ 1a /1b ↔ 1b |
| II | 2 | 11 | 1 : 1.3 : 1 | (1.05 ± 0.04) : (1.31 ± 0.02) : (1.02 ± 0.03) | 1A/2A0 /1B//1a ↔ 1a /1b ↔ 1b; 1A/1A0 /2B0 //1a0 ↔ 1a0 /1b ↔ 1b0; 1A/1A0 /2B0 //1a0 ↔ 1b0 /1b ↔ 1b0 ; 1A/1A0 /2B0 //1b ↔ 1b0 /1b0 ↔ 1b0 ; 1A/1B/2B0 //1a ↔ 1a/1a ↔ 1b; 2A0 /1B/1B0 //1a ↔ 1a0 /1a0 ↔ 1a0 ; 2A0 /1B/1B0 //1a ↔ 1a0 /1a0 ↔ 1b0 ; 2A0 /1B/1B0 //1a ↔ 1a0 /1b0 ↔ 1b0 |
| 3 | 2 | 1 : 1.6 : 1.2 | 1 : 1.60 : 1.15 | 1A/2A0 /1B//1a0 ↔ 1b/1b ↔ 1b; 1A/1B/2B0 //1a ↔ 1a0 /1a ↔ b; 1A/1B/2B0 //1a ↔ 1a /1a0 ↔ 1b | |
| 4 | 6 | 1.2 : 1.6 : 1 | (1.23 ± 0.05) : (1.65 ± 0.11) : 1 | 1A/2A0 /1B//1a ↔ 1b0 /1b ↔ 1b; 1A/2A0 /1B//1a ↔ 1b /1b ↔ 1b0 ; 1A/1B/2B0 //1a ↔ 1a /1a ↔ 1b0 | |
| 5 | 12 | 1.6 : 2 : 1 | (1.48 ± 0.06) : (1.83 ± 0.10) : 1 | 2A/2B//1a ↔ 1a0 /1a ↔ 1b; 2A/2B//1a ↔ 1a /1a0 ↔ 1b; 1A/1A0 /2B//1a ↔ 1a /1a ↔ 1b | |
| 6 | 9 | 2 : 2.5 : 1 | (2.01 ± 0.09) : (2.46 ± 0.10) : 1 | 2A/1B/1B0 //1a ↔ 1a0 /1a ↔ 1b; 2A/1B/1B0 //1a ↔ 1a/1a0 ↔ 1b; 2A/2B//1a ↔ 1a0 /1a ↔ 1b0 ; 2A/1A0 /1B0 //1a0 ↔ 1b/1b ↔ 1b0 ; 1A/1A0 /2B//1a ↔ 1a/1a ↔ 1b0 | |
| III | 7 | 15 | 1.2 : 1.3 : 1 | (1.23 ± 0.03) : (1.27 ± 0.03) : 1 | 2A/1B/1B0 //1a ↔ 1a0 /1b ↔ 1b0 |
| 8 | 29 | 1.3 : 1.3 : 1 | (1.32 ± 0.03) : (1.33 ± 0.02) : 1 | 2A/1A0 /1B//1a0 ↔ 1b/1b ↔ 1b; 2A/1B/1B0 //1a ↔ 1a/1b ↔ 1b0 ; 2A0 /1B/1B0 //1a ↔ 1a /1a0 ↔ 1a0 ; 2A0 /1B/1B0 //1a ↔ 1a/1a0 ↔ b0; 2A0 /1B/1B0 //1a ↔ 1a /1b0 ↔ 1b0 | |
| 9 | 46 | 1.3 : 1.5 : 1 | (1.37 ± 0.01) : (1.50 ± 0.02) : 1 | 1A/3B0 //1a ↔ 1a/1b ↔ 1b; 1A/2A0 /1B//1a0 ↔ 1a0 /1b ↔ b0 ; 1A/2A0 /1B//1a0 ↔ 1b0 /1b ↔ 1b0 ; 1A/2A0 /1B//1b ↔ 1b0 /1b0 ↔ 1b0 ; 2A0 /1B/1B0 //1a ↔ 1a /1a ↔ 1b | |
| 10 | 25 | 1.5 : 1.3 : 1 | (1.52 ± 0.02) : (1.34 ± 0.03) : 1 | 2A/1A0 /1B//1a ↔ 1b /1b ↔ 1b; 3A/1B//1a0 ↔ 1b /1b ↔ 1b | |
| 11 | 54 | 1.6 : 1.6 : 1 | (1.55 ± 0.01) : (1.56 ± 0.02) : 1 | 2A/1A0 /1B//1a0 ↔ 1b/1b ↔ 1b0 | |
| 12 | 39 | 1.8 : 1.6 : 1 | (1.78 ± 0.03) : (1.62 ± 0.03) : 1 | 2A/1A0 /1B//1a ↔ 1b0 /1b ↔ 1b; 2A/1A0 /1B//1a ↔ 1b /1b ↔ 1b0 ; 3A/1B0 //1a0 ↔ 1b /1b ↔ 1b; 3A/1B//1a0 ↔ 1b/1b ↔ 1b0 | |
| 13 | 13 | 1.8 : 2 : 1 | (1.75 ± 0.03) : (1.85 ± 0.04) : 1 | 2A/2B//1a ↔ 1a0 /1a0 ↔ 1a0; 2A/2B//1a ↔ 1a0 /1a0 ↔ 1b0 ; 2A/2B//1a ↔ 1a0 /1b0 ↔ 1b0 ; 2A/2B//1a ↔ 1a/1a ↔ 1b; 2A/2B0 //1a ↔ 1a0 /1b ↔ 1b; 2A0 /2B//1a ↔ 1a /1a ↔ 1a0 ; 1A/1A0 /2B//1a ↔ 1a/1a0 ↔ 1a0 ; 1A/1A0 /2B//1a ↔ 1a/1a0 ↔ b0 ; 1A/1A0 /2B//1a ↔ 1a/1b0 ↔ 1b0 ; 1A/1A0 /1B/1B0 //1a ↔ 1a0 /1a ↔ 1b; 1A/1A0 /1B/1B0 //1a ↔ 1a/1a0 ↔ 1b | |
| 14 | 19 | 2 : 2 : 1 | (2.03 ± 0.07) : (1.97 ± 0.07) : 1 | 2A/2B//1a ↔ 1a /1a0 ↔ 1a0 ; 2A/2B//1a ↔ 1a /1a0 ↔ 1b0; 2A/2B//1a ↔ 1a /1b0 ↔ 1b0 ; 2A/2B0 //1a ↔ 1a /1b ↔ 1b; 2A0 /2B//1a ↔ 1a /1a ↔ 1a; 1A/1A0 /1B/1B0 //1a ↔ 1a0 /1a0 ↔ 1a0 ; 1A/1A0 /1B/1B0 //1a ↔ 1a0 /1a0 ↔ 1b0 ; 1A/1A0 /1B/1B0 //1a ↔ 1a0 /1b0 ↔ 1b0; 1A/1A0 /1B/1B0 //1a ↔ 1a/1a ↔ b | |
| 15 | 7 | 2.7 : 2.7 : 1 | (2.69 ± 0.29) : (2.50 ± 0.24) : 1 | 2A/1B/1B0 //1a ↔ 1a/1a0 ↔ 1a0 ; 2A/1B/1B0 //1a ↔ 1a/1a0 ↔ b0 ; 2A/1B/1B0 //1a ↔ 1a /1b0 ↔ 1b0; 2A/2B0 //1a ↔ 1a/1b ↔ 1b0 ; 1A/1A0 /1B/1B0 //1a ↔ 1a/1a ↔ 1b0 | |
| IV | 16 | 18 | 1.3 : 1 : 1 | (1.31 ± 0.01) : (1.04 ± 0.03) : (1.02 ± 0.02) | 1A/2A0 /1B0 //1a0 ↔ 1b/1b ↔ 1b0 |
| 17 | 12 | 1.4 : 1.2 : 1 | 1.40 : (1.15 ± 0.03) : 1 | 1A/1B/2B0 //1a ↔ 1a0 /1a ↔ 1a0 | |
| 18 | 5 | 1.5 : 1 : 1 | 1.50 : 1.08 : 1.02 | 1A/1A0 /2B0 //1a ↔ 1a0 /1b ↔ 1b; 1A/2A0 /1B0 //1a ↔ 1b0 /1b ↔ 1b; 1A/2A0/1B0 //1 a ↔ 1b/1b ↔ 1b0; 3A/1B0 //1b ↔ 1b0 /1b ↔ 1b0 | |
| 19 | 13 | 1.7 : 1.3 : 1 | (1.65 ± 0.03) : (1.38 ± 0.04) : 1 | 3A/1B//1a ↔ 1b/1b ↔ 1b | |
| 20 | 8 | 1.8 : 1.2 : 1 | 1.80 : (1.16 ± 0.12) : (1.06 ± 0.08) | 1A/2A0 /1B//1a ↔ 1b/1b ↔ 1b; 2A/1A0 /1B0 //1a ↔ 1b/1b ↔ 1b; 3A/1B//1a0 ↔ 1a0 /1b ↔ 1b; 3A/1B//1a0 ↔ 1b0 /1b ↔ 1b; 3A/1B//1b ↔ 1b/1b0 ↔ 1b0; 1A/1B/2B0 //1a ↔ 1a/1a ↔ 1a | |
| 21 | 15 | 2 : 1.3 : 1 | (2.02 ± 0.08) : (1.34 ± 0.04) : 1 | 1A/1A0 /2B0 //1a ↔ 1a0 /1b ↔ 1b0 ; 1A/2A0 /1B0 //1a ↔ 1b0 /1b ↔ 1b0 ; 2A0 /1B/1B0 //1a ↔ 1a0 /1a ↔ 1a0 | |
| 22 | 5 | 2 : 1 : 1 | 1.84 : 1 : 1.16 | 2A/1A0 /1B0 //1a0 ↔ 1a0 /1b ↔ 1b; 2A/1A0 /1B0 //1a0 ↔ 1b0 /1b ↔ 1b; 2A/1A0 /1B0 //1b ↔ 1b/1b0 ↔ 1b0 | |
| V | 23 | 3 | 2 : 1 : 1.5 | 1.77 : 1 : 1.37 | 2A/1A0 /1B0 //1b0 ↔ 1b0 /1b0 ↔ 1b0 |
| VI | 24 | 3 | 1 : 2 : 1.8 | 1 : 1.80 : 1.63 | 2A/2B//1a ↔ 1b/1b ↔ 1b; 2A/2B//1a0 ↔ 1a0 /1b ↔ 1b0 ; 2A/2B//1a0 ↔ 1b0 /1b ↔ 1b0 ; 2A/2B//1b ↔ 1b0 /1b0 ↔ 1b0 ; 2A/2B0 //1b ↔ 1b/1b ↔ 1b0 ; 2A/1B/1B0 //1a0 ↔ 1a0 /1b ↔ 1b; 2A/1B/1B0 //1a0 ↔ 1b0 /1b ↔ 1b; 2A/1B/1B0 //1b ↔ 1b/1b0 ↔ b0; 1A/1A0 /1B/1B0 //1a ↔ 1b0 /1b ↔ 1b; 1A/1A0 /1B/1B0 //1a ↔ 1b/1b ↔ 1b0 ; 2A0 /2B//1a ↔ 1a/1b ↔ 1b0 |
| VII | 25 | 10 | 2 : 1.6 : 1 | (2.09 ± 0.11) : (1.70 ± 0.07) : 1 | 3A/1B0 //1a ↔ 1b/1b ↔ 1b; 3A/1B//1a ↔ 1b0 /1b ↔ 1b; 3A/1B//1a ↔ 1b/1b ↔ 1b0 |
| VIII | 26 | 4 | 5 : 4 : 1 | 5.25 : 3.73 : 1 | 2A/1A0 /1B0 //1a ↔ 1b/1a ↔ 1b; 3A/1B//1a ↔ 1b/1a0 ↔ 1a0 ; 3A/1B//1a ↔ 1b/1a0 ↔ 1b0 ; 3A/1B//1a ↔ 1b/1b0 ↔ 1b0 ; 1A/2A0 /1B0 //1a0 ↔ 1a0 /1a0 ↔ b; 1A/2A0 /1B0 //1a0 ↔ 1b/1a0 ↔ 1b; 1A/2A0 /1B0 //1a0 ↔ 1b/1b0 ↔ 1b0 |
| 27 | 3 | 9 : 6 : 1 | 9.07 : 5.83 : 1 | 1A/2A0 /1B//1a ↔ 1a/1a0 ↔ 1a0 ; 1A/2A0 /1B//1a ↔ 1a/1a0 ↔ 1b0 ; 1A/2A0 /1B//1a ↔ 1a/1b0 ↔ 1b0 ; 2A/1A0 /1B0 //1a ↔ 1b/1a0 ↔ 1a0 ; 2A/1A0 /1B0 //1a ↔ 1b/1a0 ↔ 1b0 ; 2A/1A0 /1B0 //1a ↔ 1b/1b0 ↔ 1b0; 3A/1B//1a0 ↔ 1a0 /1a0 ↔ 1a0 ; 3A/1B//1a0 ↔ 1a0 /1a0 ↔ 1b0 ; 3A/ 1B//1a0 ↔ 1b0 /1a0 ↔ 1b0 ; 3A/1B//1a0 ↔ a0 /1b0 ↔ 1b0 ; 3A/1B//1a0 ↔ 1b0 /1b0 ↔ 1b0 ; 3A/1B//1b0 ↔ 1b0 /1b0 ↔ 1b0 | |
| 28 | 1 | 13 : 8 : 1 | 12.70 : 8.60 : 1 | 3A/1B//1a ↔ 1a0 /1a ↔ 1b0; 3A/1B0 //1a ↔ a0 /1a ↔ 1b; 3A/1B0 //1a ↔ 1a/1a0 ↔ 1b; 2A/1A0 /1B//1a ↔ 1a/1a ↔ 1b0 | |
| 29 | 1 | 17 : 6 : 1 | 18.40 : 7.60 : 1 | 3A/1B//1a ↔ 1a/1a ↔ 1a | |
| IX | 30 | 5 | 4 : 4 : 4 : 2 : 1 | 4.08 : 2.98 : 3.72 : 1.98 : 1 | 2A/1B0 /1C//1a0 ↔ 1a0 /1a0 ↔ 1a0; 2A/1B0 /1C//1a0 ↔ 1a0 /1a0 ↔ 1b0; 2A/1B0 /1C//1a0 ↔ 1b0 /1a0 ↔ 1b0; 2A/1B0 /1C//1a0 ↔ 1a0 /1b0 ↔ 1b0; 2A/1B0 /1C//1a0 ↔ 1b0 /1a0 ↔ 1b0; 2A/1B0 /1C//1b0 ↔ 1b0 /1b0 ↔ 1b0 ; 1A/1A0 /1B0 /1C//1a ↔ 1b0 /1a0 ↔ 1a0 ; 1A/1A0 /1B0 /1C//1a ↔ 1b0 /1b0 ↔ 1b0 |
| X | 31 | 3 | 8 : 4 : 4 : 2 : 1 | 7.50 : 5.0 : 5.17 : 2.73 : 1 | 2A/1B0 /1C//1a ↔ 1a/1a0 ↔ 1a0 ; 2A/1B0 /1C//1a ↔ 1a/a0 ↔ b0 ; 2A/1B0 /1C//1a ↔ 1a/1b0 ↔ 1b0 ; 1A/1A0 /1B0 /1C//1a ↔ 1a/1a ↔ 1b0 |
| XI | 32 | 1 | 6 : 8 : 4 : 3 : 2 : 1 | 7.60 : 6.60 : 3.50 : 2.90 : 2.40 : 1 | 2A/1B/1C//1a ↔ 1b/1a ↔ 1b |
| Большой амударьинский лопатонос | |||||
| II | 5 | 1 | 1.6 : 2 : 1 | 1.50 : 1.90 : 1 | 2A/2B//1a ↔ 1a0 /1a ↔ 1b; 2A/2B//1a ↔ 1a /1a0 ↔ 1b; 1A/1A0 /2B//1a ↔ 1a /1a ↔ 1b |
| III | 11 | 7 | 1.6 : 1.6 : 1 | (1.64 ± 0.05) : (1.69 ± 0.06) : 1 | 2A/1A0 /1B//1a0 ↔ 1b /1b ↔ 1b0 |
| 14 | 13 | 2 : 2 : 1 | (1.94 ± 0.13) : (2.05 ± 0.13) : 1 | 2A/2B//1a ↔ 1a /1a0 ↔ 1a0 ; 2A/2B//1a ↔ 1a /1a0 ↔ 1b0 ; 2A/2B//1a ↔ 1a /1b0 ↔ 1b0 ; 2A/2B0 //1a ↔ 1a /1b ↔ 1b; 2A0 /2B//1a ↔ 1a/1a ↔ 1a; 1A/1A0 /1B/1B0 //1a ↔ 1a0 /1a0 ↔ 1a0 ; 1A/1A0 /1B/1B0 //1a ↔ 1a0 /1a0 ↔ 1b0; 1A/1A0 /1B/1B0 //1a ↔ 1a0 /1b0 ↔ 1b0 ; 1A/1A0 /1B/1B0 //1a ↔ 1a /1a ↔ 1b |
|
| 15 | 8 | 2.7 : 2.7 : 1 | (2.49 ± 0.16) : (2.50 ± 0.17) : 1 | 2A/1B/1B0 //1a ↔ 1a/1a0 ↔ 1a0 ; 2A/1B/1B0 //1a ↔ 1a/1a0 ↔ 1b0 ; 2A/1B/1B0 //1a ↔ 1a/1b0 ↔ 1b0 ; 2A/2B0 //1a ↔ 1a/1b ↔ 1b0 ; 1A/1A0 /1B/1B0 //1a ↔ 1a/1a ↔ 1b0 | |
Данные таблицы показывают хорошее совпадение теоретически ожидаемых и фактически наблюдаемых соотношений как у севрюги, так и у лопатоноса. Теоретические значения располагаются либо в границах доверительных интервалов, либо в непосредственной близости от этих границ. При этом все фактически наблюдаемые варианты спектров получили обоснованное, хотя в ряде случаев многозначное, толкование их генетической детерминации. Из приведенных в таблице данных следует, что спектры с одинаковым соотношением интенсивности проявления фракций МДГ могут определяться различными генотипами. Число генотипов, определяющее одно и то же соотношение интенсивности окрашивания полос, не связано с частотой встречаемости в выборке рыб с данными характеристиками. Количество генотипов, детерминирующих спектры с определенным соотношением окраски изоферментов, у севрюги варьировало от одного до двенадцати, а у лопатоноса от одного до девяти. Из данных таблицы также следует, что однозначно определить индивидуальный генотип можно лишь у рыб с соотношением активности изоферментов, детерминированным единственно возможным вариантом генотипа. В исследованной нами выборке севрюги к ним относятся подгруппы № 7, 11, 16, 17, 19, 23, 29, 32. У лопатоноса лишь одна из выделенных подгрупп (№ 11) имеет единственный вариант генетической трактовки.
Теоретически, помимо встреченных в выборке соотношений интенсивности окрашивания фракций, возможно существование значительного числа других вариантов спектров. В том числе двух- и однокомпонентных, которых в реальных выборках мы никогда не наблюдали. Возможно, это связано с фиксацией в генофонде отдельных генов, наличие которых жизненно необходимо для существования рыб. Логично предположить, что такими генами могут оказаться анцестральные гены, детерминирующие синтез аллелей *А и *В. Не исключено, однако, что это связано с низкой частотой встречаемости редких спектров при недостаточным объеме выборки и столь большом количестве теоретически возможных вариантов генотипов.
Теоретически также возможно и полное отсутствие проявления активности МДГ в случае, если в генотипе особи присутствуют только нулевые аллели. Любопытно, что ранее мы встречались с подобным явлением при изучении креатинкиназы севрюги. У трех рыб в мышечной ткани активность этого фермента абсолютно отсутствовала, хотя у всех остальных особей имела обычно высокую активность (Кузьмин, 2008). Таким образом, вопрос об отсутствии в исследованных нами выборках значительной части теоретически возможных вариантов остается открытым и требует дальнейшего изучения.
Анализ генотипов, определяющих количественную изменчивость интенсивности окрашивания изоферментов трехкомпонентой МДГ, показал (табл. 1), что все гены, детерминирующие синтез свободно и независимо рекомбинирующих субъединиц (*Ai, $*A_{i}^{'}$, *Bi, $*B_{i}^{'}$), так же как и гены, определяющие синтез субъединиц, объединяющихся в димеры, избирательно (*ai, $*a_{i}^{'}$ и *bi, $*b_{i}^{'}$) способны детерминировать любой из аллельных (в том числе и нулевых) вариантов субъединиц: *А, *В и *С в первом случае, и *a и *b – во втором. Четкая дифференциация локусов sMDH-A* и sMDH-B* по этому показателю отсутствует. На это указывает существование генотипов, в которых доля одного из аллелей среди анцестральных генов, так же как и среди генов-дупликантов (учитывая нулевые варианты), превышает 50%. В качестве примера можно привести такие генотипы, как 3A/1B//1a ↔ 1b/1b ↔ 1b (1.7 : 1.3 : 1); 3A/1B0 //1b ↔ 1b0 /1b ↔1b0 (1.5 : 1 : 1); 3A/1B//1a0 ↔ 1b0 /1b0 ↔ 1b0 (9 : 6 : 1); 2A/2B//1a ↔ 1a0 /1a0 ↔ 1a0 (1.8 : 2 : 1); 1A/1B/2B0 //1a ↔ 1a/1a ↔ 1b (1 : 1.3 : 1). В скобках приведены теоретические соотношения между фракциями А, В и С (соответственно) в спектрах, определяемых данными генотипами. Этот перечень можно дополнить еще целым рядом аналогичных примеров.
Ранее в литературе уже высказывалось предположение о возможном наличии одних и тех же аллелей в любом из дуплицированных генов медленного локуса МДГ русского осетра (Цветненко и др., 1987) и о дупликации двух локусов МДГ севрюги (Рябова и др., 2008). Полученные данные подтверждают факт дупликации, а также говорят о том, что у представителей сем. Acipenseridae одинаковые субъединицы МДГ могут быть детерминированы не только дуплицированными генами одного, но также и разных локусов.
ЗАКЛЮЧЕНИЕ
Проведенное исследование полиморфизма МДГ севрюги и амударьинского лопатоноса с использованием метода электрофореза с последующим денситометрированием спектров показало, что с учетом вариаций интенсивности окрашивания изоферментов степень разнообразия у этих видов значительно выше, чем считалось ранее.
В результате анализа собственных и литературных данных была предложена гипотеза генетической детерминации и механизма формирования количественной изменчивости проявления фракций МДГ, которая удовлетворительно объясняет все наблюдаемые варианты этого фермента у изученных видов. Большинство фенотипов, выделенных с учетом наличия количественной изменчивости, могут быть детерминированы несколькими генотипами. В то же время имеется целый ряд спектров, которые определяются единственно возможным вариантом генотипа.
Механизм образования активных молекул МДГ из пула субъединиц, подобный тому, который был выявлен у севрюги и лопатоноса, ранее был описан у одноклеточных трипаносомид (Крылов, Белова, 1984). У этих простейших организмов один из локусов возник в результате дупликации, и субъединицы, продукты разных локусов, не взаимодействуют между собой при образовании димерных молекул. Сходство между столь эволюционно далекими организмами свидетельствует о том, что в основе процесса образования активных молекул МДГ лежат общебиологические закономерности: при удвоении генов в процессе эволюции свойства контролируемых ими субъединиц могут расходиться настолько, что они теряют возможность объединяться друг с другом.
Полученные результаты позволяют рекомендовать при проведении работ по скрещиванию с целью уточнения генетической детерминации МДГ учитывать количественную изменчивость и отбирать родительские пары, индивидуальные генотипы которых определяются единственно возможным вариантом.
Автор искренне благодарит О.Ю. Кузьмину за помощь при проведении трудоeмких расчетов. Работа была выполнена в рамках Госзадания № АААА-А19-119102890013-3.
Список литературы
Алтухов Ю.П., 1983. Генетические процессы в популяциях. М.: Наука. 279 с.
Бараев А.А., 1990. Степень расслоения мышечной ткани русского осетра с различными фенотипами сывороточных альбуминов в речной период жизни // Физиолого-биохимический статус Волго-Каспийских осетровых в норме и при расслоении мышечной ткани. Рыбинск: Изд. ИБВВ АН СССР. С. 146–149.
Батычков Г.А., 1979. Ход и состав нерестового стада осетра в районе Волгограда в 1975 и 1977 годах // Тез. и реф. II Всес. совещ. “Осетровое хозяйство внутренних водоемов СССР”. Астрахань: Волга. С. 27–28.
удаев С.В., Михеев В.И., Павлов Д.С., 2015. Индивидуальные различия поведения и механизмы экологической дифференциации на примере рыб // Журн. общ. биологии. Т. 76. № 1. С. 26–47
Васильев В.П., 1985. Эволюционная кариология рыб. М.: Наука. 300с.
Васильев В.П., Васильева Е.Д., Шедько С.В., Новомодный Г.В., 2009. Уровень плоидности калуги Huso dauricus и сахалинского осетра Acipenser mikadoi (Acipenseridae, Pisces) // ДАН. Т. 426. № 2. С. 275–278.
Гербильский Н.Л., 1972. Сравнительное исследование проявлений внутривидовой биологической разнокачественности у осетровых в связи с особенностями гидрографии южных рек СССР // Осетровые и проблемы осетрового хозяйства. М.: Пищевая промышленность. С. 71–78.
Демкина Н.В., 2005. Биохимические маркеры в селекции и разведении карповых и осетровых рыб. Дис. … докт. биол. наук. Рыбное: ВНИИПРХ. 256 с.
Животовский Л.А., 1991. Популяционная биометрия. М.: Наука. 272 с.
Кирпичников В.С., 1987. Генетика и селекция рыб. Л.: Наука. 520 с.
Киселевич К.А., 1922. Инструкция для биологических наблюдений. Астрахань: “Коммунист”. 74 с.
Крылов М.В., Белова Л.М., 1984. Множественные формы малатдегидрогеназы (К.Ф.1.1.1.37) у Crithidia asclepii и C. oncopelti (Mastigophora, Trypanosomatidae) // Паразитология. Т. 18. № 6. С. 425–429.
Кузьмин Е.В., 1983. Приспособление для сушки полиакриламидных гелей // Лабораторное дело. № 6. С. 53–54.
Кузьмин Е.В., 1991a. Электрофоретический анализ мышечных и сывороточных белков различных по экологии видов осетровых рыб. Дис. … канд. биол. наук. Л.: ИЭФБ АН СССР. 238 с.
Кузьмин Е.В., 1991б. Электрофоретический анализ мышечных и сывороточных белков различных по экологии видов осетровых рыб. Автореф. дис. … канд. биол. наук. Л.: ИЭФБ АН СССР. 24 с.
Кузьмин Е.В., 1991в. Сравнительное изучение изоферментов мышечной малатдегидрогеназы сибирского осетра Acipenser Baery Brandt обской популяции, донской и камской стерляди Acipenser rutenus L. (Acipenseridae) // Вопр. ихтиологии. Т. 31. № 2. С. 342–346.
Кузьмин Е.В., 1994. Сравнительный анализ фракционного состава саркоплазматических мышечных белков различных представителей семейства осетровых (Acipenseridae) // Вопр. ихтиологии. Т. 34. № 4. С. 548–556.
Кузьмин Е.В., 1996. Альбуминовая система сыворотки крови осетрообразных в речной период жизни // Вопр. ихтиологии. Т. 36. № 1. С.101–108.
Кузьмин Е.В., 2002. Аллозимная изменчивость неспецифических эстераз русского осетра (Acipenser guldenstadti Brandt) // Генетика. Т. 38. № 4. С. 1–7.
Кузьмин Е.В., 2008. Анализ изменчивости креатинкиназы некоторых представителей семейства осетровых (Acipenseridae) // Генетика. Т. 44. № 4. С. 507–515.
Кузьмин Е.В., Кузьмина О.Ю., 1987. Полиморфизм мышечной малатдегидрогеназы русского осетра // Генетические исследования морских гидробионтов: Мат-лы III Всесоюз. совещания. М.: ВНИРО. С. 16–23.
Кузьмин Е.В., Кузьмина О.Ю., 1998. Сравнительный анализ изоферментных спектров малатдегидрогеназы и экологии различных представителей семейства осетровых (Acipenseridae) // Журн. эвол. биох. и физиол. Т. 34. № 3. С. 296–309.
Кузьмин Е.В., Кузьмина О.Ю., 2005. Популяционный анализ электрофоретической изменчивости альбуминов сыворотки крови европейской (Acipenser ruthenus Linnaeus) и сибирской (A. ruthenus marsiglii Brandt) стерляди // Генетика. Т. 41. № 2. С. 246–253.
Кузьмин Е.В., Кузьмина О.Ю., 2012. Анализ изменчивости альбуминов сыворотки крови русского (Acipenser gueldenstaedtii) и сибирского (Acipenser baerii) осетров // Вопр. рыболовства. Т. 13. № 1 (49). С. 107–124.
Кузьмин Е.В., Кузьмина О.Ю., 2014. Полиморфизм локуса миогенов у некоторых представителей семейства осетровых (Acipenseridae) // Генетика. Т. 50. № 9. С. 1089–1097.
Кузьмин Е.В., Лукьяненко В.И., 1986. Биохимическая разнокачественность волжской стерляди Acipenser ruthenus L. по неспецифическим эстеразам сыворотки крови // Гидробиол. журн. Т. 22. № 6. С. 66–69.
Кузьмин Е.В., Мензиков С.А., 1988. О мышечной МДГ стерляди и некоторых методических особенностях ее выявления // Биология внутренних вод. Инф. бюлл. Л.: Наука. № 78. С. 62–65.
Лакин Г.Ф., 1980. Биометрия. М.: Высш. шк. 296 с.
Ленинджер А.Л., 1974. Биохимия. М.: Мир. 956 с.
Ли Ч., 1978. Введение в популяционную генетику. М.: Мир. 555 с.
Лобашев М.Е., Ватти К.В., Тихомирова М.М., 1979. Генетика с основами селекции. М.: Просвещение. 304 с.
Лукьяненко В.И., Кулик П.В., 1994. Физиолого-биохимическая и рыбоводная характеристика разновозрастных производителей волго-каспийских осетровых рыб. Рыбинск: Изд. ИБВВ. 271 с.
Лукьяненко В.И., Каратаева Б.Б., Камшилин И.Н., 1988. Сезонные расы Волго-Каспийских осетровых рыб. Андропов: Изд. ИБВВ АН СССР. 191 с.
Мамонова А.С., Шишанова Е.И., Тренклер И.В., Офицеров М.В., 2015. Влияние нарушений инкубации икры на выживаемость и генетический полиморфизм личинок русского осетра (Acipenser gudenstadtii Brandt) // Вестн. АГТУ. Сер.: Рыбное хозяйство. № 4. С. 77–86.
Мусил Я., Новакова О., Кунц К., 1984. Современная биохимия в схемах. М.: Мир. 216 с.
Никоноров С.И., Рябова Г.Д., Кутергина И.Г., Офицеров М.В., 1985. Электрофоретический анализ генетической изменчивости севрюги Acipenser stellatus (Pallas) // ДАН СССР. Т. 284. № 1. С. 209–211.
Рябова Г.Д., 2013. Генетическая изменчивость в природных популяциях волжских осетровых (на примере аллозимов) // Молекулярно-генетические подходы в таксономии и экологии: тез. докл. науч. конф. Ростов-на-Дону: ЮНЦ РАН. С. 87.
Рябова Г.Д., Кутергина И.Г., 1990. Анализ аллозимной изменчивости севрюги Acipenser stellatus (Pallas) Северного Каспия // Генетика. Т. 26. № 5. С. 902–911.
Рябова Г.Д., Климонов В.О., Шишанова Е.И., 2008. Генетическая изменчивость в природных популяциях и доместифицированных стадах осетровых рыб России. Атлас аллозимов. М.: Россельхозакадемия. 94 с.
Рябова Г.Д., Демкина Н.В., Офицеров М.В., Политов Д.В., 2012. Генетический анализ наследования аллелей аллозимных локусов сибирского ленского осетра // Рыбное хозяйство. № 4. С. 60–64.
Слынько В.И., 1976. Множественные молекулярные формы малатдегидрогеназы русского осетра (Acipenser guldenstadti Br.) и белуги (Huso huso L.) // ДАН СССР. Т. 228. № 2. С. 470–473.
Цветненко Ю.Б., Чихачев А.С., Борякин В.А., 1987. Полиморфизм и наследование малатдегидрогеназы у полиплоидного вида – русского осетра // Генетические исследования морских гидробионтов: Мат-лы III Всесоюз. совещания. М.: ВНИРО. С. 23–36.
Шишанова Е.И., Кавтаров Д.А., Офицеров М.В., Шишанов Г.А., 2014. Генетическая изменчивость севрюги Acipenser stellatus Pallas в онтогенезе при индустриальном выращивании // Вестн. АГТУ. Сер.: Рыбное хозяйство. № 4. С. 66–75.
Cross T.F., Ward R.D., 1980. Protein variation and duplicate loci in the Atlantic salmon, Salmo salar L. // Genet. Res. Camb. V. 36. № 2. P. 147–165.
Fisher S.E., Shaklee J.B., Ferris S.D., Whitt G.S., 1984. Evolution of five multilocus isozyme systems in the chordates // Genetica. V. 52. № 1. P. 73–85.
Fontana F., Zane L., Pepe A., Congui L., 2007. Polyploidy in Acipenseriformes: Cytogenetic and molecular approaches // Fish Cytogenetics / Eds Pisano E., Ozouf-Costaz C., Foresti F., Kapoor B.G. New Hampshire: Science Publisher, Inc. P. 385–403.
Havelka M., Hulák M., Bailie D.A., Prodöhl P.A., Flajšhan M., 2013. Extensive genome duplications in sturgeons: New evidence from microsatellite data // J. Appl. Ichthyol. V. 29. № 4. P. 704–708.
Havelka M., Hulák M., Ráb P., Rábová M., Lieckfeldt D. et al., 2014. Fertility of a spontaneous hexaploid male Siberian sturgeon, Acipenser baerii // BMC Genet. V. 15. P. 5–15.
Havelka M., Bytyutskyy D., Symonová R., Ráb P., Flajšhans M., 2016. The second highest chromosome count among vertebrates is observed in cultured sturgeon and is associated with genome plasticity // Genet. Sel. Evol. V. 46. P. 12–21.
Kovalev K.V., Balashov D.A., Cheriak A.L., Lebedeva E.V., Vasil’eva E.D., Vasil’ev V.P., 2014. The karyotipe of the Amu Darea sturgeon, Pseudoscaphirhynchus kaufmanni (Actinipterygii: Acipenseriformes: Acipenseridae) // Acta Ichthyol. Piscat. V. 44. № 2. P. 111–116.
Ludwig A., Lippoid S., Debus L., Reinartz R., 2009. First evidence of hybridisation between endangered sterlets (Acipenser ruthenus) and exotic Siberian sturgeons (Acipenser baerii) in the Danube River // Biol. Invasions. V. 11. P. 753–760.
Ludwig A., Belfior N.M., Pitra C., Svirsky V., Jenneckens I., 2001. Genome duplication events and functional reduction of ploidy in Sturgeon (Acipenser, Huso and Scaphirhynchus) // Genetics. V. 158. № 3. P. 1203–1215.
Rodzen J.A., May B., 2002. Inheritance of microsatellite loci in the white sturgeon (Acipenser transmontanus) // Genome. V. 45. P. 1064–1076.
Romanenko S.A., Biltueva L.S., Serdyukova N.A., Kulemzina A.I., Beklemisheva V.R. et al., 2015. Segmental paleotetraploidy revealed in sterlet (Acipenser ruthenus) genome by chromosome painting // Mol. Cytogenet. V. 8. P. 90–103.
Shaklee J.B., Allendorf F.W., Morizot D.C., Witt G.S., 1990. Gene nomenclature for protein-coding loci in fish // Trans. Amer. Fish. Soc. V. 119. № 1. P. 2–15.
Sheraliev B., Peng Z., 2020. Complete mitochondrial genome sequens and phylogenetic position of the Amu Darya sturgeon, Pseudoscaphirhynchus kaufmanni (Acipenseriformes: Acipenseridae) // J. Appl. Ichthyol. V. 36. № 4. P. 389–392.
Symonova R., Havelka M., Amemia C.T., Howell W.M., Korinkova T. et al., 2017. Molecular cytogenetic differentiation of paralogs of Hox paralogs in duplicated and re-diploidized genome of the North American paddlefish (Polyodon spathula) // BMC Genet. V. 18. № 1. P. 19–31.
Trifonov V.A., Romanenko S.S., Beklemisheva V.R., Biltueva L.S., Makunin A.I. et al., 2016. Evolutionary plasticity of acipenseriform genomes // Chromosoma. V. 125. № 4. P. 661–668.
Vasil’ev V.P., 2009. Mechanisms of polyploid evolution in fish: Polyploid in sturgeons // Biology, Conservation and Sustainable Development of Sturgeons. Fish and Fisheries Series. V. 29 / Eds Carmona R., Domezain A., Garcia-Gallego M., Hernando J.A., Rodriguez F., Ruiz-Rejon M. Amsterdam: Springer. P. 97–117.
Vasil’ev V.P., Vasil’eva E.D., Shedko S.V., Novomodny G.V., 2010. How many time has polyploidization occurred during Acipenserid evolution? New data on the karyotypes of sturgeon (Acipenseridae, Actinopterygii) // J. Ichthyol. V. 50. № 10. P. 950–959.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


