Журнал общей биологии, 2019, T. 80, № 1, стр. 22-42
Воздействие температуры на рост, пульсации ценосарка и перемещение гидроплазмы у колониального гидроида Dynamena pumila (L., 1758)
В. С. Дементьев 1, Н. Н. Марфенин 1, *
1 Московский государственный университет им. М.В. Ломоносова, биологический факультет,
каф. зоологии беспозвоночных
119991 Москва, Ленинские горы, 1, Россия
* E-mail: marf47@mail.ru
Поступила в редакцию 03.04.2018
После доработки 31.05.2018
Принята к публикации 14.06.2018
Аннотация
Статья посвящена исследованию зависимости роста и функционирования распределительной системы колониальных организмов от температуры воды. Методом цейтраферной микровидеосъемки проведена регистрация латеральных (поперечных) и ростовых (продольных) пульсаций ценосарка столона и побега у колониального гидроида Dynamena pumila (L., 1758) в морской воде при температуре 10, 15, 20, 25, 28°С. В результате удалось установить, что метод микровидеосъемки пульсаций ценосарка колонии с последующим их количественным анализом позволяет в течение 2 ч адекватно отразить реакцию колоний на воздействие температуры. Реакция ростовых, латеральных пульсаций и гидроплазматических течений на изменение температуры нелинейная. Реакция столонов на изменение температуры выражена более отчетливо по сравнению с побегами. Оптимальный диапазон, при котором наблюдаются высокая скорость роста, интенсивные перемещения гидроплазмы и наибольший объем перенесенной гидроплазмы, составляет от 10 до 20°С. При 28°С пульсации ценосарка столона становятся неустойчивыми, прирост, как правило, замедляется, перемещения гидроплазмы становятся менее активными. Следовательно, верхним температурным пределом нормальной жизнедеятельности беломорских колоний D. pumila по результатам анализа пульсаций ценосарка является температура в пределах 25–28°С.
Колониальные гидроиды относятся к модульным организмам, для которых характерен неограниченный рост и изменение формы тела за счет удлинения столонов и побегов, отходящих от них, а также ветвления (Chapman, Stebbing, 1980; Chapman, 1981; Леонтович, Марфенин, 1990). Соотношение скоростей роста и ветвления разных частей определяет в конечном итоге форму такого модульного организма. Насколько аллометрия, т.е. неравномерный рост частей колониального организма, зависит от факторов внешней среды, в частности, от температуры? Известно, что жизненные формы у других модульных организмов, в частности у растений, отражают эволюционную адаптацию к условиям существования (Серебряков, 1964; Серебрякова, 1974), что в конечном счете происходит во время индивидуального развития, т.е. через соотношение скоростей роста разных частей тела. Предполагается, что модульная организация гидроидов и кораллов уменьшает эффект аллометрии (Jackson, 1979; Hughes 2005), однако может зависеть от сезона, в том числе от температуры (Edmunds, 2006).
Многие работы, посвященные колониальным гидроидам, не принимают в расчет влияние факторов внешней среды на рост и развитие этих организмов. Отсутствие соответствующей информации о росте при известных условиях приводит к тому, что достоверные выводы могут быть получены лишь после многочисленных и продолжительных наблюдений (Tusov, Davis, 1971). Реакция гидроидов на факторы среды приведена в двух подробных обзорах (Boero, 1984; Gili, Hughes, 1995), а также в ряде статей, посвященных отдельным видам (Kinne, 1956, 1958; Симкина, 1963; Kinne, Paffenhöfer, 1965, 1966). Однако эти публикации посвящены, по большей части, исследованию морфологии составляющих частей колонии и темпам роста в зависимости от изменения конкретных внешних условий. При этом публикаций о влиянии факторов внешней среды на распределительную систему колониальных гидроидов практически нет.
Определение реакции роста на факторы среды обычно требует времени: если не лет, то месяцев или хотя бы дней. Мы использовали метод, с помощью которого можно в течение нескольких часов определить скорость роста разных частей колониального организма по видеорегистрации пульсаций его тела (Wyttenbach, 1968; Белоусов и др., 1984, 1988). Метод усовершенствован нами и апробирован на колониальных гидроидах (Marfenin, 2015).
Цель данного исследования – определение кратковременной первичной реакции латеральных и ростовых пульсаций ценосарка и гидроплазматических течений (ГПТ) в столонах и побегах колониального гидроида D. pumila на повышение температуры. Изучена только первичная реакция организма в течение нескольких часов на изменение температуры, не дожидаясь последующей адаптации. Совокупность разработанных количественных показателей позволяет подробнее разобраться в функционировании распределительной системы и ответить на следующие вопросы:
Как быстро реагируют пульсации ценосарка на изменение температуры?
Насколько ростовые и латеральные пульсации разных частей (побегов и столонов) колониального организма одинаковы по частоте и амплитуде?
Насколько реакция ГПТ соответствует реакции пульсаций ценосарка на изменение температуры?
Насколько реакции пульсаций ценосарка побегов и столонов соответствуют друг другу?
Какова верхняя температурная граница нормальной жизнедеятельности (по характеру пульсаций ценосарка и ГПТ) у D. pumila?
Результаты исследования могут оказаться полезными при выяснении степени термотолерантности жизнедеятельности D. pumila и особенностях существования при различной температуре. Статья продолжает ряд работ авторов, посвященных исследованию зависимости функционирования колониальных организмов от условий внешней среды (Марфенин, Дементьев, 2018б; Дементьев, Марфенин, 2018). Проведенное исследование касается общих проблем экологии, но в то же время раскрывает специфические механизмы физиологии колониальных организмов, которые необходимо учитывать при экспериментальных исследованиях.
МАТЕРИАЛ И МЕТОДЫ
Объект исследования – колониальный гидроид Dynamena pumila (L., 1758) (Sertulariidae, Leptothecata, Hydrozoa), типичный представитель биоты нижней литорали Белого моря. Сбор, культивирование, видеосъемку и обработку данных осуществляли по описанной ранее методике (Marfenin, Dementyev, 2017; Дементьев, Марфенин, 2017, 2018; Марфенин, Дементьев, 2017, 2018а, б).
Исследование проводили в течение нескольких лет летом на Беломорской биостанции имени Н.А. Перцова Московского гос. ун-та им. М.В. Ломоносова, находящейся на берегу пролива Великая Салма Кандалакшского залива Белого моря. Колонии выращивали на предметных стеклах из отдельных больших побегов, отделенных от колоний, произраставших на фукусах в зоне нижней литорали. Содержали в термостатируемых аквариумах с аэраторами, помещенных в светонепроницаемые боксы для предотвращения обрастания диатомовыми водорослями, чье присутствие осложняет видеорегистрацию пульсаций ценосарка и перемещения гидроплазмы. Морскую натуральную воду в аквариумах меняли 2–3 раза в неделю. Кормили в отдельном аквариуме свежевылупившимися науплиями Artemia salina ежедневно в течение 1–2 ч. Концентрация науплиев A. salina в аквариуме составляла 10–25 экз./мл. Выбран такой режим кормления, при котором ценосарк остается достаточно прозрачным для регистрации направления и скорости перемещения частиц в его полости. Изменения, происходящие в колонии по мере роста, регулярно регистрировали, составляя схемы столонов и побегов на них.
В опытах использовали маленькие прямолинейные колонии с неразветвленными столонами, большими материнскими побегами (обычно 20–30 пар гидрантов) и небольшими дочерними, включающими по одной–две паре гидрантов каждый (рис. 1). Таким образом, каждая колония состояла из двух побегов: большого материнского (который мог быть разветвленным) и одного дочернего. Всего было исследовано 12 колоний: в шести из них была проведена цейтраферная микровидеосъемка верхушки и первого модуля столона (между первым, считая от верхушки столона, и материнским побегами); в шести других – верхушки и первого модуля побега (ближайшего к верхушке побега междоузлия ценосарка с парой гидрантов). Модуль столона – участок между последовательными побегами; модуль побега – участок, включающий пару гидрантов. Участок между верхушкой столона и первым от нее побегом называется нулевым модулем. В нем мы не проводили регистрацию пульсаций ценосарка и перемещения гидроплазмы.
Рис. 1.
Обобщенная схема колоний D. pumila, использованных для эксперимента. Пунктирные стрелки указывают места регистрации.

В пределах модуля столона выбирали наиболее прозрачное место, которое могло оказаться посередине модуля или ближе к одному из его концов. Такие места регистрации могли не совпадать в разных эпизодах видеосъемки, относящихся к одному модулю. С этим могли быть связаны различия в величине просвета ценосарка и амплитуде пульсаций. Чтобы уменьшить разнобой, измерение величины просвета и амплитуды латеральных пульсаций ценосарка проводили по двум сечениям, ближе к левому и правому краям поля зрения. У побега D. pumila участки между последовательно расположенными парами гидрантов выражены слабо, поэтому в качестве первого модуля снимали участок ствола между первой парой гидрантов, чтобы видеть участок дистальнее (нулевой модуль) и проксимальнее (собственно первый модуль).
Для съемки стекло с колониями помещали в непроточную термостатируемую кювету водоизмещением ¼ л (10 × 13 × 2 см). Видеосъемка проводилась камерой Arecont-AV3100 через микроскоп MБИ-1 при увеличении ×100 с записью изображения на компьютер. Продолжительность съемки не менее полутора часов. Режим цейтраферной съемки составлял 4 кадра/с. Каждая съемка какого-либо участка колонии, не сопровождающаяся сменой кадра или изменением условий опыта (нагреванием, опреснением, осушением и т.п.), называется эпизодом видеосъемки.
Регистрировали с помощью микровидеосъемки пульсации и рост верхушки столонов и побегов, а также латеральные пульсации ценосарка и перемещение частиц в гастроваскулярной полости в первом модуле (рис. 2) колоний, содержащихся в морской воде при температуре 10, 15, 20, 25, 28°С. Данные значения температуры соответствуют температурным режимам на литорали беломорского побережья в летний период (Марфенин, 2010). Верхний температурный предел (28°С) был выбран на основе предварительно проведенных опытов, которые показали, что при 30°С происходит остановка роста побегов и столонов с последующей фрагментацией ценосарка. Исходно колонию, выращенную при 15 ± 1°С, помещали в охлажденную съемочную кювету с температурой воды 10°С. Видеосъемку колонии начинали непосредственно после помещения в десятиградусную воду, без периода адаптации к указанной температуре. В дальнейшем температуру поэтапно повышали, постепенно доводя до 28°С и производя видеосъемку при заданных значениях температуры. Интервал, за который происходил переход от одного температурного режима к следующему, обычно не превышал нескольких минут (до 10 мин), что исключало незарегистрированную видеосъемкой адаптацию к более высокой температуре. Мы не ставили задачу по изучению адаптации колоний к постепенному нагреванию и исследовали только кратковременную первичную реакцию на изменение температуры. Показатели температуры воды в кювете регулировали при помощи проточного термостата, способного как охлаждать, так и нагревать воду. Непосредственно в съемочной кювете температуру регистрировали при помощи электронного термометра с погрешностью ±0.1°С.
Рис. 2.
Участок первого модуля столона (а) и верхушка столона (б). D1 и D2 – сечения ценосарка в пределах поля зрения одного модуля.

По каждой колонии были отсняты полные серии последовательных изменений температуры от 10 до 28°С. Продолжительность съемки большинства эпизодов – около 1.5–2 ч, однако некоторые завершающие эпизоды после значительного нагревания (25 и 28°С) снимали в течение длительного времени (7–10 ч) для выяснения реакции колоний на значения температур, близких к критическим (30°С). Продолжительные съемки позволили бы понять, насколько терпимы колонии к аномальным условиям и не начинают ли испытывать стресс (который, быть может, не успевает проявиться за 1.5–2 ч съемки), находясь в них в течение длительного времени. Помимо вышеуказанных полных серий, несколько колоний были отсняты только при определенных значениях температуры. Материал из таких неполных серий также был использован при усреднении.
Съемку столонов и побегов пришлось проводить на разных колониях, так как обычно в маленьких колониях, выращенных для данного исследования, высота побегов была еще недостаточна для того, чтобы можно было снимать их в латеральной плоскости, пригибая их параллельно предметному столику микроскопа. Поэтому для съемки побегов выбирали колонии, у которых на больших побегах были растущие ветви.
Для получения необходимых данных о пульсациях ценосарка и перемещении гидроплазмы в полости ценосарка через каждые 120 кадров (30 с) производили измерение четырех основных показателей: 1) величины просвета полости ценосарка (рис. 2) в двух сечениях (D1 и D2), 2) величины продольных пульсаций терминальной точки верхушки роста, “ростовых пульсаций” (РП) и 3) длины пробега любой распознаваемой частицы или группы частиц в полости за 1 с, т.е. за 4 кадра (Marfenin, 2015), и на их основе рассчитывали вторичные показатели и индексы.
Способ расчета вышеуказанных параметров описан нами в предшествующих публикациях (Marfenin, Dementyev, 2017; Марфенин, Дементьев, 2017) и кратко изложен в табл. 1.
Таблица 1.
Показатели (параметры) роста, пульсаций и гидроплазматических течений, полученные с помощью видеорегистрации
| Обозначение | Определение |
|---|---|
| Первичных показателей три: D, GP и ${{\bar {v}}_{{HF}}}$ | |
| “D1" и "D2" | Величины диаметра (англ.: diameter)просвета ценосарка (гидрантов) в оптической плоскости, параллельной субстрату в двух сечениях ценосарка в пределах поля зрения одного междоузлия; сечение D1 дальше от верхушки столона (побега), чем D2 |
| GP | Ростовые пульсации (англ.: growthpulsations) – величина продольного смещения верхушки роста, измеряемая по расстоянию от края кадра до выступающей части верхушки столона (побега) |
| ${{\bar {v}}_{{HF}}}$ | Скорость гидроплазматического течения (англ.: velocity ofhydroplasmicflow), т.е. дистанция, которую проходят распознаваемые частицы в полости столона или побега за 1 с. (+) ${{\bar {v}}_{{HF}}}$ – скорость ГПТ к верхушке роста; (–) ${{\bar {v}}_{{HF}}}$ – скорость ГПТ от верхушки роста. |
| Вторичные (производные) показатели: | |
| ΔD | Изменение величины просвета ценосарка за 30 с [ΔD = D(x+ 1) – Dx], где х – порядковый номер измерения просвета ценосарка |
| (+)D% | Процентная доля положительных ΔD (или “доля расширения”) |
| (–)D% | Процентная доля отрицательных ΔD (или “доля сжатия”) |
| (0)D% | Процентная доля нулевых ΔD (или “доля покоя”) |
| Рtrp | Период поперечных (латеральных) пульсаций ценосарка (англ.: period oftransverse (lateral) pulsations): промежуток времени между двумя последовательными максимальными значениями “D”. РtrpD1 и РtrpD2 – периоды поперечных пульсаций в сечениях D1 и D2 соответственно. |
| Atrp | Амплитуда (англ.: amplitude) поперечных пульсаций ценосарка: разница между максимальным и минимальным значениями “D” за один цикл пульсации. Условие: максимальное значение предшествует минимальному. Atrp D1 и Atrp D2 – амплитуды поперечных пульсаций в сечениях D1 и D2 соответственно. |
| ΔGP | Изменение величины продольного смещения верхушки роста за 30 с. [ΔGP = GP(x+ 1) – GPx], где х – порядковый номер измерения величины продольного смещения |
| (+)GP% | Процентная доля положительных ΔGP (или “доля расширения”) |
| (–)GP% | Процентная доля отрицательных ΔGP (или “доля сжатия”) |
| (0)GP% | Процентная доля нулевых ΔGP (или “доля покоя”) |
| РGP | Период ростовых (продольных) пульсаций верхушки столона или побега: промежуток времени между двумя последовательными максимальными значениями смещения верхушки роста |
| AGP | Амплитуда ростовых пульсаций верхушки столона или побега: разница между максимальным и минимальным значениями “GP” за один цикл пульсации. Условие: максимальное значение предшествует минимальному |
| MGP | Прирост (англ.: magnification): продольное смещение торца верхушки роста за час |
| mgp | Прирост: продольное смещение торца верхушки роста за одну пульсацию |
| РHF | Период колебаний скорости ГПТ, промежуток времени между двумя последовательными максимальными значениями ГПТ в одном направлении. Может быть Р(+)HF – период пульсаций (+)ГПТ, к верхушке роста; Р(–)HF – период пульсаций (–)ГПТ, от верхушки роста. В данной работе РHF = Р(+)HF, т.е. период пульсаций ВР определен только по пиковым значениям дистально направленных ВР |
| АHF | Амплитуда колебаний скорости ГПТ, которая равна максимальному значению ${{\bar {v}}_{{HF}}}$ однонаправленного течения. А(+)HF – максимальная скорость ГПТ за цикл к верхушке роста; А(–)HF – максимальная скорость ГПТ за цикл от верхушки роста |
| ${{\bar {v}}_{{mHF}}}$ | Средняя скорость ГПТ (англ.: meanvelocity ofhydroplasmicflow) в зависимости от направления: ${{\bar {v}}_{m}}{{( + )}_{{HF}}}$ к верхушке роста и ${{\bar {v}}_{m}}{{( - )}_{{HF}}}$ от верхушки роста, определенная простым усреднением всех значений скорости в одном направлении за время регистрации, чем отличается от амплитуды пульсаций скорости ГПТ (АHF) |
| (+)HF% | Процентная доля ГПТ, направленных к верхушке роста |
| (–)HF% | Процентная доля ГПТ, направленных от верхушке роста |
| (0)HF% | Процентная доля нулевых ГПТ (или “доля покоя”) |
| Z | Показатель протяженности переноса частиц за один акт однонаправленного ГПТ. $Z = \sum\nolimits_{i = 1}^n {{{{({{{\bar {v}}}_{{HF}}})}}_{i}}\Delta t} $ где i – порядковый номер измерения скорости ГПТ, ${{\bar {v}}_{{HF}}}$ – скорость ГПТ (протяженность пробега частицы за 1 с); ∆t – шаг регистрации (30 с). Z(+)HF – протяженность переноса частиц к верхушке роста; Z(–)HF – протяженность переноса частиц от верхушки роста |
| V | Объем (англ.: volume) перенесенной гидроплазмы через условную плоскость поперечного сечения столона (побега)
за интервал, соответствующий одному ГПТ. Вычисляется, исходя из данных о скорости
ГПТ, продолжительности ГПТ и величины просвета ценосарка столона (побега). Принимая
условно скорость ГПТ постоянной между двумя последовательными учетами, т.е. за 30
с, получаем сумму значений объемов перемещенной гидроплазмы за каждый полуминутный
интервал на протяжении однонаправленного ГПТ по формуле: $V = \sum\nolimits_{i = 1}^n {{{(\pi D_{i}^{2})} \mathord{\left/ {\vphantom {{(\pi D_{i}^{2})} 4}} \right. \kern-0em} 4}{{{({{{\bar {v}}}_{{HF}}})}}_{i}}\Delta t} $, где i – порядковый номер измерения ${{\bar {v}}_{{HF}}}$ и D; n – число шагов регистрации; ∆t – шаг регистрации (30 с). V(+)HF – объем перенесенной гидроплазмы к верхушке роста; V(–)HF – объем перенесенной гидроплазмы от верхушки роста |
Среднее значение просвета (D1 и D2 среднее) – среднее арифметическое из всех измеренных в течение эпизода значений в данной точке. Максимальное значение просвета (D1 и D2 max) – среднее арифметическое из всех измеренных в течение эпизода значений в данной точке, когда канал целентерона расширен. Минимальное значение просвета (D1 и D2 min) – среднее арифметическое из всех измеренных в течение эпизода значений в данной точке, когда канал целентерона сужен.
Статистические характеристики представленных в работе результатов (среднее арифметическое значение $\bar {x},$ стандартная ошибка среднего ±SE, объем выборки n) вычислены при помощи программы Excel для всех эпизодов при каждой конкретной температуре совместно. В тех случаях, когда продолжительности регистрации у двух одинаковых по времени осушения опытов различались, уместно применять взвешенное среднее. Однако результаты усреднения методом взвешенного среднего и всей совокупности данных оказались одинаковыми, поэтому в статье приведены количественные значения, полученные обычным усреднением.
Каждая видеорегистрация реакции одной колонии на ступенчатое повышение температуры продолжалась в течение одного дня суммарно не менее 15 ч (по полтора часа дважды: для съемки верхушки роста и первого модуля при 10, 15, 20, 25 и 28°С). Для выяснения, насколько меняются пульсации со временем, мы изучили динамику ростовых пульсаций в течение восьми и более часов на нескольких колониях при 15–16°С и без промежуточного кормления. Полученные результаты были подразделены каждый на два последовательных ряда данных (по 0–4 и 4–10 ч) и усреднены для первой части эпизодов и второй по трем основным показателям: среднему приросту за пульсацию (за цикл) mgp, среднему периоду пульсаций РGP и средней амплитуде пульсаций AGP. Установлено, что в течение продолжительной съемки (не менее 8 ч) характер ростовых пульсаций верхушки столона достоверно (p > 0.05) не меняется (табл. 2).
Таблица 2.
Сравнение показателей пульсации верхушки столона D. pumila в первые (0–4 ч) и последующие (4–10 ч) часы при 15–16°С, без перерыва на кормление
| Время съемки | PGP | n | AGP | n | mgp | n |
|---|---|---|---|---|---|---|
| Первая часть эпизодов (0–4 ч) | 15.0 ± 0.6 | 194 | 33.0 ± 1.2 | 194 | 14.4 ± 0.8 | 182 |
| Вторая часть эпизодов (4–10 ч) | 14.4 ± 0.4 | 291 | 35.5 ± 0.8 | 289 | 14.3 ± 0.7 | 275 |
РЕЗУЛЬТАТЫ
Сравнение средних значений параметров роста и работы распределительной системы D. pumila при различных значениях температуры выявило ряд отличий в пяти исследуемых температурных режимах эксперимента: 10, 15, 20, 25 и 28°С.
Ростовые пульсации
Средние значения периода ростовых пульсаций (PGP) верхушек столонов и побегов (табл. 3, 4, рис. 3) уменьшаются при повышении температуры воды с 10 до 28°С, т.е. пульсации становятся чаще. Однако эти различия для столонов статистически значимы (p < 0.001) лишь при сравнении результатов, полученных при 10 и 15°С, и становятся недостоверными при сравнении результатов, полученных при 15, 20, 25 и 28°С.
Таблица 3.
Параметры ростовых пульсаций верхушки столона D. pumila при разных значениях температуры
| Параметр | Единицы измерения | 10°С | 15°С | 20°С | 25°С | 28°С | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| эпизоды № 98, 102, 107 (2015); 43, 53, 63 (2017) | эпизоды № 95, 100, 104, 137 (2015); 46, 56, 66 (2017) | эпизоды № 109, 115, 124, 138 (2015); 47, 57, 67 (2017) | эпизоды № 110, 116, 120, 139 (2015); 50, 60, 70 (2017) | эпизоды № 113, 119, 140 (2015); 51, 61, 72 (2017) | |||||||
| $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | ||
| PGP | мин | 19.3 ± 0.5 | 57 | 11.7 ± 0.3 | 59 | 9.6 ± 0.3 | 86 | 10.7 ± 0.6 | 113 | 8.4 ± 0.9 | 55 |
| AGP | мкм | 59.5 ± 2.5 | 57 | 42.5 ± 2.6 | 59 | 51.0 ± 2.0 | 85 | 32.3 ± 1.7 | 112 | 19.2 ± 1.7 | 55 |
| MGP | мкм/ч | 52.2 ± 15.9 | 6 | 81.9 ± 17.4 | 7 | 77.9 ± 20.6 | 7 | 61.6 ± 19.4 | 7 | 8.3 ± 10.1 | 6 |
| mgp | мкм | 14.0 ± 0.8 | 51 | 15.3 ± 1.1 | 52 | 15.4 ± 1.0 | 79 | 7.2 ± 1.8 | 105 | 1.6 ± 0.8 | 49 |
| (+)GP% | % | 11.5 | 13.9 | 12.5 | 12.4 | 5.3 | |||||
| (–)GP% | % | 7.3 | 7.8 | 8.3 | 8.3 | 5.1 | |||||
| (0)GP% | % | 81.2 | 78.3 | 79.3 | 79.3 | 89.6 | |||||
Таблица 4.
Параметры ростовых пульсаций верхушки побега D. pumila при разных значениях температуры
| Параметр | Единицы измерения | 10°С | 15°С | 20°С | 25°С | 28°С | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| эпизоды № 48, 59 (2016); 73, 83, 93, 103 (2017) | эпизоды № 52, 62 (2016); 76, 86, 96, 106 (2017) | эпизоды № 53, 63 (2016); 77, 87, 97, 107 (2017) | эпизоды № 44, 56, 66 (2016); 80, 90, 100, 110 (2017) | эпизоды № 47, 57, 67 (2016); 81, 91, 102, 112 (2017) | |||||||
| $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | ||
| PGP | мин | 15.6 ± 1.2 | 34 | 13.8 ± 1.1 | 39 | 9.8 ± 0.3 | 132 | 8.9 ± 0.3 | 119 | 9.7 ± 0.5 | 136 |
| AGP | мкм | 13.2 ± 1.9 | 32 | 19.1 ± 2.7 | 35 | 16.7 ± 0.8 | 129 | 10.4 ± 0.4 | 113 | 8.8 ± 0.4 | 130 |
| MGP | мкм/ч | 11.3 ± 3.7 | 6 | 20.6 ± 5.4 | 6 | 19.1 ± 3.7 | 6 | 17.3 ± 5.6 | 7 | 15.2 ± 4.9 | 7 |
| mgp | мкм | 2.1 ± 0.8 | 26 | 4.9 ± 1.9 | 29 | 4.1 ± 0.4 | 123 | 3.1 ± 0.3 | 106 | 2.5 ± 0.3 | 123 |
| (+)GP% | % | 4.1 | 4.8 | 6.1 | 5.6 | 5.2 | |||||
| (–)GP% | % | 3.0 | 4.1 | 4.4 | 4.5 | 5.4 | |||||
| (0)GP% | % | 92.9 | 91.2 | 89.4 | 89.9 | 89.4 | |||||
Рис. 3.
Воздействие температуры на период (а), амплитуду (б) и прирост (в) ростовых пульсаций верхушки столона и побега D. pumila в сравнении.

Для побегов достоверные различия PGP получены при значениях температуры: 15 и 20°С (p < 0.001), в то же время небольшое уменьшение периода при нагревании с 10 до 15°С не является достоверным (p > 0.05). При температурах 20, 25 и 28°С период ростовых пульсаций остается в пределах 9–10 мин.
Следовательно, период ростовых пульсаций уменьшается лишь при повышении температуры воды с 10 до 15°С у столонов и с 10 до 20°С у побегов. При дальнейшем повышении температуры до 28°С период ростовых пульсаций верхушек столонов и побегов остается постоянным и составляет примерно 9–10 мин (табл. 3 и 4, рис. 3).
Средние значения PGP у верхушек столонов и побегов достоверно различаются между собой при 10 и 25°С (р < 0.01), а при остальных температурах различие между ними не достоверно (p > 0.05) (табл. 3 и 4, рис. 3).
Среднее значение амплитуды ростовых пульсаций (AGP) при повышении температуры меняется нелинейно. У столонов имеется достоверная (р < 0.05 и р < 0.001 для разных пятиградусных интервалов) тенденция к снижению AGP в диапазоне температур от 10 до 28°С, хотя при 20°С происходит увеличение AGP (рис. 3). У побегов увеличение AGP происходит при переводе колоний из 10°С в 15°С, а затем при дальнейшем повышении температуры снижается, но эти изменения достоверны лишь в диапазоне 20–28°С. Максимальное среднее значение AGP у побегов отмечено при 15°С и составляет 19.1 ± 2.7 мкм, а у столонов при 10°С и достигает 59.5 ± 2.5 мкм. Амплитуда пульсаций верхушки столона больше таковой побега примерно в 2–4 раза при одинаковом значении температуры (табл. 3 и 4, рис. 3).
Прирост был измерен у побегов и столонов двумя способами: за 1 ч (MGP) и за один цикл пульсации (mgp). Хотя оба способа описывают один и тот же процесс роста, все же mgp удобнее для характеристики прироста, так как благодаря большой выборке удается точнее определить достоверность различия показателей при разных температурах. У столонов прирост достоверно снижается при 25 и 28°С (p < 0.001), а у побегов не обнаружено достоверной зависимости mgp от температуры, видимо, из-за недостаточной выборки (табл. 4, рис. 3). Столоны растут значительно быстрее, чем побеги: величина прироста за 1 ч при 10–20°С у столонов в 4–5 раз больше, чем у побегов (табл. 3 и 4, рис. 3).
При исследованных температурах фаза покоя ростовых пульсаций не меняется и составляет 80–90% как в побеге, так и в столоне.
Побеги и столоны в отдельных случаях могут продолжать расти даже при 28°С, хотя прирост столонов достоверно (p < 0.01) снижается по сравнению с 25°С. В качестве примера можно привести колонии № 7-1(2017) и № 8-10(2017), сохранившие стабильные пульсации и рост верхушки побега при указанной температуре в течение всего семичасового срока регистрации (эпизоды № 102/2017 и № 112/2017 соответственно).
Интерес представляют и колонии, которые перестали расти, но продолжали пульсировать. У них верхушка столона отступала от выделенного ею на апексе тонкого перисарка. Таким образом, ростовые пульсации оставались продольными, но без прироста. Период ростовых пульсаций нерастущих колоний при 15°С оставался таким же, как и у растущих столонов, а амплитуда пульсаций уменьшалась (рис. 4 и 5).
Рис. 4.
Вариационные ряды значений периодов ростовых пульсаций в растущих (левая ось) и прекративших расти (правая ось) столонах D. pumila при 15°С.

Рис. 5.
Вариационные ряды значений амплитуд ростовых пульсаций у растущих и нерастущих столонов D. pumila при 15°С.
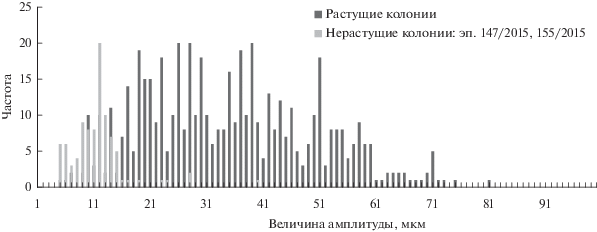
Итак, подводя итог анализа полученных результатов пульсаций верхушек роста побегов и столонов, можно констатировать, что при повышении температуры от 10 до 28°С PGP сокращается, AGP уменьшается, а mgp существенно уменьшается только у столонов.
Латеральные пульсации
Величина просвета ценосарка не изменяется при повышении температуры воды от 10 до 28°С (табл. 5 и 6). Значения просвета ценосарка столона и побега остаются постоянными в первом модуле при всех значениях температур, и в фазе максимума при расширении, и в фазе минимума при сжатии (рис. 6). Небольшое различие между D1 и D2 объясняется тем, что конфигурация первого модуля отличается от цилиндрической – дистальная часть немного шире по сравнению с проксимальной, что и отражено на графиках, особенно при сравнении средних и максимальных значений в D1 и D2.
Таблица 5.
Параметры латеральных пульсаций ценосарка первого модуля столона D. pumila при разных значениях температуры
| Параметр | Единицы измерения | 10°С | 15°С | 20°С | 25°С | 28°С | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| эпизоды № 99; 103; 106 (2015); 44, 54, 64 (2017) | эпизоды № 96; 101; 105 (2015); 45, 55, 65 (2017) | эпизоды № 108; 114; 123 (2015); 48, 58, 68 (2017) | эпизоды № 111; 117; 121 (2015); 49, 59, 69 (2017) | эпизоды № 112; 118; 122 (2015); 52, 62, 71 (2017) | |||||||
| $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | ||
| Ptrp D 1 | мин | 17.1 ± 1.4 | 33 | 14.4 ± 0.9 | 41 | 11.0 ± 0.8 | 52 | 10.1 ± 0.9 | 62 | 15.3 ± 2.0 | 84 |
| Atrp D 1 | мкм | 24.7 ± 2.1 | 40 | 22.0 ± 2.2 | 51 | 23.1 ± 2.0 | 62 | 23.0 ± 1.4 | 72 | 15.6 ± 0.8 | 90 |
| (+)D1% | % | 5.6 | 6.3 | 8.1 | 8.3 | 4.0 | |||||
| (–)D1% | % | 7.1 | 7.1 | 7.7 | 8.4 | 4.4 | |||||
| (0)D1% | % | 87.2 | 86.7 | 84.1 | 83.3 | 91.6 | |||||
| Ptrp D 2 | мин | 17.1 ± 1.5 | 34 | 14.4 ± 0.9 | 41 | 11.8 ± 0.8 | 50 | 9.8 ± 0.7 | 66 | 17.9 ± 4.0 | 72 |
| Atrp D 2 | мкм | 27.0 ± 2.3 | 41 | 26.7 ± 3.1 | 49 | 25.1 ± 2.0 | 59 | 23.0 ± 1.6 | 59 | 14.2 ± 1.0 | 78 |
| (+)D2% | % | 6.1 | 7.4 | 8.2 | 8.6 | 3.7 | |||||
| (–)D2% | % | 7.5 | 7.2 | 8.0 | 8.9 | 4.1 | |||||
| (0)D2% | % | 86.4 | 85.4 | 83.8 | 82.5 | 92.2 | |||||
Таблица 6.
Параметры латеральных пульсаций ценосарка первого модуля побега D. pumila при разных значениях температуры
| Параметр | Единицы измерения | 10°С | 15°С | 20°С | 25°С | 28°С | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| эпизоды № 49; 60 (2016); 74, 84, 94, 104 (2017) | эпизоды № 50; 61 (2016); 75, 85, 95, 105 (2017) | эпизоды № 54; 64 (2016); 78, 88, 98, 108 (2017) | эпизоды № 45; 55; 65 (2016); 79, 89, 99, 109 (2017) | эпизоды № 46; 58; 68 (2016); 82, 92, 101, 111 (2017) | |||||||
| $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | ||
| Ptrp D 1 | мин | 15.0 ± 1.1 | 33 | 10.3 ± 0.7 | 48 | 10.2 ± 0.7 | 49 | 9.0 ± 0.6 | 64 | 10.3 ± 1.0 | 107 |
| Atrp D 1 | мкм | 20.4 ± 1.7 | 39 | 18.1 ± 1.1 | 56 | 17.0 ± 1.2 | 53 | 21.1 ± 1.5 | 73 | 14.5 ± 0.6 | 109 |
| (+)D1% | % | 6.6 | 7.5 | 6.6 | 7.5 | 7.2 | |||||
| (–)D1% | % | 6.1 | 8.4 | 6.3 | 6.8 | 6.2 | |||||
| (0)D1% | % | 87.3 | 84.1 | 87.1 | 85.6 | 86.5 | |||||
| Ptrp D 2 | мин | 15.1 ± 1.1 | 32 | 10.2 ± 0.9 | 49 | 9.4 ± 0.8 | 53 | 8.2 ± 0.5 | 72 | 7.7 ± 0.4 | 137 |
| Atrp D 2 | мкм | 24.4 ± 2.1 | 39 | 22.2 ± 1.8 | 56 | 23.4 ± 2.0 | 58 | 21.0 ± 1.2 | 79 | 18.3 ± 0.8 | 140 |
| (+)D2% | % | 6.3 | 9.2 | 8.2 | 8.9 | 10.1 | |||||
| (–)D2% | % | 6.9 | 9.5 | 7.7 | 8.3 | 8.8 | |||||
| (0)D2% | % | 86.7 | 81.3 | 84.1 | 82.8 | 81.1 | |||||
Период латеральных пульсаций (Ptrp) в первом модуле у побегов и столонов снижается при нагревании нелинейно. У побегов при изменении температуры с 10 до 15°С Ptrp достоверно снижается (p < 0.001), а далее при 20, 25 и 28°С различается незначительно (p > 0.05). У столонов Ptrp также снижается при переходе от 10 к 15°С, но это различие недостоверно, зато достоверно (р < 0.05) при переходе от 15 к 20°С.
Амплитуда латеральных пульсаций (Atrp) при различных значениях температуры в наших опытах различается недостоверно (p > 0.05) из-за большого значения ошибки среднего (±SE) в диапазоне от 10 до 25°С, но достоверно (р < 0.001) снижается при сравнении результатов при 25 и 28°С как для побега, так и для столона (табл. 5, 6). Столоны и побеги по амплитуде латеральных пульсаций различаются слабо.
Пульсации в двух поперечных сечениях D1 и D2 в среднем по частоте не различаются, хотя по амплитуде бывают существенные различия (рис. 7).
Рис. 7.
Сравнение при разной температуре периодов (а) и амплитуд (б) латеральных пульсаций побегов и столонов D. pumila.

При исследованных температурах фаза покоя латеральных пульсаций (0)D1% и (0)D2% не меняется и составляет 80–90% как в побеге, так и в столоне. Лишь у столонов при 28°С доля покоя незначительно выше.
Доля фаз сжатия и расширения в цикле пульсаций одинаковы и составляют около 6–8% как у побегов, так и у столонов. Лишь у столонов при 28°С доля активности пульсаций снижается до 4% как в фазе сжатия, так и в фазе расширения, что свидетельствует о снижении активности пульсаций.
Сравнение латеральных пульсаций у побегов и столонов при температурах в диапазоне от 10 до 28°С показывает, что период пульсаций у них реагирует на температуру примерно одинаково, за исключением 28°С, когда Ptrp столонов увеличивается, а побегов остается прежним (рис. 7)
Сравнение ростовых и латеральных пульсаций у столонов обнаружило, что период пульсаций примерно одинаково снижается по мере роста температуры от 10 до 25°С, но при 28°С период латеральных пульсаций возрастает, а ростовых незначительно уменьшается (рис. 8). Обнаружены различия и в амплитуде пульсаций. В то время как амплитуда ростовых пульсаций верхушки столона снижается по мере повышения температуры, амплитуда латеральных пульсаций стенок первого модуля почти не реагирует на повышение температуры до 28°С (рис. 8). Период латеральных пульсаций варьирует в более широких пределах по сравнению с периодом ростовых пульсаций (рис. 9).
Гидроплазматические течения
Период ГПТ (PHF) в первом модуле у столонов и побегов при нагревании морской воды от 10 до 25°С снижается в 2–2.5 раза, однако у столонов PHF затем возрастает при 28°С, а у побегов не увеличивается. Эти различия достоверны (р < 0.05) при попарном сравнении по всем пятиградусным интервалам: 10 и 15°С, 15 и 20°С, 20 и 25°С (рис. 10). Вариабельность периодов ГПТ, отраженная в ошибке среднего, невелика, за исключением величины периода ГПТ в столонах при 28°С (табл. 7 и 8).
Таблица 7.
Параметры ГПТ в первом модуле столона D. pumila при разных значениях температуры
| Параметр | Единицы измерения | 10°С | 15°С | 20°С | 25°С | 28°С | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| эпизоды № 99; 103; 106 (2015); 44, 54, 64 (2017) | эпизоды № 96; 101; 105 (2015); 45, 55, 65 (2017) | эпизоды № 108; 114; 123 (2015); 48, 58, 68 (2017) | эпизоды № 111; 117; 121 (2015); 49, 59, 69 (2017) | эпизоды № 112; 118; 122 (2015); 52, 62, 71 (2017) | |||||||
| $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | ||
| PHF | мин | 19.0 ± 1.4 | 27 | 14.3 ± 0.6 | 40 | 9.9 ± 0.6 | 57 | 8.4 ± 0.5 | 78 | 15.5 ± 3.4 | 66 |
| A(+)HF | мкм/с | 25.1 ± 2.4 | 33 | 41.1 ± 4.5 | 45 | 37.3 ± 4.2 | 61 | 27.4 ± 2.3 | 82 | 17.0 ± 1.4 | 70 |
| A(–)HF | мкм/с | (–)23.5 ± 1.6 | 34 | (–)28.0 ± 2.0 | 50 | (–)26.8 ± 2.5 | 57 | (–)22.8 ± 1.4 | 86 | (–)16.0 ± 1.1 | 95 |
| ${{\bar {v}}_{{m( + )HF}}}$ | мкм/с | 18.0 ± 0.9 | 162 | 23.3 ± 1.1 | 222 | 25.3 ± 1.3 | 202 | 20.3 ± 0.9 | 231 | 14.5 ± 0.4 | 173 |
| ${{\bar {v}}_{{m( - )HF}}}$ | мкм/с | (–)15.3 ± 0.6 | 366 | (–)16.7 ± 0.8 | 434 | (–)18.6 ± 0.9 | 389 | (–)17.1 ± 0.8 | 292 | (–)13.5 ± 0.3 | 282 |
| (+)HF% | % | 12.6 | 15.8 | 15.2 | 17.2 | 6.8 | |||||
| (–)HF% | % | 28.2 | 31.3 | 29.6 | 21.7 | 10.6 | |||||
| (0)HF% | % | 59.2 | 52.9 | 55.1 | 61.2 | 82.6 | |||||
| Z(+)HF | мкм | 2192 ± 273 | 40 | 3101 ± 255 | 50 | 2232 ± 248 | 67 | 1560 ± 134 | 90 | 1018 ± 95 | 74 |
| Z(–)HF | мкм | (–)3416 ± 378 | 49 | (–)2811 ± 272 | 77 | (–) 059 ± 412 | 71 | (–)1541 ± 124 | 97 | (–)1129 ± 91 | 99 |
| V(+)HF | мкм3 | 5 505 885 ± 910 439 | 40 | 7 764 190 ± 1 093 795 | 50 | 4 500 050 ± 667 303 | 68 | 3 462 456 ± 483 495 | 89 | 1 038 013 ± 192 082 | 74 |
| V(–)HF | мкм3 | (–)4 599 101 ± 570 921 | 50 | (–)3 720 311 ± 447 176 | 77 | (–)3 972 877 ± 438 547 | 73 | (–)2 290 636 ± 237 883 | 98 | (–)1 061 409 ± 104 341 | 103 |
Таблица 8.
Параметры ГПТ в первом модуле побега D. pumila при разных значениях температуры
| Параметр | Единицы измерения | 10°С | 15°С | 20°С | 25°С | 28°С | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| эпизоды № 49; 60 (2016); 74, 84, 94, 104 (2017) | эпизоды № 50; 61 (2016); 75, 85, 95, 105 (2017) | эпизоды № 54; 64 (2016); 78, 88, 98, 108 (2017) | эпизоды № 45; 55; 65 (2016); 79, 89, 99, 109 (2017) | эпизоды № 46; 58; 68 (2016); 82, 92, 101, 111 (2017) | |||||||
| $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | $\bar {x}$ ± SE | n | ||
| PHF | мин | 17.5 ± 1.9 | 23 | 11.4 ± 0.7 | 38 | 10.4 ± 1.0 | 40 | 6.7 ± 0.4 | 86 | 7.3 ± 0.3 | 106 |
| A(+)HF | мкм/с | 18.4 ± 2.9 | 26 | 24.4 ± 4.7 | 42 | 17.3 ± 1.1 | 43 | 18.5 ± 1.2 | 82 | 23.4 ± 1.6 | 105 |
| A(–)HF | мкм/с | (–)15.5 ± 1.0 | 27 | (–)17.4 ± 1.4 | 38 | (–)16.2 ± 0.9 | 52 | (–)15.7 ± 0.5 | 79 | (–)19.3 ± 1.0 | 113 |
| ${{\bar {v}}_{{m( + )HF}}}$ | мкм/с | 14.7 ± 0.7 | 71 | 17.9 ± 0.9 | 130 | 15.8 ± 0.8 | 79 | 16.6 ± 0.7 | 144 | 19.7 ± 0.7 | 196 |
| ${{\bar {v}}_{{m( - )HF}}}$ | мкм/с | (–)14.0 ± 0.7 | 78 | (–)15.3 ± 1.0 | 108 | (–)14.7 ± 0.6 | 134 | (–)14.7 ± 0.7 | 150 | (–)16.6 ± 0.6 | 265 |
| (+)HF% | % | 6.5 | 12.1 | 7.5 | 11.0 | 10.0 | |||||
| (–)HF% | % | 7.1 | 10.0 | 12.8 | 11.3 | 13.9 | |||||
| (0)HF% | % | 86.4 | 78.0 | 79.7 | 77.7 | 76.1 | |||||
| Z(+)HF | мкм | 1008 ± 133 | 31 | 1291 ± 150 | 54 | 764 ± 71 | 49 | 793 ± 62 | 88 | 947 ± 62 | 122 |
| Z(–)HF | мкм | (–)1210 ± 187 | 27 | (–)1126 ± 107 | 44 | (–)1011 ± 90 | 58 | (–)814 ± 65 | 81 | (–)958 ± 55 | 136 |
| V(+)HF | мкм3 | 2 138 680 ± 312 414 | 31 | 3 253 541 ± 668 985 | 54 | 1 395 833 ± 176 685 | 49 | 1 597 102 ± 191 442 | 89 | 1 545 446 ± 119 583 | 123 |
| V(–)HF | мкм3 | (–)2 230 988 ± 338 979 | 27 | (–)2 994 377 ± 608 064 | 44 | (–)1 593 738 ± 147 751 | 58 | (–)1 184 594 ± 109 827 | 81 | (–)1 504 815 ± 117 245 | 138 |
Реакция PHF на изменение температуры соответствует реакции латеральных пульсаций столона (рис. 11).
Рис. 11.
Сравнение при разной температуре периодов ГПТ и латеральных пульсаций в первом модуле побегов и столонов D. pumila.

В первом модуле столона амплитуда ГПТ (максимальная скорость за цикл пульсации), направленных к верхушке (A(+)HF) и от нее (A(–)HF), достигает максимума при 15°С, а при дальнейшем нагревании воды снижается (рис. 10). В побегах такого уменьшения A(+)HF не обнаружено. В них амплитуда ГПТ изменяется по мере повышения температуры незакономерно, а различия между средними значениями амплитуд в заданных температурных диапазонах недостоверны (p > 0.05).
Средние значения амплитуды ГПТ, направленных к верхушке роста, всегда примерно в 1.5 раза выше, чем у направленных от нее при той же температуре. Вариабельность A(+)HF выше, чем у A(–)HF, и выше, чем у периода ГПТ (табл. 7 и 8). Следовательно, отток от верхушки роста стабильнее, чем приток к ней.
Средняя скорость ГПТ (${{\bar {v}}_{{mHF}}}$) мало зависит от температуры воды (табл. 7 и 8, рис. 12). В столоне ${{\bar {v}}_{{mHF}}}$ выше, чем в побеге, примерно на 20%, а скорость ГПТ к верхушке столона также примерно на 20% больше, чем в противоположном направлении, в то время как в побеге ${{\bar {v}}_{{mHF}}}$ в противоположных направлениях почти равны. Различие ${{\bar {v}}_{{mHF}}}$ между столонами и побегами проявляется также при 28°С, когда ${{\bar {v}}_{{mHF}}}$ в столонах ненамного, но достоверно уменьшается по сравнению с 10–25°С, а в побегах увеличивается. При 28°С перемещение гидроплазмы в побегах становится более активным, а в столонах – менее активным (рис. 12).
Рис. 12.
Воздействие температуры на среднюю скорость ГПТ (а), протяженность пробега частиц (б) и объем перенесенной гидроплазмы (в) в столонах и побегах D. pumila в сравнении.

Фаза покоя (0)HF% преобладает и составляет при 10°С более 50% времени у ГПТ в столонах и более 80% в побегах. По мере повышения температуры доля покоя ГПТ изменяется у столонов и побегов по-разному. В столонах фаза покоя существенно возрастает вплоть до 82% времени при 28°С, а в побегах незначительно сокращается при повышении температуры от 10 до 15°С и далее при дальнейшем повышении температуры не меняется (табл. 7 и 8).
Расчетная протяженность переноса гидроплазмы (Z(+)HF и Z(–)HF) в побегах незначительно зависит от температуры и фактически одинакова в противоположных направлениях, в то время как в столонах эта величина существенно уменьшается по мере повышения температуры свыше 15°С (табл. 7 и 8, рис. 12). Протяженность перемещенной гидроплазмы за один акт однонаправленного ГПТ в столонах в 2–3 раза больше, чем в побегах. Аналогично и расчетный объем перемещенной гидроплазмы (V(+)HF и V(–)HF) сильнее зависит в столонах от температуры и больше по величине, чем в побегах.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Морские беспозвоночные и водоросли, населяющие приливно-отливную среду обитания, поочередно оказываются под влиянием множества внешних факторов (волнового воздействия, осушения, колебаний солености и температуры и т.п.) во время фаз приливно-отливного цикла. В результате сильное абиотическое воздействие и пространственно локализованное сообщество сделало литораль прекрасной “естественной лабораторией” для изучения совместной роли физических и биологических факторов в определении обилия и распределения организмов в природе (Connell, 1961; Tomanek, Helmuth, 2002). Колебания температуры существенно влияют на организмы. Способность выдерживать суточные и сезонные изменения температуры – необходимое условие существования видов в зоне осушки. Однако существует и противоположная точка зрения, согласно которой верхний температурный предел, например, у морских гастропод, таких как Patella vulgata, Nucella lapillus и Patella depressa, превышает диапазон колебания температуры в месте их обитания и поэтому не может быть ограничителем в их пространственном распространении (Evans, 1948). Другая морская улитка Crepidula fornicata выдерживает прогревание до 35°С в течение нескольких часов, не проявляя явных признаков угнетения, причем личинки этого вида более термотолерантны, чем взрослые особи (Diederich, Pechenik, 2013). Эксперименты в лаборатории показали, что и колониальный гидроид Cordylophora caspia (Pallas, 1771) способен выдерживать в течение нескольких часов увеличение температуры до 36°С (Folino-Rorem, Indelicato, 2005).
Тем не менее считается, что верхнелиторальные организмы обладают более высокой термотолерантностью и способны выдерживать бóльшие значения температур, чем населяющие нижнюю литораль и сублитораль (Nguyen et al., 2011).
Относительно D. pumila до настоящего времени не были известны ни верхний температурный предел, ни температурный оптимум, впрочем, как и для всех остальных гидроидов. Было лишь установлено, что в пределах от 1 до 20°С колонии нормально живут, хотя при 1°С рост едва заметен (Бурыкин, 1980). В дополнение к этим данным нами с помощью методики регистрации пульсаций ценосарка установлено, что по крайней мере в диапазоне температуры от 10 до 28°С у D. pumila сохраняются пульсации ценосарка и ГПТ. Не было ни одного случая, когда пульсации ценосарка или перемещения гидроплазмы прекращались. Это означает, что даже при 28°С D. pumila остается жизнеспособной, хотя в местах ее обитания вода никогда не бывает такой теплой.
D. pumila относится к атлантическим бореальным видам и распространена вокруг Европы со стороны Баренцева моря вплоть до Бискайского залива, а также вдоль побережья Канады в основном на нижней литорали (Наумов, 1960). В условиях Белого моря развитие половых продуктов и последующее размножение D. pumila в верхней сублиторали происходит в конце июня – июле при температуре поверхностного слоя воды в пределах 9–15°С (Припузова, Марфенин, 2001). По нашим данным, 16°С – это наивысшая температура естественного обитания D. pumila в Белом море, если не считать непродолжительные периоды обсыхания фукоидов во время малой воды, на которых эти гидроиды преимущественно обитают. Глубже, где можно встретить D. pumila, температура, очевидно, еще ниже. Поэтому выживание, хотя бы в течение 10 ч, и рост при 25°С, а тем более при 28°С, представляется существенным расширением представлений о температурном диапазоне выживания этого вида.
Выше было отмечено, что, по нашим наблюдениям, проведенным до начала данного исследования, повышение температуры до 30°С негативно влияет на рост столонов и побегов, сопровождается дедифференцировкой гидрантов и фрагментацией ценосарка. В свете полученных нами результатов и данных по другим гидроидам (Folino-Rorem, Indelicato, 2005) теперь надо проверить, сколь необратима негативная реакция ценосарка D. pumila на повышение температуры до 30°С. Мы не ставили перед собой задачу анализа выживания D. pumila при длительном содержании при различных температурах. В данном исследовании мы хотели выявить температурный рубеж, при котором проявляется быстрая, фактически моментальная, реакция колониального организма на повышение температуры до того, как происходит рассасывание гидрантов и фрагментация ценосарка. Предположение, что таким рубежом может быть 28°С, подтвердилось, что проявилось в динамике нескольких параметров: скорости роста, периода (частоты) и амплитуды ростовых пульсаций.
Данные по скорости роста, определенные точнее всего по ростовым пульсациям ценосарка, позволяют установить оптимальные значения температуры для D. pumila.
Впервые подобное исследование было осуществлено Виттенбахом (Wyttenbach, 1968) на колониальном гидроиде Campanularia flexuosa11. Он сравнил ростовые пульсации верхушек столонов при различных температурах от 12 до 26°С с шагом в 2°С и пришел к выводу, что с увеличением температуры ростовые пульсации учащаются, а прирост за цикл пульсации изменяется нелинейно: не нарушается в диапазоне 14–20°С, но заметно снижается при дальнейшем нагревании (Wyttenbach, 1968). Следовательно, как написал Виттенбах, оптимальная температура существования C. flexuosa не превышает 20°С, “а при 22–26°С состояние гидроида ухудшается и он умирает”. Относиться к его выводам надо с некоторой осторожностью, так как в то время еще не принято было статистически оценивать достоверность различия средних значений. Поэтому снижение прироста за цикл при 22°С (20.4 мкм) по сравнению с 20°С (18.9 мкм) вполне могло быть в пределах ошибки среднего. Значительное снижение прироста происходило при повышении температуры от 24 до 26°С, а именно с 14.4 до 9.1 мкм. Однако и при 26°С столоны продолжали расти, т.е. не проявляли признаков умирания. Интересно, что частота пульсаций верхушек столона C. flexuosa существенно (12–28% за 2°С) снижалась с 12 до 22°С, а затем уменьшалась намного меньше (6–8% за 2°С). Похожие результаты получены и в нашем исследовании реакции ростовых пульсаций столонов D. pumila на повышение температуры.
У столонов наибольший средний прирост за один цикл ростовых пульсаций (mgp) был при 10, 15 и 20°С, а при дальнейшем повышении температуры до 25 и 28°С происходило значительное падение прироста вплоть до полной остановки роста столонов.
У побегов результат зависимости mgp от температуры получился иной. При повышении температуры до 25 и 28°С не обнаружено значительного снижения mgp. На графике видно (рис. 3), что mgp у побегов при 10°С несколько ниже, чем при 15, 20, 25°С и даже при 28°С. Наибольший прирост зарегистрирован при 15°С. Однако все эти различия не достоверны с учетом величины отклонения от средних значений. Следовательно, температурный оптимум у побегов D. pumila не ограничен 15–20°С, как у столонов этого же вида.
Поскольку у нас нет сопоставимых данных по пульсациям ценосарка при температуре ниже 10°С, мы не можем пока установить нижнюю границу оптимума, но нам известно (Марфенин, 1971а, б, 1973; Марфенин, Карлсен, 1983; Бурыкин, 1980), что D. pumila выдерживает самую низкую из возможных за год в месте обитания температур для морской воды. Вблизи биостанции МГУ это –1.0°С. При такой температуре колонии почти не растут, но многие гидранты остаются на побегах и не рассасываются. У других видов в том же биотопе, например у Gonothyraea loveni и Laomedea flexuosa, на зиму гидранты рассасываются (Марфенин, Карлсен, 1983), а их клеточный материал перемещается в столоны (Полтева и др., 1987).
Сравнивая при определенной температуре приросты столонов и побегов за ростовой цикл (или за 1 ч), мы видим, что столоны растут примерно в 4 раза быстрее, чем побеги. В то же время столоны сильнее реагируют на превышение температурного оптимума. Если у побегов скорость роста при 28°С уменьшается лишь незначительно, то у столонов уменьшение роста происходит почти на порядок величин. При более высокой температуре рост колонии становится преимущественно “вертикальным”, а при более низкой (10°С) – преимущественно “горизонтальным”. Это соответствует сезонным стадиям развития гидроида, когда в начале биологического лета колонии D. pumila активно осваивают субстрат и растут “вширь”, а в конце биологического лета при самых больших температурах образуется более всего гонангиев, в которых происходит половое размножение и формируются планулы (Марфенин, 1980; Марфенин, Карлсен, 1983). Аналогичные различие между скоростями роста побегов и столонов D. pumila были ранее обнаружены обычными методами измерения длины ценосарка через каждые двое или четверо суток при изучении изменения формы и размеров колонии, культивируемых как в лабораторных, так и в естественных условиях (Бурыкин, 1980). Было установлено, что столоны растут вдвое быстрее, чем побеги. При этом длину побега автор рассчитывал, суммируя длины ценосарка и формирующихся гидрантов. Если же не прибавлять к длине ценосарка длины гидрантов, то разница между скоростями роста столонов и побегов получится вдвое большей, т.е. в 3–4 раза, что соответствует нашим результатам, полученным методом регистрации ростовых пульсаций ценосарка.
Такое различие реакции скоростей роста столонов и побегов на температуру отражает способ адаптации колоний D. pumila к неблагоприятным условиям существования. Прирост побегов сопровождается увеличением числа гидрантов, но не верхушек роста, а прирост столонов автоматически приводит к увеличению числа побегов, т.е. верхушек роста. Каждая из верхушек роста нуждается в достаточном количестве клеточного материала, причем чем выше температура, тем больше требуется новых клеток, если скорость роста увеличивается. Рост побегов может создать условия для получения большего количества пищи, а рост столонов создает условия не только для образования большего числа гидрантов, но и большего числа верхушек роста – потребителей клеточного материала. Побеги D. pumila ветвятся лишь при избытке пищи, а столоны образуют новые побеги при любых условиях по мере своего роста (Марфенин, 1993).
Период ростовых пульсаций (PGP) столонов и побегов реагирует на повышение температуры нелинейно: сокращаясь в диапазоне от 10 до 20°С и оставаясь на одном уровне при дальнейшем повышении температуры с 20 до 28°С. Сокращение PGP у столонов происходит более отчетливо, чем у побегов: если у столонов на 7.5 мин в диапазоне 5°С, то у побегов на меньшую величину в диапазоне 10°С (табл. 3 и 4). В этой связи два обстоятельства примечательны: во-первых, достоверное различие средних величин PGP между столонами и побегами при 10°С, а во-вторых, неизменность частоты пульсаций столонов и побегов в некотором диапазоне повышения температуры воды. Лишь в промежутке между 10 и 20°С у побегов и между 10 и 15°С у столонов происходит значительное (в 1.5–2 раза) сокращение периода ростовых пульсаций, а при дальнейшем повышении температуры PGP не меняется (рис. 3). Различие периодов ростовых пульсаций при одной температуре между побегами и столонами – необычное явление22, свидетельствующее об аллометрии. Отсутствие реакции пульсаций ценосарка на повышение температуры выше 20оС также необычно, так как многочисленные примеры разнообразных пульсаций, например сердца у пойкилотермных видов животных, неизменно демонстрируют зависимость частоты пульсаций (т.е. периода) от температуры среды (Dietz, Tomkins, 1980; Tsukuda et al., 1985; Bjelde et al., 2015; Chapperon et al., 2016). Возможно, невыраженность реакции пульсаций ценосарка на повышение температуры от 20 до 28°С надо воспринимать как сигнал выхода за пределы термопреферендума.
Амплитуда пульсаций ценосарка включает фазы его расширения и сжатия. Поэтому величина амплитуды ростовых пульсаций зависит не только от продвижения верхушки роста вперед, но и от степени оседания (впячивания) апекса. A priori можно считать, что степень впячивания апекса должна отражать внутреннее давление в полости верхушки столона или побега, которое в свою очередь должно определяться, во-первых, степенью сжатия ценосаркальной трубки, и во-вторых, соотношением между потребляемым объемом пищи и увеличением объема гастроваскулярной полости колонии по мере ее роста. Если колония растет, а пищу не получает, то просвет ценосарка становится меньше. Если же колония получила много пищи, то просвет ценосарка увеличивается, а амплитуда сжатий уменьшается. Ранее предполагали, что на ростовые пульсации может оказывать воздействие приток или отток гидроплазмы к/от верхушки роста (Hale, 1960) и что при совпадении притока гидроплазмы в верхушку роста с фазой ее сжатия происходит сдвиг пульсаций по фазе (Wyttenbach, 1968). Все это определяет значительную вариабельность данных по амплитудам ростовых и латеральных пульсаций.
Проведенная нами видеорегистрация ростовых пульсаций ценосарка (AGP) при различных температурах показала, что в целом AGP столона достоверно уменьшается при попарном сравнении по пятиградусным интервалам по мере увеличения температуры во всем диапазоне от 10 до 28°С, а AGP пульсаций побегов ограниченно зависит от температуры – всего лишь в диапазоне от 20 до 28°С (рис. 3). Это различие между столонами и побегами соответствует реакции их прироста на температуру и его можно считать экологически целесообразным (см. выше), хотя причина такого различия не известна.
Необходимо отметить, что наши результаты отличаются от данных, приведенных в статье Ю.А. Лабаса с соавторами (1981) и представленных в табл. 9. Если в цитируемой работе при сравнении побегов D. pumila при 10 и 20оС период пульсаций их верхушек различался в 4 раза, а амплитуда почти в 2 раза, то в наших опытах период различается всего в 1.5 раза, а амплитуда пульсаций в 1.3 раза. Эти различия, возможно, обусловлены другой методикой постановки опытов в исследовании, опубликованном в 1981 г. В статье указано, что регистрацию пульсаций осуществляли осциллографическим методом (по изменению интенсивности проходящего света) на отделенных от колоний побегах, которые по очереди помещали в узкую слабопроточную камеру оригинальной конструкции, описанную в диссертации В.Н. Летунова (1981). Побег находился на предметном стекле с боковыми стенками из предметных стекол, накрытый покровным стеклом. Проточность обеспечивалась за счет подачи и стекания воды из микрокамеры по фильтровальной бумаге. Водообмен не был установлен, а при слабом водообмене в такой тесной камере, по нашим неопубликованным наблюдениям, возможно изменение частоты пульсаций. Со слов одного из соавторов статьи В.Н. Летунова нам известно, что исследование было проведено в июне на биостанции “Картеш” АН СССР, расположенной на Белом море. Регистрацию пульсаций при 10°С осуществляли в холодовой комнате, где побеги D. pumila находились в течение нескольких часов. Все эти особенности исследования существенны для характеристик пульсаций ценосарка у гидроидов. Наконец, нельзя исключить и возможности генетических различий между различными популяциями одного вида, о чем писал в своих статьях Виттенбах (Wyttenbach, 1969). Акцентируя внимание на различии данных, полученных нами и коллегами (Лабас и др., 1981), важно не упустить из вида сходство трендов в изменении пульсаций при сравнении их показателей при 10 и 20°С, а именно: сокращение периода и увеличение амплитуды ростовых пульсаций при возрастании температуры.
Таблица 9.
Сравнение результатов двух исследований влияния температуры на ростовые пульсации верхушек побегов D. pumila
| Источник | Температура | 10°С | 20°С | Температура | 10°С | 20°С | ||
|---|---|---|---|---|---|---|---|---|
| Настоящее исследование | PGP | мин | 15.6 ± 1.2 | 9.8 ± 0.3 | AGP | мкм | 13.2 ± 1.9 | 16.7 ± 0.8 |
| Лабас и др., 1981 | 34–39 | 7–8 | 10–25 | 20–35 | ||||
Период латеральных пульсаций (Ptrp) у побегов зависит от повышения температуры примерно так же, как и ростовые пульсации (рис. 8, 9), однако у столонов при 28°С латеральные пульсации ценосарка становятся реже, а у побегов частота пульсаций сохраняется такой же, как при 25°С или почти такой же, как при 15–20°С. Это различие в периоде латеральных пульсаций между столонами и побегами вполне согласуется с уменьшением прироста столонов и остановкой роста многих из них по мере повышения температуры. В то время как побеги продолжают расти вплоть до завершения формирования модуля (Косевич, 1991), столоны могут прекратить рост на любом этапе до образования очередного побега (рис. 3). Лишь при 15°С, т.е. в контроле, средние значения периодов ростовых и латеральных пульсаций значительно различались – почти в 1.5 раза, а при остальных температурных режимах, кроме 28°С, совпадали (рис. 8, 9). Совпадение периодов ростовых и латеральных пульсаций при большинстве значений температурного ряда кажется естественным, так как пульсации генетически присущи ценосарку, и повсюду в пределах колонии, казалось бы, должны быть одинаковыми. Однако латеральные пульсации тесно связаны с перемещением гидроплазмы, так что приток гидроплазмы может вызвать расширение ценосаркальной трубки и множество пульсаторов в колонии способны независимо оказывать воздействие на давление, что неизбежно должно изменять диаметр эластичной ценосаркальной трубки. Оценивая вариации периода латеральных пульсаций, мы обнаружили, что число кратких циклов в столонах существенно больше, чем у ростовых пульсаций (рис. 9). Это может служить косвенным подтверждением предположения о том, что латеральные пульсации в столонах “частят” по сравнению с пульсациями верхушек роста. Верхушка роста – это апикальная часть ценосаркальной трубки, расположенная на торце, а не посередине между различными пульсаторами, как в случае латеральных пульсаций при их регистрации в первом модуле столона. Мы предполагали, что латеральные пульсации менее регулярны, чем ростовые, и это подтвердилось (рис. 9). Сопоставление вариационных рядов периодов ростовых и латеральных пульсаций столонов позволило установить, что в сравнении с ростовыми пульсациями у латеральных пульсаций намного больше непродолжительных сокращений и расширений, отражающих гидродинамическое взаимодействие множества пульсаторов, которые, по некоторым данным (Бурыкин, 2010, 2013, 2015), могут работать несогласованно.
Амплитуда латеральных пульсаций значительно меньше, чем ростовых (рис. 8), и лишь по мере приближения температуры к 28°С это различие сглаживается, так как ростовые пульсации уменьшаются. Причина столь существенного различия между амплитудами ростовых и латеральных пульсаций вовсе не в том, что ценосаркальная трубка ограничена перисарком, так как ценосарк в первом модуле значительно тоньше перисарка, и его стенки не упираются изнутри в перисаркальную трубку. Видимо, большая амплитуда ростовых пульсаций обусловлена опорой, которую имеет апекс в виде зоны утолщенной гастродермы. Выпячивание апекса происходит не под влиянием пульсирующего давления в полости верхушки роста, а по большей части независимо от него из-за регулярного изменения размеров клеток, вызванных, как считается, циклическими осмотическими процессами, описанными ранее (Beloussov et al., 1989).
Период и амплитуда ГПТ. Перемещение гидроплазмы в общей гастроваскулярной полости колониального организма возникает под действием сжатия одних участков ценосарка и пассивного расширения других (Карлсен, Марфенин, 1984; Марфенин, 1985, 1993). Вблизи верхушек роста ГПТ всецело зависят от пульсаций терминальных участков ценосарка – верхушек роста и прилежащих к ним нулевого и первого модулей. Кроме них, могут активно пульсировать гидранты, но их роль значительно меньше, чем торцевых частей ценосарка (Марфенин, Дементьев, 2017).
Наше исследование зависимости пульсаций ценосарка и ГПТ от температуры у колониального гидроида D. pumila позволило установить (рис. 11), что период ГПТ (PHF) соответствует периоду латеральных пульсаций ценосарка (Ptrp). При повышении температуры PHF сокращается, т.е. частота смены направлений ГПТ возрастает. В то же время амплитуда ГПТ (AHF), т.е. максимальная скорость ГПТ, по мере увеличения температуры в побегах изменяется незначительно, а в столонах становится меньше. Более того, средняя скорость ГПТ (${{\bar {v}}_{{mHF}}}$) в побегах при 28°С ненамного возрастает, а в столонах уменьшается (рис. 12). Такое несоответствие между побегами и столонами в реакции ГПТ на повышение температуры нельзя объяснить уменьшением амплитуды латеральных пульсаций терминальных отделов столона, в которые входят верхушка и два модуля: нулевой и первый – так как, по нашим данным, Atrp в первых модулях столона и побега мало зависит от температуры (рис. 7). Скорее уменьшение AHF обусловлено десинхронизацией локальных ГПТ, продуцируемых побегами, которые взаимодействуют между собой в общеколониальных каналах – в столонах. В итоге расчетная протяженность и объем однонаправленного переноса гидроплазмы за один цикл ГПТ в первом модуле столона существенно уменьшаются по мере повышения температуры свыше 15°С (табл. 7 и 8, рис. 12).
Обобщение результатов изучения реакции пульсаций ценосарка и гидроплазматических течений в столонах и побегах D. pumila на изменение температуры
При изменении температуры, например при ее возрастании от 10 до 28°С, естественно было бы ожидать единого тренда в изменении пульсаций ценосарка столонов и побегов D. pumila, а именно обычного увеличения их частоты.
Для такого предположения есть все основания, если учесть опыт изучения реакции на температуру пульсирующих органов у пойкилотермных животных. Приведем лишь несколько примеров. При нагревании от 9 до 31°С частота пульсаций сократительных вакуолей инфузории Paramecium caudatum увеличивается почти в 10 раз (Cole, 1925). С повышением температуры учащается сердцебиение пресноводной двустворки Ligumia subrostrata, достигая максимума при 32°С (Dietz, Tomkins, 1980). Частота сердечных сокращений рыбы Carassius aurutus также усиливается с увеличением температуры, равно как и интенсивность дыхания, причем у обитающих при более низких температурах особей реакция на нагревание выражена ярче, чем у экземпляров того же вида из более теплых мест обитания (Tsukuda et al., 1985). Не только пульсации, но и другие жизнеобеспечивающие процессы ускоряются при увеличении температуры среды обитания. Например, у мшанки Electra crustulenta скорость фильтрации через лофофор возрастает с 90 до 229 мл/(ч см2) при увеличении температуры с 6 до 22°С соответственно (Lisbjerg, Petersen, 2001). И таких примеров можно было бы привести больше. Но среди них нами не обнаружено случаев несовпадающей реакции частей целого.
В этом отношении примечательно различие реакций на повышение температуры воды столонов и побегов у D. pumila. Столоны сильнее реагируют на повышение температуры, чем побеги (рис. 3). По мере увеличения температуры до 28°С столоны сначала медленнее растут, а затем и вовсе могут прекратить расти, в то время как у растущих побегов, которых может быть немного, прирост уменьшается незначительно – по крайней мере до завершения формирования очередного модуля (междоузлия) побега. Таким образом, при приближении к верхнему температурному пределу рост колонии становится неравномерным – аллометрическим. Аналогичный результат был получен при изучении роста различных склерактиниевых кораллов (Edmunds, 2006). Изометрический рост наблюдался в теплые годы, а аллометрический – в холодные, т.е. менее благоприятные, годы. Предполагается, что способность переключаться между изометрическим и аллометрическим ростом связана с модульным типом строения, а в условиях холодных (менее благоприятных) лет аллометрический рост становится более выгодным. Сходный эффект мы наблюдаем и у колониального гидроида D. pumila, для которого приближение температуры воды к верхнему допустимому для данного вида пределу означает наступление неблагоприятных условий жизнедеятельности, с чем, как мы считаем, и связан аллометрический рост.
Гидроплазматические течения в побегах при 28°С становятся чуть активнее, но в столонах ГПТ не ускоряются, а даже замедляются. Это, казалось бы, странное несоответствие между ГПТ в побегах и столонах становится понятным, если учесть, что столоны связывают побеги между собой, и в них происходит взаимодействие локальных ГПТ, формирующихся в побегах (Марфенин, 1993). Если амплитуда ГПТ и протяженность пробега частиц в столонах больше, чем в побегах, как мы видим при 15–20°С (рис. 12), а при 25 и 28°С оба показателя становятся меньше в столонах, то можно предполагать, что при оптимальной температуре в столонах наблюдается синергетический эффект взаимного усиления локальных ГПТ, т.е. их согласованности, а при менее благоприятной температуре происходит разбалансировка согласования локальных ГПТ в канале, который их соединяет.
ВЫВОДЫ
Реакция ростовых, латеральных пульсаций и ГПТ на изменение температуры нелинейная. Реакция столона на изменение температуры выражена более отчетливо по сравнению с побегом. Наибольшие изменения происходят в диапазоне между 10 и 15°С из изученного промежутка от 10 до 28°С. Оптимальный диапазон, при котором наблюдаются высокая скорость роста, интенсивные перемещения гидроплазмы и наибольший объем перенесенной гидроплазмы, составляет от 10 до 20°С. При 28°С пульсации ценосарка столона становятся неустойчивыми, прирост, как правило, замедляется, перемещения гидроплазмы становятся менее активными.
В диапазоне от 10 до 28°С повышение температуры воды вызывает, в конечном итоге, сокращение периода и уменьшение амплитуды ростовых пульсаций ценосарка D. pumila, однако в столонах и побегах эти процессы выражены по-разному. В столонах уменьшение амплитуды ростовых пульсаций и прироста за цикл при повышении температуры происходит сильнее, чем в побегах. В результате рост столонов при 28°С снижается почти в 10 раз по сравнению с 15–20°С, а в побегах лишь в 1.5–2 раза. Однако рост побегов при неблагоприятных обстоятельствах, как нам известно из предыдущих наших исследований, продолжается лишь до завершения формирования модуля. Следовательно, верхним температурным пределом нормальной жизнедеятельности беломорских колоний D. pumila, по результатам анализа пульсаций ценосарка, является температура в пределах 25–28°С.
Метод видеорегистрации позволяет быстро (в течение 1–2 ч) определить скорость роста столонов и побегов, а также выявить реакцию пульсаций ценосарка на изменение температуры.
Вариабельность пульсаций ценосарка: как продольных (ростовых), так и поперечных (латеральных) – свидетельствует о влиянии неких дополнительных факторов. Мы предполагаем, что вариабельность является следствием взаимодействия ростовых и латеральных пульсаторов между собой.
Гидроплазматические течения (ГПТ) обладают наибольшей скоростью при 15 и 20°С. Увеличение скорости ГПТ при повышении температуры от 10 до 15°С свидетельствует о нормальной реакции организма на подъем температуры. Снижение скорости ГПТ при повышении температуры от 20 до 28°С означает разбалансировку распределительной системы и является дополнительным аргументом в пользу предположения о приближении к верхнему температурному пределу существования D. pumila.
Среди всех показателей пульсаций и роста столонов и побегов наиболее информативными для определения реакции колониального организма на температуру являются: прирост за одну пульсацию, период и амплитуда ростовых пульсаций.
В статье были использованы результаты пилотного проекта, поддержанного грантом РФФИ № 11-04-00994 и по НИР “Исследование экологии, функциональной морфологии и биологии беспозвоночных в морских экосистемах” (№ госрегистрации 01200117379).
Авторы признательны канд. биол. наук И.А. Косевичу за предоставленное дополнительное оборудование для проведения съемки и критические замечания при подготовке рукописи в печать.
Список литературы
Белоусов Л.В., Лабас Ю.А., Баденко Л.А., 1984. Ростовые пульсации и форма зачатков у гидроидных полипов // Журн. общ. биологии. Т. 45. С. 796–806.
Белоусов Л.В., Лабас Ю.А., Казакова Н.И., Баденко Л.А., 1988. Ростовые пульсации у гидроидных полипов // Губки и книдарии. Современное состояние и перспективы исследований. Л.: Зоол. ин-т АН СССР. С. 47–57.
Бурыкин Ю.Б., 1980. Регулирующая роль некоторых экологических факторов в процессах роста и интеграции колониальных гидроидов // Теоретическое и практическое значение кишечнополостных. Л.: ЗИН АН СССР. С. 16–19.
Бурыкин Ю.Б., 2010. Основы функционирования распределительной системы колониальных гидроидов // Онтогенез. Т. 41. № 4. С. 300–311.
Бурыкин Ю.Б., 2013. Эстафетный способ перемещения гидроплазмы в колониях гидроидных полипов // Онтогенез. Т. 44. № 2. С. 115–125.
Бурыкин Ю.Б., 2015. Функционирование распределительной системы у колониального гидроида Dynamena pumila (L., 1758) // Вестн. МГУ. Сер. 16. Биол. Вып. 3. С. 44–48.
Дементьев В.С., Марфенин Н.Н., 2017. Функциональная морфология столонов у колониального гидроида Gonothyraea loveni (Allman, 1859): рост, пульсации и перемещение гидроплазмы // Изучение, рациональное использование и охрана природных ресурсов Белого моря. СПб.: ЗИН РАН. С. 66–69.
Дементьев В.С., Марфенин Н.Н., 2018. Влияние опреснения на рост, пульсации ценосарка и перемещение гидроплазмы у колониального гидроида Dynamena pumila (L., 1758) // Журн. общ. биологии. Т. 79. № 5. С. 376–392.
Карлсен А.Г., Марфенин Н.Н., 1984. Перемещение гидроплазмы в колонии у гидроидов на примере Dynamena pumila (L.) и некоторых других видов гидроидов // Журн. общ. биологии. Т. 45. № 5. С. 670–680.
Косевич И.А., 1991. Сравнение функционирования верхушек роста побегов и столонов в колонии Obelia loveni (Allm.) (Hydrozoa, Campanulariidae) // Вестн. МГУ. Сер. 16. Биол. № 2. С. 44–52.
Лабас Ю.А., Белоусов Л.В., Баденко Л.А., Летунов В.Н., 1981. О пульсирующем росте у многоклеточных организмов // ДАН СССР. Т. 257. С. 1247–1250.
Леонтович А.А., Марфенин Н.Н., 1990. Взаимосвязь основных внутриколониальных процессов при ветвлении у колониальных гидроидов // Журн. общ. биологии. Т. 51. № 3. С. 353–362.
Летунов В.Н., 1981. Пищевое поведение, пищеварительно-распределительный аппарат и морфогенез у колониальных гидроидных полипов отр. Leptolida. Дис. канд. биол. наук. Л.: ЛГУ. 163 с.
Марфенин Н.Н., 1971а. Жизнедеятельность колонии гидроидного полипа Dynamena pumila зимой // Экология морских организмов. М.: Изд-во МГУ. С. 52–54.
Марфенин Н.Н., 1971б. Интеграция колонии гидроидного полипа Dynamena pumila (Hydrozoa, Leptolida). Реакция колонии на промерзание зимой // ДАН СССР. Т. 199. № 2. С. 489–492.
Марфенин Н.Н., 1973. Морфология роста в колонии гидроидного полипа Dynamena pumila (Hydrozoa, Leptolida) // Журн. общ. биологии. Т. 34. № 5. С. 727–737.
Марфенин Н.Н., 1980. Основные морфо-функциональные состояния колонии у гидроида Dynamena pumila (L.) в естественных условиях // ДАН СССР. Т. 2. № 1. С. 253–256.
Марфенин Н.Н., 1985. Функционирование распределительной системы пульсаторно-перистальтического типа у колониальных гидроидов // Журн. общ. биологии. Т. 46. № 2. С. 153–164.
Марфенин Н.Н., 1993. Функциональная морфология колониальных гидроидов. СПб.: ЗИН РАН. 151 с.
Марфенин Н.Н., 2010. Природные особенности губы Ругозерской и пролива Великая Салма // Флора и фауна Белого моря: иллюстрированный атлас / Под ред. Цетлина А.Б., Жадан А.Э., Марфенина Н.Н. М.: Т-во науч. изд. КМК. С. 9–13.
Марфенин Н.Н., Дементьев В.С., 2017. Парадокс протяженных течений гидроплазмы в колониальном гидроиде Dynamena pumila (Linnaeus, 1758) // Журн. общ. биологии. Т. 78. № 4. С. 3–20.
Марфенин Н.Н., Дементьев В.С., 2018а. Продольные пульсации столона у колониального гидроида Dynamena pumila (Linnaeus, 1758) // Журн. общ. биологии. Т. 79. № 2. С. 85–96.
Марфенин Н.Н., Дементьев В.С., 2018б. Рост, пульсации ценосарка и перемещение гидроплазмы у колониального гидроида Dynamena pumila (L., 1758) в проточной и непроточной кюветах // Журн. общ. биологии. Т. 79. № 2. С. 97–107.
Марфенин Н.Н., Карлсен А.Г., 1983. Состояние фауны гидроидов Еремеевского порога Белого моря ранней весной // Науч. докл. высш. шк. Биол. науки. № 2. С. 26–30.
Наумов Д.В., 1960. Гидроиды и гидромедузы морских, солоноватоводных и пресноводных бассейнов СССР. М.; Л.: Изд-во АН СССР. 626 с.
Полтева Д.Г., Донаков В.В., Айзенштадт Т.Б., 1987. Сезонные изменения клеточного состава в колонии гипогенетического гидроида Obelia lоveni // Зоол. журн. Т. 66. № 8. С. 1135–1147.
Припузова Н.С., Марфенин Н.Н., 2001. Особенности полового размножения трех видов колониальных гидроидов в Белом море // Матер. 5-й науч. конф. Беломорской биол. ст. МГУ: сборник статей. М.: Изд. Рус. ун-т. С. 64–68.
Серебряков И.Г., 1964. Жизненные формы высших растений и их изучение // Полевая геоботаника. Т. 3. М.; Л.: Изд-во АН СССР. С. 146–208.
Серебрякова Т.И., 1974. Жизненные формы растений // Жизнь растений. В 6 т. Гл. ред. Федоров А.А. Т. 1. Введение. Бактерии и актиномицеты / Под ред. Красильникова Н.А., Уранова А.А. М.: Просвещение. С. 87–98.
Симкина Р.Г., 1963. К экологии гидроидного полипа Perigonimus megas Kinne – нового вида в фауне СССР // Тр. Ин-та океанол. Т. 70. С. 216–224.
Beloussov L.V., Labas Ju.A., Zaraisky A.G., Kazakova N.I., 1989. Cytophysiology of growth pulsations in hydroid polyps // J. Experimental Zool. V. 249. P. 258–270.
Bjelde B.E., Miller N.A., Stillman J.H., Todgham A.E., 2015. The role of oxygen in determining upper thermal limits in Lottia digitalis under air exposure and submersion // Physiol. Biochem. Zool. V. 88. № 5. P. 483–493.
Boero F., 1984. The ecology of marine hydroids and effects of environmental factors: a review // Marine Ecol. V. 5. P. 93–118.
Chapman G., 1981. Individuality and modular organisms // Biol. J. Linnean Soc. V. 15. P. 177–183.
Chapman G., Stebbing A.R.D., 1980. The modular habit – a recurring strategy // Devel. Cell. Biol. Coelenterates. Elsiver: N.Holl. P. 157–162.
Chapperon C., Volkenborn N., Clavier J., Seite S., Seabra R., Lima F.P., 2016. Exposure to solar radiation drives organismal vulnerability to climate: Evidence from an intertidal limpet // J. Thermal Biol. V. 57. P. 92–100.
Cole W.H., 1925. Pulsation of the contractile vacuole of Paramecium as affected by temperature // J. Gen. Physiol. V. 7. P. 581–587.
Connell J.H., 1961. The influence of intra-specific competition and other factors on the distribution of the barnacle Chthamalus stellatus // Ecology. V. 42. № 4. P. 710–723.
Diederich C.M., Pechenik J.A., 2013. Thermal tolerance of Crepidula fornicata (Gastropoda) life history stages from intertidal and subtidal subpopulations // Mar. Ecol. Prog. Ser. V. 486. P. 173–187.
Dietz T.H., Tomkins R.U., 1980. The effect of temperature on heart rate of the freshwater mussel Ligumia subrostrata // Comparative Biochem. Physiol. V. 67. № 2. P. 269–271.
Edmunds P.J., 2006. Temperature-mediated transitions between isometry and allometry in a colonial, modular invertebrate // Proc. Royal Soc. London. V. 273. P. 2275–2281.
Evans R.G., 1948. The lethal temperatures of some common British littoral molluscs // J. Anim. Ecol. V. 17. № 2. P. 165–173.
Folino-Rorem N.C., Indelicato J., 2005. Controlling biofouling caused by the colonial hydroid Cordylophora caspia // Water Research. V. 39. P. 2731–2737.
Gili J.M., Hughes R.G., 1995. Ecology of benthic hydroids // Oceanogr. Marine Biol. V. 33. P. 351–426.
Hale L.J., 1960. Contractility and hydroplasmic movements in the hydroid Clytia johnstoni // Quart. J. Microscop. Sci. V. 101. Pt 3. P. 339–350.
Hughes R.N., 2005. Lessons in modularity: the evolutionary ecology of colonial invertebrates // Scientia Marina. V. 69. P. 169–179.
Jackson J.B.C., 1979. Morphological strategies of sessile animals // Biology and systematics of colonial organisms / Eds Larwood G., Rosen B. R. L.: Acad. Press. P. 499–555.
Kinne O., 1956. Über den Einfluss des Salzgehaltes und der Temperature auf Wachstum, Form und Vermehrung bei dem Hydroidpolypen Cordylophora caspia (Pallas), Thecata, Clavidae // Zool. Jahrb. Abt. Allgem. Zool. Physiol. Tiere. Bd. 66. № 4. S. 565–638.
Kinne O., 1958. Über die Reaktion erbgleichen Coelenteratengewebes auf verschiedene Asalzgehalts- und Temperaturbedingungen. II. Mitteilung über den Einflub des Salzgehaltes auf Wachstum und Entwicklung mariner, brackischer und limmischer Organismen // Zool. Jahrb. Abt. Allgem. Zool. Physiol. Tiere. Bd. 67. S. 407–486.
Kinne O., Paffenhöfer G.-A., 1965. Hydranth structure and digestion rate as a function of temperature and salinity in Clava multicornis (Cnidaria, Hydrozoa) // Helgoland Marine Research. V. 12. Is. 4. P. 329–341.
Kinne O., Paffenhöfer G.-A., 1966. Growth and reproduction as a function of temperature and salinity in Clava multicornis (Cnidaria, Hydrozoa) // Helgoländer wiss. Meeresunters. V. 13. P. 62–72.
Lisbjerg D., Petersen J.K., 2001. Feeding activity, retention efficiency and effects of temperature and particle concentration on clearance rate in the marine bryozoan Electra crustulenta // Mar. Ecol. Prog. Ser. V. 215. P. 133–141.
Marfenin N.N., 2015. A new method for studying the transport system in colonial hydroids // Hydrobiologia. V. 759. Is.1. P. 133–146.
Marfenin N.N., Dementyev V.S., 2017. Functional morphology of hydrozoan stolons: stolonal growth, contractility, and hydroplasmic movement in Gonothyraea loveni (Allman, 1859) // Mar. Biol. Res. V. 13. № 5. P. 521–537.
Nguyen K.D.T., Morley S.A., Lai C.-H., Clark M.S., Tan K.S., Bates A.E., Peck L.S., 2011. Upper temperature limits of tropical marine ectotherms: global warming implications // PLoS ONE. V. 6. N. 12. e29340. doi 10.1371/journal.pone.0029340
Tomanek L., Helmuth B., 2002. Physiological ecology of rocky intertidal organisms: a synergy of concepts // Integrative and Comparative Biology. V. 42. № 4. P. 771–775.
Tsukuda H., Liu B., Fujii K.I., 1985. Pulsation rate and oxygen consumption of isolated hearts of the goldfish, Carassius auratus, acclimated to different temperatures // Comp. Biochem. Physiol. V. 82. P. 281–283.
Tusov J., Davis L.V., 1971. Influence of environmental factors on the growth of Bougainvillia sp. Experimental Coelenterate Biology / Eds Lenhoff H.M., Muscatine L., Davis L.V. Honolulu. P. 53–65.
Wyttenbach C.R., 1968. The dynamics of stolon elongation in the hydroid, Campanularia flexuosa // J. Exp. Zool. V. 167. № 3. P. 333–352.
Wyttenbach C.R., 1969. Genetic variations in the mode of stolon growth in the hydroid, Campanularia flexuosa // Biol. Bull. V. 137. № 3. P. 547–556.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии






