Журнал неорганической химии, 2022, T. 67, № 8, стр. 1151-1155
Синтез и строение карбоксилатов тетра(пара-толил)сурьмы p-Tol4SbOC(O)R (R = C6H3F2-2,3, C6H3F2-3,4, C6H3F2-2,5)
В. В. Шарутин a, О. К. Шарутина a, А. Н. Ефремов a, *
a Национальный исследовательский Южно-Уральский государственный университет
454080 Челябинск, пр-т им. В.И. Ленина, 76, Россия
* E-mail: efremov_an94@mail.ru
Поступила в редакцию 12.01.2022
После доработки 07.02.2022
Принята к публикации 09.02.2022
- EDN: OQEOKE
- DOI: 10.31857/S0044457X22080244
Аннотация
Взаимодействием эквимолярных количеств пента(пара-толил)сурьмы и карбоновой кислоты в бензоле синтезированы пара-толильные производные сурьмы p-Tol4SbOC(O)R (R = C6H3F2-2,3 (I), C6H3F2-3,4 (II) и C6H3F2-2,5 (III)), особенности строения которых установлены методом РСА. Атомы сурьмы в I−III имеют искаженную тригонально-бипирамидальную координацию с карбоксилатным лигандом в аксиальном положении. Наличие внутримолекулярных контактов Sb⋅⋅⋅O(=C) (3.346(4), 3.345(6) и 3.284(4) Å) в молекулах I, II и III обусловливает увеличение одного валентного угла CSbC до 126.53(10)°, 126.83(9)° и 126.45(8)° соответственно за счет уменьшения двух других.
ВВЕДЕНИЕ
Потенциал применения органических соединений сурьмы в самых разнообразных областях практической деятельности достаточно широк: от лекарственных препаратов и реагентов тонкого органического синтеза до компонентов каталитических систем при полимеризации и в качестве антиоксидантов [1]. Соединения сурьмы также широко используются в терапии в качестве противопаразитарных средств, особенно при лечении лейшманиоза [2]. Некоторые органические производные сурьмы являются биологически активными веществами [3–5], обладают антибактериальной [6–8] и противоопухолевой активностью [9–14].
Весьма обширным классом органических соединений сурьмы(V) являются соли тетраорганилсурьмы R4SbX, среди которых наиболее изучены производные сурьмы общей формулы Ph4SbX, содержащие в своем составе ароксидные, карбоксилатные, оксимные и другие лиганды Х [15].
Изучению особенностей синтеза и строения подобных толильных соединений пятивалентной сурьмы посвящено гораздо меньше исследований, а подобные вопросы для карбоксилатов тетра(пара-толил)сурьмы практически не затронуты [16, 17], хотя антилейшманиозная активность толильных соединений сурьмы, содержащих фторсодержащие карбоксилатные лиганды, достаточно высока [18], поэтому получение подобных соединений весьма актуально.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ИК-спектры соединений записывали на ИК-фурье-спектрометре Shimadzu в таблетках KBr. Температуры плавления измеряли на синхронном термоанализаторе Netzsch 449C Jupiter. Элементный анализ выполняли на анализаторе Euro EA3028-НТ, рентгеноструктурный анализ − на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (графитовый монохроматор) при 293 K. Сбор, первичную обработку данных, уточнение параметров элементарной ячейки, учет поглощения, определение и уточнение структур проводили по программам [19–21]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных; deposit@ccdc.cam.ac.uk или deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/structures).
2,3-Дифторбензоат тетра(пара-толил)сурьмы p‑Tol4SbOC(O)C6H3F2-2,3 (I) получали по методике [17] из эквимолярных количеств пента(пара-толил)сурьмы и 2,3-дифторбензойной кислоты в бензоле (20°C, 1 ч). Выделены бесцветные кристаллы с tпл = 162.8°С (выход 88%). ИК-спектр (ν, см−1): 3015, 2922, 2866, 1630, 1587, 1493, 1476, 1449, 1395, 1337, 1312, 1267, 1221, 1211, 1188, 1151, 1117, 1065, 1016, 968, 945, 831, 797, 775, 762, 700, 679, 623, 575, 488, 426.
Аналогично синтезировали соединения II, III.
3,4-Дифторбензоат тетра(пара-толил)сурьмы p‑Tol4SbOC(O)C6H3F2-3,4 (II). Выделены бесцветные кристаллы с tпл = 173.7°С (выход 84%). ИК-спектр (ν, см−1): 3051, 3017, 2920, 2866, 1634, 1601, 1508, 1493, 1448, 1423, 1395, 1331, 1277, 1227, 1192, 1109, 1065, 1016, 937, 897, 835, 797, 777, 770, 700, 679, 637, 582, 575, 548, 488, 455, 426.
Сольват 2,5-дифторбензоата тетра(пара-толил)сурьмы с бензолом p-Tol4SbOC(O)C6H3F2-2,5 · ⋅ 1,5C6H6, (III). После перекристаллизации из смеси бензол–октан выход 83%, tразл = 81.8°С. ИК-спектр (ν, см−1): 3034, 2920, 2866, 1647, 1582, 1489, 1447, 1420, 1410, 1391, 1285, 1242, 1211, 1186, 1118, 1063, 1036, 1015, 935, 893, 824, 802, 762, 677, 582, 542, 486, 422.
Соединение I (CCDC 2117685): бесцветные кристаллы триклинные, пр. гр. $P\bar {1},$ a = 10.110(4), b = 11.455(5), c = 14.183(7) Å, α = 76.57(3)°, β = = 89.403(15)°, γ = 70.478(18)°, V = 1501.7(11) Å3, Z = 2, ρвыч = 1.423 г/см3; μ = 0.960 мм–1, F(000) = 652.0. Измерено 35793 независимых отражения (Rint = = 0.0757), 365 параметров уточнения: R1 = 0.0304, wR2 = 0.0749.
Соединение II (CCDC 2119792): бесцветные кристаллы триклинные, пр. гр. $P\bar {1},$ a = 10.195(7), b = 11.561(5), c = 14.224(7) Å, α = 75.364(16)°, β = = 88.91(3)°, γ = 70.67(2)°, V = 1526.8(2) Å3, Z = 2, ρвыч = 1.399 г/см3; μ = 0.944 мм–1, F(000) = 652.0. Измерено 41536 независимых отражений (Rint = = 0.0254), 365 параметров уточнения: R1 = 0.0274, wR2 = 0.0731.
Соединение III (CCDC 2070386): бесцветные кристаллы моноклинные, пр. гр. С2/с, a = = 28.583(8), b = 15.158(4), c = 17.673(5) Å, β = = 90.591(14)°, V = 7656(4) Å3, Z = 8, ρвыч = 1.320 г/см3; μ = 0.765 мм–1, F(000) = 3112.0. Измерено 9678 независимых отражений (Rint = 0.0312), 469 параметров уточнения: R1 = 0.0280, wR2 = 0.0659.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В основе одного из эффективных способов получения производных тетраарилсурьмы Ar4SbX лежит реакция деарилирования пентаарилсурьмы кислотой HX [1].
Мы установили, что реакции пента(пара-толил)сурьмы с дифторбензойными кислотами, содержащими в органическом радикале по два атома фтора в различных положениях, протекают с образованием карбоксилатов тетра(пара-толил)сурьмы с выходом до 88%:
Реакции между реагентами проводили при комнатной температуре в растворе бензола, ход реакции контролировали методом тонкослойной хроматографии (Silufol, элюент – бензол). Показано, что в течение 1 ч из реакционной смеси исчезает пента(пара-толил)сурьма и появляются кристаллы целевых продуктов. Соединения I−III представляют собой бесцветные вещества, устойчивые к действию влаги и кислорода воздуха, хорошо растворимые в ароматических углеводородах, хлороформе, тетрагидрофуране.
В ИК-спектрах соединений I−III наблюдаются интенсивные полосы поглощения при 426 (I), 426 (II), 422 (III) см–1, характеризующие валентные колебания связи Sb−С. Полосы поглощения, отвечающие колебаниям связей С=О (1630, 1634, 1647 см–1 в I−III соответственно), сдвигаются в низкочастотную область спектра по сравнению с полосами поглощения соответствующих карбоновых кислот (1694, 1690, 1699 см–1) [22–24], что характерно для солей карбоновых кислот и обусловлено перераспределением электронной плотности в карбоксильной группе.
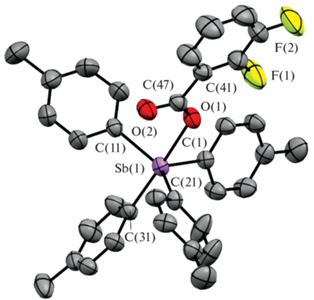
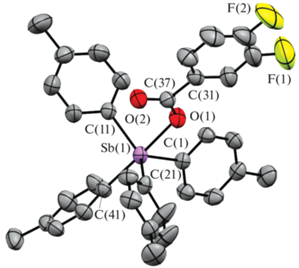
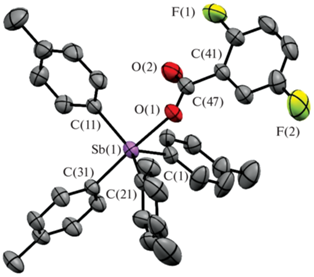
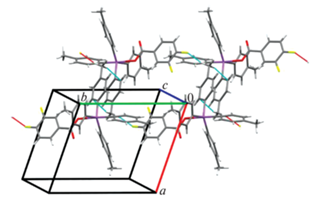
По данным РСА, в кристаллах I−III атомы сурьмы имеют искаженную тригонально-бипирамидальную координацию с карбоксилатным лигандом в аксиальном положении (рис. 1–3).
Длины связей Sb−Cэкв в карбоксилатах тетраарилсурьмы I–III составляют 2.111(2)−2.127(3) Å, расстояния Sb−Cакс близки между собой (2.159(3), 2.166(2), 2.173(2) Å соответственно) и длиннее экваториальных связей, аксиальные углы СSbO равны 177.55(8)°, 178.02(7)°, 176.56(6)° и приближаются к идеальному значению. Длины связей Sb−O (2.314(2), 2.2914(18), 2.2812(15) Å) несколько превышают сумму ковалентных радиусов атомов сурьмы и кислорода (2.14 Å [25]). Один из трех экваториальных валентных углов CSbC в I−III (126.53(10)° (I), 126.83(9)° (II), 126.45(8)° (III)) значительно больше двух других, как и в молекуле 3,4,5-трифторбензоата тетра(пара-толил)сурьмы, содержащей в бензоатном заместителе три электроотрицательных атома фтора [26]. По-видимому, уменьшение электронной плотности на карбонильном атоме кислорода в последнем случае приводит к удлинению расстояния Sb⋅⋅⋅O(=C) (3.377(3) Å), в отличие от подобных внутримолекулярных контактов Sb⋅⋅⋅O(=C) в структурах I−III (3.346(4) Å (I), 3.345(6) Å (II), 3.284(4) Å (III)), которые значительно меньше суммы ван-дер-ваальсовых радиусов атомов-партнеров (3.7 Å [27]), поэтому можно считать, что координационное число центрального атома увеличивается до шести (5+1), как и в подобных соединениях этого типа [1].
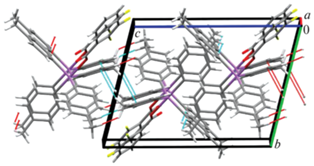
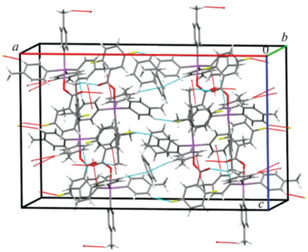
Пространственная структура кристалла соединения I формируется только посредством СН⋅⋅⋅π-взаимодействий метильных атомов водорода и ароматических систем пара-толильных заместителей при атоме металла, что приводит к образованию слоев, ориентированных параллельно плоскости, расположенной вдоль осей a и c элементарной ячейки (рис. 4). В кристалле соединения II межмолекулярные контакты F⋅⋅⋅H–CH2– (2.51 Å) и СН⋅⋅⋅π-взаимодействия структурируют молекулы в парные цепочки, расположенные вдоль кристаллографической оси b (рис. 5). Трехмерная сетка кристалла соединения III образована водородными связями типа С=О⋅⋅⋅H–CH2– (2.50 Å), F⋅⋅⋅HAr (2.50 Å) и взаимодействиями НAr и π-системы арильного лиганда. Интересно отметить, что в данной кристаллической структуре молекулы бензола также участвуют в упаковке молекул посредством СН⋅⋅⋅π-взаимодействий с арильными лигандами соседних молекул (рис. 6).
ЗАКЛЮЧЕНИЕ
Дифторбензойные кислоты реагируют с пента(пара-толил)сурьмой в растворе бензола с образованием карбоксилатов тетра(пара-толил)сурьмы, геометрические характеристики которых (длины связей Sb–C, Sb–О, внутримолекулярные контакты Sb⋅⋅⋅O и величины валентных углов) близки между собой при одинаковом координационном полиэдре атомов сурьмы (КЧ = 5 + 1).
Список литературы
Sharutin V.V., Poddel’sky A.I., Sharutina O.K. // Russ. J. Coord. Chem. 2020. V. 46. № 10. P. 663. [Шарутин В.В., Поддельский А.И., Шарутина О.К. // Коорд. химия. 2020. Т. 46. № 10. С. 579.]https://doi.org/10.1134/S1070328420100012
Mishra J., Saxena A., Singh S. // Curr. Med. Chem. 2007. V. 14. P. 1153. https://doi.org/10.2174/092986707780362862
Mushtaq R., Rauf M.K., Bond M. et al. // Appl. Organomet. Chem. 2016. V. 30. P. 465. https://doi.org/10.1002/aoc.3456
Saleem L., Altaf A.A., Badshah A. et al. // Inorg. Chim. Acta. 2018. V. 474. P. 148. https://doi.org/10.1016/j.ica.2018.01.036
Oliveira L.G., Silva M.M., Paula F.C.S. et al. // Molecules. 2011. V. 16. P. 10314. https://doi.org/10.3390/molecules161210314
Islam A., Da Silva J.G., Berbet F.M. et al. // Molecules. 2014. V. 19. P. 6009. https://doi.org/10.3390/molecules19056009
Mushtaq R., Rauf M.K., Bolte M. et al. // Appl. Organomet. Chem. 2017. V. 31. P. e3606. https://doi.org/10.1002/aoc.3606
Yu L., Ma Y.-Q., Liu R.-C. et al. // Polyhedron. 2004. V. 23. P. 823. https://doi.org/10.1016/j.poly.2003.12.002
Wang F., Yin H., Yue C. et al. // J. Organomet. Chem. 2013. V. 738. P. 35. https://doi.org/10.1016/j.jorganchem.2013.03.046
Islam A., Rodrigues B.L., Marzano I.M. et al. // Eur. J. Med. Chem. 2016. V. 109. P. 254. https://doi.org/10.1016/j.ejmech.2016.01.003
Iftikhar T., Rauf M.K., Sarwar S. et al. // J. Organomet. Chem. 2017. V. 851. P. 89. https://doi.org/10.1016/j.jorganchem.2017.09.002
Jiang J., Yin H., Wang D. et al. // Dalton Trans. 2013. V. 42. P. 8563. https://doi.org/10.1039/C3DT50221J
Yu L., Ma Y.-Q., Wang G.-C. et al. // Heteroatom. Chem. 2004. V. 15. P. 32. https://doi.org/10.1002/hc.10208
Polychronis N.M., Banti C.N., Raptopoulou C.P. et al. // Inorg. Chim. Acta. 2019. V. 489. P. 39. https://doi.org/10.1016/j.ica.2019.02.004
Cambridge Crystallographic Data Center. 2020. deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk
Sharutin V.V., Sharutina O.K. // Russ. J. Inorg. Chem. 2017. V. 62. № 7. P. 905. [Шарутин В.В., Шарутина О.К. // Журн. неорган. химии. 2017. Т. 62. № 7. С. 925.]https://doi.org/10.1134/S003602361707021X
Шарутина О.К. // Вестник ЮУрГУ. Сер. хим. 2021. Т. 13. № 4. С. 63. https://doi.org/10.14529/chem210404
Artem’eva E.V., Efremov A.N., Sharutina O.K. et al. // Polyhedron. 2022. V. 213. P. 115627.
Bruker (1998). SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA.
Bruker (1998). SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Тарасевич Б.Н. ИК-спектры основных классов органических соединений. М.: Изд-во МГУ, 2012. 55 с.
Васильев А.В., Гриненко Е.В., Щукин А.О., Федулина Т.Г. Инфракрасная спектроскопия органических и природных соединений. СПб.: СПбГЛТА, 2007. 54 с.
Spectral Database for Organic Compounds, SDBS. Release 2021. National Institute of Advanced Industrial Science and Technology.
Cordero B., Gómez V., Platero-Prats A.E. et al. // Dalton Trans. 2008. V. 21. P. 2832. https://doi.org/10.1039/B801115J
Шарутин В.В., Шарутина О.К., Ефремов А.Н. // Журн. структур. химии. 2020. Т. 61. № 9. С. 1490. https://doi.org/10.26902/JSC_id60682
Mantina M., Chamberlin A.C., Valero R. et al. // J. Phys. Chem. A. 2009. V. 113. № 19. P. 5806. https://doi.org/10.1021/jp8111556
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии