Журнал неорганической химии, 2022, T. 67, № 8, стр. 1087-1094
Комплексные соединения перхлоратов цинка(II) и меди(II) с никотинамидом: синтез, строение, цитотоксичность
Н. С. Рукк a, *, Н. С. Каберник a, Г. А. Бузанов b, Л. Г. Кузьмина b, Г. А. Давыдова c, С. К. Белусь d, Е. И. Кожухова d
a МИРЭА – Российский технологический университет (Институт тонких химических технологий
им. М.В. Ломоносова)
119571 Москва, пр-т Вернадского, 86, Россия
b Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
c Институт теоретической и экспериментальной биофизики РАН
142290 Пущино, Институтская ул, 3, Россия
d Институт химических реактивов и особо чистых веществ Национального исследовательского центра “Курчатовский институт”
107076 Москва, ул. Богородский вал, 3, Россия
* E-mail: roukkn@inbox.ru
Поступила в редакцию 20.01.2022
После доработки 07.02.2022
Принята к публикации 09.02.2022
- EDN: VQTMPK
- DOI: 10.31857/S0044457X22080220
Аннотация
Изучено взаимодействие гексагидратов перхлоратов цинка(II) и меди(II) с никотинамидом (Nia – никотинамид, ниацин, 3-пиридинкарбоксамид, C5H4NС(O)NH2). Показано, что при мольных отношениях M(ClO4)2 ⋅ 6H2O : Nia = 1 : 2 в водных растворах образуются комплексные соединения состава [Zn(Nia)2(H2O)4](ClO4)2 (1) и [Cu(Nia)2(H2O)2](ClO4)2 ⋅ 2H2O (2). Оба соединения являются ионными. Комплексный катион 1 представляет собой искаженный октаэдр, в котором молекулы никотинамида находятся в транс-положении друг к другу. Атом меди(II) в соединении 2 находится в центре квадрата, а координированные молекулы никотинамида также находятся в транс-положении Цитотоксичность соединений определена методом МТТ-теста по отношению к постнатальным стволовым клеткам пульпы зуба человека DPSC и к клеточной линии аденокарциномы молочной железы. Проведено также исследование антипролиферативной активности выделенных соединений по отношению к 10 линиям раковых клеток. Продемонстрирована эффективность воздействия соединения 1 на клеточные линии C6, Panc-1, U251 (жизнеспособность <15%).
ВВЕДЕНИЕ
В настоящее время онкологические заболевания, за исключением COVID-19 и болезней сердечно-сосудистой системы, являются основной причиной смертности во всем мире [1]. Лекарственные препараты на основе платины (цисплатин, оксалиплатин, карбоплатин и др.) широко применяются для химиотерапии опухолей различной природы. Их действие обусловлено образованием с дезоксирибонуклеиновой кислотой (ДНК) меж- и внутривитковых ковалентных связей через атомы азота N7 пуриновых оснований, что приводит к нарушению репликации, транскрипции, апоптозу, приостановке клеточной пролиферации и роста опухолей. Этот механизм является неспецифическим, и соединения платины проявляют серьезные побочные эффекты (нейро-, гепато- и нефротоксичность). В этой связи особый интерес представляют комплексные соединения переходных металлов, редкоземельных элементов с небольшими органическими лигандами в качестве потенциальных противораковых фармакологических препаратов нового поколения [2–9]. Действие противораковых препаратов на основе металлокомплексов базируется на образовании различных аддуктов с ДНК [10]. В связи с этим интеркаляцию рассматривают как один из наиболее важных способов нековалентного взаимодействия биологически активных частиц с молекулой ДНК, помимо электростатических взаимодействий и связывания в малом желобке ДНК [10, 11]. Другой мишенью в клетке могут быть циклинзависимые киназы, белки и аминокислоты, а также более сложные образования, например, отдельно взятые органеллы – митохондрии.
Многие органические соединения, используемые в фармацевтике, активируются или биотрансформируются ионами металлов, например катионами меди и цинка, принимающими участие в различных клеточных процессах и оказывающими комплексное воздействие на клетку [12].
Медь и цинк – незаменимые для живых организмов элементы, обеспечивающие протекание разнообразных биохимических реакций, а также способные проявлять противораковую активность.
Медьсодержащие частицы являются кофактором многих ферментов, например супероксиддисмутазы, нейтрализующей свободные кислородные радикалы. Они также проявляют селективную цитотоксичность по отношению к раковым клеткам вследствие пониженного содержания кислорода в областях, окружающих злокачественные новообразования, что приводит к восстановлению меди(II) в обедненных кислородом опухолевых клетках до меди(I), катализирующей образование активных форм кислорода, окислительному стрессу, разрывам двойной спирали ДНК и апоптозу. В ряде работ показана роль ионов меди как ингибиторов протеасом [13], возможно, они могут стимулировать аутофагию в клетках [14]. Известно, что атомы меди могут не только входить в состав противоопухолевого препарата, но и усиливать его действие [15].
Цинк является жизненно важным элементом, выступая в клетках как регуляторный ион [16]. Кроме того, цинк входит в состав ряда ферментов, выступающих в роли антиканцерогенов.
Никотинамид (Nia, амид никотиновой кислоты) – витамин B3, а также предшественник важнейшего кофермента никотинамидадениндинуклеотида. Известно, что никотинамид обладает определенными противоопухолевыми свойствами и может быть эффективен при терапии [17] и профилактике предракового состояния кожи (актинического кератоза) и плоскоклеточной карциномы (cutaneous squamous cell carcinoma) – второго по распространенности рака кожи [18]. Показано, что использование аминокислот и витаминов способствует повышению селективности препаратов [13].
В литературе имеются сведения о соединениях платины(II) цис-[Pt(Nia)(NH3)2Cl]NO3 [19] и серебра(I) [Ag(Nia)2]NO3 · H2O [20] с никотинамидом. Показано, что [Ag(Nia)2]NO3 · H2O проявляет более высокую цитотоксичность по отношению к клеточной линии L1210 лейкемии мышей (IC50 = 1.23 ± 0.22 μM) по сравнению с цисплатином (IC50 = 3.40 ± 0.20 μM) [20].
В работе [21] описано строение комплекса нитрата цинка(II) с никотинамидом состава [Zn(Nia)2(H2O)4](NO3)2 ⋅ 2H2O, полученного в этанольном растворе из нитрата цинка и никотинамида, однако его биологическая активность не изучена. Описан синтез комплекса перхлората меди(II) с никотинамидом [Cu(Nia)6](ClO4)2 в среде ацетонитрила. В этом соединении комплексный катион представляет собой октаэдр, в вершинах которого находятся атомы азота пиридинового цикла координированных молекул никотинамида [22]. Перхлоратные комплексы цинка(II) и меди(II) с никотинамидом, синтезированные из водных растворов, не были изучены. Таким образом, целью настоящей работы является синтез и изучение строения и свойств никотинамидных производных перхлората цинка(II) и меди(II), а также сравнение их биологической активности.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. Гексагидраты перхлоратов цинка и меди предварительно получали из соответствующих основных карбонатов 3Zn(OH)2 ⋅ 2ZnCO3 (99%, Реахим), CuOH)2 ⋅ CuCO3 (99%, ABCR) и хлорной кислоты (ч., Реахим). Для синтеза комплексов использовали никотинамид (99.5%, Sigma-Aldrich).
Методы физико-химического анализа
Элементный анализ на углерод, водород и азот проводили на элементном анализаторе CHNS Euro Vector EuroFA 3000 (EuroVector s.p.a., Italy). Содержание металла определяли трилонометрически, а также методом ICP MS на атомно-эмиссионном спектрометре с индуктивно связанной плазмой iCAP 6300 Duo (Thermo Scientific, USA), в ЦКП “Исследовательский научно-аналитический центр НИЦ “Курчатовский институт” – ИРЕА”.
ИК-спектры соединений записывали на программно-аппаратном комплексе на основе ИК-спектрометра VERTEX-70 с модулем комбинационного рассеяния RAM II Bruker в области 350–4000 см–1 в таблетках KBr.
Масс-спектры с ионизацией электрораспылением (ESI-MS) записывали на ESI масс-спектрометре AmaZon Bruker Daltonic GmbH, диапазон регистрируемых фрагментов m/z = 70–2200 в режиме регистрации положительных и отрицательных ионов в растворе H2O–CH3CN (1 : 1).
Рентгенофазовый анализ (РФА) проводили на дифрактометре Bruker D8 Advance (CuKα-излучение, Ni-фильтр, LYNXEYE детектор; геометрия на отражения; диапазон 2θ 5°–80°, шаг изменения 0.01125°.
Рентгеноструктурный анализ (РСА). Набор дифракционных отражений для комплексных соединений 1 и 2 получен в Центре Коллективного пользования ИОНХ РАН на дифрактометре CCD area Bruker D8 Venture (графитовый монохроматор, MoKα-излучение, ω-сканирование, 150 K). Первичную обработку экспериментальных данных осуществляли с помощью программы SAINT [23]. Поправку на поглощение учитывали с помощью программы SADABS. Кристаллическая структура была определена прямым методом и уточнена по F2 полноматричным методом наименьших квадратов в анизотропном приближении для неводородных атомов. Позиции атомов водорода были рассчитаны геометрически. Уточнение осуществляли методом наименьших квадратов по модели “наездника”. Все расчеты проводили с помощью пакета программ Olex-2 [24] и SHELXTL-Plus [25]. Визуализацию строения осуществляли с помощью программы Mercury [26]. Результаты РСА депонированы в Кембриджской базе структурных данных CCDC под номерами 2121923 (1) и 2121926(2). Данные могут быть запрошены по адресу: http://www.ccdc.cam.ac.uk.
Изучение цитотоксичности. Цитотоксическую активность полученных соединений изучали в течении 24 ч колориметрическим МТТ-тестом [27, 28] на постнатальных стволовых клетках пульпы зуба человека (DPSC) и клеточной линии MCF-7 (аденокарциномы молочной железы), полученных из Российской коллекции клеточных культур Института цитологии РАН. Статистическую обработку результатов проводили с помощью программы Origin, за ошибку принимали среднеквадратичное отклонение от среднего значения, за достоверные принимали различия по U-критерию Манна–Уитни (р < 0.01). Антипролиферативная активность была изучена по отношению к десяти различным линиям раковых клеток: глиомы крысы (С6), карциномы поджелудочной железы человека (Panc-1), глиобластомы человека (U251), нейробластомы человека (IMR32), нейробласт-подобным клеткам человека (SH-SY5Y), карциномы молочной железы человека (HS 578T) и (BT474), эмбриональных почек человека (HEK293), рака гортани человека (Hep-2) и остеосаркомы человека (MNNG-HOS) при концентрации комплексов с = 1 × 10–4 моль/л.
Эксперимент. Гексагидраты перхлоратов меди(II) и цинка(II) получали взаимодействием основных карбонатов меди(II) Cu(OH)2 ⋅ CuCO3 и цинка(II) 3Zn(OH)2 ⋅ 2ZnCO3 с хлорной кислотой в мольном соотношении карбонат : HClO4 = 1 : 2. Полученные растворы нагревали до упаривания 60–70% воды и охлаждали до комнатной температуры. Гексагидрат перхлората цинка(II) кристаллизовался в виде бесцветных призм, а гексагидрат перхлората меди(II) – в виде голубых призм. Состав соединений соответствовал формуле M(ClO4)2 ⋅ 6H2O, где M = Cu, Zn. Гомогенность полученных препаратов была подтверждена методом РФА.
Комплексы перхлоратов меди(II) и цинка(II) c никотинамидом [Zn(Nia)2(H2O)4](ClO4)2 (1) и [Cu(Nia)2(H2O)2](ClO4)2 ⋅ 2H2O (2) получали путем взаимодействия предварительно полученных перхлоратов цинка(II) (1.8619 г, 5 ммоль) и меди(II) (1.8527 г, 5 ммоль), растворенных в 10 мл дистиллированной воды, c 10 мл водного раствора никотинамида (1.2213 г, 10 ммоль) при мольном соотношении M(ClO4)2 : Nia = 1 : 2, где M = = Zn, Cu (схема S1, S2 ). Такие мольные соотношения были выбраны на основании результатов, представленных в работе [21]. В ходе синтеза происходило изменение окраски растворов: для 1 – с бесцветной на бледно-оранжевую, для 2 – с голубой на темно-синюю. Полученные соединения отделяли от маточного раствора на фильтре с пористым дном, промывали минимальным количеством дистиллированной воды и высушивали в эксикаторе над гидроксидом натрия. Выход составил 80–85%.
Перхлорат тетрааква-бис(никотинамид)цинка(II) [Zn(Nia)2(H2O)4](ClO4)2 (1). Выход 2.32 г, 80%.
ИК-спектр (см–1): 827 ρ(H2O); 1070 ν3(${\text{ClO}}_{4}^{ - }$); 1430 ν(Zn–N) + δ(CNC); 1608 δ(H2O); 1640 ν(С=O); 3350–3450 ν(N–H) (табл. S1 ).
| C | N | H | Zn | |
| Найдено, мас. %: | 24.58; | 9.47; | 3.67; | 11.07. |
| Для C12H20Cl2N4O14Zn (1) (580.58) | ||||
| вычислено, мас. %: | 24.83; | 9.65; | 3.47; | 11.26. |
Масс-спектр (ESI, 4.5 кВ, m/z (Iотн, %)), найд./выч.: 225.97/218.89 [Zn(H2O)3(ClO4)]+ (7.7), 256.99/254.92 [Zn(H2O)5(ClO4)]+ (10.8), 329.01/322.99 [Zn(Nia)(H2O)2(ClO4)]+ (13.1), 358.93/359.02 [Zn(Nia)(H2O)4(ClO4)]+ (35.6), 406.97/409.09 [Zn(Nia)2(ClO4)]+ (100), 479.01/479.31 [Zn(Nia)2(H2O)4(ClO4)]+ (13.5), 531.00/531.221 [Zn(Nia)3(ClO4)]+ (21.4); 99.04/99.45 (ClO4)– (3.4), 362.55/363.74 [Zn(ClO4)3]– (100), 486.61/485.87 [Zn(Nia)(ClO4)3]– (5.0); и катион никотинамидия 123.28/123.13 [NiaH]+ (14.6) (рис. S1 ).
Дигидрат перхлората диаква-бис(никотинамид)меди(II) [Cu(Nia)2(H2O)2](ClO4)2 ⋅ 2H2O (2). Выход 2.45 г, 84.7%.
ИК-спектр (см–1): 837 ρ(H2O) ; 1060 ν3(ClO4–); 1440 ν(Cu–N) + δ(CNC); 1603 δ(H2O); 1670 ν(С=O); 3100–3400 ν(N–H); 3600 ν(O–H) (табл. S1 ).
| C | N | H | Cu | |
| Найдено, мас. %: | 24.27; | 9.97; | 3.65; | 11.00. |
| Для C12H20Cl2N4O14Cu (2) (578.76) | ||||
| вычислено, мас. %: | 24.90; | 9.68; | 3.48; | 10.98. |
Масс-спектр (ESI, 4.5 кВ), m/z (Iотн, %) найд./выч.: 225.94/217.04 [Cu(H2O)3(ClO4)]+ (19.8), 326.85/321.15 [Cu(Nia)(H2O)2(ClO4)]+ (10.2), 355.91/357.18 [Cu(Nia)(H2O)4(ClO4)]+ (13.3), 405.91/407.16 [Cu(Nia)2(ClO4)]+ (100); 98.98/99.45 (ClO4)– (3.6), 361.49/361.9 [Cu(ClO4)3]– (100), 483.58/484.03 [Cu(Nia)(ClO4)3]– (13.2), 605.71/606.15 [Cu(Nia)2(ClO4)3]– (8.7); и катион никотинамидия 123.20/123.13 [NiaH]+ (3.8) (рис. S1 ).
Монокристаллы 1 были выделены в виде светло-желтых призм после 3–4 сут изотермического (комнатная температура) испарения растворителя. Монокристаллы 2 в виде темно-синих блоков были получены на следующий день после проведения синтеза. Индивидуальность полученных образцов подтверждена сопоставлением рентгеновских дифрактограмм исходных веществ, выделенных целевых продуктов, а также дифрактограмм, рассчитанных из данных РСА (рис. S2 ). Таким образом, полученные соединения выделены в индивидуальном виде без примеси реагентов или других веществ, причем дифрактограммы, рассчитанные на основании данных по рентгеновской дифракции монокристалла для соединений 1 и 2, совпадают с экспериментальными, поэтому структуры монокристаллов являются репрезентативными для соответствующих образцов в объеме.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По данным РСА, соединения 1 и 2 представляют собой ионные соединения. В комплексном катионе 1 атом цинка находится в центре несколько искаженного октаэдра, образованного двумя атомами азота молекул никотинамида, находящихся в транс-положении, и атомами кислорода четырех молекул воды (рис. 1а), тогда как комплексный катион 2 имеет плоскоквадратное строение, причем два атома азота лиганда и два атома кислорода молекул воды находятся в транс-положении (рис. 1б). Рентгенографические характеристики соединений представлены в табл. S2 , а значения основных длин связей и валентных углов – в табл. S3, S4 .
Рис. 1.
Строение соединений [Zn(Nia)2(H2O)4](ClO4)2 (1) (а) и [Cu(Nia)2(H2O)2](ClO4)2 ⋅ 2H2O (2) (б).
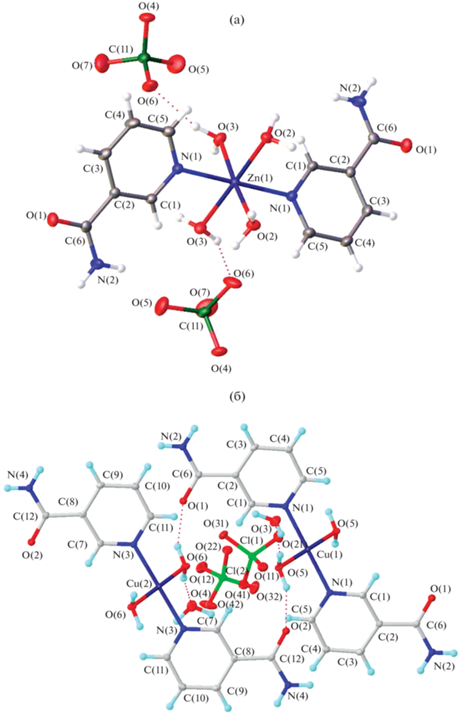
Сравнение длин связей М–O и М–N показывает, что для комплекса [Cu(Nia)2(H2O)2](ClO4)2 ⋅ ⋅ 2H2O (2) длины связей Cu–O и Cu–N составляют 1.9658(10)–1.9800(9) и 1.989(1)–2.005(1) Å соответственно. Для соединения 1 длины связей Zn–O и Zn–N равны 2.101(1)–2.104(1) и 2.155(1) Å соответственно (табл. S3, S4 ) и сопоставимы с данными для [Zn(Nia)2(H2O)4](NO3)2 · 2H2O [21]. Подобные явления могут быть обусловлены изменением размеров комплексных катионов при изменении координационного числа. Для обоих соединений характерно образование системы водородных связей с участием перхлорат-ионов, амидной группы никотинамида, а также координированных и некоординированных молекул воды. Комплексное соединение 1, в отличие от соединения меди(II) с никотинамидом 2, дополнительно стабилизировано за счет π–π-взаимодействия между пиридиновыми фрагментами молекул никотинамида (угол между плоскостями равен 0°, расстояние между центроидами циклов – 2.325 Å).
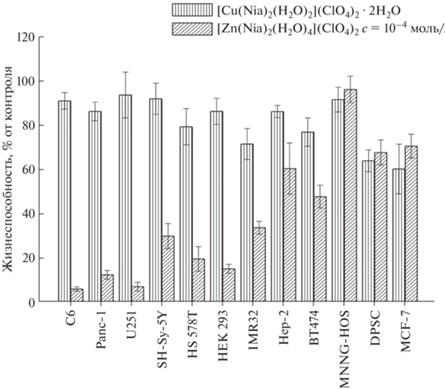
Как видно из данных, представленных в табл. S5 и S6 , а также на рис. S3 , все образцы оказывают дозозависимое воздействие на клетки, причем соединение 1 подавляет выживаемость клеток DPSC при c = 1 × 10–4–5 × 10–5 моль/л в большей степени, чем соответствующие стехиометрические смеси. При меньших концентрациях нет достоверного различия между образцами и их смесями, что, по-видимому, обусловлено высокой токсичностью перхлорат-ионов. Однако для комплекса цинка 1 (с = 1 × 10–5 моль/л) выживаемость DPSC выше (в сравнении с MCF-7) и составляет 95.40 ± 9.25 и 89.21 ± 18.08% соответственно. В то же время соединение 1 подавляет выживаемость клеточной линии MCF-7 (в сравнении с перхлоратом цинка и его стехиометрической смесью с никотинамидом) и приближается к токсическому действию доксорубицина при той же концентрации (89.21 ± 18.08 и 81.73 ± 9.23% соответственно, табл. S5, S6 ). Как показано в [29], влияние цинка на апоптоз зависит от ряда факторов, прежде всего от типа клеток, причем в некоторых клетках воздействие низких доз цинка вызывает апоптоз; тогда как воздействие высоких концентраций цинка его ингибирует. Кроме того, цинк способен регулировать пролиферацию клеток и их рост [29]. В ряде случаев происходит регулируемый посредством р53/ROS апоптоз, включающий транслокацию р53 в митохондрии, диссипацию потенциала митохондриальной мембраны и прямую транслокацию ускоряющего апоптоз гена Bax. Для клеточной линии MCF-7 вызываемый цинком апоптоз проявляется в присутствии экспрессии гена р53 [29].
Как видно из рис. 2, комплекс перхлората цинка с никотинамидом демонстрирует сильное антипролиферативное воздействие на клетки (жизнеспособность, % по отношению к контролю, концентрация 1 × 10–4 моль/л): C6 (6.02 ± 0.96%), Panc-1 (12.41 ± 1.97%), U251 (7.05 ± 1.98%), SH‑Sy‑5Y (30.00 ± 5.72%), HS578T (19.66 ± ± 5.58%), HEK293 (15.16 ± 2.07%), IMR32 (33.80 ± ± 2.89%), а также умеренное влияние на клетки Hep-2 (60.63 ± 11.62%), BT474 (47.86 ± 5.15%). Оказалось, что клеточная линия MNNG-HOS является наиболее устойчивой к действию [Zn(Nia)2(H2O)4](ClO4)2 (1) (жизнеспособность 96.49 ± 6.03%) в сравнении с DPSC (67.91 ± 5.67%). При этой же концентрации комплекс перхлората меди(II) с никотинамидом практически не оказывает противоракового действия, это, возможно, связано с меньшей устойчивостью комплексного иона [Cu(Nia)(H2O)2(ClO4)]+ по сравнению с [Zn(Nia)(H2O)4(ClO4)]+ в водном растворе, что характеризуется следующей интенсивностью сигналов (Iотн, %) в ESI-MS спектре: 10.2 для медного комплекса и 35.6 – для цинкового. Однако эффективность воздействия соединения 1 на клеточные линии C6, Panc-1 и U251 проявляется в значительной степени (жизнеспособность <15%).
ЗАКЛЮЧЕНИЕ
Впервые получены и идентифицированы комплексные соединения состава [Zn(Nia)2(H2O)4](ClO4)2 (1), [Cu(Nia)2(H2O)2](ClO4)2 ⋅ ⋅ 2H2O (2), изучено их строение и свойства. Проведены сравнительные цитотоксические исследования комплексов перхлоратов цинка(II) и меди(II) на линиях стволовых и раковых клеток. Для всех типов клеток наблюдается дозозависимое изменение цитотоксичности. На основании сравнительного исследования антипролиферативной активности соединений 1 и 2 на 10 линиях раковых клеток показана эффективность воздействия цинксодержащего соединения 1 на клеточные линии C6, Panc-1, U251 (жизнеспособность <15%).
Результаты настоящей работы согласуются с литературными данными по биологической активности комплексных соединений цинка и меди с производными пиразола, фосфорсодержащими аналогами салициловой кислоты и другими лигандами, в состав которых входят донорные атомы кислорода и азота [30–32]. Однако необходимы дополнительные исследования для изучения биологической активности соединений in vivo и in vitro.
Список литературы
Cancer research in UK. Worldwide statistics. https://www.cancerresearchuk.org/health-professional/cancer-statistics/worldwide-cancer/incidence/heading-One
Kostova I. // Recent Patents on Anti-Cancer Drug Discovery. 2006. V. 1. P. 1. https://doi.org/10.2174/157489206775246458
Rukk N.S., Kuzmina L.G., Albov D.V. et al. //. Polyhedron. 2015. V. 102. P. 152. https://doi.org/10.1016/j.poly.2015.09.011
Findoráková L., Győryová K., Hudecová D. et al. // J. Therm. Anal.Calorim. 2006. V. 111. P. 1771. https://doi.org/10.1007/s10973-012-2275-9
Barry N.P.E., Sadler P.J. // Chem. Commun. 2013. V. 49. P. 5106. https://doi.org/10.1039/c3cc41143e
Rukk N.S., Albov D.V., Shamsiev R.S. et al. // Polyhedron. 2012. V. 44. P. 124. https://doi.org/10.1016/j.poly.2012.06.075
Рукк Н.С., Кузьмина Л.Г., Давыдова Г.А. и др. // Изв. АН. Сер. хим. 2020. № 7. С. 1394.
Rukk N.S., Kuzmina L.G., Shamsiev R.S. et al. // Inorg. Chim. Acta. 2019. V. 487. P. 184. https://doi.org/10.1016/j.ica.2018.11.036
Голубева И.С., Яворская Н.П., Барышникова М.А. и др. // Рос. биотерапевтический журн. 2016. Т. 15. С. 89. https://doi.org/10.17650/1726-9784-2016-15-4-89-95
Boer R.D., Canals A., Coll M. // Dalton Trans. 2009. V. 3. P. 399. https://doi.org/10.1039/b809873p
Hurley L.H. // Nat. Rev. Canc. 2002. V. 2. P. 188. https://doi.org/10.1038/nrc749
Marloye M., Berger G., Gelbcke M. et al. // Future Med. Chem. 2016. V. 8. P. 2263. https://doi.org/10.4155/fmc-2016-0153
Zhen Zhang, Huiyun Wang, Maocai Yan et al. // Mol. Med. Rep. 2017. V. 15. P. 3. https://doi.org/10.3892/mmr.2016.6022
Molinaro C., Martoriati A., Pelinski L. et al. // Cancers. 2020. V. 12. P. 2863. https://doi.org/10.3390/cancers12102863
Mizutani H., Nishimoto A., Hotta S. et al. // Anticancer Res. 2018. V. 38. P. 2643. https://doi.org/10.21873/anticanres.12506
Chasapis C.T., Ntoupa P.-S.A., Spiliopoulou C.A. et al. // Arch. Toxicol. 2020. V. 94. P. 1443. https://doi.org/10.1007/s00204-020-02702-9
Nikas I.P., Paschou S.A., Han Suk Ryu // Biomolecules. 2020. V. 20. P. 477. https://doi.org/10.3390/biom10030477
Fania L., Mazzanti C., Campione E. et al. // Int. J. Mol. Sci. 2019. V. 20. P. 5946. https://doi.org/10.3390/ijms20235946
Wang B., Qian H., Yiu S.-M. et al. // Eur. J. Med. Chem. 2014. V. 71. P. 366. https://doi.org/10.1016/j.ejmech.2013.10.062
Rendošová M., Vargová Z., Kuchár J. et al. // J. Inorg. Biochem. 2017. V. 168. P. 1. https://doi.org/10.1016/j.jinorgbio.2016.12.003
Dziewulska-Kułaczkowska A., Mazur L., Ferenc W. // J. Therm. Anal. Calorim. 2009. V. 96. P. 255. https://doi.org/10.1007/s10973-008-9851-z
Chen K.-L. H., Iwamoto R.T. // Inorg. Chim. Acta. 1969. V. 3. P. 223. https://doi.org/10.1016/s0020-1693(00)92483-6
Bruker 2001. SAINT (Version 6.02a). Bruker AXS Inc., Madison, Wisconsin, USA.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
SHELXTL-Plus, Version 5.10, Bruker AXS Inc., Madison, Wisconsin (USA), 1997.
Macrae C.F., Bruno I.J., Chisholm J.A. et al. // J. Appl. Crystallogr. 2008. V. 41. P. 466. https://doi.org/10.1107/S0021889807067908
Mossman T. // J. Immunol. Methods. 1983. V. 65. P. 55.
Poltavtseva R.A., Nikonova Yu.A., Selezneva I.I. et al. // Bull. Exp. Biol. Med. 2014. V. 158. P. 164. https://doi.org/10.1007/s10517-014-2714-7
Franklin R.B., Costello L.C. // J. Cellular Biochem. 2009. V. 106. P. 750. https://doi.org/10.1002/jcb.22049
Ivanova A.D., Kuz’menko T.A., Smolentsev A.I. et al. // Russ. J. Coord. Chem. 2021. V. 47. P. 751. https://doi.org/10.1134/S1070328421110026
Ivanova I.S., Tsebrikova G.S., Rogacheva Yu.I. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 1846. https://doi.org/10.1134/S0036023621120068
Marinova P., Marinov M., Kazakova M. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 1925. https://doi.org/10.1134/S0036023621130052
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Инструменты
Журнал неорганической химии