Журнал неорганической химии, 2022, T. 67, № 6, стр. 693-697
Натрий-ионный транспорт и фазовый переход в ванадате Na3ErV2O8 с глазеритоподобной структурой
О. Н. Леонидова a, *, И. А. Леонидов a, М. В. Патракеев a, Р. Ф. Самигуллина a
a Институт химии твердого тела УрО РАН
620990 Екатеринбург, Первомайская, 91, Россия
* E-mail: olga@ihim.uran.ru
Поступила в редакцию 08.11.2021
После доработки 06.12.2021
Принята к публикации 08.12.2021
- EDN: GTWKFI
- DOI: 10.31857/S0044457X22060137
Аннотация
Ванадат Na3ErV2O8 с глазеритоподобной структурой получен на воздухе методом твердофазного синтеза. Параметры элементарной ячейки (пр. гр. симметрии P21/n), рассчитанные на основе данных порошковой рентгенографии, при комнатной температуре составляют: a = 5.488, b = 9.723, c = = 7.213 Å, β = 93.06°. Фазовый переход из низкотемпературной α-модификации в высокотемпературную β-модификацию при 866°С имеет энтальпию 36.9 Дж/г. Методом дилатометрии установлено, что коэффициент линейного термического расширения (αL) в α-фазе увеличивается от 8.0 × × 10−6 до 12.5 × 10−6 K−1. Фазовый переход α → β сопровождается резким расширением Na3ErV2O8 и увеличением αL до 15.0 × 10−6 K−1 в β-фазе. Методом импедансной спектроскопии проведено исследование электропроводности (σ) в зависимости от температуры и парциального давления кислорода (${{p}_{{{{{\text{O}}}_{{\text{2}}}}}}}$) в газовой фазе. Неизменность значений σ в широком диапазоне ${{p}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ свидетельствует об ионном характере электропроводности. Методом Тубандта установлено, что носителями заряда являются катионы натрия.
ВВЕДЕНИЕ
Двойной ванадат Na3ErV2O8 относится к семейству сложных оксидов M3MeX2O8 (М – щелочной металл, Me = Fe, Bi, Sc, Y, редкоземельный элемент, X = P, V, As) с глазеритоподобной структурой, как у природного минерала K3Na(SO4)2 [1–4]. Низкотемпературная модификация α-Na3ErV2O8 имеет моноклинную структуру (пр. гр. P21/n) с параметрами элементарной ячейки a = 5.490, b = = 9.739, c = 7.215 Å, β = 93.07° (5) [2]. В этой структуре ионы Er3+ расположены в 2d-позициях Вайкоффа, образуя октаэдры ErO6, ионы V5+ находятся в 4e-позициях с образованием тетраэдров VO4. Ионы Na+ локализуются в двух положениях: в позициях 2c (Na(1)) образуют искаженную пирамиду Na(1)O5, а в позициях 4e (Na(2)) – октаэдры Na(2)O6. В высокотемпературной фазе β-Na3ErV2O8, которая кристаллизуется в тригональной сингонии (пр. гр. P$\bar {3}$m) с параметрами элементарной ячейки a = 5.64, c = 7.46 Å, натрий находится в октаэдрическом кислородном окружении [2].
Глазеритоподобные оксиды M3RX2O8, содержащие ионы редкоземельных элементов, вызывают интерес как оптические материалы [5–9]. Вместе с тем наличие в структуре обеих модификаций междоузельных позиций, которые имеют общие грани с позициями, занятыми натрием, способствует образованию непрерывных путей для миграции ионов натрия. К настоящему времени считается, что электропроводность глазеритоподобных оксидов Na3Bi(PO4)2 и Na3Bi(AsO4)2 обусловлена переносом ионов натрия [10–12]. Фазовые переходы в фосфате Na3Bi(PO4)2 и твердых растворах на его основе приводят к сложным температурным зависимостям электропроводности с различными энергиями активации [9, 10].
В этой статье мы сообщаем об исследованиях электропроводности, ионных чисел переноса, термического расширения и фазовых переходов ванадата Na3ErV2O8.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образец Na3ErV2O8 получали методом твердофазного синтеза из стехиометрических количеств Na2CO3, Er2O3 и V2O5. Исходные реагенты смешивали в агатовой ступке. Полученный порошок помещали в платиновый тигель и обжигали при 540–950°С на воздухе с несколькими промежуточными перетираниями. Кристаллическую структуру соединения и наличие примесей посторонних фаз определяли методом порошковой рентгеновской дифракции при комнатной температуре с использованием дифрактометра Shimadzu XRD-7000 с CuKα-излучением. Параметры элементарной ячейки Na3ErV2O8 уточняли с использованием программы PowderCell 2.3.
Образцы для исследования электропроводности и термического расширения готовили прессованием полученного порошка ванадата Na3ErV2O8 в таблетки толщиной 5 мм и диаметром 6 мм. Таблетки спекали на воздухе при 950°С в течение 10 ч. Электропроводность (σ) измеряли методом импедансной спектроскопии (Solatron 1260 Frequency Response Analyzer). Частотные зависимости комплексного импеданса получали при постоянной температуре в диапазоне частот от 1 Гц до 1 МГц. Для обеспечения хорошего электрического контакта между образцом и Pt-электродами измерительной ячейки на плоские поверхности таблеток наносили Pt-электроды. Изменение σ в зависимости от парциального давления кислорода ${\text{(}}{{p}_{{{{{\text{O}}}_{{\text{2}}}}}}})$ в газовой фазе измеряли в изотермических условиях в электрохимической ячейке, изготовленной из твердого кислородпроводящего электролита Zr(Y)O2. Ячейка оснащена двумя парами Pt-электродов, которые обеспечивали варьирование и контроль ${{p}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ [13].
Для измерения чисел переноса ионов методом Тубандта использовали образцы в виде таблеток диаметром 8 мм и толщиной 1.5 мм [14]. Круглые поверхности таблеток были отполированы. Таблетки собирали в ячейки: (+)Pt|Na3ErV2O8(I)|Na3ErV2O8(II)|Na3ErV2O8(III)|Pt(−), где Pt-электроды в виде пластин были плотно прижаты к плоским поверхностям крайних таблеток. Сила пропускаемого через таблетки постоянного тока составляла ~0.5 мА, напряжение варьировали от 1 до 5 В. Таблетки и Pt-электроды взвешивали с точностью 10–5 г до и после эксперимента.
Дифференциальный термический анализ (ДТА) проводили с помощью термоанализатора Setaram Setsys Evolution-1750 на воздухе со скоростью нагрева и охлаждения 5 град/мин. Дилатометр LINSEIS L75V использовали для исследования термического расширения образца на воздухе, скорость нагрева составляла 5 град/мин.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
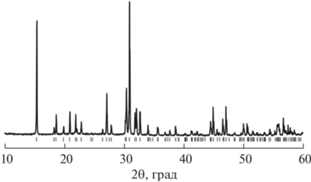
Все рефлексы на рентгенограмме (рис. 1) синтезированного ванадата Na3ErV2O8 при комнатной температуре были проиндексированы в пр. гр. P21/n, их положение и интенсивность хорошо согласуются с данными JCPDS (PDF2, файл 70-257). Параметры элементарной ячейки a = 5.488, b = 9.723, c = 7.213 Å и β = 93.06° находятся в хорошем согласии с данными [2].
Рис. 1.
Рентгенограмма Na3ErV2O8 при комнатной температуре. Положения брэгговских рефлексов отмечены штрихами.
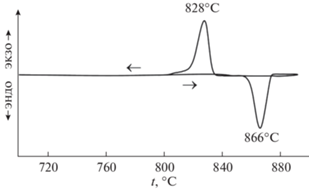
На кривых ДТА (рис. 2) как при нагреве, так и при охлаждении Na3ErV2O8 фиксируется только по одному пику при температурах 866 и 828°С соответственно. Согласно данным [1], происходит превращение α-модификации в β-модификацию Na3ErV2O8. Энтальпия обратимого фазового перехода первого рода составляет 36.9 Дж/г при нагреве и 41.0 Дж/г при охлаждении.
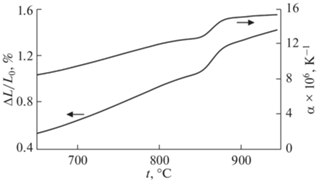
На рис. 3 показано изменение относительного удлинения ΔL/L0 (L0 – длина образца при 20°С, ΔL = LT– L0) при нагревании Na3ErV2O8. Фазовый переход приводит к резкому увеличению как ΔL/L0, так и коэффициента линейного термического расширения (αL = ΔL/(L0ΔT)) Na3ErV2O8. Если до перехода (при 850°С) значение αL составляло 12.5 × 10−6 K−1, то при 870°С оно увеличилось до 15.0 × 10−6 K−1.
Рис. 3.
Температурные зависимости относительного удлинения и коэффициента термического расширения при нагреве Na3ErV2O8 на воздухе.
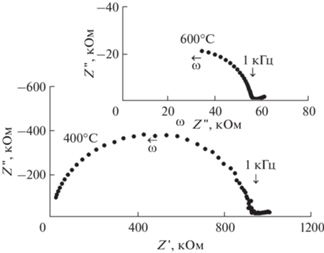
Типичные годографы (кривые Z''–Z', где Z' – действительная часть, Z'' – мнимая часть) комплексного импеданса (Z*) керамических образцов Na3ErV2O8 при различных температурах приведены на рис. 4. Высокочастотные дуги Z''–Z' обусловлены сопротивлением и емкостью объема зерен поликристаллического образца. Наличие низкочастотного хвоста на кривых Z''–Z' указывает на ионную природу проводимости при использовании ионно-блокирующих электродов [15, 16]. Поскольку Pt-электроды, применяемые нами в экспериментах, являются обратимыми для кислород-ионного транспорта в оксидах, низкочастотный хвост на годографах импеданса указывает на преобладание катионной проводимости в Na3ErV2O8. Подобный вид годографов импеданса ранее наблюдался у других катионных проводников [17, 18]. Электросопротивление образца (R) определяли на основе значений Z' в минимуме между высокочастотным полукругом и низкочастотным хвостом. Поскольку в широком диапазоне частот значения Z' не зависят от частоты переменного тока и близки к значениям R, частота 1 кГц была выбрана для детальных измерений полной проводимости как функции Т и ${{p}_{{{{{\text{O}}}_{2}}}}}.$
Температурная зависимость электропроводности Na3ErV2O8 на воздухе в координатах Аррениуса показана на рис. 5. При нагревании фазовый переход из α- в β-фазу около 870°С приводит к скачку σ в ~2 раза. Обратный переход β → α происходит около 830°С, что хорошо согласуется с данными ДТА и дилатометрии. Наблюдаемый гистерезис на зависимости σ(Т) при нагреве и охлаждении образца является характерной особенностью фазовых переходов 1 рода. Поскольку температурная зависимость электропроводности описывается уравнением σT = σ0exp(−EA/kT), где k – константа Больцмана, значения энергии активации Ea рассчитывали из графиков lg(σT) от обратной температуры.
Рис. 5.
Температурные зависимости электропроводности Na3ErV2O8 в координатах Аррениуса при нагреве (1) и охлаждении (2) на воздухе.
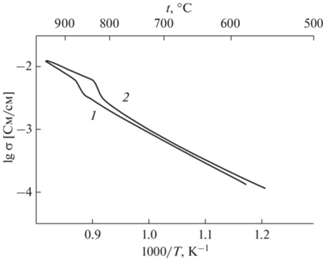
Энергия активации σ в α-Na3ErV2O8 составляет 1.0 эВ. Такое же значение Ea получено при нагревании образца выше фазового перехода α → β. При охлаждении β-фазы величина Ea составляет 0.85 эВ. Несовпадение значений σ и Ea при нагреве и охлаждении β-фазы можно объяснить медленной кинетикой фазового перехода β → α, которая приводит к уменьшению температуры этого перехода на 40° и к гистерезису электропроводности в его окрестностях (рис. 5). Так как величина Ea в α-Na3ErV2O8 больше, чем в Na3BiAs2O8 (0.76 эВ [11]), это приводит при температуре >300°С к более высоким значениям σ в ванадате по сравнению с арсенатом, обладающим такой же моноклинной структурой (пр. гр. P21/n). В интервале температур 450–560°С значения σ в α-Na3ErV2O8 довольно близки к значениям σ в ванадате AgBaScV2O8 с проводимостью по ионам Ag+ и глазеритоподобной структурой [19, 20].
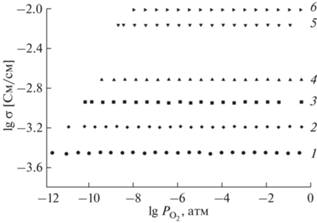
На рис. 6 представлены изотермические зависимости полной электропроводности (σ) Na3ErV2O8 от парциального давления кислорода. В общем случае в ванадатах с катионной проводимостью при постоянной температуре зависимость σ от ${{p}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ определяется уравнением [18, 21]:
(1)
$\sigma = {{\sigma }_{i}} + \sigma _{n}^{o}p_{{{{{\text{O}}}_{2}}}}^{{{{ - 1} \mathord{\left/ {\vphantom {{ - 1} 4}} \right. \kern-0em} 4}}},$Рис. 6.
Зависимости электропроводности Na3ErV2O8 от парциального давления кислорода в газовой фазе при постоянных температурах (°С): 650 (1), 700 (2), 750 (3), 800 (4), 850 (5), 900 (6).
Для определения типа иона, ответственного за перенос, выполнено измерение чисел переноса методом Тубандта при 700°С. После пропускания заряда Q = 14.2 Кл через три таблетки анодная (I) и средняя (II) таблетки, а также платиновый электрод, примыкающий к анодной таблетке, были отделены друг от друга. Масса таблетки (I), примыкающей к аноду, уменьшилась на ∆mI = 4.4 мг. Масса средней (II) таблетки практически не изменилась (∆mII = 0.2 мг). Суммарная масса таблетки (III) и платинового катода увеличилась на ∆mIII = 5.8 мг. Уменьшение массы анодной таблетки и увеличение массы катодной таблетки явно указывают на то, что носителями заряда в Na3ErV2O8 являются катионы. Отношение ∆mI/Q, составляющее 0.31 мг/Кл и почти равное половине электрохимического эквивалента оксида Na2O (Э(Na2O)/2 = 0.33 мг/Кл), означает, что перенос заряда в Na3ErV2O8 осуществляется ионами Na+. Отклонение ∆mI/Q от Э(Na2O)/2 вызвано небольшими потерями массы при разделении таблеток и платинового электрода (анода).
РФА поверхности платинового электрода (катода) после отделения от него таблетки (III) показал образование Na2PtO3 [22] (рис. 7). Поэтому превышение изменения массы таблетки (III) и платинового катода над изменением массы таблетки (I) после пропускания постоянного тока объясняется протеканием электрохимической реакции на катоде:
(2)
${\text{2N}}{{{\text{a}}}^{{\text{ + }}}}{\text{ + 2}}{{{\text{e}}}^{ - }}{\text{ + Pt + 3/2}}{{{\text{O}}}_{{\text{2}}}}{\text{(газ) = N}}{{{\text{a}}}_{{\text{2}}}}{\text{Pt}}{{{\text{O}}}_{{\text{3}}}}{\text{.}}$Рис. 7.
Рентгенограмма поверхности платинового электрода (катода) после окончания эксперимента по методу Тубандта.
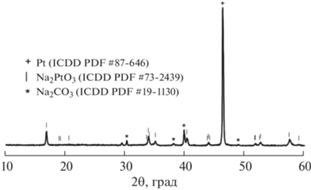
Избыточная суммарная масса таблетки (III) и платинового катода, обусловленная окислением платины кислородом воздуха с образованием платината Na2PtO3, подтверждает перенос ионов Na+ через три таблетки Na3ErV2O8.
ЗАКЛЮЧЕНИЕ
Ванадат Na3ErV2O8 с глазеритоподобной структурой получен на воздухе методом твердофазного синтеза. В результате исследований электропроводности в зависимости от температуры и парциального давления кислорода в газовой фазе, а также чисел переноса методом Тубандта установлен униполярный перенос заряда в Na3ErV2O8 катионами Na+. Фазовый переход из низкотемпературной α-модификации (пр. гр. P21/n) в высокотемпературную β-модификацию (пр. гр. $P\bar {3}m$) при 866°С приводит к резкому расширению кристаллической структуры и росту электропроводности в два раза. Неизменность значений σ в широком диапазоне ${{p}_{{{{{\text{O}}}_{2}}}}}$ свидетельствует о высокой стабильности Na3ErV2O8 в восстановительной атмосфере.
Список литературы
Vlasse M., Parent C., Salmon R. et al. // J. Solid State Chem. 1980. V. 35. № 3. P. 318. https://doi.org/10.1016/0022-4596(80)90528-9
Salmon R., Parent C., Le Flem G., Vlasse M. // Acta Crystallogr., Sect. B: Struct. Sci. Cryst. 1976. V. 32. P. 2799. https://doi.org/10.1107/S0567740876008911
Lazoryak B.I. // Russ. Chem. Rev. 1996. V. 65. № 4. P. 307. [Лазоряк Б.И. // Успехи химии. 1996. Т. 65. № 4. С. 287.]
Morozov V.A., Lazoryak B.I., Malakho A.P. et al. // J. Solid State Chem. 2001. V. 160. P. 377. https://doi.org/10.1006/jssc.2001.9250
Zhang Q., Hu Y., Ju G. et al. // J. Mater. Sci. Mater-El. 2017. V. 28. № 3. P. 2529. https://doi.org/10.1007/s10854-016-5827-0
Qin L., Wei D.-L., Huang Y. et al. // Mater. Chem. Phys. 2014. V. 147. № 3. P. 1195. https://doi.org/10.1016/j.matchemphys.2014.07.006
Tao Z., Tsuboi T., Huang Y. // Inorg. Chem. 2014. V. 53. № 8. P. 4161. https://doi.org/10.1021/ic500208h
Sobczyk M. // Opt. Mater. 2013. V. 35. № 5. P. 852. https://doi.org/10.1021/ic500208h
Kimani M.M., Thompson L., Snider W. et al. // Inorg. Chem. 2012. V. 51. № 24. P. 13271. https://doi.org/10.1021/ic301922e
Diouri M., Sadel A., Zahil M. et al. // J. Alloys. Compd. 1992. V. 188. P. 206. https://doi.org/10.1016/0925-8388(92)90677-2
Drache M., Obbade O., Conflant P. et al. // Ann. Chim. Sci. Mat. 1998. V. 23. P. 89. https://doi.org/10.1016/S0151-9107(98)80030-5
Bdey S., Bourguiba N.F., Savvin S.N. et al. // J. Solid State Chem. 2019. V. 272. P. 189. https://doi.org/10.1016/j.jssc.2019.01.034
Patrakeev M.V., Mitberg E.B., Leonidov I.A., Kozhevnikov V.L. // Solid State Ion. 2001. V. 139. P. 325. https://doi.org/10.1016/S0167-2738(01)00681-6
Morozov V.A., Deyneko D.V., Dzhevakov P.B. et al. // Solid State Ion. 2021. V. 359. P. 115518. https://doi.org/10.1016/j.ssi.2020.115518
Irvine J.T.S., Sinclair D.C., West A.R. // Adv. Mater. 1990. V. 2. P. 132. https://doi.org/10.1002/adma.19900020304
Song S., Yan B., Zheng F. et al. // Solid State Ion. 2014. V. 268. P. 135. https://doi.org/10.1016/j.ssi.2014.10.009
Reddy M.V., Adams S. // J. Solid State Electrochem. 2017. V. 21. P. 2921. https://doi.org/10.1007/s10008-017-3615-2
Leonidova O.N., Patrakeev M.V., Leonidov I.A. // J. Solid State Electrochem. 2019. V. 23. P. 1083. https://doi.org/10.1007/s10008-019-04202-y
Sorokin N.I. // Crystallogr. Rep. 2019. V. 64. № 1. P. 110. https://doi.org/10.1134/S1063774519010267
Solov’ev O.I., Rusakov D.A., Filaretov A.A., Komissarova L.N. // Russ. Chem. Bull. 2012. V. 61. № 10. P. 1877. [Соловьев О.И., Русаков Д.А., Филаретов А.А., Комиссарова Л.Н. // Изв. АН. Сер. хим. 2012. Т. 61. № 10. С. 1862.] https://doi.org/10665285/12/61101877
Leonidov I.A., Leonidova O.N., Slepukhin V.K. // Inorg. Mater. 2000. V. 36. P. 72. [Леонидов И.А., Леонидова О.Н., Слепухин В.К. // Неорган. материалы. 2000. Т. 36. № 1. С. 83.] https://doi.org/10.1007/BF02758384
Kasuya R., Miki T., Morikawa H., Tai Y. // Int. J. Min. Process. 2014. V. 128. P. 33. https://doi.org/10.1016/j.minpro.2014.02.005
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии