Журнал неорганической химии, 2022, T. 67, № 6, стр. 686-692
Кристаллическая структура и кислородная нестехиометрия твердых растворов Ba0.9Ln0.1Fe1 – yCoyO3 – δ (Ln = Nd, Sm, Eu)
И. Б. Головачев a, А. А. Трушников a, Н. Е. Волкова a, *, Т. В. Аксенова a, В. А. Черепанов a
a Институт естественных наук и математики, Уральский федеральный университет
имени первого Президента России Б.Н. Ельцина
620002 Екатеринбург, ул. Мира, 19, Россия
* E-mail: nadezhda.volkova@urfu.ru
Поступила в редакцию 21.10.2021
После доработки 10.12.2021
Принята к публикации 13.12.2021
- EDN: VHAZKV
- DOI: 10.31857/S0044457X22060095
Аннотация
Образцы с общей формулой Ba0.9Ln0.1Fe1 –yCoyO3 – δ (Ln = Nd, Sm, Eu, y = 0.1–0.9) исследованы при 1100°С на воздухе. По результатам РФА образцов, полученных по глицерин-нитратной технологии, установлены области существования твердых растворов Ba0.9Ln0.1Fe1 –yCoyO3 – δ: 0.1 ≤ y ≤ 0.7 для Ln = Nd; 0.1 ≤ y ≤ 0.5 для Ln = Sm и 0.1 ≤ y ≤ 0.4 для Ln = Eu. Кристаллическая структура однофазных оксидов описана в кубической элементарной ячейке (пр. гр. $Pm\bar {3}m$). Показано, что при увеличении содержания кобальта и радиуса РЗЭ наблюдается увеличение параметра элементарной ячейки Ba0.9Ln0.1Fe1 –yCoyO3 – δ. Содержание кислорода (3 – δ) на воздухе в диапазоне температур 25–1100°C определено методами термогравиметрического анализа и йодометрического титрования. Обмен кислородом между твердым оксидом и газовой фазой начинается при температуре ~350°С. Содержание кислорода и средняя степень окисления 3d-металлов в Ba0.9Ln0.1Fe1 –yCoyO3 – δ уменьшаются с ростом концентрации кобальта и порядкового номера лантанида.
ВВЕДЕНИЕ
Широкая область применения твердых растворов на основе феррита бария BaFeO3 – δ, частично замещенного по А- и В-подрешеткам, основана на их высокой смешанной электронно-ионной проводимости [1–3] и связана с конструированием на их основе кислородпроводящих мембран [4] и твердооксидных топливных элементов [5–10].
Кристаллическая структура незамещенного феррита бария BaFeO3 – δ зависит от содержания кислорода (3 – δ), которое определяется условиями синтеза и термообработки [11–16]. Известно, что функциональные свойства в большой степени определяются кристаллической структурой оксидов, а двойное допирование является перспективной стратегией для стабилизации кислородной подрешетки и, следовательно, структуры феррита бария [17–21].
Как правило, введение редкоземельных элементов (РЗЭ) в А-позицию приводит к стабилизации кубической структуры перовскита, а частичное замещение железа на кобальт положительно сказывается на электротранспортных свойствах оксидных материалов.
Замещение бария на лантаноиды больших радиусов (La, Pr, Nd) приводит к образованию широкого ряда твердых растворов с кубической структурой и статистическим распределением ионов бария и РЗЭ в А-подрешетке [21–24]. Использование в качестве заместителя лантанидов средних радиусов (Sm, Gd) при соотношении Ln : Ba ~ 2 : 3 позволяет получить упорядоченные трех- или пятислойные структуры [24–26], при этом частичное замещение железа на кобальт приводит к стабилизации упорядоченных структур. Легирование феррита бария BaFeO3–δ лантанидами маленьких радиусов (Y) вследствие меньшей разницы в ионных радиуса железа и иттрия по сравнению с таковыми для иттрия и бария приводит к формированию твердых растворов, замещенных по В-подрешетке BaFe1 –zYzO3 – δ [27, 28].
В некоторых случаях катионное упорядочение и связанное с ним упорядочение вакансий в кислородной подрешетке не являются положительным фактором с точки зрения транспортных характеристик. В рамках настоящей работы рассмотрена возможность получения разупорядоченных фаз за счет уменьшения содержания РЗЭ по сравнению с известными слоистыми перовскитами Ba0.9Ln0.1Fe1 –yCoyO3 – δ (Ln = Nd, Sm, Eu), изучена их структура и кислородная нестехиометрия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез образцов для исследования осуществляли по глицерин-нитратной технологии. В качестве исходных реактивов использовали оксиды неодима Nd2O3, самария Sm2O3, европия Eu2O3 (все 99.99%) и карбонат бария BaCO3 (ос. ч.), предварительно прокаленные для удаления адсорбированной влаги и газов, а также оксалат железа FeC2O4 · 2H2O (ч. д. а.) и металлический кобальт. Металлический кобальт получали восстановлением оксида Co3O4 (ос. ч.) в токе водорода при 400–600°С.
Навески исходных компонентов растворяли в 4 М азотной кислоте HNO3 (ос. ч.) при нагревании и добавляли глицерин C3H8O3 (ч. д. а.). Полученный раствор выпаривали в фарфоровой чашке. После обезвоживания и высыхания вязкого геля полученный состав подвергали пиролизу. Сухой остаток медленно (50 град/ч) нагревали до температуры 1100°C.
Заключительный отжиг образцов проводили при 1100°C на воздухе в течение 120 ч (с промежуточным перетиранием в среде этилового спирта), затем образцы медленно охлаждали до комнатной температуры со скоростью 100 град/ч.
Фазовый состав образцов определяли рентгенографически с использованием дифрактометров Shimadzu XDR-7000 (CuKα-излучение, интервал углов 2θ = 20°–80°, скорость 0.04 град/мин, экспозиция 5 с) и Inel Equinox 3000 (CuKα-излучение, 2θ = 20°–80°, шаг 0.024°, экспозиция 4 с) при комнатной температуре на воздухе. Идентификацию фаз осуществляли с использованием базы данных ICDD. Уточнение структуры и параметров ячейки выполняли методом Ритвельда с помощью программы Fullprof 2008.
Термогравиметрические исследования проводили на термоанализаторе STA 409 PC (Netzsch Gmbh) в интервале температур 25–1100°C на воздухе (скорость нагрева/охлаждения 1 град/мин). Абсолютные значения содержания кислорода определяли методом восстановления образцов в токе водорода до оксидов Ln2O3, BaO и металлических железа Fe и кобальта Co непосредственно на установке ТГА (H2 : N2 = 90 : 10%). Водород получали электролизом воды в стандартном генераторе водорода “Спектр-12”. Дополнительно содержание кислорода в Ba0.9Eu0.1Fe1 –yCoyO3 – δ было определено методом йодометрического титрования. Методика йодометрического титрования подробно описана в работе [24].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для определения возможности образования твердых растворов состава Ba0.9Ln0.1Fe1 –yCoyO3 – δ (Ln = Nd, Sm, Eu) по глицерин-нитратной технологии были синтезированы образцы с различным содержанием кобальта (y = 0.1–0.9). На основании данных рентгенофазового анализа установлено, что области существования твердых растворов Ba0.9Ln0.1Fe1 –yCoyO3 – δ находятся в интервалах составов 0.1 ≤ y ≤ 0.7 (Ln = Nd), 0.1 ≤ y ≤ 0.5 (Ln = Sm) и 0.1 ≤ y ≤ 0.4 (Ln = Eu).
Определенная ранее область существования родственных твердых растворов аналогичного состава Ba0.9Pr0.1Fe1 –yCoyO3 – δ, равная 0 ≤ y ≤ 0.8, хорошо вписывается в наблюдаемую зависимость – сужение области гомогенности при уменьшении радиуса РЗЭ. Подобная тенденция, вероятно, определяется как размерным фактором, так и изменением содержания кислорода и связанной с этим средней степенью окисления 3d-металлов.
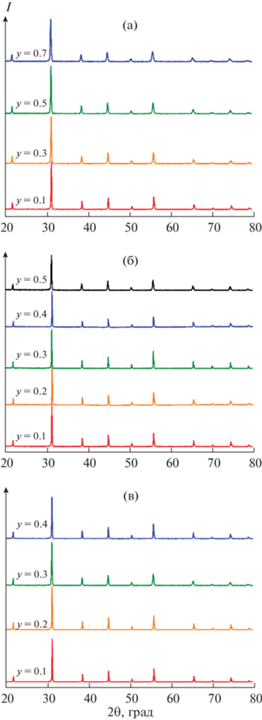
На рис. 1а–1в представлены рентгеновские профили однофазных образцов Ba0.9Ln0.1Fe1 –yCoyO3 – δ (Ln = Nd, Sm, Eu).
Рис. 1.
Рентгенограммы твердых растворов: а – Ba0.9Nd0.1Fe1 –yCoyO3 – δ (0.1 ≤ y ≤ 0.7); б – Ba0.9Sm0.1Fe1 –yCoyO3 – δ (0.1 ≤ y ≤ 0.5); в – Ba0.9Eu0.1Fe1 –yCoyO3 – δ (0.1 ≤ y ≤ 0.4).
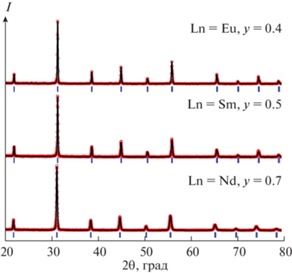
Рентгенограммы всех однофазных образцов описаны в рамках кубической элементарной ячейки (пр. гр. $Pm\bar {3}m$). На рис. 2 в качестве примера представлены рентгенограммы твердых растворов Ba0.9Ln0.1Fe1 –yCoyO3 – δ граничного состава, обработанные по методу полнопрофильного анализа Ритвельда.
Рис. 2.
Рентгенограммы Ba0.9Ln0.1Fe1 –yCoyO3 – δ (Ln = Nd, y = 0.7; Ln = Sm, y = 0.5; Ln = Eu, y = 0.4), обработанные по методу Ритвельда: красные точки – экспериментальные данные; сплошная черная линия – теоретический спектр.
Уточненные по методу Ритвельда параметры элементарных ячеек всех однофазных образцов представлены на рис. 3. Видно, что введение кобальта в Ba0.9Ln0.1Fe1 –yCoyO3 – δ приводит к практически линейному увеличению параметра элементарной ячейки твердого раствора. Такой результат может показаться странным, если не принимать во внимание изменение содержания кислорода при увеличении содержания кобальта. Как будет показано ниже, замещение железа на кобальт в Ba0.9Ln0.1Fe1 –yCoyO3 – δ сопровождается уменьшением содержания кислорода и, следовательно, средней степени окисления ионов 3d-металлов, что приводит к незначительному расширению кристаллической решетки (${{{{r}_{{{\text{F}}{{{\text{e}}}^{{{\text{3 + }}}}}}}}} \mathord{\left/ {\vphantom {{{{r}_{{{\text{F}}{{{\text{e}}}^{{{\text{3 + }}}}}}}}} {{{r}_{{{\text{F}}{{{\text{e}}}^{{{\text{4 + }}}}}}}}}}} \right. \kern-0em} {{{r}_{{{\text{F}}{{{\text{e}}}^{{{\text{4 + }}}}}}}}}}$ = = 0.785/0.725 Å и ${{r}_{{{\text{C}}{{{\text{o}}}^{{{\text{3 + }}}}}}}}$ = 0.75 Å [29]). Нарушение линейности концентрационных зависимостей параметров элементарной ячейки твердых растворов Ba0.9Ln0.1Fe1 –yCoyO3 – δ свидетельствует о достижении предельной растворимости ионов кобальта в подрешетке железа.
Рис. 3.
Концентрационные зависимости параметра элементарной ячейки твердых растворов Ba0.9Ln0.1Fe1 –yCoyO3 – δ (Ln = Nd, Sm, Eu).
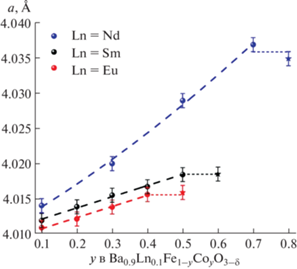
Уменьшение параметра ap элементарной ячейки твердых растворов Ba0.9Ln0.1Fe1 –yCoyO3 – δ при одинаковых концентрациях металлов в В-подрешетке в ряду заместителей Nd–Sm–Eu связано с размерным фактором: больший радиус РЗЭ соответствует большему значению ap [29].
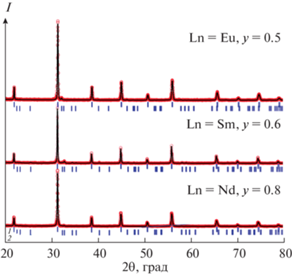
Фазовый состав образцов, находящихся за пределами области гомогенности, приведен в табл. 1. На рис. 4 в качестве примера представлены рентгенограммы двухфазных образцов Ba0.9Ln0.1Fe1 –yCoyO3 – δ (Ln = Nd, y = 0.8; Ln = Sm, y = 0.6; Ln = Eu, y = 0.5), обработанные по методу полнопрофильного анализа Ритвельда.
Таблица 1.
Номинальный и фазовый состав образцов Ba0.9Ln0.1Fe1 –yCoyO3 – δ (0.5 ≤ y ≤ 0.9), находящихся за пределами области гомогенности
| Номинальный состав образца | Фазовый состав образца |
|---|---|
| Ba0.9Nd0.1Fe0.1Co0.9O3–δ | Ba0.9Nd0.1Fe0.3Co0.7O3–δ + LnBa(Co, Fe)2O6–δ |
| Ba0.9Nd0.1Fe0.2Co0.8O3–δ | |
| Ba0.9Sm0.1Fe0.1Co0.9O3–δ | Ba0.9Sm0.1Fe0.5Co0.5O3–δ + SmBa(Co, Fe)2O6–δ + Ba(Co, Fe)O3–δ |
| Ba0.9Sm0.1Fe0.3Co0.7O3–δ | Ba0.9Sm0.1Fe0.5Co0.5O3–δ + SmBa(Co, Fe)2O6–δ |
| Ba0.9Sm0.1Fe0.4Co0.6O3–δ | |
| Ba0.9Eu0.1Fe0.1Co0.9O3–δ | Ba0.9Eu0.1Fe0.5Co0.5O3–δ + EuBa(Co, Fe)2O6–δ + Ba(Co, Fe)O3–δ |
| Ba0.9Eu0.1Fe0.3Co0.7O3–δ | Ba0.9Eu0.1Fe0.6Co0.4O3–δ + EuBa(Co, Fe)2O6–δ |
| Ba0.9Eu0.1Fe0.5Co0.5O3–δ |
Рис. 4.
Рентгенограммы Ba0.9Ln0.1Fe1 –yCoyO3 – δ (Ln = Nd, y = 0.8; Ln = Sm, y = 0.6; Ln = Eu, y = 0.5), обработанные по методу Ритвельда: 1 – рефлексы, относящиеся к граничным твердым растворам Ba0.9Ln0.1Fe1 –yCoyO3 – δ, 2 – рефлексы, относящиеся к фазе двойного перовскита LnBa(Co,Fe)2O6 – δ.
Абсолютное значение содержания кислорода в Ba0.9Sm0.1Fe1 –yCoyO3 – δ (y = 0.1, 0.3 и 0.5) и Ba0.9Ln0.1Fe1 –yCoyO3 – δ (Ln = Nd, Eu; y = 0.3) определяли методом полного восстановления образцов в токе водорода. Дополнительно для образцов Ba0.9Eu0.1Fe1 –yCoyO3 – δ (y = 0.1 и 0.3) содержание кислорода было рассчитано из данных йодометрического титрования. Видно, что данные, полученные разными методами, хорошо согласуются между собой.
Содержание кислорода в Ba0.9Ln0.1Fe1 –yCoyO3 – δ, а также средняя степень окисления кобальта и железа, приведенная к комнатной температуре, представлены в табл. 2. Значение средней степени окисления ионов железа было получено из допущения, что весь кобальт как более электроотрицательный элемент находится в степени окисления +3.
Таблица 2.
Содержание кислорода (3 – δ) и средняя степень окисления 3d-металлов (zM) и ионов железа (zFe) в оксидах состава Ba1 –xLnxFe1 –yCoyO3 – δ при 25 и 1100°C на воздухе
| Ln | y | 25°C | 1100°C | |||
|---|---|---|---|---|---|---|
| 3 – δ | zM | zFe | 3 – δ | zM | ||
| Nd | 0.3 | 2.73(1) | 3.36 | 3.51 | 2.58(1) | 3.06 |
| Sm | 0.1 | 2.76(1) | 3.42 | 3.47 | 2.61(1) | 3.12 |
| 0.3 | 2.71(1) | 3.32 | 3.46 | 2.57(1) | 3.04 | |
| 0.5 | 2.68(1) | 3.26 | 3.52 | 2.55(1) | 3.00 | |
| Eu | 0.1 | 2.73*(4) | 3.37 | 3.41 | 2.59(1) | 3.08 |
| 0.3 | 2.69*(4) 2.69(1) |
3.28 | 3.41 | 2.56(1) | 3.02 | |
Видно, что увеличение содержания кобальта в Ba0.9Ln0.1Fe1 –yCoyO3 – δ приводит к закономерному уменьшению содержания кислорода (3 – δ) и средней степени окисления 3d-металлов. Это связано с большей электроотрицательностью кобальта по сравнению с железом (ЭОFe = 1.72; ЭОCo = 1.82 по шкале Полинга [30]) и, следовательно, с образованием оксидов с меньшими степенями окисления при прочих равных условиях. При этом средняя степень окисления железа остается практически неизменной во всем интервале существования твердых растворов и близка к +3.5. Таким образом, отношение Fe4+/Fe3+ остается близким к единице.
Природа лантанидов также оказывает влияние на содержание кислорода в твердых растворах: с уменьшением радиуса лантанида значение (3 – δ) уменьшается. Данную тенденцию можно объяснить уменьшением прочности связи в ряду Nd–O (703 кДж/моль), Sm–O (619 кДж/моль), Eu–O (557 кДж/моль) [31].
Подобное поведение отмечено для родственных перовскитоподобных соединений Ba1 –xLnxFe1 –yCoyO3–δ в работах [21, 25, 32–36].
Температурные зависимости содержания кислорода и средней степени окисления ионов 3d-металлов в Ba0.9Ln0.1Fe1 –yCoyO3 – δ были получены методом высокотемпературной термогравиметрии в широком диапазоне температур на воздухе (рис. 5, 6).
Рис. 5.
Температурные зависимости содержания кислорода и средней степени окисления кобальта и железа в образцах Ba0.9Sm0.1Fe1 –yCoyO3 – δ (0.1 ≤ y ≤ ≤ 0.5).
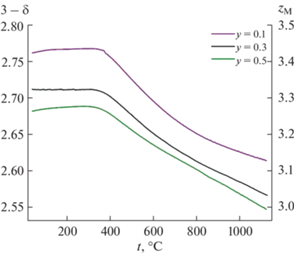
Рис. 6.
Температурные зависимости содержания кислорода и средней степени окисления кобальта и железа в образцах Ba0.9Ln0.1Fe0.7Co0.3O3 – δ (Ln = Nd, Sm, Eu).
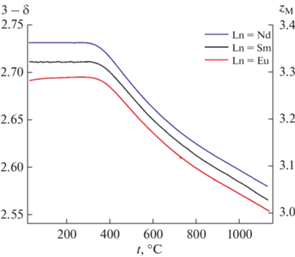
Обмен кислородом между образцами и газовой фазой начинается при температуре около 300–350°С. Увеличение температуры приводит к росту кислородной нестехиометрии. При этом наблюдается монотонное уменьшение содержания кислорода вплоть до значений, соответствующих средней степени окисления 3d-переходных металлов, равной +3 (у = 0.5 для Ln = Sm). В случае родственных ферритов не допированных кобальтом, приближение к этой точке (Fe3+), как правило, сопровождается появлением перегибов на зависимости содержания кислорода от внешних термодинамических параметров (Т, ро2) [37, 38], которые отсутствуют у разупорядоченных кобальтитов [39, 40]. Возможность появления такого перегиба просматривается в Ba0.9Sm0.1Fe0.9Co0.1O3 – δ, в оксиде с у = 0.3 он сомнителен, а при у = 0.5 он не возникает. Таким образом, увеличение содержания кобальта приводит к более равномерному уменьшению содержания кислорода с температурой.
ЗАКЛЮЧЕНИЕ
Установлено, что увеличение порядкового номера (уменьшение радиуса) РЗЭ приводит к сужению области гомогенности твердых растворов Ba0.9Ln0.1Fe1 –yCoyO3 – δ. Это коррелирует с уменьшением термической стабильности кобальтитов при увеличении порядкового номера РЗЭ [41, 42]. Все однофазные образцы кристаллизуются в структуре идеального кубического перовскита. Увеличение радиуса лантанида и концентрации ионов кобальта в Ba0.9Ln0.1Fe1 –yCoyO3 – δ приводит к монотонному увеличению параметра элементарной ячейки. Содержание кислорода в Ba0.9Ln0.1Fe1 –yCoyO3 – δ уменьшается при увеличении концентрации ионов кобальта как более электроотрицательного по сравнению с железом элемента и уменьшении радиуса РЗЭ вследствие уменьшения энергии связи Ln–O в этом ряду. Полагая, что все ионы кобальта при комнатной температуре находятся в степени окисления +3, соотношение Fe4+/Fe3+ остается близким к единице независимо от состава оксида.
Список литературы
Penwell W.D., Giorgi J.B. // Sens. Actuators, B: Chem. 2014. V. 191. P. 171. https://doi.org/10.1016/j.snb.2013.09.095
Rembelski D., Viricelle J.P., Combemale L. et al. // Fuel Cells. 2012. V. 12. № 2. P. 256. https://doi.org/10.1002/fuce.201100064
Dong F., Chen D., Chen Y. et al. // J. Mater. Chem. 2012. V. 22. P. 15071. https://doi.org/10.1039/C2JM31711G
Kharton V.V., Yaremchenko A.A., Kovalevsky A.V. et al. // J. Membr. Sci. 1999. V. 163. P. 307. https://doi.org/10.1016/S0376- 7388(99)00172-6
Tsipis E.V., Kharton V.V. // J. Solid State Electrochem. 2008. V. 12. P. 1367. https://doi.org/10.1007/s10008-008-0611-6
Wei Z., Wang J., Yu X. et al. // Int. J. Hydrogen Energy. 2021. V. 46. № 46. P. 23868. https://doi.org/10.1016/j.ijhydene.2021.04.188
Lin Y., Ran R., Zheng Y. et al. // J. Power Sources. 2008. V. 180. P. 15. https://doi.org/10.1016/j.jpowsour.2008.02.044
Ding X., Gao X., Zhu W. et al. // Int. J. Hydrogen Energy. 2014. V. 39. № 23. P. 12092. https://doi.org/10.1016/j.ijhydene.2014.06.009
Kim Y.-D., Yang J.-Y., Saqib M. et al. // Ceram. Int. 2021. V. 47. № 6. P. 7985. https://doi.org/10.1016/j.ceramint.2020.11.149
Chen D., Chen C., Dong F. et al. // J. Power Sources. 2014. V. 250. P. 188. https://doi.org/10.1016/j.jpowsour.2013.11.010
Delattre J.L., Stacy A.M., Siegrist T. // J. Solid State Chem. 2004. V. 177. P. 928. https://doi.org/10.1016/j.jssc.2003.09.032
Mori K., Kamiyama T., Kobayashi H. et al. // Phys. B: Condens. Matter. 2003. V. 329–333. P. 807. https://doi.org/10.1016/S0921-4526(02)02571-1
Zhu X., Wang H., Yang W. // Solid State Ion. 2006. V. 177. P. 2917. https://doi.org/10.1016/j.ssi.2006.08.027
Gonzalez-Calbet J.M., Parras M., Vallet-Regi M. et al. // J. Solid State Chem. 1990. V. 86. P. 149. https://doi.org/10.1016/0022-4596(90)90129-L
Parras M., González-Calbet J.M., Vallet-Regi M. et al. // Solid State Ion. 1993. V. 63–65. P. 714. https://doi.org/10.1016/0167-2738(93)90185-6
Yáng Z., Harvey A.S., Infortuna A. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 153. https://doi.org/10.1107/S0021889809002040
Yang K., Wang Y., Yang Z. et al. // Int. J. Hydrogen Energy. 2020 V. 45. P. 34080. https://doi.org/10.1016/j.ijhydene.2020.09.086
Okiba T., Sato T., Fujishiro F. et al. // Solid State Ion. 2018. V. 320. P. 76. https://doi.org/10.1016/j.ssi.2018.02.036
Wang J., Saccoccio M., Chen D. et al. // J. Power Sources. 2015. V. 297. P. 511. https://doi.org/10.1016/j.jpowsour.2015.08.016
Wang J., Lam K.Y., Saccoccio M. et al. // J. Power Sources. 2016. V. 324. P. 224. https://doi.org/10.1016/j.jpowsour.2016.05.089
Volkova N.E., Bazueva M.V., Aisarinova D.T. et al. // J. Alloys Compd. 2020. V. 860. Art. 158438. https://doi.org/10.1016/j.jallcom.2020.158438
Okiba T., Sato T., Fujishiro F. et al. // Solid State Ion. 2018. V. 320. P. 76. https://doi.org/10.1016/j.ssi.2018.02.036
Parras M., Vallet-Regi M., Gonzáles-Calbet J.M. et al. // J. Solid State Chem. 1988. V. 74. P. 110. https://doi.org/10.1016/ 0022-4596(88)90336-2
Volkova N.E., Urusova A.S., Gavrilova L.Ya. et al. // Russ. J. Gen. Chem. 2016. V. 86. № 8. P. 1800. https://doi.org/10.1134/S1070363216080041 [Волкова Н.Е., Урусова А.С., Гаврилова Л.Я. и др. // Журн. общ. химии. 2016. Т. 86. № 8. С. 1258.]
Volkova N.E., Mychinko M.Yu., Golovachev I.B. et al. // J. Alloys Compd. 2019. V. 784. P. 1297. https://doi.org/10.1016/j.jallcom.2018.12.391
Volkova N.E., Lebedev O.I., Gavrilova L.Ya. et al. // Chem. Mater. 2014. V. 26. P. 6303. https://doi.org/10.1021/cm503276p
Karen P., Andresen P.H., Kjekshus A. // J. Solid State Chem. 1992. V. 101. № 1. P. 48. https://doi.org/10.1016/0022-4596(92)90199-6
Liu X., Zhao H., Yang J. et al. // J. Membr. Sci. 2011. V. 383. № 1–2. P. 235. https://doi.org/10.1016/j.memsci.2011.08.059
Shannon R.D. // Acta Crystallogr. 1976. V. A32. P. 751. https://doi.org/10.1107/S0567739476001551
Huheey J.E., Keiter E.A., Keiter R.L. Inorganic Chemistry: Principles of structure and reactivity. N.Y.: Prentice Hall, 1997.
Cottrell T.L. The Strengths of Chemical Bonds. London: Butterworth, 1958.
Li X., Jiang X., Pang S. et al. // Int. J. Hydrogen Energy. 2011. V. 36. P. 13850. https://doi.org/10.1016/j.ijhydene.2011.07.083
Golovachev I.B., Mychinko M.Yu., Volkova N.E. et al. // J. Solid State Chem. 2021. V. 301. Art. 122324. https://doi.org/10.1016/j.jssc.2021.122324
Kundu A.K., Mychinko M.Yu., Caignaert V. et al. // J. Solid State Chem. 2015. V. 231. P. 36. https://doi.org/10.1016/j.jssc.2015.07.050
Maignan A., Martin C., Pelloquin D. et al. // J. Solid State Chem. 1999. V. 142. № 2. P. 247. https://doi.org/10.1006/jssc.1998.7934
Aksenova T.V., Gavrilova L.Ya., Tsvetkov D.S. et al. // Russ. J. Phys. Chem. (A). 2011. V. 85. № 3. P. 427. https://doi.org/10.1134/S0036024411030022 [Аксенова Т.В., Гаврилова Л.Я., Цветков Д.С. и др. // Журн. физ. химии. 2011. Т. 85. № 3. С. 493.]
Yoo J., Park C.Y., Jacobson A.J. // Solid State Ionics. 2004. V. 175. P. 55. https://doi.org/10.1016/j.ssi.2004.09.026
Mizuzaki J., Yoshihiro M., Yamauchi Sh., Fueki K. // J. Solid State Chem. 1985. V. 58. P. 257. https://doi.org/10.1016/0022-4596(85)90243-9
Petrov A.N., Cherepanov V.A., Kononchuk O.F., Gavrilova L.Ya. // J. Solid State Chem. 1990. V. 87. № 7. P. 69. https://doi.org/10.1016/0022-4596(90)90066-7
Gavrilova L.Ya., Cherepanov V.A. // Solid Oxide Fuel Cells VI / Eds. Singhal S.C., Dokiya M. N.J., 1999. P. 404.
Кропанёв А.Ю., Петров А.Н. // Изв. АН СССР. Неорган. материалы. 1983. Т. 19. С. 2027.
Кропанёв А.Ю., Петров А.Н., Жуковский В.М. // Журн. неорган. химии. 1983. Т. 11. С. 2938.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


