Журнал неорганической химии, 2022, T. 67, № 5, стр. 569-574
Интеркаляция лития в Ni3GaTe2 с помощью LiH
Г. А. Бузанов a, *, Е. А. Строганова a, b, А. Ю. Быков a, К. Ю. Жижин a, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
111071 Москва, Ленинский пр-т, 31, Россия
b Московский государственный университет им. М.В. Ломоносова, Химический факультет
119991 Москва, Ленинские горы, 1, Россия
* E-mail: gbuzanov@yandex.ru
Поступила в редакцию 17.11.2021
После доработки 29.12.2021
Принята к публикации 30.12.2021
- EDN: INXFFK
- DOI: 10.31857/S0044457X22050038
Аннотация
С целью расширения методов интеркаляции лития в слоистые многокомпонентные матрицы изучено взаимодействие гидрида лития со слоистым теллуридом Ni3GaTe2 через стадию образования механокомпозитов. Показано образование интеркаляционных соединений LixNi3GaTe2 (0 ≤ x ≤ 0.3) при отжиге механокомпозитов матрицы и интеркалирующего агента (LiH) в аргоне. Изучены каналы конверсии гидрид-иона и описаны превращения с участием матрицы при различных мольных соотношениях матрицы и интеркалирующего агента и температурах.
ВВЕДЕНИЕ
Низкоразмерные системы связей металл–металл являются интересными объектами для изучения в неорганической химии и химии твердого тела, так как их присутствие в кристаллических соединениях часто обусловливает нетривиальное строение и физико-химические свойства последних. Один из таких типов соединений представлен семейством смешанных теллуридов никеля-p-металла, имеющих слоистую структуру и состав Ni3MTe2, где M = Ga, In, Ge, Sn, Sb, 0 ≤ x ≤ 1 [1–8]. Все эти соединения кристаллизуются в гексагональной сингонии с пр. гр. P63/mmc и Z = 2, кроме Ni2.58SnTe2, описанного в пр. гр. P$\bar {3}$1c. Структура слоистых соединений является производной от комбинации структурного типа NiAs и структурного типа Ni2In. Она основана на двумерно-бесконечных гетерометаллических фрагментах, ограниченных атомами теллура вдоль оси с, которые, в свою очередь, посредством слабых взаимодействий Te–Te образуют ван-дер-ваальсову щель. Наиболее изученной является система Ni–Ga–Te, в которой синтезирован ряд образцов состава Ni2.98GaTe2, Ni2.75GaTe2, Ni2.5GaTe2 и Ni2.3GaTe2 [1, 2]. Структура Ni2.98GaTe2 основана на чередующихся гетерометаллических фрагментах $_{\infty }^{2}$[Ni2.6Ga], ограниченных терминальными атомами теллура, расположенных вдоль оси с. В данном случае гетерометаллические фрагменты относятся к дефектной структуре Ni2In. Длины гомо- и гетерометаллических связей Ni–Ni и Ni–M близки по значению во всех соединениях Ni3 –хGaTe2. Расстояния Ni(1)–Ga и Ni(1)–Te в тройных соединениях схожи с аналогичными расстояниями в структуре интерметаллида Ni1.8Ga, который относится к структурному типу Ni2In (Ni(1)–Ga = 2.625 Å) [2].
В отличие от интерметаллических соединений ближайшее октаэдрическое окружение Ni(1) образовано тремя атомами галлия и тремя атомами теллура. Это объясняется тем, что позиция мышьяка в исходной структуре NiAs в нашем случае заселяется галлием и теллуром упорядоченно, что приводит к ее разделению на две независимые позиции и утроению исходной элементарной ячейки по оси с. Три атома галлия, занимающие экваториальные вершины тригональной бипирамиды, и два атома теллура, занимающие аксиальные вершины тригональной бипирамиды, образуют координационный полиэдр для атома Ni(2). Относительно короткое расстояние Ni(2)–Ga аналогично расстоянию в интерметаллиде Ni2Ga (d(Ni(2)–Ga) = 2.311 Å). Частичную занятость позиции d-металла авторы работы [2] объясняют тем, что короткая гетерометаллическая связь не типична для пары элементов Ni–Ga. Это не является, с нашей точки зрения, рациональным объяснением наблюдаемого явления. Координационный полиэдр для Ni(3) представляет собой октаэдр, образованный только атомами теллура.
Расстояние Ni–Te в перечисленных тройных соединениях схоже с типичными межатомными расстояниями, обнаруженными в структурах большого числа бинарных теллуридов никеля, особенно в твердом растворе Ni1 –xTe, который представляет собой дефектную структуру NiAs. В работе [2] кристаллические структуры обедненных никелем соединений типа Ni3 –xGaTe2 (х = = 0.25, 0.5) были уточнены методом Ритвельда.
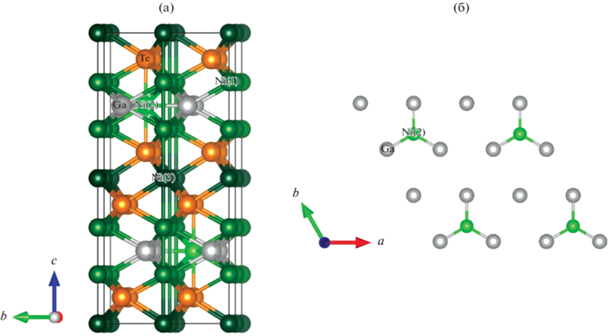
Следует отметить относительно постоянную заселенность позиции Ni(3) внутри ван-дер-ваальсовой щели (~25–30%), которая сопровождается снижением заселенности позиции Ni(2) внутри гетерометаллического фрагмента по мере уменьшения общего содержания Ni (50% в Ni2.79GaTe2, 36% в Ni2.58GaTe2) (табл. 1). Увеличение параметра с при переходе от Ni2.79GaTe2 к Ni2.58GaTe2 объясняется уменьшением заселенности позиции Ni(3), поскольку ван-дер-ваальсова щель становится более ярко выраженной и меньше “стягивается” за счет нахождения в ней атомов никеля в части ячеек. Авторы [2] также полагают, что позиция Ni(2) в Ni3–хGaTe2 не может быть полностью свободной. При попытках синтезировать соединение состава Ni2GaTe2 была получена тройная фаза, содержащая Ni2.3GaTe2 и Ga2Te3. Это является доказательством существования нижней границы содержания Ni в соединениях типа Ni3 –xGaTe2. Возникновение сверхструктуры связано с упорядоченным заполнением позиции Ni(3) в плоскости ab, что наблюдается для соединений состава Ni3 –xGaTe2, где 0.5 ≤ х ≤ 0.65, 3/4 атомов никеля регулярно отсутствуют в позиции Ni(2), в отличие от соединения Ni3GaTe2, где позиции Ni(3)' и Ni(3)" полностью заняты (рис. 1) [2]. В сверхъячейке с удвоенными параметрами a и b бывшие позиции Ni(2) в гетерометаллическом слое преобразуются в позиции Ni(2)' и Ni(2)". В предложенной симметрии первая позиция занята, в то время как вторая остается вакантной, что приводит к возникновению гетерометаллических фрагментов типа $_{\infty }^{2}$[Ni2.25Ga]. Учитывая, что заселенность позиции Ni(3) в ван-дер-ваальсовой щели составляет ~30% (согласно данным уточнения по методу Ритвельда), авторы [2] считают, что идеальный состав для наблюдения данного типа упорядочения близок к Ni2.55GaTe2. Это согласуется с верхним пределом содержания никеля, для которого идентифицирована сверхструктура данного типа. При х < 0.45 наблюдается “стандартная” ячейка типа Ni2.98GaTe2 c утроенным по сравнению с NiAs параметром с. Авторы [2] предполагают, что занятость позиции никеля внутри ван-дер-ваальсой щели постоянна. Однако в реальной структуре суммарная занятость может варьироваться, меняя соотношение между занятостью двух позиций d-металла и общим содержанием никеля [2].
Таблица 1.
Кристаллографические параметры соединений Ni3 –xGaTe2 (х = 0, 0.25, 0.5)
| Параметр | Ni2.98(1)GaTe2 | Ni2.79(1)GaTe2 | Ni2.58(1)GaTe2 |
|---|---|---|---|
| а, Å | 3.93933(3) | 3.93190(2) | 3.9291(2) |
| c, Å | 15.7933(2) | 15.8571(1) | 15.9060(6) |
| V, Å3 | 212.250(3) | 212.305(2) | 212.65(2) |
| Заселенность Ni(2) | 0.612(2) | 0.500(3) | 0.358(4) |
| Заселенность Ni(3) | 0.372(3) | 0.287(4) | 0.224(5) |
Рис. 1.
Вид элементарной ячейки Ni3–xGaTe2 со сверхструктурой, asup = bsup = 2asub (а). Атомы Ni(2) и Ga упорядочены в плоскости ab, 2D-срез одного гетерометаллического слоя (б).
Изучение процесса интеркаляции в структуры со слоистым строением имеет значение как для теоретической неорганической химии и физикохимии твердого тела, так и для направленного синтеза функциональных неорганических материалов, в том числе модельных. Особый интерес представляет использование интеркалятов слоистых халькогенидов щелочных металлов для получения наноматериалов, в частности электродов для металл-ионных аккумуляторов, при их обработке протонными растворителями [9–12]. Для интеркаляции лития в слоистые структуры-матрицы в настоящее время используют элементарный металлический Li [13], металлорганические соединения лития: н-бутиллитий [14, 15], трет-бутиллитий [16], гидроксид лития [12], а также растворы металлического лития в жидком аммиаке [9]. Следует отметить, что ни один из этих методов не может гарантировать получение продуктов с заданным составом. Это обстоятельство определяет возможность более глубокого изучения свойств интеркалятов с различным содержанием атома-интеркалянта.
Первым примером применения гидрида лития в качестве интеркалирующего агента стала интеркаляция в графит, широко используемый как модельный объект [17, 18]. В дальнейшем LiH применяли для синтеза технологически важного продукта – литированной шпинели Li1 +xMn2O4 – δ, используемой в качестве электрохимически активного материала перезаряжаемых литий-ионных батарей, в результате чего были получены однофазные продукты-шпинели с рекордным содержанием лития [19, 20]. Обнаружено, что в качестве побочных продуктов выделяются водород и вода, соотношение которых меняется в зависимости от мольного соотношения интеркалирующего агента и матрицы, а также от режима отжига.
Таким образом, расширение систем, в которых возможно применение гидрида лития в качестве интеркалирующего агента, и изучение происходящих при этом превращений представляют актуальную задачу как для неорганической химии, так и для материаловедения в целом [21–28].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Прекурсоры. В настоящей работе использовали LiH с содержанием основного вещества не менее 98% (по данным волюмометрического анализа). В качестве исходных веществ для синтеза Ni3GaTe2 использовали никель (порошок, 99.98%), галлий (слиток), теллур (порошок, 99.999%). Никель предварительно отжигали в течение нескольких часов при 550°С в токе сухого водорода хроматографической чистоты для восстановления оксидного слоя. Синтез исходной тройной матрицы Ni3GaTe2 проводили по стандартной высокотемпературной ампульной методике: стехиометрическую смесь исходных простых веществ помещали в прокаленную кварцевую ампулу диаметром 8–15 мм и длиной 50–100 мм, которую затем вакуумировали до остаточного давления 5–10 × 10–3 мм рт. ст., отпаивали в пламени кислородной горелки и отжигали в печи при 1023 K в течение 168 ч. Согласно результатам РФА, образец Ni3GaTe2 является однофазным. Исследования методом РФА выполняли на оборудовании ЦКП ИОНХ РАН (рентгеновский дифрактометр Bruker D8 Advance, CuKα-излучение, Ni-фильтр, детектор Lynxeye, геометрия на отражение) в рамках государственного задания ИОНХ РАН в области фундаментальных научных исследований. Регистрацию дифрактограмм литийсодержащих образцов проводили во фторопластовой кювете, образец в ней покрывали полиамидной пленкой Captone, которую фиксировали прижимным кольцом. Операции с веществами, чувствительными к компонентам воздуха (разгрузка и загрузка размольных стаканов, работа с гидридом лития, пробоподготовка литированных образцов к РФА), проводили в герметичном перчаточном боксе СПЕКС ГБ 22М (10 и 5 м.д. O2 и H2O соответственно), образцы помещали в низкофоновые кюветы с подложками из ориентированного монокристалла кремния (диапазон углов 2θ = 5°–90°, шаг 0.01023°, время накопления 0.15–0.3 с). Элементный анализ (Li, Ga, Ni, Te) выполняли с использованием эмиссионного спектрометра iCAP 6300 Duo с индуктивно связанной плазмой. Для перевода образца в раствор навеску определяемого вещества обрабатывали царской водкой, для приготовления которой использовали соляную и азотную кислоты особой чистоты. Содержание водорода определяли гравиметрическим методом путем сжигания навески исследуемого вещества в токе кислорода высокой чистоты с улавливанием образовавшихся паров воды в U-образных трубках с безводным Mg(ClO4)2. Относительная погрешность определения данным методом составляет 1.5%. Во избежание потери определяемого водорода в виде простого вещества осуществляли дожиг газов, поступающих в U-образную трубку с Mg(ClO4)2 над проволокой CuO. Механохимическую активацию проводили с использованием шаровой вибрационной мельницы Retsch MM400 с размольными стаканами (V = 25 мл), футерованными ZrO2, и размольными шарами (5 мм) из ZrO2. Соотношение массы обрабатываемой навески вещества к массе шаров поддерживали на уровне 20 : 1.
Измерения pH проводили с помощью анализатора жидкости “Мультитест” ИПЛ-201 с диапазоном измерения pX (–2…+20) с погрешностью ±0.02 pX (pH). Навеску гидролизуемого препарата LixNi3GaTe2 подбирали достаточной для образования 0.01 М раствора LiOH по окончании гидролиза. Для гидролиза использовали бидистиллированную воду, величину pH измеряли при постоянном перемешивании суспензии интеркалята в воде магнитной мешалкой.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для проведения интеркаляции заданное количество гидрида лития подвергали механохимической активации (25 мин, 30 Гц), затем в размольный стакан вносили требуемое количество однофазного образца Ni3GaTe2 (матрицы) и полученную смесь активировали в течение 3–5 мин в том же режиме. Такой порядок активации был выбран ввиду возможности механолиза теллурида, обладающего слоистой структурой. В настоящей работе исследовали смеси с мольной долей вводимого LiH, равной 0.1, 0.2, 0.3, 0.5 и 0.7. Полученные таким образом механокомпозиты имели заданное расчетное соотношение элементов (табл. 2) и фазовый состав, отвечающий механической смеси (рис. 2). Извлеченные из размольного сосуда механокомпозиты переносили в алундовые тигли (l = 35 мм, dвнутр = 6 мм, dвнеш = 8 мм) и помещали в проточную кварцевую трубку-реактор. Отжиг проводили в атмосфере аргона высокой чистоты (p(O2) ~ 0.0001 атм). На дифрактограммах образцов, прошедших отжиг при 523 K (2 ч) все еще наблюдаются рефлексы LiH, а элементный состав остается практически без изменения, незначительно уменьшается только содержание водорода, что свидетельствует о выделении его в молекулярной форме. Увеличение продолжительности отжига до 24–48 ч и температуры до 747 K в случае LiH с мольной долей, не превышающей x = 0.3, приводит к образованию однофазных образцов LixNi3GaTe2 с сохранением структуры исходной матрицы Ni3GaTe2 (рис. 2). Полученные таким образом образцы не содержат водорода (табл. 2). При интеркаляции лития элементарная ячейка Ni3GaTe2 претерпевает незначительное сжатие, например, для x = 0.3 a = 3.9557(5), c = 15.6555(18) Å, V = 212.51(4) Å3).
Таблица 2.
Элементный состав изучаемых образцов, мол. д.
| Образец, условия обработки | H | Li | Ga | Ni | Te |
|---|---|---|---|---|---|
| Ni3GaTe2, прекурсор | 0 | 0 | 1.0014 | 2.9996 | 2.0014 |
| Ni3GaTe2 + 0.1 LiH, МХА* | 0.0980 | 0.1012 | 1.0006 | 3.0011 | 2.0023 |
| Ni3GaTe2 + 0.5 LiH, МХА* | 0.4967 | 0.5042 | 1.0011 | 3.0020 | 2.0013 |
| Ni3GaTe2 + 0.3 LiH, 523 K, 3 ч, Ar | 0.2133 | 0.2999 | 1.0015 | 3.0021 | 2.0007 |
| Ni3GaTe2 + 0.1 LiH, 747 K, 24 ч, Ar | 0 | 0.1013 | 1.0004 | 3.0017 | 2.0023 |
| Ni3GaTe2 + 0.3 LiH, 747 K, 36 ч, Ar | 0 | 0.2996 | 0.9994 | 3.0021 | 1.9994 |
| Ni3GaTe2 + 0.7 LiH, 747 K, 36 ч, Ar | 0 | 0.6766 | 1.0020 | 3.0022 | 1.5834 |
Рис. 2.
Дифрактограммы: 1 – LiH в кювете из фторопласта (С), 2 – исходная матрица Ni3GaTe2, 3 – интеркалят Li0.3Ni3GaTe2.
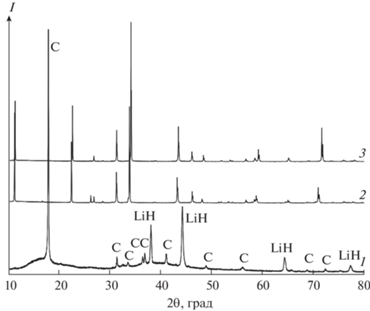
При увеличении мольной доли LiH в смесях (>0.3) или температуры выше 823 K наряду с полным выделением водорода наблюдается разложение матрицы – на стенках реакционной кварцевой трубки образуется зеркало элементного теллура, что также заметно по изменению элементного состава (табл. 2). Массоперенос теллура возможен как вследствие испарения из матрицы, так и в результате термолиза H2Te, источником водорода для образования которого служит гидрид-ион, вносимый с LiH.
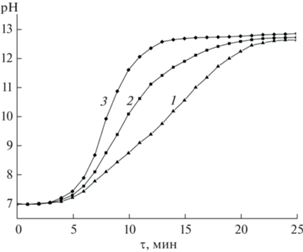
На рис. 3 представлены результаты гидролиза интеркалятов, свидетельствующие о том, что гидролиз проходит с выраженным индукционным периодом. Величина pH начинает возрастать вследствие образования LiOH спустя определенное время после внесения препарата LixNi3GaTe2 в воду, чего нельзя ожидать от взаимодействия с водой LiH или металлического Li, локализованных на поверхности кристаллитов образца или находящихся в виде механической смеси с матрицей.
ЗАКЛЮЧЕНИЕ
Впервые показана возможность применения гидрида лития LiH в качестве интеркалирующего агента для получения чистых образцов интеркалятов слоистого многокомпонентного теллурида LixNi3GaTe2 со структурой исходной матрицы и заданным содержанием лития по твердофазной реакции. Определены возможности и ограничения данного метода, описаны сопутствующие превращения в широком диапазоне мольных долей LiH в исходных смесях и температур. Данные, полученные в настоящее время, позволяют предполагать статистическое распределение лития в ван-дер-ваальсовой щели матрицы. Для более детального изучения интеркалятов необходимы исследования монокристаллических интеркалированных образцов.
Список литературы
Litvinenko O.N., Kuznetsov A.N., Olenev A.V. et al. // Russ. Chem. Bull. 2007. V. 56. № 10. P. 1945. https://doi.org/10.1007/s11172-007-0301-z
Isaeva A.A., Makarevich O.N., Kuznetsov A.N. et al. // Eur. J. Inorg. Chem. 2010. P. 1395. https://doi.org/10.1002/ejic.200901027
Larsson A.-K., Noren L., Withers R.L. et al. // J. Solid State Chem. 2007. V. 180. P. 2723. https://doi.org/10.1016/j.jssc.2007.07.020
Noren L., Withers R.L., Brink F.J. // J. Alloys Compd. 2003. V. 353. P. 133. https://doi.org/10.1016/S0925-8388(02)01309-9
Deiseroth H.-J., Aleksandrov K., Reiner et al. // Eur. J. Inorg. Chem. 2006. V. 8. P. 1561. https://doi.org/10.1002/ejic.200501020
Deiseroth H.-J., Sprirovski F., Reiner C. et al. // Z. Kristallogr. – New Cryst. Struct. 2007. V. 222. P. 169. https://doi.org/10.1524/ncrs.2007.0070
Dankwort T., Duppel V., Deiseroth H.-J. et al. // Sci. Technol. 2016. V. 31. P. 7. https://doi.org/10.1088/0268-1242/31/9/094001
Reynolds T.K., Kelley R.F., DiSalvo F.J. // J. Alloys Compd. 2004. V. 366. P. 136. https://doi.org/10.1016/j.jallcom.2003.07.008
Ding S., Bux S.K., King D.J. et al. // J. Mater. Chem. 2009. V. 19. P. 2588. https://doi.org/10.1039/B820226E
Raza A., Hassan J.Z., Ikram M. et al. // Adv. Mater. Interfaces. 2021. V. 8. № 14. P. 2002205. https://doi.org/10.1002/admi.202002205
Zhang L., Chen C., Zhou J. et al. // Adv. Funct. Mater. 2020. V. 30. № 45. P. 2004139. https://doi.org/10.1002/adfm.202004139
Ren L., Qi X., Liu Y. et al. // J. Mater. Chem. 2012. V. 22. № 11. P. 4921. https://doi.org/10.1039/c2jm15973b
Yajima T., Koshiko M., Zhang Y. et al. // Nat. Comm. 2016. № 7. P. 13809. https://doi.org/10.1038/ncomms13809
Guzmán R., Morales J., Tirado J.L. // J. Mater. Chem. 1993. V. 3. № 12. P. 1271. https://doi.org/10.1039/jm9930301271
Yang D., Frindt R.F. // J. Phys. Chem. Solids. 1996. V. 57. № 6–8. P. 1113. https://doi.org/10.1016/0022-3697(95)00406
Golden J.H., DiSalvo F.J., Fréchet J.M.J. // Mater. Sci. Forum. 1994. V. 152–153. P. 209. https://doi.org/10.4028/www.scientific.net/msf.152-153.209
Elansari L., Marassl R., Tossicl R. et al. // Mol. Cryst. Liq. Cryst. Sci. Technol., Sect. A. 1998. V. 310. № 1. P. 309. https://doi.org/10.1080/10587259808045354
Konar S., Häusserman U., Svensson G. // Chem. Mater. 2015. V. 27. № 7. P. 2566. https://doi.org/10.1021/acs.chemmater.5b00235
Бузанов Г.А., Нипан Г.Д., Жижин К.Ю. и др. Пат. РФ RU2591154. Бюл. изобр. № 19. Опубл. 10.07.2016.
Buzanov G.A., Nipan G.D., Zhizhin K.Yu. et al. // Russ. Chem. Bull. 2016. V. 471. № 1. P. 330. https://doi.org/10.1134/s0012500816110082
Lapshin O.V., Boldyreva E.V., Boldyrev V.V. // Russ. J. Inorg. Chem. 2021. V. 66. P. 433. https://doi.org/10.1134/S0036023621030116
Davydova A.A., Raksha E.V., Glazunova V.A. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 324. https://doi.org/10.1134/S0036023621030062
Pechen L.S., Makhonina E.V., Medvedeva A.E. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 777. https://doi.org/10.1134/S0036023621050144
Shelyapina M.G., Lushpinskaya I.P., Kurnosenko S.A. et al. // Russ. J. Gen. Chem. 2020. V. 90. P. 760. https://doi.org/10.1134/S1070363220040337
Leont’eva N.N., Drozdov V.A., Bel’skaya O.B. et al. // Russ. J. Gen. Chem. 2020. V. 90. P. 509. https://doi.org/10.1134/S1070363220030275
Makaryan I.A., Sedov I.V. // Russ. J. Gen. Chem. 2021. V. 91. P. 1912. https://doi.org/10.1134/S1070363221090371
Doinikov D.A., Zavgorodnii A.S., Kazakov I.V. et al. // Russ. J. Gen. Chem. 2021. V. 91. P. 1969. https://doi.org/10.1134/S1070363221100078
Postnikova I.V. // Russ. J. Gen. Chem. 2021. V. 91. P. 1218. https://doi.org/10.1134/S1070363221060360
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии