Журнал неорганической химии, 2022, T. 67, № 5, стр. 575-581
Гидротермальный синтез оксида никеля с иерархической организацией частиц в присутствии триэтаноламина
Т. Л. Симоненко a, *, Н. П. Симоненко a, Ф. Ю. Горобцов a, Д. А. Дудорова a, b, Е. П. Симоненко a, В. Г. Севастьянов a, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Российский химико-технологический университет им. Д.И. Менделеева (государственный университет)
125047 Москва, Миусская пл., 9, Россия
* E-mail: egorova.offver@gmail.com
Поступила в редакцию 18.11.2021
После доработки 27.12.2021
Принята к публикации 28.12.2021
- EDN: QDDZQD
- DOI: 10.31857/S0044457X22050178
Аннотация
Изучен процесс гидротермального синтеза оксида никеля с иерархической организацией частиц в присутствии триэтаноламина. Исследовано термическое поведение, кристаллическая структура и спектральные характеристики α-Ni(OH)2, полученного в ходе гидротермальной обработки реакционной системы и последующей сушки твердой фазы. Показано, что в результате термообработки при 350°С (1 ч) происходит разложение полученного полупродукта с образованием целевого нанокристаллического оксида (средний размер ОКР ~6 нм). С помощью Кельвин-зондовой силовой микроскопии построены карты распределения потенциала по поверхности частиц исследуемого материала, а также определено значение работы выхода электрона с его поверхности.
ВВЕДЕНИЕ
Несмотря на то, что в современном мировом энергобалансе все еще преобладают ископаемые виды топлива, в настоящее время во многих странах наметилась четкая тенденция к переходу на энергосистемы с низким содержанием углерода [1–4]. Осуществление трансформации энергетического сектора и смещение равновесия в сторону альтернативной энергетики требуют развития технологий генерации и накопления “зеленой” электроэнергии. В данном аспекте особое внимание привлекают твердооксидные топливные элементы (ТОТЭ), которые представляют собой экологически чистые электрохимические генераторы энергии, характеризующиеся высоким КПД (могут достигать значений >80%) и способные функционировать с использованием различных видов топлива (водород, метан, биотопливо и т.п.) [5–8]. Рабочие характеристики ТОТЭ во многом определяются свойствами материалов их электродов. Так, аноды выполняют одну из ключевых ролей в работе топливного элемента, обеспечивая процесс электрохимического окисления топлива, а также участвуя в процессе переноса образовавшихся электронов к интерконнекторам. Материалы анода по своим химическим и теплофизическим параметрам должны быть совместимы с электролитом, иметь высокую электронную проводимость, каталитическую активность, а также обладать развитой поверхностью [9–11]. За последнее десятилетие было разработано большое количество различных анодных материалов, которые, как правило, представляют собой композиционный материал, состоящий из электролита (например, ZrO2–Y2O3 [12], CeO2–Gd2O3 [13], CeO2–Sm2O3 [10, 14, 15], CeO2–Y2O3 [16, 17] и т.п.) и металла (или оксида металла) с высокой каталитической активностью и электронной проводимостью (например, Сu, Ni, NiO). При этом большинство современных анодов можно разделить на никельсодержащие (NiO/CeO2–Sm2O3, Ni/(La1 –xSrx)(Ga1 –yMgy)O3 и т.п.) и безникелевые (Cu–CeO2–Gd2O3, La0.2Sr0.24Ca0.45TiO3–CeO2–Sm2O3 и т.п.). При этом никельсодержащие анодные материалы позволяют достичь более высоких плотностей мощности топливной ячейки на их основе (>500 мВт/см2) по сравнению с безникелевыми (<500 мВт/см2) в среднетемпературном интервале (500–600°С), что важно при разработке ТОТЭ с более низкими рабочими температурами [11]. Функциональные характеристики анодных слоев определяются микроструктурой, в частности, формой и размером составляющих их частиц. В последние годы все более активно развиваются подходы к формированию наноматериалов, в том числе и для устройств альтернативной энергетики, с иерархически организованной микроструктурой, что, как правило, приводит к существенному улучшению их функциональных характеристик [18–21]. Среди различных методов синтеза одним наиболее эффективных и удобных с этой точки зрения является гидротермальный метод, позволяющий формировать наиболее широкий спектр различных вариантов микроструктуры, а также осуществлять тонкий контроль параметров синтеза (тип растворителя, осадителя, структурообразователя, температура, давление, длительность процесса термообработки, а также концентрация реагентов), влияющих на формирование и особенности морфологии получаемых наноматериалов [22–27]. Зачастую при формировании оксида или гидроксида никеля с помощью гидротермального метода используют ряд оснований (и их комбинаций), таких как мочевина, гидроксид натрия, гидрат аммиака [28–31], а также структурообразователей (например, оксалаты аммония или натрия [32–36]) и поверхностно-активных веществ (этиленгликоль, полиэтиленгликоль [33, 34]). В единичных работах для создания основной среды при синтезе оксида никеля использовали триэтаноламин, выполняющий дополнительно функцию комплексо- и структурообразователя, однако этот процесс остается малоизученным [36, 37].
Цель настоящей работы – исследование процесса синтеза оксида никеля с помощью гидротермального метода в присутствии триэтаноламина, а также изучение физико-химических характеристик полученных порошков.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Нанопорошок оксида никеля был получен с помощью гидротермального метода по следующей методике. На первом этапе к водному раствору хлорида никеля (0.025 моль/л) при перемешивании добавляли водный раствор триэтаноламина (объемная доля 10%) в соотношении 1 : 1. Полученную таким образом реакционную систему переносили в стальной автоклав с тефлоновой вставкой объемом 100 мл и подвергали гидротермальной обработке при температуре 140°С в течение 1 ч. После естественного охлаждения системы до 25°С отделяли сформировавшуюся в ходе синтеза дисперсную фазу, промывали ее дистиллированной водой путем циклического центрифугирования, а затем сушили продукты синтеза при 100°С в течение 3 ч. Далее проводили термическую обработку (350°С, 1 ч) полученного порошка в атмосфере воздуха с целью разложения промежуточных продуктов и кристаллизации целевого оксида.
Синхронный (ТГА/ДСК) термический анализ полученного в ходе гидротермального синтеза и последующей сушки при 100°С порошка был выполнен с применением термоанализатора SDT Q-600. Контролируемый нагрев осуществляли в Al2O3-микротиглях в диапазоне температур 25–1000°С со скоростью 10 град/мин в токе воздуха, скорость потока газа составляла 250 мл/мин, масса навески – 4.586 мг.
Для регистрации ИК-спектров пропускания порошков были приготовлены соответствующие суспензии в вазелиновом масле, которые в виде пленки помещали между стеклами из бромида калия. Спектральный анализ выполняли в интервале волновых чисел 350–4000 см–1 (время накопления сигнала 15 с, разрешение 1 см–1) с использованием ИК-Фурье-спектрометра ИнфраЛЮМ ФТ-08.
Рентгенофазовый анализ (РФА) полученных порошков проводили на дифрактометре Bruker D8 Advance (излучение CuKα, λ = 1.5418 Å, Ni-фильтр, E = 40 кэВ, I = 40 мА, диапазон 2θ 5°–80°, разрешение 0.02°, время накопления сигнала в точке 0.3 с).
Микроструктуру полученных оксидных частиц исследовали методом просвечивающей электронной микроскопии (ПЭМ, микроскоп JEOL JEM-1011 с цифровой фотокамерой Orius SC1000W).
Морфологию полученного после дополнительной термообработки (350°С, 1 ч) нанопорошка оксида никеля изучали с помощью атомно-силовой микроскопии (АСМ). Для этого на его основе была приготовлена устойчивая дисперсия в 1-бутаноле, которую далее использовали для нанесения соответствующего покрытия на поверхность алюминиевой подложки. С помощью Кельвин-зондовой силовой микроскопии (КЗСМ) были построены карты распределения поверхностного потенциала, а также рассчитана величина работы выхода электрона с поверхности материала. АСМ- и КЗСМ-исследования выполняли на сканирующем зондовом микроскопе Solver Pro-M (производство NT-MDT) с использованием зондов ETALON HA-HR с проводящим покрытием на основе W2C (резонансная частота ~230 кГц, радиус скругления <35 нм).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
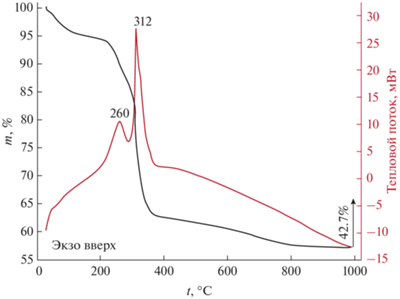
Термическое поведение порошка, полученного в ходе гидротермального синтеза и сушки (100°С, 3 ч), исследовали с помощью синхронного (ТГА/ДСК) термического анализа в токе воздуха (рис. 1). В ходе нагрева наблюдается пятиступенчатая потеря массы в интервалах температур 25–200 (Δm = 5.7%), 200–290 (7.7%), 290–310 (10.8%), 310–375 (12.7%) и 375–900°С (5.9%). Первая ступень потери массы обусловлена процессами десорбции остаточного растворителя и атмосферных газов с поверхности материала, вторая, сопровождаемая экзотермическим эффектом с максимумом при 260°С, может быть связана с процессами окисления органических компонентов в составе полупродуктов синтеза. В ходе дальнейшего нагрева выше 290°С помимо процессов окисления происходит трансформация промежуточных продуктов с образованием оксида никеля. Итоговая потеря массы составляет 42.7%. На основании результатов термического анализа можно сделать вывод о том, что основная потеря массы завершается около 350°С, поэтому данная температура была выбрана для проведения дополнительной термообработки полупродукта с целью кристаллизации целевого оксида.
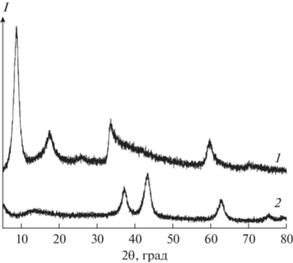
Методом РФА исследована кристаллическая структура и фазовый состав порошков, сформировавшихся в результате гидротермальной обработки и последующей дополнительной термообработки на воздухе. Как видно из рентгенограммы полупродукта (рис. 2), набор характеристичных отражений в данном случае соответствует α-модификации гидроксида никеля (α-Ni(OH)2; JCPDS 22-0444). Рефлексы с максимумами при 8.5° и 17.5°, не характерные в общем случае для данного соединения, могут указывать на частично слоистую структуру полученного полупродукта. Подобный вид рентгенограмм ранее наблюдался авторами работы [38] при получении слоистых гидроксидов никеля, меди и марганца при длительной выдержке их гидроксидов в растворах хлоридов, сульфатов и нитратов алюминия или хрома. Дополнительно процессу расслаивания могло способствовать использование в процессе синтеза триэтаноламина, который является представителем аминов, активно применяемых в качестве эксфолиантов при формировании материалов со слоистой структурой [39]. В результате термообработки порошка при 350°С происходит формирование целевого оксида никеля (JCPDS, № 78-0643). При этом на рентгенограмме отсутствуют рефлексы полупродукта и каких-либо других кристаллических примесей. Средний размер ОКР для полученного таким образом порошка оксида никеля(II) составляет ~6 нм.
Рис. 2.
Рентгенограммы промежуточного продукта (1) и порошка, полученного в результате дополнительной термообработки при 350°С (2).
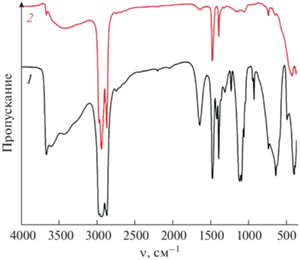
Использование ИК-спектроскопии позволило оценить набор функциональных групп в составе полупродукта и порошка после дополнительной термообработки (рис. 3). В спектре полупродукта в интервале волновых чисел 3700–3100 см–1 наблюдается наложение узкой полосы поглощения с максимумом при 3650 см–1, а также нескольких более широких характеристических полос, соответствующих валентным колебаниям свободных и связанных водородной связью гидроксильных групп соответственно. Узкая выраженная полоса с максимумом при 1620 см–1 относится к деформационным колебаниям ОН-групп молекул воды, которые, по данным работы [40], могут находиться в межслоевом пространстве сформировавшегося гидроксида никеля. Полосы при 1300, 1215 и 915 см–1 относятся к колебаниям нитрогрупп, тогда как набор полос в интервале волновых чисел 1180–990 см–1 обусловлен колебаниями связей C–N (1105 см–1), C–O (1075 см–1) и C–C (1042 и 1023 см–1). Характеристические полосы в области 850–520 см–1 могут быть отнесены к деформационным колебаниям OH-групп [22, 40], а полосы, наблюдаемые после 500 см–1, относятся к колебаниям связей Ni–OH и Ni–O [22, 41, 42]. После проведения дополнительной термообработки при 350°С видно, что интенсивность полос поглощения, относящихся к промежуточному продукту, значительно снижается, что говорит о его практически полном разложении и формировании целевого продукта.
Рис. 3.
ИК-спектры промежуточного продукта (1) и порошка, полученного в результате дополнительной термообработки при 350°С (2).
Микроструктура порошка оксида никеля была изучена с помощью просвечивающей электронной микроскопии (рис. 4). Полученные результаты свидетельствуют об иерархической организации частиц данного оксида. Так, исследуемый порошок имеет двухуровневую организацию и состоит из частиц (средний размер ~15 нм), упорядоченных в виде нанолистов, собранных в более крупные сферические структуры (средний диаметр ~1.7 мкм). Дополнительно микроструктура порошка была изучена с помощью АСМ (рис. 5). Как видно из микрофотографий, порошок состоит из агломератов, размер которых ≥1 мкм. Образования размером 1–2 мкм имеют выраженную сферическую форму, которая с увеличением размера агломерата становится все более вытянутой (при этом с увеличением их длины ширина остается равной ~2 мкм). Высота образований сравнима с их диаметром и шириной и составляет в среднем 400 нм. Описанные результаты хорошо согласуются с данными ПЭМ, где также видны округлые образования размером ~2 мкм. Наблюдаемые агломераты также характеризуются двухуровневой организацией частиц – наблюдаются как крупные частицы (размером 150–200 нм), так и более мелкие (40–60 нм).
Рис. 5.
АСМ-микрофотографии пленки NiO, полученной с использованием оксидного нанопорошка: топография (а, б) и распределение поверхностного потенциала (в).
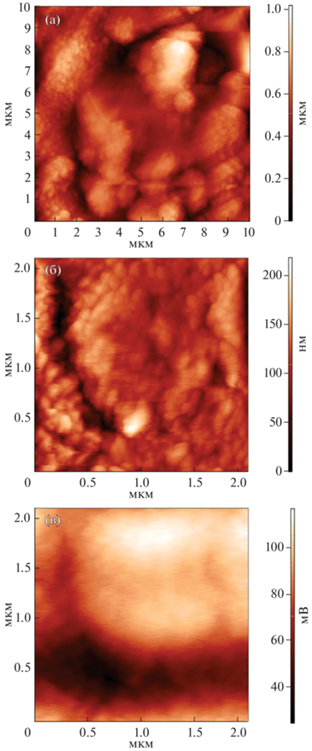
С помощью КЗСМ были охарактеризованы локальные электрофизические свойства порошка. Из приведенной на рис. 5в карты распределения потенциала по поверхностям двух соседних агломератов видно, что наблюдается положительный отклик, т.е. значение потенциала растет симбатно высоте на скане топографии. Это говорит о повышенной концентрации электронов на основной площади поверхности частиц и пониженной – на границах их контакта. С учетом того, что NiO является p-полупроводником, в котором в качестве носителей заряда выступают дырки, такие данные свидетельствуют о межзеренной дырочной проводимости в образце. По результатам КЗСМ возможно также определение работы выхода электрона с поверхности материала по формуле:
ЗАКЛЮЧЕНИЕ
В рамках проведенной работы изучен процесс гидротермального синтеза оксида никеля в присутствии триэтаноламина. Исследовано термическое поведение, спектральные свойства и кристаллическая структура α-Ni(OH)2, полученного в качестве промежуточного продукта в результате синтеза и последующей сушки при 100°С в течение 3 ч. Показано, что в результате дополнительной термообработки при 350°С происходит разложение полупродукта с образованием целевого оксида никеля (по данным РФА и ИК-спектроскопии), характеризующегося иерархической организацией составляющих его частиц. Установлено, что синтезированный оксид никеля является нанокристаллическим (средний размер ОКР составляет ~6 нм, а средний размер частиц, по данным ПЭМ, равен ~15 нм) и не содержит посторонних кристаллических включений. Применение Кельвин-зондовой силовой микроскопии дало возможность оценить локальные электрофизические свойства полученного оксида никеля, в частности, работу выхода электрона с его поверхности (4.751 эВ). Построение карты распределения потенциала по поверхности изучаемого материала позволило установить, что основная концентрация электронов наблюдается на основной поверхности частиц и снижается при переходе к границам их контакта. Результаты используемых методов физико-химического анализа свидетельствуют о том, что предложенный подход и параметры синтеза позволяют эффективно получать иерархически организованные наноструктуры оксида никеля.
Список литературы
Tsoi K.H., Loo B.P.Y., Tal G. et al. // J. Clean. Prod. 2022. V. 330. P. 129866. https://doi.org/10.1016/j.jclepro.2021.129866
Abbasi M.H., Abdullah B., Ahmad M.W. et al. // Sustain. Energy Technol. Assessments. 2021. V. 48. P. 101630. https://doi.org/10.1016/j.seta.2021.101630
Wang Y., Wang J., He W. // Renew. Sustain. Energy Rev. 2022. V. 154. P. 111747. https://doi.org/10.1016/j.rser.2021.111747
Kwok Y.T., Schoetter R., Ng E. // Sci. Total Environ. 2021. P. 152338. https://doi.org/10.1016/j.scitotenv.2021.152338
Haseltalab A., van Biert L., Sapra H. et al. // Energy Convers. Manag. 2021. V. 245. P. 114625. https://doi.org/10.1016/j.enconman.2021.114625
Tan L., Dong X., Chen C. et al. // Energy Convers. Manag. 2021. V. 245. P. 114539. https://doi.org/10.1016/j.enconman.2021.114539
Radenahmad N., Azad A.T., Saghir M. et al. // Renew. Sustain. Energy Rev. 2020. V. 119. P. 109560. https://doi.org/10.1016/j.rser.2019.109560
Saebea D., Arpornwichanop A., Patcharavorachot Y. // Int. J. Hydrogen Energy. 2021. V. 46. № 20. P. 11445. https://doi.org/10.1016/j.ijhydene.2020.07.264
Tian D., Liu W., Chen Y. et al. // Mater. Res. Bull. 2015. V. 71. P. 1. https://doi.org/10.1016/j.materresbull.2015.06.042
Yao X., Li P., Yu B. et al. // Int. J. Hydrogen Energy. 2017. V. 42. № 34. P. 22192. https://doi.org/10.1016/j.ijhydene.2017.02.008
Ng K.H., Rahman H.A., Somalu M.R. // Int. J. Hydrogen Energy. 2019. V. 44. № 58. P. 30692. https://doi.org/10.1016/j.ijhydene.2018.11.137
Kalinina M.V., Morozova L.V., Egorova T.L. et al. // Glas. Phys. Chem. 2016. V. 42. № 5. P. 505. https://doi.org/10.1134/S1087659616050060
Simonenko T.L., Kalinina M. V., Simonenko N.P. et al. // Glass. Phys. Chem. 2018. V. 44. № 4. P. 314. https://doi.org/10.1134/S1087659618040144
Zhu L., Liu X., Han F. et al. // Solid State Ionics. 2016. V. 288. P. 115. https://doi.org/10.1016/j.ssi.2015.11.016
Ahsan M., Irshad M., Fu P.F. et al. // Ceram. Int. 2020. V. 46. № 3. P. 2780. https://doi.org/10.1016/j.ceramint.2019.09.268
Egorova T.L., Kalinina M.V., Simonenko E.P. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 9. P. 1061. https://doi.org/10.1134/S0036023616090047
Egorova T.L., Kalinina M.V., Simonenko E.P. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 10. P. 1275. https://doi.org/10.1134/S0036023617100072
Wang Z., Wang S., Jiao S. et al. // J. Alloys Compd. 2017. V. 702. P. 186. https://doi.org/10.1016/j.jallcom.2017.01.212
Rath M.K., Choi B.-H., Ji M.-J. et al. // Ceram. Int. 2014. V. 40. № 2. P. 3295. https://doi.org/10.1016/j.ceramint.2013.09.105
Li N., Yuan K., Gao T. et al. // Arab. J. Chem. 2022. V. 15. № 2. P. 103580. https://doi.org/10.1016/j.arabjc.2021.103580
Mohammadi M., Arvand M., Daneshvar S. // J. Electroanal. Chem. 2022. V. 904. P. 115934. https://doi.org/10.1016/j.jelechem.2021.115934
Salavati-Niasari M., Entesari M. // Polyhedron. 2012. V. 33. № 1. P. 302. https://doi.org/10.1016/j.poly.2011.11.054
Keshari A.S., Dubey P. // J. Energy Storage. 2021. V. 40. P. 102629. https://doi.org/10.1016/j.est.2021.102629
Yao Y., Liu C., Luo L. et al. // Mater. Res. Bull. 2022. V. 146. P. 111625. https://doi.org/10.1016/j.materresbull.2021.111625
Bustos M.E., Hevia F., Fuentes S. et al. // Mater. Lett. 2021. V. 297. P. 129936. https://doi.org/10.1016/j.matlet.2021.129936
Xu G., Zhao J., Yuan J. et al. // J. Alloys Compd. 2021. P. 163163. https://doi.org/10.1016/j.jallcom.2021.163163
Simonenko T.L., Ivanova V.M., Simonenko N.P. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 14. P. 1753. https://doi.org/10.1134/S0036023619140080
Fan J., Lu J., Sha Z. et al. // Sci. China Chem. 2021. V. 64. № 9. P. 1596. https://doi.org/10.1007/s11426-021-1101-4
Zhang Y., Zhao J., Kang X. et al. // Colloids Surf., A: Physicochem. Eng. Asp. 2021. V. 629. P. 127466. https://doi.org/10.1016/j.colsurfa.2021.127466
Wan X., Yuan M., Tie S. et al. // Appl. Surf. Sci. 2013. V. 277. P. 40. https://doi.org/10.1016/j.apsusc.2013.03.126
Madhura T.R., Kumar G.G., Ramaraj R. // J. Solid State Electrochem. 2020. V. 24. № 11–12. P. 3073. https://doi.org/10.1007/s10008-020-04763-3
Zhou L., Zeng W., Li Y. // Mater. Lett. 2019. V. 254. P. 92. https://doi.org/10.1016/j.matlet.2019.07.042
Liu B., Yang H., Zhao H. et al. // Sens. Actuators, B: Chem. 2011. V. 156. № 1. P. 251. https://doi.org/10.1016/j.snb.2011.04.028
Miao B., Zeng W., Lin L. et al. // Physica E: Low-dimensional Syst. Nanostructures. 2013. V. 52. P. 40. https://doi.org/10.1016/j.physe.2013.03.006
Yu Y., Xia Y., Zeng W. et al. // Mater. Lett. 2017. V. 206. P. 80. https://doi.org/10.1016/j.matlet.2017.06.119
Chung Y., Park H., Lee E. et al. // J. Electrochem. Soc. 2016. V. 163. № 13. P. B624. https://doi.org/10.1149/2.0751613jes
Singh J., Lee S., Kim S. et al. // J. Alloys Compd. 2021. V. 850. P. 156755. https://doi.org/10.1016/j.jallcom.2020.156755
Rajamathi M., Vishnu Kamath P. // Bull. Mater. Sci. 2000. V. 23. № 5. P. 355. https://doi.org/10.1007/BF02708384
Chen H., Liu B., Yang Q. et al. // Mater. Lett. 2017. V. 199. P. 124. https://doi.org/10.1016/j.matlet.2017.04.066
Cai Y., Ma J., Wang T. // J. Alloys Compd. 2014. V. 582. P. 328. https://doi.org/10.1016/j.jallcom.2013.07.206
Gund G.S., Dubal D.P., Jambure S.B. et al. // J. Mater. Chem. A. 2013. V. 1. № 15. P. 4793. https://doi.org/10.1039/c3ta00024a
Simonenko T.L., Ivanova V.M., Simonenko N.P. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 14. P. 1753. https://doi.org/10.1134/S0036023619140080
Greiner M.T., Helander M.G., Wang Z.-B. et al. // J. Phys. Chem. C. 2010. V. 114. № 46. P. 19777. https://doi.org/10.1021/jp108281m
Mokrushin A.S., Simonenko T.L., Simonenko N.P. et al. // Appl. Surf. Sci. 2022. V. 578. P. 151984. https://doi.org/10.1016/j.apsusc.2021.151984
Simonenko T.L., Bocharova V.A., Gorobtsov P.Y. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 9. P. 1292. https://doi.org/10.1134/S0036023620090193
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии