Журнал неорганической химии, 2022, T. 67, № 10, стр. 1505-1512
Влияние сурьмы на реакцию диборида гафния с иридием
В. В. Лозанов a, *, Н. И. Бакланова a, Д. А. Банных a, А. Т. Титов b
a Институт химии твердого тела и механохимии СО РАН
630090 Новосибирск, ул. Кутателадзе, 18, Россия
b Институт геологии и минералогии им. В.С. Соболева СО РАН
630090 Новосибирск, пр-т Академика Коптюга, 3, Россия
* E-mail: lozanov.25@yandex.ru
Поступила в редакцию 16.03.2022
После доработки 26.04.2022
Принята к публикации 29.04.2022
- EDN: REDLLY
- DOI: 10.31857/S0044457X22100300
Аннотация
Тройные бориды на основе иридия и гафния получены простым методом по реакции иридия с диборидом гафния в присутствии металлической сурьмы при температуре 1500°С. Продукт представляет собой кристаллы Hf2Ir5B2 вытянутой формы, а также зерна размером до 10–15 мкм, состоящие из других тройных боридов системы Hf–Ir–B. Показано, что введение сурьмы в реакционную смесь меняет схему взаимодействия и приводит к образованию соединений, не плавящихся в интервале температур 1000–1300°С, что способствует образованию сыпучего продукта. Образующийся в ходе реакции IrSb2 распадается при 1500°С, при этом иридий тратится на формирование тройных боридов, а сурьма испаряется и может быть полностью отогнана из реакционной зоны. Высокая скорость испарения сурьмы препятствует консолидации частиц тройных боридов, что также приводит к получению сыпучего продукта. Предложенный подход может быть использован для получения порошков тройных боридов Hf–Ir–B, востребованных в различных областях материаловедения.
ВВЕДЕНИЕ
Диборид гафния, особенно в сочетании с карбидом кремния, представляет большой интерес для разработки материалов и покрытий, работающих в экстремальных условиях температур, механических нагрузок и агрессивных газовых сред [1–5]. Тройные бориды на основе гафния, в частности Hf–Ir–B, в последнее время привлекают особое внимание в качестве потенциальных катализаторов для электролитического разложения воды (oxygen evolution reactions), топологических полуметаллов (topological semimetals), магнитных и высокотемпературных материалов [6–9]. В настоящее время известно о существовании Hf2Ir5B2, Hf3Ir5B2, HfIr3B4, твердого раствора внедрения HfIr3B0.45, а также недавно открытых соединений, имеющих среднестатистический состав HfIr2.1B1.3 и HfIr5.7B2.7 [6–10]. Синтез этих соединений, как правило, проводят при высокой температуре посредством спекания порошков металлов и бора между собой, взаимодействием иридия с HfB2 либо металлического гафния с боридом иридия при различных температурах [9–11]. В результате этих реакций образуется плотно спеченный и очень твердый (HV = 13–23 ГПа [9]) продукт, который нуждается в дальнейшем измельчении в специальном размольном оборудовании [9, 11].
Известно, что многокомпонентные бориды можно синтезировать в присутствии легкоплавких металлов или сплавов, которые влияют на механизм взаимодействия, облегчая, например, диффузию компонентов через жидкую фазу. В качестве такой добавки для синтеза боридов могут быть использованы алюминий, медь, некоторые сплавы [12–15]. Так, для синтеза сложных боридов благородных металлов LaOs2Al2B, LaOs2AlB2 и LaRu2Al2B был использован легкоплавкий эвтектический состав La0.8Ni0.2, имеющий температуру плавления ~532°C. Недостатком такого подхода является образование побочных продуктов – двойных и тройных соединений вышеуказанных металлов с компонентами системы.
В настоящей работе предложен подход к синтезу многокомпонентных боридов на основе гафния и иридия с использованием металлической сурьмы. Сурьма имеет довольно низкую температуру плавления по сравнению с гафнием, иридием и бором (630.6°С по сравнению с 2227°С, 2443 и 2076°С соответственно), при этом равновесное давление паров при температуре плавления достаточно высокое и составляет 2.05 × 10–4 атм. [16]. Сведения о фазовых диаграммах тройных систем Hf–B–Sb и B–Ir–Sb отсутствуют, есть лишь упоминание об одном соединении состава HfIrSb [17]. Это дает некоторые основания полагать, что формирование тройных соединений Hf–Ir–B будет более предпочтительным, чем формирование тройных соединений, содержащих сурьму.
Цель работы – изучить влияние легкоплавкого агента – металлической сурьмы на реакцию диборида гафния с иридием и охарактеризовать полученные продукты с точки зрения фазового состава и морфологии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных веществ использовали порошок HfB2 (ч., ТУ 6-09-03-418-76, Россия), механически активированный порошок иридия (99.95%, ГОСТ 12338-81, Россия) [18], металлическую сурьму (ос. ч., Россия). Рентгенофазовый анализ (РФА) исходных реагентов подтвердил отсутствие примесных фаз. Реагенты смешивали в агатовой ступке в мольном соотношении HfB2 : Ir : Sb = 1 : 2 : 1. Смесь загружали в графитовый тигель, накрывали фольгой из терморасширенного графита и загружали в установку горячего прессования. Реакционную зону вакуумировали и заполняли аргоном (чистота 99.999%) до давления ~130 кПа. Нагрев проводили со скоростью 100 град/мин до 1000°С, выдерживали при этой температуре 12 ч, а затем охлаждали со скоростью ~75 град/мин. После нагрева порошок извлекали, проводили отбор пробы, затем перемешивали в агатовой ступке и вновь загружали в реактор для проведения экспериментов при 1300 (6 ч выдержки) или 1500°С (4 ч выдержки). Ранее было показано, что первые признаки взаимодействия HfB2 с иридием – бориды иридия – становятся заметными при 1000°С, а при 1300°C наблюдается изменение фазового состава продукта и появление тройных боридов Hf2Ir5B2 и HfIr3B4 [9]. Выбор температуры 1500°C обусловлен тем, что эта температура близка к температуре кипения сурьмы (1587°С).
Дифрактограммы порошков регистрировали с помощью дифрактометра D8 Advance (Bruker, США), в CuKα-излучении в диапазоне 2θ = 10°–130°. Качественный и количественный рентгенофазовый анализ и уточнение параметров элементарных ячеек проводили с использованием программного обеспечения Topas 4.2. Для идентификации фаз использовали базу данных ICSD (2006 г.) и литературные данные [9, 10]. Морфологию продуктов исследовали с помощью сканирующих электронных микроскопов TM-1000 (Hitachi, Япония) и MIRA3 LMU (Tescan, Чехия). Для изучения микроструктуры порошки заливали в эпоксидную смолу, шлифовали и полировали алмазными суспензиями. Элементный анализ проводили с применением приставки INCA Energy 450 X-Max80 (Oxford Instruments, UK) при ускоряющем напряжении 20 кВ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Продукт, полученный после термообработки смеси при 1000°С, представляет собой порошок черного цвета, легко растирающийся в ступке. По данным СЭМ, он состоит из частиц различной морфологии размером 1–3 мкм и небольших конгломератов размером до 10 мкм (рис. 1а). Исследование фазового состава порошка (рис. 1б) указывает на присутствие незначительного количества непрореагировавшего HfB2 (6%), а также IrB1.1, IrSb2 и HfIr3B0.45, причем основными фазами, по данным количественного РФА, являются IrB1.1 и IrSb2 (35 и 44 мас. %) соответственно. Содержание известной из литературы тройной фазы HfIr3B0.45 незначительно и составляет ~4 мас. %. Образование этих фаз можно объяснить протеканием следующих реакций:
(1)
$22{\text{Hf}}{{{\text{B}}}_{{{\text{2(тв)}}}}} + 97{\text{I}}{{{\text{r}}}_{{{\text{(тв)}}}}} = 22{\text{HfI}}{{{\text{r}}}_{{\text{3}}}}{{{\text{B}}}_{{{\text{0}}{\text{.45(тв)}}}}} + 31{\text{Ir}}{{{\text{B}}}_{{{\text{1}}{\text{.1(тв)}}}}},$(2)
${\text{I}}{{{\text{r}}}_{{{\text{(тв)}}}}} + 2{\text{S}}{{{\text{b}}}_{{{\text{(ж)}}}}} = {\text{IrS}}{{{\text{b}}}_{{{\text{2(тв)}}}}}{\text{.}}$Рис. 1.
СЭМ-изображение (а) и экспериментальная дифрактограмма (б) продуктов, полученных при термообработке смеси HfB2–Ir–Sb при 1000°С.
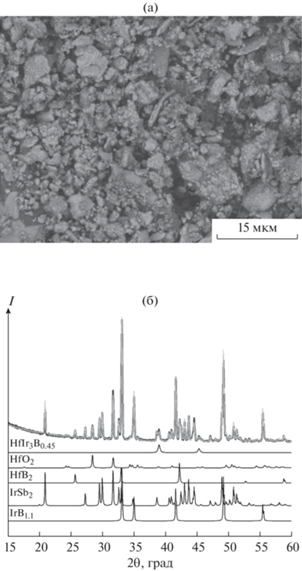
Несколько неожиданным является появление в продуктах фазы HfO2, содержание которой находится на уровне 11 мас. %. Следует отметить, что рассчитанное количество может быть несколько завышенным (для CuKα снижение интенсивности на 90% происходит при толщине образца 2.23 мкм для HfO2, 1.10 мкм для IrB1.1 и 1.15 мкм для IrSb2). Образование этой фазы можно объяснить взаимодействием кислородных примесей, содержащихся, например, в исходных реактивах с HfB2. Известно, что связь Hf–O является очень прочной, энергия ее диссоциации составляет 189 ккал/моль [19], поэтому присутствие примесей кислорода в реакционной среде будет приводить к образованию связей Hf–O [20]. Нельзя исключать наличие на поверхности металлической сурьмы оксидной пленки состава Sb2O3, образовавшейся в результате растирания порошка в ступке [21, 22]. Ранее было показано [22], что двухчасовое механическое измельчение сурьмы в агатовом контейнере металлическими шарами приводит к натиру и образованию побочного продукта – оксида сурьмы, что было подтверждено методом РФА. Оксид сурьмы в виде паров Sb4O6 [23] может взаимодействовать с HfB2 в присутствии металлического иридия по брутто-реакции:
(3)
$\begin{gathered} 33{\text{Hf}}{{{\text{B}}}_{{{\text{2(тв)}}}}} + 11{\text{S}}{{{\text{b}}}_{{\text{4}}}}{{{\text{O}}}_{{{\text{6(г)}}}}} + 60{\text{I}}{{{\text{r}}}_{{{\text{(тв)}}}}} = \\ = 33{\text{Hf}}{{{\text{O}}}_{{{\text{2(тв)}}}}} + 44{\text{S}}{{{\text{b}}}_{{{\text{(ж)}}}}} + 60{\text{Ir}}{{{\text{B}}}_{{{\text{1}}{\text{.1(тв)}}}}}. \\ \end{gathered} $Сравнение результатов взаимодействия иридия с HfB2 при 1000°С в присутствии сурьмы и без нее указывает на изменение качественного фазового состава продуктов [9], а именно появление фазы антимонида иридия IrSb2 и отсутствие фазы IrB0.9, которую ранее мы обнаруживали наряду с фазой IrB1.1 в реакции иридия с HfB2:
(4)
$\begin{gathered} 2{\text{Hf}}{{{\text{B}}}_{{{\text{2(тв)}}}}} + 9{\text{I}}{{{\text{r}}}_{{{\text{(тв)}}}}} = \\ = 2{\text{HfI}}{{{\text{r}}}_{{\text{3}}}}{{{\text{B}}}_{{{\text{0}}{\text{.45(тв)}}}}} + 2{\text{Ir}}{{{\text{B}}}_{{{\text{1}}{\text{.1(тв)}}}}} + {\text{Ir}}{{{\text{B}}}_{{{\text{0}}{\text{.9(тв)}}}}}{\text{.}} \\ \end{gathered} $Полученный при 1300°С продукт представляет собой сыпучий порошок черного цвета. Можно напомнить, что в отсутствие сурьмы уже при температурах 1200°С и выше HfB2 реагирует с иридием с образованием продукта в виде плотно спеченных частиц шаровидной формы, которые с трудом поддаются измельчению [9]. Исследование морфологии продукта показало, что он состоит из зерен неправильной формы (рис. 2а). Более полные представления можно получить из анализа шлифа этого образца. Так, на рис. 2б можно видеть, во-первых, достаточно крупные агрегаты вытянутой формы длиной 75–100 мкм и шириной ~25 мкм, состоящие, по данным ЭДС-анализа, из HfO2. Кроме этого присутствуют зерна округлой формы, которые в некоторых случаях собраны в агломераты неправильной формы. Элементный анализ в режиме обратнорассеянных электронов этих зерен показал, что они состоят главным образом из фазы IrSb2 (области темно-серого цвета, табл. 1). Между областями темно-серого цвета присутствуют области светло-серого оттенка размером 1–2 мкм, в состав которых входят Ir (преимущественно), Sb и Hf. Так как фазовые диаграммы тройной Hf–Ir–Sb и четверной Hf–Ir–Sb–B систем отсутствуют, можно только предполагать, что данные области относятся к тройным соединениям Hf–Ir–B, которые были зарегистрированы методом РФА. Обнаружение сурьмы в этих областях методом ЭДС обусловлено тем, что область регистрации спектра ЭДС несколько больше, это приводит к частичному включению соседних областей в анализируемую область.
Рис. 2.
СЭМ-изображение продуктов, полученных при термообработке смеси HfB2–Ir–Sb при 1300°С: а – общий вид частиц порошка, б – сечение частиц порошка.

Таблица 1.
Элементный анализ (ат. %) и фазовый состав зерен округлой формы, образующихся при 1300°С
 |
№ спектра | Sb | Hf | Ir | Фаза |
| 1 | 67.3 | 0.0 | 32.7 | IrSb2 | |
| 2 | 67.2 | 0.0 | 32.8 | IrSb2 | |
| 3 | 67.1 | 0.0 | 32.9 | IrSb2 | |
| 4 | 20.1 | 4.2 | 75.6 | * | |
| 5 | 19.7 | 4.6 | 75.7 | * | |
| 6 | 6.6 | 0.0 | 93.4 | ** |
На рис. 3 представлена рентгенограмма продукта, полученного при 1300°С. Можно отметить, что, как и для образца, полученного при 1000°С, основными фазами являются IrB1.1 и IrSb2. Присутствует также диоксид гафния в качестве примеси и непрореагировавший HfB2. Отличительной особенностью рентгенограммы образца, полученного при 1300°С, является присутствие пиков, относящихся к тройным боридам Hf2Ir5B2 и HfIr3B4. Таким образом, данные ЭДС и РФА хорошо согласуются между собой. Как было отмечено выше, при 1300°С образуется сыпучий продукт, что может косвенно свидетельствовать об отсутствии в системе жидкой фазы. Действительно, согласно данным РФА и ЭДС, в продуктах взаимодействия HfB2 с иридием в присутствии сурьмы Sb (реакции (1) и (2)) обнаружены фазы, температуры плавления которых превышают 1300°С, а именно: IrB1.1 (1339°С [24]), IrSb2 (1475°С [25]) и тройные соединения Hf–Ir–B, плавящиеся при температуре выше 1600°С [11]. Когда реакция HfB2 с иридием протекает в отсутствие сурьмы, образуется борид иридия состава IrB0.9, имеющий температуру плавления 1289°С, поэтому получается плотно спеченный продукт [9].
Рис. 3.
Экспериментальная дифрактограмма продуктов, полученных при термообработке смеси HfB2–Ir–Sb при 1300°С.
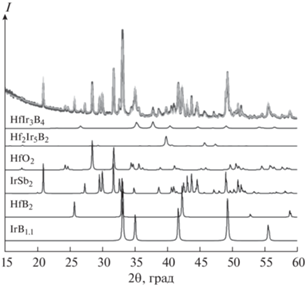
В результате термической обработки смеси при 1500°С образуется продукт темного цвета, также сохраняющий сыпучесть. Морфология продукта изменяется, и наряду с частицами округлой формы появляется заметное количество одноосных вытянутых кристаллов (рис. 4а). Множественный элементный анализ этих кристаллов показал, что в них присутствуют иридий и гафний с отношением Ir : Hf ~ 2.4 (рис. 4б), что соответствует соотношению этих элементов в фазе тройного борида Hf2Ir5B2 [9]. Частицы округлой формы имеют более сложный состав, в котором атомное отношение Ir к Hf варьируется от 2 до 6 (табл. 2). Эти отношения находятся в хорошем соответствии с составами тройных фаз Hf–Ir–B, которые образуются в ходе реакции между HfB2 и иридием [9]. Элементный анализ свидетельствует об отсутствии сурьмы в составе образца. Это можно объяснить испарением металлической сурьмы. Действительно, металлическая сурьма была обнаружена в виде конденсата на водоохлаждаемой крышке реактора.
Рис. 4.
СЭМ-изображения и рентгенофазовый анализ продуктов, полученных при термообработке смеси HfB2–Ir–Sb при 1500°С: а – общий вид продукта, б – сечение кристалла Hf2Ir5B2; в – дифрактограмма.

Таблица 2.
Элементный анализ (ат. %) и фазовый состав произвольно выбранных округлых зерен продукта, полученного при 1500°С
 |
№ спектра | Hf | Ir | Фаза |
| 1 | 23.9 | 76.1 | HfIr3B4 | |
| 2 | 23.8 | 76.2 | HfIr3B4 | |
| 3 | 23.1 | 76.9 | HfIr3B4 | |
| 4 | 23.5 | 76.5 | HfIr3B4 | |
| 5 | 23.8 | 76.2 | HfIr3B4 | |
| 6 | 13.0 | 87.0 | HfIr5.7B2.7 | |
| 7 | 13.4 | 86.6 | HfIr5.7B2.7 | |
 |
1 | 32.7 | 67.3 | HfIr2.1B1.3 |
| 2 | 23.3 | 76.7 | HfIr3B4 | |
| 3 | 32.9 | 67.1 | HfIr2.1B1.3 | |
| 4 | 23.7 | 76.3 | HfIr3B4 | |
| 5 | 29.6 | 70.4 | Hf2Ir5B2 | |
| 6 | 25.5 | 74.5 | HfIr3B4 |
По данным РФА, фазовый состав продукта, полученного при 1500°С, отличается от такового для смеси, прогретой при 1300°C (рис. 4в). Основной фазой является борид состава Hf2Ir5B2 (41 мас. %). Количество непрореагировавшего HfB2 составило ~16 мас. %, а тройного борида HfIr3B4 – не более 8 мас. %. Рефлексы тройных боридов со среднестатистическим составом HfIr2.1B1.3 и HfIr5.7B2.7 в рентгенограммах отсутствуют, что может быть связано с их незначительной концентрацией. В продукте присутствует в количестве ~30 мас. % фаза, положение всех рефлексов которой соотносится с положениями рефлексов тройного борида Hf3Ir5B2 (P4/mbm, структурный тип Ti3Co5B2), но с меньшим на 6% объемом элементарной ячейки, чем сообщалось ранее (267.3–285 Å3) [10]. Уменьшение объема элементарной ячейки, по-видимому, является следствием полного замещения атома гафния в кристаллографической позиции 2a на атом меньшего размера. С помощью ЭДС-анализа в продукте действительно был обнаружен кремний. Присутствие кремния в продукте можно объяснить натиром материала агатовой ступки в ходе пробоподготовки, так как тройные бориды на основе гафния и иридия обладают очень высокой твердостью [9].
Моделирование структуры соединения Hf2SiIr5B2, в котором один атом гафния в кристаллографической позиции 2а замещен на атом кремния, приводит к очень хорошему соответствию с экспериментальными данными РФА, полученными в настоящей работе (рис. 4в). Соединение Hf2SiIr5B2 изоструктурно Hf3Ir5B2 с пр. гр. P4/mbm; параметры решетки: a = 9.056, c = 3.260 Å. Хотя в литературе отсутствуют сведения об этом соединении, однако сообщается о подобных четверных соединениях вида Mg2SiIr5B2 и Sc2SiIr5B2, изоструктурных Ti3Co5B2, в которых атом Si занимает кристаллографическую позицию 2a [26]. Целенаправленный синтез этого соединения является предметом отдельной работы.
Анализ дифрактограмм продукта, полученного при 1500°С, показывает, что примесная фаза HfO2 исчезла из состава продукта, что, возможно, связано с восстановлением ее углеродом тигля до HfC. Содержание HfC, определенное методом количественного РФА, составляет 5 мас. %. В дифрактограммах также отсутствуют какие-либо фазы, содержащие сурьму. Их отсутствие указывает на то, что при 1500°С антимониды гафния и иридия, включая высокоплавкие (tпл(IrSb) ~ 1645°С [25]), становятся термодинамически нестабильными в присутствии бора. При этом формирование тройных боридов системы Hf–Ir–B становится предпочтительным. Благодаря интенсивному разложению IrSb2 (по перитектической реакции при 1475°С [25]) и испарению жидкой сурьмы (при 1587°С скорость испарения составляет ~19 г/(см с) [16]) консолидация частиц порошка не происходит и продукт сохраняет сыпучесть.
Таким образом, при температуре 1500°С из смеси HfB2 и иридия в присутствии сурьмы получен сыпучий продукт, состоящий преимущественно из тройного борида гафния Hf2Ir5B2, а также тройных боридов другого состава. Присутствие примесных фаз можно уменьшить или исключить через контроль условий синтеза, например, исключая присутствие кислорода или кремния в исходных реактивах.
ЗАКЛЮЧЕНИЕ
Впервые тройные бориды на основе иридия и гафния получены по реакции иридия с диборидом гафния в присутствии металлической сурьмы при температуре 1500°С. Продукт выделен в виде легко рассыпающегося порошка, тогда как в отсутствие сурьмы образуется плотно спеченный продукт, требующий дополнительной обработки для последующего использования. Полученный при 1500°С порошок представляет собой кристаллы Hf2Ir5B2 вытянутой формы, а также округлые зерна размером до 10–15 мкм, состоящие преимущественно из других тройных боридов системы Hf–Ir–B, а именно: HfIr3B4, HfIr2.1B1.3 и HfIr5.7B2.7.
Ранее было показано [9], что при осуществлении реакции HfB2 с иридием без добавления сурьмы наряду с тройными соединениями Hf–B–Ir образуются бориды иридия IrB1.1 и IrB0.9, причем последний имеет температуру плавления 1289°С, что способствует образованию плотно спеченного продукта при температуре 1300°С. Введение сурьмы в реакционную смесь меняет схему взаимодействия. В интервале температур 1000–1300°С из смеси HfB2, Ir и сурьмы наряду с тройными боридами Hf–B–Ir образуется IrB1.1 и антимонид IrSb2, которые не плавятся в этом температурном интервале, что способствует образованию сыпучего продукта. Антимонид IrSb2 устойчив до 1300°С включительно, но при 1500°С распадается. При этом иридий тратится на формирование тройных боридов, а сурьма испаряется и может быть полностью отогнана из реакционной зоны и использована повторно. Высокая скорость испарения сурьмы препятствует консолидации частиц тройных боридов, что приводит к получению сыпучего продукта.
Список литературы
Simonenko E.P., Simonenko N.P., Sevastyanov V.G. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 1697. https://doi.org/10.1134/S0036023619140079
Simonenko E.P., Simonenko N.P., Gordeev A.N. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 421. [Симоненко Е.П., Симоненко Н.П., Гордеев А.Н. и др. // Журн. неорган. химии. 2018. Т. 63. № 4. С. 393.]https://doi.org/10.1134/S0036023618040186
Vinokurov A.A., Korobov I.I., Domashnev I.A. et al. // Russ. J. Gen. Chem. 2018. V. 88. № 5. P. 851. [Винокуров А.А., Коробов И.И., Домашнев И.А. и др. // Журн. общ. химии. 2018. Т. 88. № 5. С. 705.]https://doi.org/10.1134/S1070363218050018
Simonenko E.P., Simonenko N.P., Gordeev A.N. et al. // Russ. J. Inorg. Chem. 2020. V. 65. P. 606. [Симоненко Е.П., Симоненко Н.П., Гордеев А.Н. и др. // Журн. неорган. химии. 2020. Т. 65. № 4. С. 564. https://doi.org/10.31857/S0044457X20040194]https://doi.org/10.1134/S0036023620040191
Simonenko E.P., Simonenko N.P., Kolesnikov A.F. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 1405. [Симоненко Е.П., Симоненко Н.П., Колесников А.Ф. и др. // Журн. неорган. химии. 2021. Т. 66. № 9. С. 1314.]https://doi.org/10.1134/S003602362109014X
Barrios Jiménez A.M., Burkhardt U., Cardoso-Gil R. et al. // ACS Appl. Energy Mater. 2020. V. 3. P. 11042. https://doi.org/10.1021/acsaem.0c02022
Wang X., Cheng Zh., Zhang G. et al. // Nanoscale. 2020. V. 12. P. 8314. https://doi.org/10.1039/D0NR00635A
Shankhari P., Janka O., Pöttgen R. et al. // J. Am. Chem. Soc. 2021. V. 143. P. 4205. https://doi.org/10.1021/jacs.0c10778
Lozanov V.V., Utkin A.V., Gavrilova T.A. et al. // J. Am. Ceram. Soc. 2022. V. 105. P. 2323. https://doi.org/10.1111/jace.18234
Rogl P., Nowotny H. // J. Less-Common Met. 1979. V. 67. P. 41. https://doi.org/10.1016/0022-5088(79)90072-9
Sichevych O., Flipo S., Ormeci A. et al. // Inorg. Chem. 2020. V. 59. P. 14280. https://doi.org/10.1021/acs.inorgchem.0c02073
Shishido T., Ye J., Oku M. et al. // J. Alloys Compd. 1997. V. 248. P. 18. https://doi.org/10.1016/S0925-8388(96)02621-7
Okada Sh., Iizumi K., Kudaka K. et al. // J. Solid State Chem. 1997. V. 133. P. 36. https://doi.org/10.1006/jssc.1997.7313
Zaikina J.V., Jo Y.-J., Latturner S.E. // Inorg. Chem. 2010. V. 49. P. 2773. https://doi.org/10.1021/ic902151d
Bugaris D.E., Han F., Im J. et al. // Inorg. Chem. 2015. V. 54. P. 8049. https://doi.org/10.1021/acs.inorgchem.5b01275
Казенас Е.К., Цветков Ю.В. Испарение карбидов. М.: Красанд, 2017. 800 с.
Gautier R., Zhang X., Hu L. et al. // Nat. Chem. 2015. V. 7. P. 308. https://doi.org/10.1038/NCHEM.2207
Bannykh D.A., Golosov M.A., Lozanov V.V. et al. // Inorg. Mater. 2021. V. 57. P. 879. [Банных Д.А., Голосов М.А., Лозанов В.В. и др. // Неорган. материалы. 2021. Т. 57. № 9. С. 925.]https://doi.org/10.1134/S0020168521090028
Краснов К.С., Филиппенко Н.В., Бобкова В.А. и др. Молекулярные постоянные неорганических соединений: Справочник. Л.: Химия, 1979. 448 с.
Lozanov V.V., Il’in I.Yu., Morozova N.B. et al. // Russ. J. Inorg. Chem. 2020. V. 65. P. 1781. [Лозанов В.В., Ильин И.Ю., Морозова Н.Б. и др. // Журн. неорган. химии. 2020. Т. 65. № 11. С. 1570.]https://doi.org/10.1134/S0036023620110108
Ma P., Slavin A.J. // Phys. Rev. B. 1994. V. 49. № 12. P. 8340. https://doi.org/10.1103/PhysRevB.49.8340
Tonejc A., Dužević D., Tonejc A.M. // Mater. Sci. Eng. 1991. V. A134. P. 1372. https://doi.org/10.1016/0921-5093(91)90993-W
Казенас Е.К., Цветков Ю.В. Испарение оксидов. М.: Наука, 1997. 543 с.
Zeiringer I., Cheng X., Chen X.-Q. et al. // Sci. China Mater. 2015. V. 58. P. 649. https://doi.org/10.1007/s40843-015-0078-6
Caillat T., Borshchevsky A., Fleurial J.-P. // J. Alloys Compd. 1993. V. 199. P. 207. https://doi.org/10.1016/0925-8388(93)90452-S
Nagelschmitz E.A. Die Phasenumwandlung der Verbindung LiNiB und neue quaternäre Boride mit Mg2SiIr5B2-Struktur. PhD Thesis, Köln, 1995. 146 s.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


